ООО "ПРОПИОНИКС"
| пн-пт с 09:00 до 18:00 | |
Профилактика дисбактериоза и взаимосвязанных патологий у будущего ребенка и уже рожденного малыша
ПРОБИОТИКИ. БЕРЕМЕННОСТЬ И ПОСТНАТАЛЬНЫЙ ПЕРИОД

1. Возможность пробиотической коррекции нарушений микрофлоры матери для профилактики возможных осложнений у ребенка. Влияние микрофлоры матери на формирование здоровья будущего ребенка
1.1. Введение
Хорошо известно, что формирование микробиоты человека начинается еще в период внутриутробного развития. При этом генная последовательность микроорганизмов, обнаруженных у матери в тканях матки и плаценте, повторяется у новорожденного [1,2]. Хотя ранее считалось, что амниотическая жидкость стерильна, на основании генных методов исследования выявлены некоторые общие признаки бактериального профиля полости рта у матери и амниотической жидкости плода и плацентарных образцов [3]. Установлено, что бактерии присутствуют в амниотической жидкости, меконии, кишечнике у здоровых новорожденных. После рождения, примерно до 3 лет, происходят дифференцировка и формирование уникального состава микросреды кишечника индивидуума, которая практически не меняется в течение всей жизни.
Множество факторов влияет на формирование микробиоты кишечника младенца: в период внутриутробного развития микрофлора матери, состояние ее здоровья, в дальнейшем условия и способы ведения родов, грудное или искусственное вскармливание и т.д. До 80% информации о микробиоте матери передается к плоду. Первые несколько дней после родов микробиота у здоровых младенцев, рожденных естественным путем, содержит большое количество лактобацилл, пропорциональное числу лактобактерий в вагинальной флоре. Между тем доля лактобактерий в кишечнике у младенцев, рожденных кесаревым сечением, быстро истощается; наблюдается задержка колонизации рода Bacteroides, но происходит колонизация факультативными анаэробами, такими как Clostridium species, свойственными для лиц зрелого возраста, но в детском организме приобретает патогенные свойства.
В первые часы и дни постнатальной жизни происходит адаптация ребенка к энтеральному вскармливанию, поэтому характер питания в это время — ведущий фактор становления кишечной микробиоты. Выявлено, что у детей на грудном вскармливании бифидобактерий в 2 раза больше, чем у младенцев на искусственном, в течение нескольких недель бифидофлора становится доминирующей. При этом наличие в грудном молоке таких цитокинов, как IL-10 и фактор некроза опухолей-β (ФНО-β или лимфотоксин-бета), способствует формированию пищевой толерантности и снижает риск развития аллергии. Соответственно снижение бифидобактерий увеличивает риск возникновения аллергической патологии. При этом I. Kull и соавт. при обследовании более 4 тыс. детей установили, что продолжительное грудное вскармливание снижало риск развития не только пищевой, но и респираторной аллергии [4, 5].
Неблагоприятные факторы внешней среды нарушают у новорожденных заселение бифидобактериями, приводят к длительному персистированию аэробов (протеобактерий), что нарушает формирование иммунной толерантности растущего организма.
У детей с манифестацией атопического дерматита в первые 6 мес жизни уже изначально регистрируется активная колонизация кишечника протеобактериями, аэробными грамотрицательными бактериями, спектр которых практически идентичен таковому у их матерей с патологическим течением беременности, обусловлен также дисбиозом, снижением нормальной колонизации лактобатериями. У аэробных грамотрицательных бактерий кишечного происхождения (цитобактер, клебсиелла, протей, кишечная палочка с измененными свойствами) у матери и младенцев с нарушениями становления кишечной микробиоты выявлена высокая интенсивность продукции гистамина. Этот признак относят к дополнительным, прогностически значимым критериям реализации аллергической настроенности организма ребенка на заболевание [6].
1.2. Роль бактериальных метаболитов в детском возрасте и механизмы биологической активности пробиотиков

В норме в микробном сообществе детей раннего возраста в тонком кишечнике преобладает Lactobacillaceae, в толстой кишке доминируют Prevotellaceae, Lachnospiraceae и Rikenellaceae. Применение пробиотических препаратов может быть рекомендовано для коррекции нарушений микрофлоры матери и профилактики возможных осложнений у ребенка [7].
С учетом процессов метилирования ДНК установлено, что организм особенно уязвим в критические периоды развития, включая внутриутробную и раннюю послеродовую жизнь, которая относится к концепции «первые 1000 дней жизни» [8]. Одна из основных причин может заключаться в том, что это период, когда делящимся клеткам требуется относительно высокий уровень метильных доноров для метилирования позиций CpG в новообразованной цепи ДНК для поддержания установленных образцов метилирования. В отсутствие достаточного количества метильных доноров метиловые метки затем могут быть полностью потеряны [9].
Эпигенетически уязвимые периоды различаются для разных органов. Органы, подобные сердцу, формируются в начале эмбриогенеза, когда воздействие бактериальных метаболитов происходит только косвенно через мать, поэтому могут быть почти инертными по отношению к этим факторам. С другой стороны, органы, которые формируются и дифференцируются в более поздний период, как мозг, или с высокой скоростью деления клеток, как, например, клетки кишечника, могут быть более восприимчивыми к влиянию метаболитов из микробиоты матери.
Как различия в микробиоте при кесаревом сечении, осложненные роды влияют на микробный метаболизм и иммунитет ребенка, так и несбалансированное питание матери и ребенка также может приводить к неблагоприятным воздействиям на развивающийся организм (эпигеном). Питание матери определяет состав микробиоты детского кишечника и, следовательно, абсолютные количества и отношения бактериальных метаболитов, включая бутират и фолиевую кислоту. Как следствие, ткани плода и новорожденного, подвергшиеся воздействию высоких концентраций этих метаболитов, таких как эпителий кишечника или печень, могут подвергаться эпигенетическим изменениям, которые в дальнейшем программируют метаболизм и регуляцию обмена веществ [10, 11].
Представители нормальной микрофлоры кишечника у детей обладают адгезивными свойствами, фиксируясь на эпителии слизистой оболочки кишечника, они образуют пристеночный слой, что обеспечивает колонизационную резистентность организма. Они устойчивы к неблагоприятным внешним воздействиям за счет образования клеточного муцина и бактериального полисахарида, синтезируют антибиотикоподобные вещества (бактериоцины). Продукты жизнедеятельности нормальной микрофлоры кишечника, закисляя его содержимое, стимулируют его моторную функцию. Кроме того, метаболиты микрофлоры задействованы в энергообеспечении эпителиоцитов, регуляции нормальной пролиферации и дифференцировки клеток кишечника и др.
Пробиотики, такие как лактобактерии и бифидобактерии, секретируют вещества, обладающие антибактериальными свойствами и подавляющие жизнедеятельность кишечных патогенов, регулируют кислотность кишечного содержимого, подавляя размножение кишечных патогенов. Система пищеварительного тракта и микробиота, препараты пробиотиков, как, например, Lactobacillus GG, обладают иммуномодулирующим эффектом и могут уменьшать выраженность воспаления в кишечной стенке.
Ученые из педиатрической клиники Бостона и Гарвардского университета в сотрудничестве с учеными из медицинского университета Нью-Йорка (США) провели исследование, позволившее доказать, что применение пробиотиков у детей младше 5 лет сокращает продолжительность диареи.
Анализ рандомизированных контролируемых исследований в MEDLINE и Кокрановской библиотеке, опубликованных в период с 1966 по 2010 г., в которых сравнивалось применение пробиотиков и плацебо, показал, что в двух исследованиях изучалось применение пробиотиков у детей, в четырех - использовались дрожжевые грибы (обычно сахаромицеты), еще в четырех - лактобактерии, и в одном - применялись штаммы энтерококков, продуцировавшие молочную кислоту. В трех исследованиях применялась комбинация пробиотических штаммов бактерий. Во всех случаях пробиотики назначались вместе с антибиотиками, в то время как контрольная группа получала антибиотики и плацебо. Ученые суммировали полученные данные и выявили преимущества терапии пробиотиками. Оказалось, что количество случаев диареи, вызванной антибиотиками, было ниже на 63% по сравнению с контрольной группой, причем прием дрожжевых грибов снизил частоту возникновения диареи на 61%, а лактобактерий - на 66% [12, 13].
Избыточный вес и ожирение, развитие сахарного диабета чаще отмечаются у детей с малым весом при рождении, не получавших грудного молока и рожденных от матерей с различными вариантами дисбиоза (гарднереллез, низкое содержание лактобактерий в кишечнике) [12]. Напротив, грудное вскармливание, здоровая микробиота в кишечнике матери определяют нормальное физическое и психическое развитие [14, 15]. Показано важное значение пробиотиков женщиной во время беременности и в период грудного вскармливания, так как предупреждает истощение лактобактерий (LGG) в постнатальном периоде. Показано, что микробиота матери вне зависимости от колонизации бактерий в неонатальном периоде стимулирует формирование иммунного ответа с помощью иммуноглобулинов грудного молока [16].
1.3. Коррекция микробиоты матери для профилактики возможных осложнений у ребенка

Большое число исследований посвящено изучению эффективности приема пробиотиков кормящими матерями. Доказано, что прием пробиотиков, содержащих LGG или бифидобактерии, во время беременности увеличивает содержание интерферона-гамма в крови и грудном молоке, что положительно влияет на иммунитет новорожденных [17-19]. На основании рандомизированных контролируемых исследований R. Boyle и соавт. показали, что прием пробиотиков, содержащих Lactobacillus GG, во время беременности благоприятно влиял на иммунный статус и предупреждал развитие бронхиальной астмы и экземы у новорожденных [20].
Таким образом, прием пробиотиков женщиной в перинатальном периоде и в период лактации для улучшения колонизации кишечника ребенка является обоснованным на основании доказательств того, что бактерии передаются от матери к новорожденному через прямой контакт с материнской микрофлорой во время родов и через молоко в период грудного вскармливания.
S. Rautava и соавт. показали, что пробиотики в течение беременности и грудного вскармливания повышают устойчивость к атопии в дальнейшем [22]. Эффективность пробиотиков для профилактики атопических заболеваний продемонстрирована в систематических обзорах и метаанализе [22-24]. По данным анализа базы Cochrane, проведенного D. Osborn, J. Sinn, было показано, что про- и пребиотики эффективны у младенцев для профилактики аллергии [24].
К настоящему моменту различные исследования продемонстрировали эффективность использования пробиотиков как амбулаторно, так и в стационаре во время подготовки к беременности и родам. Пробиотики, содержащие штаммы Lactobacillus acidophilus NCFM, L. paracasei Lpc-37, Bifidobacterium lactis Bi-07, B. lactis BI-04, Streptococcus thermophilus STY-31, Lactobacillus acidophilus W37 и W55, L. paracasei W72, L. plantarum W62, L. rhamnosus W71 и L. salivarius W24, благоприятно влияют на формирование микрофлоры в ранний неонатальный период и могут быть использованы для профилактики будущих заболеваний у ребенка (см. таблицу) [26,27]. P. Mastromarino и соавт. показали, что комплексный пробиотик VSL#3, содержащий 8 штаммов пробиотиков (1 штамм Streptococcus thermophilus, 4 штамма Lactobacillus spp. и 3 штамма Bifidobacterium spp.), эффективно влияет на свойства грудного молока в зависимости от способа родоразрешения [28-30].
Таким образом, включение указанных штаммов в программу предродовой подготовки, периода беременности, вскармливания.
- предотвращает развитие атопических заболеваний [20], бронхиальной астмы, экземы [20,21];
- улучшает иммунитет в целом и повышает резистентность к инфекциям у ребенка [22-25];
- способствует общефизическому и психическому развитию ребенка (отражено в обзорах по влиянию грудного вскармливания на психофизическое формирование ребенка [26,27]);
- активирует синтез иммуноглобулинов и предотвращает падение функциональной активности нейтрофилов [28];
- восстанавливает нормальную микрофлору, повышает колонизационную резистентность кишечника [28,30].
Клинические исследования, в которых изучались эффекты перорального приема пробиотиков у беременных женщин и рожденных ими детей, представлены в таблице.
|
Пробиотик
|
Применение
|
Результат
|
Авторы
|
|
L. rhamnosus GG
|
В III триместре беременности и в течение 4 нед до и 3 нед после родов
|
Пробиотическая колонизация кишечника младенца. Изменения в трансферинге бифидобактерий у новорожденного
|
M. Schultz, C. Göttl,
R. Young и соавт.
[15], R. Gonzalez, E. Klaassens, E. Malinen
и соавт. [31]
|
|
Ферментированное молоко и йогуртные бактерии
|
С 3-4-й недели беременности, пероральное или вагинальное применение с I триместра и далее
|
Снижение риска генитального инфицирования
|
M. Gueimonde,
S. Sakata, M. Kalliomäki, E. Isolauri
и соавт. [32],
L. VandeVusse, L. Hanson, N. Safdar [33]
|
|
Lactobacillus casei DN11401
|
За 6 нед до родов и в течение 6 нед лактации
|
Увеличение количества клеток-киллеров в периферической крови и снижение TNF-α в грудном молоке матери; снижение эпизодов кишечных колик и срыгиваний у новорожденных
|
P. Mastromarino,
D. Capobianco, A. Miccheli и соавт. [28], M. Gueimonde,
S. Sakata, M. Kalliomä-ki, E. Isolauri и соавт. [32], A. D’Souza,
C. Rajkumar, J. Cooke,
C. Bulpitt [34]
|
|
L. rhamnosus GG иC705,
Bifidobacterium breve Bb99.,
shermanii и галактоза
|
Женщины, имеющие высокий риск аллергии у плода, в течение последнего месяца беременности и их младенцы в возрасте до 6 мес
|
Повышенная устойчивость к респираторным инфекциям у детей в течение 2 лет; тенденция к сокращению lgE-ассоциированных заболеваний и предотвращение атопической экземы от 2 до 5 лет; дети, родившиеся только с помощью кесарева сечения; увеличение количества фекальных лактобацилл и бифидобактерий
|
L. VandeVusse, L. Hanson, N. Safdar [33], И.В. Маев, А.А. Самсонов, Е.Ю. Плотникова и соавт. [35]
|
|
L. rhamnosus GG
|
Женщины, имеющие семейный риск атопического дерматита, от 4 нед до родов и в течение 6 мес постнатального периода
|
Уменьшение риска заболевания атопическим дерматитом до 7 лет; увеличение TGF-β2 в молоке матери
|
R. Boyle, I. Ismail, S. Kivivuori и соавт. [20], N. Kondo, Y. Suda,
A. Nakao и соавт. [21]
|
|
L. rhamnosus GG и
Bifidobacterium lactis Bb2
|
Женщины с высоким риском аллергии с I триместра беременности до конца грудного вскармливания
|
Некоторое увеличение TGF-β2 в молозиве; уменьшение чувствительности к аллергенам
у младенцев
|
N. Kondo, Y. Suda,
A. Nakao и соавт. [21],
A. Ortiz-Andrellucchi,
A. Sánchez-Villegas,
C. Rodríguez-Gallego
и соавт. [38]
|
|
L. rhamnosus GG
|
Женщины с риском атопических заболеваний от 4 до 6 нед до родов и в течение 6 мес послеродового периода
|
Не влияет на антигенспецифические иммунные реакции плода; оценивали пуповинные клетки крови
|
P. Jeurink, J. van Bergenhenegouwen,
E. Jimenez и соавт. [27], K. Kukkonen,
E. Savilahti, T. Haahtela
и соавт. [39]
|
|
Lactobacillus reuteri ATCC 557304
|
Женщины от 36 нед беременности до 12 мес грудного вскармливания
|
Снижение риска возникновения lgE-ассоциированной экземы в течение второго года жизни; но влияет на общую заболеваемость экземой
|
A. Ortiz-Andrellucchi,
A. Sánchez-Villegas,
C. Rodríguez-Gallego
и соавт. [38]
|
|
L. rhamnosus HN001 или Bifidobacterium animalis подвид lactis HN019
|
С 35 нед беременности до 6 мес грудного вскармливания; дети в возрасте от рождения до 2 лет
|
Только младенцы в группе, получающей L. rhamnosus, имели значительно меньший риск заболевания экземой
|
K. Kukkonen, E. Savilahti, T. Haahtela
и соавт. [39]
|
|
Bifidobacterium
bifidum W23.
B. animalis подвид
Lactis W52 и
Lactococcus lactis W58
|
С 6 нед до родов до 12 мес грудного вскармливания
|
Экзема наблюдалась значительно реже в течение первых 3 мес жизни, но не позднее
|
M. Kalliomaki, S. Salminen, T. Poussa,
E. Isolauri [40]
|
|
L. rhamnosus GG. B. lactis BB12 и
диетическое
консультирование
|
С I триместра беременности и далее
|
Снижение концентрации глюкозы в крови и повышение толерантности к глюкозе во время беременности и в течение 12 мес после родов
|
L. Niers, R. Martín,
G. Rijkers и соавт. [43]
|
|
L. rhamnosus GG
|
С 4 нед до предполагаемых родов и в течение 6 мес после рождения ребенка
|
Влияние на появление избыточной массы тела у ребенка до 10 лет не имеет существенного значения; тенденция к нормальному весу при рождении
|
C. Pelucchi, L. Chatenoud, F. Turati,
C. Galeone и соавт. [44], R. Bertelsen,
A. Brantsæter, M. Magnus, M. Haugen
и соавт. [45],
K. Laitinen, T. Poussa, E. Isolauri [46]
|
Исследования показали, что введение L. rhamnosus GG в конце беременности выявило длительную стабильную колонизацию кишечника младенцев бактериями [15,31,32]. По данным L. VandeVusse и соавт. [33], перинатальное применение пробиотиков в 37 исследованиях, опубликованных с 1990 по 2011 г., показало значительное снижение частоты возникновения бактериального вагиноза, увеличивало колонизацию влагалища Lactobacillus и кишечника Lactobacillus rhamnosus, изменяло уровень иммунных маркеров в сыворотке крови и грудном молоке, улучшало материнский метаболизм глюкозы, снижало частоту развития гестационного диабета и преэклампсии. В исследовании M. Gueimonde и соавт. распространенность В. adolescentis у матери до родов также коррелировала с его присутствием у новорожденных в 1 и 5 мес. Аналогичные эффекты были обнаружены в отношении Bifidobacterium catenulatum и Bifidobacterium longum у 1-месячных младенцев. В целом эти результаты доказывают, что бактерии передаются от матери к новорожденному [32].
Также пренатальный прием пробиотиков был связан со значительным увеличением количества Bifidobacterium и Lactococcus lactis (здоровая кишечная флора) в кишечнике матери и неонатальном кале ребенка. Побочных эффектов пробиотиков в этих исследованиях отмечено не было [33].
Введение матерям в течение 4 нед до и 3 нед после родов L. rhamnosus GG индуцировало специфические изменения в колонизации бифидобактериями кишечника новорожденных по сравнению с теми, кто получал плацебо. Младенцы в возрасте 5 дней, чьи матери получали L. rhamnosus GG, имели более высокую распространенность B. breve и низкую распространенность В. adolescentis, чем новорожденные, матери которых получали плацебо.
Эффективность пробиотиков в профилактике преждевременных родов оценивалась у женщин с их высоким риском, который достигал уровня 30—50%; полученные результаты свидетельствуют о снижении риска половых инфекций на 81% у этих женщин после приема пробиотиков [36,37].
Использование пробиотических бактерий во время беременности было предложено в качестве средства модуляции иммунной системы развивающегося плода для снижения риска иммунных аберраций и улучшения защиты хозяина. У матерей, принимающих пробиотики, было обнаружено значительное увеличение естественных клеток-киллеров в периферической крови и незначительное увеличение Т-лимфоцитов и В-лимфоцитов. В материнском молоке было выявлено снижение медиаторов инициального повреждения фактора некроза опухолей-альфа (TNFα). У грудных детей, матери которых употребляли L. casei, также было зарегистрировано меньше проблем с пищеварением, в том числе меньше случаев кандидоза полости рта, срыгивания, диареи, колик, запоров в период от 2 до 6 мес [34, 38].
Применение пробиотика L. rhamnosus GG беременными женщинами и их детьми уменьшило риск развития атопической экземы в течение первых 7 лет жизни [39]. L. rhamnosus GG назначался беременным женщинам, которые имели, по крайней мере, одного родственника первой степени родства с атопическим дерматитом, аллергическим ринитом или астмой, в течение 4 нед до предполагаемых родов и в течение 6 мес в послеродовом периоде. При приеме пробиотика беременной и кормящей женщиной увеличивалось количество противовоспалительного цитокина TGF-2 в молоке матери, что улучшало ее иммунозащитный потенциал и было связано с уменьшением риска атопической экземы в течение первых 2 лет жизни ребенка (15% по сравнению с 47%). Дети «атопических» матерей, особенно находящиеся на исключительно грудном вскармливании в течение 2,5 или 6 мес, имеют более высокий риск сенсибилизации в течение 1-го года жизни. Однако этот риск может быть снижен за счет использования пробиотиков во время беременности и в период лактации [40,41].
В группе детей, матери которых получали во время беременности пробиотики, было выявлено меньше случаев иммуноглобулин Е(IgE)-ассоциированных экзем в течение 2-го года жизни (8% по сравнению с 20%). Сравнительное изучение эффектов 2 пробиотиков — L. rhamnosus HN001 и Bifidobacterium animalis подвид lactis HN019 — проведено у беременных женщин и их детей. Младенцы, получавшие в этом исследовании L. rhamnosus, имели значительно меньший риск развития экземы [38]. Смесь пробиотических бактерий (Bifidobacterium bifidum W23, Bifidobacterium lactis W52 и Lactococcus lactis W58) назначалась беременным женщинам за 6 нед до родов и в течение 12 мес после, а также их младенцам, наблюдение продолжалось 24 мес. Частота экземы у детей «пробиотической» группы в течение первых 3 мес жизни была значительно ниже, чем в группе плацебо. Однако в возрасте 3 мес и до 2 лет заболеваемость экземой была одинаковой в обеих группах [39, 40].
C. Pelucchi и соавт. провели метаанализ рандомизированных контролируемых исследований по влиянию пробиотиков, применяемых во время беременности и в послеродовом периоде, на заболеваемость атопическим дерматитом и IgE-зависимым атопическим дерматитом. Получены доказательства эффективности пробиотиков в профилактике атопического дерматита и IgE-ассоциированного атопического дерматита у младенцев и детей. Благоприятный эффект не зависел от времени использования пробиотика (беременность или период лактации), а также объекта получения пробиотиков (мать, ребенок или оба) [44].
R. Bertelsen и соавт. изучали взаимосвязи между потреблением пробиотических молочных продуктов матерями во время беременности и лактации и развитием атопического дерматита, риноконъюнктивита и бронхиальной астмы у 40 614 детей. Потребление пробиотиков во время беременности было связано со снижением относительного риска (ОР) развития у младенцев атопического дерматита в первые 6 мес (ОР 0,94; 95% ДИ 0,89—0,99) и риноконъюнктивита между 18 и 36 мес (ОР 0,87; 95% ДИ 0,78—0,98) по сравнению с детьми, матери которых не принимали пробиотики [45].
K. Laitinen и соавт. исследовали эффекты пробиотиков в сочетании с диетой на метаболизм глюкозы у беременных женщин. Исследование включало три подгруппы беременных женщин в I триместре беременности. 1-я группа соблюдала диету (диета—плацебо), женщины 2-й группы получали пробиотики и соблюдали диету (L. rhamnosus GG и B. lactis BB12, диета—пробиотики), а 3-я группа получала плацебо (привычное питание и плацебо). Концентрация глюкозы в крови оставалась низкой в группе «диета—пробиотики» во время беременности и в течение 12 мес послеродового периода. Толерантность к глюкозе была в группе «диета—пробиотики» также выше, чем в группе «привычное питание—плацебо» в течение последнего триместра беременности и в период 12 мес после родов [46]. R. Luoto и соавт. обнаружили, что дети, рожденные женщинами, которые принимали пробиотики в III триместре беременности, имели статистически значимое снижение риска ожирения (p=0,035) и большой длины тела при рождении (p=0,028) [47].
Z. Asemi и соавт. провели сравнение показателей инсулинорезистентности (HOMA-IR) у женщин в III триместре беременности. Часть из них в течение 9 нед потребляли 200 г/сутки обычного йогурта, а другая часть — пробиотик, содержащий два штамма (Lactobacillus acidophilus LA5 и Bifidobacterium animalis BB12) с общим количеством 1×107 колонийобразующих единиц (КЕ). В отличие от обычного йогурта ежедневное потребление пробиотического йогурта в течение 9 нед снижало у беременных женщин сывороточный уровень инсулина и риск развития инсулинорезистентности [48].

Таким образом, пробиотики показаны для беременных и кормящих женщин, так как:
- пренатальный прием пробиотиков значительно снижает частоту возникновения дисбиоза (бактериального вагиноза) родовых путей, снижает риск осложнений во время беременности и родов, увеличивает колонизацию кишечника матери полезной микрофлорой и снижает риски заболеваний у ребенка в будущем [12,14,17,18];
- применение пробиотиков (L. rhamnosus GG, B. Lactis BB12) улучшает материнский метаболизм глюкозы, снижает риск осложненной беременности [43];
- перинатальный прием пробиотиков (Lactobacillus casei DN1140, L. rhamnosus GG и C705, Bifidobacterium breve Bb99, Propionibacterium freudenreichii подвид shermanii и галактоза) способствует хорошей микробной колонизации кишечника ребенка, повышает защитные свойства грудного молока [45];
- пренатальный прием пробиотиков в III триместре беременности (L. rhamnosus HN001 и Bifidobacterium animalis подвид lactis HN019) безопасен и снижает риск возникновения у младенцев атопического дерматита, экземы, риноконъюнктивита, метаболических нарушений и ожирения [47,48];
- у детей, получающих L. rhamnosus GG и C705, Bifidobacterium breve Bb99, Propionibacterium freudenreichii подвид shermanii и галактозу, отмечается устойчивость к респираторным инфекциям у детей в течение 2 лет; тенденция к сокращению lgE-ассоциированных заболеваний и предотвращение атопической экземы от 2 до 5 лет; у детей, родившихся с помощью кесарева сечения, — увеличение количества фекальных лактобацилл и бифидобактерий [13,19,23,38,39].
Литература по 1-й части раздела (по 48 пункт) здесь→

2. НЕКОТОРЫЕ ФАКТЫ И РЕКОМЕНДАЦИИ
Изложенный выше материал убедительно показывает значимость пробиотической профилактики для мам и их будущих, а также новорожденных детей с целью укрепления иммунитета и предотвращения различных заболеваний в дальнейшей жизни. Однако краткий обзор основан на небольшом количестве исследований, а потому количество и виды используемых штаммов пробиотических микроорганизмов, указанные как рекомендуемые (с позиции доказательной медицины) ограничены рамками проанализированных работ. В связи с этим мы решили дополнить данный раздел некоторыми полезными заметками.
2.1 Пробиотики при беременности и подготовке к беременности
(дополнение к рекомендации).
Микробиом младенца начинает развиваться в утробе матери.
Ведущая парадигма колонизации в раннем возрасте гласит, что плод развивается в стерильной среде внутриутробного развития и становится колонизированным микробами после рождения в процессе вагинального родоразрешения, кормления грудным молоком матери и других воздействий окружающей среды. Однако результаты исследования американских педиатров, в котором секвенирование следующего поколения выявило ДНК из различных ассоциированных с человеком бактерий в человеческой плаценте, амниотической жидкости (околоплодных водах) и меконии младенцев, позволяет утверждать, что первые столкновения с микробами могут происходить пренатально даже в условиях здоровой беременности.
- Patrick C. Seed., et. al. Fetal exposure to the maternal microbiota in humans and mice. JCI Insight. 2019 Oct 3;4 (19)
Было установлено, что успешная беременность требует координации и баланса между материнским и развивающимся иммунитетом плода. Микробы играют важную роль в иммунном гомеостазе и регуляции. Наличие эмбриональных организмов или их молекулярных сигнатур может стимулировать иммунитет слизистой оболочки плода и подготавливать ткани к колонизации после рождения.
- Seferovic MD, et al. Visualization of microbes by 16S in situ hybridization in term and preterm placentas without intraamniotic infection. Am J Obstet Gynecol. 2019;221(2):146.e1–146.e23.
- Jimenez E, et al. Is meconium from healthy newborns actually sterile? Res Microbiol. 2008;159(3):187–193.
Микробиота беременной женщины обеспечивает ей метаболизм, необходимый для вынашивания здорового ребенка. Тип и количество бактерий, содержащихся в различных микробиоценозах и амниотической полости будущей матери, имеют важное значение для исходов беременности и рождения здорового ребенка.
- Николаева И.В., Царегородцев А.Д., Шайхиева Г.С. Формирование кишечной микробиоты ребенка и факторы, влияющие на этот процесс. Российский вестник перинатологии и педиатрии 2018; 63:(3): 13–18).
При привычным невынашивании беременности (ПНБ) по данным МСММ у женщин в кишечнике наблюдается избыточный рост условно-патогенной флоры (УПФ) на фоне дефицита всей нормобиоты, особенно бифидобактерий и лактобацилл. Также, избыточный рост УПФ в сочетании с дефицитом нормофлоры напрямую был связан с сальпингитом и эндометритом. Выявленные зависимости свидетельствуют о значимой роли микробиоты кишечника в развитии дисбиоза матки и формировании ПНБ.
- Карпеев С.А., Гриневич В.Б., Карпеева Ю.С., Балукова Е.В. Изменения микробиоценоза кишечника при привычном невынашивании беременности. Научно-практический журнал «Гастроэнтерология Санкт-Петербурга» №1/2017 ISSN 1727-7906
Во многом благодаря этим познаниям, репродуктологи, работающие по методике МСММ и учитывающие микробный фактор, стали иметь больше положительных результатов беременности, даже в случае обращений пациенток к таким специалистам после ряда неудачных ЭКО – ред..
Таким образом, пробиотики должны быть показаны не только беременным и кормящим женщинам, но и женщинам при подготовке к беременности, особенно из группы риска на инфекционные осложнения.
2.2. Постнатальное пробиотическое лечение детей.
Ведущая роль бифидобактерий и грудное вскармливание

Младенцы, лишенные грудного вскармливания имеют больший риск развития многих заболеваний в более позднем возрасте, таких как аллергия и ожирение. Исследования укрепили важную роль грудного вскармливания в обеспечении хороших бактерий кишечника для младенцев на ранних стадиях их жизни. Так, например, группа специалистов из Университета Ньюкасла, Великобритания, установила, что Бифидобактерии изобилуют грудном в молоке и быстро сокращаются в кишечнике младенцев после прекращения грудного вскармливания. Нацеливание на питательные вещества в грудном молоке, которые стимулируют рост здоровых бактерий в кишечнике ребенка, или предоставление пробиотиков, содержащих бифидобактерии, представляют собой важные направления для вмешательств, направленных на восстановление полезных свойств грудного вскармливания, когда грудное молоко недоступно.
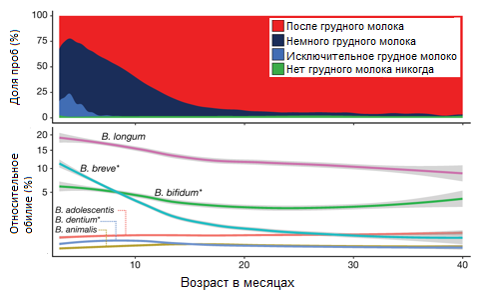
Рис. 1. Графики, показывающие получение грудного молока в возрасте от 3 до 40 месяцев по сравнению с относительным обилием шести наиболее распространенных видов бифидобактерий за тот же период (n = 11,717)
У ребенка есть возможность до двух с половиной лет установить здоровые кишечные бактерии - с небольшим изменением после этого момента. Как видно из исследований, среди бифидобактерий преобладает вид лонгум (B. longum содержится в КБЖ, рекомендованном детям с первых часов жизни).
- Christopher J. Stewart, et al. Temporal development of the gut microbiome in early childhood from the TEDDY study. Nature, 2018; 562 (7728): 583
Уже в первую неделю жизни новорожденного, питающегося грудным молоком, первичную (преимущественно аэробную) кишечную микрофлору сменяют анаэробные бифидобактерии. Причины данного явления стали понятны, когда был секвенирован геном Bifidobacterium longum и обнаружен участок, содержащий гены гликозидаз - ферментов, расщепляющих олигосахариды женского грудного молока до моносахаридов. Очевидно, без этих бифидобактерий ребенок не сможет эффективно усваивать поступающую пищу, что отразится на его развитии.
Пробиотическая защита недоношенных детей от некротизирующего колита (НЭК) и сепсиса

Миллиарды живых пробиотических бактерий для укрепления здоровья кишечника недоношенных детей реально спасают жизни новорожденных в ОРИТ. Согласно новым исследованиям, проведенным Норфолкской и Норвичской университетской больницей (NNUH - Norfolk and Norwich University Hospital), а также с участием Университета Восточной Англии (UEA), увеличение количества молока с пробиотическими бактериями, помогло сократить вдвое число серьезных проблем с кишечником и инфекций у недоношенных детей. В исследовании использовались пробиотики трех видов (B. longum, L. acidophilus и B. bifidum). Отчет об исследовании, опубликованный в журнале Archives of Diseases in Childhood, показывает, что с момента введения пробиотиков в неонатальном отделении NNUH число случаев некроза среди очень недоношенных детей снизилось с 7,5% до 3,1%, а число случаев сепсиса снизилось с 22,6% до 11,5%. Ученые рекомендуют обязательную пробиотическую профилактику во всех неонатальных центрах и отделениях ОРИТ.
- Lindsay J Hall, Paul Clarke, et al. Incidence of necrotising enterocolitis before and after introducing routine prophylactic Lactobacillus and Bifidobacterium probiotics. Archives of Disease in Childhood - Fetal and Neonatal Edition, 2019
Дополнительная информация о пропионовокислых бактериях!

Потребление грудного молока человека (HBM) снижает частоту развития некротического энтероколита (NEC), который остается ведущей и трудноизлечимой причиной смертности недоношенных детей. В работе Colliou et al., 2017 сообщается, что это уменьшение коррелирует с изменениями в микробиоте кишечника, особенно с обогащением видов молочных пропионибактерий:
Молочные пропионовокислые бактерии (P. freudenreichii), также как и бифидобактерии, были идентифицированы как защитные и ранние колонизирующие пробиотические симбионты [Colliou, N., et al. Commensal Propionibacterium strain UF1 mitigates intestinal inflammation via Th17 cell regulation. J. Clin. Investig. 2017, 127, 3970–3986. [Google Scholar] [CrossRef]]. Таким образом, (применительно к НЭК и сепсису) из источника следует, что механизмы, участвующие в ослаблении воспалительных реакций, влияющих на клеточный гомеостаз, действуют посредством взаимодействия молочных пропионовокислых бактерий с белком SIGNR1. Это приводит к регуляции провоспалительных сигналов (например, IL-1β), способствующих функциональному гомеостазу регуляторных T-клеток. Таким образом, с учетом имеющихся данных, является обоснованным использование бифидогенных ПКБ, как отдельно, так и совместно с бифидобактериями для защиты от некротизирующего энтероколита (НЭК) и сепсиса у недоношенных новорожденных детей.
Предотвращение задержки роста детей

Что касается недоношенных детей, находящихся в отделении реанимации и интенсивной терапии, то чем более аномален (дисбиотичен) их кишечный микробиом, тем более вероятно, что они будут испытывать замедление роста даже в 4-летнем возрасте, что было установлено в исследовании Университетом Южной Флориды (USF Innovation).
В отношении других детей с задержкой роста влияние кишечного микробиома на их рост продемонстрировали сразу несколько независимых исследовательских коллективов, которые установили 3 основные причины:
- Задержка роста связана с «незрелостью микробима» (соответствует более младшему возрасту – изучали 6-месячных и 18-месячных детей – ред.)
- Кишечный микробиом воздействует на гормональный фон детей. Задержка роста может быть вызвана снижением уровня соматотропина (гормон роста), который вызывает рост мышечной и костной ткани. При дисбактериозе его уровень падает.
- «Незрелость» микробиоты у детей с задержкой роста на грудном вскармливании была связана с отсутствием в молоке матерей сиалированных олигосахаридов (особых модифицированных углеводов).
Эксперт по инфекционным заболеваниям и кишечной микробиоте из Университета Виргинии в Шарлотсвилле Уильям Петри (William Petri) подчеркнул важность полученных данных, назвав их «переломным моментом в глобальном здравоохранении в целом и в диетологии в частности». Основная идея в лечении та же – обязательная пробиотическая профилактика (пробиотикотерапия).
- Laura V. Blanton, et. al. Gut bacteria that prevent growth impairments transmitted by microbiota from malnourished children. Science 19 Feb 2016: Vol. 351, Issue 6275, aad3311
- Martin Schwarzer, et. al. Lactobacillus plantarum strain maintains growth of infant mice during chronic undernutrition. Science 19 Feb 2016: Vol. 351, Issue 6275, pp. 854-857
- Mark R. Charbonneau et al., Sialylated Milk Oligosaccharides Promote Microbiota-Dependent Growth in Models of Infant Undernutrition. Cell 25 Feb 2016: Vol. 164, Issue 5, pp. 859–871
2.3. Доказательства безопасности пробиотиков для будущих мам и новорожденных детей.

Снижение частоты инфекционных заболеваний, предотвращение аллергии, экземы и т.д.
В ряде рандомизированных исследований [39,49,50] была показана эффективность пробиотиков, при применении которых наблюдались: устойчивость к респираторным инфекциям у детей в течение 2 лет; тенденция к сокращению lgE-ассоциированных заболеваний (аллергий) и предотвращение атопической экземы от 2 до 5 лет; у детей, родившихся с помощью кесарева сечения, - увеличение количества фекальных лактобацилл и бифидобактерий
В исследованиях была подтверждена долгосрочная безопасность и эффективность кормления пробиотической смесью. Смесь назначалась как беременным матерям, носившим детей с высоким риском развития аллергии (в течение от 2 до 4 недель до родов), так и их новорожденным младенцам (в течение 6 месяцев от рождения). В указанные смеси входили следующие пробиотические виды: Lactobacillus rhamnosus, Bifidobacterium breve и Propionibacterium freudenreichii ssp shermanii.
Следует отметить, что в рандомизированных выборках новорожденных была проанализирована бактериальная колонизация мекония (n = 131) и образцов фекалий через 3 (n = 98), 6 (n = 99) и 24 (n = 89) месяца для бактериального восстановления добавленных бактерий. Были проведены анализы на общее количество лактобацилл и бифидобактерий.
При этом штамм молочных пропионовокислых бактерий P.freudenreichii подвид shermanii (который был добавлен в пробиотическую смесь) был идентифицирован с помощью RAAPD - т.е. методом случайной амплификации полиморфной ДНК. Таким образом, классические пропионовокислые бактерии (ПКБ), также как и бифидобактерии, представляют нормобиоценоз кишечника малышей, т.е. являются ранними колонизирующими симбиотическим анаэробами с полезными свойствами. Это открывает огромные перспективы по применению вида P. freudenreichii ssp shermanii (используется в «Пропионикс») в профилактике дисбиозов не только у взрослых, но и у детей всех возрастных групп, особенно учитывая бифидогенные, антибиотические (антипатогенные), антимутагенные и детоксицирующие свойства данных пробиотических микроорганизмов (см. также доп. информацию о ПКБ для недоношенных детей с риском НЭК и сепсиса).
См. подробнее:
Дополнительно см.:
Это подтверждают и др. исследования. Так, например, в 2004 году в Индии в Махараштрском университете была проведена обширная по масштабу исследовательская работа, в которой объектами исследования служили 135 детей-добровольцев (от 2 до 5 лет) с желудочно-кишечными инфекциями. В результате данного эксперимента было установлено, что в группе детей, получавших ПКБ, выздоровление происходило быстрее, и в течении 3-х месяцев после лечения сохранялось стабильное состояние здоровья. Более того, у детей наблюдалась прибавка в весе, а через 15 дней в их кале в несколько раз возрастало количество бифидобактерий, лактобацилл и самих пропионибактерий, и резко снижалось количество клостридий, колиформных бактерий, стафилококков и энтерококков.
Дополнительная информация про безопасность бифидобактерий и классических ("молочных") пропионовокислых бактерий:


Итак, пропионибактерии и бифидобактерии были идентифицированы как защитные и ранние колонизирующие пробиотические симбионты [51,52]. Кроме того, было показано, что, как и грудное вскармливание, кормление ребенка смесью, содержащей такие пробиотические бактерии, предотвращает заболевания, связанные с дисбактериозом [53,54].
И, наконец, самым главным доказательством безопасности для ПКБ является то, что молочные пропионибактерии общепризнанны безопасными (Generally recognized as safe - GRAS) и обладают квалифицированной презумпцией безопасности (Qualified presumption of safety - QPS) Европейского агентства по безопасности продуктов питания [55].
Учитывая все данные изложенного выше материала, в т.ч. описанные пробиотические свойства молочных пропионовокислых бактерий P. freudenreichii и важную роль бифидобактерий в пробиотической профилактике для беременных женщин и новорожденных детей, а также доминирование среди бифидобактерий вида B. longum (в первые годы жизни ребенка), медицинским специалистам необходимо на практике (и более широко) использовать данный потенциал полезных микроорганизмов в сфере репродуктологии, акушерства и гинекологии и педиатрии. Тем более, что кроме усиления бифидогенной активности, симбиоз бифидо- и пропионовых бактерий имеет повышенные противоинфекционные и антимутагенные свойства, что ранее было установлено экспериментально.




В заключение стоит отметить, что во время планирования беременности и при беременности, помимо профилактики дисбакетриоза, обязательно нужно контролировать свой селеновый и йодный статус. Это связано с тем, что, во-первых, селен входит в состав важных селенопротеинов, крайне необходимых для протекания поздних стадий развития фолликулов, что создает нужную среду для производства яйцеклеток (это касается повышения фертильности, т.е. самой способности забеременеть), а во-вторых, йод и селен при самой беременности требуются в повышенных количествах, т.к. играют важную роль в правильном развитии плода и рождении здорового ребенка, причем оба эссенциальных микроэлемента взаимосвязаны: поскольку гомеостаз тироксина зависит от Se-содержащего фермента, устранить йододефицит без устранения селенодефицита не получится. Таким образом, при наличии йодо- и селенодефицита, вместо рекомендуемого выше "Пропионикса" (P. freudenreichii ssp. shermanii) с "Концентратом бифидобактерий жидким" или "Бификардио" (B. longum) следут использовать "Селенпропионикс" и/или "Йодпропионикс".
- Добавление смеси бифидобактерий ускоряет созревание микробиома и уменьшает воспаление кишечника у крайне недоношенных детей
- Почему бифидобактерии важны для младенцев?
- Роль бифидобактерий в здоровье младенцев
- Неонатальная желтуха и бифидобактерии
- Микробиом и гестационный сахарный диабет
- Пробиотическая смесь устраняет вредные последствия у детей, получавших антибиотики или рожденных путем кесарева сечения
- Полезные бактерии могут быть восстановлены у детей с кесаревым сечением при рождении
- Новый взгляд на бифидогенный эффект - экология и перспективы здоровья при колонизации бифидобактериями в раннем возрасте
- НЭК и сепсис у недоношенных новорожденных и кишечный микробиом
- Комбинация пробиотиков снижает летальность у недоношенных детей
- Пробиотики защищают недоношенных детей от НЭК и сепсиса
- Матери недоношенных детей имеют индивидуальную микробиоту грудного молока, которая изменяется во времени
- Рыбий жир и пробиотики во время беременности могут снизить риск детской пищевой аллергии и экземы
- Метаболиты кишечных бактерий, пропионат и бутират, защищают от аллергических расстройств (атопии)
- Рекомендации Всемирной организации по аллергии и Университета Макмастера по профилактике аллергических заболеваний (GLAD-P): Пробиотики
- Микроэлементы во время беременности и их влияние на развитие ребенка
- Дисбактериоз, недоношенность ребенка и пробиотики
- Внутриутробное развитие плода протекает не в стерильной среде
- Формирование кишечной микробиоты ребенка
- Материнские кишечные микробиомы, осложнения беременности и влияние на потомство
- Пробиотики защищают недоношенных детей от некроза и сепсиса
- Кишечная микробиота, болезнь Гиршпрунга и Гиршпрунг-ассоциированный энтероколит у маленьких детей
- Кишечный дисбиоз у детей в ОРИТ способствует задержке роста
- Задержка роста детей и кишечный микробиом
- Микрофлора кишечника и ответ на вакцинацию у детей раннего возраста
- Пробиотики снижают риск развития атопической экземы
- Пробиотики и здоровье недоношенных детей
- Пробиотики и детское ожирение
- Прием антибиотиков в детстве вызывает в дальнейшем ожирение
- Преэклампсия и пробиотики
- Ученые рекомендуют пробиотики беременным и кормящим женщинам
- Кишечные бактерии, такие как Klebsiella, влияют на развитие мозга крайне недоношенных детей
- Пробиотики снижают риск гестационного диабета
- Пробиотики против токсоплазмоза
- Микробиоценоз кишечника при привычном невынашивании беременности
- Пробиотики и СПКЯ - перспективы лечения подростков с ожирением
- Селен повышает женскую фертильность
- Эффект микробиома и рождение здорового ребенка
- Роль кишечной микрофлоры и пробиотиков в развитии иммунитета грудных детей (PDF)
Источник 1 части: Попова Е.Н. и соавт. Возможность пробиотической коррекции нарушений микрофлоры матери для профилактики возможных осложнений у ребенка. Влияние микрофлоры матери на формирование здоровья будущего ребенка. / МИКРОБИОТА. - Монография под редакцией Е.Л. Никонова и Е.Н. Поповой. – Москва. - 2019. - С.140-152
Список литературы
- Maccaferri S, Biagi E, Brigidi P. Metagenomics: key to human gut microbiota. Dig Dis. 2011;29(6):525-530.
- Wilmes P, Heintz-Buschart A, Bond PL. A decade of metaproteomics: Where we stand and what the future holds. Proteomics. 2015;15(20):3409-3417.
- Elson CO, Alexander KL. Host-microbiota interactions in the intestine. Dig Dis. 2015;33(2):131-136.
- Pyun BY. Natural history and risk factors of atopic dermatitis in children. Allergy Asthma Immunol Res. 2015;7(2):101-105.
- Nutten S. Atopic dermatitis: global epidemiology and risk factors. Ann Nutr Metab. 2015;66(1):8-16.
- Wong GW. Epidemiology: international point of view, from childhood to adults, food allergens. Chem Immunol Allergy. 2015;101:30-37.
- Flohr C, Mann J. New insights into the epidemiology of childhood atopic dermatitis. Allergy. 2014;69(1):3-16.
- Garg N, Silverberg JI. Epidemiology of childhood atopic dermatitis. Clin Dermatol. 2015;33(3):281-288.
- Смирнова Г.И. Новое в патогенезе и лечении атопического дерматита у детей. Российский педиатрический журнал. 2013;6:53-57.
- Смирнова Г.И. Атопический дерматит и инфекции кожи у детей. Российский педиатрический журнал. 2014;2:49-56.
- Purchiaroni F, Tortora A, Gabrielli M, Bertucci F, Gigante G, Ianiro G, et al. The role of intestinal microbiota and the immune system. Eur Rev Med Pharmacol Sci. 2013;17:323-333.
- Li M, Wang M, Donovan SM. Early development of the gut microbiome and immune-mediated childhood disorders. Semin Reprod Med. 2014;32(1):74-86.
- Grimshaw K, Logan K, O’Donovan S. Modifying the Infant’s Diet to Prevent Food Allergy. Arch Dis Child. 2017;102(2):179-186.
- Wesemann DR, Nagler CR. The microbiome, timing, and barrier function in the context of allergic disease. Immunity. 2016;44:728-738.
- Schultz M, Gottl C, Young RJ, et al. Administration of oral probiotic bacteria to pregnant women causes temporary infantile colonization. J Pediatr Gastroenterol Nutr. 2004;38:293-297.
- Gonzalez R, Klaassens ES, Malinen E, et al. Differential transcriptional response of Bifidobacterium longum to human milk, formula milk, and galactooligosaccharide. Appl Environ Microbiol.2008;74:4686-4694.
- Gomez de Aguero M, Ganal-Vonarburg SC, Fuhrer T, et al. The maternal microbiota drives early postnatal innate immune development. Science. 2016;351:1296-1302.
- Matamoros S, Gras-Leguen C, Le Vacon F, et al. Development of intestinal microbiota in infants and its impact on health. Trends Microbiol. 2013;21:167-173.
- Prescott SL, Wickens K, Westcott L, et al. Supplementation with Lactobacillus rhamnosus or Bifidobacterium lactis probiotics in pregnancy increases cord blood interferon-gamma and breast milk transforming growth factor-beta and immunoglobin A detection. Clin Exp Allergy. 2008;38:1606-1614.
- Boyle RJ, Ismail IH, Kivivuori S, et al. Lactobacillus GG treatment during pregnancy for the prevention of eczema: a randomized controlled trial. Allergy. 2011;66:509-516.
- Kondo N, Suda Y, Nakao A, et al. Maternal psychosocial factors determining the concentrations of transforming growth factor-beta in breast milk. Pediatr Allergy Immunol. 2011;22:853-861.
- Rautava S, Kalliomaki M, Isolauri E. Probiotics during pregnancy and breastfeeding might confer immunomodulatory protection against atopic disease in the infant. J Allergy Clin Immunol. 2002;109:119-121.
- Zuccotti G, Meneghin F, Aceti A, et al. Probiotics for prevention of atopic diseases in infants: systematic review and meta-analysis. Allergy. 2015;70:1356-1371.
- Osborn DA, Sinn JK. Prebiotics in infants for prevention of allergy. Cochrane Database Syst Rev. 2013;CD006474.
- Martin R, Jimenez E, Heilig H, et al. Isolation of bifidobacteria from breast milk and assessment of the bifidobacterial population by PCR-denaturing gradient gel electrophoresis and quantitative real-time PCR. Appl Environ Microbiol. 2009;75:965-969.
- Аrrieta MC, Stiemsma LT, Dimitriu PA, et al. Early infancy microbial and metabolic alterations affect risk of childhood asthma. Sci Transl Med. 2015;7:307-152.
- Jeurink PV, van Bergenhenegouwen J, Jimenez E, et al. Human milk: a source of more life than we imagine. Benef Microbes. 2013;4:17-30.
- Mastromarino P, Capobianco D, Miccheli A, et al. Administration of a multistrain probiotic product (VSL#3) to women in the perinatal period differentially affects breast milk beneficial microbiota in relation to mode of delivery. Pharmacol Res. 2015;95-96:63-70.
- Zeng H, Chi H. Metabolic control of regulatory T cell development and function. Trends Immunol. 2015;36:3-12.
- Bode L. Human milk oligosaccharides: every baby needs a sugar mama. Glycobiology. 2012;22:1147-1162.
- Gonzalez R, Klaassens ES, Malinen E, et al. Differential transcriptional response of Bifidobacterium longum to human milk, formula milk, and galactooligosaccharide. Appl Environ Microbiol. 2008;74:4686-4694.
- Gueimonde M, Sakata S, Kalliomaki M, Isolauri E, et al. Effect of maternal consumption of Lactobacillus GG on transfer and establishment of fecal bifidobacterial microbiota in neonates. J Pediatr Gastroenterol Nutr. 2006;166-170.
- VandeVusse L, Hanson L, Safdar N. Perinatal outcomes of prenatal probiotic and prebiotic administration: an integrative review. J Perinat Neonatal Nurs. 2013;27(4):288-301.
- D’Souza AL, Rajkumar C, Cooke J, Bulpitt CJ. Probiotics in prevention of antibiotic associated diarrhoea: meta-analysis. BMJ. 2002;324(7350):1361.
- Маев И.В., Самсонов А.А., Плотникова Е.Ю. и др. Пробиотики и пребиотики в клинической практике. Фарматека. 2011;5(218):33-41.
- Othman M, Neilson JP, Alfirevic Z. Probiotics for preventing preterm labour. Cochrane Dat Syst Rev. 2007;24:CD005941.
- Vitali B, Cruciani F, Baldassarre ME, Capursi T, et al. Dietary supplementation with probiotics during late pregnancy: outcome on vaginal microbiota and cytokine secretion. BMC Microbiol. 2012;12:236.
- Ortiz-Andrellucchi A, Sanchez-Villegas A, Rodriguez-Gallego C, et al. Immunomodulatory effects of the intake of fermented milk with Lactobacillus casei DN114001 inlactating mother sеnd their children. Br J Nutr. 2008;100:834-845.
- Kukkonen K, Savilahti E, Haahtela T, et al. Long-term safety and impact on infection rates of postnatal probiotic and prebiotic (synbiotic) treatment: randomized, double-blind, placebo- controlled trial. Pediatrics. 2008;122:8-12.
- Kalliomaki M, Salminen S, Poussa T, Isolauri E. Probiotics during the first 7 years of life: accumulative risk reduction of eczema in a randomized, placebo-controlled trial. J Allergy Clin Immunol. 2007;119:1019-1021.
- Rautava S, Kalliomaki M, Isolauri E. Probiotics during pregnancy and breast-feeding might confer immunomodulatory protection against atopic disease in the infant. J Allergy Clin Immunol. 2002;109:119-121.
- Wickens K, Black PN, Stanley TV. Probiotic Study Group. A differential effect of 2 probiotics in the prevention of eczema and atopy: a double-blind, randomized, placebo-controlled trial. J Allergy Clin Immunol. 2008;122:788-794.
- Niers L, Martin R, Rijkers G, et al. The effects of selected probiotic strains on the development of eczema (the Pand A study). Allergy. 2009;64:1349-1358.
- Pelucchi C, Chatenoud L, Turati F, Galeone C, et al. Probiotics supplementation during pregnancy or infancy for the prevention of atopic dermatitis: a meta-analysis. Epidemiol. 2012;23(3):402-414.
- Bertelsen RJ, Brantsater AL, Magnus MC, Haugen M, et al. Probiotic milk consumption in pregnancy and infancy and subsequent childhood allergic diseases. J Allergy Clin Immunol. 2014;133(1):165-171.e1-8.
- Laitinen K, Poussa T, Isolauri E. Nutrition, Allergy, Mucosal Immunology and Intestinal Microbiota Group. Probiotics and dietary counselling contribute to glucose regulation during and after pregnancy: a randomised controlled trial. Br J Nutr. 2009;101:1679-1687.
- Luoto R, Laitinen K, Nermes M, Isolauri E. Impact of maternal probiotic-supplemented dietary counseling on pregnancy outcome and prenatal and postnatal growth: a double-blind, placebo-controlled study. Br J Nutr. 2010;103(12):1792-1799.
- Asemi Z, Samimi M, Tabassi Z, et al. Effect of daily consumption of probiotic yoghurt on insulin resistance in pregnant women: a randomized controlled trial. Eur J Clin Nutr. 2013;67(1):71-74.
- Mikael Kuitunen, et. al. Probiotics prevent IgE-associated allergy until age 5 years in cesarean-delivered children but not in the total cohort. Journal of Allergy and Clinical Immunology, February 2009. Vol. 123, Issue 2, p335–341
- Kaarina Kukkonen, et. al. Probiotics and prebiotic galacto-oligosaccharides in the prevention of allergic diseases: A randomized, double-blind, placebo-controlled trial. Journal of Allergy and Clinical Immunology, January 2007. Vol. 119, Issue 1, p192–198
- Colliou, N.; Ge, Y.; Sahay, B.; Gong, M.; Zadeh, M.; Owen, J.L.; Neu, J.; Farmerie, W.G.; Alonzo, F.; Liu, K.; et al. Commensal Propionibacterium strain UF1 mitigates intestinal inflammation via Th17 cell regulation. J. Clin. Investig. 2017, 127, 3970–3986. [Google Scholar] [CrossRef]
- Chang, H.-Y.; Chen, J.-H.; Chang, J.-H.; Lin, H.-C.; Lin, C.-Y.; Peng, C.-C. Multiple strains probiotics appear to be the most effective probiotics in the prevention of necrotizing enterocolitis and mortality: An updated meta-analysis. PLoS ONE 2017, 12, e0171579. [Google Scholar] [CrossRef] [PubMed]
- Milani, C.; Duranti, S.; Bottacini, F.; Casey, E.; Turroni, F.; Mahony, J.; Belzer, C.; Delgado Palacio, S.; Arboleya Montes, S.; Mancabelli, L.; et al. The first microbial colonizers of the human gut: Composition, activities, and health implications of the infant gut microbiota. Microbiol. Mol. Biol. Rev. 2017, 81, e00036-17. [Google Scholar] [CrossRef]
- Repa, A.; Thanhaeuser, M.; Endress, D.; Weber, M.; Kreissl, A.; Binder, C.; Berger, A.; Haiden, N. Probiotics (Lactobacillus acidophilus and Bifidobacterium bifidum) prevent NEC in VLBW infants fed breast milk but not in formula. Pediatr. Res. 2015, 77, 381–388. [Google Scholar] [CrossRef] [PubMed]
- European Food Safety Authority (EFSA). The Maintenance of the List of QPS Microorganisms Intentionally Added to Food or Feed-Scientific Opinion of the Panel on Biological Hazards 2008. (accessed on 22 October 2019).



