ООО "ПРОПИОНИКС"
| пн-пт с 09:00 до 18:00 | |
Пропионовокислые бактерии (или пропионибактерии - от лат. Propionibacterium)
ПРОПИОНОВОКИСЛЫЕ БАКТЕРИИ
КЛАССИЧЕСКИЕ ("МОЛОЧНЫЕ") ПРОПИОНОВОКИСЛЫЕ БАКТЕРИИ - НАИПОЛЕЗНЕЙШИЕ ИЗ АНАЭРОБОВ
Анаэробы - организмы, получающие энергию при отсутствии доступа кислорода путем субстратного фосфорилирования, конечные продукты неполного окисления субстрата при этом могут быть окислены с получением большего количества энергии в виде Аденозинтрифосфата (АТФ) в присутствии конечного акцептора протонов организмами, осуществляющими окислительное фосфорилирование.
Содержание страницы:
 Пропионовокислые бактерии можно назвать живыми ископаемыми: они появились не менее трех миллиардов лет назад, когда на Земле только еще зарождалась жизнь. В те времена температура поверхности планеты была гораздо выше, чем сейчас; иным был и состав атмосферы: много метана, аммиака, углекислоты, водорода, сероводорода, водяных паров, полное отсутствие кислорода. Такие условия и определили свойства современных пропионовокислых бактерий (Propionibacterium) – термоустойчивость, анаэробность, спокойное отношение к сероводороду, для большинства живых существ ядовитому.
Пропионовокислые бактерии можно назвать живыми ископаемыми: они появились не менее трех миллиардов лет назад, когда на Земле только еще зарождалась жизнь. В те времена температура поверхности планеты была гораздо выше, чем сейчас; иным был и состав атмосферы: много метана, аммиака, углекислоты, водорода, сероводорода, водяных паров, полное отсутствие кислорода. Такие условия и определили свойства современных пропионовокислых бактерий (Propionibacterium) – термоустойчивость, анаэробность, спокойное отношение к сероводороду, для большинства живых существ ядовитому.
Когда же в земной атмосфере появился кислород, то пропионовокислые бактерии приспособились и к аэробному окружению. Больше того, они даже способны извлекать из контакта с кислородом маленькую энергетическую пользу, поскольку обладают дыхательной цепью – каскадом биохимических реакций окислительного фосфорилирования, в результате которых создаются богатые энергией соединения. Однако главная форма их общения с кислородом это обезвреживание его путем флавинового дыхания (ФД), в ходе которого кислород расходуется на окисление восстановленных флавопротеидов (ФД - восстановление О2, при котором в роли окислительных ферментов (или оксидаз), непосредственно осуществляющих перенос электронов на молекулярный кислород, выступают флавопротеины.
Пропионовокислые бактерии (син.: пропионовые бактерии или пропионибактерии - от лат. Propionibacterium) были впервые описаны в конце 19-го века Фройденрайхом (E. Von Freudenreich) и Орла-Енсеном (Sigurd Orla-Jensen) во время изучения пропионовокислого брожения в сыре Эмменталь. Сыры, молоко и молочные продукты стали основными источниками выделения чистых культур пропионовых бактерий. Главное место обитания классических (молочных) пропионовокислых бактерий – твердые сычужные сыры и более 60% штаммов, выделенных из «Эмментальского» сыра, относится к Propionibacterium freudenreichii и Propionibacterium shermanii. Стоит отметить, что существуют молочные и кожные виды пропионовокислых бактерий, однако мы рассмотрим пробиотический и биотехнологический потенциал только молочных (классических) propionibacteria, т.к. они используются в заквасках и биодобавках (Прим.: в частности, в закваске «Пропионикс», используется штамм КМ-186, относящийся к виду Propionibacterium freudenreichii подвид Shermanii).
Таблица 1. Молочные и кожные виды пропионовокислых бактерий*
|
Молочная (классическая) propionibacteria
|
Кожная propionibacteria
|
|
P. acidipropionici
|
P. acidifaciens
|
|
P. cyclohexanicum
|
P. acnes
|
|
P. freudenreichii subsp. freudenreichii
|
P. australiense
|
|
P. freudenreichii subsp. shermanii
|
P. avidum
|
|
P. jensenii
|
P. granulosum
|
|
P. microaerophilum
|
P. propionicum
|
|
P. thoenii
|
*Актуальные данные о ПКБ см. в разделе "Новое о ПКБ"
Пропионовокислые бактерии (род Propionibacterium, англ. Propionic acid bacteria) — род грамположительных факультативных анаэробных неподвижных бактерий. Пропионовокислые бактерии (пропионовые бактерии, пропионибактерии) представляют собой неспороносные грамположительные неподвижные палочки размером 0,5—0,8 или 1,0—1,5 мкм (в молодых культурах — искривленные, слегка ветвящиеся палочки, в более старых — кокковидной формы). Образуют колонии жёлтого, оранжевого или красного цвета, растут как в аэробных, так и в анаэробных условиях. Непатогенны, обитают в рубце и кишечнике жвачных животных, в молочных продуктах (твердых сырах), являются представителями резидентной микрофлоры кишечника человека. Пропионовокислые бактерии — возбудители пропионовокислого брожения, сбраживают глюкозу, лактозу и др. углеводы, а также некоторые спирты с образованием пропионовой и уксусной кислот и CO2. Закваски, содержащие пропионовокислые бактерии, издавна употребляли в сыроделии: рисунок («глазки»), а также вкус и аромат швейцарского сыра в значительной мере связаны с пропионовокислым брожением. Пропионовокислые бактерии применяют для микробиологического синтеза витамина B12. Выращивают пропионовые бактерии на различных питательных средах, содержащих кобальт.
Propionibacterium freudenreichii — грамположительная неподвижная бактерия (из рода Propionibacterium) играющая важную роль в создании сыра Эмменталь и, в некоторой степени, сыра Ярлсберг, Леердаммер и Маасдам. Концентрация P. freudenreichii в сырах швейцарского типа выше, чем в любом другом сыре. Пропионибактерии обычно встречаются в молоке и молочных продуктах. P. freudenreichii имеет кольцевую хромосому длиной около 2,5 млн. п.н. При производстве сыра Эмменталь P. freudenreichii ферментирует лактат с образованием ацетата, пропионата и углекислого газа.
Продукты этого брожения придают сыру ореховый и сладкий вкус, а побочный продукт двуокиси углерода отвечает за образование отверстий или «глазков» в сыре. Сыроделы контролируют размер отверстий, изменяя кислотность, температуру и время отверждения смеси. По оценкам, один миллиард живых клеток P. freudenreichii присутствует в одном грамме Эмменталя. В отличие от большинства молочнокислых бактерий, эта бактерия в основном расщепляет липиды, образуя свободные жирные кислоты. Недавние исследования были сосредоточены на возможных преимуществах употребления P. freudenreichii, которые, как считается, очищают желудочно-кишечный тракт (освобождают от токсинов, ингибируют патогенны). Также предполагалось, что P. freudenreichii может снизить заболеваемость раком толстой кишки. Эти мутуалистические отношения необычны для пропионибактерий, которые в значительной степени являются комменсалами.
МОЛОЧНЫЕ ПРОПИОНОВОКИСЛЫЕ БАКТЕРИИ КАК ЧЕЛОВЕЧЕСКИЕ ПРОБИОТИКИ
 Пробиотики являются предметом интенсивных исследований, в которых ориентируются в основном на бифидобактерии и молочнокислые бактерии. Однако, есть свидетельства того, что молочные пропионовокислые бактерии (ПКБ) обладают просто уникальными и зачастую более значимыми пробиотическими свойствами, и чьи потенциальные ресурсы недооценены до сих пор. Список пробиотических характеристик ПКБ должен быть увеличен, в первую очередь, за счет обнаруженных у них антимутагенных, реактивирующих и протекторных свойств. На практике выбор критериев для определения пробиотических свойств пропионовокислых бактерий производили в таких областях, как продовольственная безопасность, технологическая и пищеварительная стрессоустойчивость, а также потенциальные преимущества для здоровья, которые включают: модуляцию микробиоты и метаболическую активность в кишечнике, модуляцию кишечной перистальтики и всасывания, влияние на воспаление кишечника, модуляцию иммунной системы и потенциальное снижение факторов риска развития раковых заболеваний.
Пробиотики являются предметом интенсивных исследований, в которых ориентируются в основном на бифидобактерии и молочнокислые бактерии. Однако, есть свидетельства того, что молочные пропионовокислые бактерии (ПКБ) обладают просто уникальными и зачастую более значимыми пробиотическими свойствами, и чьи потенциальные ресурсы недооценены до сих пор. Список пробиотических характеристик ПКБ должен быть увеличен, в первую очередь, за счет обнаруженных у них антимутагенных, реактивирующих и протекторных свойств. На практике выбор критериев для определения пробиотических свойств пропионовокислых бактерий производили в таких областях, как продовольственная безопасность, технологическая и пищеварительная стрессоустойчивость, а также потенциальные преимущества для здоровья, которые включают: модуляцию микробиоты и метаболическую активность в кишечнике, модуляцию кишечной перистальтики и всасывания, влияние на воспаление кишечника, модуляцию иммунной системы и потенциальное снижение факторов риска развития раковых заболеваний.
Устойчивость молочных пропионовокислых бактерий к технологическим стрессам должно привести их к дальнейшему использованию в различных ферментированных пробиотических продуктах. Следует отметить, что некоторые из пробиотических свойств молочных propionibacteria, описанные в литературе, отличаются от тех, которые характерны для бифидобактерий и молочнокислых бактерий. Тем не менее, до сих пор в рандомизированных, плацебо-контролируемых, двойных слепых клинических испытаниях на людях, добавки с молочными propionibacteria применяют вместе с пробиотическими бактериями из других родов. Клинические исследования с употреблением только молочных propionibacteria весьма немногочисленны, и вопрос о том, оказывает ли тот или иной штамм P. freudenreichii непосредственное положительное воздействие на организм человека при поступлении в желудочно-кишечный тракт (ЖКТ) был до сих пор обойден вниманием (прим.: речь идет о штаммоспецифичности бактерий). Однако, последние исследования пробиотически значимых свойств ПКБ позволяют более чем обоснованно применять большинство изученных штаммов классических (молочных) пропионовокислых бактерий в здравоохранительной практике.
Большой интерес в научном и практическом плане вызывают молочнокислые (МКБ) и бифидобактерии как эубиотики, т.е. микроорганизмы, колонизующие эпителий кишечника. Однако пропионовокислые бактерии могут быть существенно полезными для здоровья человека в качестве транзиторных пробиотиков. Наличие пробиотически значимых свойств у определенных штаммов ПКБ позволяет использовать их как транзиторные пробиотики, о которых известно, что они сохраняют жизнеспособность и проявляют метаболическую активность, продвигаясь по ЖКТ в течение примерно 20 ч. Пробиотики разделяют на три функциональные категории: антимикробные, иммуномодулирующие и метаболические. Все эти качества присутствуют в "арсенале" молочных ПКБ.
Важное пробиотически значимое свойство штаммов P. freudenreichii состоит в том, что в отличие от МКБ они способны продуцировать ряд полезных соединений - нутрицевтиков, проявляя при этом низкие ростовые потребности (глюкозо-минеральная среда с добавлением только двух витаминов). Экзометаболитами ПКБ являются витамины группы В (рибофлавин, пиридоксин, никотиновая и фолиевая кислоты), антимикробные факторы, конъюгаты линолевой кислоты, экзоферменты и антимутагенные факторы, а так же бифидогенные факторы — стимуляторы роста бифидобактерий. Биосинтез больших количеств корриноидов - внутриклеточных соединений группы витамина В12 - известная метаболическая особенность пропионовокислых бактерий, которая существенна как для организма животного (человека), так и для микробиоты ЖКТ. Известна способность эубиотиков усиливать адгезию ПКБ на внутренней поверхности ЖКТ. Следовательно, не исключается образование сообщества бактерий пробиотиков в ЖКТ. Штамм P. freudenreichii, физиология которого давно изучается (в лабораториях МГУ и ВСГУТУ), обнаружил биосовместимость (отсутствие взаимного подавления роста) с молочнокислыми эубиотиками, такими как Lactobacillus casei и L. acidophilus (данные не опубликованы). Пробиотически значимым свойством ряда исследуемых штаммов является также выраженная антиоксидантная активность, которая была показана ранее методом вольтамперометрии, а также, например, способность вызывать отмирание опухолевых клеток прямой кишки и желудка человека и т.д. (об этих и др. свойствах ПКБ см. подробнее в соотв. пп. данной страницы)
Пропионовокислые бактерии относятся к наиполезнейшим из анаэробов. Видимо поэтому на Международном симпозиуме в Рэнне (Франция, 1995 г.) большое внимание уделялось вопросам создания пробиотиков с включением в них пропионовых бактерий, созданию и изучению условий, усиливающих биологическую активность ПКБ в сырах и некоторых сортах хлеба. Бактерии приживаются в кишечнике людей и животных и снижают генотоксическое действие различных химических соединений и ультрафиолетовых лучей. Впервые продемонстрированная индукция антимутагенеза у пропионовокислых бактерий (см.: Воробьева Л.И. Пропионовокислые бактерии. - М.: Изд-во МГУ, 1995. - 288 с.) служит дополнительным указанием на необходимость создания более тесной связи жизнедеятельности пропионовокислых бактерий и людей. Сегодня молочные пропионовокислые бактерии используют в мире как пробиотики для людей, особенно при нарушении работы кишечного тракта у детей (пока более широко за рубежом: во Франции, Финляндии, Индии и др.).

О безопасности и пользе молочных пропионовокислых бактерий для малышей см. здесь → и здесь →.
Особенности классических (молочных) пропионовокислых бактерий
Известно, что положительная роль пропионовокислых бактерий как пробиотиков обусловлена образованием ими пропионовой кислоты (CH3CH2COOH), минорных органических кислот, бактериоцинов, ферментов и витаминов. Эти уникальные микроорганизмы обладают мощными иммуномодулирующими и антимутагенными свойствами, они приживаются в кишечнике людей и способны к снижению генотоксического действия ряда химических соединений и УФ-лучей. В отличие от других пробиотиков у пропионовокислых бактерий установлен значительный синтез корриноидов, гемсодержащих антиоксидантных ферментов: каталазы, пероксидазы и супероксиддисмутазы (СОД). Известно, что молочные пропионовокислые бактерии не перевариваются в желудочно-кишечном тракте людей, устойчивы к действию желчных кислот, выдерживают низкую рН (2.0) кислотность желудка, ингибируют активность β-глюкуронидазы, азаредуктазы и нитроредуктазы - ферментов, образуемых кишечной микрофлорой и вовлекаемых в образование мутагенов, канцерогенов и промоторов роста опухолей.
Предотвращение риска раковых заболеваний и детоксицирующие свойства
 Пропионовокислые бактерии могут способствовать уменьшению факторов риска для развития рака, в частности, благодаря способности связывать и элиминировать из организма канцерогенные соединения, такие как микотоксины, особенно афлатоксин B1, цианотоксины, такие как микроцистин-LR, растительные лектины, такие как concanavalin A и jacalin, а также некоторые тяжелые металлы, такие как кадмий и свинец, которые также являются эндокринными разрушителями.
Пропионовокислые бактерии могут способствовать уменьшению факторов риска для развития рака, в частности, благодаря способности связывать и элиминировать из организма канцерогенные соединения, такие как микотоксины, особенно афлатоксин B1, цианотоксины, такие как микроцистин-LR, растительные лектины, такие как concanavalin A и jacalin, а также некоторые тяжелые металлы, такие как кадмий и свинец, которые также являются эндокринными разрушителями.
Органические токсины, приведенные выше, связаны, в частности, с колоректальным раком. Тяжелые металлы тоже несут в себе много вредного воздействия на здоровье человека, негативно влияют на почки, провоцируют другие виды онкологических болезней. Все это свидетельствует о том, что молочные пропионовокислые бактерии, как минимум, уменьшают всасывание канцерогенных соединений в кишечнике и препятствуют появлению и развитию раковых заболеваний.
Кроме того, эти бактерии могут быть использованы в качестве детоксицирующей добавки к пище, загрязненной высоким уровнем такого рода канцерогенными соединениями, которые очень трудно удалить из продуктов. В исследованиях были показаны выраженные антимутагенные свойства классических молочных пропионовокислых бактерий Propionibacterium freudenreichii subsp. shermanii по предотвращению мутаций, вызванных самыми различными мутагенными агентами. Положительное действие здесь также достигается и за счет синтеза P. freudenreichii (P. shermanii) соединений с полезными физиологическими и антиканцерогенными свойствами через изомеризацию линолевой кислоты (трансформирование в конъюгированную форму):
Конъюгированная линолевая кислота (КЛК или CLA) – ненасыщенная С18 жирная кислота, образуемая в организме животного как незаменимая. Она представляет собой смесь изомеров. Участвует в липидном обмене, имеет существенное значение для свертываемости крови и структуризации цитоплазматической мембраны. Проявляет ряд полезных для здоровья человека действий: антиканцерогенное, антиатерогенное, антидиабетическое, антиоксидантное, модулирует иммунную систему и регулирует жировой статус. Штаммы P. freudenreichii способны превращать (трансформировать) изомеры линолевой кислоты в конъюгированные формы с высокой эффективностью (50-90%). Это происходит вне клеток, т.е. во внешней среде. Способность обогащать ЖКТ человека изомерами КЛК можно считать пробиотическим свойством.
Из детоксицирующих свойств ледует отметить также способность ПКБ нейтрализовывать лектины, разрушающие слизистую ЖКТ. Пропионовокислые бактерии удаляют лектины с поверхности слизистой ЖКТ, замещая их собой: P. freudenreichii были способны удалить 60-70% конканавалина А и якалина с эпителиальных клеток кишечника.
Раковые заболевания. Недавние исследования показали, что пропионовокислые батерии могут также использоваться как эффективные пробиотики в профилактике рака кишечника через их способность синтезировать апоптоз-индуцирующие короткоцепочечные жирные кислоты (КЖК). Как известно молочные ПКБ путем ферментации вырабатывают КЖК, в основном пропионат и ацетат. Как было установлено, пропионовокислые бактерии действуя на митохондрии через КЖК, индуцируют апоптоз (процесс программируемой клеточной гибели) клеток колоректального рака. Прим.: Апоптоз - один из основных механизмов самопрофилактики онкологических заболеваний. Некоторые сведения в пользу пробиотического действия P. freudenreichii указывают также и на определенную штаммоспецифичность данного эффекта. В опытах ex vivo было выявлено, что P. freudenreichii SI41 вызывает отмирание опухоли прямой кишки — колоректальной карциномы.
Также отмечается, что молоко, ферментированное только молочными P. freudenreichii, способствовало апоптозу раковых клеток желудка человека (HGT-1) и усиливало цитотоксическое действие камптотецина, применяемого в химиотерапии данного вида рака. Это же молоко положительно влияло на поросят при болезни воспаленного кишечника. Следует отметить, что Propionibacterium freudenreichii прилипает к клеткам пищеварительного эпителия и к слизи. Было показано, что ПКБ также ингибируют адгезию Helicobacter pylori (возбудителя рака желудка) к пищеварительным эпителиальным клеткам, а также вызванные ею повреждения. Эти свойства указывают на важную роль молочных P. freudenreichii в профилактике рака желудка. Такой новый пробиотический кисломолочный напиток может представлять интерес в качестве функциональной пищи для профилактики рака желудка и / или для потенциального терапевтического лечения.
Таким образом, важным аспектом применения молочных пропионовокислых бактерий P. freudenreichii ssp. является снижение риска и подавление развития опухолей в тканях человека.
Иммуномодулирующий эффект классических пропионовокислых бактерий

Диетические компоненты с иммуномодулирующими свойствами, в том числе бактерии, в последнее время привлекают значительное внимание. В частности, пробиотические бактерии с противовоспалительными способностями открывают новые перспективы в контексте растущего числа патологий, связанных с дисбиозом. Последнее связано с дисбалансом микробиоты кишечника, что связано с размножением провоспалительных бактерий за счет их противовоспалительных аналогов. Диета модулирует структуру, разнообразие и метаболизм кишечной микробиоты, что позволяет предположить, что эти заболевания можно облегчить с помощью диетического вмешательства. В этом контексте многочисленные исследования посвящены иммунологическому статусу бактерий, употребляемых в пищу или в качестве пробиотической добавки. Основной мотивацией является то, что манипулирование кишечной микробиотой с помощью пищевых бактерий предлагает многообещающий подход к профилактике и / или лечению патологий, связанных с дисбиозом. Молочные пропионибактерии образуют богатую группу видов бактерий с различными полезными, технологическими и полезными для здоровья свойствами, такими как синтез витамина B12, биосинтез бифидогенного соединения, такого как DHNA, или синтез ароматических соединений в сыре. Отличительной особенностью вида P. freudenreichii являются общие противовоспалительные свойства его штаммов - потребляемый в качестве пробиотика, Propionibacterium freudenreichii проявляет противовоспалительные свойства, опосредованные поверхностными белками, которые индуцируют IL-10 (Ил-10) в лейкоцитах [31].
Экспериментальные и клинические испытания препаратов на основе ПКБ показали иммуномодулирующую, антивирусную активность в медицинских исследованиях, что связывают с активацией моноцитмакрофаговой системы, индукцией синтеза интерферона и активацией киллерных клеток.
Модуляция иммунной системы молочными пропионовокислыми бактериями производится различными путями, которые в последнее время изучаются все более подробно. Так, было установлено, что иммуномодулирующий эффект P. freudenreichii связан с химическим составом клеточной стенки бактерий, в частности с особыми молекулами, выступающими на ее поверхности. В подтверждение этому в зарубежной научной литературе не так давно были опубликованы данные, показывающие, что именно поверхностные белки пробиотического штамма P. freudenreichii (идентифицированы методами протеомики) обеспечивают иммуномодулирующий эффект, который проявляется в противо-воспалительном действии. Позднее, с помощью мульти-штаммового исследования была проведена идентификация белков, определяющих противовоспалительные свойства Propionibacterium freudenreichii. Исследование продемонстрировало природное биоразнообразие видов пропионовокислых бактерий P. freudenreichii относительно механизмов проявления их иммуномодулирующих свойств, что может привести к разработке новых пробиотических продуктов для использования в целевых группах населения с дисбактериозом.
Противовоспалительные механизмы.
Считается, что 1,4-Дигидрокси-2-нафтойная кислота (DHNA), ростовый бифидогенный стимулятор или РБС (речь о нем ниже) из Propionibacterium freudenreichii, оказывает благоприятное действие в качестве пребиотика. В исследованиях на мышах было установлено, что DHNA ослабляет декстран сульфат натрия индуцированный колит путем модуляции бактериальной флоры и самонаведения лимфоцитов. В итоге, P. freudenreichii посредством DHNA уменьшает Ил-1β, Ил-6 и ФНО-α и увеличивает Ил-10, а также восстанавливает количество бифидобактерий и лактобацилл. Также, несмотря на то, что основным метаболитом ПКБ при брожении является пропионат, медицинское исследование показало, что пациенты демонстрируют увеличение концентрации бутирата стула после лечения с помощью РБС пропионовокислых бактерий (повышение уровня бутирата наблюдалось и у животных), который модифицировал кишечную микробиоту. Все это в совокупности выражается в эффективном противовоспалительном действии иммуномодулирующих пробиотических бактерий на колит (см. доп. пропионат; бутират).
Отдельно отметим, что экзополисахариды (ЭПС), синтезируемые propionibacteria выступают в роли факторов, способствующих адгезии полезных микроорганизмов на стенках кишечника, чем обеспечивают максимальную эффективность пробиотического воздествия на организм хозяина, а также обеспечивают колонизационную резистентность, которая представляет собой совокупность факторов местного иммунитета и антагонистических свойств нормальной микрофлоры организма, предотвращающих колонизацию слизистых оболочек патогенными микроорганизмами.
Стоит также отметить, что Propionibacterium freudenreichii способна превращать молочную кислоту в ацетат (соли уксусной кислоты) и пропионат (соли и эфиры пропионовой кислоты, как правило, пропионат натрия), которые обладают иммуномодулирующими свойствами - защищают организм от патогенов, восстанавливают кишечную микрофлору, снижают уровень стресса.
Стимуляция роста бифидобактерий
 Стоит особо отметить бифидогенный эффект пропионовокислых бактерий, т.к. основным преимуществом молочной propionibacteria в модуляции кишечной микробиоты является их способность стимулировать рост бифидобактерий, которые являются доминирующей микрофлорой ЖКТ человека, и чьи пробиотические свойства не вызывают сомнений и подтверждены многочисленными исследованиями.
Стоит особо отметить бифидогенный эффект пропионовокислых бактерий, т.к. основным преимуществом молочной propionibacteria в модуляции кишечной микробиоты является их способность стимулировать рост бифидобактерий, которые являются доминирующей микрофлорой ЖКТ человека, и чьи пробиотические свойства не вызывают сомнений и подтверждены многочисленными исследованиями.
Было показано, что пропионовокислые бактерии (ПКБ) выводят из организма и генерируют определенные метаболиты, способствуя тем самым росту различных штаммов бифидобактерий. Молочные пропионовокислые бактерии являются продуцентами особых ростовых бифидогенных стимуляторов (РБС) или англ. bifidogenic growth stimulator (BGS).
Так, например, синтезируемые классическими Propionibacterium freudenreichii 1,4-дигидрокси-2-нафтойная кислота (DHNA → (HO)2C10H5CO2H) и 2-амино-3-карбокси-1,4-нафтохинон (ACNQ), для бифидобактерий являются активными стимуляторами роста. Установлено, что ACNQ и DHNA составляют более 70% от общего содержания РБС. В отличие от пребиотиков углеводной природы, бифидогенный эффект которых связан со стимуляцией роста пробиотических микроорганизмов путем обогащения питательной среды источником углерода, ACNQ стимулирует рост бифидобактерий как акцептор электронов при восстановлении кофермента NAD+ (Nicotineamide Adenine Dinucleotide - кофермент, присутствующий во всех живых клетках, катализирует окислительно-восстановительные реакции). Восстановленный NAD+ считают ответственным за способность ПКБ стимулировать рост бифидобактерий посредством DHNA и ACNQ.

Ранее французские ученые Руссель Эдмон Даниель, Легран Шарль Габриель (Laboratoires Standa, 1996) при разработке диетической композиции для улучшения биологического равновесия флоры кишечного тракта установили, что пероральное введение пропионовокислых бактерий благоприятствует развитию флоры бифидобактерий; этот эффект быстрый, наблюдаемый с первой недели, и устойчивый, по крайней мере, в течение недели после прекращения введения пропионовокислых бактерий. Подтверждено, что эти промоторные эффекты возникают отчасти вследствие влияния пропионата. Однако оказывается, что пропионат не является единственным ответственным за эти эффекты. Пропионовая кислота также оказывает стимулирующее влияние на метаболическую активность бифидобактерий, в частности В. longum. В заключение отмечается, что промоторный эффект пропионовокислых бактерий в отношении роста бифидобактерий не связан ни с их внутриклеточным содержимым, ни со стенками. Ответственные соединения локализованы главным образом во внеклеточной среде. Пропионат соответствует одному из этих соединений.
Было показано, что при совместном культивировании (Propionibacterium и Bifidobacterium), экзополисахариды пропионовокислых бактерий также обеспечивают для бифидобактерий ростстимулирующий эффект и внешнюю защиту. Пропионовые бактерии, присутствуя в кишечнике здоровых взрослых в количестве не менее 5 lоg10 КОЕ/г фекалий, обладают достаточно высокими адгезивными свойствами, что позволяет им хорошо крепиться на клетках кишечника, создавая защитный барьер, а также стимулируют рост бифидобактерий в толстом кишечнике и помогают в лечении бактериальных дисбактериозов.
Имеются указания, что оральное назначение пропионибактерий в количестве 1010 КОЕ/г на протяжении 14 дней сопровождалось заметным увеличением содержания в толстой кишке как пропионибактерий, так и бифидобактерий. Пропионовокислые бактерии составляют незначительную часть от общей микрофлоры в кишечном тракте здорового человека (0.001%); однако, ежедневная пероральная профилактика в течение недели приводит к значительному увеличению их содержания (до 106 КОЕ/г). Этого количества вполне достаточно для проявления благоприятного воздействия на кишечник, экологии и физиологии хозяина. При этом эффект ПКБ в качестве стимулятора роста полезных бактерий достигается и без колонизации и адгезии в желудочно-кишечном тракте.
В заключение раздела резюмируем, что ПКБ стимулируют рост не только бифидобактерий, но и, как было установлено, способствуют увеличению ряда лактобацилл и кишечного бутирата (наряду с синтезом пропионата и ацетата), являясь, таким образом, уникальной бактерией - пребиотиком.
Лечение воспалительных заболеваний кишечника

Воспалительные заболевания кишечника (ВЗК) – язвенный колит и болезнь Крона – заболевания желудочно-кишечного тракта при которых возникает воспаление слизистой оболочки кишки. При язвенном колите поражается только толстая кишка, при болезни Крона - любой отдел пищеварительного тракта (от ротовой полости до прямой кишки), но наиболее часто тонкая и толстая кишка. К сожалению, причины развития воспалительных заболеваний кишечника до сих пор окончательно не установлены. Неизвестный фактор вызывает сбой в иммунной системе организма, который приводит к воспалению слизистой оболочки кишечника, в результате чего повреждается и стенка кишки.
В настоящее время считается, что воспалительные заболевания кишечника реализуются при взаимодействии 3 основных факторов:
- генетической предрасположенности;
- характера питания – преобладания рафинированных продуктов, фаст-фуда и др.;
- нарушение состава кишечной микрофлоры (микробиоты).
В проведенных исследованиях сообщалось, что синтезируемая пропионовокислыми бактериями P. freudenreichii 1,4-дигидрокси-2-нафтойная кислота или DHNA препятствовала инфильтрации лимфоцитов за счет снижения особого белка MAdCAM-1 в модели DSS-индуцированного колита мышей, и что потребление молочной сыворотки с культурой P. freudenreichii оказалось эффективным при лечении язвенного колита в экспериментальном исследовании человека. Все это также достигается во многом благодаря описанным выше противовоспалительным механизмам.
Дополнительно см.:
- Польза пропионибактерий из сыра в отношении колита
- Эффективность пропионовокислых бактерий в лечении колита
Также, в настоящее время считается, что гомеостаз слизистой оболочки толстой кишки зависит от равновесия между «полезными» и «вредными» бактериями. К защитным или «полезным» относят Lactobacillus sp., Bifidobacterium sp., непатогенные штаммы Escherichia coli, Saccharomyces boulardii, Bacteroides fragilis, Faecalibacterium prausnitzii, Roseburia spp. и др. К «вредным» Bacteroides vulgatus, Bacteroides thetaiotamicron, Enterococcus faecalis, адгезивные-инвазивные штаммы E. Coli, Klebsiella pneumoniae, Bifidobacterium animalis, Fusobacterium varium, все виды кишечной Helicobacter, сегментированные филаментозные бактерии, Ruminococcus gnavus, Proteus mirabilis и т. д. В отношении каждого из указанных видов показана их повреждающая или протективная активность на модели грызунов или при ВЗК человека. (см. Sartor RB. Key questions to guide a better understanding of hostcommensal microbiota interactions in intestinal infl ammation. // Mucosal Immunol. 2011 Mar; 4 (2):127–32.). В итоге имеем:
- P. freudenreichii были эффективны в лечении язвенного колита легкой и средней степени тяжести в экспериментальном исследовании на людях.
- P. freudenreichii ускоряют заживление у крыс при колите.
- Компонент P. freudenreichii улучшали выживаемость и уменьшал повреждение у мышей с колитом, ослабляя воспаление толстой кишки за счет балансирования кишечной бактериальной флоры и подавления лимфоцитарной инфильтрации.
Молочная сыворотка с ПКБ. Проведенные исследования показали, что молочная сыворотка, содержащая культуру классических (молочных) пропионовокислых бактерий Propionibacterium freudenreichii, обладает противовоспалительным эффектом, устраняющим индуцированные декстран-сульфатом натрия (dextran sulfate sodium, DSS) или тринитробензенсульфонатом (trinitrobenzenesulfonate, TNBS) колиты.
Показано, что указанная питательная среда с пропионовокислыми бактериями P. freudenreichii, стимулирует рост собственных бифидобактерий в кишечнике человека, а не рост других микроорганизмов. У здоровых добровольцев, при приеме внутрь молочной сыворотки, содержащей культуру P. freudenreichii, значительно возрастало население бифидобактерий по отношению к общему количеству фекальных бактерий. В TNBS-индуцированной модели колита у крыс, молочная сыворотка (с культурой P. freudenreichii) значительно ускоряла ход излечения колита (дозозависимым образом), во многом благодаря синтезу пропионовой кислоты (воздействию пропионата натрия).
Результаты исследований показали, что молочная сыворотка, содержащая культуру классических (молочных) пропионовокислых бактерий P. freudenreichii, может стать эффективным средством в терапии воспалительных заболеваний кишечника, а пропионовая кислота - одним из активных веществ в сывороточной основе указанного средства. Прим. ред.: В настоящее время в ООО "Пропионикс" представлены биоконцентраты с ПКБ на сывороточной основе (доп. см.: Применение ПКБ для образования пропионовой кислоты (пропионатов) в ободочной кишке).
Модуляция активности кишечных ферментов

Профилактика ферментативной недостаточности
1. Повышение уровня β-галактозидазы
Профилактика непереносимости лактозы - помощь в усвоении молока
Пропионовокислые бактерии являются эффективными в лечении непереносимости лактозы за счет повышения β-галактозидазной активности в кишечнике, т.е. синтеза фермента β-галактозидазы. Так, известно отсутствие толерантности к лактозе (не усваивается) у многих людей, особенно старшего возраста, что не позволяет им потреблять натуральное молоко. Но пропионовокислые бактерии: Propionibacterium acidipropionici и Propionibacterium freudenreichii, обладающие высокой активностью β-галактозидазы при ±370С, способствуют усвоению молока.

Прим.: Чтобы расщеплять молочный сахар (лактозу), в организме вырабатывается специальный фермент лактаза (lactase или LCT), относящийся к семейству β-галактозидаз. Этот фермент в слизистой оболочке кишечника катализирует расщепление дисахарида лактозы (lactose) на составляющие его моносахариды: галактозу (galactose) и глюкозу (glucose). Нарушение его синтеза является причиной непереносимости лактозы. Непереносимость лактозы (или гиполактазия) - патологическое состояние, вызванное снижением уровня (отсутствием или недостаточностью) лактазы — фермента, необходимого для правильного переваривания лактозы. (Фермент β-галактозидаза также может расщеплять фукозиды и арабинозиды, но с гораздо меньшей эффективностью, чем лактозу - прим. ред.).
Врожденное или приобретенное снижение активности лактазы, фермента пристеночного пищеварения, расщепляющего молочный сахар – лактозу, а также непереносимость молочных белков встречаются достаточно часто. Но наибольшую значимость данная проблема имеет для детей раннего возраста, так как молоко для них – основной источник питания. Снижение активности лактазы может быть обусловлено генетически и передаваться по наследству, а также в большей степени определяется этнической принадлежностью человека. Так, в Швеции и Дании непереносимостью лактозы страдают 3% детей, в Англии - 20-30%, в России лактазной недостаточностью страдают порядка 18-20% детей (Melvin B. Lactose Intolerance in Infants, Children, and Adolescents // Pediatrics. - 2010. - Vol. 118, N 3, Sept. - P. 1279-1286.). В основе лечения лактазной недостаточности лежит исключение из рациона питания молочных продуктов, содержащих лактозу, что может вызвать дисбактериоз кишечника. В связи с этим необходима обязательная терапия, направленная на коррекцию микробного состава кишечника. Для этого повсеместно применяются пробиотические препараты, активно участвующие в восстановлении нормофлоры организма.
2. Профилактика белковой и жировой диспепсии
Ферментативный гидролиз оставшихся в кишечнике белков и липидов
Пропионовокислые бактерии P. freudenreichii выделяют из своих клеток такие экзоферменты, как пептидазы и липазы, которые важны для гидролиза белков и липидов, сохранившихся в кишечнике.
- Пептидазы - протеолитические ферменты, катализирующие отщепление от белков и пептидов аминокислот. Т.е. основные продукты гидролиза - аминокислоты. Участвуют в пищеварении у животных и человека.
- Липаза – водорастворимый фермент, который катализирует гидролиз нерастворимых эстеров (липидных субстратов), помогая переваривать, растворять и фракционировать жиры. Липаза вместе с желчью расщепляет жиры и жирные кислоты, а также жирорастворимые витамины А, D, E, K, обращая их в энергию теплопродукции.
Данная способность ПКБ, наряду с их позитивным влиянием на процессы кишечного всасывания в тонком кишечнике, очень полезна при профилактики и комплексном лечении гнилостной (белковой) или жировой диспепсии. Патология возникает из-за нарушений в питании, но часто проявляется по причине недостаточного количества пищеварительных ферментов в организме.
В результате при гнилостной диспепсии, например, в процессе гниения белков в толстом кишечнике образуются токсические вещества, которые всасываясь в кровь вызывают интоксикацию организма. А к примеру, при жировой диспепсии (по причине дефицита панкреатической липазы и (или) секреции желчи), происходят боли в животе, усиливаясь при приеме пищи, а также развивается метеоризм и обнаруживаются остатки пищи в кале.
При отсутствии лечения диспепсии патология переходит в хроническую форму и может спровоцировать серьезные функциональные нарушения организма, например дисбаланс обмена веществ – смертельное явление для больных сахарным диабетом, и др. Поэтому разгрузка ЖКТ и восстановление баланса кишечной микрофлоры является важным методом лечения, а ПКБ в данном случае - становятся просто незаменимыми помощниками.
Стрессоустойчивость пропионовокислых бактерий
 Устойчивость пропионовокислых бактерий к агрессивным средам. Например, отмечено, что исследованные штаммы пропионовокислых бактерий Propionibacterium freudenreichii subsp freudereichii АС-2500, P. cyclohexanicum Kusano АС-2259, P. freudenreichii subsp. shemanii AC–2503, P. cyclohexa-nicum Kusano АС-2260, P. freudenreichii subsp. shermanii – КМ 186. проявили устойчивость к высокой концентрации желчи (40%), NaCl (6%) и развивались в среде с низким рН (4,5), сохраняли жизнеспособность при pH (2,0), что указывает на высокую выживаемость данных культур в неблагоприятных условиях ЖКТ человека. Здесь важдную роль играют т.н. белки кислотного шока.
Устойчивость пропионовокислых бактерий к агрессивным средам. Например, отмечено, что исследованные штаммы пропионовокислых бактерий Propionibacterium freudenreichii subsp freudereichii АС-2500, P. cyclohexanicum Kusano АС-2259, P. freudenreichii subsp. shemanii AC–2503, P. cyclohexa-nicum Kusano АС-2260, P. freudenreichii subsp. shermanii – КМ 186. проявили устойчивость к высокой концентрации желчи (40%), NaCl (6%) и развивались в среде с низким рН (4,5), сохраняли жизнеспособность при pH (2,0), что указывает на высокую выживаемость данных культур в неблагоприятных условиях ЖКТ человека. Здесь важдную роль играют т.н. белки кислотного шока.
Кислотоустойчивость пропионовокислых бактерий
Дополнение: Кислая среда желудка и наличие желчи в тонкой кишке представляют собой два биологических барьера, которые пробиотики должны выдержать, чтобы оказать свое полезное действие; считается, что для оценки возможности практического использования полезных свойств конкретного пробиотического микроорганизма необходимо изучить выживание данного штамма при рН 2,5 и 0,3% желчных солей, чтобы смоделировать контакт микроорганизма с желудочным соком и желчью.

Рис. 1. Потеря жизнеспособности пропионибактерий в подкисленном cMRS-бульоне (рН 2,5) через 3 и 24 часа. Средние значения ± стандартное отклонение. Значения с разными буквами значительно различаются (односторонний анализ ANOVA и тест Дункана) (P <0,05) [69].
Такое моделирование было произведено. На рис. 1 показана потеря жизнеспособности пропионибактерий при рН 2,5 через 3 и 24 ч (это представляло собой время прохождения через желудок и длительный кислотный стресс соответственно). Через 3 часа штаммы не показали какой-либо потери жизнеспособности (V.L.), что подтверждает их значительную устойчивость к кислотным условиям. Через 24 ч P. freudenreichii subsp. shermanii, P. jensenii, P. thoenii показали снижение жизнеспособности на 30%. Важное примечание: Неполная выживаемость ПКБ (как в ЖКТ, так и в ферментируемом молоке, при автолизе), как ни парадоксально, имеет свои преимущества, т.к. это связано с кишечным всасыванием полезных эндометаболитов ПКБ (в тонком кишечнике транзит пищи занимает около 7-8 часов).
 Устойчивость к антибиотикам. Пропионовые бактерии устойчивы* к пенициллину, хлортетра-циклину, хлормицетину, стрептомицину, эритромицину, грамицидину С и полимиксину, поэтому возможно совместное применение указанных антибиотиков и пропионовых бактерий при лечении некоторых заболеваний как людей, так и животных. Кроме того, исследования показали, что молочные P. freudenreichii обладают внутренней устойчивостью к нескольким антибиотикам, включая аминогликозиды, хинолоны I и II-го поколения, оксациллин, метронидазол, канамицин и левофлоксацин. Эта устойчивость не кодируется бактериальными плазмидами, и не было зарегистрировано никакой передаваемой устойчивости к антибиотикам.
Устойчивость к антибиотикам. Пропионовые бактерии устойчивы* к пенициллину, хлортетра-циклину, хлормицетину, стрептомицину, эритромицину, грамицидину С и полимиксину, поэтому возможно совместное применение указанных антибиотиков и пропионовых бактерий при лечении некоторых заболеваний как людей, так и животных. Кроме того, исследования показали, что молочные P. freudenreichii обладают внутренней устойчивостью к нескольким антибиотикам, включая аминогликозиды, хинолоны I и II-го поколения, оксациллин, метронидазол, канамицин и левофлоксацин. Эта устойчивость не кодируется бактериальными плазмидами, и не было зарегистрировано никакой передаваемой устойчивости к антибиотикам.
*Прим. ред.: Широкое распространение устойчивости (или резистентности) к антибиотикам представляет собой растущую угрозу, и патогенные микроорганизмы могут приобрести эту устойчивость путем конъюгации (от лат. conjugatio - соединение - однонаправленный перенос части генетического материала (плазмид или бактериальной хромосомы) при непосредственном контакте двух бактериальных клеток). Т.е. гены, кодирующие устойчивость к антибиотикам, могут быть размещены на хромосоме или на плазмидах непатогенных бактерий. Микроорганизмы, несущие эти гены на плазмидах, могут переносить гены к патогенам в кишечнике. Однако исследование показало [70], что гены устойчивости к антибиотикам пропионовокислых бактерий осуществляются на хромосоме, а потому устойчивость к антибиотикам не является проблемой для этих пробиотических микроорганизмов.
Таким образом, уникальные полезные свойства пропионовых бактерий и полное отсутствие у них токсичности позволило рекомендовать их в качестве лечебно-профилактических препаратов для защиты и восстановления микрофлоры (в т.ч. для снижения генотоксического воздействия на организм) во время и после проведения антибактериальной терапии (а также лучевой, гормональной и химиотерапии).
См. доп: Устойчивость к антибиотикам бактерий рода Propionibacterium
См. также: Устойчивость ПКБ к поваренной соли
Экзополисахариды (ЭПС). Как уже отмечалось выше, при совместном культивировании экзополисахариды, синтезируемые пропионовокислыми бактериями, стимулируют рост бифидобактерий, а также обеспечивают гибкую адаптацию бактерий и предохраняют отдельные клетки и популяцию в целом от неблагоприятных факторов внешней среды (изменение температуры, низкие значения рН, замораживание и обезвоживание). Экзополисахариды также защищают клетки от фагоцитов, амебной инфекции и фагов, препятствуют денатурации белков. Исследования показывают важную роль ЭПС в регуляции работы иммунной системы.
Полифосфаты, гликоген и трегалоза
Интересным свойством ПКБ является образование ими в большом количестве такого полимера, как гликоген, свойственный клеткам живого организма. Накопление и гидролиз гликогена в клетках – также физиологическая особенность ПКБ. По сути – это запасание глюкозы для переживания голодания и стрессов в ЖКТ. При этом использование экзогенного гликогена не происходит. У прокариот биосинтез гликогена - редкое явление.
В отличие от других бактерий, которые используют только АТФ, штаммы P. freudenreichii аккумулируют также неорганические полифосфаты в качестве энергетического резерва. Полифосфаты образуются из пирофосфата и АТФ под действием полифосфаткиназы, которая катализирует перенос терминальной фосфатной группы от АТФ на пирофосфат или полифосфат. Пирофосфат является одним из продуктов пропионовокислого брожения. Полифосфаты как энергетический резерв позволяет ПКБ долгое время выживать в условиях субстратного голодания, например, в стационарной фазе роста, осуществляя основной (поддерживающий) обмен.
 Трегалоза – специфический нередуцирующий дисахарид, который служит запасным источником углерода и энергии, а также осмопротектором (compatible solute) и антистрессовым фактором клеток ПКБ. В клетках P. freudenreichii синтез трегалозы осуществляется двумя альтернативными путями: из глюкозы и пирувата или из мальтозы. Синтез и аккумуляция трегалозы усиливаются в стационарной фазе и при окислительном, кислотном и осмотическом стрессах.
Трегалоза – специфический нередуцирующий дисахарид, который служит запасным источником углерода и энергии, а также осмопротектором (compatible solute) и антистрессовым фактором клеток ПКБ. В клетках P. freudenreichii синтез трегалозы осуществляется двумя альтернативными путями: из глюкозы и пирувата или из мальтозы. Синтез и аккумуляция трегалозы усиливаются в стационарной фазе и при окислительном, кислотном и осмотическом стрессах.
Полифосфаты, гликоген и трегалоза способствуют, с одной стороны, выживанию клеток ПКБ в условиях агрессивной среды ЖКТ, а с другой, поступают в ЖКТ в результате автолиза этих клеток.
|
Изображение модели комплекса бактериальных шаперонов GroES и GroEL (вид сверху).
|
Представители разных видов классических пропионвокислых бактерий выделяют в среду белковые соединения - реактивирующие факторы, способные повышать или воссстанавливать жизнеспособность клеток, подвергнутых стрессорному воздействию (ультрафиолет, этанол, ионы тяжелых металлов, прогревание). Предполагается, что механихм реактивации клеток связан с индукцией у них синтеза антистрессорных белков, особенно шаперонов, после взаимодействия реактивирующих факторов со специальными рецепторами цитоплазматической мембраны [58].
Прим. ред.: Шаперон (англ. chaperones) - класс белка, главная функция которого состоит в восстановлении правильной нативной третичной или четвертичной структуры белка, а также образование и диссоциация белковых комплексов. Многие виды шаперонов являются белком теплового шока (англ. heat shock proteins, НSP), то есть белком, экспрессия которого начинается в ответ на рост температуры, а также воздействие других экстремальных факторов.
Бактериальная адаптация и промышленное производство P. freudenreichii в сухой форме методом распылительной сушки.
Все что мы здесь рассматриваем можно назвать бактериальной адаптацией. БА является хорошо известным защитным механизмом и может использоваться для улучшения устойчивости бактерий к технологическим стрессам. Тем не менее, выбор типа бактериальной адаптации должен учитывать производственные ограничения. В заключение данного подраздела предлагаем ознакомиться с материлами одного исследования, где для получения сухой формы P. freudenreichii методом распылительной сушки исследователи объединили (I) модуляцию состава ростовой среды, (II) тепловую адаптацию и (III) осмоадаптацию, чтобы повысить толерантность P. freudenreichii к технологическим нагрузкам, включая термические и окислительные ограничения. Результаты весьма впечатляют. См.: Адаптация ПКБ к распылительной сушке.
Снижение уровня холестерина
 Доказано, что молочные пропионовокислые бактерии способны воздействовать на липидный (жировой) обмен организма, путем снижения уровня холестерина в крови. Холестериндеградирующая активность данных пробиотических микроорганизмов выше чем у бифидобактерий [32]. Таким образом, пропионовокислые пропионовые бактерии и кисломолочные продукты на заквасках ПКБ могут эффективно использоваться в профилактике и лечении атеросклероза, а также при разработке новых бактериальных концентратов [36] на основе пробиотических микроорганизмов (ПКБ отдельно или в сочетании) с наиболее выраженными холестерин-метаболизирующими свойствами.
Доказано, что молочные пропионовокислые бактерии способны воздействовать на липидный (жировой) обмен организма, путем снижения уровня холестерина в крови. Холестериндеградирующая активность данных пробиотических микроорганизмов выше чем у бифидобактерий [32]. Таким образом, пропионовокислые пропионовые бактерии и кисломолочные продукты на заквасках ПКБ могут эффективно использоваться в профилактике и лечении атеросклероза, а также при разработке новых бактериальных концентратов [36] на основе пробиотических микроорганизмов (ПКБ отдельно или в сочетании) с наиболее выраженными холестерин-метаболизирующими свойствами.
Следует отметить, что синтезируемые ПКБ пропионовая кислота и ее производные влияют на синтез холестерина. В частности отмечено, что образующийся в толстом кишечнике при анаэробной ферментации углеводов и жиров пропионат способен снижать уровень холестерина в сыворотке крови за счет ингибирования синтеза этого стерола гепатоцитами. Помимо печени важным источником эндогенного холестерина являются клетки ворсинок кишечника. Бактерии, присутствующие в пищеварительном тракте, оказывают существенное влияние на скорость обновления кишечного эпителия, и, следовательно, также регулируют образование эндогенного холестерина. Содержание холестерина в сыворотке крови зависит от выраженности его абсорбции из кишечника.
См. также: Холестеринметаболизирующая активность бактерий
Было установлено, что пропионовокислые бактерии трансформируют и разрушают животный холестерин в процессе наращивания биомассы. Холестерин входит в состав мембран не только животных клеток, но и микроорганизмов. ПКБ, проявляя протеолитическую и липолитическую активность, способны модифицировать синтез регуляторных соединений и деградировать холестерин в процессе культивирования. Полученные результаты открывают широкие перспективы для создания продуктов функционального питания для профилактики и лечения атеросклероза.
Пропионовокислые бактерии в профилактике ожирения и диабета
 Ожирение может вызывать хронические нарушения обмена веществ, такие как диабет 2 типа, гиперлипидемию и неалкогольные жировые заболевания печени. Целью этого исследования было изучить противодействие ожирению и противодиабетическое действие молочной бактерии P. freudenreichii MJ2, выделенной из сырого молока, с использованием клеток 3T3-L1 и мышей с ожирением, индуцированных высокожировой диетой (HFD). Накопление липидов и уровни экспрессии генов, связанных с метаболизмом липидов, таких как преадипоцитарный ген (Pref-1), адипогенные гены (PPARγ и C/EBPα) и липогенные гены (FAS, SCD-1 и ACC), значительно снижались в адипоцитах, обработанных термически убитым P. freudenreichii MJ2 (hkMJ2). Живые P. freudenreichii MJ2 (MJ2), hkMJ2 и Lactobacillus plantarum (LP) снижали прирост массы тела у мышей с ожирением, вызванным HFD, по сравнению с модельной группой. Вес печени и эпидидимальной белой жировой ткани (eWAT) в группах, получавших MJ2, hkMJ2 и LP, был значительно ниже, чем в модельной группе. Уровни экспрессии генов и белков, связанных с адипогенезом и липогенезом, значительно снизились, а липолиз (HSL и ATGL) увеличился в группах, получавших MJ2, hkMJ2 и LP. Уровни экспрессии генов, связанных с β-окислением жирных кислот (CPT-1α и ACOX1), увеличивались в группах, получавших MJ2, hkMJ2 и LP. Кроме того, уровни глюкозы в крови и инсулина натощак в группах, получавших MJ2 и hkMJ2, снизились по сравнению с таковыми в модельной группе. P. freudenreichii MJ2 улучшает резистентность к инсулину при ожирении. В заключение, как MJ2, так и hkMJ2 облегчают ожирение и метаболический синдром.
Ожирение может вызывать хронические нарушения обмена веществ, такие как диабет 2 типа, гиперлипидемию и неалкогольные жировые заболевания печени. Целью этого исследования было изучить противодействие ожирению и противодиабетическое действие молочной бактерии P. freudenreichii MJ2, выделенной из сырого молока, с использованием клеток 3T3-L1 и мышей с ожирением, индуцированных высокожировой диетой (HFD). Накопление липидов и уровни экспрессии генов, связанных с метаболизмом липидов, таких как преадипоцитарный ген (Pref-1), адипогенные гены (PPARγ и C/EBPα) и липогенные гены (FAS, SCD-1 и ACC), значительно снижались в адипоцитах, обработанных термически убитым P. freudenreichii MJ2 (hkMJ2). Живые P. freudenreichii MJ2 (MJ2), hkMJ2 и Lactobacillus plantarum (LP) снижали прирост массы тела у мышей с ожирением, вызванным HFD, по сравнению с модельной группой. Вес печени и эпидидимальной белой жировой ткани (eWAT) в группах, получавших MJ2, hkMJ2 и LP, был значительно ниже, чем в модельной группе. Уровни экспрессии генов и белков, связанных с адипогенезом и липогенезом, значительно снизились, а липолиз (HSL и ATGL) увеличился в группах, получавших MJ2, hkMJ2 и LP. Уровни экспрессии генов, связанных с β-окислением жирных кислот (CPT-1α и ACOX1), увеличивались в группах, получавших MJ2, hkMJ2 и LP. Кроме того, уровни глюкозы в крови и инсулина натощак в группах, получавших MJ2 и hkMJ2, снизились по сравнению с таковыми в модельной группе. P. freudenreichii MJ2 улучшает резистентность к инсулину при ожирении. В заключение, как MJ2, так и hkMJ2 облегчают ожирение и метаболический синдром.
Подробнее см.: Пропионовокислые бактерии против ожирения и диабета
Молочные пропионовокислые бактерии предотвращают остеопороз

Исследование показало, что пероральное введение живых или термически убитых молочных пропионовокислых бактерий (ПКБ) предотвращает индуцированную остеопорозом потерю костной массы. В частности, поверхностные белки, выделенные из штамма Propionibacterium freudenreichii MJ2, способствовали дифференцировке и минерализации остеобластов. Остеобласты - это молодые клетки костной ткани (диаметром 15-20 мкм), которые синтезируют межклеточное вещество - матрикс. Таким образом, ПКБ усиливают дифференцировку и минерализацию остеобластов, и эффективным компонентом ПКБ являются их поверхностные белки, которые влияют на определенные гены.
Антимикробные свойства пропионовокислых бактерий
 Пропионовокислые бактерии выделяют бактериоцины, анти-грибковые соединения и противовирусные вещества и поэтому используются в т.ч. в качестве пищевых консервантов. Установлено положительное влияние классической молочной propionibacteria на кишечную микрофлору (снижение патогенных микроорганизмов и стимулирование полезных) за счет синтеза короткоцепочечных жирных кислот (SCFAs), экзополисахаридов (ЭПС) и веществ с антибиотической активностью (бактерицидного и бактериостатического действия).
Пропионовокислые бактерии выделяют бактериоцины, анти-грибковые соединения и противовирусные вещества и поэтому используются в т.ч. в качестве пищевых консервантов. Установлено положительное влияние классической молочной propionibacteria на кишечную микрофлору (снижение патогенных микроорганизмов и стимулирование полезных) за счет синтеза короткоцепочечных жирных кислот (SCFAs), экзополисахаридов (ЭПС) и веществ с антибиотической активностью (бактерицидного и бактериостатического действия).
Как известно, пропионовокислые бактерии расщепляют углеводы по гликолитическому пути до пировиноградной кислоты, которая подвергается дальнейшим превращениям с образованием конечных продуктов энергетического обмена - пропионовой кислоты, уксусной кислоты и СО2. Данные кислоты не поддерживают гнилостные бактерии, клостридии, дрожжи и плесневые грибы, а CO2 участвует в снижении окислительно-восстановительного потенциала и токсичен для ряда аэробных гнилостных бактерий. Некоторые из штаммов производят бактериоцины, которые подавляют рост и выживаемость клеток таких бактерий, как Listeria monocytogenes (возбудителя смертельно опасного заболевания человека — листериоза) и Yersinia enterocolitica (возбудителя иерсиниоза - острой антропозоонозной кишечной инфекции), а также, в отличие от лактобактерий, подавляют рост грам-отрицательных бактерий, дрожжей и плесневых грибов.
Также установлено, что пропионовокислые бактерии ингибируют патогенную бактерию E.coli O157:H7 - энтерогеморрагический штамм кишечной палочки, частую причину пищевых отравлений, в т.ч. с летальным исходом; зона ингибирования составляла от 1,97 см (P. freudenreichii) до 3,83 см (P. thoenii). Также, были изучены ингибирующие свойства пропионибактерий в отношении других патогенов, таких как E.coli ATCC 11229 и Shigella sonnei Mu: 57 (вызывает шигеллёз), и было установлено, что патогены в целом ингибируются.
Также, в эксперименте на индюшатах было установлено, что Propionibacterium freudenreichii (подвиды freudenreichii и shermanii) были эффективны в снижении подвижности Сальмонеллы (Salmonella), размножения, адгезии и инвазии в эпителиальные клетки птиц (P <0,05). Propionibacterium freudenreichii обладали высокой выживаемостью при низких значениях рН (2,5) и в присутствии солей желчи (0,3%). Propionibacterium freudenreichii не обладали гемолитической активностью и обеспечивали безопасность для применения у индеек.
Синтезируемые ПКБ уксусная и пропионовая кислоты (ацетат и пропионат) в отношении патогенных микроорганизмов (клебсиелл, протеев, псевдоманад, грамотрицательных энтеробактерий и др.) обладают выраженным антимикробным эффектом, и создают благоприятную pH-среду для развития дружественной симбионтной микрофлоры.
 Отношение количества пропионовой кислоты к уксусной обычно равно 2:1, но оно меняется в широких пределах и может достигать 5:1. Наиболее быстрый рост при температуре от 30 °С до 37 °С и pH 7,0. ПКБ ферментируют аланин, серин, аспарагин и глицин с образованием углекислого газа, аммиака, уксусной и пропионовой кислоты. Прим.: Пропионовая кислота (CH3CH2COOH) - это короткоцепочечная жирная кислота, которая синтезируется ПКБ. Она транспортируется в печень и включается в процесс глюконеогенеза и синтеза биогенных аминов, улучшает микроциркуляцию в слизистой кишечника и поддерживает в ней метаболические процессы, блокирует прикрепление к колоноцитам условно-патогенной микрофлоры. Пропионовая кислота участвует в синтезе гормонов, нейромедиаторов (серотонина, эндорфинов). Пропионовая кислота обладает известной антибактериальной и противогрибковой активностью (прим.: в пищевом производстве предотвращает микробиологическую порчу продуктов), препятствует колонизации кишечника патогенными микроорганизмами, например, шигелламии, сальмонеллами, и в тоже время служит промотором роста анаэробных бактерий нормальной микрофлоры ЖКТ. Иными словами, пропионовокислые бактерии и их метаболиты служат важным фактором в поддержании баланса микробной экосистемы.
Отношение количества пропионовой кислоты к уксусной обычно равно 2:1, но оно меняется в широких пределах и может достигать 5:1. Наиболее быстрый рост при температуре от 30 °С до 37 °С и pH 7,0. ПКБ ферментируют аланин, серин, аспарагин и глицин с образованием углекислого газа, аммиака, уксусной и пропионовой кислоты. Прим.: Пропионовая кислота (CH3CH2COOH) - это короткоцепочечная жирная кислота, которая синтезируется ПКБ. Она транспортируется в печень и включается в процесс глюконеогенеза и синтеза биогенных аминов, улучшает микроциркуляцию в слизистой кишечника и поддерживает в ней метаболические процессы, блокирует прикрепление к колоноцитам условно-патогенной микрофлоры. Пропионовая кислота участвует в синтезе гормонов, нейромедиаторов (серотонина, эндорфинов). Пропионовая кислота обладает известной антибактериальной и противогрибковой активностью (прим.: в пищевом производстве предотвращает микробиологическую порчу продуктов), препятствует колонизации кишечника патогенными микроорганизмами, например, шигелламии, сальмонеллами, и в тоже время служит промотором роста анаэробных бактерий нормальной микрофлоры ЖКТ. Иными словами, пропионовокислые бактерии и их метаболиты служат важным фактором в поддержании баланса микробной экосистемы.
Стоит отметить, что совместное культивирование молочных пропионовокислых бактерий Propionibacterium freudenreichii и бифидобактрий Вifidobacterium longum резко усиливает антагонистический эффект в отношении таких тест-микроорганизмов, как Micrococcus luteus, Pseudomonas sp. и Staphylococcus aureus за счет увеличенного накопления в питательной среде органических кислот.
См. доп: Антагонистическая активность пропионовокислых бактерий
В Индии в 2004 г. большую выборку детей родителей - добровольцев, больных желудочно-кишечными заболеваниями, подвергли масштабному эксперименту по использованию в питании йогуртов, в состав которых вводили штамм P. freudenreichii ssp. shermanii (обозначение штамма отсутствует); контролем служили готовые йогурты на основе L. acidophilus. Эксперимент выявил высокое излечивающее действие пропионибактерий в отношении диареи. Некоторые штаммы P. freudenreichii были эффективны в клинических экспериментах по борьбе с инфекцией, вызванной метициллин-резистентным Staphylococcus aureus (MRSA), которому свойственна множественная лекарственная устойчивость. Хотя в отношении Helicobacter pilori, инфицирующей эпителиальные клетки желудка, прямой подавляющий эффект штамма P. freudenreichii Js не выявлен, он вызывал заметное снижение адгезии патогена на эпителии при высокой концентрации живых клеток пропионовокислой бактерии (109/мл) и задерживал деструкцию цитоплазматических мембран эпителиальных клеток. Таким образом, многим штаммам P. freudenreichii свойственны выраженные пробиотические эффекты.
ПРОПИОНОВОКИСЛЫЕ БАКТЕРИИ В ПРОМЫШЛЕННОСТИ. ПРИМЕНЕНИЕ В ПИЩЕВОЙ ОТРАСЛИ.
Пропионовокислые бактерии в промышленности.
Пропионовокислые бактерии синтезируют ряд ценных метаболитов широкого промышленного использования. Биомасса ПКБ является источником витаминов группы B, включая B12, трегалозы (trehalose) и многочисленных бактериоцинов. Эти бактерии также способны синтезировать органические кислоты, такие как пропионовая кислота и уксусная кислота. ПКБ относятся к микроорганизмам, разрешенным и предлагаемым к использованию в пищевой промышленности (см. Постановление Главного государственного санитарного врача РФ от 14 ноября 2001 г. N 36 "О введении в действие санитарных правил"). Стоит отметить, что за рубежом, например в США, пропионовокислым бактериям присвоен статус GRAS - Generally recognized as safe («в целом признаны безопасными»), который обозначает, что химикат или вещество освобождены от федеральных требований (США) к допускам, применяемым к пищевым добавкам, лекарствам и косметическим средствам. Из-за статуса GRAS и своих лечебных характеристик, ПКБ и их метаболиты (пропионовая кислота, витамин B12 и трегалоза) широко используются в косметической, фармацевтической, пищевой и других отраслях промышленности, в т.ч. в качестве добавок в корма для скота.
Пропионовокислые бактерии в пищевой отрасли.

Эффективным решением проблемы, связанной с дефицитом эссенциальных и физиологически важных нутрицевтиков в питании современного человека является разработка и производство пищевых продуктов и биологически активных добавок к пище с применением пробиотических микроорганизмов, в частности, пропионовокислых бактерий, способных синтезировать множество важных и крайне полезных для организма веществ, подавлять патогенную микрофлору, выводить токсины, способствовать процессам ферментативного переваривания и усвоения пищи.
В процессе своего метаболизма пропионовокислые бактерии продуцируют такие важные для человека вещества, как витамин В12 и фолиевую кислоту, аминокислоты, ферменты, короткоцепочечные жирные кислоты, значительно улучшают кишечное всасывание кальция и железа. Одним из основных продуктов жизнедеятельности ПКБ является пропионовая кислота, которая наряду с пропионатами и пропиоцинами способна подавлять рост патогенных микроорганизмов.
Закваски пропионовокислых бактерий нашли свое применение при производстве кисломолочных биопродуктов, которые рекомендованы к употреблению для всех категорий населения, особенно детям, подросткам, людям со сниженным иммунитетом, с высоким риском развития раковых опухолей. Эти кисломолочные биопродукты поддерживают иммунитет во время тяжёлых заболеваний, после приёма антибиотиков или химиотерапии, в период эпидемий, побеждают хроническую усталость и предотвращают развитие кишечных инфекций. Разработанная технология применения заквасок ПКБ в молочной промышленности позволила получить кисломолочные биопродукты с высокими потребительскими свойствами без использования консервантов, загустителей и стабилизаторов.
 В домашних условиях уникальную кисломолочную продукцию изготавливают на домашней закваске пропионовокислых бактерий "Пропионикс", либо на других бактериальных концетратах на основе ПКБ, которыми являются жидкие пробиотики, чье описание представлено в соответствующих разделах данного сайта. Ферментация молока производится без добавления (!) молочнокислых бактерий, за счет чего гарантируется самое наивысшее качество готового пробиотического продукта с полифункциональными свойствами.
В домашних условиях уникальную кисломолочную продукцию изготавливают на домашней закваске пропионовокислых бактерий "Пропионикс", либо на других бактериальных концетратах на основе ПКБ, которыми являются жидкие пробиотики, чье описание представлено в соответствующих разделах данного сайта. Ферментация молока производится без добавления (!) молочнокислых бактерий, за счет чего гарантируется самое наивысшее качество готового пробиотического продукта с полифункциональными свойствами.
См. подробнее: Пробиотические домашние закваски
 Пропионовокислые бактерии представляют собой естественную микробиоту, спонтанно обитаемую в твердых сырах. В настоящее время они применяются в сыроделии в качестве стартовых культур в технологиях управляемого созревания высококачественных сыров. Именно ПКБ обусловливают вкус и аромат готового сыра, обогащая его при этом целым спектром биологически активных веществ. Это подтверждают данные хроматографического анализа. Помимо этого, ПКБ за счет своих бактерицидных свойств выступают как натуральные биоконсерванты молочного белка – казеина.
Пропионовокислые бактерии представляют собой естественную микробиоту, спонтанно обитаемую в твердых сырах. В настоящее время они применяются в сыроделии в качестве стартовых культур в технологиях управляемого созревания высококачественных сыров. Именно ПКБ обусловливают вкус и аромат готового сыра, обогащая его при этом целым спектром биологически активных веществ. Это подтверждают данные хроматографического анализа. Помимо этого, ПКБ за счет своих бактерицидных свойств выступают как натуральные биоконсерванты молочного белка – казеина.
 Также были проведены исследования по применению пропионовокислых бактерий и в хлебопечении. Установлено, что внесение концентратов ПКБ в рецептуру хлебобулочных изделий позволяет предотвратить микробиологическую порчу хлеба. На сегодняшний день разработаны закваски, содержащие в своем составе пропионовокислые бактерии, благодаря которым выпекаемый хлеб обладает устойчивостью к «картофельной болезни», имеет пролонгированные сроки сохранения качества, обогащен витамином В12, и при этом характеризуется высокими органолептическими показателями.
Также были проведены исследования по применению пропионовокислых бактерий и в хлебопечении. Установлено, что внесение концентратов ПКБ в рецептуру хлебобулочных изделий позволяет предотвратить микробиологическую порчу хлеба. На сегодняшний день разработаны закваски, содержащие в своем составе пропионовокислые бактерии, благодаря которым выпекаемый хлеб обладает устойчивостью к «картофельной болезни», имеет пролонгированные сроки сохранения качества, обогащен витамином В12, и при этом характеризуется высокими органолептическими показателями.
 Следует отметить, что квасной напиток, произведенный по технологии с использованием пропионовокислых бактерий, обладает более высокими потребительскими свойствами, как за счет продуцирования ПКБ полезных веществ, так и за счет устранения специфического привкуса сыворотки, увеличения сроков хранения продукта, а также сокращения процесса брожения квасного сусла.
Следует отметить, что квасной напиток, произведенный по технологии с использованием пропионовокислых бактерий, обладает более высокими потребительскими свойствами, как за счет продуцирования ПКБ полезных веществ, так и за счет устранения специфического привкуса сыворотки, увеличения сроков хранения продукта, а также сокращения процесса брожения квасного сусла.
При производстве улучшенного кваса использовались: концентрат пропионовокислых бактерий штамм Propionibacterium freudenreichii subsp. Shermanii AC-2503 или концентрат пропионовокислых бактерий, штамм Propionibacterium freudenreichii subsp. freudenreichii AC-2500 или концентрат пропионовых бактерий, штамм Р. Shermanii freudenreichii subsp. Shermanii.
См.: Способ производства квасного напитка с ПКБ
 Цикл исследовательских работ с использованием пропионовокислых бактерий проведен и с мясными продуктами. Выявлена высокая биохимическая активность пропионовокислых бактерий в мясном субстрате, позволяющая ускорить биотехнологические процессы при посоле и созревании мяса. Предложены рациональные параметры технологического процесса производства вареных, варено-копченых, сырокопченых колбас и натуральных мясных консервов из парного мяса с использованием концентратов пропионовокислых бактерий в роли стартовых культур, а также с использованием культуральной жидкости ПКБ.
Цикл исследовательских работ с использованием пропионовокислых бактерий проведен и с мясными продуктами. Выявлена высокая биохимическая активность пропионовокислых бактерий в мясном субстрате, позволяющая ускорить биотехнологические процессы при посоле и созревании мяса. Предложены рациональные параметры технологического процесса производства вареных, варено-копченых, сырокопченых колбас и натуральных мясных консервов из парного мяса с использованием концентратов пропионовокислых бактерий в роли стартовых культур, а также с использованием культуральной жидкости ПКБ.
Например, как известно, наиболее качественные и полезные консервы получаются на основе парного мяса. Однако в связи с таким явлением, как бомбаж при стерилизации, его запрещено использовать для изготовления консервов. Результаты, полученные при применении биотехнологического метода обработки такого мяса с использованием ПКБ, позволили решить данную проблему, при этом добившись более высокого качества консервов и их вкусоароматических свойств.
СИНТЕЗ ВИТАМИНОВ, АМИНОКИСЛОТ И ИНЫХ ПРАКТИЧЕСКИ ВАЖНЫХ ВЕЩЕСТВ ПРОПИОНОВЫМИ БАКТЕРИЯМИ
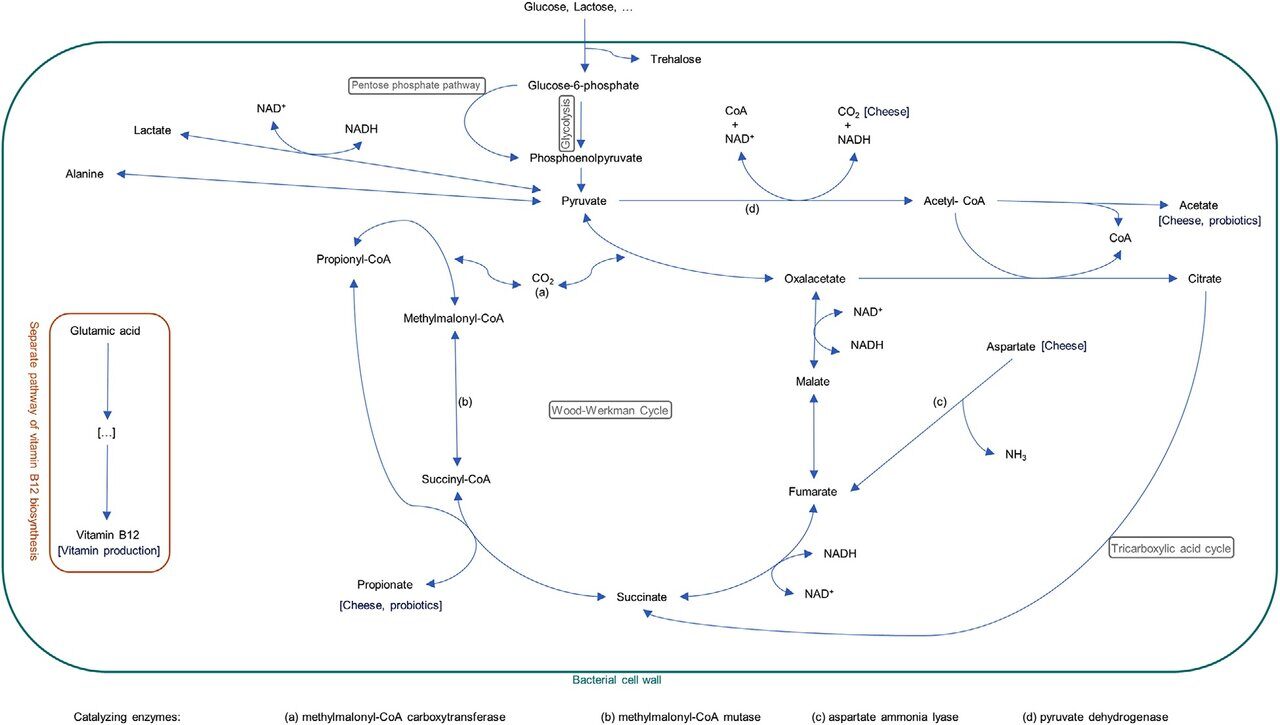
Классические пропионовокислые бактерии относятся к наиполезнейшим микроорганизмам и способны к синтезу практически важных веществ: большинства аминокислот, значительного количества жирных кислот, экзополисахаридов, липидов и фосфолипидов, полифосфатов, конъюгированной линоленовой кислоты, ферментов, витамина К2, а также витаминов группы В: В1 (тиамин), В2 (рибофлавин), В3 (витамин PP, ниацин, никотиновая кислота), В5 (пантотеновая кислота), В6 (пиридоксин), фолиевая кислота (В9), большое количество (сверхсинтез) витамина В12. Биосинтез витамина B12 происходит параллельно накоплению биомассы ПКБ.
Пропионовые бактерии могут также за счет ассимиляции азота (NH4)2SO4 синтезировать все аминокислоты. Биосинтез белков пропионовыми бактериями сопровождается созданием пула из 15 аминокислот: цистина, гистидина, аргинина, аспартата, глутаминовой кислоты, глицина, серина, треонина, β-аланина, тирозина, валина, метионина, пролина, фенилаланина и лейцина. Известно, что бактерии содержат пептидазы, при участии которых обеспечивают себя незаменимыми аминокислотами и осуществляют реакции трансаминирования, могут расти на любой из 20 аминокислот, внесенной в среду в качестве единственного (!) источника азота.
Коротко о витамине В12
Последние исследования врачей и микробиологов подтвердили, что наиболее эффективно использование витаминов в коферментной (связанной с белком микробной клетки) легкоусвояемой форме. Так как лидерами в таком биосинтезе витамина В12 являются пропионовокислые бактерии, то прием пробиотиков и ферментированных продуктов, содержащих данные микроорганизмы, может эффективно устранять витамин-В12-дефицитные состояния.
Следует отметить, что витамин В12 локализуется внутри клеток ПКБ, для которых он является эндометаболитом, поэтому в пространство желудочно-кишечного тракта витамин поступает только в результате аутолиза (или лизиса) клеток. Некротизированные клетки подвергаются деструкции (лизису). Если разложение осуществляется при помощи лизосомных ферментов и свободных радикалов погибших клеток, процесс называется аутолизом. Этот процесс достаточно выражен. Аутолиз микроорганизмов происходит при старении микробной культуры или повреждении клеток различными агентами. Здесь стоит напомнить также о фазе отмирания - периоде в развитии культуры, когда выросшие клетки, исчерпавшие питательные вещества среды (концентрация клеток сильно выросла), теряют активность, отмирают и автолизируются. Например, часть клеток при завершении брожения в молоке отмирает (брожение останавливают охлаждением к/м продукта) и/или гибнет при прохождении агрессивной среды желудка (для ПКБ - небольшая часть, но достаточная для снабжения организма человека дополнительным легкоусвояемым витамином В12).
Здоровые люди получают витамин В12 с пищей (печень, мясо). В зеленой части растений не обнаружен витамин В12, поэтому его нет в хлебе, пшеничной муке, рисе, фруктах, овощах. Водоросли и др. планктонсодержат значительные количества кобаламинов (Schneider, 1987). Люди не утилизируют корриноиды, образованные микроорганизмами кишечника. Различные причины (негенетические) дефицита витамина в организме перечислены в таблице 1, из которой видно, что их достаточно много и устранению способствует введение витамина В12 перорально или внутримышечно.
Таблица 1. Причины возникновения дефицита витамина В12 у людей (Stroinski, 1987)
|
Фаза адсорбции
|
Причина дефицита
|
|
События в желудке
|
Дефицит в пище, нарушенное выделение витамина из пищи, дефицит ВФ (внутреннего фактора):
|
|
События в кишечнике
|
Конкуренция с паразитами: бактериальный гипер-рост, глисты (солитеры), панкреатическая недостаточность
|
|
Адсорбция в тонком кишечнике
|
Хирургические заболевания, операции, отсутствие двухвалентных ионов, нефункционирующая транспортная система через мембраны, лекарства, дефицит внутриклеточных связывающих белков
|
Описан ряд заболеваний, являющихся в конечном счете следствием отсутствия или дефицита в организме человека витамина В12 и среди них мегалобластическая анемия, которая проявляется в изменении морфологии крови, нарушении функций крови и клеток костного мозга. Терапевтический витамин В12 используют в микрограммовых количествах при лечении пернициозной анемии, при питательном дефиците и периферических невритах и невралгиях. Поскольку витамин не токсичен, он широко используется во многих типах неизлечиваемых хронических недугах, как артриты и псориазы. Его также используют как средство, снимающее утомление, другие недомогания и боли.
Если бы пропионовокислые бактерии использовались только для получения витамина В12, их можно было бы уже отнести к наиполезнейшим микроорганизмам, но их применение шире (Воробьева Л. И., 1995 г.)
Применение пропионовокислых бактерий для образования пропионовой кислоты и/или пропионатов в ободочной кишке
 |
|
Ободочная кишка (выделена зелёным цветом и обозначена номером 23), является продолжением слепой кишки (26). После ободочной кишки идёт прямая кишка (29).
|
Ранее было показано (Эдмон Даниель (FR), Легран Шарль Габриель (FR) - Laboratoires Standa, 2000 г.), что пищевая композиция, содержащая пропионовокислые бактерии, выбранные на основании их незначительной приверженности автолизу, а также их устойчивости к воздействию желчных солей, способна оказывать значительное стимулирующее и усиливающее воздействие на синтез пропионовой кислоты и/или пропионата, а в случае необходимости, уксусной кислоты и/или ацетата на уровне ободочной кишки путем бактериальной анаэробной ферментации при условии регулярного перорального введения в организм значительного количества микрофлоры указанных пробиотных бактерий
В течение нескольких лет диетологи рекомендуют своим пациентам питание, богатое волокнами, что, по их мнению, может оказывать благотворное физиологическое и метаболическое воздействие на состояние здоровья. Известно, что пищевые волокна устойчивы к расщеплению ферментами в тонком кишечнике, их расщепление и усвоение происходит только на уровне ободочной кишки, т.е. на конечном участке кишечника. Упомянутое выше благотворное воздействие может, таким образом, оказываться лишь при том условии, что упомянутые расщепление и усвоение будут максимально полными на данном предпоследнем участке (т.е. на участке ободочной кишки).
Кроме того, было установлено, что указанные выше биологические реакции происходят в результате анаэробной ферментации пищевых волокон под воздействием микроорганизмов в ободочной кишке. В результате данной ферментации образуются короткоцепочечные жирные кислоты, водород, двуокись углерода и биомасса.
Среди различных микроорганизмов, которые могли бы использоваться в целях стимуляции синтеза пропионовой кислоты и/или пропионата, молочнокислые бактерии мало удовлетворяют данным требованиям, так как из-за присущих им свойств они в основном вызывают образование молочной кислоты и лишь очень незначительное количество уксусной кислоты, при этом не образуется пропионовой и масляной кислоты.
Вместе с тем пропионовокислые бактерии обладают способностью образовывать в большом количестве пропионовую кислоту и уксусную кислоту, то есть обе жирные кислоты с короткой цепочкой, необходимые для питания тканей, в процентном отношении, например, 2/3 пропионовой кислоты и 1/3 уксусной кислоты. Упомянутые выше бактерии присутствуют в человеческой пище на протяжении веков, в частности, в твердых сортах сыра; более того, они лучше, чем молочнокислые бактерии, подходят для условий ободочной кишки, в условиях полной анаэробности; кроме того, эти бактерии более устойчивы к технологическому воздействию, чем молочнокислые бактерии и бифидобактерии.
Принимаемые перорально пропионовокислые бактерии могут играть двойную роль, а именно технологическую на первом этапе, участвуя в ферментативном расщеплении пищи, и функциональную на втором этапе, так как после употребления вовнутрь они попадают в ободочную кишку, где играют указанную выше пробиотную роль, в частности оптимизируют синтез пропионовой кислоты и усвоение минералов, в частности, кальция, железа, цинка, и магния на уровне ободочной кишки. Прим.: в части, касающейся синтеза пропионовой кислоты, которая влияет на увеличение секреции лептина (т.н. "гормона насыщения"), ПКБ могут рассматриваться как безопасное средство для снижения риска набора лишнего веса (ожирения)... См. по ссылке:
Имеются также сведения о важной роли пропионовой кислоты в сохранении здоровья костной системы. ПКБ к тому же принадлежат к штаммам, способным хорошо удерживаться на колоноцитах и обладают противогрибковыми свойствами на уровне ободочной кишки и, в частности, способны замедлить развитие патогенных грибков типа Candida.
АНТИОКСИДАНТНЫЕ СВОЙСТВА МОЛОЧНЫХ ПРОПИОНОВОКИСЛЫХ БАКТЕРИЙ
| Антиоксиданты (антиокислители) - вещества, которые ингибируют окисление; любое из многочисленных химических веществ, в том числе естественные продукты деятельности организма и питательные вещества, поступающие с пищей, которые могут нейтрализовать окислительное действие свободных радикалов и других веществ. Рассматриваются преимущественно в контексте окисления органических соединений. |
Установлено, что активизированные культуры пропионовокислых бактерий в больших количествах образуют антиоксидантные гемсодержащие ферменты (СОД, каталазу и пероксидазу), обезвреживающие активные формы кислорода (супероксидный радикал О2-, гидроксильные радикалы ОН*, перекись водорода и др. свободные радикалы), а также производят другие вещества, способные предотвращать губительное влияние на организм человека химических мутагенов, ультрафиолетовых лучей и радиации, что открывает широкие перспективы для их практического применения в качестве антиоксидантов. Следует сказать и о том, что недавно впервые прямым вольтамперометрическим методом для соответствующих штаммов пропионовокислых бактерий были установлены выраженные антиоксидантные свойства.
Антиокислительные свойства P. freudenreichii
Бактерия обладает редуцированным дыханием с использованием молекулярного кислорода, флавиновыми оксидазами (не связанными с ферментами ЭЦТ - экстрацеллюлярных токсинов, нейтрализующими молекулярный кислород), а также ферментами, участвующими в антиоксидантной защите (ФАОЗ) собственных клеток: супероксиддисмутазой, каталазой и пероксидазой.
Следовательно, молекулярный кислород клетками ПКБ поглощается и нейтрализуется. Но обладают ли культуры ПКБ антиоксидантной активностью в целом, что существенно для их пробиотических и защитных эффектов? Важно, чтобы культура ПКБ (клетки или культуральная жидкость с выделенными ими веществами) снижала окислительный потенциал или концентрацию активного кислорода в среде.
Активные формы кислорода (АФК) в умеренных концентрациях в живом организме выступают в роли медиаторов процессов передачи клеточного сигнала. Но при повышенном содержании они оказывают повреждающее действие на биополимеры (белки, ДНК, липиды мембран). В ходе эволюции в организме человека возникла защитная антиоксидантная система, которая базируется на комплексе ферментов: оксидазы, супероксиддисмутазы, каталазы, а также витаминов А, С. Е и некоторых коферментов. Разнообразие этих соединений обусловлено различиями в механизме их окисления-восстановления.
Важно отметить, что для эффективного поддержания оптимальной концентрации АФК в организме человека, особенно при оксидативном стрессе (для защиты его естественной иммунной системы), целесообразно использовать внешние антиоксиданты. Среди источников экзогенных антиоксидантов могут быть и культуры пропионовокислых бактерий, общую антиоксидантную активность которых ранее не исследовали.
Методом катодной вольтамперометрии установили, что разные штаммы P. freudenreichii обладают выраженными антиоксидантными свойствами. При этом культуры разных штаммов имели разную антиоксидантную активность в соответствии с величиной кинетического критерия. Катодная вольтамперометрия – это процесс электровосстановления кислорода, ЭВ О2. В его основе лежит модельная реакция ЭВ О2, протекающая на индикаторном электроде по механизму, аналогичному восстановлению кислорода в тканях и клетках организмов, способных к кислородному дыханию. В данном способе регистрируется одноэлектронное восстановление кислорода с образованием активных кислородных радикалов (О2.-).
Следовательно, исследованные штаммы пропионовокислых бактерий вида P. freudenreichii могут рассматриваться в качестве эффективно действующих биоантиоксидантов. Это имеет научное и практическое значение, поскольку расширяет возможности использования ПКБ, например, для обогащения биологически активными веществами пищевых продуктов, в частности, при создании функциональных продуктов питания, где ПКБ действуют как пробиотики. Требуется дальнейшее изучение обнаруженных эффектов.

Антиоксидантные ферменты. Известно, что очень важную роль в организме играют антиокислительные ферменты, подобные тем, что в большом количестве синтезируют пропионовокислые бактерии. Так, супероксиддисмутаза (СОД) и каталаза, образуют антиоксидантную пару, которая борется со свободными радикалами кислорода, не давая им возможности запустить процессы цепного окисления, а глутатионпероксидаза обезвреживает липидные перекиси. СОД, каталаза и пероксидаза ПКБ также образуют эффективную антиоксидантную систему.
Как известно, Цитохромы (гемопротеины) присутствующие во всех клетках организмов, катализируют окислительно-восстановительные реакции. Процесс окисления с помощью цитохромов дает побочный продукт, который в некоторых концентрациях становится губительным для всего живого — перекись водорода (Н2О2). Перекись водорода является сильным окислителем и в крови может вызывать гемолиз эритроцитов. Фермент каталаза катализирует разложение перекиси водорода на воду и кислород. Пероксидазы выполняют при этом защитные функции - окисляют органические вещества перекисью водорода, в результате чего образуется молекула воды (Н2О). Таким образом, супероксидные радикалы с помощью антиоксидантных ферментов превращаются в безвредный кислород. (Прим.: Следует подчеркнуть, что когда концентрация перекиси водорода становится незначительной, каталаза начинает катализировать реакцию окисления перекисью водорода спиртов, формальдегидов и нитратов).

Наличие антиоксидантной активности пропионовокислых бактерий позволяет расширить спектр применения данных микроорганизмов в здравоохранении и для обогащения ими физиологически функциональных продуктов питания. Также антиоксидантные свойства ПКБ нашли свое применение в косметологии и эстетической медицине:
См. доп: Применение пропионовокислых бактерий в косметологии
(Прим.: антиоксидантные свойства ПКБ напрямую связаны с таким понятием как "антимутагенность")
АНТИМУТАГЕННАЯ АКТИВНОСТЬ МОЛОЧНЫХ ПРОПИОНОВОКИСЛЫХ БАКТЕРИЙ
До недавнего времени основным источником антимутагенов - агентов, снижающих уровень индуцированных и спонтанных мутаций, служили растения, некоторые морские животные и соединения, полученные химическим путем. Оказалось, что клетки многих исследованных пропионовокислых бактерий, а также выделяемые ими в среду внеклеточные соединения белковой природы, более чем на 90% снижают вредное воздействие веществ, вызывающих внутригенные мутации, которые могут приводить к образованию поврежденных белков, либо к полному отсутствию их синтеза. Обнаружение антимутагенных свойств пропионовых бактерий открывает новые области их применения как профилактических средств, которые могут быть использованы в пищевых продуктах для людей и в кормах для животных.

Прим.: Процесс возникновения мутаций получил название мутагенеза. Мутагенез — внесение изменений в нуклеотидную последовательность ДНК (мутаций). Различают естественный (спонтанный) и искусственный (индуцированный) мутагенез. См.: Мутагены, антимутагены и пробиотики.
В настоящее время природные защитные механизмы не всегда справляются с резким ростом мутационного воздействия, поэтому поиск и наличие антимутагенов должны рассматриваться как элементы компенсационного подхода к защите генофонда. Таким образом, возможность снижения количества мутагенов с помощью бактерий, в первую очередь, населяющих желудочно-кишечный тракт, как антимутагенный фактор имеет большое значение в улучшении здоровья человека.
Антимутагенные свойста пропионовокислых бактерий трудно переоценить, принимая во внимание наличие различного количества мутагенов в пищевых продуктах. Известно, что серосодержащие аминокислоты стимулируют рост, а бактерии устойчивы к высоким концентрациям H2S в среде. Из серосодержащих аминокислот пептидов молока бактерии образуют диметилсульфид, обладающий антимутагенным действием (Прим.: сероводород H2S - продукт распада серосодержащих аминокислот – цистеина, метионина). Метаболиты ПКБ также повышают активность ферментных систем, участвующих в детоксикации поступающих в клетку веществ, оказывая влияние на окислительно-восстановительный потенциал организма, эти процессы приводят к снижению количества мутаций.
Пропионовые бактерии, как и все живые существа, в первую очередь бактерии, постоянно и длительно подвергаются воздействию внешних и внутренних мутагенов. К обычным внешним естественным источникам мутагенов относятся радиация, газ радон, космические лучи, К40 и другие радионуклиды (ядра нестабильных изотопов, самопроизвольно распадающихся в земной коре). Поскольку в естественных условиях микроорганизмы (а также растения и животные) постоянно подвергаются действию мутагенов, у них сформировались эндогенный и экзогенный защитные механизмы: у всех живых существ образуются молекулы, способные к осуществлению антимутагенеза.
П од антимутагенезом понимают снижение частоты спонтанной и индуцированной мутации. Антимутагены регулируют скорость спонтанных мутаций, стабилизируют мутационный процесс. Антимутагены повышают активность ферментативных систем, участвующих в детоксификации поступающих в клетку веществ, влияют на окислительно-восстановительный потенциал организма. Все эти процессы приводят к снижению мутаций. Экстракты клеток классических пропионовокислых бактерий проявляют высокую эффективность антимутагенного действия. Кроме супероксиддисмутазы в клеточном экстракте пропионовых бактерий присутствуют и другие белки (видимо, ферменты) с антимутагенной активностью. На сегодняшний день можно твердо сказать, что обследованные штаммы обладают антимутагенностью против Азида натрия (NaN3), 4-нитрохинолин-1-оксида, Нитрозогуанидина (НГ) и что антимутагены имеют пептидную (белковую) природу. Было однозначно показано, что кожные и классические молочные пропионовокислые бактерии выделяют в среду вещества с антимутагенной активностью. Десмутагенное действие культуральной жидкости проявлялось при выращивании бактерий на среде с глюкозой, лактозой и лактатом. Установление факта атимутагенности культуральной жидкости и клеточного экстракта пропионовокислых бактерий открыло новые, ранее не известные у них свойства, обуславливающие защиту клетки от внешних и эндогенных мутагенов. Поэтому пропионовокислые бактерии могут стать источниками новых и ценных антимутагенов.
од антимутагенезом понимают снижение частоты спонтанной и индуцированной мутации. Антимутагены регулируют скорость спонтанных мутаций, стабилизируют мутационный процесс. Антимутагены повышают активность ферментативных систем, участвующих в детоксификации поступающих в клетку веществ, влияют на окислительно-восстановительный потенциал организма. Все эти процессы приводят к снижению мутаций. Экстракты клеток классических пропионовокислых бактерий проявляют высокую эффективность антимутагенного действия. Кроме супероксиддисмутазы в клеточном экстракте пропионовых бактерий присутствуют и другие белки (видимо, ферменты) с антимутагенной активностью. На сегодняшний день можно твердо сказать, что обследованные штаммы обладают антимутагенностью против Азида натрия (NaN3), 4-нитрохинолин-1-оксида, Нитрозогуанидина (НГ) и что антимутагены имеют пептидную (белковую) природу. Было однозначно показано, что кожные и классические молочные пропионовокислые бактерии выделяют в среду вещества с антимутагенной активностью. Десмутагенное действие культуральной жидкости проявлялось при выращивании бактерий на среде с глюкозой, лактозой и лактатом. Установление факта атимутагенности культуральной жидкости и клеточного экстракта пропионовокислых бактерий открыло новые, ранее не известные у них свойства, обуславливающие защиту клетки от внешних и эндогенных мутагенов. Поэтому пропионовокислые бактерии могут стать источниками новых и ценных антимутагенов.
Подробнее об антимутагенных свойствах ПКБ против 4НХО и МННГ см. по ссылке:
Антимутагенные свойства классических (молочных) пропионовокислых бактерий P. freudenreichii
Изучение антимутагенеза важно именно в отношении тех бактерий, которые используют при изготовлении пищи (в т.ч. биодобавок), кормов и кормовых добавок. Бактерии как источники антибиомутагенов или десмутагенов могут быть использованы для предобработки пищевых продуктов и кормов с целью нейтрализации мутагенных (канцерогенных) веществ, а также как пробиотики. Считается, что систематическое употребление пищевых антимутагенов и антиканцерогенов эффективно понижает риски развития генетических и онкозаболеваний, а защита от мутаций может быть полезной как в ранней, так и на поздней стадии развития рака. Пропионовокислые бактерии широко используют на практике: в сыроделии, производстве витамина В12, приготовлении ветеринарного препарата пропиовита, силосовании кормов. В настоящее время пропионовокислые бактерии применяются в инновационных биодобавках «Йодпропионикс», «Селенпропионикс», а также закваске прямого внесения «Пропионикс».
Новое о ПКБ по состоянию на 2021 г:
Обновленные данные, касающиеся таксономии, реклассификации, метаболизма и идентификации пропионовокислых бактерий
Случайный рис.: Сканирующие электронные микрофотографии P. freudenreichii CIRM-BIA-129
Пропионовокислые бактерии в пищевой промышленности: обновленная информация об основных признаках и методах обнаружения
Примечание редактора: Здесь изложены 3 первых раздела статьи из научного рецензируемого журнала "Всесторонние обзоры в области науки о питании и безопасности пищевых продуктов", посвященной обновленной информации об основных признаках и методах обнаружения пропионовокислых бактерий. Bücher C, Burtscher J, Domig KJ. Propionic acid bacteria in the food industry: An update on essential traits and detection methods. / Compr Rev Food Sci Food Saf. 2021 Sep;20(5):4299-4323
Резюме
Пропионовокислые бактерии (ПКБ) — это общий термин для группы бактерий, способных продуцировать пропионовую кислоту. В прошлом из-за этой общей черты и других фенотипических сходств генетически гетерогенные бактерии считались одним родом Propionibacterium. Представители этого рода варьировались от «молочных пропионибактерий», которые широко известны своей ролью в формировании глаз и вкуса при производстве сыра, до «кожных пропионибактерий», которые в первую очередь связаны с кожей человека. В 2016 году введение двух новых родов на основе генотипических данных способствовало четкому разделению кожных (Cutibacterium spp.) и молочных ПКБ (Propionibacterium spp., Acidipropionibacterium spp.). В свете этих таксономических изменений, но с особым акцентом на PAB молочных продуктов, в этом обзоре описывается современное состояние знаний о метаболических путях и других характеристиках, таких как устойчивость к антибиотикам и факторы вирулентности. Кроме того, подчеркнута актуальность молочных ПКБ для пищевой промышленности и производства сыра в частности. Кроме того, рассматриваются методы выращивания, обнаружения и подсчета с учетом текущей таксономии, а также возможностей рутинного применения.
1. ВВЕДЕНИЕ
Первое важное появление пропионовокислых бактерий (ПКБ) можно датировать 1878 годом, когда Фитц провел свою работу по биохимии ПКБ (Fitz, 1884; Stackebrandt et al., 2006). После этого исследования эту группу бактерий игнорировали до тех пор, пока примерно 25 лет спустя фон Фрейденрайх и Орла-Йенсен не исследовали пропионовокислое брожение. Эти авторы также были первыми, кто выделил чистые культуры из сыра Эмменталь (Hettinga & Reinbold, 1972b). На тот момент большая часть исследований была посвящена влиянию молочных ПКБ на производство сыра и вопросам таксономии (Hettinga & Reinbold, 1972b). Виртанен больше сосредоточил свое внимание на понимании химических механизмов пропионовокислого брожения, и в 1928 году Ван Нил выделил восемь видов, проанализировав более ранние работы и проведя собственные исследования (Hettinga & Reinbold, 1972b; Stackebrandt et al., 2006). Однако наибольший вклад в исследование ферментативной способности ПКБ внесли Вуд и Веркман, и даже сегодня метаболический путь восстановления пирувата до пропионата называют циклом Вуда-Веркмана (Hettinga & Reinbold, 1972b; Thierry et al., 2011). С тех пор появилось много новых сведений о ПКБ, а также об отдельных видах, и роды и виды неоднократно подвергались реструктуризации и реклассификации (Stackebrandt et al., 2006). Последняя реклассификация, на которой построена сегодняшняя таксономия, произошла в 2016 году (Scholz & Kilian, 2016).
2. ТАКСОНОМИЯ
ПКБ относятся к типу актинобактерий с высоким содержанием GC, составляющим примерно 57–70% генома. Семейство Propionibacteriaceae насчитывает 25 родов (Parte et al., 2020). Среди них три признаны ПКБ: Acidipropionibacterium spp., Cutibacterium spp. и Propionibacterium spp. (Deptula et al., 2017b; Patrick & McDowell, 2012; Turgay et al., 2020). Шольц и Килиан также предложили четвертый род, Pseudopropionibacterium, с двумя выделенными представителями, но, несмотря на публикацию статьи, это название считается нелегитимным, и два вида в настоящее время отнесены к роду Arachnia, а именно Arachnia propionica и Arachnia rubra (Parte et al., 2020; Scholz & Kilian, 2016). До действующей в настоящее время классификации ПКБ на три рода в 2016 году все ПКБ были отнесены к роду Propionibacterium (Scholz & Kilian, 2016). Когда первые пропионибактерии были выделены из сыра, молочных продуктов и крупного рогатого скота, появилось название «молочные пропионовокислые бактерии». Сегодня некоторых представителей родов Propionibacterium и Acidipropionibacterium называют «классическими» или «молочными» ПКБ, хотя не все представители встречаются в молочной среде. Виды, относящиеся к молочным ПКБ, идентифицированы как таковые в таблице 1, а значимость молочных ПКБ для пищевой промышленности описана более подробно в разделе 4. Род Cutibacterium долгое время считался Corynebacterium, пока в 1946 году не было доказано, что основным конечным продуктом его метаболизма является пропионовая кислота, что позволило отнести его к Propionibacterium. Впоследствии представителей этого рода часто называли «кожными пропионибактериями» из-за их связи с кожей человека (Patrick & McDowell, 2012).
Таблица 1. Реорганизация бывшего рода Propionibacterium (Parte et al. 2020)
|
Propionibacteriaceae
|
||
|
Propionibacterium spp.
|
Acidipropionibacterium spp.
|
Cutibacterium spp.
|
|
P. acidifaciens
|
A. acidipropionicia
|
C. acnes
|
|
P. australiense
|
A. damnosum
|
C. avidum
|
|
P. cyclohexanicumb
|
A. jenseniia
|
C. granulosum
|
|
P. freudenreichiia
|
A. microaerophilumb
|
C. modestum
|
|
P. ruminifibrarum
|
A. olivae
|
C. namnetense
|
|
A. thoeniia
|
||
|
A. virtanenii
|
||
Одним из аспектов, подчеркивающих важность дифференциации между пропионибактериями и ацидипропионибактериями, является состав клеточной стенки (т.е. эти роды имеют свои диагностические аминокислоты в составе пептидогликана - ред.). Роды Propionibacterium и Acidipropionibacterium здесь различаются, поскольку представители пропионибактерий содержат мезо-2,6-диаминопимелиновую кислоту, а для ацидипропионибактерий характерна LL-2,6-диаминопимелиновая кислота, за исключением Propionibacterium cyclohexanicum, которая не содержит ни того, ни другого (Patrick & McDowell, 2012; Turgay et al., 2020). Дифференциация кутибактерий (Cutibacterium) от двух других родов путем сравнения пептидогликанов вряд ли возможна. Фактически, наличие LL-2,6-диаминопимелиновой кислоты и C15 изо- и антеизокислот в качестве основных жирных кислот клеточных липидов, а также производство пропионовой кислоты являются основанием для отнесения бывших коринебактерий к пропионибактериям (Patrick & McDowell, 2012). Тем не менее, род Cutibacterium четко отделяется от родов Propionibacterium и Acidipropionibacterium, поскольку имеет на 5-10 % меньшее содержание GC в геномной ДНК (Scholz & Kilian, 2016).
Обзор всех видов, отнесенных в настоящее время к трем различным родам, можно найти в Таблице 1 (статус по состоянию на июль 2021 г.). На видовом уровне наиболее яркими представителями, а также типовыми видами трех родов ПКБ являются Acidipropionibacterium acidipropionici, Cutibacterium Acnes и Propionibacterium freudenreichii (Scholz & Kilian, 2016). A. acidipropionici известен своим благотворным воздействием на рубец крупного рогатого скота и способностью производить пропионовую кислоту (Patrick & McDowell, 2012; Scholz & Kilian, 2016). C. acnes часто выделяют из кожи человека и связывают с заболеванием кожи, обыкновенными угрями, поскольку они колонизируют волосяные фолликулы у больных пациентов. Колонизация является одним из четырех процессов при формировании угревых высыпаний, но точный ход событий при формировании обыкновенных угрей, а также влияние других факторов, влияющих на заболевание, до сих пор остаются неясными (Williams et al., 2012). P. freudenreichii прежде всего известен своей ролью в производстве сыра Эмменталь и др. сыров швейцарского типа. Кроме того, этот организм связан с промышленным производством витамина B12 и штамм-зависимыми пробиотическими и противовоспалительными свойствами благодаря выработке нескольких полезных метаболитов, а также бифидогенных факторов (Altieri, 2016; Rabah et al., 2017; Rabah et al., 2018, Thierry et al., 2015; Turgay et al., 2020).
Раньше P. freudenreichii делили на подвиды freudenreichii и shermanii на основании их способности к ферментации лактозы и активности нитрат-редуктазы (Dalmasso et al., 2011). Однако, поскольку гены, кодирующие ферментацию лактозы, окружены интегразами и транспозазами, что указывает на приобретение их путем горизонтального переноса генов, а гены, кодирующие деградацию нитратов, нарушены сдвигом рамки считывания у штаммов P. freudenreichii, не способных деградировать нитраты, такое разделение больше не актуально (Dalmasso et al., 2011; Deptula et al., 2017b). Кроме того, при тестировании на этот признак авторы сообщали об ингибирующем эффекте нитрата калия даже в низких дозах на нитратредуктазоположительные организмы (Freitas et al., 2015b).
3. МЕТАБОЛИЗМ
ПКБ – грамположительные, неподвижные, неспорообразующие бактерии. Они выглядят как короткие палочки, хотя их морфология может различаться в зависимости от условий и фазы роста. Поэтому их еще называют плеоморфными (Fröhlich-Wyder et al., 2017; Turgay et al., 2020). Они также могут иметь кокковидный, раздвоенный, разветвленный или нитевидный вид и могут встречаться одиночными, парными или в виде коротких цепочек с V- или Y-конфигурацией; однако возможно также образование комков, напоминающих «китайские иероглифы» (Patrick & McDowell, 2012; Turgay et al., 2020). Кутибактерии кажутся длиннее и тоньше молочных видов, особенно на ранних стадиях роста (Patrick & McDowell, 2012). ПКБ являются анаэробными и аэротолерантными, и оптимальный рост происходит при pH 6–7, с минимальным pH 4,6 и максимальным 8,5 (Fröhlich-Wyder et al., 2017). Молочные ПКБ проявляют чувствительность к соли, но степень нарушения роста ПКБ зависит от штамма, а также от pH (Fröhlich-Wyder et al., 2017). Например, в культуре на основе сыворотки рост и выработка пропионовой кислоты были полностью подавлены добавлением 6% NaCl, что соответствует aw 0,955 (Bisig et al., 2019). Более того, в сырах швейцарского типа концентрация соли также влияет на содержание летучих жирных кислот, а также на выработку CO2 молочными ПКБ (Fröhlich-Wyder et al., 2017). Сообщалось о росте ПКБ при температурах ниже 14°C, а оптимум, зависящий от штамма, находится при 25-35°C (Jakob et al., 2016; Turgay et al., 2011). Они могут выживать при более высоких температурах, но их способность и температурная выносливость сильно зависят от штамма и более подробно рассматриваются в разделе 4 (Fröhlich-Wyder et al., 2017). Молочные ПКБ растут довольно медленно, время генерации составляет около 5 ч при оптимальных условиях (Falentin et al., 2010a). Интересно, что Патрик и Макдауэлл (2012) сообщили о более быстром росте группы кожных ПКБ, чем среди молочных ПКБ, со средним временем инкубации 7 и 14 дней соответственно, но редко сообщается о времени инкубации, превышающем 14 дней для молочных ПКБ (Tharmaraj & Shah , 2003). Тем не менее, исследования показывают, что контаминация C. acnes часто недодиагностируется, и увеличение времени инкубации для кутибактерий улучшит их выявление (Dagnelie et al., 2018; Foster et al., 2020). На твердых средах ПКБ образуют линзовидные колонии диаметром 1-4 мм (Turgay et al., 2020). Цвет колоний варьирует от кремового до оранжевого или красно-коричневого (Patrick & McDowell, 2012; Turgay et al., 2020). Проявление цвета зависит, с одной стороны, от исследуемого вида (см. табл. 2), а с другой - от условий роста, хотя они могут различаться при аэробной и анаэробной инкубации (Turgay et al., 2020).
Таблица 2. Характеристики молочных ПКБ и C. acnes по данным Patrick & McDowell (2012)
|
Виды
|
|||||
|
Характеристика
|
P. freudenreichii
|
A.acidipropionici
|
A.jensenii
|
A.thoenii
|
C.acnes
|
|
Оптимальная температура роста [°C]
|
30–32
|
30–32
|
30–32
|
30–32
|
36–37
|
|
Цветb
|
Кремовый
|
От кремового до оранжевого
|
От кремового до красно-коричневого
|
От оранжевого до красно-коричневого
|
Сероватый, полу-прозрачныйc
|
|
Потребность для роста
|
Биотин (sd)
Пантотенат
Тиамин (sd)
|
Биотин
Пантотенат
|
Биотин Пантотенат
п-амино-бензойная кислота (sd)
|
Биотин
Пантотенат
Тиамин (sd)
|
Пантотенат
|
|
Стимуляторы роста
|
Тиамин (sd)
|
Тиамин
|
Тиамин
п-амино-бензойная кислота (sd)
|
Тиамин (sd)
|
Биотин
Никотинамид
Тиамин
|
|
Для производства кислоты
– Инозитол
– Лактоза
– Мальтоза
– Сахароза
|
i+
i−
−
−
|
+
+
+
+
|
i+
i+
i+
+
|
i+
i−
i+
i+
|
i−
−
−
−
|
|
Гидролиз эскулина
|
+
|
+
|
+
|
+
|
−
|
|
Производство индола
|
i
|
−
|
−
|
−
|
i+
|
|
Восстановление нитратов
|
sd
|
+
|
−
|
−
|
i+
|
|
Рост в 20% желчи
|
+
|
+
|
+
|
−
|
+
|
|
Гидролиз желатина
|
−
|
−
|
−
|
−
|
+
|
|
β-гемолиз
|
−
|
−a
|
sd
|
sd
|
i+
|
|
Пигментация d
|
−
|
−
|
sd
|
sd
|
−
|
|
−
|
−
|
−
|
−
|
sd
|
|
Примечание: +, положительный результат у >90% изолятов; −, отрицательный результат у >90% изолятов; i, 11–89% изолятов положительны по параметру; i+, – 40–90% изолятов положительны; i−, 10–40% изолятов положительны; sd, зависит от штамма,
Что касается утилизации сахаров, то их способность сильно зависит от штамма, но все ПКБ могут ферментировать различные вещества, включая углеводы, полиолы и органические кислоты (Turgay et al., 2020). Большинство ПКБ способны утилизировать такие сахара, как лактоза, галактоза или d-глюкоза, а также спирты, например глицерин (Freitas et al., 2013; Patrick & McDowell, 2012). Что касается потребностей в азоте, P. freudenreichii является прототрофным для всех аминокислот и нуклеотидов, в то время как в отношении витаминов некоторые штаммы ПКБ нуждаются только в пантотенате и биотине, в то время как другим дополнительно необходимы тиамин и п-аминобензойная кислота (Falentin et al., 2010a). Обзор примерных факторов, влияющих на рост молочных ПКБ в отличие от C. acnes, приведен в таблице 2. В «Руководстве по систематической бактериологии» Берджи указано, что более 90 % штаммов P. freudenreichii способны деградировать арабинозу, эритрит, эскулин, фруктозу, галактозу, глюкозу, глицерин и маннозу (Patrick & McDowell, 2012). Кроме того, Patrick & McDowell (2012) сообщили, что от 40 до 90 % P. freudenreichii способны деградировать адонитол, инозитол и рибозу, а 10-40 % - лактозу и мелибиозу. Loux et al. (2015) сообщили, что количество сахаров, используемых различными штаммами P. freudenreichii в их исследовании, варьировалось от 10 до 15. Кроме того, каждый штамм демонстрировал уникальный профиль ферментации. Процентное соотношение, указанное в «Руководстве Берджи» для утилизации сахаров различными штаммами, не нашло подтверждения в работе Loux et al. (2015), поскольку, например, все протестированные штаммы были способны ферментировать рибозу. Аналогичная картина наблюдается и в отношении катаболизма лактозы (80 % протестированных штаммов Loux et al. против 10-40 % в Patrick & McDowell). Однако большинство штаммов Loux et al. (2015) были получены из сыра и сырной среды и, следовательно, могли быть подвергнуты одомашниванию. Возникает вопрос, можно ли рассматривать это изменение как развитие с течением времени или же оно связано с другим отбором штаммов, учитывая, что в публикациях конца 1990-х годов P. freudenreichii все еще считался непригодным для ферментации лактозы (Piveteau, 1999).
Обзор метаболических путей и катализирующих ферментов P. freudenreichii представлен на рисунке 1. P. freudenreichii была выбрана для иллюстрации в качестве репрезентативной ПКБ, поскольку она является наиболее ярким примером молочной ПКБ в производстве сыра и окружающей среде.
Рис.1. Метаболизм P. freudenreichii (по данным Falentin et al., 2010a; Piveteau, 1999; Thierry et al., 2011; Turgay et al., 2020)
Особенно характерным для всех ПКБ является производство пропионата, ацетата и углекислого газа по циклу Вуда-Веркмана, однако соотношение пропионата и ацетата может сильно варьироваться (Deptula et al., 2017b; Stackebrandt et al., 2006; Thierry et al., 2011). В молочной ПКБ углеводы либо окисляются с образованием пирувата через гликолиз или пентозофосфатный путь, либо используются для производства трегалозы (Turgay et al., 2020). Дисахарид трегалоза состоит из двух связанных молекул глюкозы и образуется в ответ на стрессы в качестве защитной функции (Turgay et al., 2020). Пируват может быть преобразован в лактат или аланин (Turgay et al., 2020). Возможны два других пути дальнейшего метаболизма пирувата: один путь включает преобразование пировиноградной кислоты в уксусную кислоту с помощью активности пируватдегидрогеназы (рис. 1 (d)), что приводит к образованию ацетата и CO2 и генерированию NADH (Turgay et al., 2020). Другой путь приводит к восстановлению пирувата до пропионата через цикл Вуда-Веркмана (Thierry et al., 2011; Turgay et al., 2020). При продолжении цикла Вуда-Веркмана происходит утилизация NADH, образующегося в ходе гликолиза, и образуется дополнительный аденозинтрифосфат (АТФ) (Thierry et al., 2011). Степень превращения пировиноградной кислоты в пропионат или в ацетат и CO2 можно рассматривать как функцию количества коферментов, восстановленных в процессе окисления субстрата до пировиноградной кислоты для поддержания окислительно-восстановительного баланса, однако пропорции между двумя путями образования пировиноградной кислоты также различаются в зависимости от свойств штамма, субстрата и условий окружающей среды (Falentin et al., 2010a; Thierry et al., 2011; Turgay et al., 2020). Одной из ключевых реакций является перенос карбоксильной группы с метилмалонил-КоА на пировиноградную кислоту, благодаря чему пропионил-КоА и оксалоуксусная кислота могут образовываться без участия свободного CO2 (Falentin et al., 2010a; Thierry et al., 2011). Фермент, отвечающий за перенос, биотин-зависимая метилмалонил-КоА карбокситрансфераза (a; E.C. 2.1.3.1), до сих пор был обнаружен только в пропионибактериях. Этот фермент состоит из трех полипептидных субъединиц, одна из которых была использована в качестве молекулярного маркера для изучения пробиотических способностей P. freudenreichii в пищеварительном тракте человека (Turgay et al., 2020). Превращение сукцинил-КоА в метилмалонил-КоА катализируется метилмалонил-КоА-мутазой (b; E.C. 5.4.99.2), которая является витамин B12-зависимой (Turgay et al., 2020).
Утилизация аспартата у P. freudenreichii также возможна, но степень активности аспартата зависит от штамма (Turgay et al., 2020). Аспартат деаминируется до фумарата и, как следствие, вступает в цикл Вуда-Веркмана (Falentin et al., 2010a). Утилизация аспартата приводит к регенерации окисленных коферментов и АТФ (Falentin et al., 2010a). У P. freudenreichii катаболизм аспартата связан с двумя ферментами: аспартат-оксидазой (E.C. 1.4.3.16), превращающей аспартовую и фумаровую кислоты в янтарную и имминосукциновую, и аспартат-аммиак-лиазой (c, E.C. 4.3.1.1), катализирующей деаминирование аспартовой кислоты с последующим образованием фумаровой кислоты и аммиака (Turgay et al., 2020). Различные штаммы обладают двумя соседними генами, кодирующими аспартат-аммиачную лиазу, что важно отметить в контексте сыроделия (Turgay et al., 2020). Такие штаммы производят больше янтарной кислоты, чем штаммы с одним кодирующим геном, и, следовательно, образование CO2 также усиливается (Thierry et al., 2011). В отсутствие других субстратов могут метаболизироваться также аспаргиновая и пропионовая кислоты; в этом случае цикл Вуда-Веркмана обращается вспять, и пропионовая кислота превращается в янтарную (Turgay et al., 2020).
Биосинтез витамина B12 P. freudenreichii — это процесс, который в культуре происходит на более поздних стадиях роста и поэтому представлен отдельно на рисунке 1 (Deptula et al., 2017b). Отправной точкой для производства витамина B12 является глутаминовая кислота, которая в результате многочисленных реакций превращается в порфобилиноген, а затем полимеризуется в преуропорфириноген. Требуются дальнейшие реакции до тех пор, пока окончательно не образуется активная форма витамина В12 (Turgay et al., 2020). Интересно, что Deptula et al. (2017b) в своем исследовании наблюдали кобаламин, а также псевдокобаламин в начале инкубации, но уровень псевдокобаламина был ниже предела обнаружения в конце инкубации, что указывает на процесс преобразования в активную форму. Стоит отметить, что для образования активной формы необходимы аэробные и анаэробные условия (Turgay et al., 2020). Нижний лиганд активной формы не может быть получен в строго анаэробных условиях, что объясняет наблюдения Deptula et al. (2017b). Кроме того, необходим синий свет (Turgay et al., 2020).
Несмотря на то, что филогенетический анализ последовательностей генов 16S рРНК выявил отдельную и согласованную кладу Acidipropionibacterium, Cutibacterium и Propionibacterium внутри семейства Propionibacteriaceae, молочные и кожные виды образуют два отдельных кластера (Scholz & Kilian, 2016; Stackebrandt et al., 2006). Учитывая разную среду обитания кутибактерий и молочных ПКБ, логично, что некоторые гены теряются при адаптации к человеку-хозяину. Кутибактерии обладают меньшим геномом, чем молочная группа. Исключением в этом отношении является только P. freudenreichii, обладающая еще меньшим геномом, чем кутибактерии (Scholz & Kilian, 2016). Шольц и Килиан (2016) обнаружили, что C. acnes больше не обладает активностью леваназы - фермента, катализирующего деградацию полимеров фруктозы, содержащихся в травах, а также генами, необходимыми для транспорта аминокислот с разветвленной цепью и глутаматдекарбоксилазы. Однако в результате адаптации к новому хозяину гены не только терялись, но и приобретались новые. Авторы сообщили, что в общей сложности у кутибактерий было обнаружено 108 уникальных генов. У исследованных штаммов были обнаружены новые гены для поглощения железа, а также отличия в генах, связанных с поглощением сахара и липазами, а именно триацилглицерол-липазой и пирофосфокиназой, которые позволяют выживать во враждебных сальных фолликулах (Scholz & Kilian, 2016).
В заключение следует отметить, что особенно молочные ПКБ обладают уникальным метаболизмом, который позволяет им использовать различные источники энергии и производить несколько соединений, интересных для промышленного применения. Например, способность A. acidipropionici производить большое количество пропионовой кислоты показывает потенциал для производства этой органической кислоты в промышленных масштабах (Assis et al., 2020; Deptula et al., 2018). Сообщается, что при использовании в качестве пробиотика P. freudenreichii выдерживает пищеварительные стрессы и внедряется в эпителиальные клетки кишечника, где вырабатывает ряд метаболитов, например, короткоцепочечные жирные кислоты и поверхностные белки, которые положительно влияют на здоровье желудочно-кишечного тракта человека и животных (Nair et al., 2019; Rabah et al., 2017; Rabah et al., 2018). Кроме того, изучается возможность обогащения продуктов питания P. freudenreichii для повышения их питательной ценности, что приводит к улучшению усвоения витамина B12 потребителем. P. freudenreichii является одним из наиболее часто используемых организмов для промышленного производства витамина B12, а образование B12 - это очень сложный процесс, на который влияет множество факторов (Assis et al., 2020). Рекомендуется проведение дополнительных исследований для дальнейшего совершенствования промышленного использования P. freudenreichii.
Литература: Список литературы см. в источнике:
Источник: Bücher C, Burtscher J, Domig KJ. Propionic acid bacteria in the food industry: An update on essential traits and detection methods. / Compr Rev Food Sci Food Saf. 2021 Sep;20(5):4299-4323 (PDF)
Дополнительная пополняемая информация
- Обновленная информация о ПКБ по состоянию на 2021 (↑)
- Многогранные свойства молочных пропионибактерий
- Propionibacterium spp. - источник важных для промышленности метаболитов
- P. freudenreichii: Общие характеристики и пробиотические свойства
- Молочные пропионибактерии: Универсальные пробиотики
- Пропионовокислые бактерии как пробиотики
- Эффективность пропионовокислых бактерий в лечении колита
- Польза пропионибактерий из сыра в отношении колита
- Многообещающие иммуномодулирующие эффекты отдельных штаммов молочных пропионибактерий, подтвержденные in vitro и in vivo
- Снижение риска гепатокарциномы с помощью пропионовокислых и лактобактерий
- Пропионовокислые бактерии в профилактике и лечении рака
- Молочные пропионовокислые бактерии предотвращают остеопороз
- Пропионовокислые бактерии в лечении мукозита, вызванного химиотерапией
- Молочные пропионовокислые бактерии смягчают воспаление, модулируя путь ядерного фактора «каппа-би» с помощью внеклеточных везикул
- Антибиотикорезистентность, антагонистическая активность и биосовместимость пропионовокислых бактерий
- Противодействие ожирению и противодиабетические эффекты молочной бактерии Propionibacterium freudenreichii
- Антиоксидантные свойства пропионовокислых бактерий P. freudenreichii
- Бифидогенный стимулятор роста, продуцируемый P. freudenreiichii
- Кислотоустойчивость пропионовокислых бактерий
- Некоторые пробиотически значимые свойства пропионибактерий
- Пропионовокислые бактерии защищают от микотоксинов
- Молочнокислые и пропионовокислые бактерии при совместной ферментации
- Биотехнологический потенциал пропионовокислых бактерий
- Пропионовая кислота и пропионаты
- О пропионовокислых бактериях (статья-заметка, Воробьева Л.И.)
- Воробьева Л.И. Пропионовокислые бактерии. - М.: Изд-во МГУ, 1995. - 288 с. (монография, Воробьева Л.И.)
- Биотехнология заквасок пропионовокислых бактерий (монография, Хамагаева И.С.)
- Предпосылки для испытаний штамма Propionibacterium freudenreichii RVS-4-irf в качестве компонента клинического питания (Статья об эксперименте: Рыжкова Е.П.)
- Антимутагенная активность пропионовокислых бактерий
- Бактериоцины пропионовокислых бактерий
- Безопасность молочных пропионовокислых бактерий
- Молочные пропионовокислые бактерии увеличивают продолжительность жизни нематод Caenorhabditis elegans через активацию иммунной системы - (иссл.)
Дополнительную информацию о пробиотических свойствах и биотехнологическом потенциале пропионовокислых бактерий см. в разделе "СТАТЬИ"