ООО "ПРОПИОНИКС"
| пн-пт с 09:00 до 18:00 | |
Микроорганизмы начинают заселять человеческий плод еще в утробе матери
ДОКАЗАНО: МИКРОБИОМ МЛАДЕНЦА НАЧИНАЕТ РАЗВИВАТЬСЯ В УТРОБЕ МАТЕРИ

Воздействие плода на материнскую микробиоту у людей и мышей

Примечание: Данная статья описывает ситуацию, которая спорная. Так на 2023 год была опубликована статья, в которой все изложенное ниже подвергается критике.
Предыдущие исследования показали наличие микробной ДНК в эмбриональной среде. Однако остается неясным, представляет ли эта ДНК жизнеспособные бактерии и как она связана с материнской микробиотой в разных участках тела. Мы изучили микробиоту Диад человека и мыши, чтобы понять эти отношения, локализовать бактерии в плоде и продемонстрировать жизнеспособность бактерий. В человеческих недоношенных и доношенных диадах мать-младенец во время кесарева сечения ротовая полость и меконий новорожденных, рожденных уже на 24-й неделе беременности, содержали микробиоту, которая, по прогнозам, происходила из внутриутробных источников, включая плаценту. Используя оперативные роды беременных мышей в строго контролируемых стерильных условиях в лаборатории, состав, визуализация и жизнеспособность бактерий в маточном отделении и кишечнике плода были продемонстрированы секвенированием генов 16S рРНК, флуоресцентной гибридизацией in situ и бактериальной культурой. Состав и прогнозируемый источник микробиоты кишечника плода смещены между серединой и концом беременности. Культивируемые бактерии в кишечнике плода были обнаружены в середине беременности, но не в конце беременности. Наши результаты демонстрируют динамичную, жизнеспособную микробиоту плода млекопитающих во время внутриутробного развития.
Прим. редактора: В целях сокращения объема статьи в нашем разделе не указана подробная стандартная информация о материалах и методах исследования (они описаны кратко). Данную информацию читатель сможет найти самостоятельно в оригинале статьи в журнале JCI Insight.
Также советуем обратить внимание, что подобные исследования вызывают споры. Поэтому, т.к. наш сайт весьма динамичен, приводим ссылку на более позднее исследование, в котором опровергается заселение микробиотой до родов:
Katherine M. Kennedy, Max J. Gerlach, Thomas Adam, Markus M. Heimesaat, Laura Rossi, Michael G. Surette, Deborah M. Sloboda, Thorsten Braun. Fetal meconium does not have a detectable microbiota before birth. Nature Microbiology, 2021.
ВВЕДЕНИЕ
Микробная колонизация кожи и слизистых оболочек в раннем возрасте имеет важное значение для развития иммунитета хозяина и обмена веществ (1–3). Ведущая парадигма колонизации в раннем возрасте гласит, что плод развивается в стерильной среде внутриутробного развития и становится колонизированным микробами после рождения в процессе вагинального родоразрешения, кормления грудным молоком матери и других воздействий окружающей среды (4–6). Однако секвенирование следующего поколения выявило ДНК из различных ассоциированных с человеком бактерий в человеческой плаценте, амниотической жидкости (околоплодных водах) и меконии младенцев, что позволяет предположить, что первые столкновения с микробами могут происходить пренатально даже в условиях здоровой беременности (7-13). Эти результаты породили новые гипотезы для материнских резервуаров этих бактерий и их влияния на развитие плода. Одна из таких гипотез, основанная на исследованиях, демонстрирующих сходство между материнской и эмбриональной микробиотой, заключается в том, что микробы в материнской кишке или ротовой полости могут передаваться к материнско-фетальному барьеру гематогенно или через иммунные клетки (7, 8, 14, 15). Однако сроки и характер воздействия микробов на плод остаются в значительной степени неизвестными. Остается важный вопрос о том, представляют ли эти бактериальные гены жизнеспособные и метаболически активные бактерии, их источник и путь прохождения к плоду, и сохраняются ли они после рождения для формирования раннего неонатального микробиома.
Определение наличия и состава микробиома плода является сложной задачей с учетом технических и этических ограничений, включая некультивируемый характер многих организмов, риски инвазивного тестирования плода человека и проблему выделения микробиоты плода из вездесущих загрязнителей окружающей среды (16). Если микробная ДНК действительно присутствует в эмбриональной среде в отсутствие патологической инфекции, текущие данные подтверждают, что она имеет низкую численность (17, 18). Интерпретация данных секвенирования бактериальной ДНК в среде с низким содержанием бактериальной биомассы обычно осложняется фоновым загрязнением (19). Хотя некоторые исследования не смогли идентифицировать ассоциированную с хозяином микробиоту, отличную от загрязняющей ДНК (16, 20-22), другие исследования подтверждают наличие уникальной микробной ДНК в фетальной (околоплодной) среде за пределами фонового загрязнения (17, 18, 23, 24). Учитывая технические ограничения секвенирования в образцах биомассы с низким содержанием бактерий, для решения вопроса о наличии и динамике микробиоты плода во время беременности потребуется несколько взаимодополняющих подходов, включая культивирование и молекулярные методы.
В этой работе мы изучали микробиоту Диад человека и мыши, чтобы понять эти отношения, локализовать бактерии в плоде и продемонстрировать жизнеспособность бактерий. В недоношенных и доношенных диадах мать-ребенок в операционной во время кесарева сечения мы стремились понять природу взаимоотношений материнской вагинальной, плацентарной и фекальной микробиоты с оральной и мекониевой микробиотой ребенка. Для более глубокой характеристики характера этих взаимоотношений в контролируемых условиях мы также изучали материнско-фетальную микробиоту у мышей. Мы использовали комбинацию бактериального секвенирования ДНК, флуоресцентной гибридизации in situ (FISH) и бактериального культивирования для определения наличия и жизнеспособности микробиоты плода на протяжении всей беременности.
РЕЗУЛЬТАТЫ
Перинатальная микробиота матери и ребенка.

Мы изучали микробиоту на момент рождения в когорте из 10 недоношенных и доношенных Диад мать-ребенок. Только младенцы, рожденные путем кесарева сечения, были включены в исследование, чтобы обеспечить возможность отбора проб внутриутробной среды и избежать воздействия материнской мочеполовой микробиоты во время вагинальных родов. Восемь из 10 матерей не испытывали родов до родов, и 9 из 10 имели неповрежденные мембраны во время кесарева сечения. Средний гестационный возраст при родах составил 26 (диапазон: 24-29) недель у 5 недоношенных детей и 39 (диапазон: 38-40) недель у 5 доношенных детей (Таблица 1). Все матери получали однократную дозу антибиотиков внутривенно во время кесарева сечения. Ни один из доношенных детей не получал антибиотиков, но 4 из 5 недоношенных детей лечились антибиотиками эмпирически после рождения. Ни у одного из детей не было положительных посевов крови.
|
Таблица 1. Клиническая характеристика человеческих диад мать-младенец
|
||||
| Вес при рождении / Возраст при рождении | Пол | Потуги перед родами | Разрыв мембран | Показатель родов |
| (грамм) (недели) | перед родами | |||
|
Преждевременно |
||||
| PT1 780 27 | F | N | N | Преэклампсия |
| PT2 640 26 | F | N | N | Преэклампсия |
| PT3 780 25 | F | Y | Y | Преждевременные роды |
| PT4 680 29 | M | N | N | Статус плодаA |
| PT5 640 24 | F | Y | N | Преждевременные роды |
|
Полный срок |
||||
| FT1 3495 39 | F | N | N | Повторение CS |
| FT2 3420 39 | M | N | N | Повторение CS |
| FT3 3475 39 | F | N | N | Повторение CS |
| FT4 2955 40 | F | N | N | Тазовое рождение |
| FT5 3010 38 | M | N | N | Повторение CS |
|
AСерьезное ограничение внутриутробного развития. CS, кесарево сечение.
|
||||
Мы собрали образцы из 10 пар мать-ребенок в стерильных условиях в операционной во время кесарева сечения. Образцы были взяты с поверхности эндометрия (матки), плаценты и околоплодных вод, а также из влагалища и прямой кишки матери. В первые минуты после рождения ребенка ротовую полость исследовали стерильным тампоном. Первый мекониевый стул ребенка был собран от каждого ребенка в среднем возрасте 1 (межквартильный интервал [IQR]: 1–4) дня. Плазма, собранная венопункцией у матери после родов, была включена в качестве контроля.
Мы использовали секвенирование генов 16S рРНК для характеристики состава и разнообразия микробиоты на каждом участке тела. Мы использовали Делительный Алгоритм Шумоподавления Ампликона (DADA2) для вывода 16S вариантов секвенирования ампликона гена рРНК (ASVs), который превосходит обычную кластеризацию операционных таксономических единиц в различении мелкомасштабных вариаций последовательности и устранении ошибок секвенирования (25).
В общей сложности 3789 уникальных ASV присутствовали среди образцов. Медианное число операций чтения на выборку составило 19 666 (IQR: 15 265–43 291). Среднее число ASV, наблюдаемых в каждом участке выборки, не было значимо отличным для разных участков (P> 0,05 для всех парных сравнений по критерию суммы рангов Уилкоксона с поправкой Бенджамини-Хохберга). Альфа-разнообразие, измеренное по индексу Шеннона, было выше в плазме матери, чем во влагалище и ротовой полости младенца (4,03 против 2,97, P = 0,027; и 4,03 против 2,59, P = 0,029 соответственно), но существенно не отличалось между другими сайтами. Микробиота плаценты матери, которая пережила разрыв мембран перед преждевременными родами, содержала самое большое количество наблюдаемых ASV (552 против диапазона 38–241), но сходное разнообразие Шеннона (2,92 против 2,18–4,18), по сравнению с др. образцами плаценты. Большая доля ASV была разделена между материнскими и младенческими сайтами в рамках отдельных Диад мать-младенец, чем между неродственными матерями и младенцами (дополнительная таблица S1). Относительно более низкая доля ASV была разделена между образцами плазмы матери и младенца.
Мы исследовали взаимосвязь состава микробиоты между участками тела, включая все пары мать-ребенок. Общая вариация между сайтами была выше, чем вариация внутри сайтов (R2 = 0,191; P = 0,001 по дисперсионному анализу перестановки adonis [PERMANOVA], рис. 1A). В парных сравнениях между участками образцов микробные сообщества в матке и плаценте отличались от микробиоты амниотической мембраны, которая имела большее сходство с микробиотой плазмы (рис. 1, А и В). Сообщества плаценты и матки отличались от материнской фекальной микробиоты, но существенно не отличались от микробиоты влагалища, ротовой полости младенца или мекония младенца. Микробные сообщества детского мекония и полости рта варьировали между субъектами в их отношении к другим участкам, но отличались от микробиоты материнского кала и плазмы крови.
Рисунок 1. Основанное на секвенировании определение микробиоты недоношенных и доношенных диад мать-ребенок человека, родоразрешенных путем кесарева сечения.
(A) Анализ основных координат образцов на основе расстояний Брея-Кертиса. (B) Попарные сравнения расстояний Брея-Кертиса между участками выборки по Адонису Перманову с корректировкой Бенджамини-Хохберга. Значения R2 и P (в скобках; выделены, если P <0,05) отмечены для каждого сравнения. (C) Тепловая карта относительной доли высших бактериальных таксонов (низшей назначенной таксономии), представленных в каждом месте выборки в недоношенных и доношенных парах мать-младенец.
Среди многих недоношенных и доношенных Диад мать-младенец, внутриутробная среда и места отбора образцов у младенцев были обогащены для ASV, относящихся к родам Escherichia и Acinetobacter (рис. 1C). На долю преждевременного или доношенного гестационного возраста приходится незначительная доля вариабельности состава микробного сообщества (adonis PERMANOVA R2 = 0,020; P = 0,008, стратифицированная по участку тела). Многие бактериальные таксоны были разделены между несколькими материнскими и младенческими участками в рамках отдельных Диад (дополнительный рисунок S1).
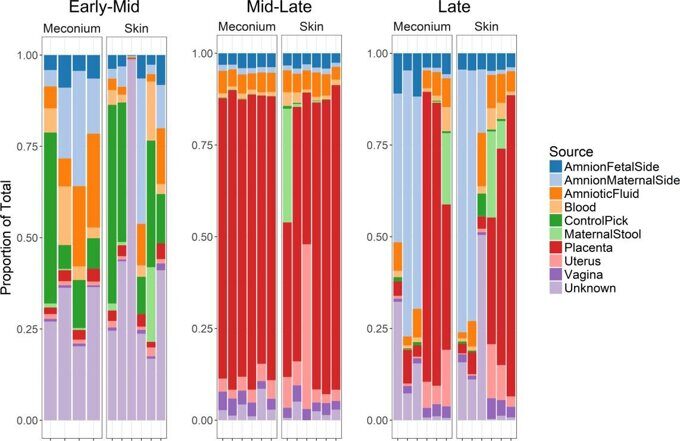
Мы использовали отслеживание источника бактериальных ASV в ротовой полости младенца и меконии для определения потенциального внутриутробного или материнского происхождения детской микробиоты (26). Мы включили матку, плаценту, амниотическую оболочку, материнские фекалии, влагалище и плазму в качестве потенциальных источников микробиоты младенца. Модель предсказала плацентарную микробиоту как общее происхождение для пероральной и мекониевой микробиоты непосредственно после рождения ребенка (Рис.2). В некоторых диадах более высокая доля микробиоты выравнивается с амниотической мембраной или маточными источниками. Для проверки модели мы вводим отдельные материнские и внутриутробные сайты в качестве «поглотителей» и оцениваем другие сайты из всей когорты в качестве потенциальных источников. Модель обычно предсказывала тот же тип сайта, что и источник микробиоты для каждого образца (дополнительный рисунок S2). В целом, наши результаты демонстрируют присутствие микробной ДНК в меконии и полости рта при рождении у детей, рожденных от 24 до 40 недель беременности, и предсказывают происхождение из среды внутриутробного развития.
Рисунок 2. Пропорции детской микробиоты отнесены к материнским и внутриутробным источникам.
Предсказанные источники микробиоты младенцев были определены с использованием SourceTracker (26). Доля микробиоты младенцев, относящаяся к материнским и внутриутробным источникам, показана для полости рта и кала младенца (т.е. мекония) среди недоношенных (А) и доношенных (В) Диад мать-младенец. Субъекты не испытывали родов или разрыва мембран до родов, за исключением субъекта PT3 (преждевременные роды и разрыв плодных оболочек) и субъекта PT5 (преждевременные роды без разрыва мембран). Недоношенные дети PT1, PT2, PT3 и PT5 получали антибиотики после рождения.
Материнско-фетальная микробиота у мышей.

Для более глубокого изучения внутриутробной микробиоты в контролируемых условиях мы изучили динамику и принадлежность мышиной материнско-фетальной микробиоты. Мы проводили оперативные роды на беременных дамбах в стерильных условиях в сроки от середины до конца беременности. Всесторонние образцы от матери, плодов, и внутриутробной окружающей среды были секвенированы на локусе 16S rRNA для того чтобы охарактеризовать микробиоту на каждом месте. Было идентифицировано в общей сложности 3050 ASV с медианой 16 940 считываний на выборку. Медианное разнообразие в образцах, измеренное по индексу Шеннона, было самым высоким в материнских фекалиях и самым низким во влагалище (3,01 и 1,94 соответственно), но участки существенно не отличались друг от друга после корректировки для множественных сравнений.
При определении состава микробиоты в тканях матери и плода методом секвенирования следующего поколения, многие общие бактериальные таксоны были найдены в утробе и фетальных компартментах (Рисунок 3). У мышей, отобранных в начале-середине беременности (E14–16, n = 2 dams и ≥ 3 fetus/dam), микробиота фетальных компартментов содержала многие из тех же ASV, что и материнская фекальная микробиота, включая ASV в пределах родов Candidatus Arthromitus, Bacteroidales S24-7, Lactobacillus и Desulfovibrio. У мышей, отобранных в середине поздней (Е17–18) или поздней (Е19–20) беременности (n = 2 dams and ≥ 3 fetuses/dam/time point), внутриутробные и фетальные отсеки имеют большее перекрытие с ASV, идентифицированными в плацентарной и вагинальной микробиоте, включая Kurthia gibsonii иEscherichia / Shigella ASV. Таксон Bacteroidales S24-7 доминировал в материнской фекальной микробиоте и был одновременно представлен в образцах матки и плода в эти более поздние сроки. В качестве контроля мы включили 2 образца из стерильных инструментов, используемых для сбора образцов из фетальных участков ("контрольный выбор") в ходе секвенирования. Мы также брали кровь у животных непосредственно перед оперативными родами. Наиболее распространенные ASV в кишечнике плода были часто представлены в крови при более низком содержании, но не в отрицательных контрольных образцах (дополнительный рисунок S3). Для дальнейшего подтверждения микробиоты желудочно-кишечного тракта плода, мы проводили исследование методом флуоресцентной гибридизации in situ (FISH) на срезах фетальной кишечной ткани с использованием эубактериального зонда EUB338. Зонд EUB338 визуализировался при низком обилии по всей фетальной кишке (Рис. 4). Контроль без зонда (no-probe) и скрэмблированный зонд (scrambled-probe) не показали окрашивания, наблюдаемого в секциях зондирования EUB338 (репрезентативные изображения показаны на Рис.4).
Рисунок 3. Относительное обилие высших бактериальных таксонов в мышиной материнской и фетальной микробиоте на всех этапах беременности.
Лучшие 15 бактериальных таксонов (самая низкая назначенная таксономия) в пределах каждого материнского или фетального сайта показаны среди мышей раннего среднего (E14-16), среднего позднего (E17–18) или позднего (E19-20) срока беременности. Представлены образцы от самок и 3-5 плодов на самку.
Рисунок 4. Идентификация бактериальной ДНК в кишечнике плода мышей с помощью гена 16S рРНК.
Срезы кишечной ткани получали от эмбриональных мышей при Е12-14 и окрашивали DAPI и зондировали с помощью Меченного Cy3 эубактериального зонда EUB338 и скремблированного зонда контроля. Изображения были получены с помощью конфокальной микроскопии. Шкала бар: 50 мкм. Увеличении 10×.
Как и в случае с человеческими данными, состав микробного сообщества на основе расстояний Брэя-Кертиса значительно варьировал между участками тела в модели перманентной динамики (R2 = 0,119; P = 0,003, дополнительный рисунок S4A). При попарных сравнениях образцы материнских фекалий значительно отличались от всех других участков (значения R2 от 0,168 до 0,302). Разница между другими сайтами не была значительно больше, чем внутри сайтов для остальных парных сравнений сайтов. Состав сообщества смещался вдоль PC1 между образцами, собранными в начале-середине и конце беременности (медиана -0,38 против 0,41; P < 0,001, дополнительный рисунок S4B).
Используя отслеживание бактериальных источников ASV гена 16S рРНК для определения наиболее вероятных источников материнской микробиоты для кишечника и кожи плода, прогнозируемый источник микробиоты плода варьировался в зависимости от гестационного возраста на момент отбора образцов. При средней и поздней (E17–18) и поздней (E19–20) беременностях микробиота кишечника и кожи плода чаще приписывалась плаценте, за которой следовала амниотическая мембрана. Предсказанный источник микробиоты плода в раннем и среднем сроке беременности (E14-16) был более изменчивым, чем измеренный в образцах поздней стадии. По сравнению с более поздними стадиями, ASVs плода с бактериями имели повышенную прогнозируемую связь с контрольными пробами в некоторых пробах, что потенциально отражало уменьшение бионагрузки и повышенный риск смещения выборки. В связи с этой же проблемой в модели было получено больше источников с низким уровнем достоверности, сгруппированных как «неизвестные». Несмотря на эти проблемы, уникальные ASV отличали образцы плода от контроля, что предполагает раннее воздействие бактерий на плод. Вместе результаты показывают, что микробиота плода является динамичной во время беременности.
Рисунок 5. Прогнозируемые источники микробиоты плода мышей.
Отслеживание бактериального источника было использовано для определения вероятных источников бактериальной ДНК в кишечнике и коже плода ранней (E14-16), средней (E17–18) и поздней (E19-20) беременности. Представлены образцы от 2 самок и соответствующих им зародышей.
Затем мы попытались определить, присутствуют ли жизнеспособные и культивируемые бактерии в мышином внутриутробном компартменте и плоде. Образцы, отобранные у беременных самок и их плодов, гомогенизировали, наносили на культуральные среды и инкубировали в анаэробных и / или аэробных условиях с контролем среды и инструмента для исключения загрязнения окружающей среды во время отбора проб. Жизнеспособные бактерии были обнаружены в фетальных и внутриутробных участках (Рисунок 6). В некоторых случаях штаммы с высокой идентичностью последовательности были выделены из более чем 1 участка на отдельных участках плода и в матке. Положительные культуры чаще встречались в середине беременности, в то время как образцы, полученные ближе к полному сроку, не давали положительных культур, несмотря на наличие бактериальных последовательностей ДНК. Штаммы лактобацилл были наиболее распространенными изолятами в кишечнике плода и внутриутробных образцах. Lactobacillus ASV также были идентифицированы в данных секвенирования, хотя они составляли незначительную часть микробиоты (диапазон: 0% -30,6% от общей микробиоты кишечника среди отдельных плодов). Другие бактериальные изоляты из фетальных и внутриутробных образцов включали штаммы Escherichia, Enterococcus, Bacteroides, Bacillus и др. (рис.6). Многие из этих таксонов были также культивированы из материнских фекальных и вагинальных образцов, а иногда колонии с высокой достоверностью идентичности последовательности были изолированы одновременно из фетальных и материнских участков. Например, штаммы энтерококков, выделенные из плаценты, были аналогичны штаммам в материнском влагалище и кале. Мы собрали образцы кожи и крови матери для сравнения. Культивированные организмы из кожи, как правило, отличались от изолятов внутриутробного развития и включали Streptococcus, Rothia, Bacillus, Staphylococcus, Streptomyces и Brevibacillus spp. Одна колония (Streptococcus sp.) была обнаружена в крови от 1 из самок; все остальные культуры крови были отрицательными. Для исключения контаминации материнской флорой кожи кожу беременных самок (n = 2) перед вскрытием местно покрывали спектиномицин-резистентной кишечной палочкой. Затем кожу очищали с помощью тех же процедур, что и в предыдущих экспериментах. Ткани матери и плода высевали на агар MacConkey со спектиномицином. Мазки из кожи матери, собранные после применения раствора E. coli, показали рост резистентного к антибиотикам штамма, в то время как все другие ткани матери и плода были отрицательными, демонстрируя отсутствие загрязнения от флоры кожи матери во время иссечения (данные не показаны).
Рисунок 6. Бактериальные штаммы культивировали из кишечника плода мыши, плаценты и матки.
Верхняя серо-белая полоса указывает на отдельные самки и эмбриональный день на момент отбора проб, под которой идет анатомический участок, показывающий откуда были выделены бактериальные штаммы. Цветные квадраты на тепловой карте представляют участки с положительными культурами. Меньше образцов имели положительные культуры в конце беременности. Штаммы были идентифицированы с помощью секвенирования Sanger гена 16S рРНК (8F / 1492R). Для каждого изолята отображается присоединительный номер для верхнего совпадения, идентифицированного базовым инструментом поиска локального выравнивания (BLAST) (изоляты без совпадения с идентичностью последовательности не менее 94% были обозначены как неизвестные).
Затем мы попытались определить, можно ли культивировать бактерии из эмбриональной среды после материнской колонизации во время беременности. Беременные самки обрабатывали стрептомицином перорально через желудочный зонд один раз в день в течение 2 последовательных дней в начале беременности, чтобы сделать кишечную микробиоту пермиссивной к колонизации кишечной палочкой, вводимой через желудочный зонд (E5-6; Рисунок 7A). На следующий день (Е7) самок обрабатывали пероральным введением стрептомицин-резистентного уропатогенного штамма E. coli (UTI89/pCOMgfp [UTI89]; 1×108 колониеобразующих единиц [кое]) (27). Самки выглядели хорошо, не демонстрировали никаких побочных эффектов и не имели спонтанных потерь беременности после лечения. Ткани собирали с самок и их плодов при ранней (E9) или поздней (E18) беременности и высевали на агар Luria, содержащий стрептомицин. На ранних сроках беременности (Е9) стрептомицин-резистентную кишечную палочку культивировали из слепой кишки матери, крови, матки и плода (рис. 7В). Количество бактерий варьировалось от 10 до 103 КОЕ на плод (исключая плаценту). Из влагалища культивировалось мало или вообще не культивировалось колоний E. coli. На поздних сроках беременности (Е18) после предшествующего введения E. coli на E7 введенные бактерии сохранялись в материнской слепой кишке, но больше не обнаруживались во внутриутробной среде или у плода, за исключением 1 плода с низким содержанием амниотической жидкости (рис.7С). Контрольные культуры, выполненные в колонии мышей и отдельно размещенных пометах, показали, что животные не были изначально колонизированы стрептомицин-резистентными бактериями (данные не показаны). В совокупности эти результаты свидетельствуют о том, что жизнеспособную кишечную палочку можно культивировать из эмбриональной среды на ранних сроках беременности после колонизации кишечника матери-мыши.
Рисунок 7. Культивирование стрептомицин-резистентной E. coli из тканей матери и плода после материнской колонизации
А) сроки лечения самок антибиотиками (Abx; стрептомицин), колонизации стрептомицин-резистентной кишечной палочкой путем перорального введения и сбора тканей матери и плода. B) количество колониеобразующих единиц (КОЕ) на пластинку (100 мкл гомогената / пластинка) из тканей матери и плода в ранние сроки беременности (Е9). C) количество КОЕ на пластинку (100 мкл гомогената / пластинка) из тканей матери и плода в середине и конце беременности (Е18). На клеточных диаграммах показаны минимальное и максимальное значения («усы»), верхний и нижний квартили, а также медиана. Длина коробки представляет собой межквартильный диапазон.
Чтобы гарантировать, что бактерии, идентифицированные в культурах и FISH из плодов мышей, не были вызваны перекрестным загрязнением из соседних материнских участков, был проведен следующий контрольный эксперимент. Беременные самки на E14 были анестезированы и помещены в стерильное хирургическое поле. Матка была подвергнута хирургическому воздействию, а наружная поверхность была покрыта устойчивой к канамицину кишечной палочкой. Каждый второй плод внутри матки затем микроинъецировали через стенку матки в печень плода устойчивой к спектиномицину кишечной палочки с использованием ручной стеклянной пипетки. После размещения тугих лигатур для отделения каждой фетально-плацентарной единицы, была собрана стенка матки, а затем амниотический мешок, а затем каждый отдельный плод. Ткани матери и плода гомогенизировали в стерильной жидкости и наносили на содержащие антибиотики агаровые пластины, а также перечисляли устойчивые к антибиотикам кишечные палочки. Как показано на дополнительном рисунке S5, культуры из незараженных плодов и сопутствующих амниотических мешков не выращивали ни одного бактериального штамма. Культуры плодов, инъецированных спектиномицин-резистентным штаммом E coli и сопутствующими амниотическими мешками, выращивали только инъецированный штамм, а не канамицин-резистентный штамм, используемый для преднамеренного загрязнения матки. Образцы матки демонстрировали переменный рост обоих штаммов E coli, что указывает на некоторое потенциальное загрязнение от плода до матки. Однако эти меры контроля свидетельствуют о том, что культуры плода не отражают загрязнения из материнских источников, таких как матка.
ОБСУЖДЕНИЕ И ВЫВОДЫ
Наше исследование расширяет ограниченный объем литературы, которая оспаривает представление о том, что плод развивается в стерильной среде (7-11, 14, 18, 24, 28). Сильные стороны этой работы включают в себя комплементарный отбор проб человека и мыши, визуализацию эмбриональной микробиоты у мышей, демонстрацию динамических изменений стадии беременности в материнских и фетальных (эмбриональных) участках и жизнеспособность среди культивируемых компонентов. Мы наблюдали наличие внутриутробной микробиоты в диадах мать-ребенок человека, перенесших кесарево сечение, и у мышей, отобранных в стерильных условиях в лаборатории. Наши наблюдения за наличием бактериальной ДНК в плоде и внутриутробной среде были подтверждены визуализацией бактерий в кишечнике плода с помощью FISH и данными культивирования, показывающими наличие жизнеспособных бактерий в кишечнике плода мышей.
Хотя наши данные от людей и мышей показывают, что плод подвергается воздействию бактериальной ДНК в течение середины беременности и в конце беременности, мы наблюдали временной сдвиг в составе и прогнозируемом источнике микробиоты по мере прогрессирования беременности. Хотя различия между микробиотой в середине беременности и на поздних сроках беременности были менее выражены в диадах мать-ребенок человека, чем у мышей, наблюдались существенные межиндивидуальные различия, и исследования в более крупных когортах были бы необходимы для получения окончательных выводов. Наши культуральные данные показывают, что плод мышей подвергается воздействию жизнеспособных и культивируемых бактерий в середине беременности, которые впоследствии не культивируются в конце беременности, несмотря на секвенирование, демонстрирующее присутствие организмов в этот период времени. Мы предполагаем, что изменения иммунной регуляции на материнско-фетальном барьере во время беременности могут приводить к различиям в способности микроорганизмов проникать и сохраняться в фетальной среде. Возможно также, что некоторые микробы могут сохраняться в жизнеспособном, но некультивируемом состоянии (29). Модель мыши, которую мы описываем в исследовании, может быть полезна для выяснения природы взаимодействий между материнской микробиотой и развивающимся плодом в будущей работе.
Наличие микробиоты плода остается областью интенсивного интереса и дебатов (30). Низкая бактериальная биомасса внутриутробной среды затрудняет выделение из окружающей среды загрязнений, которые могут возникать при сборе и подготовке проб (16, 20). Недавнее исследование в большой когорте женщин показало, что большинство последовательностей бактериальной ДНК, идентифицированных в терминальных ворсинках человеческой плаценты, можно отнести к загрязнению окружающей среды (22). Однако в плацентах женщин, перенесших кесарево сечение без родов, были выявлены ассоциированные с человеком бактериальные сигнатуры 16S рДНК, которые не могли быть отнесены к лабораторному загрязнению. Эти таксоны включали сигнатуры лактобацилл (Lactobacillus) и были описаны как “сигналы, связанные с родами”, учитывая их более высокую частоту в плацентах женщин с вагинальными родами или родами до родов. Наши эксперименты с контрольной культурой на мышах показали, что лактобациллы и другие микробы присутствовали в тканях плода и вряд ли могли быть приобретены путем заражения из соседних тканей. Наши результаты секвенирования и культивирования выявили общие микробные сигнатуры в отдельных диадах мать-ребенок и различия между фетальными / внутриматочными образцами и контролем. Отслеживание источника показало, что плацента может быть важным источником микробиоты как у людей, так и у мышей.
Хотя многие образцы не давали жизнеспособных организмов в культуре, различные организмы культивировались из кишечника плода, плаценты и матки мышей, включая лактобациллы, а также энтерококк (Enterococcus), эшерихии (Escherichia) и другие. Эти организмы являются общими компонентами неонатального микробиома человека, и бактериальная ДНК из этих таксонов была идентифицирована в меконии, амниотической жидкости и плаценте в предыдущих исследованиях (7-9, 13, 31, 32).
Несмотря на небольшой размер выборки, мы отметили, что образцы, собранные в самом раннем сроке беременности (E12–16), с большей вероятностью давали положительные культуры, чем образцы, собранные ближе к полному сроку, которые обычно были стерильными. В другом недавнем исследовании сообщалось о стерильных культурах из просвета кишечника плода мыши в один момент времени в середине поздней беременности (E17), несмотря на наличие бактериальной ДНК (18). Из культивированных изолятов в нашем исследовании инвазия плаценты Эшерихиями и другими организмами часто вызывает системную воспалительную реакцию у плода, тогда как присутствие лактобацилл в плаценте было связано с супрессивным эффектом (33). Мы обнаружили, что эмбриональные ткани преднамеренно колонизированные антибиотикорезистентной кишечной палочкой E. coli во время беременности, содержали культивируемую E. coli в раннем, но не позднем сроке беременности. Хотя эмбриональные ткани не демонстрировали явной клинической инфекции, E. coli культивировалась из крови и слепой кишки. Эти результаты позволяют предположить, что бактерии достигли плода через кишечник или кровоток, но необходимы дальнейшие исследования, чтобы определить источник и маршрут прохождения в среду плода. Мы не проводили бактериальную культуру на образцах человека, собранных в нашем исследовании.
Collado et al. сообщают о наличии жизнеспособных организмов, в том числе Пропионибактерий (Propionibacterium) и Стафилококков (Staphylococcus), из плаценты и околоплодных вод во время кесарева сечения в когорте доношенных матерей и младенцев (8). Если живые бактерии действительно присутствуют в эмбриональном компартменте человека, то механизмы, с помощью которых они обходят физические и иммунные барьеры на границе матери и плода, а также факторы, препятствующие прогрессированию клинической инфекции, еще предстоит определить.
Успешная беременность требует координации и баланса между материнским и развивающимся иммунитетом плода. Микробы играют важную роль в иммунном гомеостазе и регуляции. Наличие эмбриональных организмов или их молекулярных сигнатур может стимулировать иммунитет слизистой оболочки плода и подготавливать ткани к колонизации после рождения (17, 32). Мы наблюдали признаки микробной ДНК, культивируемость и FISH-свидетельства бактерий во время критического окна иммунного развития плода.
Врожденные лимфоидные клетки обнаруживаются в развивающейся мышиной фетальной печени, кишечнике, легких и селезенке, начиная с E12.5-14.5, с лимфатическими узлами, развивающимися по E16.5, в течение которых мы наблюдаем прямые микробной колонизации плода (34). Врожденные лимфоидные клетки кишечника плода человека (ILC) продуцируют ключевые цитокины, в том числе IL-13, IL-22 и IL-17A, которые, в свою очередь, способствуют развитию иммунитета и тканей (35). Недавнее исследование продемонстрировало наличие тканерезидентных Т-клеток, подобных памяти, в кишечнике плода человека, которые секретируют провоспалительные цитокины в более высоких уровнях при стимуляции, чем наивные Т-клетки (38). Эти результаты позволяют предположить, что кишечник плода подвергается воздействию чужеродных антигенов, но неизвестно, являются ли эти антигены микробными. Будущая работа будет отличать роль прямого воздействия микробов на плод от других механизмов иммунной стимуляции плода, таких как воздействие микробных лигандов, происходящих из кишечника матери.
Таким образом, мы описываем наличие бактериальной ДНК и жизнеспособных бактерий в утробной среде. Хотя сложные механизмы эволюционировали для защиты развивающегося плода млекопитающих от воздействия патогенов и токсинов, открытие бактериальных сигнатур в среде in utero у людей и мышей предполагает сосуществование усовершенствованных механизмов для контролируемого воздействия плода на материнскую микробиоту. Даже временное воздействие бактериальных антигенов в эмбриональной среде может обеспечить важные эволюционные преимущества для раннего иммунного созревания. Потенциальные последствия этих результатов для развития плода подчеркивают необходимость дальнейшей работы по полному выяснению механизмов, посредством которых плод вступает в контакт с материнской микробиотой.
 Данные исследования определенным образом согласуются с результатами, достигаемыми на практике врачами репродуктологами, работающими по методике профессора Осипова Г.А., где большой упор при подготовке к беременности (в т.ч. ЭКО), особенно после неудачных попыток, делается на микробиомный гомеостаз (коррекцию микробиома) будущей мамы, что в итоге приводит к положительным результатам.
Данные исследования определенным образом согласуются с результатами, достигаемыми на практике врачами репродуктологами, работающими по методике профессора Осипова Г.А., где большой упор при подготовке к беременности (в т.ч. ЭКО), особенно после неудачных попыток, делается на микробиомный гомеостаз (коррекцию микробиома) будущей мамы, что в итоге приводит к положительным результатам.
Литература:
К разделу: Формирование кишечной микробиоты ребенка
Источник: Patrick C. Seed., et. al.Fetal exposure to the maternal microbiota in humans and mice.JCI Insight. 2019 Oct 3;4 (19)
- 1. Olszak T, et al. Microbial exposure during early life has persistent effects on natural killer T cell function. Science. 2012;336(6080):489–493.
- 2. Gensollen T, Iyer SS, Kasper DL, Blumberg RS. How colonization by microbiota in early life shapes the immune system. Science. 2016;352(6285):539–544.
- 3. Cox LM, et al. Altering the intestinal microbiota during a critical developmental window has lasting metabolic consequences. Cell. 2014;158(4):705–721.
- 4. Dominguez-Bello MG, et al. Delivery mode shapes the acquisition and structure of the initial microbiota across multiple body habitats in newborns. Proc Natl Acad Sci U S A. 2010;107(26):11971–11975.
- 5. Azad MB, et al. Gut microbiota of healthy Canadian infants: profiles by mode of delivery and infant diet at 4 months. CMAJ. 2013;185(5):385–394.
- 6. Martin V, et al. Sharing of bacterial strains between breast milk and infant feces. J Hum Lact. 2012;28(1):36–44.
- 7. Aagaard K, Ma J, Antony KM, Ganu R, Petrosino J, Versalovic J. The placenta harbors a unique microbiome. Sci Transl Med. 2014;6(237):237ra65.
- 8. Collado MC, Rautava S, Aakko J, Isolauri E, Salminen S. Human gut colonisation may be initiated in utero by distinct microbial communities in the placenta and amniotic fluid. Sci Rep. 2016;6:23129.
- 9. Ardissone AN, et al. Meconium microbiome analysis identifies bacteria correlated with premature birth. PLoS One. 2014;9(3):e90784.
- 10. Moles L, et al. Bacterial diversity in meconium of preterm neonates and evolution of their fecal microbiota during the first month of life. PLoS One. 2013;8(6):e66986.
- 11. Satokari R, Gronroos T, Laitinen K, Salminen S, Isolauri E. Bifidobacterium and Lactobacillus DNA in the human placenta. Lett Appl Microbiol. 2009;48(1):8–12.Bearfield C, Davenport ES, Sivapathasundaram V, Allaker RP. Possible association between amniotic fluid micro-organism infection and microflora in the mouth. BJOG. 2002;109(5):527–533.
- 13. Rautava S, Collado MC, Salminen S, Isolauri E. Probiotics modulate host-microbe interaction in the placenta and fetal gut: a randomized, double-blind, placebo-controlled trial. Neonatology. 2012;102(3):178–184.
- 14. Jimenez E, et al. Isolation of commensal bacteria from umbilical cord blood of healthy neonates born by cesarean section. Curr Microbiol. 2005;51(4):270–274.
- 15. Perez PF, et al. Bacterial imprinting of the neonatal immune system: lessons from maternal cells? Pediatrics. 2007;119(3):e724–e732.
- 16. Lauder AP, et al. Comparison of placenta samples with contamination controls does not provide evidence for a distinct placenta microbiota. Microbiome. 2016;4(1):29.
- 17. Seferovic MD, et al. Visualization of microbes by 16S in situ hybridization in term and preterm placentas without intraamniotic infection. Am J Obstet Gynecol. 2019;221(2):146.e1–146.e23.
- 18. Martinez KA, et al. Bacterial DNA is present in the fetal intestine and overlaps with that in the placenta in mice. PLoS One. 2018;13(5):e0197439.
- 19. Salter SJ, et al. Reagent and laboratory contamination can critically impact sequence-based microbiome analyses. BMC Biol. 2014;12:87.
- 20. Leiby JS, et al. Lack of detection of a human placenta microbiome in samples from preterm and term deliveries. Microbiome. 2018;6(1):196.
- 21. Theis KR, et al. Does the human placenta delivered at term have a microbiota? Results of cultivation, quantitative real-time PCR, 16S rRNA gene sequencing, and metagenomics. Am J Obstet Gynecol. 2019;220(3):267.e1–267.e39.
- 22. de Goffau MC, et al. Human placenta has no microbiome but can contain potential pathogens. Nature. 2019;572(7769):329–334.
- 23. Stinson LF, Boyce MC, Payne MS, Keelan JA. The not-so-sterile womb: evidence that the human fetus is exposed to bacteria prior to birth. Front Microbiol. 2019;10:1124.
- 24. Stout MJ, et al. Identification of intracellular bacteria in the basal plate of the human placenta in term and preterm gestations. Am J Obstet Gynecol. 2013;208(3):226.e1–226.e7.
- 25. Callahan BJ, McMurdie PJ, Rosen MJ, Han AW, Johnson AJ, Holmes SP. DADA2: high-resolution sample inference from Illumina amplicon data. Nat Methods. 2016;13(7):581–583.
- 26. Knights D, et al. Bayesian community-wide culture-independent microbial source tracking. Nat Methods. 2011;8(9):761–763.
- 27. Balsara ZR, Ross SS, Dolber PC, Wiener JS, Tang Y, Seed PC. Enhanced susceptibility to urinary tract infection in the spinal cord-injured host with neurogenic bladder. Infect Immun. 2013;81(8):3018–3026.
- 28. Borghi E, et al. Antenatal microbial colonization of mammalian gut. Reprod Sci. 2019;26(8):1045–1053.
- 29. Li L, Mendis N, Trigui H, Oliver JD, Faucher SP. The importance of the viable but non-culturable state in human bacterial pathogens. Front Microbiol. 2014;5:258.
- 30. Perez-Munoz ME, Arrieta MC, Ramer-Tait AE, Walter J. A critical assessment of the “sterile womb” and “in utero colonization” hypotheses: implications for research on the pioneer infant microbiome. Microbiome. 2017;5(1):48.
- 31. Chu DM, Ma J, Prince AL, Antony KM, Seferovic MD, Aagaard KM. Maturation of the infant microbiome community structure and function across multiple body sites and in relation to mode of delivery. Nat Med. 2017;23(3):314 326.
- 32. Jimenez E, et al. Is meconium from healthy newborns actually sterile? Res Microbiol. 2008;159(3):187–193.
- 33. Fichorova RN, et al. Maternal microbe-specific modulation of inflammatory response in extremely low-gestational-age newborns. MBio. 2011;2(1):e00280–e00210.
- 34. van de Pavert SA, Mebius RE. New insights into the development of lymphoid tissues. Nat Rev Immunol. 2010;10(9):664–674.
- 35. Hoorweg K, et al. Functional differences between human NKp44(-) and NKp44(+) RORC(+) innate lymphoid cells. Front Immunol. 2012;3:72.
- 36. Mjosberg JM, et al. Human IL-25- and IL-33-responsive type 2 innate lymphoid cells are defined by expression of CRTH2 and CD161. Nat Immunol. 2011;12(11):1055–1062.
- 37. Gomez de Aguero M, et al. The maternal microbiota drives early postnatal innate immune development. Science. 2016;351(6279):1296–1302.
- 38. Li N, et al. Memory CD4+ T cells are generated in the human fetal intestine. Nat Immunol. 2019;20(3):301–312.
- 39. Caporaso JG, et al. Ultra-high-throughput microbial community analysis on the Illumina HiSeq and MiSeq platforms. ISME 2012;6(8):1621–1624.
- 40. Altschul SF, Gish W, Miller W, Myers EW, Lipman DJ. Basic local alignment search tool. J Mol Biol. 1990;215(3):403–410.
- 41. McMurdie PJ, Holmes S. phyloseq: an R package for reproducible interactive analysis and graphics of microbiome census data. PLoS One. 2013;8(4):e61217.
- 42. Paulson JN, Stine OC, Bravo HC, Pop M. Differential abundance analysis for microbial marker-gene surveys. Nat Methods. 2013;10(12):1200–1202.
- 43. Kelly BJ, et al. Power and sample-size estimation for microbiome studies using pairwise distances and PERMANOVA. Bioinformatics. 2015;31(15):2461–2468.
- 44. Chen J, et al. Associating microbiome composition with environmental covariates using generalized UniFrac distances. Bioinformatics. 2012;28(16):2106–2113