ООО "ПРОПИОНИКС"
| пн-пт с 09:00 до 18:00 | |
Лактобактерии Lactobacillus reuteri в онкологии
« НазадПРОБИОТИК Lactobacillus reuteri ПРИ ЛЕЧЕНИИ МЕЛАНОМЫ
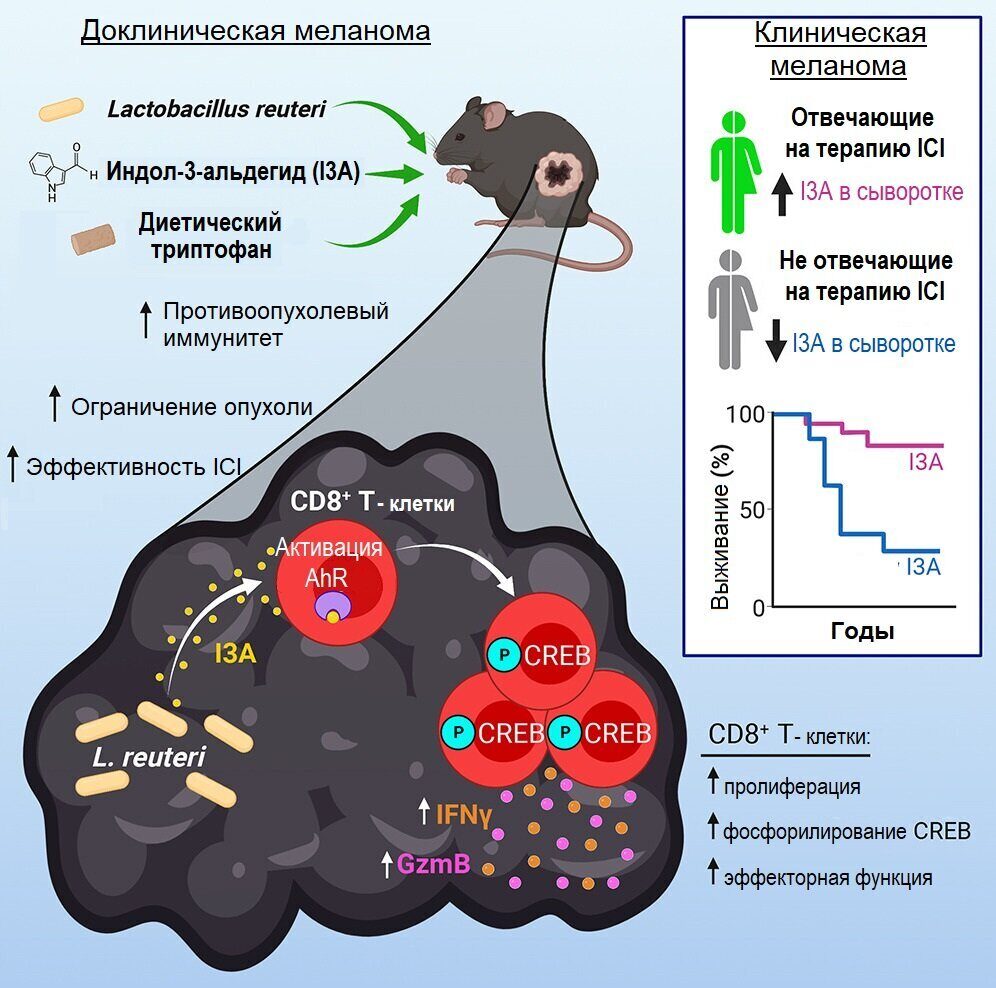
Метаболит пищевого триптофана, высвобождаемый внутриопухолевыми Lactobacillus reuteri, облегчает лечение ингибиторами иммунных контрольных точек
Основные моменты того, что было обнаружено:
- Бактерии Lactobacillus reuteri транслоцируются из кишечника в опухоль и стимулируют противоопухолевый иммунитет (опосредованный лимфоцитами Тс1), изнутри опухоли;
- Индол-3-альдегид (I3A), полученный из Lactobacillus reuteri, повышает эффективность лечения ингибиторами иммунных контрольных точек (ICI);
- Индол-3-альдегид управляет эффекторной функцией клеток Тс1 за счет индуцирования активности белка CREB, которая зависит от арилуглеводородного рецептора (AhR);
- Отмечена потенциальная роль I3A в стимулировании ответа на лечение ингибиторами иммунных контрольных точек и повышении выживаемости у пациентов с меланомой.
Обозначения:
- Tc1 – это эффекторный фенотип CD8+ Т-клеток (цитотоксических Т-лимфоцитов). Эффекторные фенотипы характеризуются высокой способностью по уничтожению клеток-мишеней и высокой продукцией цитокинов.
- Индол-3-альдегид (I3A) является метаболитом пищевого L-триптофана, который синтезируется желудочно-кишечными бактериями человека, в частности видами рода Lactobacillus.
- CREB – это транскрипционный фактор (белок), который связывается с определёнными последовательностями ДНК, регулируя (усиливая или ослабляя) транскрипцию соответствующих генов. CREB впервые был описан в 1987 г как цАМФ-зависимый транскрипционный фактор, регулирующий работу гена соматостатина.
Использование пробиотиков онкологическими больными растет, в том числе среди тех, кто проходит лечение ингибиторами иммунных контрольных точек (ICI). В настоящем исследовании выявлялось критическое перекрестное взаимодействие "микроб-хозяин" между высвобождаемым из пробиотика индол-3-альдегидом (являющимся агонистом арилуглеводородного рецептора (AhR)) и CD8+ Т-клетками (т.е. цитотоксическими Т-лимфоцитами) в микроокружении опухоли, которое (взаимодействие) потенциально усиливает противоопухолевый иммунитет и облегчает лечение ингибиторами иммунных контрольных точек (ICI) при доклинической меланоме.

Согласно новому исследованию, проведенному исследователями Университета Питтсбурга, у мышей с меланомой пробиотические бактерии перемещаются из кишечника и внедряются в опухоли, где они напрямую стимулируют иммунные клетки, чтобы сделать иммунотерапию рака более эффективной.
Кратко о меланоме
Меланома кожи является одной из наиболее распространенных злокачественных новообразований. Хотя в большинстве случаев у пациентов с локализованным заболеванием лечение ограничивается радикальным иссечением первичной опухоли, у некоторых пациентов развивается диссеминированное заболевание, у которых ключевое место в лечении занимает системная терапия. Понимание молекулярной биологии меланомы привело к введению новых методов системной терапии, таких как иммунотерапия и таргетная терапия, что способствовала снижению показателей смертности при диссеминированном заболевании. Несмотря на успехи в терапии в 2017 году диагностированы 87110 случаев меланомы, из которых 9730 привели к летальному исходу. Стоит отметить, что ежегодная заболеваемость и смертность от меланомы продолжает расти. В течение последних 25 лет темпы прироста ежегодной заболеваемости меланомой составляют почти 3% в год.
Меланома кожи развивается из меланоцитов, клеток, вырабатывающих пигмент. Множество исследований подтвердили связь между рисками возникновения меланомы кожи и воздействием ультрафиолетового (УФ) излучения. За последние два десятилетия знания о молекулярных механизмах и гетерогенности этого заболевания сильно расширились. В частности, с помощью расширенного секвенирования следующего поколения (Next-generation sequencing (NGS)) показано, что меланома обладает одним из самых высоких уровней соматических мутаций среди всех солидных опухолей. Преобладающими типом мутаций являются C/T или G/A замены, которые напрямую ассоциированы с УФ-индуцируемым повреждением ДНК. Таким образом подтверждается важная роль влияния окружающей среды на молекулярные механизмы развития данного заболевания. Спектр соматических аберраций также часто затрагивает гены, кодирующие молекулы сигнальных путей, что, вероятно, обуславливает патогенез меланомы кожи.
Опубликованное 6 апреля в Cell исследование показало, что Lactobacillus reuteri стимулирует Т-клетки, убивающие рак, выделяя соединение под названием индол-3-альдегид, или I3A. Когда исследователи давали мышам диету, богатую аминокислотой триптофан, которую бактерии превращают в I3A, иммунотерапевтические препараты оказывали более сильное влияние на ограничение размера опухоли и продление выживаемости. Полученные результаты закладывают основу для клинических испытаний, чтобы проверить, может ли лечение I3A или сочетание пробиотиков и диеты улучшить результаты у пациентов с меланомой, проходящих иммунотерапию.
"Мы знали, что кишечные микробы влияют на ответ на иммунотерапию, но все еще оставались большие вопросы о том, как они это делают и действуют ли они из кишечника или должны находиться в месте опухоли", - сказала старший автор Марлис Мейзель, доктор философии, доцент кафедры иммунологии Медицинской школы Pitt и член программы иммунологии рака и иммунотерапии (CIIP) в онкологическом центре Хиллмана UPMC. "Наше исследование является первым, показывающим, что бактерии, вводимые перорально, повышают эффективность иммунотерапии рака, перемещаясь в опухоли за пределами кишечника, где они непосредственно воздействуют на иммунные клетки в опухоли".
Микробиом кишечника является важным фактором, объясняющим, почему иммунотерапия, которая помогает иммунной системе организма распознавать и уничтожать раковые клетки, эффективна для некоторых пациентов, но не для других. Несколько недавних исследований также обнаружили связь между пробиотическими добавками и ответом на иммунотерапию у пациентов с меланомой.
Чтобы узнать больше, Мейзель и ее коллеги скармливали L. reuteri, бактерию, которая часто входит в состав коммерчески доступных пробиотиков, безмикробным мышам с меланомой. Они показали, что бактерии перемещаются из кишечника в опухоли, где они со временем укореняются и сохраняются.
По сравнению с контрольными мышами, которые не получали бактерии, у мышей, которым давали L. reuteri, было большее количество мощных CD8+Т клеток (цитотоксических Т-лимфоцитов) в месте опухоли, при этом опухоли уменьшались сильнее, а мыши жили дольше.
|
И эффекты L. reuteri не ограничивались меланомой. На мышиных моделях аденокарциномы, фибросаркомы и рака молочной железы бактерия аналогичным образом перемещалась в опухоли за пределами кишечника и подавляла рост рака.
|
Углубляясь, исследователи показали, что L. reuteri стимулирует иммунитет в опухолях путем выработки I3A, который активирует арилуглеводородный рецептор в CD8+ Т-клетках. Хотя этот рецептор обнаружен почти в каждой клетке организма, I3A действует специфически на киллерные клетки, повышая их способность убивать рак. Когда исследователи удалили рецептор в этих клетках, бактерии больше не вызывали противоопухолевый иммунитет, показывая, что эффект зависит от упомянутого клеточного рецептора в CD8+ Т-клетках. С использованием генетически модифицированного штамма бактерий L. reuteri, представители которого не вырабатываеют I3A, они продемонстрировали, что это соединение необходимо для воздействия бактерии на повышение противоопухолевого иммунитета и подавление опухоли.
"Хотя микробиом опухолей за пределами кишечника, включая меланому, был описан, концепция о том, что опухолевые микробы играют активную роль в обеспечении эффективности иммунотерапии рака, не была продемонстрирована", - сказала Мейзель. "И мы были удивлены, обнаружив, что I3A, высвобождаемый L. reuteri в опухоли, усиливает ответ на иммунотерапию, тогда как присутствие L. reuteri только в кишечнике было недостаточным для оказания противо-опухолевого эффекта".
Чтобы выяснить, может ли I3A играть роль в реакции человека на иммунотерапию, Мейзель объединилась с Дивакаром Даваром, доктором медицинских наук, доцентом медицины в Pitt и членом CIIP, и Хассаном Заруром, доктором медицинских наук, профессором медицины в Pitt и соруководителем CIIP. Ранее они обнаружили, что модификация кишечных бактерий с помощью фекальных трансплантатов улучшает ответ на иммунотерапию у пациентов с меланомой.
Анализируя образцы крови у пациентов с меланомой, проходящих лечение ингибиторами иммунных контрольных точек, исследователи обнаружили, что у пациентов, которые хорошо реагировали на иммунотерапию, были повышены уровни I3A. Более высокие уровни I3A до лечения также были связаны с высокими шансами на выживание.
"Основываясь на этих результатах, в будущем можно будет использовать уровни I3A в качестве биомаркера, чтобы предсказать, какие пациенты, скорее всего, ответят на иммунотерапию", - сказала Мейзель. "Еще одно направление, которое меня вдохновляет, - это разработка клинических испытаний для оценки того, может ли сочетание I3A с иммунотерапией улучшить результаты для пациентов".

Бактериям L. reuteri для выработки I3A необходим триптофан — аминокислота, содержащаяся в таких продуктах, как курица, соевые бобы, овсянка, орехи и семена. Когда мыши с меланомой ели диету, богатую триптофаном, опухоли росли медленнее, и мыши жили дольше, чем контрольные мыши, которых кормили идентичной диетой с низким содержанием триптофана. Диета с высоким содержанием триптофана также усиливала эффект иммунотерапии на уменьшающиеся опухоли.
Майзель предупредила, что необходимы дополнительные исследования, в том числе хорошо контролируемые клинические испытания, чтобы понять, может ли диета, богатая триптофаном, влиять на результаты у больных раком.
"Эта статья должна служить не рекомендацией, а началом: мы надеемся, что она послужит толчком для других исследований, которые изучают, как диета влияет на иммунитет и исходы рака", - сказала она. "Моя лаборатория заинтересована в понимании того, могут ли целостные подходы, такие как диета или изменения образа жизни, повысить эффективность иммунотерапии и других методов лечения рака. Я думаю, что это дает пациентам больше возможностей, поскольку они могут сами вносить эти изменения — конечно, после тщательного клинического рассмотрения — и иметь некоторый контроль над ходом лечения, а не полностью зависеть от системы здравоохранения".
ЧТО МЫ ЗНАЕМ СЕГОДНЯ О ПРОБИОТИЧЕСКОЙ БАКТЕРИИ LACTOBACILLUS REUTERI ?

На рис.: микрофотографии Lactobacillus reuteri
Прим. ред.: Лактобактерии реутери или ройтери (лат. Lactobacillus reuteri) — вид грамположительных анаэробных неспорообразующих молочнокислых бактерий. Lactobacillus reuteri обитают в толстой кишке человека и многих животных. Они также встречаются в ротовой полости, желудке, тонкой кишке, влагалище. В кишечнике человека Lactobacillus reuteri во время анаэробного роста способны выделять сильнодействующую антимикробную субстанцию широкого спектра, названную «реутерин», Реутерин может угнетать рост различных бактерий, включая Escherichia, Salmonella, Shigella, Proteus, Pseudomonas, Clostridium и Staphylococcus, а также дрожжи, грибы, протозоа и вирусы.
Современные молекулярно-генетические методы исследования, появившиеся в XXI в., полностью перевернули наши представления не только о микромире, но и о его влиянии на жизнь и здоровье макроорганизма. Идентификация кишечных бактерий и особенности их разных штаммов все больше расширяют наше понимание механизмов их влияния на соматическое и психическое здоровье человека. На сегодняшний день наиболее изученными являются различные штаммы лактобацилл. Известно, что род Lactobacillus включает примерно 90 видов с широким спектром биохимических и физиологических свойств. Одним из уникальных микроорганизмов семейства Lactobacillaceae является Lactobacillus reuteri, имеющая штаммы с разным механизмом действия. На сегодняшний день спектр возможностей использования разных штаммов Lactobacillus reuteri очень широкий. В данной статье рассмотрены клинические эффекты, связанные со штаммо-специфичностью Lactobacillus reuteri.
История существования микроорганизмов и человека насчитывает тысячелетия, история изучения человеком микроорганизмов – всего около 300 лет. Больше 100 лет тому назад пришло осоз- нание того, что микробы оказывают влияние на организм человека, на его здоровье. Современные молекулярно- генетические методы исследования, появившиеся в XXI в., полностью перевернули наши представления не только о микромире, но и о его влиянии на жизнь и здоровье макроорганизма. Самые доступные для изучения микроорганизмы находятся в кишечнике, и новые методы исследования позволяют изучать механизмы их влияния на соматическое и психическое здоровье человека.
С 2001 г. пробиотиками называют непатогенные живые микроорганизмы, которые при введении в организм человека в достаточном количестве приносят пользу организму хозяина [1]. В данном контексте очень важно понимание механизма воздействия пробиотика на организм, что постоянно изучается in vitro, ex vivo и моделируется на животных. Доказано, что разные микроорганизмы оказывают различное воздействие на органы и системы человека [2].
Таким образом, для того, чтобы повысить эффективность применения пробиотика, необходимо понимать механизм действия каждого конкретного штамма [3].
На сегодняшний день наиболее изученными являются различные штаммы лактобацилл. Известно, что род Lactobacillus включает примерно 90 видов с широким спектром биохимических и физиологических свойств. Более 100 лет назад лауреат Нобелевской премии И.И. Мечников (1845–1916) впервые предположил, что употребление молочнокислых бактерий (Lactobacillus delbrueckii subsp. bulgaricus) способно изменить активность микрофлоры желудочно-кишечного тракта (ЖКТ) и улучшить как физическое, так и психическое здоровье человека [4]. Он использовал данный штамм для создания кисломолочного продукта, который был назван «Мечниковской простоквашей» и использовался в терапии кишечных инфекций. Удивительно, но в течение многих веков бактерии, вырабатывающие молочную кислоту, применяли для улучшения сохранности продуктов. Хорошо известны различные рецепты квашения, основанные на выработке Lactobacillaceae молочной кислоты, что не только безопасно для здоровья человека, но и способствует улучшению пищеварения за счет особенностей метаболизма бактерий [5, 6].
Многочисленные исследования показали, что эффекты от применения разных штаммов микроорганизмов даже одного вида лактобацилл различаются [7]. В первую очередь влияние пробиотиков начали исследовать в терапии инфекционных заболеваний. Например, штамм Lactobacillus bulgaricus OLL1073R-1 повышает естественную активность клеток – натуральных киллеров (NK-клеток) и снижает тяжесть респираторных инфекций у пожилых людей [8]. С целью профилактики его используют в пищевых продуктах, в частности в йогуртах. Эффективность штамма Lactobacillus casei DN-114001 также изучена у пациентов с рекуррентными респираторными инфекциями. Показано, что длительное употребление пищевых продуктов, содержащих данный штамм, значимо снижает длительность и тяжесть течения вирусных респираторных инфекций даже в течение месяца после прекращения приема [9, 10]. Использование штамма Lactobacillus casei Shirota показало эффективность снижения тяжести и длительности воспаления при норовирусной инфекции у детей и взрослых [11–13]. Известны уникальные свойства Lactobacillus acidophilus, обладающей бактерицидными и вирусоцидными свойствами, особенно у иммунокомпрометированных пациентов [14]. Исследования влияния штамма Lactobacillus acidophilus La1 на подавление активности Helicobacter pylori показали его действие на основании данных уреазного теста, но значимого эффекта по данным биопсии не получено [15]. Полученные результаты позволили рекомендовать продолжить исследования по изучению возможностей других штаммов лактобацилл на ЖКТ. Например, у детей с коликами в составе кишечной микробиоты практически никогда не выявляются Lactobacillus acidophilus. Зато Lactobacillus brevis у них обнаруживались достоверно чаще, чем у здоровых детей. То есть важно не только общее снижение содержания лактобацилл, но и изменение соотношения их видов в составе кишечной микробиоты [16]. Штамм Lactobacillus rhamnosus GG обладает способностью ингибировать активность некоторых микроорганизмов, причем как грамположительных, так и грамотрицательных [17]. Для штамма Lactobacillus casei rhamnosus Lcr35 в экспериментах in vitro показана антимикробная активность на фоне снижения адгезии некоторых микроорганизмов к энтероцитам кишечника человека [18].
Lactobacillus reuteri в процессе своей жизнедеятельности путем ферментации образует короткоцепочечные жирные кислоты: уксусную и молочную. Процесс сопровождается выделением углекислого газа и этанола, что создает низкий рН в просвете кишечника.
Одним из уникальных микроорганизмов семейства Lactobacillaceae является Lactobacillus reuteri, имеющая штаммы с разными механизмами действия [10].

Рисунок 1. а. Lactobacillus reuteri – это неправильной формы с закругленными концами грамположительные палочки, которые располагаются и по отдельности, и парами, и небольшими кластерами. б. Lactobacillus reuteri (синий), связанные со слоем слизи (зеленый) биоптат 12-перстной кишки человека. Изображение, сделанное А. Уолшем и окрашенное С. Шюллер [22].
Lactobacillus reuteri была идентифицирована еще в 1960- х гг. [19]. До 1980 г. ее относили к виду Lactobacillus fermentum II биотипа, на данный момент она относится к самостоятельному виду и имеет несколько штаммов с различным влиянием на организм [20]. Первым в 1990 г. был выделен штамм Lactobacillus reuteri SD 2212 из грудного молока женщин Перу, живущих в Андах. В 1995 г. штамм был переведен в «Budapest Treaty Deposit» и получил код АТСС 55730. В 2007 г. из штамма АТСС 55730 были удалены две плазмиды, которые могли передавать резистентность к антибиотикам. После этого «вылеченный» штамм был депонирован в DSMZ (Deutsche Sammlung von Mikroorganismen und Zellkulturen) и получил обозначение L. reuteri DSM 17938 (Lactobacillus reuteri Protectis). Человеческий организм, в частности ЖКТ, начиная с периода рождения, является естественной средой обитания Lactobacillus reuteri [21] (рис. 1).
Наиболее изученные и чаще используемые штаммы перечислены в таблице 1.
В таблице представлена только часть исследований и возможностей использования Lactobacillus reuteri. Однако несмотря на различное штаммоспецифичное действие на организм человека, у них всех есть общие уникальные свойства.
Lactobacillus reuteri в процессе своей жизнедеятельности путем ферментации образует короткоцепочечные жирные кислоты (КЖК): уксусную и молочную. Процесс сопровождается выделением углекислого газа и этанола, что создает низкий рН в просвете кишечника [36]. В частности, уксусная кислота ингибирует активность дрожжей, грибов и некоторых видов микроорганизмов, а углекислый газ и перекись водорода оказывают противомикробное действие на патогенные микроорганизмы. Lactobacillus reuteri синтезирует несколько совершенно уникальных веществ, одним из которых является реутерин [37].
Таблица 1. Наиболее изученные штаммы Lactobacillus reuteri и их влияние при различной патологии
|
Lactobacillus reuteri ATCC 55730
|
Цель: оценить у пациентов с кистозным фиброзом (CF) влияние Lactobacillus reuteri на частоту обострений и инфекций со стороны респираторного тракта и ЖКТ. В исследовании учувствовал 61 пациент с муковисцидозом, без инфицирования микобактерией туберкулеза и Burkholderia cepacia (самостоятельный таксон из рода Pseudomonas). 30 пациентов получали Lactobacillus reuteri ATCC 55730 5 капель 1 р/сут, 31 – плацебо в течение 6 месяцев. Достоверно реже в основной группе отмечены эпизоды респираторных (отит) и кишечных инфекций [23]
|
|
Lactobacillus reuteri LTH 2584 и Lactobacillus reuteri LTH 5531
|
Используется в пищевой промышленности. В частности, в хлебобулочных изделиях – обладая противомикробной активностью, дольше сохраняет хлеб
|
|
Lactobacillus reuteri ATCC PTA 6475
|
Было обнаружено, что штамм Lactobacillus reuteri ATCC PTA 6475 повышает уровень тестостерона и окситоцина, а также качество кожи в исследованиях на животных
|
|
Lactobacillus reuteri, ATCC PTA 5289
|
Цель: влияние пробиотиков на кариесогенные биопленки. Проведена оценка 2-х пробиотических штаммов Lactobacillus reuteri, ATCC PTA 5289 и ATCC 55730 с кариесогенной точки зрения in vitro. Эти штаммы используются в коммерческих продуктах, предназначенных для гигиены полости рта. Отмечена эффективность подавления Streptococcus mutans у штамма ATCC PTA 5289. Штамм ATCC 55730 не показал положительного влияния [24, 25]
|
|
Lactobacillus reuteri ATCC PTA 4659
|
Метаанализ показал, что применение пробиотика Lactobacillus reuteri ATCC PTA 4659 уменьшает количество Streptococcus mutans к концу курса лечения [26]. Использование Lactobacillus reuteri в жевательной резинке положительно влияет на уровень секреторного иммуноглобулина А в полости рта и снижает уровень Streptococcus mutans [27]
|
|
Lactobacillus reuteri ATCC 23272
|
Этот продукт предназначен только для лабораторных исследований
|
|
Lactobacillus reuteri ATCC 55730
|
Цель: проверить, поддерживает ли Lactobacillus reuteri ATCC 55730 внутрижелудочную нагрузку H. pylori in vivo, уменьшает диспептические симптомы и влияет на уровень эрадикации после обычного лечения. В двойном слепом плацебо-контролируемом исследовании 40 пациентов – H. pylori-положительных субъектов получали L. reuteri 1 р/сут в течение 4 недель или плацебо. L. reuteri эффективно подавляет инфекцию H. pylori у людей и уменьшает возникновение диспептических симптомов [28]
|
|
Цель: определить эффективность добавок Lactobacillus reuteri при эрадикации H. pylori и в предотвращении связанных с антибиотиками побочных эффектов во время тройной терапии второй линии (левофлоксацин). 90 пациентов с H. рylori+ – 7 дней тройная терапия 2-й линии (эзомепразол, левофлоксацин и амоксициллин) с L. reuteri в течение 14 дней (группа 1) и без пробиотических добавок (группа 2). Результат оценен в течение 4 недель терапии и 6 недель после отмены. На уровень эрадикации значительное влияние оказали пробиотические добавки L. reuteri. Частота тошноты и диареи в группе 1 была значительно ниже, чем в группе 2. Заключение. У H. рylori+ субъектов L. reuteri повышает скорость эрадикации, уменьшая частоту появления наиболее распространенных побочных эффектов [29]
|
|
|
Lactobacillus reuteri DSMZ17648
|
Цель: оценка эффективности и безопасности 28-дневного приема инактивированных клеток пробиотических бактерий L. reuteri DSMZ17648 у пациентов с выявленным H. pylori, не имеющих абсолютных показаний для эрадикационной терапии. 28-дневная монотерапия L. reuteri DSMZ17648 дозозависимо снижает обсемененность слизистой оболочки желудка H. pylori. Независимо от кратности приема у четверти больных отмечено снижение степени воспаления по системе OLGA. К 28-му дню лечения наблюдалось снижение как доли больных с симптомами диспепсии, так и степени выраженности этих симптомов [30]
|
|
Lactobacillus reuteri DSMZ17648 Pylopass
|
Новый продукт Lactobacillus reuteri DSMZ17648 Pylopass предлагает альтернативный способ снижения колонизации H. pylori и повышения эффективности и безопасности эрадикационной схемы [31, 32]
|
|
Lactobacillus reuteri DSM 17938 – дочерний штамм, полученный из ATCC 55730 (незначительно повышенная устойчивость к кислоте и повышенный рост в лабораторных условиях)
|
Этот дочерний штамм был создан за счет интереса к двум генам, обнаруженным в ATCC 55730: устойчивость к тетрациклину и линкомицину. Плазмиды, передающие эти свойства, были удалены при создании DSM 17938 [33]
|
|
Lactobacillus reuteri NCIMB 30242
|
Цель: оценка эффективности снижения уровня холестерина при использовании йогурта, содержащего микрокапсулированную гидролазу желчной соли (BSH), активную Lactobacillus reuteri NCIMB 30242 2 р/сут в течение 6 недель у взрослых с гиперхолестеринемией. Исследование рандомизированное двойное слепое плацебо-контролируемое параллельное многоцентровое – 114 человек. Представленные результаты показывают, что потребление микрокапсулированного BSH-активного L. reuteri NCIMB 30242 йогурта является эффективным и безопасным для пациентов с гиперхолестеринемией. Эффективность применения микрокапсулированных BSH-активных L. reuteri NCIMB 30242 йогуртов превосходит эффективность традиционной пробиотической терапии [34]
|
|
Lactobacillus reuteri RC-14 + Lactobacillus rhamnosus GR-1
|
Цель: оценить эффективность пробиотика, содержащего Lactobacillus rhamnosus GR-1 и Lactobacillus reuteri RC-14, в дополнительной терапии к противомикробному лечению хронических вагинитов. 64 бразильских женщины принимали тинидазол и пробиотик или плацебо 4 недели. К 28-му дню приема основная группа имела более высокие уровни излечения, чем группа плацебо [35]
|
Реутерин, или ß-гидроксипропионовый альдегид (ß-ГПА), – молекула небольших размеров, обладающая уникальными противомикробными свойствами, провоцирующая окислительный стресс в определенных микроорганизмах. Реутерин синтезируется in vitro только при рН, температуре и анаэробных условиях, близких к условиям ЖКТ (рис. 2) [38]. In vivo в процессе метаболизма Lactobacillus reuteri синтезирует активный реутерин в толстой кишке при наличии достаточного количества глицерина, который является продуктом микробиологического брожения, переваривания жиров в просвете кишки, отторжения слизи и десквамированных эпителиальных клеток. Необходимо также учитывать эндогенный кишечный клиренс глицерина плазмы [36].
Реутерин в концентрациях 10–30 мг/мл способен ингибировать рост Escherichia, Salmonella, Shigella, Proteus, Pseudomonas, Clostridium, Staphylococcus, Streptococcus и H. pylori, а также ряда грибов и других микроорганизмов в течение 30–90 мин, не влияя на концентрацию лактобацилл в кишечнике.
Именно с продукцией реутерина связывают защитную функцию Lactobacillus reuteri при многочисленных заболеваниях. Реутерин в концентрациях 10–30 мг/мл способен ингибировать рост Escherichia, Salmonella, Shigella, Proteus, Pseudomonas, Clostridium, Staphylococcus, Streptococcus и H. pylori, а также ряда грибов и других микроорганизмов в течение 30–90 мин, не влияя на концентрацию лактобацилл в кишечнике [39, 40]. Известно, что все Lactobacillus reuteri продуцируют реутерин, но в разном количестве. Многие штаммы после длительного (более 5 сут) пребывания в ЖКТ значимо снижают синтез реутерина. На сегодняшний день в исследованиях на животных показано, что штамм Lactobacillus reuteri ATCC 55730 (DSM 17938) является наиболее активным и сохраняет способность к синтезу реутерина при неблагоприятном уровне рН в ЖКТ [41].
Еще один уникальный продукт жизнедеятельности Lactobacillus reuteri – реутерициклин, представляющий собой антибактериальный метаболит, который вырабатывается многими штаммами Lactobacillus reuteri. Однако наибольшей активностью обладает штамм LTH 2584, что позволяет активно использовать его в пищевой промышленности. Вещество реутерициклин представляет собой циклическую тетрамовую кислоту, активную в первую очередь относительно бактериальной мембраны грамположительных организмов. По сути, он обладает антибактериальной активностью, в связи с чем его относят к группе антибиотикоподобных веществ [42]. Важным свойством реутерициклина является его активность к метициллин-резистентному золотистому стафилококку (MRSA) и Сlostridium difficile.
Активно изучается противовоспалительное действие пробиотиков. Известно, что Lactobacillus reuteri в процессе своей жизнедеятельности активно вырабатывает гистамин, который является мощным противовоспалительным фактором. Наибольшей активностью обладает штамм ATCC 6475. Гистамин вырабатывается из L-гистидина и обладает противовоспалительным действием, включая подавление такого значимого провоспалительного цитокина, как ФНО-α [43]. Механизм ингибирования ФНО-α с помощью гистамина исследовали с использованием активированных Toll-подобных рецепторов 2 (TLR2) человеческих моноцитов. Lactobacillus reuteri штамм ATCC 6475 обладает тремя генами, потенциально участвующими в образовании гистамина [44]. Бактериальный гистамин подавляет продукцию ФНО-α посредством активации рецептора Н2. Гистамин из штамма ATCC 6475 Lactobacillus reuteri стимулирует повышение уровня ц-АМФ, ингибируя передачу сигналов митоген-активированной протеинкиназой (MAPK), и приводит к подавлению продукции ФНО-α с помощью транскрипционной регуляции. Таким образом, Lactobacillus reuteri способен превращать L-гистидин в иммунорегуляторный сигнал – гистамин, который подавляет продукцию провоспалительного интерлейкина ФНО-α. В исследованиях показано, что штамм Lactobacillus reuteri ATCC PTA 6475 эффективно подавляет продукцию человеческого ФНО-α с помощью липополисахарид-активированных моноцитов и макрофагов, полученных из первичных моноцитов, у детей с болезнью Крона [45]. Активирует апоптоз у больных миелоидным лейкозом путем модуляции сигналов NF-kappa B и MAPK [46]. Это открывает перспективы его использования в терапии серьезных аутоиммунных заболеваний. В некоторых работах показано, что пероральный прием штамма Lactobacillus reuteri ATCC PTA 6475 повышает уровень противовоспалительного цитокина IL-10, что в свою очередь каскадно влияет на снижение уровня провоспалительного цитокина IL-17 у пациентов с поражением кожи и слизистых ЖКТ [47]. В исследованиях на мышах кроме указанных эффектов дополнительно выявлены повышение уровня тестостерона и улучшение детородной функции [48]. Lactobacillus reuteri стимулируют продукцию масляной кислоты (КЖК), которая является источником энергии для энтероцитов и обладает противоопухолевыми свойствами (исследования проведены на животных).
Рисунок 2. Синтез реутерина
Перспективно изучение влияния метаболитов Lactobacillus reuteri на формирование аллергического иммунного ответа. Проведено рандомизированное плацебо-контролируемое исследование с пероральным приемом Lactobacillus reuteri ATCC 55730 (1 × 108 КОЕ) женщиной в течение 4-х недель перед родами и младенцем на первом году жизни с дальнейшим наблюдением в течение 7 лет. В исследование вошли 232 семьи с высоким риском развития аллергических процессов у будущих детей, закончили семилетнее исследование только 184 семьи. Доказано влияние Lactobacillus reuteri ATCC 55730 на частоту развития респираторных и кожных проявлений аллергии только у детей в раннем возрасте. К 7 годам частота распространенности бронхиальной астмы, аллергического ринита, атопического дерматита оказалась одинаковой в обеих группах. Это, вероятно, связано с воздействием других факторов риска аллергии в течение дальнейшей жизни детей школьного возраста [49]. Однако новые исследования показывают возможные перспективы применения пробиотика в терапии респираторных аллергических заболеваний. Влияние Lactobacillus reuteri ATCC 55730 на течение атопических состояний и проявления пищевой аллергии у детей раннего возраста доказано [50].
Доказано, что у младенцев с интенсивными коликами значимо снижен уровень лактобацилл при выраженном повышении титра колиформных газообразующих бактерий, что приводит к избыточному газообразованию.
У младенцев аллергия к белкам коровьего молока, как правило, начинается с кишечных колик. В основе колик, связанных с едой, примерно у 25% младенцев лежит именно этот вид аллергии. Семейный анамнез, клинические проявления колик, сроки их возникновения и связь с кормлением являются основными критериями постановки диагноза. Выраженные колики у младенцев нередко являются первым признаком гастроинтестинальной аллергии, а далее присоединяются кожные симптомы, у части детей – бронхообструкция, аллергический ринит, т. е. происходит реализация всего «атопического марша». В 2015 г. в British Medical Journal был опубликован клинический случай: установленной причиной симптомов, похожих на колики, был IgE-опосредованный вариант аллергии на белок коровьего молока у ребенка 3-го месяца жизни [16]. Колики наблюдаются у 55% младен- цев первых трех месяцев жизни, и причина их – не только пищевая аллергия на белки коровьего молока. Со стороны матери важными причинами развития колик являются стрессовые факторы, курение, вегетативные расстройства и мигрень. Со стороны младенца основными причинами развития колик, помимо пищевой аллергии, являются последствия церебральной ишемии, нарушения естественной микробной колонизации вследствие родов путем кесарева сечения, искусственное вскармливание и др. [51]. Нарушение взаимоотношения между бактериальными агентами в просвете кишки приводит к изменению среды на фоне измененного метаболизма кишечных бактерий и к развитию колик. Доказано, что у младенцев с интенсивными коликами значимо снижен уровень лактобацилл при выраженном повышении титра колиформных газообразующих бактерий, что приводит к избыточному газообразованию [52]. В сравнении со здоровыми малышами у детей с коликами уменьшено не только количество лактобацилл и бифидобактерий, но и разнообразие их штаммов [53].
Для младенцев грудное молоко – не только питательная субстанция, но и главный источник микроорганизмов для ЖКТ [51, 54]. Важной частью здоровой микрофлоры ЖКТ человека являются Lactobacillus. При естественных родах и грудном вскармливании происходит адекватная колонизация кишечника Lactobacillus, которые отвечают за механизмы иммунной защиты ребенка [21]. Особенности метаболизма Lactobacillus reuteri привели к активному изучению ее влияния на здоровье [36, 55]. Много работ свидетельствует о положительном влиянии Lactobacillus reuteri (DSM 17938/Protectis) на развитие кишечных колик у младенцев и cнижение риска возникновения аллергических реакций [56]. Доказано, что формирование собственного микробиома кишечника у младенцев протекает через «реакцию воспаления». Показано, что уровень фекального кальпротектина у здоровых детей раннего возраста значимо выше, чем у здоровых взрослых. У детей с интенсивными коликами уровень фекального кальпротектина в несколько раз превышает таковой в группе здоровых младенцев [16]. Белок кальпротектин является компонентом лейкоцитов (нейтрофилов, макрофагов, лимфоцитов), и чем он выше, тем о большей воспалительной реакции это говорит.
На сегодняшний день уровень фекального кальпротектина можно рассматривать в качестве надежного маркера кишечного воспаления и использовать для дифференциальной диагностики заболеваний толстой кишки [57–59].
Показано, что у детей на грудном вскармливании уровень фекального кальпротектина несколько ниже, чем у детей на искусственном вскармливании, что, вероятно, связано с особенным микробным спектром, иммунными клетками, гормонами грудного молока [51]. Однако, согласно другим исследованиям, у детей на грудном вскармливании уровень фекального кальпротектина выше, чем у детей на искусственном вскармливании [16]. Различия, вероятно, связаны с неоднородностью исследованных групп.
Lactobacillus reuteri успешно используется не только в пищевой промышленности как средство профилактики различных заболеваний ЖКТ, но и в виде биологически активной добавки в терапии кишечных колик у младенцев [60]. В исследовании, проведенном профессором Ф. Савино, показано, что уровень фекального кальпротектина после приема 5 капель препарата, содержащего Lactobacillus reuteri Protectis (АТСС 55730), снижался через 3 недели приема, особенно значимо у детей с тяжелыми формами кишечных колик [16]. Клинически это проявлялось в уменьшении длительности и интенсивности плача младенцев, улучшении сна и психологического климата в семье. Однако на сегодняшний день появились работы, в которых говорится, что эффективность Lactobacillus reuteri в терапии колик у младенцев низкая и недостаточно доказанная [61].
В Мельбурне (Австралия) проведено двойное слепое плацебо-контролированное исследование, результаты которого представлены в 2014 г. В исследование вошли 167 детей с угрозой развития атопии в анамнезе. Из них 85 малышей получали препарат на основе Lactobacillus reuteri Protectis DSM 17398, 82 – плацебо. Через 1 месяц по данным оценки дневников, которые вели родители детей, в основной группе длительность плача и уменьшения ночного сна была меньше на 46–47 мин, чем в группе плацебо. По данным лабораторных исследований (микробное разнообразие, E. coli, уровень фекального кальпротектина), различий между обеими группами не выявлено через 1 и 6 месяцев. Комплаентность составила 82% в основной группе и 80% – в группе плацебо. По данным авторов, через 1 месяц после отмены Lactobacillus reuteri Protectis DSM 17398 из кишечника не выделялись. Осложнений при приеме пробиотика не отмечено. Учитывая полученные данные, авторы сделали вывод, что эффективность применения пробиотика Lactobacillus reuteri DSM 17398 не доказана в этом исследовании. Однако в 2017 г. опубликован метаанализ, составленный по базам PubMed, Medline, Embase, the Cumulative Index to Nursing и Allied Health Literature, the Database of Abstracts of Reviews of Effects, Cochranе. В анализе приняли участие 345 детей с клиникой колик, 174 из которых принимали пробиотик Lactobacillus reuteri DSM 17398 и 171 – плацебо. Эффективность терапии оценивалась на 21-й день терапии. По данным анализа показана эффективность терапии колик у младенцев именно штаммом Lactobacillus reuteri DSM 17398 [62]. На сегодняшний день использование штамма Lactobacillus reuteri Protectis (DSM 17398) доказало свою эффективность в терапии колик у младенцев как клинически, так и лабораторно при исследовании фекального кальпротектина. В этих, на первый взгляд противоречивых, данных о влиянии Lactobacillus reuteri на эффективность терапии колик у младенцев есть существенный недостаток. Как известно, разные штаммы Lactobacillus reuteri также имеют разные клинические и метаболические эффекты. Учитывая такие разные данные двух представленных работ, можно предположить, что недостаточный эффект связан с различием базовой микробиоты кишечника младенцев в Мельбурне и младенцев в Европе. Еще одним недостатком австралийской работы является недостаточно четкий отбор групп младенцев, без достаточного учета риска аллергии и вскармливания.
По данным анализа показана эффективность терапии колик у младенцев именно штаммом Lactobacillus reuteri DSM 17398
Использование штамма Lactobacillus reuteri Protectis (АТСС 55730) доказало свою эффективность в уменьшении воспаления у детей с язвенным колитом. Пробиотик использовался в виде клизм у детей с дистальным язвенным колитом в течение 8 недель. Контроль эффективности проводился путем клинической, эндоскопической, гистологической оценки и измерения уровней активности цитокинов в слизистой прямой кишки (IL-10, IL-1β, TNFα и IL-8), которые оценивали в начале и в конце исследования [63]. Эффективное снижение воспаления по всем проведенным показателям и по индексу активности воспаления Mayo доказало положительное влияние штамма Lactobacillus reuteri Protectis (АТСС 55730).
В заключение еще раз хочется напомнить о том, что важно не просто назначение любого пробиотика, а правильный выбор штамма для конкретной терапевтической или профилактической задачи. Вероятно, дальнейшие исследования раскроют новые тайны такой многогранной Lactobacillus reuteri.
- Роль микробиома в развитии и терапии рака
- Лактобациллы могут нарушить иммунитет при протоковой аденокарциноме поджелудочной железы
- Кишечная микробиота, ожирение, болезнь Крона и колоректальный рак
- Пропионовокислые бактерии в профилактике и лечении рака
- Бифидобактерии могут быть эффективными в предотвращении колоректального рака
- Микробиом, нервная система и канцерогенез
- Микробиом кишечника и рак предстательной железы
- Изменения микробиоты и рак поджелудочной железы
- Гепатоцеллюлярная карцинома и кишечный микробиом
- Кишечный микробиом при раке легких
- Нацеливание на микробные биопленки кишечника - ключ к сдерживанию канцерогенеза толстой кишки?
- Микробиом и рак. Есть ли связь?
- Микробиом кишечника направляет иммунную систему на борьбу с раком
- Снижение риска гепатокарциномы с помощью лакто- и пропионовокислых бактерий
- Связь между бактериями в кишечнике и раком печени
- Кишечные бактерии и их метаболиты: кто является ответчиком за колоректальный рак?
- Кишечная микрофлора и иммунотерапия рака
- Кишечные бактерии могут усилить иммунотерапию для борьбы с различными формами рака
- Индолпропионовая кислота, метаболит микробиома, как цитостатик при раке молочной железы
- Рак молочной железы и его связь с микробиотой
- Кишечный микробиом и рак молочной железы
- Выдвинута "бактериальная" гипотеза рака молочной железы
- Макро-, микронутриенты и пробиотики в иммунотерапии рака
- Дисбиоз толстой кишки может вызывать колоректальный рак
- Потребление пищевых волокон с пробиотическим йогуртом снижает риск рака легких
- Хорошие бактерии помогают иммунотерапии рака
- Бактерии могут способствовать противораковому иммунному ответу
- Пребиотические свойства грецких орехов и влияние на канцерогенез толстого кишечника
- Стрептококк gallolyticus вызывает рак толстой кишки
- Правильная комбинация диеты и бактерий ограничивает прогрессирование рака
- Рак толстой кишки вызван бактериями и клеточным стрессом
- Противоопухолевая активность кишечных бактерий
- Клюква в борьбе колоректальным раком
- Бактерии в кишечнике могут препятствовать химиотерапии
- Пробиотики в лечении рака толстой кишки
- Бактерии играют важную роль в лечении рака толстого кишечника
- Дисбактериоз, НЭРБ и аденокарцинома пищевода
- Взаимосвязь ПНЖК и микробиоты и ее роль в канцерогенезе
- Микробиом при остром лимфобластном лейкозе у детей
- Нацеливание на микробиоту в здравоохранительной практике
- Добавление бактерии Helicobacter hepaticus в микробиом кишечника повышает противоопухолевый иммунитет у мышей
Литература по доп. материалу:
- Food and Agricultural Organization of the United Nations and World Health Organization. Joint FAO/WHO working group report on drafting guidelines for the evaluation of probiotics in food. Food and Agricultural Organization of the United Nations, 2002.
- Reid G, Jass J, Sebulsky MT, McCormick JK. Potential uses of probiotics in clinical practice. Clinical Microbiology Reviews, 2003, 16(4): 658- 720.
- Hill C, Guarner F, Reid G, Gibson GR, Merenstein DJ, Pot B, Morelli L, Canani RB, Flint HJ, Salminen S, Calder PC, Sanders ME. The International Scientific Association for Probiotics and Prebiotics consensus statement on the scope and appropriate use of the term probiotic. Nat. Rev. Gastroenterol. Hepatol., 2014 June, 11(8). doi: 10.1038/nrgastro.2014.66.
- Мечников И.И. Этюды о природе человека. 4-е изд. М., 1913.
- Valeur N, Engel P et al. Colonization and immuno-modulation by Lactobacillus reuteri ATCC 55730 in the human gastrointestinal tract. Appl Environ Microbiol, 2004, 70: 1176- 1181.
- Tubelius P, Stan V, Zachrisson A. Increasing workplace healthiness with the probiotic Lactobacillus reuteri: A randomized, doubleblind placebo-controlled study. Environmental Health, 2005, 4: 25.
- Sanders ME. New York Academy of Sciences, “Science & The City” podcast about probiotics. Free podcast (“More Than A Yogurt Cup”) available at NYAS website and on iTunes (search “Science & The City”), 2010.
- Sanders ME. Considerations for Use of Probiotic Bacteria to Modulate Human Health. J Nutr, 2000, 130: 3845-3905.
- Wold AE. Immune effects of probiotics. Scand J Nutr, 2001, 45: 76-85.
- Christensen HR et al. Lactobacilli differentially modulate expression of cytokines and maturation surface markers in murine dendritic cells. J Immunol, 2002, 168: 171-178.
- Nagata S, Asahara T, Ohta T, Yamada T, Kondo S, Bian L, Wang C, Yamashiro Y, Nomoto K. British Journal of Nutrition, 2011, 106: 549-556 doi: 10.1017/S000711451100064X.
- King S, Glanville J, Sanders ME, Fitzgerald A, Varley D. Effectiveness of probiotics on the duration of illness in healthy children and adults who develop common acute respiratory infectious conditions: a systematic review and meta-analysis. Br J Nutr, 2014, 112: 41-54.
- Shida K, Sato T, Iizuka R, Hoshi R, Watanabe O, Igarashi T, Miyazaki K, Nanno M, Ishikawa F. Daily intake of fermented milk with Lactobacillus casei strain Shirota reduces the incidence and duration of upper respiratory tract infections in healthy middle-aged office workers. European Journal of Nutrition, 2017 February, 56(Issue 1): 45-53.
- Klebanoff SJ, Coombs RW. Viricidal effect of Lactobacillus acidophilus on human immunodeficiency virus type 1: possible role in hetero-sexual transmission. J. Exp. Med., 1991, 174(1): 289-292.
- Michetti P, Dorta G, Wiesel PH et al. Effect of whey based culture supernatant of Lactobacillus acidophilus (johnsonii) La1 on Helicobacter pylori infection in humans. Digestion, 1999, 60: 203.
- Савино Ф., Захаровa И.Н. Диагностика и лечение младенческих кишечных колик: мнение экcпертов ESPGHAN. Consilium Medicum. Педиатрия (Прил.)., 2016, 2: 10-17.
- Silva M, Jacobus NV, Deneke C, Gorbach SL. Antimicrobial substance from a human Lactobacillus strain. Antimicrob Agents Chemother, 1987, 31: 1231.
- Forestier C, De Champs C, Vatoux C, Joly B. Probiotic activities of Lactobacillus casei rham- nosus: in vitro adhe rence to intestinal cells and antimicrobial properties. Res Microbiol, 2001, 152: 167-173.
- Sarra PG, Dellaglio F, Bottazzi V. Genetic heterogeneity among Lactobacillus acidophilus strains. Syst. Appl. Microbiol., 1985, 6: 86-99.
- Kandler O et al. Lactobacillus reuteri sp. nov. a new species of heterofermentative lactobacilli. Zbl Bakt Hyg Abt Orig, 1980, 1: 264-269.
- Reuter G. The Lactobacillus and Bifidobacterium Microflora of the Human Intestine: Composition and Succession. Curr Issues Intest Microbiol, 2001, 2: 43-53.
- Schuller S. How Lactobacillus reuteri protects against enteropathogenic E. coli infection in the human gut. March 4, 2016.
- Di Nardo G, Oliva S, Menichella A, Pistelli R, De Biase RV, Patriarchi F, Cucchiara S, Stronati L. Lactobacillus reuteri ATCC55730 in Cystic Fibrosis. Journal of Pediatric Gastroenterology and Nutrition, 2014 Jan, 58(1): 81–86. doi: 10.1097/MPG.0000000000000187, PMID: 24121143 Issn Print: 0277-2116 Publication Date: 2014/01/01.
- Jalasvuori H, Haukioja A, Tenovuo J. Probiotic Lactobacillus reuteri strains ATCC PTA 5289 and ATCC 55730 differ in their cariogenic properties in vitro. Archives of Oral Biology, 2012, 57(12): 1633-8.
- Gruner D, Paris S, Schwendicke F. Probiotics for managing caries and periodontitis: systematic review and metaanalysis. J Dent, 2016, 48: 16-25.
- Sinkiewicz G et al. Influence of dietary supplementation with Lactobacillus reuteri on the oral flora of healthy subjects. Swed Dent J., 2010, 34: 197–206.
- Ericson D, Hamberg K, Bratthall G, Sinkiewicz-Enggren G, Ljunggren L. Salivary IgA response to probiotic bacteria and mutans streptococci after the use of chewing gum containing Lactobacillus reuteri. Pathog Dis, 2013, 68: 82-87.
- Francavilla R, Castellaneta S, Lionetti E, Miniello VL. Inhibition of Helicobacter pylori Infection in Humans by Lactobacillus reuteri ATCC 55730 and Effect on Eradication Therapy: A Pilot Study. Helicobacter, 2008 May, 13(2): 127-34. doi: 10.1111/j.1523-5378.2008.00593.x.
- Ojetti V, Bruno G, Ainora ME, Gigante G, Rizzo G, Roccarina D, Gasbarrini A. Impact of Lactobacillus reuteri Supplementation on Anti- Helicobacter pylori Levofloxacin-Based Second-Line Therapy. Gastroenterology Research and Practice, 2012, 2012: ID 740381. doi: 10.1155/2012/740381.
- Бордин Д.С., Войнован И.Н., Хомерики С.Г., Янова О.Б., Ким В.А., Быстровская Е.В., Шишин К.В. Эффективность и безопасность Lactobacillus reuteri DSMZ17648 у инфицированных Helicobacter pylori. Лечащий врач, 2016, 05.
- Mehling H, Busjahn A. Non-Viable Lactobacillus reuteri DSMZ 17648 (Pylopass™) as a New Approach to Helicobacter pylori Control in Humans. Nutrients, 2013, 5(8): 3062-3073.
- Плотникова Е.Ю., Грачева Т.Ю. Роль пробиоти- ков в лечении Hр-ассоциированных заболеваний. Медицинский совет, 2017, 5: 80-84.
- Montesi A et al. Molecular and microbiological analysis of caecal microbiota in rats fed with diets supplemented either with prebiotics or pro- biotics. Int J Food Microbiol, 2005, 98(3): 281-289.
- Jones ML et al. Cholesterol-lowering efficacy of a microencapsulated bile salt hydrolase-active Lactobacillus reuteri NCIMB 30242 yoghurt formulation in hypercholesterolaemic adults. The British journal of nutrition, 2011 November, 107(10): 1505-1513.
- Martinez RCR, Franceschini SA, Patta MC, Quintana SM, Gomes BC, De Martinis ECP, Reid G. Improved cure of bacterial vaginosis with single dose of tinidazole (2 g), Lactobacillus rhamnosus GR-1, and Lactobacillus reuteri RC-14: a randomized, double-blind, placebocontrolled trial. Canadian Journal of Microbiology, 2009, 55(2): 133-138. https: //doi. org/10.1139/W08-102.
- Casas IA, Dobrogosz WJ. Validation of the probiotic concept: Lactobacillus reuteri confers broad-spectrum protection against disease in humans and animals. Microbial Ecol Health Dis, 2000, 12(4): 247-285.
- Афонюшкин В.Н., Филипенко М.Л., Ширшова А.Н., Маслов О. Г. Механизмы биологической активности системы Lactobacillus reuteri – реутерин. Проблемы. Суждения, 2013, 4: 70-75.
- Chung TC, Axelsson L, Lindgren SE, Dobrogosz WJ. Studies in vitro9. Reuterin synthesis of Lactobacillus reuteri. MicrobEcol Health Dis, 1989, 2: 137-140.
- Axelsson LT, Chung TC, Dobrogosz WJ, Lindgren SE. Production of a broad spectrum antimicrobial substance by Lactobacillus reuteri. MicrobEcol Health Dis, 1989, 2: 131-136.
- Hidetoshim et al. Comparative genome analysis of Lactobacillus reuteri and Lactobacillus fermentum reveal a genomic island for reuterin and cobalamin production. Published online 16.05.2008.
- Kiňová HS, Bilková A. Isolation and identifica- tion of new lactobacilli from goatling stomach and investigation of reuterin production in Lactobacillus reuteri strains. Folia Microbiologica, 2013 January, 58(Issue 1): 33-38.
- Höltzel A et al. The First Low Molecular Weight Antibiotic from Lactic Acid Bacteria: Reutericyclin, a New Tetramic Acid. Angew Chem Int Ed Engl. 2000.
- Spinler JK, Sontakke A, Hollister E, Venable SF, Oh PL. From prediction to function using evolutionary genomics: Human-specific ecotypes of Lactobacillus reuterihave diverse probiotic functions. Genome Biology and Evolution, 2014 June, 19, doi: 10.1093/gbe/evu137.
- Thomas CM, Hong T, van Pijkeren JP, Hemarajata P, Trinh DV, Hu W, Britton RA, Kalkum M, Versalovic J. Histamine Derived from Probiotic Lactobacillus reuteri Suppresses TNF via Modulation of PKA and ERK Signaling. PLoS ONE, 2012, 7(2): e31951
- Lin YP, Thibodeaux CH, Pena JA, Ferry GD, Versalovic J. Probiotic Lactobacillus reuteri suppress proinflammatory cytokines via c-Jun. Inflamm Bowel Dis, 2008, 14: 1068-1083.
- Iyer C, Kosters A, Sethi G, Kunnumakkara AB, Aggarwal BB et al. Probiotic Lactobacillus reuteri promotes TNF-induced apoptosis in human myeloid leukemia-derived cells by modulation of NF-kappaB and MAPK signalling. Cell Microbiol, 2008, 10: 1442-1452.
- Castiblanco GA, Yucel-Lindberg T, Roos S, Twetman S. Effect of Lactobacillus reuteri on Cell Viability and PGE2 Production in Human Gingival Fibroblasts. Probiotics and Antimicrobial Proteins, 2017, 9(Issue 3): 278-283.
- Ohlsson C et al. Probiotics protect mice from ovariectomy-induced cortical bone loss. PLoS One, 2014.
- Abrahamsson TR, Jakobsson T, Björkstén B, Oldaeus G, Jenmalm MC. No effect of probiotics on respiratory allergies: a seven-year follow-up of a randomized controlled trial in infancy. Pediatric Allergy and Immunology, 2013 September, 24(Issue 6): 556-561.
- Cirillo A, Boccia E, Cirillo Ar, Scotto G, Maiella D, De Crescenzo G, Leone G, Grimaldi S, Cirillo Ag. Effectiveness of Lactobacillus reuteri in patients with atopic dermatitis and cow milk intolerance. Preliminary study. Presented at the Italian Society for Clinical Allergy and Immunology (SIAIC) Congress, Rome, Italy, 4-7 May 2005. Abstract P-08.
- Kheirkhah D, Sharif MR, Rezaei MH, Ardakani AT. Relationship between type of nutrition and infantile colic. International Journal of Medical Research & Health Sciences, 2016, 5(12): 261-264.
- Pärtty A, Kalliomäki M, Endo A, Salminen S, Isolauri E. Compositional Development of Bifidobacterium and Lactobacillus Microbiota Is Linked with Crying and Fussing in Early Infancy. PLoS One, 2012, 7(3): e32495.
- De Weerth C, Fuentes S, Puylaert P, De Vos WM. Intestinal Microbiota of Infants With Colic: Development and Specific Signatures. Pediatrics, 2013, 131: e550. Originally published online January 14, 2013, DOI: 10.1542/peds.2012-1449.
- Mackie RI, Sghir A, Gaskins HR. Developmental microbial ecology of the neonatal gastrointestinal tract. Am J Clin Nutr, 1999, 69: 1035S-1045S.
- Weizman Z, Asli G, Alsheikh A. Effect of a probiotic infantformula on infections in child care centers: comparison of twoprobiotic agents. Pediatrics, 2005, 115: 5-9.
- Kalliomäki M, Salminen S, Arvilommi H, Kero P, KoskinenP, Isolauri E. Probiotics in the primary prevention of atopicdisease: a randomised placebo-controlled trial. Lancet, 2001, 357: 1076-1079.
- Roseth AG, Fagerhol MK, Aadland E et al. Assessment of the neutrophil dominating protein calprotectin in feces. A methodologic study. Scand. J. Gastroenterol., 1992, 27: 793-798.
- Roseth AG, Schmidt PN, Fagerhol MK. Correlation between faecal excretion of indium<111<labelled granulocytes and calprotectin, a granulocyte marker protein, in patients with inflammatory bowel disease. Scand. J. Gastroenterol., 1999, 34: 50-54.
- Татьянина О.Ф., Потапов А.С., Намазова Л.С., Цимбалова Е.Г., Кучеренко А.Г., Лохматов М.М. Фекальный кальпротектин в неинвазивной диагностике воспалительных заболеваний кишечника у детей. Педиатрическая фармакология, 2008, 5(3): 46-51.
- Szajewska H, Gyrczuk E, Horvath A. Lactobacillus reuteri DSM 17938 for the management of infantile colic in breastfed infants: a randomized, double-blind, placebo-controlled trial. J Pediatr, 2013, 162: 257–6.
- Sung V, Hiscock H, Tang M, Mensah FK, Monica L, Satzkeresearch C, Heine RG, Stock A, Barrprofessor RG, Wake M. Treating infant colic with the probiotic Lactobacillus reuteri: dou- bleblind, placebo controlled randomised trial. BMJ, 2014, 348: g2107. doi: 10.1136/bmj.g2107 (Published April 2014).
- Indrio F, Mentula S, Partty A, Tancredi D. Lactobacillus reuteri to Treat Infant Colic: A Metaanalysis. Pediatrics, 2018 Jan, 141(1). Department of Pediatrics, University of California Davis Health System, Sacramento, California.
- Oliva S, Di Nardo G, Ferrari F, Mallardo S, Rossi P, Patrizi G, Cucchiara S, Stronati L. Randomised clinical trial: the effectiveness of Lactobacillus reuteri ATCC 55730 rectal enema in children with active distal ulcerative colitis. Aliment Pharmacol Ther, 2012 Feb, 35(3): 327-334. doi: 10.1111/ j.1365-2036.2011.04939.x. Epub 2011 Dec 8.
Комментарии
Комментариев пока нет