ООО "ПРОПИОНИКС"
| пн-пт с 09:00 до 18:00 | |
Роль микробиоты тонкого кишечника
Новая роль микробиоты тонкого кишечника в здоровье и заболеваниях человека
СОДЕРЖАНИЕ:
Примечание редактора: Тонкий кишечник (ТК) - самый важный орган пищеварительного тракта. Ведь главная функция тонкого кишечника – это всасывание полезных веществ, а толстого – калообразование. В ТК всасываются: глюкоза, аминокислоты, глицерин, жирные кислоты, минеральные соли, вода (в виде изотонических растворов) и витамины. Тонкий кишечник также играет важную роль в функционировании иммунной системы, поскольку он выступает в качестве барьера для различных агентов (бактерий, токсинов и т.д.), которые вместе с поглощенными питательными веществами могут проникать из внешнего мира внутрь человеческого организма...
Микробиота кишечника человека продолжает демонстрировать свою важность для здоровья и болезней человека, во многом благодаря бесчисленному количеству исследований, изучающих фекальную микробиоту. Однако в этих исследованиях недостаточно представлена роль микробных сообществ, обнаруженных в тонком кишечнике, что, учитывая важную функцию тонкого кишечника в поглощении питательных веществ, метаболизме хозяина и иммунитете, вероятно, весьма актуально. В обзоре представлен обзор методов изучения состава и динамики микробиоты в различных отделах тонкой кишки. Кроме того, в нем исследуется роль микробиоты в обеспечении физиологических функций тонкой кишки и обсуждается, как нарушение микробного равновесия может повлиять на развитие заболевания. Имеющиеся данные свидетельствуют о том, что микробиота тонкого кишечника является важным регулятором здоровья человека, и ее характеристика может значительно продвинуть исследования микробиома кишечника и разработку новых методов диагностики и лечения заболеваний.
Введение
Триллионы бактерий, грибов, вирусов и архей обитают в нашем желудочно-кишечном тракте (ЖКТ). Эти микроорганизмы, более известные как микробиота кишечника, имеют решающее значение для здоровья человека, а нарушения в их предпочтительном составе связаны с широким спектром патологий.1 Поэтому неудивительно, что микробиота кишечника продолжает привлекать внимание как научных исследователей, так и представителей индустрии здравоохранения.
Несмотря на то, что для всего ЖКТ используется один общий термин «микробиота кишечника», в кишечнике человека на всем его протяжении обитают различные сообщества микробов - микробные ниши.2 По мере проведения все большего числа исследований становится все более очевидным, что эти микробные ниши устанавливают уникальные взаимодействия с хозяином и выполняют различные функции в организме. Это важно, учитывая, что большинство исследований, посвященных изучению микробиоты кишечника, основываются на образцах кала, которые более точно представляют микробиоту дистального отдела кишечника (толстой кишки), а функции, выполняемые микробами в проксимальных отделах кишечного тракта, остаются практически неизвестными. Учитывая, что тонкий кишечник (ТК) необходим для усвоения питательных веществ из рациона, а также является обширным и благоприятным местом для важных иммунных, метаболических, нейронных и эндокринных реакций, весьма правдоподобно, что его микробиота имеет столь же фундаментальное значение.
Действительно, начинают появляться доказательства того, что микробиота ТК играет ключевую роль в здоровье и болезни человека. В этом обзоре рассматриваются проблемы и современные методы изучения микробиоты ТК, то, что известно о ее составе и временной динамике, и, наконец, ее потенциальная роль в метаболизме, иммунитете и заболеваниях хозяина.
ИЗУЧЕНИЕ МИКРОБИОМА ТОНКОГО КИШЕЧНИКА ЧЕЛОВЕКА

Изучение микробиома ТК у человека представляет собой сложную задачу из-за его труднодоступности и высокой временной динамики. В настоящее время во многих исследованиях для получения образцов ТК используются обычные эндоскопии, резекции кишечника или исследования жертв внезапной смерти.3-9 Эти методы отбора образцов, однако, имеют ряд ограничений (табл. 1). Во-первых, эндоскопические процедуры являются инвазивными, могут выполняться только специалистами и поэтому не всегда оправданы для лиц без симптомов, связанных с ЖКТ. Во-вторых, лаваж, который предшествует эндоскопическим процедурам, может нарушить эндогенную среду кишечника, что вносит погрешность. В-третьих, эти методы подвержены загрязнению из других частей кишечного тракта во время извлечения образца. Кроме того, трудно получить продольные образцы. И наконец, материал, полученный в ходе этих процедур, представляет собой преимущественно биопсию слизистой оболочки. Анализ слизисто-ассоциированной микробиоты ограничивается секвенированием 16S рРНК, которое не может конкурировать с более высоким таксономическим и функциональным разрешением, достигаемым с помощью метагеномного «дробного» секвенирования. Лица с илеостомой или подвздошно-анальным анастомозом представляют собой уникальную когорту, в которой можно неинвазивно и продольно брать образцы просвета ТК, обходя многие из вышеупомянутых проблем. 10-12 Однако ограниченное число пациентов и контекст заболевания создают альтернативные проблемы. Измененная анатомия и возможная подверженность содержимого просвета внешней среде также являются предполагаемыми ограничениями; однако, согласно результатам недавно опубликованного исследования Yilmaz et al., микробное содержимое кишечника не подвергается значительным нарушениям в результате илеостомии13. Дополнительные методы взятия проб микробиоты ТК включают в себя новый метод, описанный Dreskin et al. для одновременного взятия проб проксимального люминального и слизистого микробиома кишечника без риска контаминации, который обычно связан с обычными эндоскопиями.14 Однако взятие проб с помощью этого метода ограничено проксимальным отделом ТК и по-прежнему является инвазивным. Аналогичные ограничения также применимы к 4-просветному катетеру с несколькими аспирационными портами, описанному в исследовании Seekatz et al.15 Также предпринимаются попытки разработать эндоскопические капсулы, позволяющие неинвазивно и без загрязнения брать пробы на всем протяжении ЖКТ, и получены некоторые многообещающие результаты.16,17
Таблица 1. Исследования микробиоты ТК и их методы.
|
Когорта исследования
|
Метод отбора проб
|
Место в ТК
|
Микробный анализ
|
Ограничения
|
Основные идентифици-рованные виды
|
Ref
|
|
54-летняя женщина, ранее отличавшаяся хорошим здоровьем
|
Биопсия слизистой оболочки при колоноскопии и с помощью кишечной биопсийной капсулы Watson
|
Тощая кишка
Дистальный отдел подвздошной кишки
|
Секвенирование ампликонов гена
16S рРНК
|
- Склонность к загрязнению
- Предварительное промывание - Инвазивность - Низкое таксономическое разрешение - Небольшой размер выборки |
Тощая кишка: Streptococcus &
Proteobacteria
Дистальный отдел подвздошной кишки: Bacteroidetes &
Clostridium кластеров
XIVa и IV
|
[3]
|
|
26 пациентов, перенесших экстренную операцию, требующую резекции толстой кишки
|
Биопсия слизистой оболочки после резекции толстой кишки
|
Терминальная
часть
подвздошной
кишки
|
Секвенирование ампликонов гена
16S рРНК
|
- Низкое таксономическое разрешение
- Инвазивность - Сложная интерпретация |
Bacteroides, Bifidobacteria,
Lactobacilli & Enterobacteria
|
[4]
|
|
3 скончавшихся пожилых человека
|
Кишечное содержимое, полученное во время вскрытия
|
Тощая кишка
Подвздошная
кишка
|
Секвенирование ампликонов гена
16S рРНК
|
- Небольшой размер выборки
- Невозможно изучать динамику микробов. |
Streptococcus,
Lactobacillus, ‘Gammaproteobacteria’, группа Enterococcus & группа Bacteroides
|
[5]
|
|
5 людей с илеостомой & 4 здоровых человека
|
Стоки при илеостомии
Кишечная жидкость при использовании интралюминального назо-илеального катетера
|
(Дистальный) ТК
Тощая кишка, подвздошная
кишка и терминальный
отдел
|
Филогенетический микрочип HITChip, специфичный для желудочно-кишечного тракта
|
- Измененная анатомия желудочно-кишечного тракта (образцы илеостомы)
- Потенциальное воздействие внешней среды (образцы илеостомы) - Контекст заболевания (ВЗК) (образцы илеостомы) - Риск заражения (назо-подвздошный катетер) - Инвазивный (назо-подвздошный катетер) |
Streptococcus, E.coli, Clostridium, организмы с высоким содержанием G+C
|
[12]
|
|
5 участников, прошедших колоноскопию
|
Биопсия слизистой оболочки при колоноскопии
|
Терминальная
часть подвздошной кишки
|
Метагеномное дробное секвенирование
|
- Небольшой размер выборки
- Предварительная обработка лаважа - Большое количество человеческих чтений, низкий микробный охват |
B. vulgatus, B. thetaiotaomicron,
B. uniformis &
B. caccae
|
[6]
|
|
Пациенты с заболеваниями
печени, проходящие эзофагогастро-дуоденоскопию
|
Дуоденальная аспирация и биопсия во время верхней эндоскопии - новая техника, подробно описанная авторами
|
Двенадцати-перстная кишка
|
Секвенирование ампликонов гена
16S рРНК
|
- Ограничено двенадцатиперстной кишкой
- Инвазивность - Контекст заболевания |
Аспират: Veillonella, Streptococcus,
Prevotella
Биоптат: Streptococcus, S24–7 (Muribaculaceae), Parabacteroides |
[14]
|
|
49 человек
с илеостомой
9 человек с илеоанальным
мешком
|
Илеостомический сток
Фекальный образец
|
ТК
|
Метагеномное дробное секвенирование
|
- Контекст заболевания (ВЗК)
- Измененная анатомия ЖКТ (образцы для илеостомии) - Потенциальное воздействие внешней среды (образцы для илеостомии) - Ограниченная популяция образцов |
Streptococcus, Escherichia, Veillonella, Blautia, Actinomyces, Enterococcus, Lactobacillus
|
[10]
|
|
27 пациентов,
перенесших
радикальную
цистэктомию
|
Лабораторное культивирование образцов, полученных путем протирания тампоном слизистой оболочки подвздошной кишки на расстоянии 25 см от илеоцекального клапана
|
Подвздошная
кишка
|
MALDI-TOF/биотипирование
|
- Ограничено культивируемыми микробами
- Контекст заболевания может влиять на состав микроорганизмов |
стрептококки
семейства viridans,
виды Candida, Actinomyces, Rothia & Lactobacillus
|
[7]
|
|
8 здоровых людей, подвергшихся
голоданию
|
Пероральная интубация с помощью четырехпросветного катетера с несколькими аспирационными отверстиями - несколько образцов
|
Двенадцати-перстная кишка
Тощая кишка
|
Секвенирование ампликонов гена
16S рРНК
|
- Инвазивность
- Риск загрязнения - Ограничивается проксимальным отделом ТК |
Firmicutes, Proteobacteria & Bacteroidetes (двенадцатиперстная кишка)
|
[15]
|
|
Исследование
ex vivo на ТК ягненка
|
Новый капсульный робот, разработанный авторами: берет образцы слизистой оболочки и содержимого кишечника
|
ТК
|
/
|
- Все еще находится в разработке
|
/
|
[16]
|
|
27 пациентов,
перенесших радикальную цистэктомию
с отведением мочи
|
Образец клапана получают путем протирания тампоном стенки просвета примерно на 25 см проксимальнее илеоцекальной области во время операции.
|
Дистальный отдел подвздошной кишки
|
Секвенирование ампликонов гена
16S рРНК
плюс целевое секвенирование альтернативных генов, когда это необходимо для более высокого таксономического разрешения
|
- Контекст заболевания может оказывать влияние на микробный состав
|
Streptococcus, Granulicatella, Actinomyces, Solobacterium, Rothia, Gemella & TM7(G-1)
|
[8]
|
|
6 пациентов,
перенесших операцию желудочного
шунтирования
|
Образец, полученный из клапана путем протирания тампоном стенки просвета во время операции
|
Тощая кишка
|
Секвенирование ампликонов гена
16S рРНК
|
- Контекст заболевания может оказывать влияние на микробный состав
|
Streptococcus, Granulicatella,
комплекс Schaalia odontolytica complex & Gemella
|
[9]
|
|
7 человек
с илеостомой
|
Илеостомические стоки
|
ТК
|
HITChip на основе последователь-ностей гена SSU рРНК
|
- Контекст заболевания (ВЗК)
- Измененная анатомия ЖКТ - Потенциальное воздействие внешней среды - Ограниченная популяция выборки |
Streptococcus,
Veillonella & кластер I Clostridium
|
[11]
|
|
30 человек
с илеостомой
|
Илеостомические стоки
|
ТК
|
Секвенирование ампликонов гена 16S рРНК
|
- Контекст заболевания (колоректальный рак)
- Измененная анатомия ЖКТ - Потенциальное воздействие внешней среды - Ограниченная популяция выборки |
Lactobacillus, Clostridium, Streptococcus,
Enterococcus, & Veillonella |
[13]
|
Сокращения: ТК - тонкий кишечник.
NB: Включает исследования, в которых также были взяты пробы толстой кишки; однако подробно описаны только методы, использованные для изучения ТК, и соответствующие результаты.
Помимо взятия проб, были предприняты усилия по моделированию ТК как in vitro, так и in vivo. Потенциально перспективной моделью in vitro для подвздошной кишки человека и ее микробиоты является одноступенчатый ферментер, разработанный Stolaki et al. 18 Исследования моделей in vivo в основном проводились на мышах. Хотя известны различия между ЖКТ мышей и человека и микробным составом - например, длина тракта по отношению к размеру вида19 - эти исследования позволили функционально изучить роль микробиоты ЖКТ как в здоровом, так и в специфическом для заболевания контексте. В будущих исследованиях можно также рассмотреть возможность использования моделей поросят, поскольку анатомически и физиологически ЖКТ этих животных более схож с ЖКТ человека, чем у мышей.20
В целом, несмотря на то, что важность микробиоты ЖКТ находит все больше сторонников, и в изучении ее состава и функций наблюдается прогресс, все еще существует необходимость в разработке унифицированных методов, которые бы точно моделировали ее динамику.
Состав и временная динамика микробиоты тонкого кишечника человека
Несмотря на различия в изучаемых популяциях, методах отбора проб и аналитических методиках, которые усложняют процесс характеристики микробиоты ТК человека, исследования, как представляется, согласуются с основными характеристиками этой микробной экосистемы.
Плотность микроорганизмов в микробиоте ТК оценивается в 103 - 108 клеток/г, с возрастающим градиентом от низкой плотности в двенадцатиперстной кишке (103) до высокой плотности в терминальной части подвздошной кишки (108), которая все еще примерно в 4 раза ниже, чем в толстой кишке.21 Этот возрастающий градиент отражает более благоприятные условия - более низкую кислотность и более низкие концентрации пищеварительных ферментов, панкреатической, желудочной и желчной кислот - в терминальном отделе подвздошной кишки по сравнению с двенадцатиперстной и тощей кишкой.2,22 Микробная экосистема в ТК также в целом менее разнообразна и более динамична, чем в толстой кишке11; в какой степени, зависит от расположения вдоль ТК и от того, описывается ли люминальное (т.е. в просвете - ред.) содержимое или мукоза-ассоциированная микробиота (т.е. в слизи - ред.). Например, разнообразие слизистой оболочки в подвздошной и толстой кишке существенно не отличается, тогда как при сравнении люминального содержимого эта разница более выражена.23 Пространственный и временной анализ микробиоты ТК также показал, что меж- и внутрииндивидуальная вариабельность дуоденальных аспиратов выше, чем у аспиратов из тощей кишки, что позволяет предположить, что дуоденальное микробное сообщество (т.е. сообщество в 12-перстной кишке - ред.) более динамично.15
Микробиота ТК состоит преимущественно из факультативных анаэробов и аэробных бактерий, в частности, принадлежащих к типам Firmicutes, Proteobacteria и Actinobacteria.3,5,8,10,12,14,15 Это контрастирует с облигатными анаэробами, преобладающими в толстой кишке.3,5,12 На родовом уровне бактерии с высоким содержанием в ТК включают Lactobacillus, Veillonella, Streptococcus, Gemella, Actinomyces и E. coli.3,5,8,10,12,14,15 Более высокая доля Bacteroidetes, а именно Prevotella, и более низкая доля Firmicutes (Streptococcus, Veillonella, Gemella и Lactobacillaceae) обнаружена в двенадцатиперстной кишке по сравнению с тощей кишкой.15 Бактериальный состав в подвздошной и тощей кишке сопоставим, несмотря на более высокую бактериальную нагрузку в подвздошной кишке.2,8,9 Только отдельные виды бактерий, включая Clostridium, Lactobacillus и Enterococcus, способны проникать в слой слизи на эпителии или прикрепляться к нему и использовать слизь в качестве источника энергии, что объясняет некоторые различия между бактериальными сообществами в просвете и слизистой оболочке.24,25
На состав микробиоты ТК также влияют внешние факторы. Двумя важными факторами являются курение и терапия ингибиторами протонной помпы (ИПП).26,27 Было показано, что курение нарушает микробиоту слизистой оболочки двенадцатиперстной кишки и ее просвета.26,27 В просвете у курильщиков снижается численность Prevotellaceae, Neisseriaceae и Porphyromonadaceae, тогда как численность Enterobacteriaceae и Lactobacillaceae увеличивается. Отказ от курения в конечном итоге восстанавливает микробный состав до такой степени, что он становится более близким к составу никогда не курившего человека. ИПП - часто назначаемые препараты для профилактики и лечения заболеваний, связанных с желудочной кислотой, таких как язва желудка и рефлюксные заболевания. ИПП подавляют секрецию желудочной кислоты, повышая рН желудка и позволяя определенным микробам процветать и колонизировать более дистальные отделы желудочно-кишечного тракта. В исследовании Lim et al. было показано, что прием ИПП вызывает дисбиоз микробиоты двенадцатиперстной кишки, характеризующийся увеличением количества Akkermansia muciniphila и Porphyromonas endodontalis и уменьшением количества видов Enterococcaceae, Coprococcus, Enterobacteriaceae и Synergistes.27
Быстрые изменения в доступности питательных веществ также являются фактором, формирующим состав микробиоты в тонкой кишке. Используя содержимое люминальной стомы (илео- и колостомы) 114 пациентов с ВЗК или колоректальным раком, Yilmaz и коллеги продемонстрировали динамические изменения биомассы и штаммового профиля бактерий, полученных из илеостомы, после приема пищи, что контрастировало с более стабильной микробиотой образцов, полученных из колостомы.13
Наконец, следует отметить, что к микробиоте ТК относятся также вирусы, археи и грибы. Хотя эти микробы практически не изучены в контексте ТК, они все больше изучаются в контексте фекального микробиома и оказываются очень важными не только для формирования микробиоты, но и для поддержания здоровья и развития заболеваний.28,29 Используя илеостомическую жидкость и свежие резекции толстой кишки пациентов без ВЗК и с ВЗК для изучения защитного или провоспалительного потенциала вирусов, обитающих в кишечнике, исследование Adiliaghdam и коллег дает нам возможность впервые взглянуть на виром ТК.30 Результаты показали, что семейства эукариотических вирусов, присутствующих в ТК, включают Anelloviridae, Papillomaviridae, Picornaviridae и Virgaviridae, а семейства бактериофагов - Caudovirales, Siphoviridae, Myoviridae и Podoviridae. Однако необходимы дополнительные исследования для подтверждения этих результатов и определения, если таковое существует, основного вирома ТК. Учитывая скудость исследований, описывающих небактериальный компонент микробиоты ТК, в дальнейшем в этом обзоре основное внимание будет уделено бактериому ТК.
МИКРОБИОТА ТОНКОГО КИШЕЧНИКА И РЕГУЛЯЦИЯ МЕТАБОЛИЗМА ХОЗЯИНА
Помимо того, что ТК является основным местом поглощения питательных веществ и энергии из рациона, он выполняет ряд других функций, критически важных для метаболизма хозяина. В соответствии с этим, исследования, изучающие потенциальную функцию микробиоты ТК с помощью вычислительного анализа, выявили обогащение бактериальных путей, связанных с энергетическим и простым углеводным обменом.10,12 В этом разделе мы обсудим роль ТК в регуляции метаболизма хозяина и новые данные, которые возлагают эту роль на микробиоту ТК (рис. 1).
 |
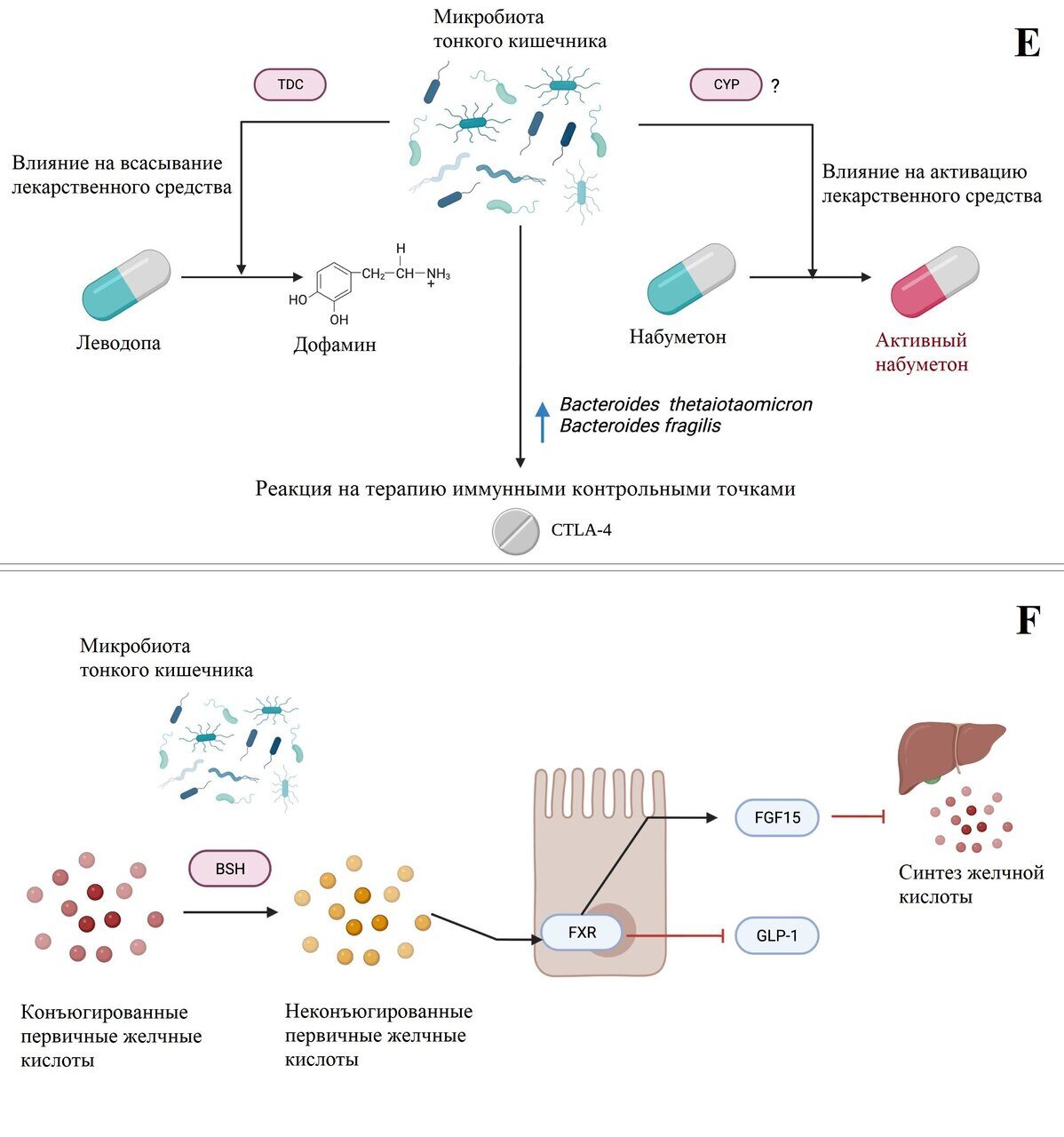 |
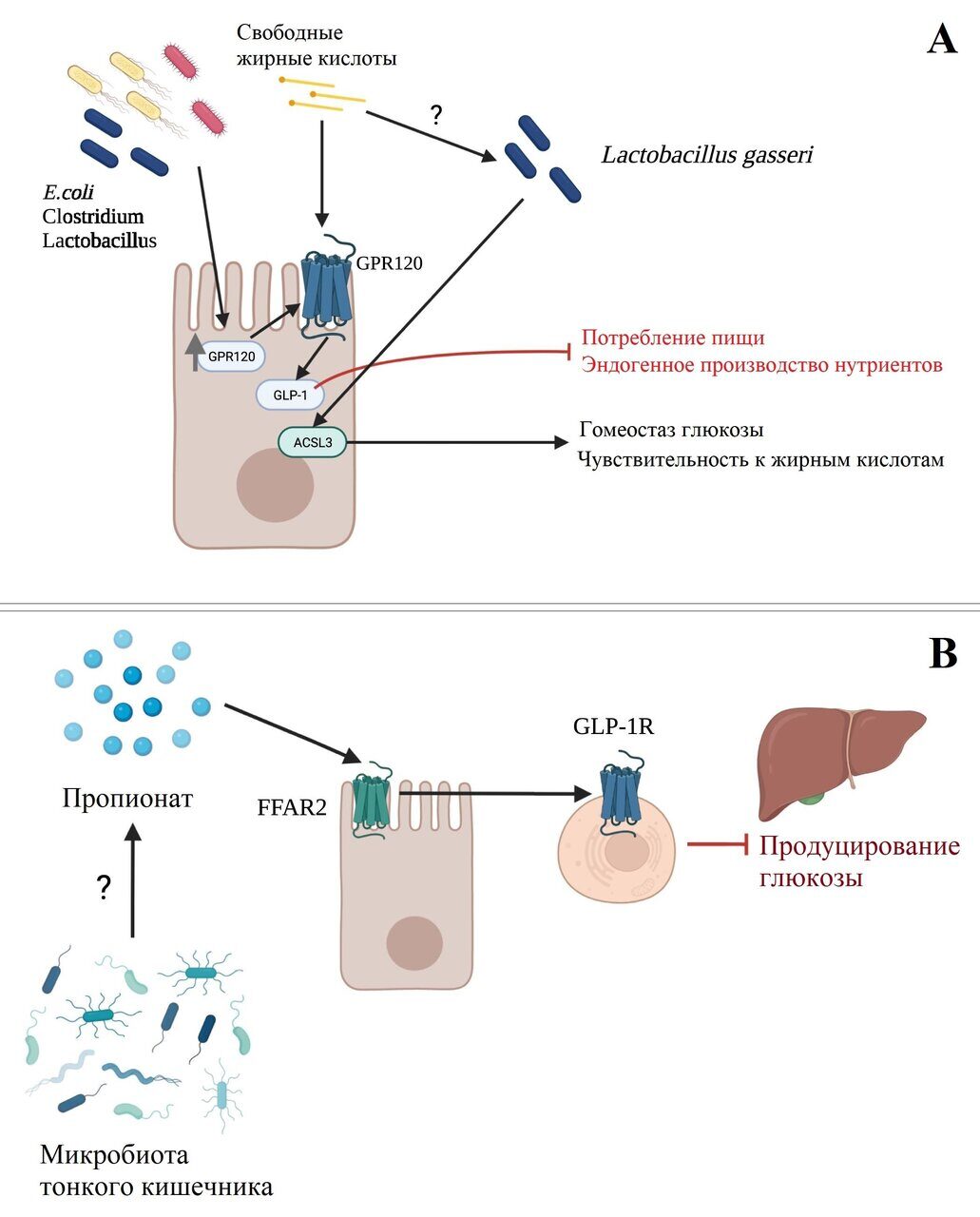
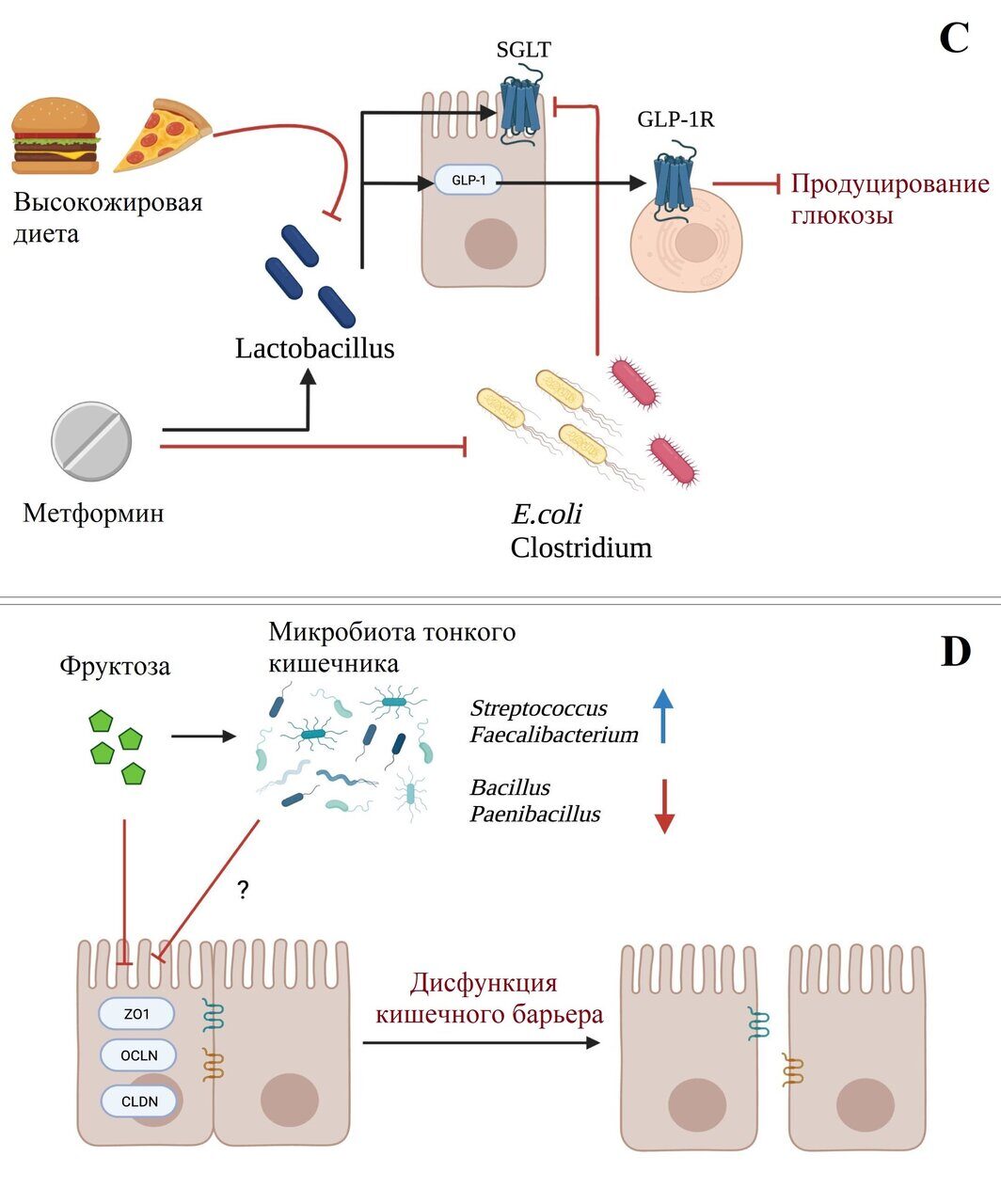
Рисунок 1. Взаимодействие микробов тонкого кишечника и метаболизм хозяина.
Примечание: схематический обзор концепций, обсуждаемых в данном обзоре, касающихся роли микробиоты тонкого кишечника в метаболизме хозяина. (a-c) определение питательных веществ и энергетический гомеостаз: a) бактерии ТК могут влиять на энергетический гомеостаз и определение питательных веществ через регуляцию экспрессии GPR120, который, активируясь свободными жирными кислотами, стимулирует секрецию GLP-1. Секреция GLP-1, в свою очередь, приводит к снижению потребления энергии и эндогенного производства питательных веществ. Бактерии ТК могут также способствовать восприятию питательных веществ, содержащих жирные кислоты, и гомеостазу глюкозы путем увеличения экспрессии белка ACSL3 и последующей сигнализации, приводящей к снижению производства глюкозы. b) Предполагается, что бактерии ТК могут производить короткоцепочечные жирные кислоты (представленные на рисунке пропионатом), которые через FFAR2/GLP-1R-зависимый путь регулируют метаболизм глюкозы. c) Диета с высоким содержанием жиров и метформин модулируют микробиоту ТК противоположным образом, что влияет на метаболизм глюкозы. (d) Метаболизм фруктозы: чрезмерное потребление фруктозы ассоциируется со снижением экспрессии генов плотного соединения (ZO1, OCLN, CLDN), возможно, опосредованным (индуцированным фруктозой) микробным дисбиозом ТК, что приводит к дисфункции кишечного барьера. (e) Взаимодействие с лекарственными препаратами: микробы ТК участвуют в биодоступности некоторых рецептурных препаратов через активность эндогенных ферментов (TDC и CYP, соответственно). Аналогичным образом, количество бактерий ТК связано с эффективностью противоопухолевого лечения, а именно иммунотерапии с использованием анти-CTLA-4-антител. (f) Метаболизм желчных кислот: микробы ТК регулируют пулы желчных кислот в тонком кишечнике посредством активности фермента BSH, который, в свою очередь, регулирует синтез желчных кислот и хозяин/липидный метаболизм. Рисунок создан с помощью программы BioRender (biorender.com).
Чувствительность к питательным веществам и глюкозно-энергетический гомеостаз
ТК обладает способностью воспринимать питательные вещества и вызывать как местные, так и системные, гормональные и неврологические реакции в организме, которые регулируют гомеостаз энергии и глюкозы31. По всему кишечному эпителию, но особое значение здесь имеет ТК, расположены гормонсекретирующие энтероэндокринные клетки (EECs)32, которые при воздействии питательных веществ выделяют различные кишечные пептиды, включая гормоны глюкагоноподобный пептид 1 (GLP-1) и холецистокинин (CCK)33,34. Эти секреторные продукты, в свою очередь, действуют эндокринным или паракринным образом через метаболическую ось кишечник-мозг и/или портальную вагально-мозговую ось для предотвращения постпрандиального избытка энергии путем подавления потребления пищи и производства эндогенных питательных веществ.31,35-37
Tahmasebi и коллеги смогли показать, что введение пропионата в подвздошную кишку крыс активирует расположенный в слизистой подвздошной кишки рецептор свободных жирных кислот 2 (FFAR2).38 Активация FFAR2, в свою очередь, запускает сигнал отрицательной обратной связи, который через нейронную сеть, зависящую от рецептора GLP-1, приводит к снижению печеночного производства глюкозы. Пропионат - это короткоцепочечная жирная кислота (SCFAs), образующаяся в результате бактериальной ферментации пищевых волокон. Хотя SCFAs в основном синтезируются бактериями в толстом кишечнике39 , эти результаты позволяют предположить, что жирные кислоты, получаемые из подвздошной кишки, важны для высвобождения GLP-1 и гомеостаза глюкозы. В соответствии с этим было продемонстрировано, что супернатант бактерий, обычно присутствующих в ТК (Lactobacillus, Enterococcus, E. coli), повышает экспрессию рецептора 120 (GPR120), связанного с G-белками, который при стимуляции свободными жирными кислотами способствует секреции GLP-140. Кроме того, изменения состава микробиоты верхнего отдела ТК у крыс в результате диеты с высоким содержанием жиров (HFD) были связаны с нарушением чувствительности верхнего отдела ТК к питательным веществам жирных кислот и гомеостаза глюкозы, что было обусловлено вызвано снижением экспрессии длинноцепочечной жирной ацил-КоА-синтазы (ACSL3)34. Прямая трансплантация микробиоты верхнего отдела ТК, полученной от крыс, которых кормили обычной диетой, а также введение пробиотика L. gasseri обращает этот фенотип вспять, предполагая, что бактерии ТК имеют решающее значение для ACSL3-зависимой регуляции глюкорегуляторных путей чувствительности к жирным кислотам (рис. 1 a-b).
Роль микробов в восприятии питательных веществ в ТК подтверждается исследованием Бауэра (Bauer et al.), в котором изучался эффект снижения выработки глюкозы диабетическим препаратом метформином.41 Ранее было показано, что метформин увеличивает секрецию GLP-1 в верхнем отделе ТК, стимулирует экспрессию натрий-глюкозного котранспортера-1 (SGLT1), регулирующего секрецию GLP-1, и снижает выработку глюкозы через нейронную ось, зависящую от GLP-1R, при введении в верхний отдел ТК42-45. Кроме того, прием метформина был связан с изменениями дистальной микробиоты кишечника46, что побудило Бауэра и коллег исследовать, играют ли изменения микробиоты верхнего отдела ТК также роль в глюкорегуляторных эффектах лечения метформином.41 Во-первых, они подтвердили, что у крыс, получавших HFD в течение всего 3 дней, нарушалась чувствительность к глюкозе в верхнем отделе ТК, что характеризовалось снижением экспрессии SGLT1 и секреции GLP-1. Затем они показали, что трансплантация микробиоты верхнего отдела ТК от крыс-доноров, получавших метформин, что привело к увеличению количества Lactobacillus salivarius и уменьшению количества Clostridium и E. coli в верхнем отделе ТК, смогла восстановить дефектное восприятие глюкозы у крыс, получавших HFD. В совокупности эти результаты позволяют предположить, что глюкорегуляторные эффекты метформина частично обусловлены изменениями состава микробиоты верхнего отдела ТК, включая обращение вспять вызванного HFD снижения количества видов Lactobacillus (рис. 1c).
Циркадные ритмы и метаболизм
Циркадные ритмы - это физические, психические и поведенческие изменения, происходящие в организме, которые непрерывно циклически повторяются в течение 24 часов.47 Циркадные ритмы управляются 24-часовыми внутренними часами - циркадными часами, которые находятся почти во всех клетках организма и, в свою очередь, управляются регулируемыми светом «центральными» циркадными часами, расположенными в мозге.48 На «периферические» циркадные часы могут влиять и другие факторы, помимо центральных часов, например, время приема пищи, которое регулирует циркадные ритмы печени и кишечника.49,50 Циркадные ритмы важны для поддержания функций клеток и органов, а их дисрегуляция может привести к дисфункции органов. Связь между циркадными ритмами и метаболизмом хозяина хорошо известна47 , и ТК и его микробиота, по-видимому, играют здесь важную роль51. Предыдущие исследования показали, что суточные колебания состава кишечных микроорганизмов необходимы для включения периферических циркадных часов, которые, в свою очередь, поддерживают метаболический гомеостаз хозяина, вызывая суточную экспрессию печеночных и кишечных метаболических регуляторов обмена глюкозы, холестерина и жирных кислот.48,52-54 Однако эти результаты основаны главным образом на образцах кала, в основном представляющих толстый кишечник. Поэтому Дантас Мачадо (Dantas Machado) и его коллеги сосредоточились на процессе периферического подчинения циркадных ритмов в подвздошной кишке.51 Здесь они продемонстрировали, что суточные колебания микробного состава подвздошной кишки и транскриптома подвздошной кишки существуют, и оба эти процесса нарушены у мышей с ожирением, вызванным диетой, что приводит к нарушению периферических циркадных ритмов и дисметаболизму. Интересно, что ограниченное по времени кормление способно восстановить суточную динамику микробного состава подвздошной кишки, увеличить выработку GLP-1 и повлиять на пулы желчных кислот и сигнализацию, что говорит о том, что динамика микробного состава в ТК важна для регуляции метаболизма хозяина, а режим питания/кормления может существенно влиять на эту динамику.
Метаболизм желчных кислот
Центральная роль ТК в метаболизме желчных кислот - еще один важный аспект регуляторной функции ТК в метаболизме хозяина. Желчные кислоты представляют собой ключевую группу сигнальных молекул в кишечнике, которые в первую очередь способствуют всасыванию липидов и жирорастворимых питательных веществ в ТК, а также регулируют метаболизм липопротеинов, глюкозы и энергии.55,56 Желчные кислоты выполняют свои сигнальные функции путем связывания с ядерным рецептором, фарнезоидным Х-рецептором (FXR) и мембранно-связанным рецептором желчных кислот (TGR5), связанным с G-белками. Оба рецептора высоко экспрессируются в подвздошной кишке, где реабсорбируется 90 % желчных кислот. Было показано, что конститутивная активация кишечного FXR, опосредованная желчными кислотами, усугубляет ожирение, повышает инсулинорезистентность и жировую ткань печени.57-59 В исследовании, проведенном Jiang et al. на мышах, ингибирование сигнала FXR обратило вспять метаболические нарушения, связанные с высокожировой диетой и генетической предрасположенностью к метаболическим заболеваниям, включая ожирение, инсулинорезистентность и жировую ткань печени.60 Более того, передача сигналов FXR была обогащена в слизистой оболочке дистального отдела подвздошной кишки у людей с ожирением, а уровни мРНК молекул сигнального пути FXR: fxr, малый партнер гетеродимера (shp) и фактор роста фибробластов 19 (fgf19) коррелировали с индексом массы тела у этих же людей. Активация FXR ингибирует транскрипцию и секрецию GLP-1 эпителиальными L-клетками кишечника61, что позволяет предположить, что полезные метаболические эффекты ингибирования FXR включают увеличение выработки кишечного GLP-1. Этому соответствуют результаты, полученные Томасом (Thomas) и его коллегами в ходе их работы на мышах, страдающих ожирением. Было показано, что передача сигналов TGR5 стимулирует высвобождение GLP-1 в кишечнике, что приводит к улучшению функции печени и поджелудочной железы с повышением толерантности к глюкозе у мышей с ожирением.62 Эти результаты подчеркивают роль передачи сигналов желчных кислот в кишечной регуляции энергетического и глюкозного гомеостаза.
Микробиота кишечника является ключевым регулятором метаболизма и сигнализации желчных кислот. Первичные желчные кислоты (PBAs), а именно холевая кислота (CA) и хенодезоксихолевая кислота (CDCA), вырабатываются в печени.56,63 PBAs впоследствии конъюгируются с глицином или таурином, что делает их водорастворимыми, и выделяются в желчь, где они либо хранятся в желчном пузыре, либо напрямую попадают в ТК для всасывания липидов и жирорастворимых питательных веществ. После попадания в ТК судьба PBAs меняется. Некоторые PBAs пассивно всасываются в ТК в конъюгированной форме, другие сначала деконъюгируются бактериями ТК, а затем пассивно реабсорбируются, большинство активно реабсорбируется в терминальном отделе подвздошной кишки, и примерно 5% продолжают поступать в толстую кишку, где они преобразуются бактериями толстой кишки во вторичные желчные кислоты (SBAs) и выводятся с калом. Небольшая часть SBAs также реабсорбируется в толстой кишке. Таким образом, кишечные микробы играют важную роль в модуляции пулов желчных кислот, что оказывает влияние на физиологию организма. Более подробно об этой микробно-зависимой регуляции пулов желчных кислот можно прочитать в обзоре Winston и Theriot63. Влияние бактерий ТК на сигнализацию желчных кислот и метаболизм хозяина обсуждается далее в этом обзоре в контексте метаболических заболеваний в разделе «Микробиота ТК и болезни».
Метаболизм фруктозы
Недавно обнаруженная функция ТК в метаболизме фруктозы также заслуживает внимания, учитывая сильную корреляцию между высоким потреблением фруктозы и заболеваниями, связанными с метаболизмом, такими как ожирение, диабет 2 типа, неалкогольная жировая болезнь печени, дисфункция почек и сердечно-сосудистые заболевания64. Ранее предполагалось, что превращение фруктозы в глюкозу происходит в печени на основании того, что в печени экспрессируются высокие уровни ферментов, катаболизирующих фруктозу, а печень очень чувствительна к фруктозе, что приводит к жировой болезни печени.64,65 Однако Джанг (Jang) и коллеги показали, что ТК на самом деле отвечает за превращение фруктозы в глюкозу.66 Предполагается, что это играет защитную роль против токсичности фруктозы в печени, при условии, что потребление фруктозы не превышает метаболическую способность ТК. Если потребление фруктозы превышает этот порог, фруктоза становится доступной для кишечных бактерий, которые, по крайней мере в толстой кишке, могут превратить фруктозу в потенциально гепатотоксичные метаболиты. Избыточное потребление фруктозы также может привести к дисфункции кишечного барьера в результате дисбиоза микроорганизмов ТК.20 Добавка фруктозы поросятам приводила к снижению экспрессии в подвздошной кишке трех основных генов плотного соединения - ZO1, OCLN, CLDN, что коррелировало с уменьшением относительной численности Bacillus и Paenibacillus (аэробы) и увеличением относительной численности Streptococcus и Faecalibacterium (анаэробы) в подвздошной кишке.20 Таким образом, изучение роли бактерий ТК в метаболизме фруктозы может иметь значительные последствия для метаболического здоровья (рис. 1d).
Биодоступность лекарств и ответная реакция
Кишечник также является важным местом всасывания лекарств, оказывая значительное влияние на их эффективность. Бактерии в кишечнике также могут метаболизировать лекарства, однако исследования в основном сосредоточены на метаболизме, происходящем в толстой кишке, и, следовательно, на доле лекарств, которые не всасываются организмом.67 Бактерии в ТК, с другой стороны, имеют возможность влиять на биодоступность перорально принимаемых лекарств, модулируя лекарство до того, как организм успеет его всосать. В исследовании, проведенном ван Кесселем (van Kessel) и его коллегами, образцы фекалий пациентов с болезнью Паркинсона (БП) и крыс использовались для изучения возможной модуляции леводопы микробами кишечника.68 Леводопа в сочетании с ингибитором декарбоксилазы является основным средством лечения БП - дегенеративного заболевания центральной нервной системы. Однако лечение не всегда бывает успешным: многие пациенты либо не отвечают на лечение, либо вынуждены увеличивать дозировку препарата из-за снижения реакции на лечение с течением времени. Учитывая, что проксимальный отдел ТК (тощая кишка) является основным местом всасывания леводопы, а леводопа очень похожа на субстрат бактериальных тирозиндекарбоксилаз (TDC),69-71 была выдвинута гипотеза о том, что бактерии тощей кишки могут быть причиной снижения реакции на лечение. Ван Кессель и его коллеги обнаружили, что бактерии проксимального отдела ЖКТ через активность тирозиндекарбоксилазы действительно способны эффективно преобразовывать леводопу в дофамин - активную форму, которая не может пересечь гематоэнцефалический барьер и оказать модулирующее воздействие на болезнь. Полученные результаты указывают на то, что бактерии тощей кишки влияют на биодоступность леводопы, что позволяет объяснить, почему у пациентов с БП наблюдаются различия в эффективности леводопы. Аналогичным образом микробы кишечника связаны с метаболизмом нестероидного противовоспалительного препарата набуметона.72 У безмикробных мышей (GF) по сравнению с мышами, свободными от конкретных патогенов (SPF), после перорального введения набуметона наблюдается повышенная экспрессия ферментов цитохрома P450 (CYP) в тонком кишечнике, метаболизирующих лекарство. Цитохромы P450 превращают набуметон в его активную форму, что подчеркивает важность микробов кишечника, возможно, именно микробов ТК, в регулировании эффектов лекарственного лечения (набуметоном) (рис. 1е).
Помимо биодоступности лекарств, микробиота связана с реакцией на лекарства, возможно, через взаимодействие с иммунной системой. Антитела, направленные на рецепторный белок иммунной контрольной точки и негативный регулятор активации Т-клеток CTLA-4, были успешно использованы для лечения различных видов рака и улучшения выживаемости, особенно в случае меланомы.73 Эффект антител CTLA-4 в борьбе с опухолями был изучен в связи с микробами кишечника Vétizou et al.74 После введения антител CTLA-4 мышам дикого типа Vétizou и коллеги наблюдали увеличение относительной численности Bacteroides thetaiotaomicron и Bacteroides fragilis в слизистой оболочке ТК, что положительно ассоциировалось с эффективностью CTLA-4. Эти противоопухолевые эффекты отсутствовали или были снижены у мышей GF и мышей, получавших антибиотики, и восстанавливались при повторном заселении B. thetaiotaomicron и B. fragilis. Таким образом, роль микробов ТК, вероятно, распространяется и на иммуностимулирующие эффекты иммунотерапии рака, что при дальнейшем изучении может значительно улучшить лечение рака (рис. 1е).
МИКРОБИОТА ТОНКОГО КИШЕЧНИКА И ИММУНИТЕТ

Кишечно-ассоциированная лимфоидная ткань (GALT) составляет около 70% всей иммунной системы человеческого организма, и самый крупный ее компонент расположен в ТК.75 Эта иммунная ткань не только критически важна для поддержания гомеостаза кишечника, но и защищает организм от внешних факторов, способных проникнуть через слизистый барьер кишечника. Ключевая роль GALT в поддержании иммунного гомеостаза кишечника заключается в поддержании равновесия между, с одной стороны, толерантностью к антигенам и микробам, полученным в результате диеты, и, с другой стороны, иммунитетом к патогенным стимулам.76 Неспособность поддерживать это равновесие лежит в основе развития кишечных и внекишечных иммунных заболеваний, таких как диабет 1 типа, целиакия и воспалительные заболевания кишечника (ВЗК). В последнее время GALT также связывают с развитием и организацией энтеральной нервной системы, которая тесно связана с центральной нервной системой.77 Было показано, что макрофаги мышечной оболочки кишечника играют здесь важную роль. У мышей, лишенных таких макрофагов, наблюдается дисмоторика кишечника и менее организованная энтеральная нервная система.
GALT можно разделить на три отдельных компонента, распределенных в различных слоях кишечной стенки: диффузная лимфоидная ткань в пределах lamina propria, изолированные лимфоциты, встроенные в эпителий (интраэпителиальные лимфоциты, IELs), и организованные лимфоидные фолликулы, такие как Пейеровы бляшки в подвздошной кишке.78 Диффузная лимфоидная ткань состоит в основном из плазматических клеток, но также содержит Т-лимфоциты (преимущественно CD4+) и другие клетки врожденного иммунитета. IELs в основном состоят из CD8+ Т-клеток и являются почти исключительной частью кишечной иммунной системы. Естественные клетки-киллеры (NK) и NK-T-клетки также в значительной степени присутствуют в эпителии. Пейеровы бляшки богаты CD4+ и CD8+ Т-клетками и В-клетками и имеют покрывающий их эпителий, состоящий из М-клеток, которые обеспечивают транспорт люминальных антигенов в бляшки для адаптивного иммунного ответа.79 Во время воспалительной реакции эти клетки выделяют повышенный уровень хемокинов и IgA, что еще больше усиливает воспалительный ответ.
Сосуществование кишечных комменсалов с хозяином зависит от иммунной системы кишечника, и все больше данных показывает, что эта зависимость взаимна; иммунная система в равной степени зависит от кишечных микробов в своем собственном созревании и регуляции.80 У мышей GF наблюдается сниженное расширение лимфоидной ткани кишечника и наблюдается ряд иммунодефицитов.78 Лечение пробиотиками Lactobacillus kefiri у мышей приводит к увеличению содержания IgA в фекалиях, снижению экспрессии провоспалительных медиаторов и усиленное высвобождение противовоспалительного IL-10 из Пейеровых бляшек и мезентериальных лимфатических узлов81. Кроме того, метаболиты бактериального происхождения, такие как SCFAs, триптофан и производные желчных кислот в результате активности гидролазы желчных солей (BSH), проявляют иммунозащитные свойства.82–85 SCFAs, например, увеличивают выработку антимикробных пептидов (AMPs) и слизи, а также стимулируют созревание и рост регуляторных Т-клеток толстой кишки для снижения местной воспалительной реакции.83,85
Также появляются исследования, касающиеся, в частности, микробов ТК86. Это не является неожиданным, учитывая огромную площадь иммунной ткани только в ТК и тот факт, что слизистый барьер ТК гораздо менее прочен, чем в толстой кишке, что позволяет более тесно контактировать кишечным эпителиальным клеткам с люминальными бактериями.87 Одним из первых шагов в каскаде защиты кишечника является выработка и секреция антимикробных белков (AMPs) эпителиальными клетками кишечника - характерная черта врожденного иммунитета.78 Секреция AMPs, помимо прочего, регулирует бактериальную колонизацию слизистой, влияя на вероятность инфицирования человека. Экспрессия множества AMPs, включая регенерирующий островковый белок 3ɣ (REG3G) в эпителии ТК, у мышей демонстрирует суточную ритмичность, управляемую иммунным сигнальным путем ILC3-STAT3.86 Регуляция иммунного сигнального пути ILC3-STAT3, в свою очередь, зависит от регулируемого питанием хозяина ритмичного прикрепления сегментированных нитчатых бактерий (SFB) к эпителию ТК. Эти результаты указывают на то, что в дополнение к суточным колебаниям микробиоты ТК, которые регулируют метаболизм хозяина, ритмические изменения микробиоты ТК также влияют на суточные ритмы врожденного иммунитета кишечника, которые определяют изменение восприимчивости человека к инфекции в течение всего цикла день–ночь.
Суточная регуляция иммунной активности также важна для адаптивного ответа на повторное поступление пищи в ТК. Как упоминалось ранее, иммунная система кишечника должна поддерживать баланс между иммунитетом против патогенных стимулов и толерантностью к непатогенным антигенам. Постоянные изменения в доступности питательных веществ в ТК нарушают это равновесие. Поэтому резидентные эпителиальные клетки и IELs должны быть способны адаптироваться к этим изменениям. Эпителиальные клетки ТК демонстрируют суточную экспрессию основного комплекса гистосовместимости (MHC) класса II, которая зависит от суточных колебаний микробов в ТК, обусловленных питанием хозяина.88 Эта суточная экспрессия MHC класса II устанавливает суточную активацию интраэпителиальных IL-10+ Т-лимфоцитов и, следовательно, суточную секрецию IL-10, что приводит к суточным изменениям барьерной функции ТК, а именно проницаемости кишечника. Такие результаты подчеркивают центральную роль микробов ТК в поддержании толерантности кишечника к высоковариантной антигенной нагрузке пищевого происхождения.
Аналогичным образом, в недавней работе Грейс Као (Grace Cao) и коллег, где изучался мукозальный иммунитет в двенадцатиперстной кишке мышей, было обнаружено, что Faecalibaculum rodentium вместе с другими специфическими членами микробиоты двенадцатиперстной кишки регулирует гомеостаз эпителия двенадцатиперстной кишки путем увеличения скорости оборота эпителиальных клеток, пролиферации крипт и экспрессии MHC класса II.89 Это объясняется подавлением микроорганизмами выработки энтероцитами ретиноевой кислоты, что приводит к снижению популяции эозинофилов в проксимальном отделе ТК. Уменьшение популяции эозинофилов привело к увеличению опосредованной IELs продукции интерферона-γ, который стимулировал внутриэпителиальный клеточный оборот и экспрессию MHC-II.
Присутствие иммуномодулирующих бактерий в подвздошной кишке также было предположено в контексте профилактики аллергии. После колонизации GF-мышей фекалиями здоровых или аллергичных на коровье молоко младенцев, Feehley et al. отметили, что мыши, колонизированные фекалиями здоровых младенцев, были защищены от анафилактической реакции на аллерген коровьего молока.90 Дальнейший корреляционный анализ между бактериями подвздошной кишки и генами, повышенными в ней, выявил вид Clostridia, Anaerostipes caccae, в качестве ключевого игрока в этой защитной реакции. Кроме того, антиген-специфические Th2-зависимые антитела и цитокиновые реакции были снижены у мышей, моноколонизированных A. caccae. Таким образом, возможно, что Anaerostipes caccae индуцирует специфический профиль экспрессии генов подвздошного эпителия, который предотвращает/ослабляет аллергический ответ на диетические антигены.
Учитывая полученные результаты, можно предположить, что ТК является ключевым органом, в котором происходит взаимодействие между микробиотой, воздействием окружающей среды (например, диеты и инфекционных агентов) и иммунными реакциями кишечника для поддержания кишечного гомеостаза и предотвращения развития иммуноопосредованных заболеваний.
МИКРОБИОТА ТОНКОГО КИШЕЧНИКА И БОЛЕЗНИ
Кишечная микробиота вовлечена в патогенез множества заболеваний, и механизмы, лежащие в основе этих ролей, были тщательно изучены и пересмотрены применительно к микробиоте толстого кишечника. В этом разделе будут обсуждены результаты и потенциальные механизмы, объясняющие роль микробиоты тонкого кишечника в развитии и лечении специфических заболеваний.
Функциональные расстройства желудочно-кишечного тракта
Функциональные желудочно-кишечные расстройства (FGIDs), которые включают функциональную диспепсию (FD) и синдром раздраженного кишечника (IBS или СРК), долгое время ассоциировались с количественным увеличением бактерий в SI, известным как избыточный рост бактерий в тонком кишечнике (SIBO или СИБР).91 Однако механизмы, лежащие в основе этой патологии, остаются недостаточно изученными, и с тех пор в нескольких исследованиях не удалось обнаружить корреляции между наличием функциональных симптомов со стороны желудочно–кишечного тракта, таких как диарея, боли в животе и вздутие живота, и SIBO, что ставит под сомнение достоверность этой связи.91-94 Также присутствуют расхождения в наблюдаемой связи между SIBO и наличием дисбактериоза.91,95,96 Например, Саффури (Saffouri) и его коллегам не удалось продемонстрировать корреляцию между SIBO и дисбактериозом просвета двенадцатиперстной кишки у пациентов с симптомами со стороны желудочно-кишечного тракта.91 Аналогичным образом, Yang и соавт. сообщили, что SIBO не коррелирует с дисбиозом просвета двенадцатиперстной кишки у пациентов с диарейным подтипом IBS (IBS-D); однако он коррелирует с дисбиозом слизистой оболочки двенадцатиперстной кишки.95 Напротив, Bamba et al. – с целью выявления различий в микробиоме двенадцатиперстной кишки у лиц с симптомами SIBO и без них – обнаружено, что SIBO связан с дисбиозом просвета двенадцатиперстной кишки, характеризующимся значительным снижением α-разнообразия и изменениями состава, включая увеличение Streptococcus spp.. и Actinomyces spp.. и уменьшение количества видов, принадлежащих к родам Bacteroides, Blautia и Prevotella.96 Все эти несоответствия подчеркивают ограничения современных методов диагностики SIBO и ставят под сомнение значимость SIBO-положительного результата, но также подчеркивают необходимость более глубокой характеристики микробиоты ТК в контексте FGIDs для выяснения ее роли в развитии симптомов желудочно-кишечного тракта.
В исследовании Zhong et al. с участием девяти пациентов с FD (функциональной диспепсией) оценивали качество жизни (QoL), реакцию симптомов на стандартизированную дозу питательных веществ и бактериальную нагрузку, выраженную в соотношении копий бактериальной 16S рРНК и генов β–актина человека, измеренных с помощью количественной ПЦР.97 Интересно, что бактериальная нагрузка отрицательно коррелировала с зарегистрированным QoL и положительно коррелировала с общей оценкой симптомов, связанных с приемом пищи, после дозы питательных веществ, предполагая, что бактериальная нагрузка может быть лучшим предиктором развития симптомов желудочно-кишечного тракта по сравнению с SIBO. Аналогичным образом, более высокие абсолютные значения таксонов–разрушителей – бактерий, идентифицированных как вытесняющие обычные строгие анаэробы в двенадцатиперстной кишке - были связаны с более тяжелыми симптомами желудочно-кишечного тракта.98 FD была связана с увеличением количества видов Streptococcus и снижением количества видов Prevotella, Veillonella и Actinomyces в слизистой оболочке двенадцатиперстной кишки.97,99 Примечательно, что после применения ИПП также наблюдалось более высокое содержание стрептококков, ассоциированных со слизью, как у пациентов с FD, так и у здоровых лиц контрольной группы.100 Таким образом, накопление бактерий Streptococcus, наблюдаемое в слизистой оболочке у пациентов с FD, может отражать влияние использования ИПП, а не самого FD, на бактериальный состав двенадцатиперстной кишки. На микробный состав слизистой оболочки двенадцатиперстной кишки в контексте FD дополнительно влияет наличие инфекции H. pylori.101 Изменения микробиоты просвета двенадцатиперстной кишки у пациентов с распространенными симптомами FGIDs включают уменьшение количества видов Porphyromonas, Prevotella и Fusobacterium.91 Исследуя, может ли связанное с диетой увеличение бремени FGID-симптомов быть связано с изменениями в микробиоте ТК, Саффури и коллеги также провели пилотное исследование с краткосрочным диетическим вмешательством на 16 здоровых людях, потреблявших базовую диету с высоким содержанием клетчатки.91 Участники были переведены на диету с низким содержанием клетчатки и высоким содержанием простого сахара в течение 7 дней, а аспираты кала и двенадцатиперстной кишки были получены до и после вмешательства. У 80% участников в ходе вмешательства развились желудочно-кишечные симптомы, что было связано с сопутствующим уменьшением микробного разнообразия. Более того, существовала обратная зависимость между микробным разнообразием ТК и проницаемостью ТК. Более недавнее исследование, проведенное Шанаханом (Shanahan) и коллегами, напротив, не выявило существенных различий в долгосрочном потреблении питательных веществ или качестве рациона питания между лицами с FD (n = 56) и здоровыми контрольными группами (n = 30), а также они не обнаружили связи между привычным питанием и профилями микробиоты, ассоциированными со слизистой оболочкой двенадцатиперстной кишки.102 Эти результаты позволяют предположить, что кратковременные взаимодействия между диетой, микробом и хозяином важны для развития симптомов желудочно-кишечного тракта. Как именно микробы опосредуют взаимодействие между хозяином и диетой в патогенезе FGIDs, еще предстоит определить. Однако в нашем недавнем исследовании микробиоты ТК человека мы обнаружили, что бактериальные пути, продуцирующие метан, были значительно недопредставлены в ТК по сравнению с таковыми в фекальном микробиоме.10 Метан был связан с моторикой ЖКТ и заболеваниями, сопровождающимися запорами, что дает возможность предположить, что дисбиоз ТК через повышенную выработку метана влияет на развитие симптомов со стороны ЖКТ.103,104
Ожирение и метаболические нарушения
Как уже говорилось ранее, ТК играет важную роль в поддержании метаболического гомеостаза организма. Нарушение этого состояния равновесия лежит в основе развития метаболических нарушений, таких как ожирение, дислипидемия и диабет 2 типа. В этом разделе мы обсудим дислипидемию и то, как микробиота ТК может быть вовлечена в развитие гиперлипидемического состояния у человека.
Дислипидемия, или гиперлипидемия, представляет собой наличие в крови избыточного жира или липидов, таких как холестерин и триглицериды.105 Гиперлипидемия является растущей проблемой здравоохранения во всем мире, и связанные с ней осложнения, включая сердечно-сосудистые заболевания, являются разрушительными. Раннее лечение имеет первостепенное значение для предотвращения осложнений и, в свою очередь, также облегчает растущую нагрузку, с которой в настоящее время сталкиваются службы здравоохранения. Было показано, что безмикробные мыши (GF) демонстрируют снижение абсорбции липидов и устойчивость к ожирению, вызванному HFD-диетой. Этот фенотип меняется на противоположный при колонизации микробами, собранными из ТК мышей, получавших HFD, и независимо от диеты, потребляемой после этого.106 Кроме того, проксимальные эпителиальные органоиды ТК, выращенные в среде, кондиционированной ТК-культурами Clostridium bifermentans, демонстрируют повышенную экспрессию генов абсорбции липидов, таких как Dgat2, что позволяет предположить, что бактерии ТК играют ключевую роль в облегчении пищеварительных и абсорбционных реакций ТК на пищевые липиды, что важно для регуляции липидного обмена в организме хозяина. Дополнительные доказательства связи микробов, обитающих в ТК, с гиперлипидемией связаны с метаболизмом желчных кислот (BAs).107 Как подробно описывалось ранее, BAs являются важными компонентами переваривания и абсорбции липидов,56 и регуляция пула BAs не только критична для их функционирования, но и способствует регулированию уровня общего холестерина в сыворотке крови.107 Синтез BAs находится под контролем специфических печеночных ферментов, в зависимости от пути: классического (CYP7A1 и CYP8B1) или альтернативного (CYP27A1 и CYP7B1). Печеночная экспрессия BAs-синтезирующих ферментов регулируется активностью ядерного рецептора FXR в подвздошной кишке, который опосредует свое действие через фактор роста фибробластов (т.е. через FGF15-зависимый путь).55 Усиление сигнала FXR-FGF15 приводит к подавлению экспрессии печеночных BAs-синтезирующих ферментов и, следовательно, к снижению синтеза BAs. Активность илеального FXR зависит от связывания специфических BAs. Неконъюгированные BAs, как правило, повышают активность илеального FXR, в то время как конъюгированные BAs в основном являются антагонистами FXR или слабыми агонистами.55,108 Соотношение конъюгированных и неконъюгированных BAs в ТК регулируется резидентными бактериями - Lactobacillus, Bacillus, Streptococcus и Lactococcus - которые, благодаря присущей им активности гидролазы желчных солей (BSH), деконъюгируют конъюгированные BAs.55,109,110 Таким образом, микробиота ТК может подавлять печеночный синтез BAs - и, соответственно, повышать уровень холестерина в сыворотке крови - через модуляцию пула BAs, что приводит к усилению сигнала FXR-FGF15. Это также продемонстрировано в исследовании Хуанга (Huang) и др., изучавших липидоснижающее действие знаменитого традиционного китайского чая Пу-Эрх (Pu-erh) на мышах.108 Чай Пу-Эрх, а точнее, входящий в его состав теаброунин, снижает количество микробов, продуцирующих BSH, и ослабляет активность BSH в подвздошной кишке как in vivo, так и в культивируемых микробах подвздошной кишки. Это приводит к накоплению тауро-конъюгированной желчной кислоты в подвздошной кишке, ингибированию передачи сигналов FXR-FGF15 и, наконец, к увеличению печеночного желчно-кислотного синтеза с последующим снижением уровней холестерина и триглицеридов в сыворотке и печени (рис. 1f).
Экологическая энтеральная дисфункция
Экологическая энтеральная дисфункция (EED) - это заболевание TK, гистопатологически характеризующееся уменьшением количества и высоты кишечных ворсинок, нарушением эпителиального барьера и хроническим воспалительным инфильтратом. EED является распространенной проблемой здравоохранения, особенно в развивающихся странах. Клинически она ассоциируется с мальабсорбцией и диареей и, как полагают, играет роль в недостаточном питании, возможно, опосредованно через кишечную микробиоту. Исследуя эту гипотезу с помощью коллекции образцов дуоденального аспирата 80 детей с подтвержденным биопсией EED, Чен (Chen) и коллеги выявили сильную корреляцию между абсолютными уровнями группы из 14 дуоденальных бактерий - в том числе Veillonella sp., Streptococcus sp. и Rothia mucilaginosa - и степенью задержки роста.111 Кроме того, у гнотобиотических мышей, колонизированных дуоденальными штаммами, выращенными у детей с EED, развилась энтеропатия TK. В совокупности эти результаты указывают на причинно-следственную связь между микробиотой кишечника, развитием EED и задержкой роста. Поэтому терапия, направленная на эти изменения микробиоты, связанной с EED, может оказаться жизненно важной для борьбы с недоеданием.
Заболевание печени (цирроз)
Цирроз - это рубцевание (фиброз) печени в результате ее длительного повреждения. У пациентов с циррозом, особенно в стадии декомпенсации, повышен риск развития ряда серьезных осложнений, включая системные инфекции, спонтанный бактериальный перитонит, печеночную энцефалопатию и острую хроническую печеночную недостаточность.112,113 Считается, что в основе этого повышенного риска лежит повышенная проницаемость кишечника, особенно в двенадцатиперстной кишке.114 Исследуя взаимосвязь между бактериями слизистой оболочки и проницаемостью эпителия у пациентов с компенсированным циррозом печени, Блум (Bloom) и др. выявили в двенадцатиперстной кишке отдельное микробное сообщество, характеризующееся преимущественно повышенным содержанием Pseudomonadaceae (протеобактерий) и пониженным содержанием Lactobacillus, Bifidobacterium и Clostridia, что было связано с повышенной проницаемостью эпителия.115 Хотя для установления основных механизмов необходимы дальнейшие исследования, предыдущие отчеты показали, что специфические штаммы Lactobacillus и Bifidobacterium снижают кишечную проницаемость,116,117 предполагая роль слизисто-ассоциированной микробиоты двенадцатиперстной кишки в развитии осложнений, связанных с циррозом.
Воспалительные / аутоиммунные расстройства

Нарушение способности иммунной системы кишечника поддерживать баланс между иммунитетом и толерантностью лежит в основе развития ряда воспалительно-опосредованных заболеваний. Как уже говорилось ранее, бактерии ТК играют важную роль в этой регуляции. В соответствии с этим, исследования показали причастность микробиоты ТК к ряду воспалительных заболеваний, а лежащие в их основе механизмы постепенно раскрываются. Здесь мы сосредоточимся на аутоиммунных/воспалительных заболеваниях: ВЗК, поухит, диабет 1 типа и целиакия.
Воспалительные заболевания кишечника (ВЗК)
ВЗК - это хроническое рецидивирующее и ремиттирующее воспалительное заболевание желудочно-кишечного тракта, двумя наиболее распространенными клиническими проявлениями которого являются болезнь Крона (БК) и язвенный колит (ЯК). ВЗК широко изучается в контексте микробиоты кишечника118 , и несколько бактерий, общих для ТК, таких как Streptococci, Enterococci, Actinomyces, Veillonella spp. и Klebsiella pneumoniae, были неоднократно вовлечены в его патогенез 119–122. Было показано, что колонизация обычного обитателя кишечника Enterococcus faecalis также вызывает ВЗК у генетически восприимчивых мышей.123 Эти наблюдения были связаны с идеей орализации - эктопической колонизации типично оральных бактерий в толстой кишке, - которая, как предполагается, усугубляет и без того дисбиотическое и воспалительное состояние у пациентов с ВЗК.124 Это продемонстрировано в исследовании Atarashi et al., в котором эктопическая колонизация кишечника перорально полученными изолятами Klebsiella вызвала активацию клеток Th1 и последующее воспаление кишечника у генетически восприимчивых людей.125 Однако, учитывая, что Klebsiella и другие распространенные бактерии, ассоциированные с полостью рта/ВЗК, в изобилии присутствуют в ТК, а также близкое расположение ТК к толстой кишке, можно предположить, что ТК служит резервуаром для патобионтов, которые транслоцируются в толстую кишку и вызывают повреждения. Кроме того, суточная регуляция оси диета – микробиота - MHC класса II – IL-10 имеет решающее значение для поддержания иммунного ответа ТК и целостности барьера. Используя модель мышиного энтерита типа Крона, Туганбаев и коллеги показали, что одновременное нарушение оси MHC-II - IL-10 еще больше усугубляет воспаление кишечника.88 Эти данные позволяют предположить, что нарушения в микробиоте ТК способствуют патогенезу ВЗК, отчасти через дисрегуляцию MHC-II-зависимого-IL-10 сигнального пути.
Различия в проявлениях болезни между БК и ЯК также могут быть объяснены бактериями ТК. Используя когорту из 359 не получавших лечения педиатрических пациентов с БК или ЯК, а также контрольных лиц, Хаберман (Haberman) и коллеги смогли определить илеальные профили экспрессии генов и микробные сообщества, характерные для БК, независимо от локализации заболевания (т.е. подвздошная или толстая кишка).126 Эти результаты намекают на центральную роль подвздошной кишки и ее микробиоты в индукции ВЗК подтипа БК. Ассоциация между внутриклеточным рецептором распознавания образов, NOD2, и БК подтверждает это. NOD2 высоко экспрессируется в илеальных (подвздошно-кишечных) клетках Панета, где он регулирует илеальную микробиоту путем секреции антимикробных молекул и контролирует провоспалительные иммунные реакции на кишечную микробиоту путем повышения уровня противовоспалительных медиаторов и снижения уровня провоспалительных цитокинов.127,128 Мутации в NOD2 являются наиболее сильно связанными генетическими факторами риска илеальной формы БК,129-131 предполагая, что дисрегуляция микробиоты ТК вносит вклад в патогенез БК. Повышенное потребление эмульгаторов также тесно связано с повышенным риском БК.132 Сообщалось, что диетические эмульгаторы полисорбат-80 и карбоксиметилцеллюлоза (CMC) вызывают изменения состава микробиоты подвздошной кишки мышей, что приводит к усугублению поражений ТК, вызванных индометацином, через сигнальный путь интерлейкина-1β.133 Наконец, внекишечное проявление ползучего жира у людей с БК является еще одним отличительным признаком подтипа ВЗК, который недавно был приписан бактериям тонкого кишечника.134 Ползучий жир возникает в результате миграции брыжеечной жировой ткани в воспаленные участки кишечника, в первую очередь в ТК, где он подвергается гиперплазии и обволакивает стенки тонкой кишки. Ха (Ha) и его коллеги продемонстрировали, используя хирургические резекции подвздошной кишки с использованием ползучего жира и гнотобиотических мышей, что такой перестройке брыжеечной жировой ткани способствует транслокация ряда бактерий, ассоциированных со слизистой оболочкой подвздошной кишки, включая Clostridium innocuum.134
Пациенты с ЯК, особенно с правосторонним течением, также подвержены риску развития первичного склерозирующего холангита (PCS), при котором колит считается первым проявлением заболевания. PCS характеризуется воспалением и прогрессирующим фиброзом желчных протоков с последующим поражением печени. 135 Сообщалось о микробном дисбиозе в верхних отделах ЖКТ и желчных протоках, включая увеличение количества Veillonella dispar и E. coli в слизистой оболочке двенадцатиперстной кишки. 136
Поухит
Поухит — это частое осложнение после проктоколэктомии с подвздошно-анальным резервуарным анастомозом у пациентов с язвенным колитом.
Хотя доступно несколько различных медикаментозных методов лечения для уменьшения симптомов и активности заболевания у людей с ВЗК, несчастливому проценту пациентов в конечном итоге требуется тотальная резекция толстой кишки с наложением подвздошно-анального анастомоза (мешочка). Эта же хирургическая процедура проводится в качестве профилактического лечения для людей с семейным аденоматозным полипозом (FAP) из-за значительно повышенного риска развития колоректального рака.137 Примечательно, что примерно у 50% людей с воспалением мешочка из–за ВЗК в дальнейшем развивается поухит - воспаление мешочка – принимая во внимание, что это очень редко встречается у пациентов с FAP.138,139 Исследования, изучающие патогенез поухита, выявили различия в микробиомах поухита между поухитами при ВЗК и поухитах при FAP, а также между поухитами при ЯК с поухитом и без него, что указывает на роль микробиоты в развитии поухита.140,141 Это также подтверждается тем фактом, что поухит часто поддается лечению антибиотиками.142 В целом, микробиота мешочков с ВЗК демонстрирует более выраженный сдвиг в сторону более похожего на толстую кишку состава, характерно уменьшение количества факультативных анаэробов и увеличение количества облигатных анаэробов, сульфатредуцирующих бактерий и видов клостридий.143 В исследовании, проведенном Sinha et al., метаболомное, транскриптомное и метагеномное профилирование в мешочках при ЯК и FAP показало значительно сниженный уровень SBAs (вторичных желчных кислот), генов, преобразующих PBAs (первичные желчные кислоты) в SBAs, и семейства SBA-продуцирующих бактерий, Ruminococcaceae141. Кроме того, добавки SBA в мышиных моделях колита минимизировали кишечное воспаление, отчасти через рецептор желчных кислот TGR5, что позволяет предположить, что ранее существовавший дисбиоз в новообразованных мешочках пациентов с ЯК приводит к дефициту SBA, который, в свою очередь, вызывает провоспалительное состояние.
Диабет 1 типа
Прогрессирующее самоуничтожение инсулинпродуцирующих бета-клеток поджелудочной железы, вызывающее диабет 1 типа (СД1), все чаще связывают с нарушениями в кишечнике.144 Эти изменения включают дисфункциональную барьерную функцию эпителия и аномально активную иммунную систему. В связи с этим все большее внимание уделяется роли микробиоты кишечника, в том числе микробиоты ТК, учитывая ее тесную функциональную и пространственную связь с поджелудочной железой, а также общее кровоснабжение. С помощью профилирования воспаления и оценки микробиома дуоденальных биоптатов пациентов с СД1 (n = 19), пациентов с целиакией (включенных в качестве контроля воспалительных заболеваний кишечника; n = 19) и здоровых людей (n = 16), Pellegrini et al, выявили специфическую для СД1 «микробную подпись» в слизистой оболочке двенадцатиперстной кишки, которая коррелировала с профилем экспрессии провоспалительных генов.144 Отличительная микробная подпись характеризовалась увеличением количества Firmicutes и соотношения Firmicutes/Bacteroidetes и уменьшением количества Proteobacteria и Bacteroidetes. Подобные изменения также наблюдались в микробиоте двенадцатиперстной кишки крыс с диабетом.145 Примечательно, что, несмотря на общее увеличение количества Firmicutes в биоптатах слизистой оболочки двенадцатиперстной кишки пациентов с СД1 по сравнению со здоровыми контрольными группами, численность видов Clostridia была снижена. Клостридии вносят значительный вклад в производство бутирата в кишечнике, а также являются ключевыми муцин-деградирующими бактериями, что важно для целостности барьера и, возможно, предотвращения образования аутоантител.146,147 Было также показано, что штаммы сегментированных нитевидных бактерий (SFB) у мышей без диабета с ожирением вызывают аутоиммунный диабет через взаимодействие клеток Тh17 в собственной пластинке ТК.148 Дальнейшие доказательства участия микробиоты ТК в патогенезе СД1 получены в результате исследования трансплантации фекальной микробиоты (FMT), проведенного de Groot et al. в 2021 г.149 FMT сохранила остаточную функцию бета-клеток, остановив снижение выработки эндогенного инсулина. Механизмы этого явления были связаны с изменениями в составе микробиоты фекалий и ТК, экспрессией генов ТК, профилями метаболитов и Т-клеточным иммунитетом.
Целиакия
Целиакия (CeD) характеризуется непереносимостью глютена, аберрантно активирующей иммунную систему организма и вызывающей повреждение, преимущественно ТК.150 Гипотеза о том, что потеря толерантности к глютену связана с повышенной проницаемостью слизистой оболочки и последующим привлечением Т-клеток, возникла из-за изменений в составе кишечной микрофлоры.151 Анализ биопсий двенадцатиперстной кишки пациентов с CeD выявил преобладание протеобактерий, таких как бактерии семейства Enterobacteriaceae, а также высокую распространенность бактероидов и стрептококков.151,152 Количество Pseudomonas aeruginosa также увеличено в двенадцатиперстной кишке пациентов с CeD.153 P. aeruginosa способна метаболизировать глютен, производя иммуногенные пептиды, которые более эффективно проникают через кишечный барьер и активируют глютен-специфические Т-клетки. Бактерии также экспрессируют специфическую эластазу, которая, взаимодействуя с глютеном, усиливает воспаление. Потенциальные метаболические изменения, связанные с микробными изменениями в двенадцатиперстной кишке пациентов с CeD, включают увеличение альтернативных путей производства энергии, таких как путь D-глюкарата, L-арабинозы, D-галактарата, пути деградации биогенных аминов и снижение выработки SCFAs.152 Безглютеновая диета в настоящее время является единственным доступным и эффективным методом лечения CeD.150 Однако полная ремиссия не гарантирована, и некоторые люди по-прежнему испытывают симптомы, несмотря на соблюдение строгой диеты. Группа исследователей из Швеции изучала роль микробиоты двенадцатиперстной кишки в сохранении симптомов после исключения глютена из рациона.154 У пациентов, соблюдающих безглютеновую диету и страдающих стойкими симптомами, по сравнению с пациентами без симптомов, наблюдалось более низкое микробное богатство, более высокая относительная численность протеобактерий и более низкая относительная численность Bacteroidetes и Firmicutes. Хотя эти результаты находятся в зачаточном состоянии, они дают представление о возможных будущих альтернативах лечения пациентов с CeD.
Неврологические расстройства
Ось «кишечник-мозг» описывает двунаправленное взаимодействие между кишечником и мозгом, которое влияет как на неврологические, так и на кишечные функции.155 Все больше исследований проводится по изучению роли микробов кишечника в этой двусторонней связи, и несколько исследований посвящены именно ТК.
Уже в утробе матери микробиота кишечника оказывает значительное влияние на мозг. У мышей, родившихся от матерей, подвергшихся воздействию синтетической двухцепочечной РНК, имитирующей вирусную инфекцию во время беременности, что вызывает иммунный ответ, называемый материнской иммунной активацией (MIA, maternal immune activation), наблюдаются поражения коры головного мозга и аномальные поведенческие фенотипы.156 В отличие от этого, потомство беременных мышей, получавших антибиотики, не демонстрирует таких аномальных фенотипов, что позволяет предположить, что материнские кишечные микробы необходимы для индукции MIA-ассоциированных поведенческих и мозговых аномалий у потомства. Сегментированные нитевидные бактерии, ассоциированные со слизистой оболочкой подвздошной кишки беременных мышей, необходимы для индукции этих нарушений нейроразвития посредством экспансии и активации клеток Th17.
Исследуя вклад психологического стресса в обострение заболевания у пациентов с БК (т.е. усиление кишечного воспаления), Шалер (Shaler) и коллеги наблюдали ряд изменений в подвздошной кишке мышей без специфических патогенов, подвергнутых острому психологическому стрессу157. Во-первых, психологический стресс индуцировал пищевую невосприимчивость подвздошной кишки, что проявлялось в повышении уровня генов хозяина, связанных с пищевым иммунитетом и ограничением биодоступности металлов, а также в опосредованном глюкокортикоидами истощении иммунных клеток, продуцирующих IL-22, которые активируют антимикробную защиту слизистой оболочки. Это, в свою очередь, привело к дисбиозу подвздошной кишки с преобладанием экспансии, в частности, адгезивно-инвазивной Escherichia coli (AIEC) - кишечного патобионта, который способен обходить защитные механизмы ТК и, как известно, колонизирует поражения подвздошной кишки у пациентов с БК.157,158 Более глубокий анализ показал, что AIEC использует преимущества повышенного пищевого иммунитета, в том числе за счет экспрессии сидерофоров, поглощающих железо, а также ослабленного иммунитета хозяина, что позволяет им расширяться и еще больше усиливать провоспалительное состояние у пациентов с БК. Другие роды, обычно встречающиеся у пациентов с БК, такие как Enterococcus faecalis, также обогащались после воздействия физиологического стресса, хотя это не было предметом дальнейшего изучения. Полученные результаты свидетельствуют о сложной роли микробиоты ТК в рамках оси «кишечник-мозг», влияющей на здоровье кишечника, что требует дальнейшего изучения.
Исследование Мияучи (Miyauchi) и др. подчеркивает потенциал микробиоты ТК в развитии неврологических заболеваний, а именно рассеянного склероза (РС).159 РС - это демиелинизирующее заболевание головного и спинного мозга, вызванное аутоиммунными факторами. Мияучи и его коллеги продемонстрировали, что мыши, которых перорально лечили ампициллином, были защищены от демиелинизации спинного мозга и инфильтрации спинного мозга воспалительными клетками, что намекает на опосредованный микробиотой кишечника воспалительный ответ, лежащий в основе РС.159 Дальнейшие исследования с использованием мышей GF, колонизированных специфическими чувствительными к ампициллину бактериями ТК, показали, что микроорганизмы ТК действуют синергически, активируя Т-клетки, специфичные для гликопротеинов миелина и олигодендроцитов. Эти Т-клетки, вероятно, ответственны за провоспалительный и демиелинизирующий фенотип мышей с экспериментальным аутоиммунным энцефаломиелитом. Учитывая эти результаты и предыдущие сообщения о повышенном количестве Th17-клеток в ТК пациентов с РС,160 необходимо предпринять дальнейшие усилия по изучению микробиоты ТК человека в контексте РС.
Заключение и дальнейшие перспективы
ТК играет важную роль в метаболизме хозяина, иммунитете, эндокринных и неврологических функциях. Несмотря на это, а также на растущий интерес к его микробным сообществам, знания о микробиоте ТК все еще находятся в зачаточном состоянии и значительно отстают от знаний о микробиоте нижних отделов кишечного тракта. В этом обзоре мы подробно описали современные методы, используемые для отбора образцов и моделирования микробиоты ТК, и их ограничения. Мы также обсудили функции ТК в метаболизме и иммунитете хозяина и обобщили результаты исследований, которые подтверждают и позволяют понять роль, которую играет микробиота ТК, в том числе в контексте заболеваний.
Микробиота тонкого кишечника становится важнейшим компонентом здоровья человека, регулируя фундаментальные процессы в тонком кишечнике, которые влияют не только на здоровье кишечника, но и на внекишечные физиологические функции. В последние годы наблюдается всплеск исследований по трансплантации фекальной микробиоты и стремление разработать клинические вмешательства, но с ограниченным успехом. Потенциальной причиной этого может быть нынешний перекос в сторону исследований фекального микробиома, на которых основаны эти испытания, игнорирующий важный вклад микробиоты тонкого кишечника. Таким образом, лучшее понимание метаболических возможностей микробиоты тонкого кишечника и ее взаимодействия с организмом хозяина может значительно продвинуть исследования микробиома кишечника и поиск новых диагностических методов и стратегий вмешательства для улучшения здоровья человека. Аналогичным образом, диетические вмешательства были разработаны на основе выводов, полученных в результате исследований фекального микробиома. Учитывая, что тонкий кишечник является основным органом, участвующим в усвоении питательных веществ и регуляции обмена веществ, в будущих вмешательствах следует учитывать взаимодействие хозяина и микробиоты внутри этого органа.
Однако одним из основных факторов, сдерживающих исследования микробиоты тонкого кишечника, являются ограничения и проблемы, связанные с существующими методами отбора проб и моделирования этой малодоступной и очень динамичной экосистемы. Поэтому для данной области было бы очень полезно приложить больше усилий для разработки унифицированных методов отбора проб, которые обеспечивают точное представление микробиоты тонкого кишечника, являются менее инвазивными и не требуют привлечения специалистов. Кроме того, большая часть наших знаний о механизмах, лежащих в основе взаимодействия микробиоты тонкого кишечника с хозяином, получена на моделях мышей / животных. Разработка моделей in vitro или in vivo, которые лучше воспроизводят среду обитания человека, будет иметь первостепенное значение для воплощения многообещающих результатов в исследованиях вмешательства на людях и клинических испытаниях.
Дополнительная информация:
- Метагеномный анализ микробиоты двенадцатиперстной кишки при ожирении и СД2
- Кишечный микробиом и пробиотики при целиакии
- Влияние экологических и фармакологических изменений на микробиом верхнего отдела ЖКТ
- Кишечная микробиота и дефицит железа
- Влияние добавок железа на микробиоту кишечника и эффект приема пробиотиков при дефиците железа
- Влияние кишечной микробиоты на здоровье поджелудочной железы
- Симбионтное пищеварение
- Состояние микробиома тонкого кишечника и расстройство сна
- Синдром избыточного бактериального роста (СИБР) в тонкой кишке