ООО "ПРОПИОНИКС"
ИННОВАЦИОННЫЕ ПИЩЕВЫЕ ТЕХНОЛОГИИ +7(966)348-80-35; +7(915)001-93-94
ВЗК, микробиота и иммунитет слизистой оболочки
Воспалительные заболевания кишечника: потенциальный результат «сговора» между микробиотой кишечника и иммунной системой слизистой оболочки
На рисунке: работа компонентов иммунной системы кишечника

- Предисловие
- Введение
- Дисбактериоз как потенциальный триггер ВЗК
- Специфические патогенные микробы при ВЗК
- Профили кишечных бактерий и ВЗК
- Грибковая микробиота и ВЗК
- Кишечный виром и ВЗК
- Простейшие и ВЗК
- Гельминты и ВЗК
- Иммунная система слизистой оболочки и гомеостаз кишечника
- Состав слизистой иммунной системы
- Слой слизи
- Единый слой IECs
- Кишечные иммунные клетки
- Рис. 1. Биологическая передача и связь между царствами поддерживают кишечный гомеостаз
- Согласованный баланс между иммунной системой слизистой оболочки и микробиотой кишечника
- Взаимодействие между осью Treg / Th17 и кишечной микробиотой
- Рисунок 2. Изменение гомеостатического баланса кишечника способствует патогенезу воспалительных заболеваний кишечника (ВЗК)
- Связь между рецепторами распознавания образов (PRRs) и микробиотой кишечника
- Рисунок 3. Схема, показывающая пути активации toll-подобных рецепторов (TLR) и NOD-подобных рецепторов (NLR) в эпителиальных клетках кишечника
- TLR и кишечная микробиота
- NLR и кишечная микробиота
- Обсуждение и выводы
- Дополнительная информация
- Литература
1. Введение
Точный патогенез воспалительного заболевания кишечника (ВЗК) все еще неясен, но общепризнанно, что воспаление является результатом дефектного иммунного ответа слизистой оболочки на кишечную флору у генетически восприимчивых людей [1]. Распространенным типом ВЗК является болезнь Крона (БК), при которой воспаление обычно трансмуральное и может обнаруживаться в любой области желудочно-кишечного тракта. Другой основной тип ВЗК, язвенный колит (ЯК), характеризуется нетрансмуральным воспалением, которое обычно поражает толстую кишку и прямую кишку [2]. Наибольшее число случаев ВЗК наблюдается в развитых странах, таких как страны Северной Америки и Европы, поражающих до 0,5% населения в целом [3].
После урбанизации и быстрой индустриализации в развивающихся странах традиционный образ жизни сильно изменился [4]. Четкая взаимосвязь между изменениями образа жизни, связанными с индустриализацией, и распространенностью ВЗК побудила исследовать патогенез ВЗК [2]. Было показано, что изменения образа жизни во время урбанизации, в том числе улучшение санитарии, уменьшение воздействия микробов на ранних этапах жизни, вестернизация диеты и увеличение использования антибиотиков, влияют на микробиоту кишечника [5]. Кроме того, несколько доказательств подтверждают гипотезу о том, что нарушение патологии кишечной микробиоты и иммунной системы слизистой оболочки вовлечено в патогенез ВЗК [6,7,8].
Кишечник млекопитающих колонизирован большим количеством микроорганизмов, включая бактерии, грибы, вирусы, протисты и гельминты, которые в совокупности называются микробиотой кишечника или микробиомом [9,10,11]. Микробы принимают участие во многих физиологических процессах хозяина, таких как биосинтез некоторых биологически активных вторичных метаболитов. Кроме того, микробиота играет важную роль в поддержании нормального эпителиального барьера кишечника, иммунного гомеостаза, оптимальных иммунных реакций и защиты от колонизации патогенами [12].
Хотя большая часть кишечной микробиоты является мутуалистической или комменсальной, при «дисбиозе» при определенных обстоятельствах патогенное бактериальное разрастание может вызывать определенные воспалительные заболевания, такие как ВЗК [13]. В этом обзоре мы обсудим взаимодействие между кишечной микробиотой и иммунной системой слизистой оболочки во время развития ВЗК.
2. Дисбактериоз как потенциальный триггер ВЗК
2.1. Специфические патогенные микробы при ВЗК
Просвет кишки имеет большую поверхность слизистой оболочки (300–400 м2), которая имеет структуры и функции, связанные с иммунологическим распознаванием ксенобиотиков из окружающей среды [14]. Результаты ранних исследований позволили предположить, что специфические патогенные микробы вызывают ВЗК, поскольку многие инфекционные возбудители вызывают диарею и приводят к воспалению слизистой оболочки кишечника, подобно ВЗК [15]. Mycobacterium avium subsp. paratuberculosis (подвид патогенных микобактерий) является одним из таких патогенов, и он широко изучался на предмет его потенциальной роли в патогенезе БК [16,17]. Хотя связь патогенных микробов с БК, по-видимому, специфична, дальнейшие исследования его регуляции в этиологии БК еще предстоит определить [18,19].
Другим патогенным микроорганизмом, привлекающим исследовательский интерес, является адгезивно-инвазивная кишечная палочка (AIEC). Появляется все больше доказательств того, что AIEC может способствовать патогенезу ВЗК, особенно БК [20]. По сравнению со здоровыми субъектами индекс богатства AIEC у пациентов с БК значительно увеличен, и исследование показало, что протеаза Vat-AIEC этой кишечной палочки может способствовать повреждению слизистой оболочки кишечника и бактериальной колонизации [21]. Дефензины, секретируемые клетками Панета, играют важную роль в иммунитете слизистой оболочки кишечника, и поверхности клеток слизистой оболочки кишечника с высокими концентрациями дефензина также имеют высокие концентрации AIEC, что позволяет предположить, что у AIEC может развиться устойчивость к дефензинам [22]. Было показано, что новый штамм AIEC, LF82, проникает и выживает в макрофагах собственной пластинки и эпителиальных клетках кишечника (IECs) с последующей активацией передачи сигналов ядерного фактора NF-κB и секрецией TNFα [23]. Недавнее исследование Viladomiu et al. обнаружили, что интерлейкины IL-17+ CD4+ T-клетки и RORγt+ CD4+ T-клетки были увеличены как в толстой кишке, так и тонкой кишке (в lamina propria) после колонизации AIEC 2A у свободных от микробов мышей C57BL / 6 [24]. Это указывает на то, что AIEC 2A может увеличивать поляризацию Th17 и влиять на иммунитет слизистой оболочки. В целом, большое количество доказательств показывает, что AIEC может способствовать развитию БК, в то время как сигнальные пути, вовлеченные в иммунитет слизистой оболочки кишечника, остаются менее ясными.
2.2. Профили кишечных бактерий и ВЗК
В последние годы, благодаря разработке и применению высокопроизводительного секвенирования, новые методы (например, секвенирование генов 16S рибосомной РНК) предоставили новые подходы для изучения влияния кишечной микробиоты на патогенез ВЗК [15,25]. Исследования позволили изучить всю структуру бактериального сообщества, а не один или несколько видов бактерий. Все больше фактов свидетельствует о том, что ВЗК не могут вызывать ни одна, ни несколько патогенных бактерий, а скорее изменение всей структуры бактериального сообщества [26, 27]. Исследования, основанные на секвенировании 16S рДНК, показали, что только 7–9 из 55 известных бактериальных делений или типов обнаруживаются в образцах слизистой оболочки кала или кишечника человека [11]. Bacteroidetes (16%–23%) и Firmicutes (49%–76%) являются наиболее распространенными кишечными бактериями человека, а менее распространенные типы включают протеобактерии (Proteobacteria), фузобактерии (Fusobacteria), актинобактерии (Actinobacteria) и веррукомикробию (Verrucomicrobia) [14, 28, 29]. Коэволюционные отношения были обнаружены между хозяином и симбиотическими бактериями (включая комменсалов и мутуалистов) [30]. Изменения в возрасте хозяина, рационе питания или использовании антибиотиков могут привести к изменению симбиотических бактерий. В здоровом организме человека после временной смены фекальные бактерии имеют тенденцию возвращаться к своей типичной первоначальной структуре [31]. Бактериальный компонент микробиоты обеспечивает значительные преимущества для хозяина, генерируя метаболиты, способствуя развитию иммунной системы слизистой оболочки и предотвращая колонизацию патогенными микроорганизмами [32]. Однако после развития ВЗК часто обнаруживается кишечный микродисбиоз (дисбаланс между защитными и вредными бактериями) [27]. Широко признанная гипотеза заключается в том, что кишечный микродисбиоз может быть пусковым механизмом для ВЗК [27].
Кишечный микродисбиоз широко описан у пациентов с ВЗК. Например, происходит уменьшение разнообразия, изменения в составе (увеличение или уменьшение численности конкретных видов) и изменения метаболитов [14,33,34]. Что касается уменьшения разнообразия, биопсии слизистой из пар близнецов (включая дизиготных и монозиготных близнецов) с ЯК показали уменьшение разнообразия кишечной микробиоты у обоих братьев и сестер по сравнению со здоровыми индивидуумами, что указывает на уменьшение разнообразия кишечной микробиоты, что может способствовать ВЗК [35]. Кроме того, исследования бактерий у пациентов с ЯК также показали меньшее разнообразие фекальных бактерий, чем у здоровых людей [36]. Более того, в первые два года жизни меньшее разнообразие бактерий в кишечнике связано с уменьшением ответов клеток воспаления Т-хелперов-1 (Th 1), что может способствовать развитию ВЗК во взрослом возрасте [37]. Что касается изменений в составе, многие исследования показали, что микробиота кишечника у пациентов с ВЗК проявляет повышенный уровень протеобактерий (Proteobacteria) и уменьшение количества фирмикутов (Firmicutes) [38,39,40]. Кроме того, сообщалось об уменьшении численности кластера Clostridium IV (Clostridium leptumgroup), особенно Faecalibacterium prausnitzii [40,41]. Что касается изменений в метаболитах, то короткоцепочечные жирные кислоты (SCFAs), образующиеся из микробиоты кишечника после переваривания различных пищевых волокон, могут быть поглощены и использованы IEC [34]. В общей сложности 95% SCFAs могут быть выделены для их быстрого всасывания, и только около 5% выводится из организма в кале. Ацетат, пропионат и бутират являются основными компонентами в SCFAs, из которых ацетат может продуцироваться по пути Вуда - Льюнгдаля с помощью Blautia hydroydrophica, а пропионат генерируется с помощью Bacteroidetes и Firmicutes через сукцинат и лактатный путь, а оставшийся бутират производится несколькими Firmicutes через ацетил-КoA [42]. Давно известно, что европейские дети, более восприимчивые к ВЗК, имеют худшую пищеварительную способность и более низкий уровень SCFAs, чем африканские дети [43]. С другой стороны, другие данные показывают, что SCFAs участвуют в регуляции иммунитета и контроле воспаления, подтверждая роль SCFAs в поддержании кишечного гомеостаза [34].
Тем не менее, исследования биопсий слизистой оболочки у пациентов с ВЗК выявили увеличение числа представителей семейства Enterobacteriaceae и уменьшение числа представителей отряда Clostridiales [43]. В образцах толстой кишки бактерии (в том числе бактерии гамма-подразделения протеобактерий) инвазировали слизистую оболочку у 83% и 25% gпациентов с ЯК и БК соответственно, по сравнению с 0% контрольных групп без ВЗК [44,45]. Эксперименты In vitro показали, что несколько штаммов бактерий от пациентов с БК или ЯК, включая E. coli, Enterococcus faecalis и Fusobacterium varium, могут разрушать IECs [46,47,48]. Однако новые технологии (например, технологии секвенирования ДНК и вычислительные инструменты) также привлекли внимание исследователей к другим микробам кишечника, таким как грибы и вирусы [49].
2.3. Грибковая микробиота и ВЗК
Анализ секвенирования всего генома показывает, что >99% микробиоты кишечника составляют бактерии, в то время как на долю грибов приходится только 0,1% [29]. Правда, грибы были предположительно вовлечены в патогенез ВЗК в течение длительного времени. Много лет назад исследователи рассматривали антитела против Saccharomyces cerevisiae (ASCA) как своего рода серологический биомаркер для БК, указывающий на избыточный иммунный ответ на грибы у пациентов с БК [50,51]. Кроме того, ASCA может быть обнаружен у 50%-60% пациентов с БК по сравнению только с 8%-20% здоровых субъектов [52]. Недавние исследования показывают, что изменения в составе и структуре грибкового сообщества также существуют между пациентами с ВЗК и здоровыми субъектами. Пациенты с ВЗК имеют более низкое соотношение Ascomycota / Basidiomycota по сравнению со здоровыми людьми, что связано с повышенной распространенностью Candida albicans и уменьшением количества Saccharomyces cerevisiae у пациентов с ВЗК [53]. Разнообразие грибов также резко снижается при ВЗК [53]. Более того, на мышиной модели колита C. albicans усиливал воспаление кишечника, а дрожжи S. cerevisiae уменьшали воспаление [54,55]. Лечение мышей противогрибковым средством повышало восприимчивость к острому и хроническому колиту [56]. Кроме того, сообщество грибов в кишечнике млекопитающих может взаимодействовать с иммунной системой через врожденный иммунный рецептор Dectin-1 и сигнальную ось Card9-Syk, поддерживая кишечный гомеостаз [53,54]. Эти данные предоставляют объективные доказательства того, что грибковая «микобиота» регулирует иммунную систему и влияет на частоту развития ВЗК.
Кишечник содержит большое и сложное вирусное сообщество, которое известно как «кишечный виром» [57]. Развитие метагеномики помогло исследователям выявить разнообразный состав кишечного вирома, который содержит эукариотические вирусы (например, герпесвирусы, аденовирусы и нехарактерные эукариотические вирусы) и прокариотические вирусы (например, Microviridae и Caudovirales) [58,59]. Однако до сих пор мало что известно о роли кишечного вирома в ВЗК. Недавние исследования на животных показали, что кишечный виром участвует в патогенезе ВЗК. Эукариотический вирус, мышиный норовирус (MNV), нарушил гомеостаз кишечника у мышей, чувствительных к ВЗК (IL10 - / - и Atg16L - / - мышей), и вызвал серьезный колит [60,61]. Однако модель прилипания бактериофагов к слизи показала, что существует симбиотическая связь между бактериофагами и слизистой оболочкой кишечника, то есть слизь обеспечивает среду обитания для бактериофагов, которые обеспечивают защиту от других микробов [62]. Кроме того, исследование MNV-инфекции у мышей без микробов или обработанных антибиотиками показало, что MNV способствует восстановлению нормальной морфологии кишечника и поддержанию врожденных иммунных функций [63]. Кроме того, исследования кишечного вирома у здоровых людей показывают, что бактериофаги составляют большую часть вирома, и виды являются относительно стабильными [64,65]. Microviridae и Caudovirales, которые латентно заражают своих бактериальных хозяев и производят потомство, представляя собой основные доминирующие виды бактериофагов [66,67]. Однако у пациентов с ВЗК были обнаружены изменения в видовом составе бактериофагов, также известные как дисбактериоз кишечного вирома (то есть повышенные уровни бактериофагов, в частности Caudovirales - каудовиралов). Самое интересное, что между бактериофагами и их бактериальными хозяевами существует связь хищник–жертва, которая называется «транскингдомным взаимодействием» и которая может способствовать патогенезу заболевания [11,57]. Таким образом, кишечный виром влияет на иммунитет слизистой оболочки по крайней мере в некоторых отношениях, но его связь с кишечным гомеостазом еще предстоит изучить.
Хотя ясно, что дисбактериоз бактерий, грибков и вирусов может влиять на кишечный гомеостаз, потенциальная роль гомеостаза в других микробных царствах, таких как протисты, редко изучалась. Общеизвестно, что кишечные патогенные простейшие, которые являются одноклеточными эукариотами, включая Cryptosporidium spp., Giardia spp., Entamoeba histolytica, Encephalitozoon cuniculi и Toxoplasma gondii, могут вызывать заболевания у мышей и людей [68,69,70,71,72]. Кроме того, традиционно считалось, что любой простейший в кишечнике человека является паразитом, который может вызывать патогенность организма хозяина [73]. Тем не менее, интересно, что новые данные свидетельствуют о том, что некоторые распространенные простейшие, обитающие в кишечнике человека, скорее полезны, чем вредны [74]. Все больше исследований показывают, что у здоровых людей также обнаруживаются высокие уровни кишечных простейших, таких как Бластоцисты (Blastocystis) и одноклеточные землеройки Dientamoeba fragilis [75]. Многие другие симбиотические простейшие (например, Entamoeba dispar и Pentatrichomonas) также присутствуют в кишечнике [76].
Было проведено мало исследований о влиянии простейших кишечника на развитие ВЗК, особенно их влияние на иммунитет слизистой оболочки кишечника. Tritrichomonas musculis (T.mu), комменсальный кишечный простейший грызунов, колонизирует просвет кишечника и приводит к активации воспаления в эпителиальных клетках и высвобождению IL-18 и IL-1β. Управляемый T.mu IL-18 может защищать слизистую оболочку кишечника от бактериальной инвазии, но также способствует развитию хронического колита у мышей [77]. Другой вид Tritrichomonas, Tritrichomonas muris, может значительно увеличить обилие кишечных пучковых клеток (критических часовых в кишечном эпителии) и затем воздействовать на врожденные лимфоидные клетки 2 типа (ILC2) через Trpm5 и экспрессию цитокинов, таких как IL-25 и IL-13 [78]. Примечательно, что новая гипотеза заключается в том, что кишечные патогенные простейшие нуждаются в определенных стимулирующих факторах (например, транскинетических взаимодействиях с определенными кишечными бактериями) для активации их патогенности [79]. Однако простейшие, будь то патогены или комменсалы, остаются непонятыми. Нет четких доказательств того, что некоторые простейшие полезны для поддержания здоровья кишечника. Потенциальные преимущества кишечных простейших могут быть получены за счет увеличения биоразнообразия кишечника или их способности регулировать иммунитет слизистой оболочки кишечника хозяина.
«Гигиеническая гипотеза ВЗК» предполагала, что воспитание детей в чрезвычайно гигиенических условиях (например, с меньшим воздействием гельминтов) отрицательно влияет на построение врожденной иммунной системы, которая способствует восприимчивости к ВЗК в дальнейшей жизни [80]. Многие недавние клинические исследования показали, что различные гельминты (например, Trichuris trichiura, Trichuris suis и Necator americanus) могут облегчать симптомы ВЗК, и их отсутствие было связано с развитием ВЗК [5,81]. Наиболее вероятный лежащий в основе механизм заключается в том, что гельминты могут изменять иммунные ответы (подавлять или уменьшать высвобождение воспалительных факторов) у своих хозяев, выделяя различные экскреторно-секреторные (ES) продукты [82]. Исследования эффектов гельминтозной инфекции с использованием модели ВЗК-восприимчивой мыши (нуклеотидсвязывающий домен олигомеризации, содержащий белок 2 [Nod2] нокаутных мышей), показали, что паразитические Trichuris muris могут ослаблять аномальные кишечные барьеры (повышая качество бокаловидных клеток) и изменить баланс комменсальных и патогенных бактерий [83,84]. Кроме того, было показано, что различные гельминты, такие как Echinococcus granulosus, Trichinella spiralis, Heligmosomoides polygyrus и Ancylostoma caninum, защищают от колита на животных моделях [81]. Кроме того, Sj16, секретируемый белок Schistosoma japonicum, обладает иммунорегуляторными защитным действием на DSS-индуцированный колит, путем ингибирования сигнального пути пероксисомного пролифератор-активированного рецептора-Альфа (PPAR-α), увеличивая процент Treg и повышая продукцию противовоспалительных факторов [81]. Как упоминалось выше, кишечная гельминтозная инфекция может защищать от ВЗК посредством регуляции множественных иммунных реакций.
3. Иммунная система слизистой оболочки и гомеостаз кишечника
3.1. Состав слизистой иммунной системы
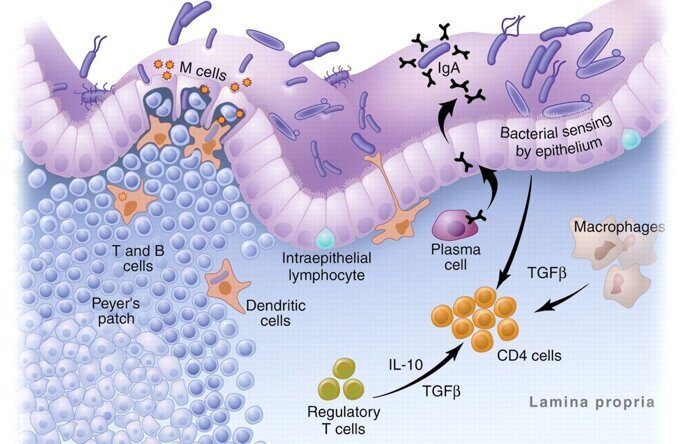
Иммунная система слизистой оболочки кишечника содержит три барьера против вредных факторов и поддерживает гомеостаз кишечника [85]. Слизистый слой, покрывающий эпителиальные поверхности просвета кишечника, является первым барьером. Этот барьер состоит из сложной полимерной сети высокогликозилированных муцинов (белков MUC), которая удерживает микроорганизмы от IECs [86]. Второй барьер представляет собой один слой IECs, организованный в кишечных структурах, который состоит из нескольких типов клеток, включая бокаловидные, энтероэндокринные, пучковые, столбчатые эпителиальные и М-клетки. Третьим барьером являются многочисленные иммунные клетки, находящиеся в кишечнике или рассеянные по всему кишечному эпителию и собственной пластинке слизистой оболочки, включая брыжеечные лимфатические узлы и патчи Пейера [85]. Все три барьера важны для предотвращения доступа комменсальных микроорганизмов к системному кровообращению и поддержания кишечного гомеостаза ЯК [87,88].
Слизь толстой кишки в значительной степени вырабатывается и секретируется бокаловидными клетками; этот слой слизи образует сложную сеть для создания физического и биохимического барьера в толстой кишке [89]. Этот барьер включает в себя два слоя, внутренний и внешний слой слизи. В здоровом кишечнике внутренний слой слизи неприступен для любых комменсальных микроорганизмов. Однако наружный слой слизи более подвержен воздействию просвета кишечника и обеспечивает среду обитания для комменсальных микроорганизмов [90]. Слизь в основном содержит гликопротеины муцина, но она также действует как среда для удержания других белков, таких как антимикробные пептиды (AMPs) и секреторный иммуноглобулин A (SIgA). Муцин 2 (MUC2) является разновидностью гелеобразующего муцина, который наиболее сильно экспрессируется в толстой кишке, образуя устойчивую хорошо организованную структуру, практически полностью свободную от бактерий [91]. SIgA, который секретируется через IECs плазматическими клетками, является основным антителом мукозального иммунитета и связывается с патогенами для предотвращения их прямого взаимодействия с хозяином [92].
У здорового человека эпителий толстой кишки покрыт слизью, но у больных ВЗК процент эпителия, покрытого слизью, значительно снижается, а слизь истончается и повреждается [93]. Интегрированный слой слизи гарантирует отсутствие прямого контакта между патогенами и IECs [93]. В отличие от этого, в некоторых генетических и химически индуцированных мышиных моделях колита патогены близки или даже вторгаются в IECs [94]. Кроме того, тесты на образцах толстой кишки доказали, что бактериальная инвазия слизистой оболочки часто встречается у пациентов с ВЗК, в то время как у здоровых контрольной группы инвазии не происходит [49].
Основную структуру кишечного барьера формируют IECs, которые не только создают физический барьер между симбиотическими и патогенными микробами и собственной пластинкой слизистой оболочки, но также играют важную роль в кишечном иммунитете против патогенных бактерий и их компонентов (например, липополисахаридов, LPS) [95]. Плотное соединение, слизь и секреция антимикробных пептидов (AMPs) являются примерами иммунной функции IECs. Эпителиальные клетки могут быть разделены на абсорбционные клетки (клетки столбчатого эпителия) и секреторные клетки (бокаловидные, энтероэндокринные и пучковые клетки) в соответствии с их биологическими функциями [96]. Столбчатые эпителиальные клетки, ответственные за поглощение переваренных питательных веществ, являются основными абсорбирующими энтероцитами в кишечном эпителии [97]. Бокаловидные клетки, незаменимый секреторный тип IECs, могут синтезировать и секретировать гелеобразующий муцин, особенно MUC2 [96]. Энтероэндокринные клетки, которые составляют около 1% IECs, могут высвобождать гормоны кишечника для контроля движения кишечника и регулирования потребления пищи [98]. Пучковые клетки, как правило, обнаруживаются позже, чем другие типы IECs, и на них приходится около 0,4% IECs. Недавно было обнаружено, что пучковые клетки выступают в качестве критических защитников иммунной системы слизистой оболочки кишечника, способствуя распознаванию и иммунитету против кишечных паразитов [78,99]. Таким образом, IECs играют решающую роль в поддержании кишечного гомеостаза и во взаимодействиях комменсала и хозяина.
Есть много видов и большое количество иммунных клеток в кишечнике, которые играют ключевую роль в поддержании кишечного гомеостаза. Изменения в их морфологии и функциях могут привести к ВЗК [100]. В последнее время все большее число исследований стало фокусироваться на отношениях между иммунными клетками и кишечной микробиотой, и исследования показали, что зрелость некоторых иммунных клеток зависит от специфической микробиоты (например, некоторых видов Bacteroidetes и Firmicutes) [100]. В настоящее время наиболее изученными кишечными иммунными клетками являются дендритные клетки (DCs), макрофаги, адаптивные иммунные клетки и врожденные лимфоидные клетки (ILCs). Макрофаги и DCs являются основными антигенпрезентирующими клетками, обнаруженными в рамках IECs, которые могут идентифицировать как безвредные антигены, так и потенциальные патогены, обеспечивая адекватную реакцию хозяина на микробиоту кишечника [101,102]. Адаптивные иммунные клетки - это тип иммунных клеток, которые участвуют только в адаптивном иммунном ответе. Они могут проходить сложный процесс, включающий развитие, дифференцировку, созревание и секрецию после стимуляции специфическими антигенами. Ключевыми адаптивными иммунными клетками, участвующими в патогенезе ВЗК, являются Т-клетки (в том числе Т-хелперы Th1, Th2 и Th17, а также регуляторные Т-клетки Treg) [103]. ILCs также являются важным классом иммунных клеток, которые действуют как предохранители в защитной иммунной системе хозяина, а также участвуют в иммунно-опосредованных заболеваниях. Было продемонстрировано, что ILCs быстро реагируют на факторы кишечной экосистемы, такие как люминальные (просветные) бактерии, метаболические сигналы и цитокины [104]. Также было продемонстрировано, что некоторые подмножества участвуют в патогенезе ВЗК (NCR-ILC3, ILC1). Кроме того, некоторые из них, вероятно, имеют защитные функции (NCR+ ILC3), в то время как другие остаются спорными (ILC2) [104,105]. Таким образом, многочисленные кишечные иммунные клетки выполняют иммунные функции в иммунной системе слизистой оболочки (Рис.1).
Рис. 1. Биологическая передача и связь между царствами поддерживают кишечный гомеостаз. Гомеостаз кишечника поддерживается тремя иммунологическими барьерами: слоем слизи (первый барьер), слоем эпителия (второй барьер) и слоем иммунных клеток (третий барьер). Слой слизи содержит множество иммунных медиаторов, таких как антимикробные пептиды (AMPs) и секреторный иммуноглобулин A (SIgA), которые ограничивают прямой контакт между миллионами микроорганизмов (включая бактерии, грибы, вирусы и протисты) и эпителиальными клетками кишечника (IECs). Тем не менее, микроорганизмы ответственны за деградацию и переваривание пищевых волокон для производства высокоэнергетических материалов (например, короткоцепочечных жирных кислот [SCFAs]) для IECs. Уровень IECs, который содержит несколько рецепторов распознавания образов (PRRs), таких как toll-подобные рецепторы (TLR) и nod-подобные рецепторы (NLR), является вторым иммунологическим барьером. Он быстро обнаруживает и реагирует на бактерии, которые проникают в кишечную ткань. Наконец, уровень иммунных клеток способствует функции контроля и очистки IECs для ограничения доступа кишечных микробов, обеспечивая их быстрое уничтожение, а также стимуляцию кишечного гомеостаза.
4. Согласованный баланс между иммунной системой слизистой оболочки и микробиотой кишечника
4.1. Взаимодействие между осью Treg / Th17 и кишечной микробиотой
Tregs, Th1, Th2 и Th17 все происходят из дифференциации наивных CD4+ T-лимфоцитов, которые могут быть повышены ILCs, DCs, и макрофагами [106]. Являясь одним из наиболее изученных подмножеств CD4+ Т-хелперных клеток, клетки Th17 характеризуются продукцией и секрецией IL-17, что способствует воспалению кишечника [107]. Клетки Th17 имеют решающее значение для защиты слизистого барьера кишечника от патогенов, включая бактерии, грибы и вирусы [108]. Однако у пациентов с ВЗК большая часть кишечных Th17-клеток обнаруживается в язвенных областях, и продвинутые эксперименты на мышах также показали, что аномально повышенные уровни Th17-клеток (индуцируемые специфическими бактериями) могут усугублять колит [24].
Tregs являются подмножеством CD4+ T-клеток, и они определяются экспрессией CD25 и Foxp3 [109]. Клетки Tregs играют решающую роль в отрицательном контроле иммунной системы, продуцируя IL-10 и трансформирующий ростовый фактор бета TGF-β, поддерживая иммунную толерантность и иммунный гомеостаз. Исследования показали, что дефекты Treg и функциональные нарушения участвуют в патогенезе различных заболеваний, включая ВЗК [110, 111]. Таким образом, ось Treg / Th17 поддерживает иммунный гомеостаз слизистой оболочки кишечника и определяет частоту и тяжесть ВЗК. Исправление дисбаланса оси Treg / Th17 может способствовать облегчению воспаления.
Со времени создания и применения мышей без микробов связь между кишечной микробиотой и осью Treg / Th17 широко изучалась. Ранние исследования показали, что у безмикробных мышей было меньше CD4+ CD25+ T-клеток в брыжеечных лимфатических узлах, что позволяет предположить, что кишечная микробиота способствует развитию клеток Treg [112]. Кроме того, колонизация различными типами микробиоты или одним бактериальным штаммом может вызывать разные иммунные реакции и формировать разнообразные кишечные иммунные ландшафты [113]. Эксперименты по совместному культивированию in vitro с участием клеток эпителия толстой кишки и клостридий показали, что клостридии индуцируют продукцию TGF-β, что способствует дифференцировке CD4+ Т-клеток в Tregs [114]. Основной вид отряда Clostridia, Faecalibacterium prausnitzii, является одной из наиболее распространенных анаэробных кишечных бактерий. Исследования подтвердили, что данный вид стимулирует выработку бутирата и блокирует путь IL-6 / Stat3 / IL-17, тем самым уменьшая дифференцировку CD4+ Т-клеток в клетки Th17, способствуя клеткам Treg [115]. Helicobacter pylori, патогенетическая грамотрицательная бактерия, может вызывать язву желудка; тем не менее, исследования показали, что он может облегчить DSS-индуцированный хронический колит у мышей, что может быть связано с пониженной регуляцией Th17 и повышением регуляции Treg [116]. Вкратце, все эти наблюдения на мышиной модели подтверждают гипотезу о том, что изменения в составе микробиоты кишечника изменяют баланс оси Treg / Th17, способствуя обострению или облегчению ВЗК [117]. Впоследствии перенос микробиоты от здоровых доноров или доноров c ВЗК к мышам без микробов подтвердил правильность этой гипотезы [118].
Как критический фактор транскрипции для поддержания баланса оси Treg / Th17, c-Maf может отрегулировать дифференцировку и функцию кишечных клеток Treg. Исследования показали, что у мышей с дефицитом c-Maf кишечная микробиота была сильно нарушена, и при переносе на мышей без микробов микробиота индуцировала тяжелые кишечные реакции Th17 и обостряла воспалительные реакции [119]. Кроме того, рецептор IL-17 (IL-17R), который является ключевым рецептором сигнального пути IL-17, ответственным за стимулирование развития Th17 клеток, имеет важное значение для регуляции эффектов иммунной системы слизистой оболочки против кишечных патогенных инфекций и контроля дисбиоза микробиоты кишечника [120]. Являясь незаменимым подмножеством Treg-клеток, обогащенные в кишечнике клетки pTreg оказывают глубокое влияние на микробные сообщества кишечника, а дефицит клеток pTreg у мышей индуцирует глубокие изменения в профилях микробных метаболитов кишечника и кишечного эпителия [121]. Короче говоря, существует сложная перекрестная помеха между осью Treg/Th17 и микробиотой кишечника. Дисбаланс оси Treg / Th17 может вызвать дисбактериоз микробиоты, а дисбактериоз микробиоты также может привести к дисбалансу оси Treg / Th17. Кроме того, нарушения оси Treg/Th17 или микробиоты кишечника могут приводить к ВЗК или усугублять его (Рис.2).
Рисунок 2. Изменение гомеостатического баланса кишечника способствует патогенезу воспалительных заболеваний кишечника (ВЗК). Во время гомеостаза в здоровом кишечнике кишечные микробы индуцируют фенотип иммунной толерантности. Напротив, ключевыми признаками дисбаланса гомеостаза являются дисбактериоз микробиоты и иммунологическая дисрегуляция. Дисбактериоз микробиоты предполагает избыточное размножение потенциально патогенных микроорганизмов, которые могут разрушать слизистую оболочку кишечника и повышать проницаемость кишечника, способствуя тем самым гиперактивации адаптивной и врожденной иммунной системы и вызывая хроническое воспаление. Кроме того, дисбактериоз микробиоты может вызвать дисбаланс оси Treg/Th17, что приводит к дальнейшим воспалительным реакциям в ткани кишечника. Однако некоторая кишечная микробиота (например, Clostridium, Faecalibacterium prausnitzii и Helicobacter pylori) способствует развитию клеток Treg для усиления противовоспалительного эффекта. Короче говоря, любая сторона или обе аномалии в микробиоте кишечника или оси Treg / Th17 могут вызвать гомеостатический дисбаланс кишечника. В конечном счете, нарушения кишечного гомеостаза могут привести к ВЗК или усугубить его.
4.2. Связь между рецепторами распознавания образов (PRRs) и микробиотой кишечника
PRRs широко экспрессируются в различных клетках иммунной системы слизистой оболочки кишечника, включая IECs, DCs, макрофаги, адаптивные иммунные клетки и ILCs. Они отвечают за распознавание различных молекулярных паттернов микроорганизмов, тем самым предотвращая инвазию патогенов и поддерживая гомеостаз кишечника [121,122,123,124,125]. Все большее число исследований показывают, что PRRs играют ключевую роль как в предотвращении прямого контакта между микробиотой кишечника и IECs, так и в влиянии на структуру кишечных сообществ [126]. В настоящее время известные PRRs включают Toll-подобные рецепторы (TLRs), Nod-подобные рецепторы (NLRs), ассоциированный с дифференцировкой меланомы ген 5 (MDA5), лабораторный генетический и физиологический ген 2 (LGP2) и ретиноидный кислотоиндуцируемый ген-I (RIG-I). Однако среди всех PRR, TLR и NLR являются классическими PRR, и они были широко изучены и исследованы [127,128] (Рисунок 3).
Рисунок 3. Схема, показывающая пути активации toll-подобных рецепторов (TLR) и NOD-подобных рецепторов (NLR) в эпителиальных клетках кишечника. Кишечные эпителиальные клетки (IECs) экспрессируют несколько рецепторов распознавания образов (PRRs), включая TLRs и NLRs, которые могут распознавать патоген-ассоциированные молекулярные паттерны (PAMPs) и связанные с повреждением молекулярные паттерны (DAMPs). TLRs присутствуют в клеточных мембранах и эндосомах. Когда TLRs воспринимают PAMPs или DAMPs, они могут рекрутировать сигнальные адаптеры (миелоидный фактор дифференцировки 88, MyD88), а затем инициировать каскад передачи сигналов в MyD88-зависимом механизме, в конечном итоге вызывая транскрипционную активацию ядерного фактора «каппа-би» (NF-kB). TLRs также можно активировать по независимому механизму MyD88, который включает в себя TIR-доменсодержащий адаптерный белок, индуцирующий интерферон-β (TRIF). Каноническая активация белков, содержащих пириновый домен семейства NLR (NLRPs), требует двух сигналов. Сигнал 1 активируется с помощью PAMPs или DAMPs с помощью TLRs для усиления регуляции pro-IL-18 и pro-IL-1β. Сигнал 2 включает сенсибилизацию NLRs и образование инфламмасомы, которая дополнительно индуцирует активацию каспазы-1 для расщепления pro-IL-18, pro-IL-18 и Gasdermin D. В конечном счете, IL-18, IL-1β и N-концевой домен Gasdermin D индуцируют пироптоз клеток.
TRAF: факторы, связанные с рецептором TNF; IRAK: IL-1R-ассоциированные киназы; IKK: ингибитор NF-κB киназы; IκBα: ингибитор NF-κBα; IRF: интерферон-регуляторные факторы; TBK1: TANK-связывающая киназа 1; PSA: полисахарид А; ssRNA: одноцепочечная РНК; dsРНК: двухцепочечная геномная РНК; CpG DNA: CpG-богатые гипометилированные мотивы ДНК в микробном геноме; GNBP: грамотрицательный бактериальный пептидогликан; MDP: мурамилдипептид.
4.3. TLR и кишечная микробиота
TLRs, наиболее характерные трансмембранные рецепторы, по крайней мере, с 13 типами, существуют в различных клетках кишечника, включая IECs (например, клетки Панета и бокаловидные клетки) и резидентные иммунные клетки в собственной пластинке кишечника (например, макрофаги и адаптивные иммунные клетки) [129]. Исследования подтвердили, что все TLR1-TLR9 существуют в IECs [130], но точные механизмы TLRs, лежащие в основе регуляции кишечного гомеостаза, еще не полностью освещены. Липопротеины бактериальных клеточных стенок, бактериальный пептидогликан и грибковый зимозан распознаются TLR1, TLR2 и TLR6 соответственно [131,132,133]. TLR4 отвечает за распознавание LPS, продуцируемых грамотрицательными бактериями. TLR5 может распознавать белки флагеллина, которые являются гранулированными белками, составляющими бактериальное волокно жгутика [129].
Ген первичного ответа миелоидной дифференцировки 88 (MyD88) был идентифицирован как белок-адаптер TLR сигнального пути, ответственный за передачу сигнала TLR к нижестоящим киназам [134]. Передача сигналов MyD88 регулирует продукцию определенных AMPs в специализированных IECs, поддерживая барьерные функции кишечного эпителия [135]. MyD88-дефицитные мыши не могут блокировать патогенную бактериальную инвазию в кишечный эпителий [136].
TLR2 может распознавать противовоспалительный полисахарид Bacteroides fragilis A (PSA) и инициировать передачу сигналов для регуляции оси Treg / Th17, тем самым способствуя иммунологической толерантности [137]. PSA обнаруживается только в микробиоме человека и активирует противовоспалительный иммунный ответ, который облегчает воспалительные заболевания [138]. Однако точный механизм вовлечения TLR2 в развитие ВЗК до конца не выяснен из-за парадоксальных результатов у мышей TLR2 - / - [139, 140]. Мыши TLR5 - / - имеют тенденцию к развитию колита или системного воспаления, и дальнейшие исследования показали, что этот механизм тесно связан с кишечной палочкой E. coli из-за изменения состава микробиоты кишечника у этих мышей [141]. Кроме того, исследования показали, что генетические варианты TLR4 в популяции приводят к восприимчивости к ВЗК [142]. Однако TLR4 высоко экспрессируется в сегментах толстой кишки, где патогенная бактериальная инвазия и инфекция усугубляются при DSS-индуцированном колите [143]. Таким образом, многие исследования подтвердили, что TLR связываются с микробиотой кишечника, чтобы опосредовать воспалительные иммунные реакции и поддерживать кишечный эпителиальный гомеостаз.
4.4. NLR и кишечная микробиота
NLRs, экспрессируемые в цитозоле, необходимы для предотвращения проникновения патогенных бактерий. NLRs существуют в различных клетках кишечника, включая IECs и резидентные иммунные клетки в собственной пластинке кишечника [144, 145]. По крайней мере 23 белка NLR были идентифицированы, но механизмы и биологические функции только меньшинства из них были тщательно изучены [146, 147]. NLRs являются новыми рецепторами, которые поддерживают кишечный эпителиальный гомеостаз посредством связи и взаимодействия с кишечной микробиотой. Примечательно, что многие гены NLRs были охарактеризованы как гены восприимчивости к ВЗК, что подтверждается несколькими исследованиями [148, 149, 150]. Некоторые NLRs образуют мультимолекулярные белковые комплексы, известные как инфламмасомы, с про-каспазой-1 и белком ASC. Эти инфламмасомы собираются после стимуляции с помощью связанных с повреждением молекулярных паттернов (DAMP) или патоген-ассоциированных молекулярных паттернов (PAMP). Кроме того, активированные NLR инфламмасомы могут инициировать активацию каспазы-1 и индуцировать продукцию зрелого IL-1β / IL-18, вызывая тем самым иммунный ответ [151,152].
NOD1 может обнаруживать уникальный мотив γ-D-глутамил-мезо-диаминопимелиновой кислоты, обнаруживаемый преимущественно в грамотрицательных бактериальных пептидогликанах, чтобы инициировать воспалительный ответ [153]. NOD2 может распознавать мурамилдипептид (MDP), содержащийся в пептидогликане, который обнаруживается у грамположительных и грамотрицательных бактерий [154]. Воздействие MDP запускает ряд острых воспалительных сигнальных эффектов, индуцирующих выработку и секрецию воспалительных цитокинов [155]. Наиболее изученный NLR, белок 3, содержащий пириновый домен семейства NLR (NLRP3), может быть активирован различными экзогенными и эндогенными лигандами или стимулами, такими как активные формы кислорода, АТФ, бактерии, вирусы и грибы [156]. Однако то, как NLRP3 поддерживает кишечный гомеостаз, остается спорным. Некоторые исследования показывают, что мыши NLRP3 - / - склонны к колиту, в то время как другие исследования показывают, что воспалительные реакции у этих мышей уменьшены [157,158,159]. Лиганды белка 4 (NLRC4), содержащие домен CARD домена NLR, включают флагеллин бактерий, таких как Salmonella и PrgJ и CprI (субъединицы бактериальных систем секреции типа III) [160, 161, 162]. NLRC4 защищает кишечный барьер слизистой оболочки путем ограничения кишечных патогенных микроорганизмов, таких как Citrobacter rodentium и Salmonella [160,163]. Лиганды NLRP6 остаются неизвестными, но доказательства установили связь между NLRP6 и кишечной микробиотой. Секвенирование микробного генома показало, что микробиота кишечника изменяется у мышей с дефицитом NLRP6, причем уровни доминирующих бактерий (Firmicutes, Bacteroidetes и Proteobacteria) значительно изменяются [164,165]. Наиболее интересно то, что чрезмерная активация NLRP12 ингибирует передачу сигнала NF-κB. Мыши NLRP12 - / - также имеют те же характеристики, отражающие восприимчивость к колиту и дисбактериозу микробиома, что указывает на ключевую роль NLRP12 в поддержании гомеостаза кишечника [166].
5. Обсуждение и выводы
При поддержании гомеостаза кишечника иммунная система слизистой оболочки кишечника может эффективно противостоять инвазии патогенных микроорганизмов и подавлять чрезмерное размножение патогенов, и одновременно комменсальные кишечные бактерии поддерживают иммунную толерантность кишечника [167]. Тем не менее, взаимодействие иммунной системы и микробиоты действует как обоюдоострый меч, причем микробиота полезна для хозяина в нормальных условиях, но также потенциально может вызывать побочные эффекты у хозяина, которые способствуют воспалению [168]. Микробиота кишечника постоянно контролируется иммунной системой слизистой оболочки, и любое небольшое нарушение в микробиоте кишечника может способствовать нарушению иммунной системы кишечника и повышению восприимчивости к ВЗК [169]. Иммунная система слизистой оболочки кишечника содержит различные пути передачи сигнала, которые включают передачу сигналов PRR и адаптивные ответы Т-клеток. PRRs являются первыми сенсорами микроорганизмов (включая патогены, комменсальные бактерии и условные патогены), и они действуют как часть системы защиты хозяина. Однако неясно, все ли микроорганизмы (такие как бактерии, грибы или вирусы) одинаково воспринимаются PRRs или существуют более специфические механизмы распознавания и защиты для поддержания гомеостаза кишечника. Кроме того, хотя многие исследования показали влияние патогенов и комменсальных бактерий на иммунную функцию кишечника, о влиянии условных патогенов на иммунный гомеостаз слизистой оболочки кишечника сообщается редко. Тем не менее, была обнаружена определенная коэволюционная связь между условными патогенами и хозяевами, и условные патогены могут активировать врожденную кишечную иммунную систему, вызывая тем самым воспаление кишечника [106, 170, 171].
Интересно, что воздействие микроорганизмов в раннем возрасте имеет решающее значение для построения иммунной системы хозяина, и это помогает хозяину строить ранние врожденные иммунные реакции и регулировать развитие аутоиммунных и воспалительных заболеваний, таких как ВЗК [5,167,172]. В течение первых нескольких лет жизни кишечные микроорганизмы могут прямо или косвенно влиять на созревание иммунной системы слизистой оболочки кишечника [173]. Кроме того, колонизация клостридиями (Clostridia) неонатального кишечного тракта способствует предотвращению роста кишечных патогенов [174]. Кроме того, при постоянном наблюдении за беременными мышами и их потомством недавнее исследование показало, что воздействие микробов матери во время беременности формирует кишечную иммунную систему потомства, включая врожденные лимфоидные и мононуклеарные популяции клеток [175]. Иммунитет слизистой оболочки кишечника (включая функции IECs, продукцию IgA и дифференцировку Т-клеточных подмножеств) у мышей без микробов очень отличается от такового у обычно выращенных мышей, а у мышей без микробов они более чувствительны к воздействию DSS [176, 177, 177, 179].
Между тем, существует потенциальная связь между дефицитом передачи сигналов PRRs (например, связанным с NOD2, MyD88 и TLR5) и составом микробиоты, и дефекты в некоторых PRRs могут вносить вклад в восприимчивость к ВЗК [136, 141, 180]. Примечательно, что мутации локусов NOD2 у пациентов с ВЗК значительно коррелируют с изменениями состава микробиоты, ассоциированной с кишечником, включая увеличение эшерихий (Escherichia) и уменьшение фекалибактерий (Faecalibacterium) [181].
Таким образом, дисбактериоз микробиоты может влиять на иммунную систему слизистой оболочки кишечника и, в свою очередь, дисфункция иммунной системы может вызвать нарушения микробиоты кишечника. Тем не менее, данные исследований об этих интерактивных отношениях все еще очень ограничены, из-за отсутствия построения и понимания сети совместного регулирования между сигнальными путями и кишечной микробиотой или ее профилями метаболитов. Внедрение междисциплинарных и многодоменных технологий в сочетании с геномикой, протеомикой, метабономикой, быстро развивающимся компьютерным искусственным интеллектом и технологией биоинформатики будет иметь решающее значение для дальнейшего освещения сложных механизмов взаимодействия микробиоты кишечника со слизистой оболочкой при ВЗК. Точное понимание и прояснение сложных связей между микробиотой кишечника и иммунной системой слизистой оболочки поможет исследователям разработать новые и эффективные методы лечения и в конечном итоге вылечить ВЗК.
- Т-клетки (Т-лимфоциты). Понятие, определение
- Врожденный и адаптивный иммунитет
- Цитокины в системе иммунитета
- Толл-подобные рецепторы и иммунный ответ (+видео)
- Иммунитет, лимфоциты и дендритные клетки
- T-лимфоциты и их циркуляция
- Врожденные лимфоидные клетки (ILCs) и патогенные бактерии (+ видео)
- Регуляторные Т-клетки - миротворцы иммунной системы
- Развитие и поддержание регуляторных Т-клеток
- Арилуглеводородный рецептор AHR в кишечном гомеостазе, иммуниете и иммунопатологии
- Иммуноглобулин А, активный связующий элемент для гомеостаза микробиоты хозяина
- Микробиом, метаболом и воспалительное заболевание кишечника
- Пребиотики, пробиотики, синбиотики, парапробиотики и постбиотики при воспалительных заболеваниях кишечника
- Пробиотическое лечение болезни Крона с помощью разрушения полимикробных биопленок
- Иммунитет и диета при воспалительных заболеваниях кишечника
- Кишечная микробиота, ожирение, болезнь Крона и колоректальный рак
- Микробные метаболиты при воспалительных заболеваниях кишечника
- Болезнь Крона, кишечная микробиота и лечебные диеты
- Кишечный микробиом, иммунитет и инфекционные заболевания
- Пробиотики регулируют микробиоту кишечника: Эффективный метод повышения иммунитета
- Микробиота кишечника и хроническое системное воспаление низкой степени
- Вклад комменсальной микрофлоры в иммунологический гомеостаз
- Дивертикулез, дивертикулит, пробиотики и кишечная микробиота
- Роль микробиоты в иммунитете и воспалении (+ видео)
- Микробиота кишечника и воспаление
- Взаимодействие между иммунной системой и микробиотой при воспалительных заболеваниях кишечника
- Роль кишечной микробиоты и метаболитов в гомеостазе кишечника и заболеваниях человека
- Иммунопатология атеросклероза и кишечная микробиота
- Регуляция иммунного развития тимуса кишечными микробами в раннем детстве
- МикроРНК, микробиом кишечника и иммунитет (доп. информация)
- Потенциальное влияние короткоцепочечных жирных кислот на эпигенетическую регуляцию врожденной иммунной памяти
- Вирусные инфекции, микробиом и пробиотики
К разделу:
К разделам:
- «Микрофлора ЖКТ» (дополнительная информация)
- «Микробиом» (дополнительная информация)
Источник: Bei Yue, Xiaoping Luo, Zhilun Yu, Sridhar Mani, Zhengtao Wang, Wei Dou. Inflammatory Bowel Disease: A Potential Result from the Collusion between Gut Microbiota and Mucosal Immune System. Microorganisms, 2019, 7(10), 440
Литература:
- Yue, B.; Ren, Y.J.; Zhang, J.J.; Luo, X.P.; Yu, Z.L.; Ren, G.Y.; Sun, A.N.; Deng, C.; Wang, Z.T.; Dou, W. Anti-Inflammatory Effects of Fargesin on Chemically Induced Inflammatory Bowel Disease in Mice. Molecules 2018, 23. [Google Scholar] [CrossRef] [PubMed]
- Harris, K.G.; Chang, E.B. The intestinal microbiota in the pathogenesis of inflammatory bowel diseases: New insights into complex disease. Clin. Sci. (Lond.) 2018, 132, 2013–2028. [Google Scholar] [CrossRef] [PubMed]
- Molodecky, N.A.; Soon, I.S.; Rabi, D.M.; Ghali, W.A.; Ferris, M.; Chernoff, G.; Benchimol, E.I.; Panaccione, R.; Ghosh, S.; Barkema, H.W.; et al. Increasing incidence and prevalence of the inflammatory bowel diseases with time, based on systematic review. Gastroenterology 2012, 142, 46–54. [Google Scholar] [CrossRef] [PubMed]
- Winglee, K.; Howard, A.G.; Sha, W.; Gharaibeh, R.Z.; Liu, J.; Jin, D.; Fodor, A.A.; Gordon-Larsen, P. Recent urbanization in China is correlated with a Westernized microbiome encoding increased virulence and antibiotic resistance genes. Microbiome 2017, 5, 121. [Google Scholar] [CrossRef] [PubMed]
- Zuo, T.; Kamm, M.A.; Colombel, J.F.; Ng, S.C. Urbanization and the gut microbiota in health and inflammatory bowel disease. Nat. Rev. Gastroenterol. Hepatol. 2018, 15, 440–452. [Google Scholar] [CrossRef] [PubMed]
- Curciarello, R.; Canziani, K.E.; Docena, G.H.; Muglia, C.I. Contribution of Non-immune Cells to Activation and Modulation of the Intestinal Inflammation. Front Immunol. 2019, 10, 647. [Google Scholar] [CrossRef] [PubMed]
- Cohen, L.J.; Cho, J.H.; Gevers, D.; Chu, H. Genetic Factors and the Intestinal Microbiome Guide Development of Microbe-Based Therapies for Inflammatory Bowel Diseases. Gastroenterology 2019, 156, 2174–2189. [Google Scholar] [CrossRef] [PubMed]
- Ananthakrishnan, A.N.; Bernstein, C.N.; Iliopoulos, D.; Macpherson, A.; Neurath, M.F.; Ali, R.A.R.; Vavricka, S.R.; Fiocchi, C. Environmental triggers in IBD: A review of progress and evidence. Nat. Rev. Gastroenterol. Hepatol. 2018, 15, 39–49. [Google Scholar] [CrossRef]
- Gao, X.; Cao, Q.; Cheng, Y.; Zhao, D.; Wang, Z.; Yang, H.; Wu, Q.; You, L.; Wang, Y.; Lin, Y.; et al. Chronic stress promotes colitis by disturbing the gut microbiota and triggering immune system response. Proc. Natl. Acad. Sci. USA 2018, 115, E2960–E2969. [Google Scholar] [CrossRef] [PubMed]
- Underhill, D.M.; Iliev, I.D. The mycobiota: Interactions between commensal fungi and the host immune system. Nat. Rev. Immunol. 2014, 14, 405–416. [Google Scholar] [CrossRef]
- Norman, J.M.; Handley, S.A.; Baldridge, M.T.; Droit, L.; Liu, C.Y.; Keller, B.C.; Kambal, A.; Monaco, C.L.; Zhao, G.; Fleshner, P.; et al. Disease-specific alterations in the enteric virome in inflammatory bowel disease. Cell 2015, 160, 447–460. [Google Scholar] [CrossRef] [PubMed]
- Pickard, J.M.; Zeng, M.Y.; Caruso, R.; Núñez, G. Gut microbiota: Role in pathogen colonization, immune responses, and inflammatory disease. Immunol. Rev. 2017, 279, 70–89. [Google Scholar] [CrossRef] [PubMed]
- Carding, S.; Verbeke, K.; Vipond D, T.; Corfe, B.M.; Owen, L.J. Dysbiosis of the gut microbiota in disease. Microb. Ecol. Health Dis. 2015, 26, 26191. [Google Scholar] [CrossRef] [PubMed]
- Manichanh, C.; Borruel, N.; Casellas, F.; Guarner, F. The gut microbiota in IBD. Nat. Rev. Gastroenterol. Hepatol. 2012, 9, 599–608. [Google Scholar] [CrossRef] [PubMed]
- Hirata, Y.; Ihara, S.; Koike, K. Targeting the complex interactions between microbiota: Host epithelial and immune cells in inflammatory bowel disease. Pharmacol. Res. 2016, 113, 574–584. [Google Scholar] [CrossRef] [PubMed]
- Chiodini, R.J.; Van Kruiningen, H.J.; Thayer, W.R.; Merkal, R.S.; Coutu, J.A. Possible role of mycobacteria in inflammatory bowel disease. I. An unclassified Mycobacterium species isolated from patients with Crohn’s disease. Dig. Dis. Sci. 1984, 29, 1073–1079. [Google Scholar] [CrossRef] [PubMed]
- Bernstein, C.N.; Shanahan, F. Disorders of a modern lifestyle: Reconciling the epidemiology of inflammatory bowel diseases. Gut 2008, 57, 1185–1191. [Google Scholar] [CrossRef] [PubMed]
- Feller, M.; Huwiler, K.; Stephan, R.; Altpeter, E.; Shang, A.; Furrer, H.; Pfyffer, G.E.; Jemmi, T.; Baumgartner, A.; Egger, M. Mycobacterium avium subspecies paratuberculosis and Crohn’s disease: A systematic review and meta-analysis. Lancet. Infect. Dis. 2007, 7, 607–613. [Google Scholar] [CrossRef]
- Okura, H.; Toft, N.; Nielsen, S.S. Occurrence of Mycobacterium avium subsp. paratuberculosis in milk at dairy cattle farms: A systematic review and meta-analysis. Vet. Microbiol. 2012, 157, 253–263. [Google Scholar] [CrossRef] [PubMed]
- Palmela, C.; Chevarin, C.; Xu, Z.; Torres, J.; Sevrin, G.; Hirten, R.; Barnich, N.; Ng, S.C.; Colombel, J.F. Adherent-invasive Escherichia coli in inflammatory bowel disease. Gut2018, 67, 574–587. [Google Scholar] [CrossRef]
- Carrillo-Larco, R.M.; Bernabe-Ortiz, A.; Pillay, T.D.; Gilman, R.H.; Sanchez, J.F.; Proterico, J.A.; Quispe, R.; Smeeth, L.; Miranda, J.J. Obesity risk in rural, urban and rural-to-urban migrants: Prospective results of the PERU MIGRANT study. Int. J. Obes. (Lond.) 2016, 40, 181–185. [Google Scholar] [CrossRef] [PubMed]
- McPhee, J.B.; Small, C.L.; Reid-Yu, S.A.; Brannon, J.R.; Le Moual, H.; Coombes, B.K. Host defense peptide resistance contributes to colonization and maximal intestinal pathology by Crohn’s disease-associated adherent-invasive Escherichia coli. Infect. Immun. 2014, 82, 3383–3393. [Google Scholar] [CrossRef] [PubMed]
- Jarry, A.; Cremet, L.; Caroff, N.; Bou-Hanna, C.; Mussini, J.M.; Reynaud, A.; Servin, A.L.; Mosnier, J.F.; Lievin-Le Moal, V.; Laboisse, C.L. Subversion of human intestinal mucosa innate immunity by a Crohn’s disease-associated E. coli. Mucosal. Immunol. 2015, 8, 572–581. [Google Scholar] [CrossRef] [PubMed]
- Viladomiu, M.; Kivolowitz, C.; Abdulhamid, A.; Dogan, B.; Victorio, D.; Castellanos, J.G.; Woo, V.; Teng, F.; Tran, N.L.; Sczesnak, A.; et al. IgA-coated E. coli enriched in Crohn’s disease spondyloarthritis promote TH17-dependent inflammation. Sci. Transl. Med. 2017, 9. [Google Scholar] [CrossRef] [PubMed]
- Tremlett, H.; Bauer, K.C.; Appel-Cresswell, S.; Finlay, B.B.; Waubant, E. The gut microbiome in human neurological disease: A review. Ann. Neurol. 2017, 81, 369–382. [Google Scholar] [CrossRef] [PubMed]
- Huttenhower, C.; Kostic, A.D.; Xavier, R.J. Inflammatory bowel disease as a model for translating the microbiome. Immunity 2014, 40, 843–854. [Google Scholar] [CrossRef] [PubMed]
- Sun, L.; Nava, G.M.; Stappenbeck, T.S. Host genetic susceptibility, dysbiosis and viral triggers in inflammatory bowel disease. Curr. Opin. Gastroenterol. 2011, 27, 321–327. [Google Scholar] [CrossRef] [PubMed]
- Turnbaugh, P.J.; Hamady, M.; Yatsunenko, T.; Cantarel, B.L.; Duncan, A.; Ley, R.E.; Sogin, M.L.; Jones, W.J.; Roe, B.A.; Affourtit, J.P.; et al. A core gut microbiome in obese and lean twins. Nature 2009, 457, 480–484. [Google Scholar] [CrossRef] [PubMed]
- Qin, J.; Li, R.; Raes, J.; Arumugam, M.; Burgdorf, K.S.; Manichanh, C.; Nielsen, T.; Pons, N.; Levenez, F.; Yamada, T.; et al. A human gut microbial gene catalogue established by metagenomic sequencing. Nature 2010, 464, 59–65. [Google Scholar] [CrossRef] [PubMed]
- Donaldson, G.P.; Lee, S.M.; Mazmanian, S.K. Gut biogeography of the bacterial microbiota. Nat. Rev. Microbiol. 2016, 14, 20–32. [Google Scholar] [CrossRef] [PubMed]
- Eckburg, P.B.; Bik, E.M.; Bernstein, C.N.; Purdom, E.; Dethlefsen, L.; Sargent, M.; Gill, S.R.; Nelson, K.E.; Relman, D.A. Diversity of the human intestinal microbial flora. Science2005, 308, 1635–1638. [Google Scholar] [CrossRef] [PubMed]
- Honda, K.; Littman, D.R. The microbiome in infectious disease and inflammation. Annu. Rev. Immunol. 2012, 30, 759–795. [Google Scholar] [CrossRef] [PubMed]
- Coleman, O.I.; Haller, D. Bacterial Signaling at the Intestinal Epithelial Interface in Inflammation and Cancer. Front. Immunol. 2017, 8, 1927. [Google Scholar] [CrossRef] [PubMed]
- Sun, M.; Wu, W.; Liu, Z.; Cong, Y. Microbiota metabolite short chain fatty acids, GPCR, and inflammatory bowel diseases. J. Gastroenterol. 2017, 52, 1–8. [Google Scholar] [CrossRef]
- Lepage, P.; Häsler, R.; Spehlmann, M.E.; Rehman, A.; Zvirbliene, A.; Begun, A.; Ott, S.; Kupcinskas, L.; Doré, J.; Raedler, A.; et al. Twin study indicates loss of interaction between microbiota and mucosa of patients with ulcerative colitis. Gastroenterology 2011, 141, 227–236. [Google Scholar] [CrossRef] [PubMed]
- Nemoto, H.; Kataoka, K.; Ishikawa, H.; Ikata, K.; Arimochi, H.; Iwasaki, T.; Ohnishi, Y.; Kuwahara, T.; Yasutomo, K. Reduced diversity and imbalance of fecal microbiota in patients with ulcerative colitis. Dig. Dis. Sci. 2012, 57, 2955–2964. [Google Scholar] [CrossRef] [PubMed]
- Jakobsson, H.E.; Abrahamsson, T.R.; Jenmalm, M.C.; Harris, K.; Quince, C.; Jernberg, C.; Björkstén, B.; Engstrand, L.; Andersson, A.F. Decreased gut microbiota diversity, delayed Bacteroidetes colonization and reduced Th1 responses in infants delivered by caesarean section. Gut 2014, 63, 559–566. [Google Scholar] [CrossRef]
- Manichanh, C.; Rigottier-Gois, L.; Bonnaud, E.; Gloux, K.; Pelletier, E.; Frangeul, L.; Nalin, R.; Jarrin, C.; Chardon, P.; Marteau, P.; et al. Reduced diversity of faecal microbiota in Crohn’s disease revealed by a metagenomic approach. Gut 2006, 55, 205–211. [Google Scholar] [CrossRef] [PubMed]
- Peterson, D.A.; Frank, D.N.; Pace, N.R.; Gordon, J.I. Metagenomic approaches for defining the pathogenesis of inflammatory bowel diseases. Cell Host Microbe 2008, 3, 417–427. [Google Scholar] [CrossRef] [PubMed]
- Sheehan, D.; Moran, C.; Shanahan, F. The microbiota in inflammatory bowel disease. J. Gastroenterol. 2015, 50, 495–507. [Google Scholar] [CrossRef]
- Wang, W.; Chen, L.; Zhou, R.; Wang, X.; Song, L.; Huang, S.; Wang, G.; Xia, B. Increased proportions of Bifidobacterium and the Lactobacillus group and loss of butyrate-producing bacteria in inflammatory bowel disease. J. Clin. Microbiol. 2014, 52, 398–406. [Google Scholar] [CrossRef]
- Louis, P.; Hold, G.L.; Flint, H.J. The gut microbiota, bacterial metabolites and colorectal cancer. Nat. Rev. Microbiol. 2014, 12, 661–672. [Google Scholar] [CrossRef] [PubMed]
- De-Filippo, C.; Cavalieri, D.; Di Paola, M.; Ramazzotti, M.; Poullet, J.B.; Massart, S.; Collini, S.; Pieraccini, G.; Lionetti, P. Impact of diet in shaping gut microbiota revealed by a comparative study in children from Europe and rural Africa. Proc. Natl. Acad. Sci. USA2010, 107, 14691–14696. [Google Scholar] [CrossRef] [PubMed]
- Sommer, F.; Adam, N.; Johansson, M.E.; Xia, L.; Hansson, G.C.; Bäckhed, F. Altered mucus glycosylation in core 1 O-glycan-deficient mice affects microbiota composition and intestinal architecture. PLoS ONE 2014, 9, e85254. [Google Scholar] [CrossRef] [PubMed]
- Kleessen, B.; Kroesen, A.J.; Buhr, H.J.; Blaut, M. Mucosal and invading bacteria in patients with inflammatory bowel disease compared with controls. Scand. J. Gastroenterol. 2002, 37, 1034–1041. [Google Scholar] [CrossRef] [PubMed]
- Ocvirk, S.; Sava, I.G.; Lengfelder, I.; Lagkouvardos, I.; Steck, N.; Roh, J.H.; Tchaptchet, S.; Bao, Y.; Hansen, J.J.; Huebner, J.; et al. Surface-Associated Lipoproteins Link Enterococcus faecalis Virulence to Colitogenic Activity in IL-10-Deficient Mice Independent of Their Expression Levels. PLoS Pathog. 2015, 11, e1004911. [Google Scholar] [CrossRef] [PubMed]
- Sobieszczańska, B.A.; Duda-Madej, A.B.; Turniak, M.B.; Franiczek, R.; Kasprzykowska, U.; Duda, A.K.; Rzeszutko, M.; Iwańczak, B. Invasive properties: Adhesion patterns and phylogroup profiles among Escherichia coli strains isolated from children with inflammatory bowel disease. Adv. Clin. Exp. Med. 2012, 21, 591–599. [Google Scholar] [PubMed]
- Boudeau, J.; Glasser, A.L.; Julien, S.; Colombel, J.F.; Darfeuille-Michaud, A. Inhibitory effect of probiotic Escherichia coli strain Nissle 1917 on adhesion to and invasion of intestinal epithelial cells by adherent-invasive E. coli strains isolated from patients with Crohn’s disease. Aliment. Pharmacol. Ther. 2003, 18, 45–56. [Google Scholar] [CrossRef]
- Sartor, R.B.; Wu, G.D. Roles for Intestinal Bacteria, Viruses and Fungi in Pathogenesis of Inflammatory Bowel Diseases and Therapeutic Approaches. Gastroenterology 2017, 152, 327–339. [Google Scholar] [CrossRef]
- Russell, R.K.; Ip, B.; Aldhous, M.C.; MacDougall, M.; Drummond, H.E.; Arnott, I.D.; Gillett, P.M.; McGrogan, P.; Weaver, L.T.; Bisset, W.M.; et al. Anti-Saccharomyces cerevisiae antibodies status is associated with oral involvement and disease severity in Crohn disease. J. Pediatr. Gastroenterol. Nutr. 2009, 48, 161–167. [Google Scholar] [CrossRef]
- Colombel, J.F.; Sendid, B.; Jouault, T.; Poulain, D. Secukinumab failure in Crohn’s disease: The yeast connection? Gut 2013, 62, 800–801. [Google Scholar] [CrossRef] [PubMed]
- Richard, M.L.; Lamas, B.; Liguori, G.; Hoffmann, T.W.; Sokol, H. Gut fungal microbiota: The Yin and Yang of inflammatory bowel disease. Inflamm. Bowel. Dis. 2015, 21, 656–665. [Google Scholar] [CrossRef] [PubMed]
- Sokol, H.; Leducq, V.; Aschard, H.; Pham, H.P.; Jegou, S.; Landman, C.; Cohen, D.; Liguori, G.; Bourrier, A.; Nion-Larmurier, I.; et al. Fungal microbiota dysbiosis in IBD. Gut2017, 66, 1039–1048. [Google Scholar] [CrossRef] [PubMed]
- Jawhara, S.; Poulain, D. Saccharomyces boulardii decreases inflammation and intestinal colonization by Candida albicans in a mouse model of chemically-induced colitis. Med. Mycol. 2007, 45, 691–700. [Google Scholar] [CrossRef] [PubMed]
- Jawhara, S.; Thuru, X.; Standaert-Vitse, A.; Jouault, T.; Mordon, S.; Sendid, B.; Desreumaux, P.; Poulain, D. Colonization of mice by Candida albicans is promoted by chemically induced colitis and augments inflammatory responses through galectin-3. J. Infect. Dis. 2008, 197, 972–980. [Google Scholar] [CrossRef] [PubMed]
- Wheeler, M.L.; Limon, J.J.; Bar, A.S.; Leal, C.A.; Gargus, M.; Tang, J.; Brown, J.; Funari, V.A.; Wang, H.L.; Crother, T.R.; et al. Immunological Consequences of Intestinal Fungal Dysbiosis. Cell Host Microbe 2016, 19, 865–873. [Google Scholar] [CrossRef] [PubMed]
- Pfeiffer, J.K.; Virgin, H.W. Viral immunity. Transkingdom control of viral infection and immunity in the mammalian intestine. Science 2016, 351. [Google Scholar] [CrossRef] [PubMed]
- Virgin, H.W. The virome in mammalian physiology and disease. Cell 2014, 157, 142–150. [Google Scholar] [CrossRef] [PubMed]
- Karst, S.M. Viral, Safeguard: The Enteric Virome Protects against Gut Inflammation. Immunity 2016, 44, 715–718. [Google Scholar] [CrossRef] [PubMed]
- Basic, M.; Keubler, L.M.; Buettner, M.; Achard, M.; Breves, G.; Schröder, B.; Smoczek, A.; Jörns, A.; Wedekind, D.; Zschemisch, N.H.; et al. Norovirus triggered microbiota-driven mucosal inflammation in interleukin 10-deficient mice. Inflamm. Bowel. Dis. 2014, 20, 431–443. [Google Scholar] [CrossRef] [PubMed]
- Cadwell, K.; Patel, K.K.; Maloney, N.S.; Liu, T.C.; Ng, A.C.; Storer, C.E.; Head, R.D.; Xavier, R.; Stappenbeck, T.S.; Virgin, H.W. Virus-plus-susceptibility gene interaction determines Crohn’s disease gene Atg16L1 phenotypes in intestine. Cell 2010, 141, 1135–1145. [Google Scholar] [CrossRef] [PubMed]
- Barr, J.J.; Auro, R.; Furlan, M.; Whiteson, K.L.; Erb, M.L.; Pogliano, J.; Stotland, A.; Wolkowicz, R.; Cutting, A.S.; Doran, K.S.l.; et al. Bacteriophage adhering to mucus provide a non-host-derived immunity. Proc. Natl. Acad. Sci. USA 2013, 110, 10771–10776. [Google Scholar] [CrossRef] [PubMed]
- Kernbauer, E.; Ding, Y.; Cadwell, K. An enteric virus can replace the beneficial function of commensal bacteria. Nature 2014, 516, 94–98. [Google Scholar] [CrossRef] [PubMed]
- Minot, S.; Bryson, A.; Chehoud, C.; Wu, G.D.; Lewis, J.D.; Bushman, F.D. Rapid evolution of the human gut virome. Proc. Natl. Acad. Sci. USA 2013, 110, 12450–12455. [Google Scholar] [CrossRef] [PubMed]
- Reyes, A.; Haynes, M.; Hanson, N.; Angly, F.E.; Heath, A.C.; Rohwer, F.; Gordon, J.I. Viruses in the faecal microbiota of monozygotic twins and their mothers. Nature 2010, 466, 334–338. [Google Scholar] [CrossRef]
- Minot, S.; Sinha, R.; Chen, J.; Li, H.; Keilbaugh, S.A.; Wu, G.D.; Lewis, J.D.; Bushman, F.D. The human gut virome: Inter-individual variation and dynamic response to diet. Genome. Res. 2011, 21, 1616–1625. [Google Scholar] [CrossRef]
- Waller, A.S.; Yamada, T.; Kristensen, D.M.; Kultima, J.R.; Sunagawa, S.; Koonin, E.V.; Bork, P. Classification and quantification of bacteriophage taxa in human gut metagenomes. ISME J. 2014, 8, 1391–1402. [Google Scholar] [CrossRef]
- Escalante, N.K.; Lemire, P.; Cruz-Tleugabulova, M.; Prescott, D.; Mortha, A.; Streutker, C.J.; Girardin, S.E.; Philpott, D.J.; Mallevaey, T. The common mouse protozoa Tritrichomonas muris alters mucosal T cell homeostasis and colitis susceptibility. J. Exp. Med. 2016, 213, 2841–2850. [Google Scholar] [CrossRef]
- Stentiford, G.D.; Becnel, J.; Weiss, L.M.; Keeling, P.J.; Didier, E.S.; Williams, B.A.P.; Bjornson, S.; Kent, M.L.; Freeman, M.A.; Brown, M.J.F.; et al. Microsporidia—Emergent Pathogens in the Global Food Chain. Trends Parasitol. 2016, 32, 336–348. [Google Scholar] [CrossRef] [PubMed]
- Moonah, S.N.; Jiang, N.M.; Petri, W.A., Jr. Host immune response to intestinal amebiasis. PLoS Pathog. 2013, 9, e1003489. [Google Scholar] [CrossRef]
- Molloy, M.J.; Grainger, J.R.; Bouladoux, N.; Hand, T.W.; Koo, L.Y.; Naik, S.; Quinones, M.; Dzutsev, A.K.; Gao, J.L.; Trinchieri, G.; et al. Intraluminal containment of commensal outgrowth in the gut during infection-induced dysbiosis. Cell Host Microbe. 2013, 14, 318–328. [Google Scholar] [CrossRef] [PubMed]
- Kotloff, K.L.; Nataro, J.P.; Blackwelder, W.C.; Nasrin, D.; Farag, T.H.; Panchalingam, S.; Wu, Y.; Sow, S.O.; Sur, D.; Breiman, R.F.; et al. Burden and aetiology of diarrhoeal disease in infants and young children in developing countries (the Global Enteric Multicenter Study, GEMS): A prospective, case-control study. Lancet 2013, 382, 209–222. [Google Scholar] [CrossRef]
- Lewthwaite, P.; Gill, G.V.; Hart, C.A.; Beeching, N.J. Gastrointestinal parasites in the immunocompromised. Curr. Opin. Infect. Dis. 2005, 18, 427–435. [Google Scholar] [CrossRef] [PubMed]
- Lukeš, J.; Stensvold, C.R.; Jirků-Pomajbiková, K.; Wegener-Parfrey, L. Are Human Intestinal Eukaryotes Beneficial or Commensals? PLoS Pathog. 2015, 11, e1005039. [Google Scholar] [CrossRef] [PubMed]
- Parfrey, L.W.; Walters, W.A.; Lauber, C.L.; Clemente, J.C.; Berg-Lyons, D.; Teiling, C.; Kodira, C.; Mohiuddin, M.; Brunelle, J.; Driscoll, M.; et al. Communities of microbial eukaryotes in the mammalian gut within the context of environmental eukaryotic diversity. Front. Microbiol. 2014, 5, 298. [Google Scholar] [CrossRef] [PubMed]
- Parfrey, L.W.; Walters, W.A.; Knight, R. Microbial eukaryotes in the human microbiome, ecology, evolution, and future directions. Front. Microbiol. 2011, 2, 153. [Google Scholar] [CrossRef] [PubMed]
- Chudnovskiy, A.; Mortha, A.; Kana, V.; Kennard, A.; Ramirez, J.D.; Rahman, A.; Remark, R.; Mogno, I.; Ng, R.; Gnjatic, S.; et al. Host-Protozoan Interactions Protect from Mucosal Infections through Activation of the Inflammasome. Cell 2016, 167, 444–456. [Google Scholar] [CrossRef] [PubMed]
- Howitt, M.R.; Lavoie, S.; Michaud, M.; Blum, A.M.; Tran, S.V.; Weinstock, J.V.; Gallini, C.A.; Redding, K.; Margolskee, R.F.; Osborne, L.C.; et al. Tuft cells, taste-chemosensory cells, orchestrate parasite type 2 immunity in the gut. Science 2016, 351, 1329–1333. [Google Scholar] [CrossRef] [PubMed]
- Vitetta, L.; Saltzman, E.T.; Nikov, T.; Ibrahim, I.; Hall, S. Modulating the Gut Micro-Environment in the Treatment of Intestinal Parasites. J. Clin. Med. 2016, 5. [Google Scholar] [CrossRef] [PubMed]
- Weinstock, J.V.; Elliott, D.E. Helminths and the IBD hygiene hypothesis. Inflamm. Bowel. Dis. 2009, 15, 128–133. [Google Scholar] [CrossRef] [PubMed]
- Wang, L.; Xie, H.; Xu, L.; Liao, Q.; Wan, S.; Yu, Z.; Lin, D.; Zhang, B.; Lv, Z.; Wu, Z.; et al. rSj16 Protects against DSS-Induced Colitis by Inhibiting the PPAR-alpha Signaling Pathway. Theranostics 2017, 7, 3446–3460. [Google Scholar] [CrossRef] [PubMed]
- Hewitson, J.P.; Grainger, J.R.; Maizels, R.M. Helminth immunoregulation: The role of parasite secreted proteins in modulating host immunity. Mol. Biochem. Parasitol. 2009, 167, 1–11. [Google Scholar] [CrossRef] [PubMed]
- Ramanan, D.; Bowcutt, R.; Lee, S.C.; Tang, M.S.; Kurtz, Z.D.; Ding, Y.; Honda, K.; Gause, W.C.; Blaser, M.J.; Bonneau, R.A.; et al. Helminth infection promotes colonization resistance via type 2 immunity. Science 2016, 352, 608–612. [Google Scholar] [CrossRef] [PubMed]
- Giacomin, P.; Agha, Z.; Loukas, A. Helminths and Intestinal Flora Team Up to Improve Gut Health. Trends Parasitol. 2016, 32, 664–666. [Google Scholar] [CrossRef] [PubMed]
- Perez-Lopez, A.; Behnsen, J.; Nuccio, S.P.; Raffatellu, M. Mucosal immunity to pathogenic intestinal bacteria. Nat. Rev. Immunol. 2016, 16, 135–148. [Google Scholar] [CrossRef] [PubMed]
- Atuma, C.; Strugala, V.; Allen, A.; Holm, L. The adherent gastrointestinal mucus gel layer: Thickness and physical state in vivo. Am. J. Physiol. Gastrointest. Liver Physiol. 2001, 280, G922–G929. [Google Scholar] [CrossRef]
- Barrett, J.C.; Lee, J.C.; Lees, C.W.; Prescott, N.J.; Anderson, C.A.; Phillips, A.; Wesley, E.; Parnell, K.; Zhang, H.; Drummond, H.; et al. Genome-wide association study of ulcerative colitis identifies three new susceptibility loci, including the HNF4A region. Nat. Genet. 2009, 41, 1330–1334. [Google Scholar]
- Van-der-Sluis, M.; De-Koning, B.A.; De-Bruijn, A.C.; Velcich, A.; Meijerink, J.P.; Van-Goudoever, J.B.; Büller, H.A.; Dekker, J.; Van-Seuningen, I.; Renes, I.B.; et al. Muc2-deficient mice spontaneously develop colitis, indicating that MUC2 is critical for colonic protection. Gastroenterology 2006, 131, 117–129. [Google Scholar] [CrossRef]
- Martens, E.C.; Neumann, M.; Desai, M.S. Interactions of commensal and pathogenic microorganisms with the intestinal mucosal barrier. Nat. Rev. Microbiol. 2018. [Google Scholar] [CrossRef]
- Johansson, M.E.; Hansson, G.C. Immunological aspects of intestinal mucus and mucins. Nat. Rev. Immunol. 2016, 16, 639–649. [Google Scholar] [CrossRef]
- Javitt, G.; Calvo, M.L.G.; Albert, L.; Reznik, N.; Ilani, T.; Diskin, R.; Fass, D. Intestinal gel-forming mucins polymerize by disulfide-mediated dimerization of d3 domains. J. Mol. Biol.2019, 431, 3740–3752. [Google Scholar] [CrossRef] [PubMed]
- Petta, I.; Fraussen, J.; Somers, V.; Kleinewietfeld, M. Interrelation of Diet, Gut Microbiome, and Autoantibody Production. Front. Immunol. 2018, 9, 439. [Google Scholar] [CrossRef] [PubMed]
- Ijssennagger, N.; van-der-Meer, R.; van-Mil, S.W.C. Sulfide as a Mucus Barrier-Breaker in Inflammatory Bowel Disease? Trends Mol. Med. 2016, 22, 190–199. [Google Scholar] [CrossRef] [PubMed]
- Johansson, M.E.; Gustafsson, J.K.; Holmen-Larsson, J.; Jabbar, K.S.; Xia, L.; Xu, H.; Ghishan, F.K.; Carvalho, F.A.; Gewirtz, A.T.; Sjövall, H.; et al. Bacteria penetrate the normally impenetrable inner colon mucus layer in both murine colitis models and patients with ulcerative colitis. Gut 2014, 63, 281–291. [Google Scholar] [CrossRef] [PubMed]
- Goto, Y.; Ivanov, I.I. Intestinal epithelial cells as mediators of the commensal-host immune crosstalk. Immunol. Cell Biol. 2013, 91, 204–214. [Google Scholar] [CrossRef] [PubMed]
- Kurashima, Y.; Kiyono, H. Mucosal Ecological Network of Epithelium and Immune Cells for Gut Homeostasis and Tissue Healing. Annu. Rev. Immunol. 2017, 35, 119–147. [Google Scholar] [CrossRef] [PubMed]
- Barker, N. Adult intestinal stem cells: Critical drivers of epithelial homeostasis and regeneration. Nat. Rev. Mol. Cell Biol. 2014, 15, 19–33. [Google Scholar] [CrossRef] [PubMed]
- Gribblem, F.M.; Reimannm, F. Enteroendocrine Cells: Chemosensors in the Intestinal Epithelium. Annu. Rev. Physiol. 2016, 78, 277–299. [Google Scholar] [CrossRef] [PubMed]
- Gerbe, F.; van-Es, J.H.; Makrini, L.; Brulin, B.; Mellitzer, G.; Robine, S.; Romagnolo, B.; Shroyer, N.F.; Bourgaux, J.F.; Pignodel, C.; et al. Distinct ATOH1 and Neurog3 requirements define tuft cells as a new secretory cell type in the intestinal epithelium. J. Cell Biol. 2011, 192, 767–780. [Google Scholar] [CrossRef] [PubMed]
- Henson, C.C.; Burden, S.; Davidson, S.E.; Lal, S. Nutritional interventions for reducing gastrointestinal toxicity in adults undergoing radical pelvic radiotherapy. Cochrane. Database. Syst. Rev. 2013, D9896. [Google Scholar] [CrossRef] [PubMed]
- Bernardo, D.; Chaparro, M.; Gisbert, J.P. Human Intestinal Dendritic Cells in Inflammatory Bowel Diseases. Mol. Nutr. Food Res. 2018, 62, e1700931. [Google Scholar] [CrossRef] [PubMed]
- Meroni, E.; Stakenborg, N.; Viola, M.F.; Boeckxstaens, G.E. Intestinal macrophages and their interaction with the enteric nervous system in health and inflammatory bowel disease. Acta. Physiol. (Oxf.) 2019, 225, e13163. [Google Scholar] [CrossRef] [PubMed]
- Geremia, A.; Biancheri, P.; Allan, P.; Corazza, G.R.; Di-Sabatino, A. Innate and adaptive immunity in inflammatory bowel disease. Autoimmun. Rev. 2014, 13, 3–10. [Google Scholar] [CrossRef] [PubMed]
- Goldberg, R.; Prescott, N.; Lord, G.M.; MacDonald, T.T.; Powell, N. The unusual suspects--innate lymphoid cells as novel therapeutic targets in IBD. Nat. Rev. Gastroenterol. Hepatol. 2015, 12, 271–283. [Google Scholar] [CrossRef] [PubMed]
- Cader, M.Z.; Kaser, A. Recent advances in inflammatory bowel disease: Mucosal immune cells in intestinal inflammation. Gut 2013, 62, 1653–1664. [Google Scholar] [CrossRef] [PubMed]
- Rossi, O.; van-Baarlen, P.; Wells, J.M. Host-recognition of pathogens and commensals in the mammalian intestine. Curr. Top Microbiol. Immunol. 2013, 358, 291–321. [Google Scholar] [PubMed]
- Sarra, M.; Pallone, F.; Macdonald, T.T.; Monteleone, G. IL-23/IL-17 axis in IBD. Inflamm. Bowel. Dis. 2010, 16, 1808–1813. [Google Scholar] [CrossRef] [PubMed]
- Li, Y.; Wei, C.; Xu, H.; Jia, J.; Wei, Z.; Guo, R.; Jia, Y.; Wu, Y.; Li, Y.; Qi, X.; et al. The Immunoregulation of Th17 in Host against Intracellular Bacterial Infection. Mediators. Inflamm. 2018, 2018, 6587296. [Google Scholar] [CrossRef]
- Pandiyan, P.; Bhaskaran, N.; Zou, M.; Schneider, E.; Jayaraman, S.; Huehn, J. Microbiome Dependent Regulation of Tregs and Th17 Cells in Mucosa. Front. Immunol.2019, 10, 426. [Google Scholar] [CrossRef] [PubMed]
- Sun, M.; He, C.; Cong, Y.; Liu, Z. Regulatory immune cells in regulation of intestinal inflammatory response to microbiota. Mucosal. Immunol. 2015, 8, 969–978. [Google Scholar] [CrossRef]
- Okumura, R.; Takeda, K. Maintenance of gut homeostasis by the mucosal immune system. Proc. Jpn. Acad. Ser. B Phys. Biol. Sci. 2016, 92, 423–435. [Google Scholar] [CrossRef] [PubMed]
- Ostman, S.; Rask, C.; Wold, A.E.; Hultkrantz, S.; Telemo, E. Impaired regulatory T cell function in germ-free mice. Eur. J. Immunol. 2006, 36, 2336–2346. [Google Scholar] [CrossRef] [PubMed]
- Geva-Zatorsky, N.; Sefik, E.; Kua, L.; Pasman, L.; Tan, T.G.; Ortiz-Lopez, A.; Yanortsang, T.B.; Yang, L.; Jupp, R.; Mathis, D.; et al. Mining the Human Gut Microbiota for Immunomodulatory Organisms. Cell 2017, 168, 928–943. [Google Scholar] [CrossRef] [PubMed]
- Atarashi, K.; Tanoue, T.; Shima, T.; Imaoka, A.; Kuwahara, T.; Momose, Y.; Cheng, G.; Yamasaki, S.; Saito, T.; Ohba, Y.; et al. Induction of colonic regulatory T cells by indigenous Clostridium species. Science 2011, 331, 337–341. [Google Scholar] [CrossRef]
- Zhou, L.; Zhang, M.; Wang, Y.; Dorfman, R.G.; Liu, H.; Yu, T.; Chen, X.; Tang, D.; Xu, L.; Yin, Y.; et al. Faecalibacterium prausnitzii Produces Butyrate to Maintain Th17/Treg Balance and to Ameliorate Colorectal Colitis by Inhibiting Histone Deacetylase 1. Inflamm. Bowel. Dis. 2018. [Google Scholar] [CrossRef] [PubMed]
- Zhang, H.; Dai, Y.; Liu, Y.; Wu, T.; Li, J.; Wang, X.; Wang, W. Helicobacter pylori Colonization Protects Against Chronic Experimental Colitis by Regulating Th17/Treg Balance. Inflamm. Bowel. Dis. 2018, 24, 1481–1492. [Google Scholar] [CrossRef] [PubMed]
- Omenetti, S.; Pizarro, T.T. The Treg/Th17 Axis: A Dynamic Balance Regulated by the Gut Microbiome. Front. Immunol. 2015, 6, 639. [Google Scholar] [CrossRef] [PubMed]
- Britton, G.J.; Contijoch, E.J.; Mogno, I.; Vennaro, O.H.; Llewellyn, S.R.; Ng, R.; Li, Z.; Mortha, A.; Merad, M.; Das, A.; et al. Microbiotas from Humans with Inflammatory Bowel Disease Alter the Balance of Gut Th17 and RORgammat (+) Regulatory T Cells and Exacerbate Colitis in Mice. Immunity 2019, 50, 212–224. [Google Scholar] [CrossRef] [PubMed]
- Neumann, C.; Blume, J.; Roy, U.; Teh, P.P.; Vasanthakumar, A.; Beller, A.; Liao, Y.; Heinrich, F.; Arenzana, T.L.; Hackney, J.A.; et al. c-Maf-dependent Treg cell control of intestinal TH17 cells and IgA establishes host-microbiota homeostasis. Nat. Immunol.2019, 20, 471–481. [Google Scholar] [CrossRef]
- Kumar, P.; Monin, L.; Castillo, P.; Elsegeiny, W.; Horne, W.; Eddens, T.; Vikram, A.; Good, M.; Schoenborn, A.A.; Bibby, K.; et al. Intestinal Interleukin-17 Receptor Signaling Mediates Reciprocal Control of the Gut Microbiota and Autoimmune Inflammation. Immunity 2016, 44, 659–671. [Google Scholar] [CrossRef]
- Campbell, C.; Dikiy, S.; Bhattarai, S.K.; Chinen, T.; Matheis, F.; Calafiore, M.; Hoyos, B.; Hanash, A.; Mucida, D.; Bucci, V.; et al. Extrathymically Generated Regulatory T Cells Establish a Niche for Intestinal Border-Dwelling Bacteria and Affect Physiologic Metabolite Balance. Immunity 2018, 48, 1245–1257. [Google Scholar] [CrossRef] [PubMed]
- Spiljar, M.; Merkler, D.; Trajkovski, M. The Immune System Bridges the Gut Microbiota with Systemic Energy Homeostasis: Focus on TLRs, Mucosal Barrier and SCFAs. Front. Immunol. 2017, 8, 1353. [Google Scholar] [CrossRef] [PubMed]
- Salonen, A.; de-Vos, W.M. Impact of diet on human intestinal microbiota and health. Annu. Rev. Food Sci. Technol. 2014, 5, 239–262. [Google Scholar] [CrossRef] [PubMed]
- Mu, C.; Yang, Y.; Zhu, W. Crosstalk Between the Immune Receptors and Gut Microbiota. Curr. Protein Pept. Sci. 2015, 16, 622–631. [Google Scholar] [CrossRef] [PubMed]
- Fawkner-Corbett, D.; Simmons, A.; Parikh, K. Microbiome: Pattern recognition receptor function in health and inflammation. Best Pract. Res. Clin. Gastroenterol. 2017, 31, 683–691. [Google Scholar] [CrossRef] [PubMed]
- Chu, H.; Mazmanian, S.K. Innate immune recognition of the microbiota promotes host-microbial symbiosis. Nat. Immunol. 2013, 14, 668–675. [Google Scholar] [CrossRef] [PubMed]
- Liston, A.; Masters, S.L. Homeostasis-altering molecular processes as mechanisms of inflammasome activation. Nat. Rev. Immunol. 2017, 17, 208–214. [Google Scholar] [CrossRef]
- Cao, X. Self-regulation and cross-regulation of pattern-recognition receptor signalling in health and disease. Nat. Rev. Immunol. 2016, 16, 35–50. [Google Scholar] [CrossRef]
- de-Kivit, S.; Tobin, M.C.; Forsyth, C.B.; Keshavarzian, A.; Landay, A.L. Regulation of Intestinal Immune Responses through TLR Activation: Implications for Pro- and Prebiotics. Front. Immunol. 2014, 5, 60. [Google Scholar] [CrossRef]
- Otte, J.M.; Cario, E.; Podolsky, D.K. Mechanisms of cross hyporesponsiveness to Toll-like receptor bacterial ligands in intestinal epithelial cells. Gastroenterology 2004, 126, 1054–1070. [Google Scholar] [CrossRef]
- Buwitt-Beckmann, U.; Heine, H.; Wiesmüller, K.H.; Jung, G.; Brock, R.; Akira, S.; Ulmer, A.J. TLR1- and TLR6-independent recognition of bacterial lipopeptides. J. Biol. Chem.2006, 281, 9049–9057. [Google Scholar] [CrossRef] [PubMed]
- Nigar, S.; Yamamoto, Y.; Okajima, T.; Sato, T.; Ogita, T.; Shimosato, T. Immune synergistic oligodeoxynucleotide from Lactobacillus rhamnosus GG enhances the immune response upon co-stimulation by bacterial and fungal cell wall components. Anim. Sci. J. 2018, 89, 1504–1511. [Google Scholar] [CrossRef] [PubMed]
- Roeder, A.; Kirschning, C.J.; Rupec, R.A.; Schaller, M.; Weindl, G.; Korting, H.C. Toll-like receptors as key mediators in innate antifungal immunity. Med. Mycol. 2004, 42, 485–498. [Google Scholar] [CrossRef]
- Balka, K.R.; De-Nardo, D. Understanding early TLR signaling through the Myddosome. J. Leukoc. Biol. 2019, 105, 339–351. [Google Scholar] [CrossRef] [PubMed]
- Cash, H.L.; Whitham, C.V.; Behrendt, C.L.; Hooper, L.V. Symbiotic bacteria direct expression of an intestinal bactericidal lectin. Science 2006, 313, 1126–1130. [Google Scholar] [CrossRef] [PubMed]
- Vaishnava, S.; Yamamoto, M.; Severson, K.M.; Ruhn, K.A.; Yu, X.; Koren, O.; Ley, R.; Wakeland, E.K.; Hooper, L.V. The antibacterial lectin RegIIIgamma promotes the spatial segregation of microbiota and host in the intestine. Science 2011, 334, 255–258. [Google Scholar] [CrossRef] [PubMed]
- Round, J.L.; Lee, S.M.; Li, J.; Tran, G.; Jabri, B.; Chatila, T.A.; Mazmanian, S.K. The Toll-like receptor 2 pathway establishes colonization by a commensal of the human microbiota. Science 2011, 332, 974–977. [Google Scholar] [CrossRef]
- Kayama, H.; Takeda, K. Polysaccharide A of Bacteroides fragilis: Actions on dendritic cells and T cells. Mol. Cell 2014, 54, 206–207. [Google Scholar] [CrossRef]
- Cario, E.; Gerken, G.; Podolsky, D.K. Toll-like receptor 2 controls mucosal inflammation by regulating epithelial barrier function. Gastroenterology 2007, 132, 1359–1374. [Google Scholar] [CrossRef]
- Heimesaat, M.M.; Fischer, A.; Siegmund, B.; Kupz, A.; Niebergall, J.; Fuchs, D.; Jahn, H.K.; Freudenberg, M.; Loddenkemper, C.; Batra, A.; et al. Shift towards pro-inflammatory intestinal bacteria aggravates acute murine colitis via Toll-like receptors 2 and 4. PLoS ONE 2007, 2, e662. [Google Scholar] [CrossRef]
- Chassaing, B.; Koren, O.; Carvalho, F.A.; Ley, R.E.; Gewirtz, A.T. AIEC pathobiont instigates chronic colitis in susceptible hosts by altering microbiota composition. Gut2014, 63, 1069–1080. [Google Scholar] [CrossRef] [PubMed]
- Ferguson, L.R.; Shelling, A.N.; Browning, B.L.; Huebner, C.; Petermann, I. Genes, diet and inflammatory bowel disease. Mutat. Res. 2007, 622, 70–83. [Google Scholar] [CrossRef] [PubMed]
- Dheer, R.; Santaolalla, R.; Davies, J.M.; Lang, J.K.; Phillips, M.C.; Pastorini, C.; Vazquez-Pertejo, M.T.; Abreu, M.T. Intestinal Epithelial Toll-Like Receptor 4 Signaling Affects Epithelial Function and Colonic Microbiota and Promotes a Risk for Transmissible Colitis. Infect. Immun. 2016, 84, 798–810. [Google Scholar] [CrossRef] [PubMed]
- Ray, K.; Marteyn, B.; Sansonetti, P.J.; Tang, C.M. Life on the inside: The intracellular lifestyle of cytosolic bacteria. Nat. Rev. Microbiol. 2009, 7, 333–340. [Google Scholar] [CrossRef] [PubMed]
- Evavold, C.L.; Kagan, J.C. How Inflammasomes Inform Adaptive Immunity. J. Mol. Biol.2018, 430, 217–237. [Google Scholar] [CrossRef] [PubMed]
- Schroder, K.; Tschopp, J. The inflammasomes. Cell 2010, 140, 821–832. [Google Scholar] [CrossRef] [PubMed]
- Kanneganti, T.D. Central roles of NLRs and inflammasomes in viral infection. Nat. Rev. Immunol. 2010, 10, 688–698. [Google Scholar] [CrossRef]
- Rubino, S.J.; Selvanantham, T.; Girardin, S.E.; Philpott, D.J. Nod-like receptors in the control of intestinal inflammation. Curr. Opin. Immunol. 2012, 24, 398–404. [Google Scholar] [CrossRef] [PubMed]
- Neudecker, V.; Haneklaus, M.; Jensen, O.; Khailova, L.; Masterson, J.C.; Tye, H.; Biette, K.; Jedlicka, P.; Brodsky, K.S.; Gerich, M.E.; et al. Myeloid-derived miR-223 regulates intestinal inflammation via repression of the NLRP3 inflammasome. J. Exp. Med. 2017, 214, 1737–1752. [Google Scholar] [CrossRef] [PubMed]
- Zhang, H.X.; Wang, Z.T.; Lu, X.X.; Wang, Y.G.; Zhong, J.; Liu, J. NLRP3 gene is associated with ulcerative colitis (UC), but not Crohn’s disease (CD) in Chinese Han population. Inflamm. Res. 2014, 63, 979–985. [Google Scholar] [CrossRef] [PubMed]
- Claes, A.K.; Zhou, J.Y.; Philpott, D.J. NOD-Like Receptors: Guardians of Intestinal Mucosal Barriers. Physiology (Bethesda) 2015, 30, 241–250. [Google Scholar] [CrossRef] [PubMed]
- Corridoni, D.; Arseneau, K.O.; Cifone, M.G.; Cominelli, F. The dual role of nod-like receptors in mucosal innate immunity and chronic intestinal inflammation. Front. Immunol.2014, 5, 317. [Google Scholar] [CrossRef]
- Girardin, S.E.; Boneca, I.G.; Carneiro, L.A.; Antignac, A.; Jéhanno, M.; Viala, J.; Tedin, K.; Taha, M.K.; Labigne, A.; Zähringer, U.; et al. Nod1 detects a unique muropeptide from gram-negative bacterial peptidoglycan. Science 2003, 300, 1584–1587. [Google Scholar] [CrossRef] [PubMed]
- Girardin, S.E.; Boneca, I.G.; Viala, J.; Chamaillard, M.; Labigne, A.; Thomas, G.; Philpott, D.J.; Sansonetti, P.J. Nod2 is a general sensor of peptidoglycan through muramyl dipeptide (MDP) detection. J. Biol. Chem. 2003, 278, 8869–8872. [Google Scholar] [CrossRef] [PubMed]
- Ogura, Y.; Inohara, N.; Benito, A.; Chen, F.F.; Yamaoka, S.; Nunez, G. Nod2, a Nod1/Apaf-1 family member that is restricted to monocytes and activates NF-kappaB. J. Biol. Chem. 2001, 276, 4812–4818. [Google Scholar] [CrossRef] [PubMed]
- Franchi, L.; Munoz-Planillo, R.; Nunez, G. Sensing and reacting to microbes through the inflammasomes. Nat. Immunol. 2012, 13, 325–332. [Google Scholar] [CrossRef] [PubMed]
- Zaki, M.H.; Boyd, K.L.; Vogel, P.; Kastan, M.B.; Lamkanfi, M.; Kanneganti, T.D. The NLRP3 inflammasome protects against loss of epithelial integrity and mortality during experimental colitis. Immunity 2010, 32, 379–391. [Google Scholar] [CrossRef] [PubMed]
- Bauer, C.; Duewell, P.; Mayer, C.; Lehr, H.A.; Fitzgerald, K.A.; Dauer, M.; Tschopp, J.; Endres, S.; Latz, E.; Schnurr, M. Colitis induced in mice with dextran sulfate sodium (DSS) is mediated by the NLRP3 inflammasome. Gut 2010, 59, 1192–1199. [Google Scholar] [CrossRef] [PubMed]
- Allen, I.C.; TeKippe, E.M.; Woodford, R.M.; Uronis, J.M.; Holl, E.K.; Rogers, A.B.; Herfarth, H.H.; Jobin, C.; Ting, J.P. The NLRP3 inflammasome functions as a negative regulator of tumorigenesis during colitis-associated cancer. J. Exp. Med. 2010, 207, 1045–1056. [Google Scholar] [CrossRef] [PubMed]
- Franchi, L.; Amer, A.; Body-Malapel, M.; Kanneganti, T.D.; Ozoren, N.; Jagirdar, R.; Inohara, N.; Vandenabeele, P.; Bertin, J.; Coyle, A.; et al. Cytosolic flagellin requires Ipaf for activation of caspase-1 and interleukin 1beta in salmonella-infected macrophages. Nat. Immunol. 2006, 7, 576–582. [Google Scholar] [CrossRef] [PubMed]
- Kofoed, E.M.; Vance, R.E. Innate immune recognition of bacterial ligands by NAIPs determines inflammasome specificity. Nature 2011, 477, 592–595. [Google Scholar] [CrossRef] [PubMed]
- Miao, E.A.; Mao, D.P.; Yudkovsky, N.; Bonneau, R.; Lorang, C.G.; Warren, S.E.; Leaf, I.A.; Aderem, A. Innate immune detection of the type III secretion apparatus through the NLRC4 inflammasome. Proc. Natl. Acad. Sci. USA 2010, 107, 3076–3080. [Google Scholar] [CrossRef] [PubMed]
- Franchi, L.; Kamada, N.; Nakamura, Y.; Burberry, A.; Kuffa, P.; Suzuki, S.; Shaw, M.H.; Kim, Y.G.; Núñez, G. NLRC4-driven production of IL-1beta discriminates between pathogenic and commensal bacteria and promotes host intestinal defense. Nat. Immunol.2012, 13, 449–456. [Google Scholar] [CrossRef] [PubMed]
- Elinav, E.; Strowig, T.; Kau, A.L.; Henao-Mejia, J.; Thaiss, C.A.; Booth, C.J.; Peaper, D.R.; Bertin, J.; Eisenbarth, S.C.; Gordon, J.I.; et al. NLRP6 inflammasome regulates colonic microbial ecology and risk for colitis. Cell 2011, 145, 745–757. [Google Scholar] [CrossRef] [PubMed]
- Normand, S.; Delanoye-Crespin, A.; Bressenot, A.; Huot, L.; Grandjean, T.; Peyrin-Biroulet, L.; Lemoine, Y.; Hot, D.; Chamaillard, M. Nod-like receptor pyrin domain-containing protein 6 (NLRP6) controls epithelial self-renewal and colorectal carcinogenesis upon injury. Proc. Natl. Acad. Sci. USA 2011, 108, 9601–9606. [Google Scholar] [CrossRef] [PubMed]
- Chen, L.; Wilson, J.E.; Koenigsknecht, M.J.; Chou, W.C.; Montgomery, S.A.; Truax, A.D.; Brickey, W.J.; Packey, C.D.; Maharshak, N.; Matsushima, G.K.; et al. NLRP12 attenuates colon inflammation by maintaining colonic microbial diversity and promoting protective commensal bacterial growth. Nat. Immunol. 2017, 18, 541–551. [Google Scholar] [CrossRef]
- Abraham, C.; Medzhitov, R. Interactions between the host innate immune system and microbes in inflammatory bowel disease. Gastroenterology 2011, 140, 1729–1737. [Google Scholar] [CrossRef] [PubMed]
- Lamas, B.; Michel, M.L.; Waldschmitt, N. Card9 mediates susceptibility to intestinal pathogens through microbiota modulation and control of bacterial virulence. Gastroenterology 2018, 10, 1836–1844. [Google Scholar] [CrossRef]
- Desai, M.S.; Seekatz, A.M.; Koropatkin, N.M.; Kamada, N.; Hickey, C.A.; Wolter, M.; Pudlo, N.A.; Kitamoto, S.; Terrapon, N.; Muller, A.; et al. A Dietary Fiber-Deprived Gut Microbiota Degrades the Colonic Mucus Barrier and Enhances Pathogen Susceptibility. Cell 2016, 167, 1339–1353. [Google Scholar] [CrossRef]
- Didelot, X.; Walker, A.S.; Peto, T.E.; Crook, D.W.; Wilson, D.J. Within-host evolution of bacterial pathogens. Nat. Rev. Microbiol. 2016, 14, 150–162. [Google Scholar] [CrossRef]
- Yang, L.; Jelsbak, L.; Marvig, R.L.; Damkiaer, S.; Workman, C.T.; Rau, M.H.; Hansen, S.K.; Folkesson, A.; Johansen, H.K.; Ciofu, O.; et al. Evolutionary dynamics of bacteria in a human host environment. Proc. Natl. Acad. Sci. USA 2011, 108, 7481–7486. [Google Scholar] [CrossRef]
- De-Filippo, C.; Di-Paola, M.; Ramazzotti, M.; Albanese, D.; Pieraccini, G.; Banci, E.; Miglietta, F.; Cavalieri, D.; Lionetti, P. Diet, Environments, and Gut Microbiota. A Preliminary Investigation in Children Living in Rural and Urban Burkina Faso and Italy. Front. Microbiol. 2017, 8, 1979. [Google Scholar] [CrossRef] [PubMed]
- Rakoff-Nahoum, S.; Medzhitov, R. Innate immune recognition of the indigenous microbial flora. Mucosal. Immunol. 2008, 1 (Suppl. 1), S10–S14. [Google Scholar] [CrossRef]
- Kim, Y.G.; Sakamoto, K.; Seo, S.U.; Pickard, J.M.; Gillilland, M.G., III; Pudlo, N.A.; Hoostal, M.; Li, X.; Wang, T.D.; Feehley, T.; et al. Neonatal acquisition of Clostridia species protects against colonization by bacterial pathogens. Science 2017, 356, 315–319. [Google Scholar] [CrossRef] [PubMed]
- Gomez, D.A.M.; Ganal-Vonarburg, S.C.; Fuhrer, T.; Rupp, S.; Uchimura, Y.; Li, H.; Steinert, A.; Heikenwalder, M.; Hapfelmeier, S.; Sauer, U.; et al. The maternal microbiota drives early postnatal innate immune development. Science 2016, 351, 1296–1302. [Google Scholar] [CrossRef] [PubMed]
- El, A.S.; Hooiveld, G.; Tremaroli, V.; Backhed, F.; Kleerebezem, M. The gut microbiota and mucosal homeostasis: Colonized at birth or at adulthood, does it matter? Gut Microbes. 2013, 4, 118–124. [Google Scholar]
- Llewellyn, S.R.; Britton, G.J.; Contijoch, E.J.; Vennaro, O.H.; Mortha, A.; Colombel, J.F.; Grinspan, A.; Clemente, J.C.; Merad, M.; Faith, J.J. Interactions Between Diet and the Intestinal Microbiota Alter Intestinal Permeability and Colitis Severity in Mice. Gastroenterology 2018, 154, 1037–1046. [Google Scholar] [CrossRef] [PubMed]
- Macpherson, A.J.; McCoy, K.D.; Johansen, F.E.; Brandtzaeg, P. The immune geography of IgA induction and function. Mucosal. Immunol. 2008, 1, 11–22. [Google Scholar] [CrossRef] [PubMed]
- Thaiss, C.A.; Itav, S.; Rothschild, D.; Meijer, M.T.; Levy, M.; Moresi, C.; Dohnalova, L.; Braverman, S.; Rozin, S.; Malitsky, S.; et al. Persistent microbiome alterations modulate the rate of post-dieting weight regain. Nature 2016, 540, 544–551. [Google Scholar] [CrossRef] [PubMed]
- Chu, H.; Khosravi, A.; Kusumawardhani, I.P.; Kwon, A.H.; Vasconcelos, A.C.; Cunha, L.D.; Mayer, A.E.; Shen, Y.; Wu, W.L.; Kambal, A.; et al. Gene-microbiota interactions contribute to the pathogenesis of inflammatory bowel disease. Science 2016, 352, 1116–1120. [Google Scholar] [CrossRef]
- Frank, D.N.; Robertson, C.E.; Hamm, C.M.; Kpadeh, Z.; Zhang, T.; Chen, H.; Zhu, W.; Sartor, R.B.; Boedeker, E.C.; Harpaz, N.; et al. Disease phenotype and genotype are associated with shifts in intestinal-associated microbiota in inflammatory bowel diseases. Inflamm. Bowel. Dis. 2011, 17, 179–184. [Google Scholar] [CrossRef] [PubMed]