ООО "ПРОПИОНИКС"
| пн-пт с 09:00 до 18:00 | |
Толл-подобные рецепторы
ТОЛЛ-ПОДОБНЫЕ РЕЦЕПТОРЫ (TLR) И ИММУННЫЙ ОТВЕТ
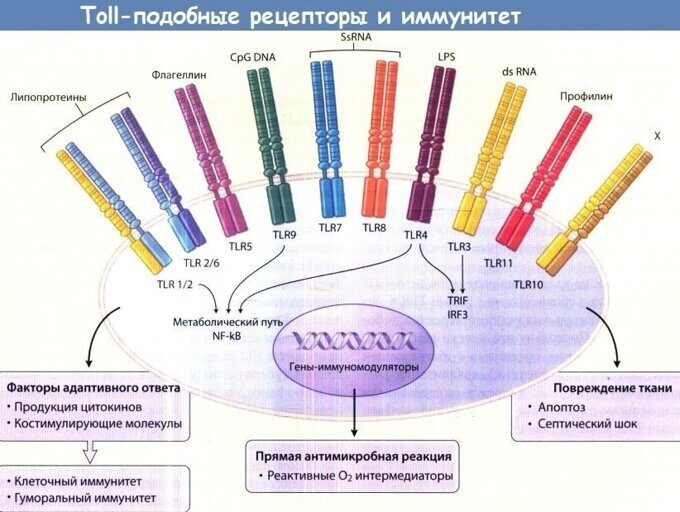
TOLL-ПОДОБНЫЕ РЕЦЕПТОРЫ ВО ВРОЖДЕННОМ И АДАПТИВНОМ ИММУНИТЕТЕ
Толл-подобные рецепторы - класс клеточных рецепторов с одним трансмембранным фрагментом, которые распознают консервативные структуры микроорганизмов и активируют клеточный иммунный ответ. Играют ключевую роль во врождённом иммунитете. Например, толл-подобный рецептор 4 (TLR-4) узнаёт и связывается с консервативной структурой клеточной стенки грамотрицательных бактерий - липополисахаридом (LPS).
Toll-подобные рецепторы (TLR), относятся к семейству паттерн-распознающих рецепторов PRRs и осуществляют распознавание молекулярных структур патогенов PAMPs (экзогенных лигандов) и ряда эндогенных лигандов DAMPs (молекул, которые высвобождаются в ответ на повреждение клеток), обеспечивая быструю реакцию клетки. У млекопитающих и человека охарактеризованы 15 TLR (на 2016 г.), которые распложены на мембране, в эндосомах или в цитоплазме клеток, осуществляющих первую линию защиты (нейтрофилы, макрофаги, дендритные клетки и пр.). После связывания лиганда TLR запускают сигнальный каскад с вовлечением ряда адаптерных белков, что ведет к активации ядерных факторов и последующей продукции цитокинов и прочих молекул, ассоциированных с воспалением. TLR-сигнальный путь контролируется с помощью различных механизмов обратной связи. В целом, биологическая роль и механизмы функционирования TLR до конца не изучены.
Toll-подобные рецепторы (TLR), опосредующие распознавание молекулярных структур патогенов, экспрессируются на клетках разных типов, инициируя развитие иммунных реакций при связывании с различными лигандами. Несмотря на то, что у ряда организмов идентифицированы функциональные TLR, их биологическая роль и механизмы функционирования до конца не изучены.
Распознавание патогенов микробного происхождения является основополагающим компонентом иммунного ответа, включающим воспаление (Janeway, 1998). Этот ответ опосредуется рецепторами особого семейства, узнающими наиболее общие молекулярные компоненты (паттерны, PAMP – Pathogen Associated Molecular Patterns) микробов (вирусов, бактерий, паразитов и т.д.) и получившими название PRR (Pattern Recognition Receptors) (Medzhitov, 2000). После узнавания соответствующего специфического паттерна PRRs запускают серию сигнальных каскадов, которые представляют собой первую линию защиты от микробов. Кроме того, инициируемый PRRs сигнал запускает созревание дендритных клеток, которые подготавливают вторую линию иммунного ответа на инфекцию, известную как приобретенный иммунитет.
Toll-подобные рецепторы (TLRs) были первыми идентифицированными PRRs - рецепторами распознавания образов – англ. Pattern recognition receptors) (См. рисунок 1) (Lemaitre, 1996; Medzhitov, 1997).
Активация провоспалительных цитокинов и интерферонов через Toll-like рецепторы

Рисунок 1. Механизмы действия толл-подобных рецепторов.
Комментарий к рисунку: Активация воспалительных цитокинов и интерферона через TLRs начинается с распознавания TLR соответствующих агонистов (красный цвет). Взаимодействие адаптеров ТLRs и киназ из семейства IRAKs (IRAK 1 - 4) приводит к активации NF-kB (ядерного фактора «каппа-би») и MAP-киназ, основных регуляторов транскрипции цитокинов и интерферона (Lemaitre, 1996; Medzhitov, 1997).
В состоянии покоя неактивированные TLRs находятся на мембране клеток в мономерной форме. После активации Toll-подобных рецепторов происходит их олигомеризация. Олигомерный рецептор способен связывать несколько внутриклеточных адаптерных белков, которые обеспечивают последующую передачу сигнала. Эти белки имеют участок специфического связывания с активированными Toll-подобными рецепторами, TIR (от англ. Toll-interleukin-1 receptor) домен, который состоит из 3 консервативных участков, участвующих в белок-белковом взаимодействии. Всего существует 5 адаптерных белков с TIR-доменом: MyD88, TIRAP, TRIF, TRAM и SARM. Различные рецепторы имеют свой набор этих адаптерных белков, необходимых для передачи сигнала. Только рецептор TLR4 способен связывать все 5 белков.
Строение Toll-like рецепторов
 Все TLRs имеют сходное строение и представляют собой интегральные трансмембранные белки, т.е. белки, которые насквозь пронизывают липидный бислой, в котором они постоянно находятся (интегральные, т.к. прочно связаны с цитоплазматической мембраной (интегрированы). Поверхностная зона молекулы, ответственная за связывание лиганда, представлена N-концевой областью аминокислотной последовательности из 19-25 повторяющихся участков, обогащенных лейцином. Далее следует переходный участок, отвечающий за прикрепление рецептора к клеточной мембране, обогащенный цистеином. Внутренняя дистальная часть рецептора представлена TIR (Toll/IL-receptor) доменом, получившим свое название из-за одинакового строения этого участка у TLRs и у рецепторов цитокинов семейства IL-1.
Все TLRs имеют сходное строение и представляют собой интегральные трансмембранные белки, т.е. белки, которые насквозь пронизывают липидный бислой, в котором они постоянно находятся (интегральные, т.к. прочно связаны с цитоплазматической мембраной (интегрированы). Поверхностная зона молекулы, ответственная за связывание лиганда, представлена N-концевой областью аминокислотной последовательности из 19-25 повторяющихся участков, обогащенных лейцином. Далее следует переходный участок, отвечающий за прикрепление рецептора к клеточной мембране, обогащенный цистеином. Внутренняя дистальная часть рецептора представлена TIR (Toll/IL-receptor) доменом, получившим свое название из-за одинакового строения этого участка у TLRs и у рецепторов цитокинов семейства IL-1.
Значимость Toll-like рецепторов

Важное значение участия TLRs в деятельности иммунной системы было показано в экспериментальных работах на нокаут-мышах, имеющих искусственно вызванные мутации генов различных TLRs. Так, мыши, имеющие мутацию гена, кодирующего TLR4, погибали при инфицировании 1-2 колониеобразующими единицами (КОЕ) Salmonela typhimurium, в то время как у нормальных животных гибель происходила при введении более 2000 КОЕ этих бактерий. В других экспериментах была показана высокая восприимчивость TLR4-дефицитных мышей к Escherichia coli, Neisseria meningitides и Candida albicans. Подобные результаты были получены и при изучении роли TLRs в защите от вирусных инфекций. Опубликованы результаты исследований, в которых показано участие TLRs при развитии опухолей.
Участие Толл-подобных рецепторов во врожденном иммунитете
Участие Toll-like рецепторов во врожденном иммунитете обеспечивается:
1. Инициацией выделения провоспалительных цитокинов, необходимых для физиологического иммунологического ответа при различных воздействиях, среди которых одно из центральных мест занимают различные инфекции;
2. регуляцией активности нейтрофилов; особую роль при этом играют TLR-2 и TLR-4, первый из которых защищает клетки от апоптоза, а второй проявляет себя как важный регулятор выживаемости нейтрофилов (см. рис. 3);
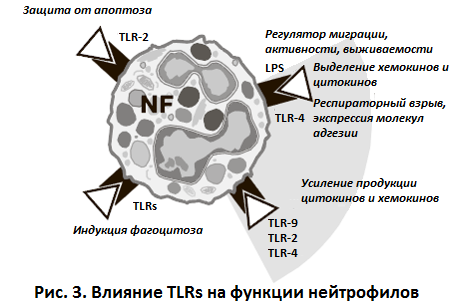
3. контролем активации, дифференциации и выживаемости В-лимфоцитов, в котором активное участие принимают TLR-2, TLR-4 и TLR-9 (этот путь активации В-лимфоцитов сопровождается усилением выброса кальция, фосфорилированием некоторых киназ, усилением эндоцитоза, синтеза иммуноглобулинов и рассматривается как альтернативный путь активации В-лимфоцитов);
4. обеспечением поддержания врожденного иммунитета кишечника, что связано с экспрессией TLRs эпителиальными клеками его слизистой;
5. участием в функционировании клеток центральной нервной ситемы, большинство которых экспрессируют TLRs (микроглия, нейроны, астроциты, эндотелиальные клетки сосудов мозга), имеются данные о дифференцированном влиянии TLRs на функции микроглии.
Участие Толл-подобных рецепторов в приобретенном иммунитете
Участие Toll-like рецепторов в приобретенном иммунитете обусловлено:
1. Активацией CD4+ и CD8+ T-лимфоцитов;
2. стимуляцией функций различных антиген-распознающих клеток: дендритных, которые экспрессируют TLR-2, TLR-3, TLR-4, TLR-7, TLR-9;

3. активацией макрофагов, тучных клеток, в частности, с участием TLR-9, что особенно выражено при действии генетического материала ДНК-вирусов бактерий, грибов;
4. активным включением в экспансию и функционирование регуляторных клеток — T-reg, которые экспрессируют высокий уровень TLR-4, TLR-5, TLR-7 и TLR-8 (см. рис. 3);

5. регуляцией гомеостаза фибробластов, миофибробластов, фибробластоподобных синовиоцитов, эндотелиальных и эпителиальных клеток, в частности, с участием TLR-2, TLR-4, TLR-6;
6. регуляцией клеток нормального эпителия (TLR-2, TLR-3, TLR-4, TLR-5), а также клеток эндотелия;
7. потенцированием приобретенного иммунитета с включением различных механизмов
Лиганды Толл-подобных рецепторов
Для TLRs также наиболее подробно изучен и идентифицирован спектр PAMPs. TLRs – это трансмембранные белки первого типа, содержащие лейцин-богатые повторы в эктодомене, трансмембранный и цитозольные домены. Эктодомен узнает микробные паттерны, в то время как цитозольный домен активирует сигнальные пути в цитоплазме клетки. В зависимости от локализации TLRs в клетке выделяют рецепторы, расположенные в цитоплазматической мембране (TLR1, TLR2, TLR4, TLR5, TLR6, TLR10 и TLR11) или в мембранах внутриклеточных органелл (TLR3, TLR7, TLR8 и TLR9) — лизосом, эндосом, аппарата Гольджи. Лигандами рецепторов, локализованных на цитоплазматической мембране, являются поверхностные структуры микроорганизмов — липопротеин, липополисахариды, флагеллин, зимозан.
Таблица 1. Toll-подобные рецепторы и их лиганды
|
PRRs
|
Локализация
|
Лиганд и его происхождение
|
|
TLR
|
мембрана клетки
|
триациллипопротеин (бактерии)
|
|
TLR2
|
мембрана клетки
|
липопротеины, липопептиды (бактерии), гликолипиды (простейшие), зимозан (грибы)
|
|
TLR3
|
внутриклеточная
|
dsРНК (вирусы);
мРНК (хозяин)
|
|
TLR4
|
мембрана клетки
|
липополисахариды (бактерии), маннаны (грибы), белковая оболочка вирусов;
белки теплового шока Hsp60 и Hsp70, фибриноген, фибронектин, гиалуроновая кислота (хозяин)
|
|
TLR5
|
мембрана клетки
|
флагеллин (бактерии)
|
|
TLR6
|
мембрана клетки
|
диациллипопротеин (бактерии)
|
|
TLR7
|
внутриклеточная
|
ssРНК (вирусы)
ssРНК (хозяин)
|
|
TLR8
|
внутриклеточная
|
ssРНК (бактерии, вирусы);
ssРНК (хозяин)
|
|
TLR9
|
внутриклеточная
|
неметилированные CpG в молекулах ДНК (бактерии, простейшие, вирусы);
комплекс хроматина и IgG (хозяин)
|
|
TLR10
|
мембрана клетки
|
нет данных
|
|
TLR11
|
мембрана клетки
|
профилин (простейшие)
|
Итак, рецепторы, локализованные в мембранах внутриклеточных органелл, распознают молекулы ядерных структур микроорганизмов, но могут быть активированы и DAMPs, т.е. поврежденными молекулярными структурами собственного организма (выделено красным - ред.). Каждый TLR обнаруживает различные PAMPs вирусного, бактериального и другого происхождения. Так, например, липопротеины узнаются различными гетеродимерами из TLR1, TLR2 и TLR6 (Takeuchi, 1999), двуцепочечная РНК (ds) - TLR3 (Alexopoulou, 2001), одноцепочечная РНК (ss) - TLR7 и TLR8 (Hemmi, 2002; Heil, 2003), флагеллин - TLR5 (Smith, 2003), ДНК - TLR9 (Kumagai, 2008) (Таблица 1). TLR4 был первым рецептором с идентифицированным лигандом - бактериальным липополисахаридом (ЛПС или англ. LPS) (Poltorak, 1998). В настоящее время у человека и мыши идентифицированы 10 и 12 функциональных TLR, соответственно.
Механизмы Толл-подобных рецепторов
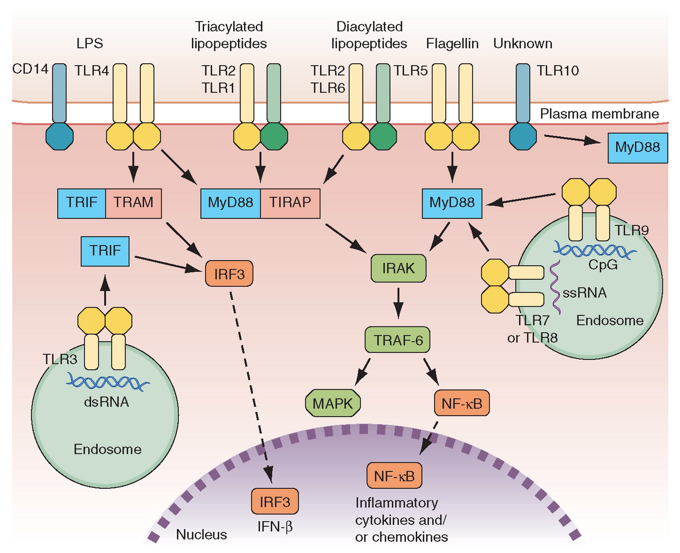
Рисунок 6. Механизмы активации провоспалительных цитокинов и / или хемокинов и интерферонов (вариант рис. 1.)
В состоянии покоя неактивированные TLRs находятся на мембране клеток в мономерном состоянии. После распознавания молекулярных «образов» патогенов TLRs активируют каскад реакций передачи сигнала в ядро клетки: при связывании с лигандом рецептор подвергается димеризации, сопровождающейся изменением конформации TIR-домена, который связывается с адапторной молекулой MyD88 (myeloid differentiation protein 88), необходимой для привлечения киназ семейства IRAK (IL-1 receptor associated kinase). После активации IRAK взаимодействует с внутриклеточным фактором TRAF6 (TNF receptor associated factor 6), в результате чего происходит высвобождение ядерного фактора каппа-В (NF-κB) и транслокация его в ядро клетки. Связываясь с промоторными участками генов, ядерный фактор активирует синтез провоспалительных цитокинов, молекул адгезии, костимулирующих молекул с последующей активацией структур адаптивного иммунитета.
Известен также механизм MyD88-независимой передачи активационных сигналов от TLRs (см. рис. 1 и 3). Его принципиальным отличием является то, что TIR-домен взаимодействует с адапторной молекулой TRIF (TIRdomain containing adaptor inducing IFNβ) с последующей активацией внутриклеточного фактора IRF3 (interferon regulatory factor 3), индуцирующего экспрессию генов интерферонов α и β (IFNα и IFNβ), являющихся важнейшими молекулами для дифференцировки Т-лимфоцитов.
Заключение
Инициированная TLRs схема передачи сигнала внутрь клетки оставляет открытыми много вопросов. В частности, каким образом активация одного и того же Тoll-рецептора в разных клетках приводит к продукции совершенно разного спектра цитокинов и других воспалительных белков. Например, известно, что TLR9 в макрофагах приводит к продукции классических цитокинов, таких как TNF и IL6, в то время как тот же TLR9 в плазмацитоидных дендритных клетках приводит к продукции IFN-I (Uematsu, 2005). Аналогично, будучи локализованным на клеточной мембране, TLR4 активирует классические цитокины, а транслокация в эндосому переключает TLR4 на продукцию типа 1 интерферона (Kagan, 2008). Только одним клеточным окружением трудно объяснить данную разницу.
Невозможно также объяснить с помощью такой простой схемы сложную и совершенную регуляцию многих сотен генов. Очевидно, что существуют дополнительные, неизвестные компоненты сигнальной активации с участием Тoll-подобных рецепторов. Вероятно также, что все эти вопросы требуют дальнейшего изучения.
Толл-подобные рецепторы (TLRs) и иммунный ответ →
Вывод: Таким образом, Толл-подобные рецепторы являются первыми сигнальными молекулами, распознающими лиганды микроорганизмов и координирующими иммунный ответ. TLRs являются активными регуляторами не только врожденного и приобретенного иммунитета, но и гомеостаза различных клеток.
К разделу:
Дополнительно см.:
- Т-клетки (Т-лимфоциты)
- Врожденный и адаптивный иммунитет
- Механизм иммунного ответа
- Цитокины в системе иммунитета
- Иммунитет, лимфоциты и дендритные клетки
- T-лимфоциты и их циркуляция
- Врожденные лимфоидные клетки (ILCs) и патогенные бактерии (+ видео)
- Регуляторные Т-клетки - миротворцы иммунной системы
- Развитие и поддержание регуляторных Т-клеток кишечника
- Арильный углеводородный рецептор и иммунитет
- Иммуноглобулин А, активный связующий элемент для гомеостаза микробиоты хозяина
- Вклад комменсальной микрофлоры в иммунологический гомеостаз
- Роль микробиоты в иммунитете и воспалении (+ видео)
- Микробиота кишечника и хроническое системное воспаление низкой степени
- Микробиота кишечника и воспаление
- Кишечный дисбиоз и иммунометаболические нарушения
- ВЗК, микробиота и иммунитет слизистой оболочки
- Роль кишечной микробиоты и метаболитов в гомеостазе кишечника и заболеваниях человека
- Иммунопатология атеросклероза и кишечная микробиота
- Эпигенетика, короткоцепочечные жирные кислоты и врожденная иммунная память
Библиография
- Alexopoulou L, Holt AC, Medzhitov R, Flavell RA. Recognition of double-stranded RNA and activation of NF-kappaB by Toll- like receptor 3. Nature 2001, 413:732-738.
- Benfey PN, Mitchell-Olds T. From genotype to phenotype: systems biology meets natural variation. Science 2008, 320:495-497.
- Brint EK, Xu D, Liu H, Dunne A, McKenzie AN, O'Neill LA, Liew FY. ST2 is an inhibitor of interleukin 1 receptor and Toll-like receptor 4 signaling and maintains endotoxin tolerance. Nat Immunol 2004, 5(4):373-379.
- Conner JR, Smirnova I, Poltorak A. Forward genetic analysis of Toll-like receptor responses in wild-derived mice reveals a novel antiinflammatory role for IRAK1BP1. J Exp Med 2008, 205:305-314.
- Conner JR, Smirnova I, Poltorak A. A mutation in Irak2c identifies IRAK-2 as a central component of the TLR regulatory network of wild-derived mice. J Exp Med 2009, 206 (7):1615-1631.
- Guenet JL, Bonhomme F. Wild mice: an ever-increasing contribution to a popular mammalian model. Trends Genet 2003, 19:24-31.
- Heil F, Ahmad-Nejad P, Hemmi H, Hochrein H, Ampenberger F, Gellert T, Dietrich H, Lipford G, Takeda K, Akira S, Wagner H, Bauer S. The Toll-like receptor 7 (TLR7)-specific stimulus loxoribine uncovers a strong relationship within the TLR7, 8 and 9 subfamily. Eur J Immunol 2003, 33:2987-2997.
- Hemmi H, Kaisho T, Takeuchi O, Sato S, Sanjo H, Hoshino K, Horiuchi T, Tomizawa H, Takeda K, Akira S. Small anti-viral compounds activate immune cells via the TLR7 MyD88- dependent signaling pathway. Nat Immunol 2002, 3(2):196-200.
- Janeway CA, Medzhitov R. Introduction: the role of innate immunity in the adaptive immune response. Semin Immunol 1998, 10(5):349-350.
- Kagan JC, Su T, Horng T, Chow A, Akira S, Medzhitov R. TRAM couples endocytosis of Toll-like receptor 4 to the induction of interferon-beta. Nat Immunol 2008, 9:361-368.
- Kumagai Y, Takeuchi O, Akira S. TLR9 as a key receptor for the recognition of DNA. Adv Drug Deliv Rev 2008, 60:795-804.
- Lemaitre B, Nicolas E, Michaut L, Reichhart JM, Hoffmann JA. The dorsoventral regulatory gene cassette spatzle/Toll/cactus controls the potent antifungal response in Drosophila adults. Cell 1996, 86(6):973-983.
- Losick VP, Stephan K, Smirnova I, Isberg RR, Poltorak A. A hemidominant Naip5 allele in mouse strain MOLF/Ei-derived macrophages restricts Legionella pneumophila intracellular growth. Infect Immun 2009, 77:196-204.
- Medzhitov R, Janeway CA. How does the immune system distinguish self from nonself? Innate immunity 2000, 343:338-344.
- Medzhitov R, Preston-Hurlburt P, Janeway CA. A human homologue of the Drosophila Toll protein signals activation of adaptive immunity [see comments]. Nature 1997, 388(6640):394-397.
- Poltorak A, He X, Smirnova I, Liu MY, Huffel CV, Du X, Birdwell D, Alejos E, Silva M, Galanos C, Freudenberg M, Ricciardi-Castagnoli P, Layton B, Beutler B. Defective LPS signaling in C3H/HeJ and C57BL/10ScCr mice: mutations in Tlr4 gene. Science 1998, 282:2085-2088.
- Smith KD, Andersen-Nissen E, Hayashi F, Strobe K, Bergman MA, Barrett SL, Cookson BT, Aderem A. Toll-like receptor 5 recognizes a conserved site on flagellin required for protofilament formation and bacterial motility. Nat Immunol 2003, 4:1247-1253.
- Stephan K, Smirnova I, Jacque B, Poltorak A. Genetic analysis of the innate immune responses in wild-derived inbred strains of mice. Eur J Immunol 2007, 37:212-223.
- Suzuki Y, Roth FP. Systematic genetics swims forward elegantly. Mol Syst Biol 2006, 2:48.
- Takeuchi O, Hoshino K, Kawai T, Sanjo H, Takada H, Ogawa T, Takeda K, Akira S. Differential roles of TLR2 and TLR4 in recognition of gram-negative and gram-positive bacterial cell wall components. Immunity 1999, 11:443-451.
- Uematsu S, Sato S, Yamamoto M, Hirotani T, Kato H, Takeshita F, Matsuda M, Coban C, Ishii KJ, Kawai T, Takeuchi O, Akira S. Interleukin-1 receptor-associated kinase-1 plays an essential role for Toll-like receptor (TLR)7- and TLR9-mediated interferon-{alpha} induction. J Exp Med 2005, 201:915-923.

