ООО "ПРОПИОНИКС"
| пн-пт с 09:00 до 18:00 | |
Методы хроматографии и свойства белков
ОСНОВНЫЕ МЕТОДЫ ХРОМАТОГРАФИИ И АДСОРБЦИЯ В РАСШИРЕННОМ СЛОЕ
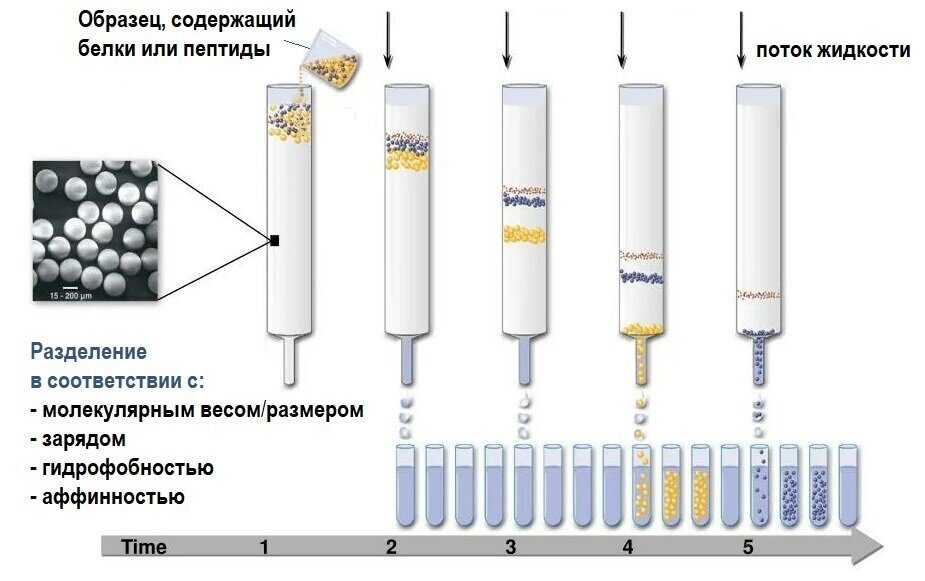
- Хроматография – метод разделения смесей веществ, основанный на различии в скоростях их перемещения в системе несмешивающихся и движущихся относительно друг друга фаз.
- Подвижная фаза – поток жидкости или газа, перемещающий компоненты разделяемой смеси вдоль неподвижной фазы.
- Неподвижная фаза – твердый сорбент или несмешивающаяся с подвижной фазой жидкость, на которых осуществляется различное удерживание и разделение компонентов смеси.
- Сорбент – твердое вещество, жидкость или их смеси, способные удерживать газы, пары или растворенные вещества.
- Адсорбент – твердый сорбент, концентрирующий на своей поверхности газы, пары или растворенные вещества.
- Абсорбент – твердый или жидкий сорбент, растворяющий в своем объеме газы, пары или компоненты жидких смесей.
- Сорбат – вещество, удерживаемое сорбентом (в хроматографии – компоненты разделяемой смеси).
- Элюент – жидкость или газ, используемые в качестве подвижной фазы.
- Элюирование (элюция) - извлечение вещества вымыванием его под соответствующим элюентом
- Элюат – выходящий из колонки поток подвижной фазы с компонентами разделяемой смеси.
Примeчание: Хроматография может быть препаративной или аналитической. Целью препаративной хроматографии является разделение компонентов смеси для последующего использования, и, таким образом, она является одной из форм очистки. Этот процесс связан с более высокими затратами из-за способа его производства. Аналитическая хроматография обычно проводится с меньшим количеством материала и предназначена для установления присутствия или измерения относительных пропорций аналитов в смеси. Эти два типа не являются взаимоисключающими. Например, аналитическая ВЭЖХ обычно применяется для качественного и количественного определения веществ. Но если задача шире, например, нужно выделить и очистить целевой продукт, а также иметь возможность масштабировать этот процесс, на помощь может прийти препаративная ВЭЖХ (обычно ее применяют в промышленном фармацевтическом производстве). Однако даже сегодня препаративная ВЭЖХ все еще имеет проблемы как с большой скоростью и эффективностью разделения, так и высокой производительностью и экономичностью. Тем не менее эксклюзионная хроматография макромолекул в препаративной ВЭЖХ все-таки заняла прочное место → метод используют в предварительном варианте для выделения целевых веществ или их групп из смесей, содержащих компоненты с заметно различающейся молекулярной массой. Исключительную важность этот метод имеет для очистки лабильных биополимеров.
.1. Введение
Термин "хроматография" был впервые использован русским ученым Михаилом Цветом в 1900 году для описания явления, когда смесь пигментов под действием растворителя перемещалась по бумаге и отделялась друг от друга. Поскольку пигменты имеют разные цвета, явление было названо "хромато-графией", что буквально означает "цветное письмо" [1]. Сейчас под этим термином обычно понимают ряд методов разделения смесей [2].
В каждой хроматографии участвуют две фазы - подвижная и неподвижная. Подвижная фаза заставляет соединения течь через поверхность неподвижной фазы, а движение соединений тормозится за счет взаимодействия с неподвижной фазой. Соединения задерживаются по-разному в зависимости от силы взаимодействия и в итоге разделяются.
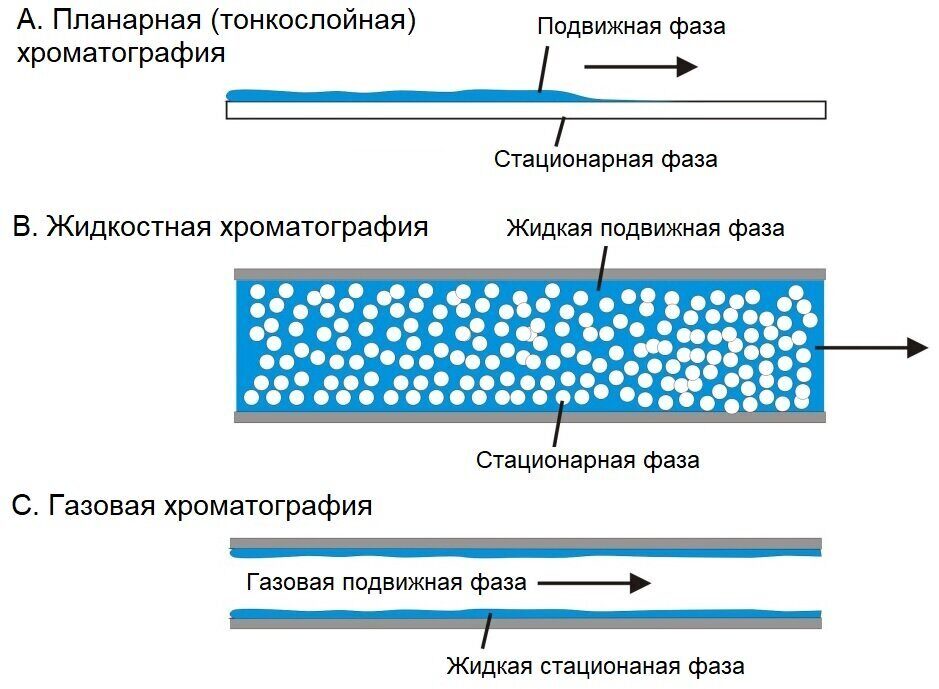
Рис. 1. Различные типы хроматографии
|
Вначале хроматографию проводили на бумаге или тонких слоях для разделения небольших молекулярных соединений, что получило название планарной (тонкослойной) хроматографии (рис. 1А). Позже была разработана колоночная хроматография, в которой неподвижная фаза изготавливается в виде пористых частиц и упаковывается в колонку, а подвижная фаза течет по тонким каналам между средами [3]. Если подвижной фазой является газ, а неподвижной - жидкость, то метод называется газовой хроматографией [4], которая используется для разделения летучих соединений (рис. 1B). Если подвижной фазой является жидкость, а неподвижной - твердое тело, то метод называется жидкостной хроматографией [5] и широко используется для разделения малых соединений или биологических макромолекул (рис. 1С).
|
Жидкостная хроматография - самый популярный метод очистки и анализа белков. Жидкая подвижная фаза, содержащая белки, проходит через колонку и разделяется, взаимодействуя со средой. Стационарная фаза, состоящая из пористых частиц, обеспечивает гораздо большую поверхность по сравнению с традиционной планарной хроматографией. Таким образом, загрузочная способность колонки значительно увеличивается и позволяет очищать даже граммы белка за один цикл. Кроме того, структура колонки позволяет использовать высокое давление, чтобы заставить подвижную фазу течь намного быстрее и завершить разделение за короткое время, что называется жидкостной хроматографией высокого давления [6]. В то же время, благодаря однородному размеру матрицы и высокому качеству, колоночная хроматография обеспечивает гораздо более высокое разрешение, чем раньше. Высокая производительность, высокая пропускная способность и высокое разрешение позволили колоночной хроматографии стать наиболее быстро развивающимся методом разделения белков за последние два десятилетия.
Было разработано несколько основных типов хроматографии, основанных на различных разделительных свойствах (табл. 1). В этой главе описаны как принципы, так и области применения этих методов.
Табл. 1. Различные методы хроматографии и соответствующие свойства белков
|
Свойство
|
Техника
|
|
Чистый заряд
|
Ионообменная хроматография
|
|
Гидрофобность
|
Гидрофобная хроматография (хроматография гидрофобных взаимодействий) и обращённо-фазовая хроматография
|
|
Биораспознавание
|
Аффинная хроматография
|
|
Размер
|
Эксклюзионная (размерно-эксклюзионная) хроматография
|
.2. Ионообменная хроматография (IEXC)
Ионообменная хроматография (IEXC) была введена в практику разделения белков в 1960-х годах и играет важную роль в очистке биомолекул [7]. Разделение методом IEXC основано на обратимых электростатических взаимодействиях между заряженными растворителями и противоположно заряженной средой. Теория и принцип действия метода просты, поэтому его легко освоить новичкам.
Под ионным обменом понимается обмен ионами между двумя электролитами или между раствором электролита и комплексом. Например: NiSO4 + Ca2+ = CaSO4 + Ni2+. Когда один из электролитов иммобилизован на смоле, обмен будет происходить между границей раздела жидкой и твердой фаз, называемой обменником, например,
R-O-CH2 -COOY + X+ → R-O-CH2 -COOX + Y+ (1)
В этом случае ион X+ обменивается с ионом Y+ и адсорбируется смолой.
Реакция обмена является обратимой, и ее направление зависит от концентрации и константы ионизации электролитов. В уравнении 1, если концентрация иона Y+ увеличивается, X+ будет десорбироваться
R-O-CH2 -COOX + Y+ → R-O-CH2 -COOY + X+ (2)
Ион Y+ может быть любым катионом, например Na+, H+. Эти два уравнения представляют процесс связывания и элюирования в IEXC.
Согласно приведенным выше двум уравнениям, связывание белка на обменнике представляет собой кинетическое равновесие между адсорбцией и десорбцией. Константа равновесия Kd составляет:
Kd = [X+] [R-O-CH2-COOY] / [Y+] [R-O-CH2-COOX] (3)
При движении подвижной фазы молекулы белка в подвижной фазе переносятся вперед и адсорбируются нижележащей средой, в то же время адсорбированные белки высвобождаются из неподвижной фазы в подвижную. Белки удаляются вперед в сопровождении непрерывной адсорбции и десорбции. При одинаковой ионной силе, чем выше Kd белка, тем больше его фракция распределяется в подвижной фазе и движется быстрее. И наоборот, белки с меньшим Kd более заторможены, чем белки с большим Kd. Фактически, все виды адсорбционной хроматографии основаны на кинетическом равновесном механизме.
2.1. Изоэлектрическая точка белка
Белки - это амфолиты, в которых карбоксильные группы и аминогруппы боковых цепей и двух концов могут ионизироваться и вызывать положительный или отрицательный заряд белков. Положительные заряды белков обычно приписываются ионизированным цистеину, аспартату, лизинам и гистидинам. Отрицательный заряд в основном обеспечивают остатки аспартата и глутамата. В определенной точке pH суммарные положительные заряды белка равны суммарным отрицательным зарядам, чистый заряд в это время равен 0, а pH определяется как изоэлектрическая точка (pI) этого белка. Когда pH раствора выше pI белка, больше карбоксильных групп ионизируется и белок заряжается отрицательно, и наоборот (рис. 2). pI белка можно определить несколькими экспериментальными методами, но приблизительное значение может быть рассчитано математическими методами. После получения первичной структуры белка pI может быть рассчитан с помощью программного обеспечения или некоторых кратких веб-сайтов (например, http://web.expasy.org/compute_pi/)
2.2. Выбор обменника
Обменники в IEXC состоят из базовой матрицы и функциональных групп, которые соединяются на поверхности матрицы. Базовая матрица представляет собой непористые или пористые сферические частицы со свободной от заряда поверхностью, на которой соединены различные функциональные группы. Пористая матрица обеспечивает большую площадь поверхности для связывания белков и, таким образом, дает высокую связывающую способность, но жертвует некоторым разрешением из-за диффузии между внешней и внутренней поверхностью матрицы. Напротив, непористая матрица ограничена по связывающей способности, но используется для обеспечения высокого разрешения в микропрепаративных или аналитических разделениях.
Подобно эффекту пористости, размер частиц также влияет на разрешение всех видов хроматографии, включая IEXC. Равномерный и малый размер частиц способствует эффективному переносу молекул между подвижной и неподвижной фазами и обеспечивает высокое разрешение, но увеличивает сопротивление колонки, поэтому требуется более высокое давление или большее время разделения. Частицы малого размера предпочтительны для аналитического разделения. Напротив, частицы большого размера чаще используются в крупномасштабном производстве.
Селективность ионообменных сред зависит от природы и степени замещения функциональных групп, называемых лигандами. Среды подразделяются на анионообменные и катионообменные. Лиганд анионообменников может быть заряжен положительно, и анионы могут связываться с ним и обмениваться на нем. Напротив, катионообменники, на которых происходит обмен катионами, могут быть заряжены отрицательно. Обычно используемые обменники названы по функциональным группам и перечислены в таблице 2.
Таблица 2. Часто используемые обменники
|
Обменник
|
Лиганд
|
Заряженная группа
|
|
Сильный катион
|
Сульфопропил (SP)
|
-CH2CH2CH2SO3-
|
|
Слабый катион
|
Карбоксиметил (CM)
|
-O-CH2COO-
|
|
Сильный анион
|
Четвертичный аммоний (Q)
|
-N+(CH3)3
|
|
Слабый анион
|
Диэтиламиноэтил (DEAE)
|
-N+H(C2H5)2
|
|
Диэтиламинопропил (ANX)
|
-N+H(C2H5)2
|
Прим. редактора (см. рис. ниже): Представление ионных лигандов на различных ионообменных смолах: (а) непосредственно прикрепленные к поверхности, (б) ионообменная смола типа "щупальце" и (в) смола типа "щупальце" повышенной гибкости.
Ионообменники классифицируются как слабые и сильные в зависимости от ионизационных свойств лигандов. Сильные ионообменники имеют лиганды с высоким коэффициентом ионизации (рис. 2). Они полностью заряжены в диапазоне pH 1~13. В этом диапазоне изменение pH не влияет на заряд ионообменника. Таким образом, сильные ионообменники могут широко использоваться практически во всех диапазонах рН. Напротив, слабые ионообменники имеют в качестве функциональных ионных групп слабые электролиты. На ионизацию этих групп влияет рН раствора. Поэтому они могут обеспечивать другую селективность по сравнению с сильными ионообменниками.

Рис. 2. Свойства заряда распространенных типов ионообменников и пример белка с различным значением рН
|
..... AIEX (Q) → сильный анионообменник Q Sepharose Fast Flow; ..... AIEX (DEAE) → слабый анионообменник DEAE Sepharose Fast Flow; — Protein X - Белок Х; −−− CIEX (CM) → слабый катионообменник CM Sepharose Fast Flow; −−− CIEX (S) → сильный катионообменник S Sepharose Fast Flow
|
Характеристики сефарозы Q, SP, DEAE и CM
|
Продукт
|
Q
|
SP
|
DEAE
(диэтиламин)
|
CM
|
|
Тип геля
|
Сильный анион
|
Сильный катион
|
Слабый анион
|
Слабый катион
|
|
Общая ионная емкость (мкмоль/мл геля)
|
180-250
|
180-250
|
110-160
|
90-130
|
|
Рекомендуемый диапазон рабочего расхода (см/ч)
|
100-300
|
100-300
|
100-300
|
100-300
|
|
Прибл. средний размер частиц (мкм)
|
90
|
90
|
90
|
90
|
|
Диапазон размеров частиц (мкм)
|
45-165
|
45-165
|
45-165
|
45-165
|
|
рабочий диапазон pH*
|
2-12
|
4-13
|
2-9
|
6-10
|
|
Стабильность pH**
- кратковременная
|
1-14
|
3-14
|
1-14
|
2-14
|
|
- долгосрочная
|
2-12
|
4-13
|
2-13
|
4-13
|
* Рабочий диапазон pH относится к диапазону pH, в котором ионообменные группы остаются заряженными и поддерживают стабильно высокую емкость.
** Стабильность pH. Долгосрочная стабильность pH относится к интервалу pH, при котором гель стабилен в течение длительного периода времени без неблагоприятного воздействия на его последующие хроматографические характеристики. Краткосрочная стабильность pH относится к интервалу pH для процедур регенерации и очистки.
2.3. Поверхностный заряд белка
Подвижной фазой в IEXC является водный раствор с соответствующим значением pH и ионной силой. Значение pH определяет зарядовые свойства белка. Значение pH, меньшее, чем pI белка, приводит к положительному суммарному заряду белка, и наоборот. Следует отметить, что метод IEXC основан на электростатическом взаимодействии. Взаимодействие между белком и ионообменником в большей степени зависит от распределения заряда на поверхности белка, чем от суммарного заряда (рис. 3).

Рис. 3. Различное распределение зарядов белков
Распределение заряда на поверхности и внутри не является равномерным, поэтому раствор со значением pH, немного отличающимся от значения pI белка, не может обеспечить получение белком ожидаемой заряженной поверхности. На практике рН обычно по меньшей мере на 1 единицу выше или ниже pI целевого белка, чтобы гарантировать, что белок обладает ожидаемым поверхностным зарядом.
2.4. Мобильная фаза
Подвижная фаза состоит из рН-буферной системы и нейтральных солевых ионов. Буферные ионы в буфере должны иметь одинаковый заряд с обменником. В противном случае буферные ионы будут связываться с обменником раньше ионов элюента и вызывать значительные колебания рН во время элюирования. Обычно используемые буферы приведены в таблице 3.
Таблица 3. Обычно используемые буферы для катионной и анионообменной хроматографии
|
Буферы
|
Диапазон pH
на уровне 20 mM
|
|
Буфер для катионообменной хроматографии
|
|
|
Лимонная кислота
|
2.6~3.6
|
|
Уксусная кислота
|
5.3~6.3
|
|
MES
|
5.8~6.8
|
|
Фосфатный буфер
|
6.3~7.3
|
|
HEPES
|
7.1~8.1
|
|
Буфер для анионообменной хроматографии
|
|
|
БИС-ТРИС
|
6.0~7.0
|
|
Трис-HCl
|
7.5~8.5
|
|
TEA
|
7.4-8.8
|
|
Этаноламин
|
9.0~10.0
|
|
Пиперидин
|
10.5~11.5
|
Кроме значения pH, на связывание белка влияет ионная сила. Типичный эксперимент IEXC включает стадию связывания и стадию элюирования. Как показано в уравнениях 1 и 2, белки адсорбируются на обменнике при низкой ионной силе и десорбируются при высокой ионной силе. Поэтому ионная сила должна быть достаточно низкой в процессе связывания для обеспечения адсорбции белков и повышенной для их элюирования. Ионная сила в IEXC обычно регулируется путем добавления раствора NaCl высокой концентрации.
2.5. Операция
2.5.1. Процесс связывания
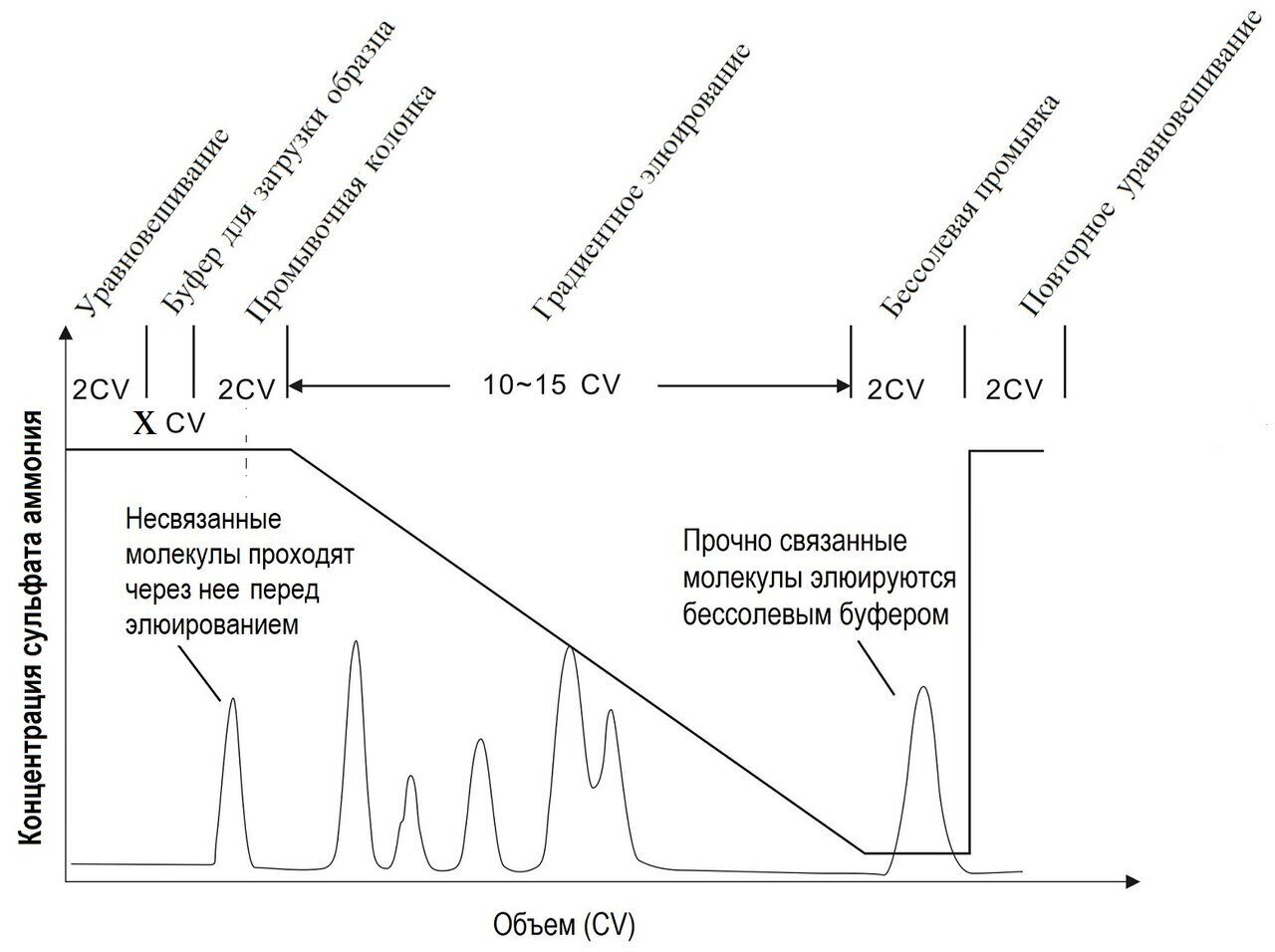
Все растворы, используемые для колоночной хроматографии, включая раствор для пробы, должны быть дегазированы и отфильтрованы (мембрана 0,22 или 0,45 мкм), чтобы избежать засорения колонки пузырьками воздуха или частицами. Перед загрузкой образца колонку следует уравновесить 2-мя объемами исходного буфера (2 CV). Затем образец загружается с той же скоростью потока. После этого необходимо прогнать 3 CV исходного буфера, чтобы смыть несвязанные примесные белки.
2.5.2. Элюирование
Хотя белки могут быть разделены при постоянном составе растворителя, что называется изократической элюцией (изократическим элюированием), для большинства плотно адсорбированных белков потребуется очень много времени для элюирования.
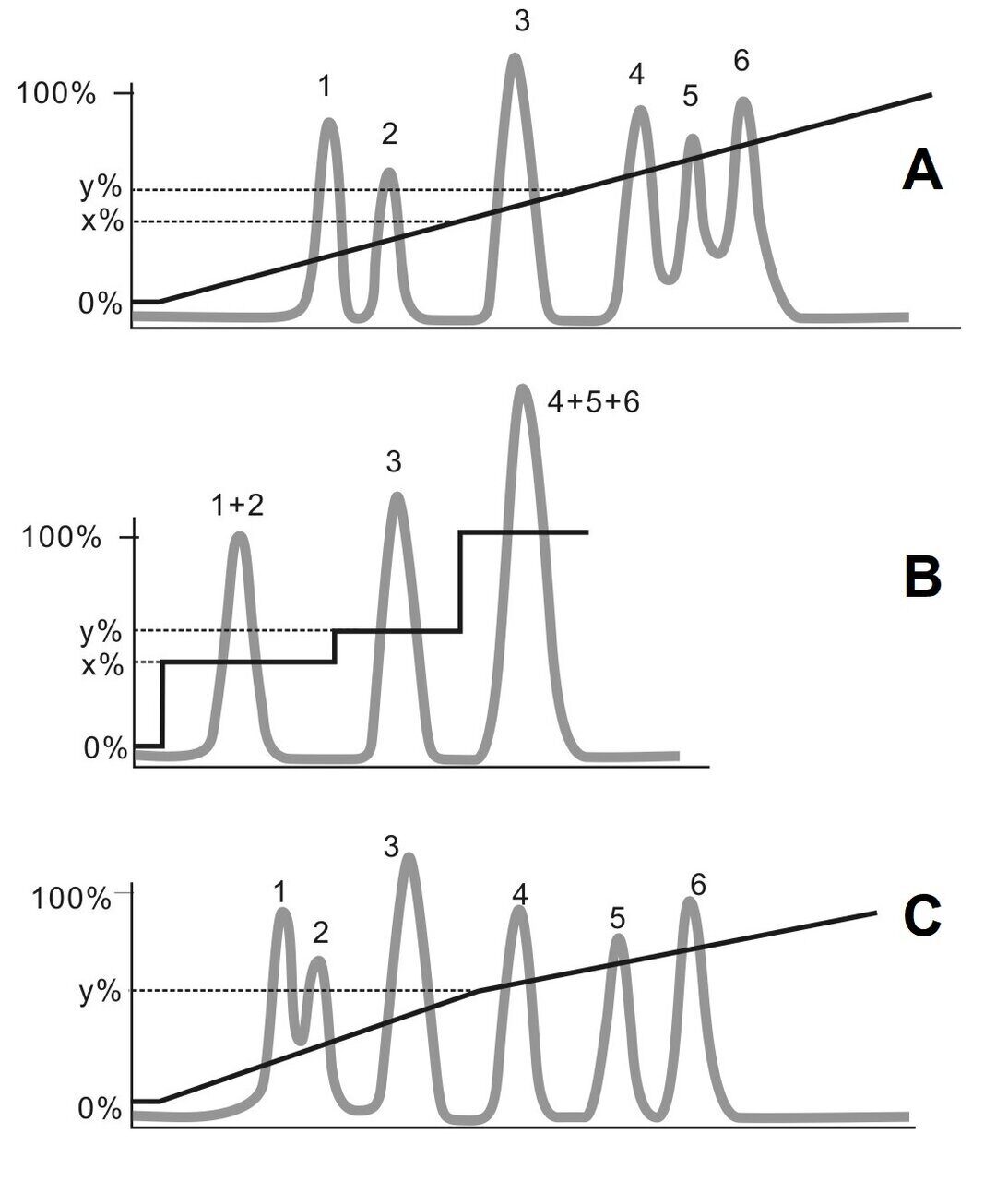
На практике чаще всего используется стратегия ускорения обмена белка путем увеличения силы ионов в исходном буфере. Наиболее широко используемым агентом является NaCl. Удобно увеличивать катион Na+ и анион Cl- одновременно и без существенного изменения pH раствора. Белки можно элюировать линейным или ступенчатым градиентом ионной силы или их комбинацией (рис. 4). Пошаговое (ступенчатое) градиентное элюирование используется для разделения групп. На каждом этапе одновременно элюируется одна группа белков со сходным зарядовым свойством. Этот метод часто используется в крупномасштабном производстве. В свою очередь линейный градиент может показаться бесконечным числом крошечных этапов, на которых белок элюируется и разделяется один за другим. Он больше используется в предварительных экспериментах или аналитических разделениях. На практике обычной стратегией является сочетание линейного и пошагового градиента. Как показано на рисунке 4C, часть примесей сначала элюируется ступенчатым градиентом, а затем целевой белок отделяется от аналогично заряженных белков линейным градиентом.
Другой метод элюирования заключается в изменении поверхностного заряда белков путем изменения значения pH элюирующего буфера. Как правило, в катионном методе IEXC увеличение значения pH уменьшает положительный заряд поверхности белков, и взаимодействие между белками и обменниками ослабевает. В анионном IEXC, чтобы элюировать белок, значение pH наоборот уменьшается. Белки элюируются при значении pH, близком к их pI. Следует отметить, что изменение pH может также изменять зарядовые свойства слабых обменников в определенных диапазонах, поэтому слабый обменник, возможно, дает различное разрешение в этих диапазонах. Однако на практике pH-элюирование используется реже, поскольку некоторые белки осаждаются при значении pH, близком к их pI, и забивают колонку. Кроме того, при изменении значения pH трудно поддерживать постоянную ионную силу, что ухудшает воспроизводимость результатов.
Рис. 4. Различные стратегии градиентного элюирования
|
А. Линейно-градиентное элюирование
В. Пошаговое градиентное элюирование разработано на основе рисунка А, учитывая, что компонент 3 представляет интерес.
С. Сегментированный градиент используется, когда некоторые компоненты необходимо дополнительно разделить.
|
2.6. Характеристика и применение
IEXC является одним из наиболее часто используемых хроматографических методов для разделения белков. Адсорбция и элюирование происходят в мягких условиях, поэтому естественная активность может быть сохранена во время хроматографического процесса.
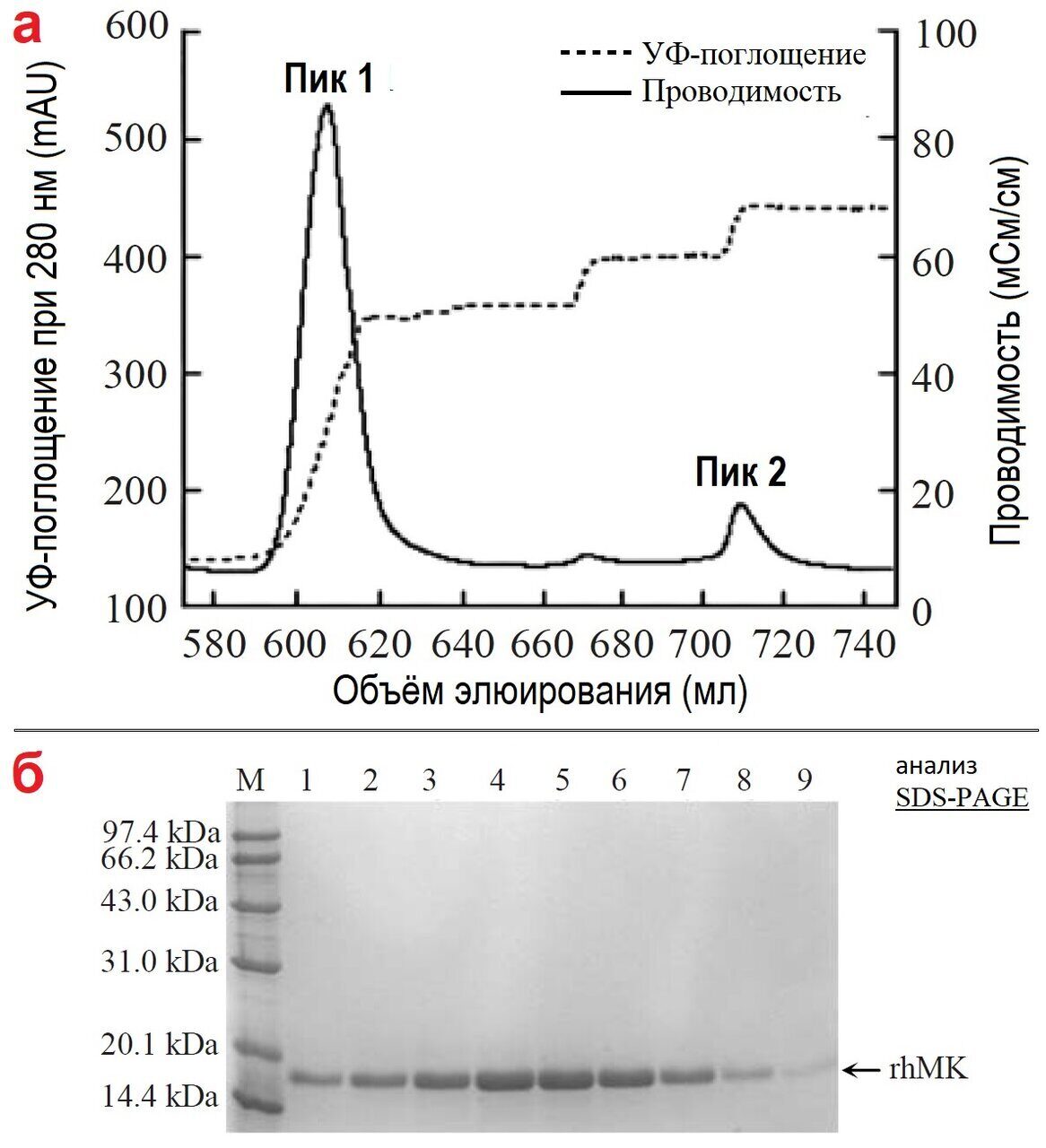
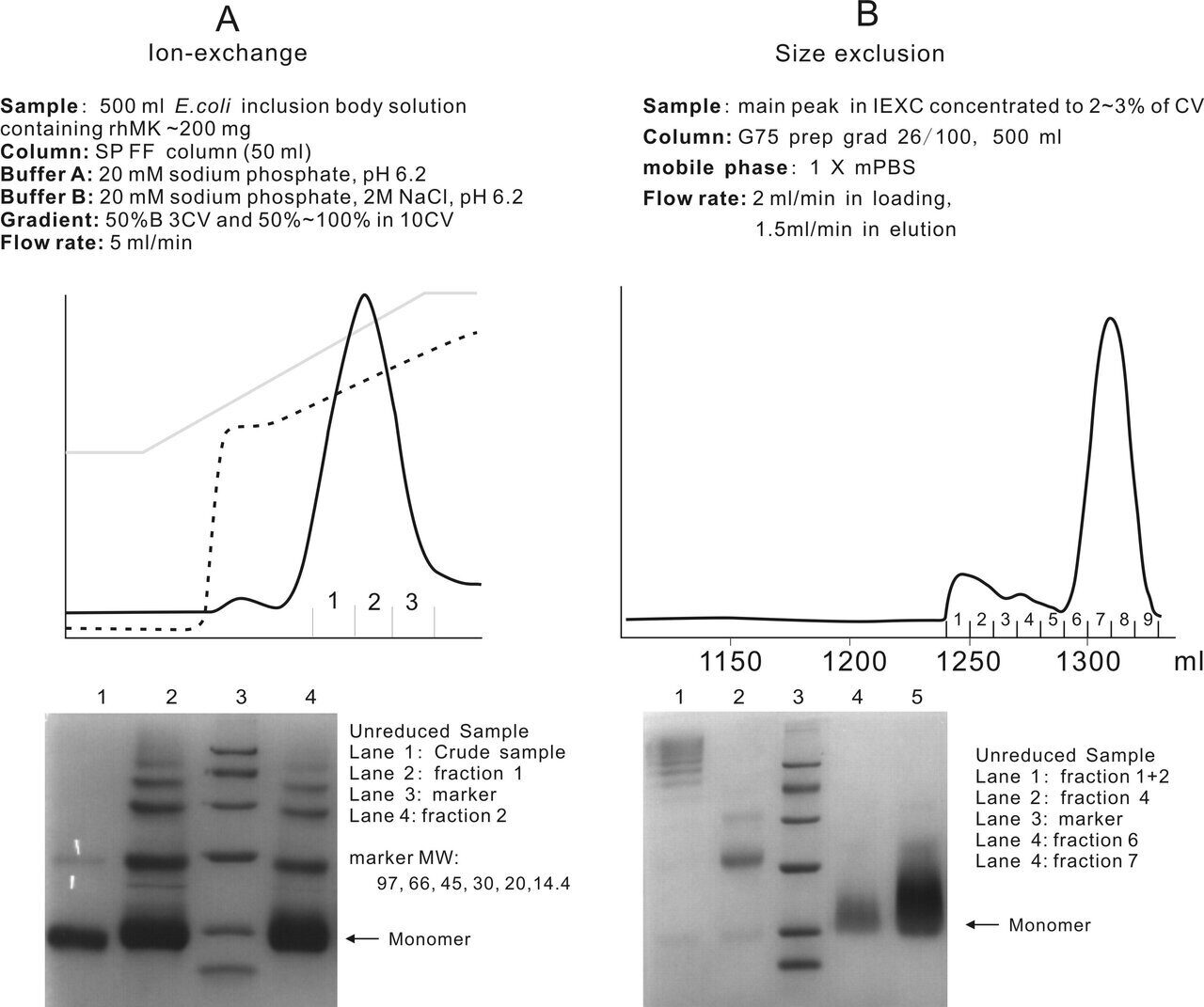
2.6.1. Ренатурация и очистка рекомбинантного мидкина человека (rhMK) с помощью колонки S-Sepharose
Рекомбинантный мидкин человека, pI=9,72, был экспрессирован по технологии микробной (E.coli) ферментации и выделен методом IEX-хроматографии с использованием колонки S-Sepharose.
Прим. ред.: Обычно при накоплении рекомбинантного белка в микробных клетках происходит их агрегация в виде плохо растворимых телец включения, содержащих неактивный белок. Для дальнейшей работы белки подвергают растворению в жестких условиях, в присутствии мощных денатурантов. Для восстановления биологической активности рекомбинантного белка необходимо провести ренатурацию. Стандартная стратегия, используемая для ренатурации нерастворимых белков, включает три этапа: 1) изоляцию и очистку телец включения; 2) солюбилизацию агрегированного белка; 3) рефолдинг солюбилизированного белка. Основной подход, применяемым для рефолдинга солюбилизированных белков, заключается в разведении, т.е. медленном внесении ренатурирующего буфера. Существенным недостатком метода является необходимость дальнейшего концентрирования белка из сильно разведенных растворов, а также низкая эффективность рефолдинга (высокими показателями считаются 30% рефолдированного белка).
Для ренатурации мидкина (rhMK) денатурированный раствор разбавляли раствором для сворачивания белков. После ренатурации белковый раствор центрифугировали для отделения нерастворимых белков при 18000×g в течение 30 минут при 4 °C, а полностью свернутый растворимый белок очищали с помощью колонки S-Sepharose. rhMK имеет основной pI 9,72, поэтому для очистки была выбрана катионообменная хроматография с буферным pH ниже 9,72.
Условия связывания белка были оптимизированы и составили 20 ммоль/л Na2HPO4 и 1 ммоль/л EDTA, pH 8,0 (буфер А), согласно экспериментам по периодическому поглощению / элюированию. Буфер А использовался для уравновешивания колонки. После загрузки раствора рефолдированного белка при скорости потока 0,5 мл/мин колонку промывали буфером А до тех пор, пока оптическая плотность при 280 нм не вернулась к исходному уровню, указывая на удаление несвязанных белков.
Прим. ред.: Белки в растворе поглощают ультрафиолетовый свет с максимумами поглощения при 280 и 200 нм. Аминокислоты с ароматическими кольцами являются основной причиной пика поглощения при 280 нм. Пептидные связи в основном отвечают за пик при 200 нм. Вторичная, третичная и четвертичная структуры влияют на поглощение, поэтому такие факторы, как pH, ионная сила и т. д., могут изменить спектр поглощения.
Рис. 5. Профиль очистки rhMK с использованием колонки S-сефарозы
|
Затем рекомбинантный белок элюировали, медленно повышая ионную силу буфера из буфера В. Во время элюирования наблюдалось два белковых пика. Первый появился, когда проводимость достигла 30 мСм/см (рис. 5а, пик 1), а второй - при проводимости 70 мСм/см (миллисименс на сантиметр) (рис. 5а, пик 2). При анализе элюированных белков с помощью SDS-PAGE и окрашивания белков было обнаружено, что rhMK элюируется в пике 1 (рис. 5б).
|
.3. Гидрофобная хроматография (HIC)
Хроматография гидрофобного взаимодействия (HIC) основана на взаимодействии между гидрофобной поверхностью белков и гидрофобными лигандами на среде [8]. Она используется для разделения белков уже более полувека, хотя общепринятой теории определения гидрофобного взаимодействия не существует. (См. дополнительно: Понятие гидрофобности).
Принцип HIC параллелен принципу высаливания (осаждения).
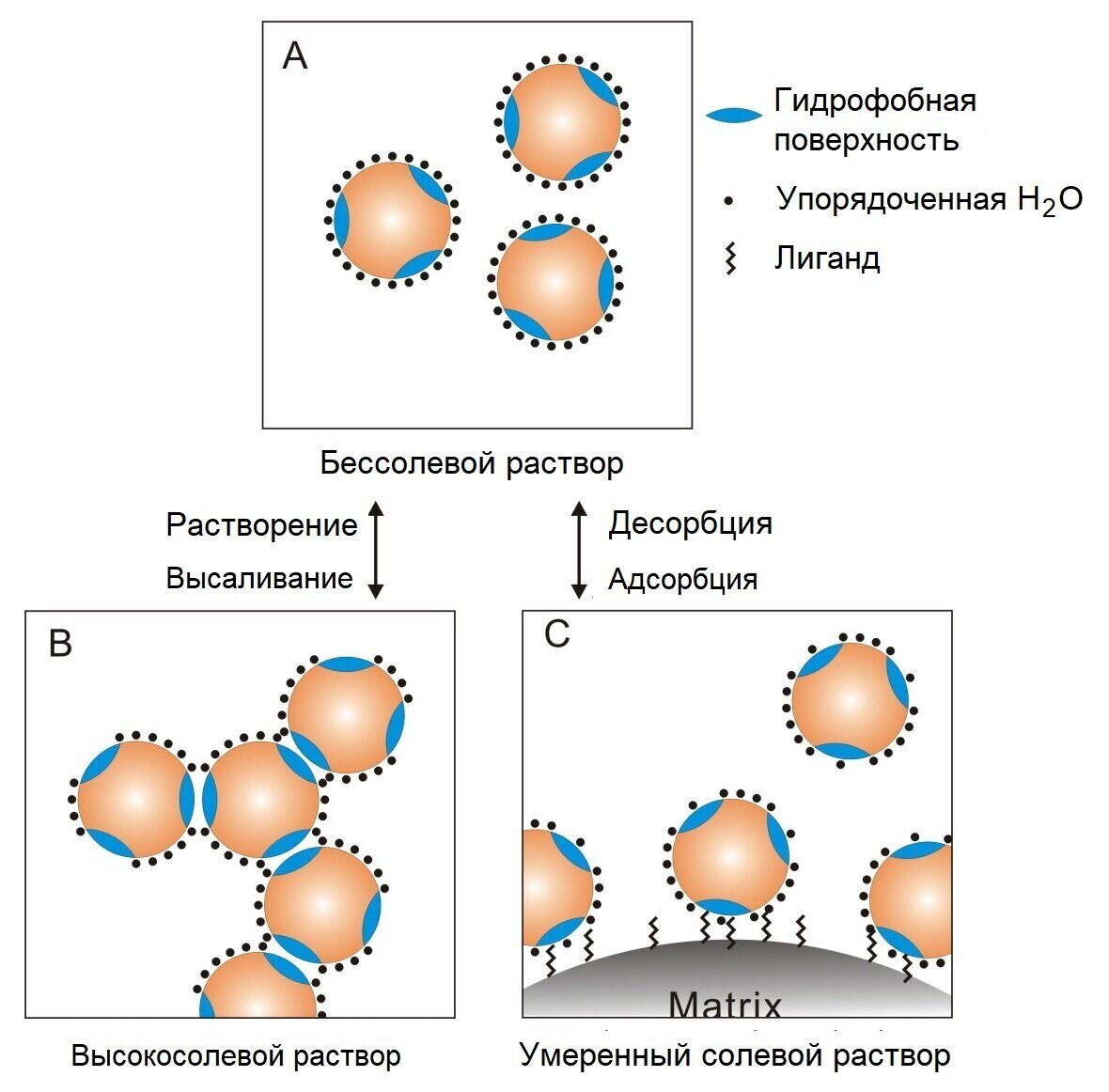
Принцип: Соединения соли диссоциируют в водных растворах. Это свойство используется в процессе высаливания. При увеличении концентрации соли ионы соли притягивают часть молекул воды, что уменьшает количество молекул воды, доступных для взаимодействия с заряженной частью белка.
В водном растворе между молекулами воды и поверхностью белка образуется водородная связь. Благодаря водородной связи боковые цепи белковых молекул адсорбируют молекулы воды, образуя вокруг них упорядоченную водную пленку (упорядоченность воды). Водная пленка предотвращает агрегацию белковых молекул и выпадение их в осадок. Различные боковые цепи аминокислот обладают разной способностью к образованию водородных связей. Гидрофобные аминокислоты, такие как изолейцин, валин, лейцин и фенилаланин, склонны терять упорядоченность воды при увеличении ионной силы раствора (т.е. не обладают высокой способностью к образованию водородных связей – ред.). Относительная гидрофобность аминокислот определялась по изменению свободной энергии Гиббса при переходе аминокислот из водного раствора в неполярный растворитель [9]. Распределение гидрофобных аминокислот на поверхности белка определяет его гидрофобность. При увеличении концентрации соли белки связываются друг с другом и выпадают в осадок в порядке уменьшения гидрофобности. Этот процесс называется дробным осаждением (рис. 6B).
В HIC концентрация соли контролируется на соответствующем уровне, например, 1 M (NH4)2SO4. При такой концентрации гидрофобное взаимодействие еще недостаточно сильно, чтобы вызвать осаждение белков. Однако гидрофобная среда, называемая адсорбентом, может адсорбировать белки с помощью связанного с ней высокогидрофобного лиганда (рис. 6С). (рис. 6C). Когда белковый раствор проходит через колонку HIC, белки с определенной гидрофобностью будут адсорбироваться, а белки со слабой гидрофобностью будут проходить через колонку вместе с подвижной фазой. Поэтому для адсорбции белков со слабой гидрофобностью необходимо применять более высокую концентрацию соли или адсорбент с более сильной гидрофобностью для усиления гидрофобного взаимодействия.
Рис. 6. Процесс высаливания и адсорбция между белком и адсорбентом.
|
(А) Белок может диспергироваться в растворе, не содержащем соли. (Б) При увеличении концентрации соли происходит поглощение упорядоченных молекул воды. Белки склонны к агрегации и выпадению в осадок. (C) При умеренной концентрации соли гидрофобное взаимодействие между белковыми молекулами недостаточно сильное, чтобы вызвать саждение, но может привести к адсорбции белков гидрофобной матрицей.
|
3.1. Стационарная фаза
Среда HIC состоит из базовой матрицы и лиганда. Базовая матрица выполняет функцию опоры, на которой иммобилизован гидрофобный лиганд. Чтобы избежать нарушения гидрофобных взаимодействий между белками и лигандом, матрица должна иметь инертную поверхность. Сшитая агароза является одной из наиболее широко используемых матриц, она имеет пористую структуру, обладает высокой связывающей способностью, высокой текучестью, хорошей физической и химической стабильностью. Кроме того, в качестве матрицы также широко используются силикополимерные или синтетические сополимерные материалы.
Гидрофобные лиганды прикрепляются к поверхности базовой матрицы ковалентными связями, например, глицидиловым эфиром для агарозы и силиловым эфиром для силикогеля. Широко используемыми лигандами для HIC являются линейно-цепочечные алканы и фенил. Сила гидрофобности возрастает с увеличением длины углеродной цепи. Бутил (C4) и октил (C8) - часто используемые лиганды с линейной цепью. Другим широко используемым лигандом является фенил, который не только обладает такой же гидрофобностью, как и пентиловый (C5) лиганд, но и имеет потенциал π-π взаимодействий с белками, богатыми ароматическими группами.
Перед выделением каждого нового белка рекомендуется предварительно протестировать различные среды (адсорбенты) на небольшой предварительно упакованной колонке. Предварительные тесты следует начинать со среды с наименьшей гидрофобностью. Идеальная среда, во-первых, должна обладать соответствующей гидрофобностью, благодаря которой целевой белок мог бы адсорбироваться при определенной концентрации соли. Чем ниже гидрофобность белка, тем более высокой гидрофобностью должна обладать среда для его улавливания. Кроме того, среда должна быть способна десорбировать белок по мере снижения концентрации соли. Как только белки захватываются слишком плотно, чтобы их можно было элюировать, необходимо добавить органический растворитель для увеличения элюирующей способности, что, возможно, приводит к инактивации белков.
3.2. Подвижная фаза
В отличие от IEXC, исходный буфер в HIC требует присутствия высокой концентрации солевых ионов, которые преимущественно захватывают упорядоченные молекулы воды с поверхности белка и способствуют гидрофобному взаимодействию. Сила воздействия различных ионов неодинакова. Ион, который больше увеличивает натяжение воды, как правило, больше увеличивает силу взаимодействия между белками и HIC-средой, хотя внутренняя природа до сих пор не ясна. В серии Хофмайстера (классификация ионов) перечислены распространенные ионы в соответствии с их способностью увеличивать натяжение воды [10].
|
Анионы:
|
|
HPO42- > SO42- > C2H3O2- > F- > Cl- > Br- > I- > ClO4- > SCN-
|
|
Катионы:
|
|
N(CH3)4+ > Cs+ > Rb+ > NH4+ > K+ > Na+ > Li+ > Ca2+ > Mg2+
|
|
Моляльное пов. натяжение растворов солей:
|
|
MgCl2 > Na2SO4 > K2SO4 > (NH4)2SO4 > MgSO4 > Na2HPO4 > NaCl > LiCl > KSCN
|
Этот ряд не является последовательным для каждого белка, поскольку, кроме влияния на натяжение воды, специфическое взаимодействие между ионами и белками, по-видимому, является еще одним параметром гидрофобного взаимодействия. Похоже, что на гидрофобное взаимодействие больше влияют анионы, чем катионы. Например, MgCl2 слабее, чем (NH4)2SO4, влияет на гидрофобное взаимодействие.
На практике (NH4)2SO4 является одной из наиболее используемых солей, 1~1,5 М раствор (NH4)2SO4 может удовлетворить большинство белковых разделений. Если не удается добиться идеального эффекта, следует изменить концентрацию или заменить другие ионы соли, например, Na2SO4 или NaCl. Недостатком (NH4)2SO4 является то, что NH+ склонен образовывать газообразный аммиак при высокой концентрации OH-, поэтому его следует использовать при pH < 8,0. При добавлении высокой концентрации соли в образец некоторые гидрофобные белки могут выпасть в осадок. Поэтому не забывайте фильтровать или центрифугировать раствор для удаления частиц после того, как нестабильные белки достаточно укрупнятся.
Значение pH раствора также оказывает комплексное влияние на силу гидрофобного взаимодействия. Механизм не совсем ясен. В целом, увеличение pH ослабляет гидрофобное взаимодействие [11], возможно, за счет увеличения поверхностного чистого заряда. Однако исследование Hjerten et al. показало, что повышение pH, наоборот, увеличивает удерживание некоторых белков [12].
Влияние температуры на гидрофобное взаимодействие также является сложным. Повышение температуры может усиливать гидрофобное взаимодействие для одних белков, но ослаблять его для других. Этот эффект до сих пор не может быть эффективно предсказан с помощью теории.
3.3. Элюирование
Как и в случае с IEXC, изократическое элюирование с постоянным составом растворителя не позволяет эффективно элюировать белок. Градиентное снижение ионной силы является наиболее часто используемым методом в процессе HIC-элюирования. При уменьшении ионной силы белки десорбируются в порядке возрастания гидрофобности поверхности.
При снижении концентрации соли белки снова приобретают упорядоченные молекулы воды и элюируются в порядке возрастания гидрофобности. Линейное или ступенчатое градиентное снижение концентрации соли используется для элюирования белка в HIC. Подобно стратегиям IEXC, простое линейное градиентное элюирование обеспечивает равномерное разрешение в универсальном диапазоне градиентов, что всегда используется в скрининговых экспериментах или аналитическом разделении, но требует больше времени. Пошаговое градиентное элюирование предпочтительнее при крупномасштабном препаративном разделении. Это выгодно с точки зрения экономии времени, раствора и получения более концентрированного продукта. Но эта стратегия обычно не может быть реализована до тех пор, пока не будут найдены подходящие условия элюирования путем предварительных работ по линейному градиентному элюированию. Типичный спектр линейно-градиентного элюирования показан на рисунке 7.
Рис. 7. Типичный спектр линейного градиентного элюирования HIC
Кроме того, добавление нейтрального неполярного раствора, такого как детергенты, в элюирующий буфер может способствовать элюированию более гидрофобных белков, таких как мембранные белки или аплипопротеины. Однако неполярный раствор может вызвать необратимую инактивацию, поэтому его следует избегать при HIC. Если целевой белок не удается элюировать в бессолевом водном растворе, следует рассмотреть возможность замены среды на менее гидрофобную. В то же время для регенерации (очистки) колонки можно использовать органический раствор высокой концентрации, с помощью которого будут вымываться прочно связанные соединения.
pH и температура являются двумя важными факторами удерживания белков, но они обычно не используются в качестве переменных параметров при элюировании, поскольку их влияние практически невозможно контролировать. Таким образом, условия pH и температуры должны быть одинаковыми для разных участков, чтобы обеспечить хорошую воспроизводимость.
3.4. Особенности
Метод HIC разделяет белки на основе различной гидрофобности белков. Он сочетает в себе обратимость гидрофобного взаимодействия и точность колоночной хроматографии для получения превосходного разделения. При определенной среде HIC может захватывать почти все белки при определенных условиях и подходит для захвата, концентрирования или полировки белков (прим. ред.: На заключительном этапе полировки удаляются наиболее сложные примеси, такие как агрегаты целевого белка. Общее эмпирическое правило заключается в том, что чем более высокая чистота белка вам нужна, тем больше этапов очистки вам придется задействовать в своем рабочем процессе).
Селективность HIC ортогональна селективности IEXC и SEC, поскольку она основана на гидрофобности белков, что совершенно отличается от заряда поверхности, используемого в IEXC, и размера молекул в SEC. Таким образом, HIC является ортогональным параметром разделения при объединении с IEXC или SEC. Поэтому последовательное использование двух из них дает гораздо лучшее разделение, чем использование одного.
.4. Обратно-фазовая хроматография (RPC)
Обращенно-фазовая (обратно-фазовая) хроматография была названа так из-за обратной полярности между подвижной фазой и неподвижной фазой по сравнению с нормальной фазовой хроматографией [13]. В обычной фазовой хроматографии подвижной фазой является органический растворитель, а неподвижной фазой является гидрофильная смола. В RPC, наоборот, в качестве неподвижной фазы используются гидрофобные адсорбенты, что теоретически аналогично HIC. Однако на практике эти два метода имеют много различий. В основном это связано с разной степенью замещения гидрофобных лигандов на поверхности среды. Как показано в таблице 4, плотность лиганда в RPC на порядок выше, чем в HIC. Это означает, что при адсорбции молекула белка может связать больше лигандов. Огромные силы могут извлекать белки из водного раствора без помощи нейтральной соли, поэтому адсорбированные белки не могут быть элюированы до использования неполярных растворителей. Поэтому RPC редко используется для получения активных белков. Однако превосходное разрешение делает этот метод важнейшей аналитической хроматографией. Жидкостная хроматография-масс-спектрометрия является важным расширенным применением метода.
Таблица 4. Сравнение между RPC и HIC
|
|
RPC
|
HIC
|
|
Взаимодействие
|
Гидрофобное взаимодействие
|
Гидрофобное взаимодействие
|
|
Лиганд
|
C2~C8 алкил или арил
|
C4~C18 алкил
|
|
Степень замещения
|
10-50 ммоль/мл геля
|
Несколько сотен ммоль/мл геля
|
|
Условия захвата
|
Бессолевой раствор
|
Высокосолевой раствор
|
|
Элюирование
|
Повышение неполярности
|
Снижение ионной силы
|
|
Применение
|
Анализ белков. Препаративное разделение полипептидов или олигонуклеотидов
|
Препаративное разделение белка
|
4.1. Стационарная фаза
Как и в случае с HIC, среда RPC состоит из инертной базовой матрицы и гидрофобных лигандов на поверхности.
Базовая матрица для обращенно-фазовых сред обычно состоит из кремнезема или синтетического органического полимера, такого как полистирол. Кремнезем был первым материалом, использованным в качестве базовой матрицы для RPC, который обладает отличной механической прочностью и химической стабильностью в кислотных условиях. Однако недостатком матрицы на основе диоксида кремния является ее химическая нестабильность в водных растворах при высоком pH. Кремнеземная матрица может раствориться при высоком pH, поэтому ее не рекомендуется использовать при длительном воздействии выше pH7,5. Кроме того, из-за неполного замещения или длительного использования некоторые недостаточно активированные силанольные группы попадают в подвижную фазу, которая при высоком значении pH заряжается отрицательно и вызывает ионное взаимодействие с белками. Смешанная хроматография всегда приводит к снижению разрешения со значительным уширением и хвостами пиков. Поэтому RPC с использованием кремнеземной матрицы часто проводят при низких значениях рН (<3).
Загрузочная способность и разрешение определяются размером смолы, в общем случае смола меньшего размера дает более высокое разрешение, но меньшую загрузочную способность. Смола с диаметром 3~5 мкм предпочтительна для аналитического разделения. Из-за небольшого размера ее трудно хорошо упаковать. Поэтому она часто предлагается в виде фасовочных колонок. С увеличением диаметра увеличивается загрузочная способность, но одновременно снижается разрешение. Как правило, для препаративного разделения используются среды диаметром 15 мкм и более.
Пористая структура используется для увеличения загрузочной способности носителей PRC. Обычно размер пор составляет 10~30 нм. Среды с размером пор 10 нм используются преимущественно для малых пептидов или молекул. Среды с размером пор 30 нм и более используются для очистки крупных пептидов или белков.
Лиганды, используемые в RPC, представляют собой линейные алкилы с различной длиной углеродной цепи, что является основным фактором, влияющим на селективность носителей. Как правило, носители с более длинноцепочечными лигандами обладают более сильной гидрофобностью. Олигонуклеотиды и органические молекулы, обладающие меньшей гидрофобностью, нуждаются в более гидрофобных средах для обеспечения достаточной адсорбируемости, таких как среды C18. Напротив, крупные пептиды или белки обычно имеют больше гидрофобных участков и нуждаются в менее гидрофобных адсорбентах, таких как C4 или C8. Селективность и загрузочная способность также зависят от степени замещения. Для крупных пептидов или белков эффект увеличения степени замещения равен увеличению длины углеродной цепи.
4.2. Подвижная фаза
4.2.1. Органический растворитель
Как правило, образец загружается в колонку в водном растворе и элюируется при уменьшении полярности раствора. Мощность элюирования увеличивается по мере уменьшения полярности. Хотя большая часть органических растворителей обладает достаточной элюирующей способностью, лишь некоторые из них могут быть использованы в RPC из-за требований к вязкости и ультрафиолетовой (УФ) прозрачности. Высокая вязкость раствора влияет на диффузию растворителей между подвижной и неподвижной фазами, поэтому высоковязкий растворитель снижает разрешение. Поглощение УФ-излучения растворителем затрудняет определение поглощения УФ-излучения растворенным веществом. Ацетонитрил и метанол являются двумя наиболее широко используемыми органическими модификаторами благодаря их умеренной вязкости и идеальной прозрачности в ультрафиолетовом диапазоне. Хотя изопропанол и обычный пропанол обладают более высокой элюирующей способностью, они используются только для очистки и регенерации колонки из-за их высокой вязкости.
Следует отметить, что все растворители, используемые в RPC, должны быть высококачественными для ВЭЖХ, чтобы свести к минимуму повреждение смолы или образцов примесями.
4.2.2. pH
Значение pH может влиять на гидрофобность белков, возможно, изменяя их зарядовое свойство [14]. На практике два белка с одинаковым временем удерживания, скорее всего, будут разделены простым изменением значения pH раствора, и наоборот. В настоящее время не существует эффективного метода, позволяющего предсказать этот эффект, поэтому единственным способом оптимизации разрешения является использование различных значений рН.
Однако, как было описано выше, носители на основе кремнеземной матрицы не подходят для работы при высоких значениях pH из-за непокрытых силанольных групп. Поэтому RPC на основе кремнезема должны работать при низком значении pH, как правило, от 2 до 3. Для поддержания pH обычно используются сильные кислоты, такие как трифторуксусная кислота (TFA) или орто-фосфорная кислота.
4.2.3. Ионно-сопряженный агент
Время удерживания растворителей, таких как белки, пептиды или нуклеотиды, может быть изменено путем добавления в раствор агентов ионного сопряжения [15]. Ионно-сопряженный агент может ионизировать и высвобождать положительные или отрицательные ионы, которые связываются с молекулами образца посредством ионных взаимодействий и приводят к изменению гидрофобности. Например, в очень кислой среде большинство белков заряжены положительно. Отрицательный ионный парный агент будет связываться с положительно заряженной группой. Эффект нейтрализации всегда увеличивает гидрофобность белков. TFA используется не только для контроля pH, но и является наиболее часто применяемым агентом отрицательного ионного сопряжения. Кроме того, триэтиламин используется в качестве агента для сопряжения положительных ионов в нейтральных и щелочных условиях.
4.3. Элюирование
В RPC часто используется простая линейная градиентная элюция. Элюент представляет собой смесь буфера А и буфера В, подаваемую смесительным насосом. Буфер А обычно является стартовым буфером, в который добавляют 0,1~0,5% TFA для контроля pH и в качестве агента ионного сопряжения. Буфер B обычно представляет собой 0,1~0,5% TFA в чистом органическом растворителе, таком как ацетонитрил или метанол. Часто используется градиентное увеличение буфера В с 0% до 90% (или более) за 30-60 мин.
4.4. Применение
Применение RPC для разделения белков в основном направлено на аналитическое разделение и проверку чистоты. Поскольку, с одной стороны, RPC имеет самое высокое разрешение по сравнению с другими относительными методами, с другой стороны, жесткие условия связывания и десорбции в RPC обычно приводят к денатурации белка и не подходят для препаративного разделения. Хорошая воспроизводимость по времени удерживания и низкий предел обнаружения делают этот метод наиболее предпочтительным при проверке чистоты белков. Кроме того, RPC - это единственная хроматография, которую можно использовать в сочетании с масс-спектрометрическим анализом, поскольку только благодаря высокому разрешению RPC-хроматография позволяет разделить сложный образец, такой как сыворотка, на отдельные компоненты и немедленно проанализировать их с помощью масс-спектрометрии.
.5. Гель-фильтрация или эксклюзионная хроматография (SEC)
Размерно-эксклюзионная хроматография (SEC), или гель-фильтрационная хроматография, разделяет белки в соответствии с различиями в размере молекул [16]. В отличие от хроматографических методов, основанных на адсорбции, в SEC молекулы не связываются с поверхностью среды, а задерживаются пористой структурой среды. Как показано на рисунке 8, носители SEC-среды состоят из пористого материала. Однако размер пор намного меньше, чем размер пор матрицы, используемой в адсорбционной хроматографии, и не является однородным. Размер пор в адсорбционной хроматографии достаточно велик, чтобы пропускать все молекулы без какой-либо селективности. Для сравнения, размеры пор SEC меньше и выборочно позволяют молекулам соответствующего размера проникать и вытеснять более крупные молекулы наружу. Молекулы меньшего размера проходят более длинные и извилистые пути в среде, а не прямые пути за пределами среды, как это делают более крупные молекулы. Таким образом, меньшие молекулы более запаздывают, чем более крупные.
5.1. Неподвижная фаза

СЭМ-изображение макропористой полимерной бусины (Eshmuno®); увеличение 2000× (a) и 50 000× (b).
Комментарий редактора (к рис. выше и ниже): Структура пор адсорбента является показателем того, как устроена система пор. Структура пор монолита представляет собой связную систему макропор с мезопорами в качестве первичных пор, которые тесно связаны или доступны через макропоры. Неорганические адсорбенты часто имеют корпускулярную структуру; сшитые полимеры имеют сетчатую структуру из взаимосвязанных углеводородных цепей с различными размерами доменов.
Пористые кремнеземы, полученные путем агглютинации или отверждения золей кремнезема в двухфазной системе, представляют собой агрегаты химически связанных коллоидных частиц. В середине: ПЭМ-изображение кремнеземного ксерогеля (диаметр первичных частиц приблизительно 10 нм). Справа: СЭМ-изображение сферического агломерата размером 20 мкм, состоящего из частиц размером 750 нм.
Разрешающая способность SEC зависит от многих параметров стационарной фазы, включая объем колонки, размер частиц, распределение пор по размерам [17].
Матрица SEC часто состоит из полимеров, которые сшиваются между собой, образуя трехмерную сеть. Матрица изготавливается в виде небольших сферических частиц. На поверхности и внутри частиц образуются небольшие каналы и поры разного размера за счет контроля различной степени сшивания. Селективность среды зависит от распределения размеров пор и может быть описана кривой селективности (рис. 9). Например, среда superdex 200 (компании GE) имеет линейный диапазон селективности 1x104~6x105, что означает, что растворители с молекулярной массой (Mw) в этом диапазоне могут быть дифференцированно заторможены. Молекулы, размеры которых превышают верхний предел, полностью исключаются из внутреннего пространства среды, поскольку поры недостаточно велики для их проникновения. В это время коэффициент распределения (Kd) достигает 0. Напротив, молекулы, размеры которых меньше нижнего предела, могут свободно проникать в любой канал, поэтому они максимально задерживаются без селективности и имеют Kd=1. Те растворенные вещества, Mw которых находится между двумя крайними значениями, могут попадать в каналы с разной степенью задержки, Kd которых находится между 0 и 1, и задерживаются дифференциально.
Среды с узким линейным диапазоном часто используются для группового разделения, при котором растворители просто разделяются на две группы. Типичное применение - обессоливание белков с помощью колонки G25 (рис. 9). Напротив, среды с широким линейным диапазоном обычно используются для разделения сходных компонентов (рис. 9), например, с помощью superdex 200 для разделения IgG (Mw=1,5 x 105) и альбумина (Mw=6,6 x 104).
Рисунок 8. Принцип SEC-разделения
В SEC крупные молекулы проходят через пространство между средами с более коротким путем, а мелкие молекулы проходят через каналы внутри среды с более длинным путем.

Рисунок 9. Кривые селективности сред Superdex 200 и G25
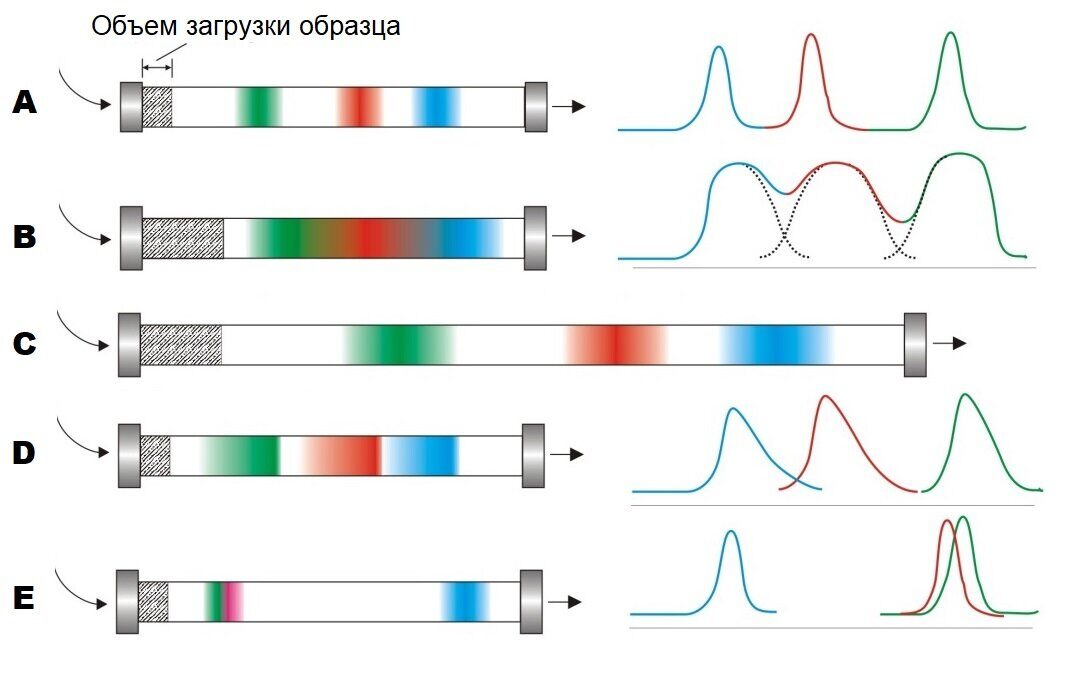
Рисунок 10. Факторы, влияющие на разрешение SEC
|
А. Типичное разделение методом SEC
Три компонента полностью разделяются на колонке SEC
В. Объем пробы
При увеличении объема пробы в три раза ширина каждого пика увеличивается в три раза. Три компонента разделяются не полностью.
С. Увеличение высоты слоя
При увеличении высоты слоя эффективность колонки увеличивается в два раза Три компонента могут быть полностью разделены.
D. Остаточный пик
Разрешение снижается из-за остаточного пика, который, возможно, вызван высокой вязкостью буфера, высокой скоростью потока или сохранением смешанного режима в результате ионного или гидрофобного взаимодействия.
Е. Смена среды
После определения целевого компонента (голубого) используется среда, подходящая для разделения крупных молекул, что увеличивает разрешение между компонентами с высоким значением Mw, но жертвует разрешением компонентов с низким значением Mw.
|
Высота насадочного слоя (слоя упаковки, адсорбционной среды) колонки влияет как на разрешение, так и на время разделения. Большая высота слоя часто дает лучшее разрешение при том же объеме образца, но требует больше времени на разделение (рис. 10C).
Размер частиц также является параметром, влияющим на разрешение и время разделения. Более мелкие частицы смолы обеспечивают более эффективный массоперенос между подвижной и неподвижной фазой, поэтому обеспечивают более высокое разрешение. Но одновременно меньшие частицы увеличивают сопротивление потоку и, как правило, приводят к увеличению времени разделения.
5.2. Подвижная фаза
Беспрецедентным преимуществом SEC во всех видах хроматографии является широкая совместимость с различными растворами. Поскольку разделение белков с помощью SEC зависит от размера молекул, а не от взаимодействия между растворенными веществами и средой, значение pH и полярность подвижной фазы обычно незначительно влияют на удерживание соединений.
Поскольку SEC не оказывает концентрационного влияния на элюаты, объемы пиков элюирования каждого компонента пропорциональны объему образца. Увеличение объема образца приведет к снижению разрешения (рис. 10B). Высокая вязкость подвижной фазы оказывает определенное влияние на разрешение, влияя на массоперенос между подвижной и неподвижной фазами, что приводит к расширению и запаздыванию пиков (рис. 10D).
Следует отметить, что ионное взаимодействие между белками и смолой, возможно, происходит при низкой ионной силе, поэтому обычно добавляют 0,15 М NaCl, чтобы избежать этого.
5.3. Элюирование
SEC не имеет определенного этапа элюирования, поскольку молекулы не адсорбируются средой. После загрузки образца буфер, обычно аналогичный исходному, прокачивается через два объема колонки до тех пор, пока все растворители не будут элюированы.
5.4. Применение
SEC имеет наиболее мягкие условия разделения, поскольку в течение всего процесса состав подвижной фазы не требует изменения. Это хорошее свойство для разделения белков, неустойчивых к изменению pH, ионной силы или полярности.
SEC часто используется на этапе полировки после грубого разделения образца с помощью другой хроматографии, особенно при разделении мономеров и полимеров, поскольку мономер и полимер обычно не могут быть разделены методами IEXC и HIC из-за сходства заряда и гидрофобных свойств. Но, к счастью, SEC вполне может разделить их по разным размерам молекул.
5.4.1. Очистка рекомбинантного мидкина человека с помощью колонки SP и колонки SEC
Рекомбинантный мидкин человека (Mw=14 кДа) был экспрессирован штаммом E.coli BL21 в виде тела включения. Тело включения было денатурировано 6 М хлоридом гуанидиния и ренатурировано путем 10-кратного разведения в ренатурирующем буфере. Ренатурированный белок разделяли с помощью IEXC и SEC (рис. 11). Из-за неправильного образования межмолекулярной дисульфидной связи часть молекул rhMK образовывала различные полимеры, которые не могли быть отделены от мономеров методом IEXC и элюировались как смесь (рис. 11А).
(результат Shixiang Jia, Ping Tu et al. General regeneratives (shanghai) limited, Shanghai, PR China)
Для отделения биоактивных мономеров от полимеров использовали колонку Sephadex G-75, обладающую диапазоном фракционирования 3000~80 000 дальтон. Метод разделения белков SDS-PAGE с невосстанавливающими условиями* продемонстрировал, что чистота мономеров достигла 95% при достижении целевого пика.
*Невосстанавливающие условия — это условия, при которых без обработки восстанавливающими агентами типа 2-меркаптоэтанола или DTT дисульфидные ковалентные связи остаются неповреждёнными и разделения на полипептидные субъединицы не происходит. Невосстановленные белки не могут полностью насыщаться SDS и, следовательно, не могут связывать детергент в постоянном массовом отношении. Это делает определение молекулярных масс этих молекул методом SDS-PAGE менее стандартизованным, чем исследование полностью денатурированных полипептидов. Однако, выявление одной полосы в таком геле (т.е. отсутствие любых компонентов, отличных от основного компонента) является показателем чистоты белка.
.6. Аффинная хроматография (AC)
Аффинная хроматография (АС) в широком смысле относится к серии методов, которые разделяют белки на основе обратимого взаимодействия между белками и их специфическими лигандами, связанными с хроматографической матрицей [18]. Аффинные взаимодействия основаны на широком спектре биопознавания, вкратце включающем взаимодействия между (1) ферментами и аналогами субстрата, ингибиторами, кофакторами [19], (2) антителами и антигенами [20], (3) мембранными рецепторами и лигандами [21], (4) нуклеиновой кислотой и комплементарной последовательностью, гистонами или полимеразой нуклеиновой кислоты, белками, связывающими нуклеиновую кислоту, (5) малыми биологическими молекулами и их рецепторами или белками-переносчиками [22], (6) ионами металлов и белками, имеющие полигистидиновую последовательность.
Аффинные взаимодействия всегда являются результатом сочетания различных типов взаимодействий, включая электростатические взаимодействия, гидрофобные взаимодействия, силы Ван-дер-Ваальса или водородные связи. Взаимодействия с высокой специфичностью всегда обеспечивают чрезвычайно высокую селективность, благодаря которой целевой белок может быть легко выделен за один этап с тысячекратным повышением чистоты и высокой степенью извлечения.
6.1. Среда
Разработка среды для АС гораздо сложнее, чем для других видов хроматографии. Она требует не только специфического лиганда, но и сложного процесса сопряжения, чтобы соединить лиганд с матрицей без значительного снижения его связывающей активности. Поэтому все больше и больше готовых к использованию матриц, к которым уже присоединены активные лиганды, были разработаны на коммерческой основе для различных видов разделения. Если подходящий лиганд отсутствует, можно рассмотреть возможность разработки специфической аффинной среды или использовать альтернативные методы очистки.
6.1.1. Базовая матрица
В основном используется агароза или сшитая агароза. Гидроксильные группы на остатках сахара легко дериватизируются для ковалентного присоединения лиганда или спейсеров, а пористая структура обеспечивает идеальную скорость потока и высокую емкость.
6.1.2. Спейсеры
Сайт связывания белка-мишени часто располагается глубоко внутри молекулы. Из-за пространственных помех небольшой лиганд, непосредственно связанный с матриксом, всегда проявляет меньшее сродство к белку-мишени, чем в свободном состоянии. Чтобы преодолеть эту ситуацию, для связывания лигандов и матрицы используются разделительные звенья (молекулярные спейсеры), обычно линейные молекулы с разной длиной цепи. Как правило, разделительное звено необходимо для связывания лигандов с Mw <1000 и не требуется для лигандов большего размера (рис. 12). Идеальные спейсеры должны иметь активные группы на двух концах, с помощью которых они могут быть ковалентно связаны с матрицей и лигандом соответственно. После соединения с матрицей и лигандом спейсерная «распорка» должна быть химически стабильной, чтобы избежать реакции с другими растворенными веществами, и гидрофильными, чтобы избежать гидрофобного взаимодействия с белками.

Рисунок 12. Влияние спейсеров на малые и большие лиганды.
|
Пространственное плечо часто необходимо для соединения малых лигандов, которые обеспечивают эффективное связывание лигандов с белками-мишенями (A), но не обязательно для больших лигандов (B).
|
Число атомов обычно используемых пространственных плеч варьируется от 4 до 12. Они часто соединяются с агарозной матрицей стабильными эфирными связями на одном конце и с лигандом другими химическими связями на противоположном конце.
6.1.3. Связывание лиганда
Процедура связывания лиганда, как правило, состоит из трех этапов. Сначала активирующим агентом активируется группа на матрице или спейсерном плече. А затем активированная группа вступает в реакцию с функциональной группой на молекулах лиганда. Наконец, остаточные непрореагировавшие группы блокируются блокирующим агентом [23]. Матрица может быть связана с лигандом с помощью химической группы на самой матрице или с помощью групп на распорных плечах. Для соединения с функциональными группами лигандов, такими как аминогруппы, гидроксильные, карбоксильные, тиольные группы, доступны различные спейсерные ответвления (рис. 13).
Рисунок 13. Часто используемые спейсеры и процедуры иммобилизации лигандов.
|
(A) Лиганды непосредственно соединяются с матрицей путем реакции между гидроксилом на матрице, активированным бромистым цианогеном, и аминогруппой на лиганде. (B) Лиганды соединяются со спейсерами путем реакции между N-гидроксисукцинимидом, активированным карбоксилом и аминогруппой на лиганде. (C) Лиганды соединяются с распорными плечами в результате реакции с эпоксидной группой. (D) Соединение через конденсацию между свободной аминогруппой и свободной карбоксильной группой. (E) Соединение через бисульфидную связь или аддитивную реакцию между силанолом и двойной связью в лиганде, такой как N=N или C=N.
|
6.1.4. Стерическая интерференция
Для малых лигандов следует обратить внимание на влияние стерической интерференции (пространственных помех), даже если используется распорное плечо. Для небольших лигандов количество каждой функциональной группы невелико. Даже всего одна. Неудачный выбор, заключающийся в неправильной пространственной ориентации соединения, скорее всего, приведет к серьезному снижению связующей способности или даже к полному отказу. Напротив, крупные лиганды имеют несколько эквивалентных групп, через которые происходит связывание, так что большая часть соединений оставляет достаточное пространство для связывания с молекулами-мишенями (рис. 14). Поэтому при соединении небольшого количества лигандов важно выбрать подходящую функциональную группу, не создавая значительных пространственных помех. Информацию о структуре можно получить из баз данных рентгеновской дифракции кристаллов или ЯМР, или предсказать с помощью вычислительной биологии.

Рисунок 14. Влияние стерических помех на малые и большие лиганды.
|
(A) Для маленького лиганда неправильная ориентация связи, скорее всего, приведет к стерическим помехам и неэффективной адсорбции. (B) Для крупных лигандов такая ситуация менее вероятна.
|
6.2. Связывание и элюирование
Идеальный буфер для связывания должен быть оптимизирован таким образом, чтобы обеспечить эффективное взаимодействие между молекулами-мишенями и лигандами и в то же время минимизировать неспецифическое взаимодействие. Поскольку взаимодействие лиганда с белком является результатом сочетания электростатического притяжения, гидрофобного взаимодействия и водородных связей, условия связывания могут быть оптимизированы с учетом этих аспектов.
Адсорбированные белки можно элюировать, изменяя значение pH, ионную силу или полярность. Значение pH можно снизить до pH 2~3, чтобы уменьшить зарядовое свойство поверхности взаимодействия между белками. Например, иммуноглюбин может быть адсорбирован на колонке с протеином А и вымыт глициновым буфером с pH 3,0. Но элюированный образец должен быть нейтрализован как можно скорее, чтобы избежать разрушения в экстремальных условиях.
Ионное взаимодействие также может быть ослаблено добавлением нейтральной соли, например, 1M NaCl часто используется на практике.
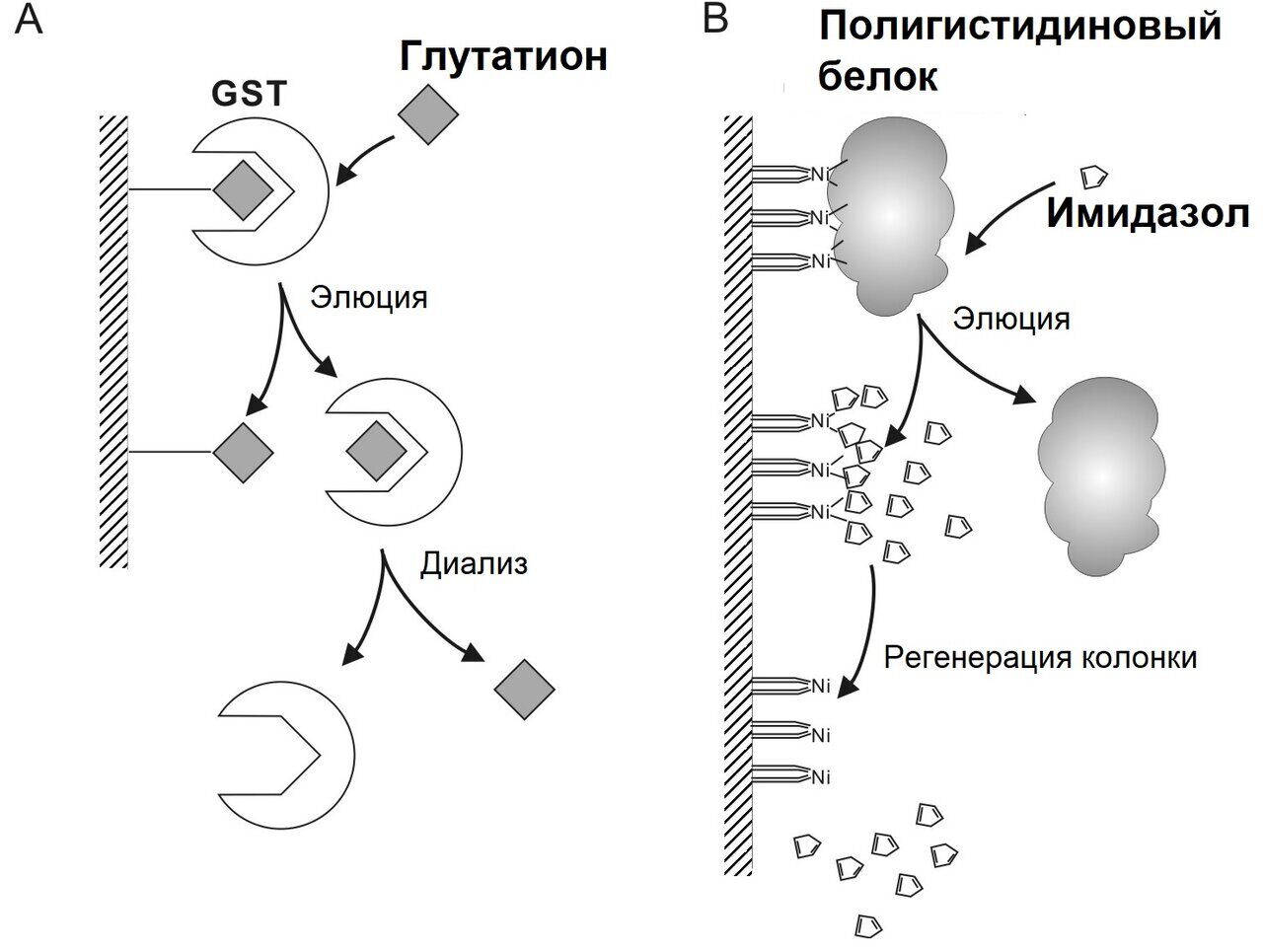
Специфическая элюция может быть осуществлена путем добавления конкурентов лигандов или целевых белков в элюирующий буфер. Идеальный конкурент должен иметь умеренный коэффициент диссоциации по отношению к лиганду или целевой молекуле, чтобы конкурент мог элюировать цель с высокой концентрацией, но при этом легко удалялся из колонки путем промывки или выделялся из целевого белка диализом. Два классических применения - аффинная хроматография глутатион S-трансферазы (GST) и полигистидина [24] (рис. 15).
В процессе связывания скорость потока должна контролироваться на относительно низком уровне, чтобы обеспечить эффективную связывающую способность.
Рисунок 15. Различные механизмы элюирования в аффинной хроматографии GST и хроматографии взаимодействия с хелатами металлов
|
(A) При очистке GST глутатион S-трансфераза захватывается средой с иммобилизованным глутатионом, а затем диссоциируется путем добавления избытка восстановленного глутатиона. Избыток глутатиона элюируется вместе с целевым белком и удаляется диализом.
***
(B) В хроматографии с хелатным взаимодействием ионов никеля белок с полигистидиновой последовательностью адсорбируется средой с иммобилизованным ионизированным никелем за счет хелатного взаимодействия между ионами никеля и имидазолилом на полигистидиновой последовательности. Белок вымывается путем добавления высокой концентрации имидазола, конкурента имидазолила на белке. Наконец, мелкий конкурент вымывается из колонки буфером для связывания.
|
6.3. Стратегия тег-очистки
(См. Белковые метки (теги))
AC разделяет белки, как правило, на основе взаимодействий между лигандами и локальными доменами белков-мишеней. В большинстве случаев взаимодействию не мешают другие домены. Поэтому для быстрого разделения рекомбинантных белков путем слитной экспрессии и совместной сепарации была изобретена стратегия очистки с помощью т.н. белковых меток (tag) [25].
Сначала целевой белок экспрессируется с белком-меткой в форме слияния. Затем целевой белок очищают с помощью аффинной колонки, специфичной для белка-метки. После этого, если метку необходимо удалить, используют рестриктивную протеазу для гидролиза слитого белка, а освободившуюся метку отделяют от целевого белка, снова пропуская через ту же колонку.
Идеальный белок-метка должен (1) иметь экономичную среду для аффинной хроматографии для удобного разделения, (2) быть очень стабильным по биоактивности и (3) обладать хорошими экспрессионными свойствами, которые помогают увеличить экспрессию целевого белка. Обычно используются такие метки, как GST-метка, FLAG-метка, S-метка, Strep-метка, His-метка и так далее.
6.4. Применение
Аффинная хроматография - это быстрый и эффективный метод хроматографии. Высокая специфичность биораспознавания придает методу чрезвычайно высокую селективность, благодаря которой белок или группа белков могут быть выделены из неочищенного образца за один шаг и доведены до удовлетворительной очистки. Однако превосходные характеристики основаны на сложной производственной технологии. Разработка каждого нового носителя требует множества испытаний по поиску подходящего лиганда и правильного соединения лиганда с матрицей. Разработка новой специфической аффинной среды для крупномасштабного производства белков стоит времени и усилий, в противном случае альтернативный метод, такой как тег-очистка или иная хроматография, должен быть лучшим выбором для мелкомасштабной подготовки в экспериментальных исследованиях.
.7. Резюме
Различные методы позволяют разделить белки в зависимости от различных свойств, включая суммарный поверхностный заряд, гидрофобность, размер молекул и аффинное взаимодействие. Аффинная хроматография обладает высочайшей селективностью и может очищать белки-мишени за одну стадию до степени очистки > 95%. Но из-за трудностей с получением и иммобилизацией подходящего лиганда этот метод хроматографии используется не так широко, как другие. Как HIC, так и RPC основаны на гидрофобном взаимодействии. PRC широко используется при аналитическом разделении из-за его высокого разрешения, но в меньшей степени используется при препаративном разделении белков, поскольку высокая неполярность элюента, вероятно, вызывает необратимую инактивацию белков. IEXC, HIC и SEC разделяют белки в мягких условиях и подходят для крупномасштабного разделения активных белков. Однако их разрешающая способность сравнительно низка, и очистить белок от сложных компонентов одним методом сложно. Идеальная очистка может быть достигнута путем комбинированного применения нескольких методов.
.8. УПАКОВКА ХРОМАТОГРАФИЧЕСКИХ КОЛОНОК

На GIF-анимации выше: Эффекты от правильной и неправильной упаковки (набивки) хроматографической колонки. Прим. ред.: Для достижения максимальной эффективности, высокого выхода продукта и его чистоты при каждом разделении необходимо получать однородный упакованный слой. Неровности, расширенные каналы и пустоты в упаковке вызывают неравномерность потока в слое, что приводит смешиванию зон, изменению скорости потока и последующему снижению выхода и качества продукта...
|
Материал для упаковки хроматографических колонок
|
|
***
↑ Примеры используемой хроматографической смолы (вид бусин)
***
Слева: показаны образцы сефарозы CL-4B после сушки в критической точке. На микрофотографии 0,6 см соответствует 10 мкм образца. На изображении видно, что отдельные бусины имеют равномерную сферическую форму и четко выраженное распределение частиц по размерам (~50-150 мкм), как указано производителем - GE Healthcare.
***
Справа: Визуализация иерархической структуры мультимодальной смолы Monomix Соге серии «ядро-оболочка», специально разработанной для разделения и очистки биологических макромолекул. Это новая полимерная хроматографическая среда с иерархической структурой слоев core-shell(s), узким распределением по размерам и желаемой пористой структурой, которая сочетает в себе разделение по размеру и различные химические методы связывания. Слой оболочки модифицирован гидрофильными группами, что эффективно повышает гидрофильность сепарационной среды, а затем минимизирует неспецифическое связывание биомолекул.
Производительность системы ВЭЖХ в значительной степени зависит от качества насадочной колонки и находящейся в ней «набивки» (т.е. неподвижной фазы = среды = сорбента = насадки = смолы).
***
Насадочная колонка - хроматографическая колонка, которая равномерно заполняется («набивается») твердой фазой (насадкой), через частицы которой проходит анализируемая (разделяемая) смесь. Твёрдой фазой может выступать силикагель, оксид алюминия, целлюлоза и прочие специально приготовленные смолы.
***
Смолы для хроматографического разделения — это материалы с однородным распределением мелких частиц по размеру.
***
По типу смолы разделяются на синтетические смолы, натуральные полимеры и неорганические носители.
***
По применению смолы разделяются (в основном) на ионообменные, аффинные, смолы, исключающие размер, а также на смолы для гидрофобной и смешанной хроматографии. Каждый тип служит определенным целям, удовлетворяя конкретные потребности в таких отраслях, как фармацевтика, биотехнологии, производство продуктов питания и напитков, а также экологические испытания.
***
Следует также отметить, что развитие методов функционализации смол и технологий иммобилизации лигандов способствует разработке специализированных хроматографических решений, предназначенных для выполнения конкретных задач очистки.
|
Искусство упаковки колонок - ключ к превосходным хроматографическим характеристикам
Множество факторов, от типа упаковочного материала до тщательности процесса упаковки, играют ключевую роль в определении успеха хроматографического разделения. Правильное обслуживание в сочетании с пониманием передового опыта может значительно продлить срок службы колонки и обеспечить стабильно высокое качество результатов.
Предварительно упакованные колонки против самостоятельно упакованных колонок
- Предварительно упакованные колонки: Как следует из названия, эти колонки поставляются с уже упакованной стационарной фазой. Они обладают такими преимуществами, как удобство и стабильность, так как производители обеспечивают единую процедуру упаковки. Однако они могут быть дороже самонаполняющихся колонок, особенно если речь идет о специализированных или больших препаративных колонках.
- Самостоятельно упаковываемые колонки: В этом случае пользователь сам упаковывает стационарную фазу в колонку, что позволяет более гибко выбирать тип и количество упаковочного материала. Несмотря на экономическую эффективность, самостоятельная упаковка требует специальных знаний и опыта для обеспечения однородности и отсутствия пустот в колонке. Любое несоответствие в упаковке может серьезно повлиять на производительность колонки.
Важность равномерной упаковки
Равномерная упаковка обеспечивает равномерное прохождение подвижной фазы через колонку, не встречая коротких путей (например, каналов) или областей с ограниченным потоком. Правильная упаковка колонки обеспечивает:
- Стабильное удерживание (прим. ред.: время удерживания вещества tR – время пребывания адсорбата в хроматографе → Каждое вещество при одних и тех же хроматографических условиях имеет свое время удерживания).
- Оптимальную форму пиков.
- Максимальную эффективность колонки.
- Снижение риска возникновения проблем с высоким противодавлением.
Методы упаковки сорбента в колонке
- Сухая упаковка: Используется в основном для больших препаративных колонок. Упаковочный материал насыпается в колонку и затем осаждается, часто с помощью легкого постукивания или вибрации. Затем вводится подвижная фаза для смачивания неподвижной фазы.
- Суспензионная упаковка: Наиболее распространенный метод упаковки колонок для ВЭЖХ. В этом случае неподвижная фаза суспендируется в подходящем растворителе, образуя суспензию. Затем суспензия закачивается в колонку:
В настоящее время существует три различных способа суспензионной упаковки технологических хроматографических колонок: проточная упаковка (flow pack), при которой используется постоянное давление или поток суспензии среды (сорбента); динамическое осевое сжатие (Dynamic Axial Compression (DAC)), достигаемое за счет осевого сжатия суспензии среды; и упаковка на месте (pack-in-place), при которой клапаны колонок встроены в проточные камеры.
- Проточная упаковка или flow-packing (постоянное давление или поток) подразумевает прокачку подвижной фазы через герметичную колонку. При этом взвешенные частицы упаковываются быстрее и равномернее, чем при гравитационном оседании, что снижает тенденцию к тому, что крупные частицы оседают первыми. Более высокая скорость потока при упаковке (обычно на 30 % больше, чем при работе) также снижает вероятность дальнейшего уплотнения слоя после упаковки.
- Упаковка на месте или pack-in-place. Благодаря встроенным в проточные кюветы многофункциональным клапанам для колонн, метод pack-in-place использует, по сути, тот же подход, что и в проточной упаковке, но с дополнительным преимуществом - не нужно извлекать регулировочную кювету из колонны, если при этом выполняется операция заполнения колонны. Этот метод облегчает набивку в больших колоннах и в колоннах с фиксированной высотой слоя… Методы упаковки "на месте" предполагают закачивание суспензии среды в колонну, где регулировочная ячейка предварительно установлена на фиксированную высоту слоя. Давление набивки задается на салазках для перекачки суспензии, и суспензия закачивается через фиксированный клапан до тех пор, пока насос не остановится, что свидетельствует о завершении набивки. Давление упаковки может быть изменено в соответствии с характеристиками упаковываемой среды.
- Динамическое осевое сжатие (DAC) имеет семь преимуществ перед упаковкой flow pack или pack-in-place. Осевое сжатие суспензии ускоряет процесс упаковки, уменьшает сегрегацию по размеру из-за гравитационного оседания и обеспечивает постоянную прижимную силу для всего слоя. Динамический аксиальный поршень исключает образование пустот или каналов в упакованном слое. Это обеспечивает равномерное распределение подвижной фазы по всему слою. Требуется только один этап упаковки по сравнению с несколькими этапами, используемыми в проточной упаковке. Системы управления могут автоматически регулировать любое сжатие слоя после упаковки. Кроме того, процесс можно автоматизировать, что обеспечивает лучший контроль и воспроизводимость. DAC особенно эффективен при работе с мелкими и жесткими частицами и является предпочтительным методом упаковки для пилотных и производственных колонн.
Оптимизация процесса упаковки
- Дегазация суспензии: перед введением суспензии в колонну необходимо удалить весь захваченный воздух. Это предотвращает образование пузырьков в колонне, которые могут нарушить однородность насадочного слоя.
- Упаковка под оптимальным давлением: Правильное давление в процессе упаковки обеспечивает плотное и равномерное оседание частиц. Слишком низкое давление может привести к ослаблению упаковки, а чрезмерное давление - к разрушению частиц или чрезмерному противодавлению в колонне.
- Кондиционирование колонки: После упаковки колонку обычно кондиционируют, пропуская через нее подвижную фазу в течение нескольких объемов колонки. Это помогает уравновесить колонку и обеспечить ее готовность к вводу образца.
Факторы, влияющие на комплектацию колонок
Размер и форма частиц
- Чем меньше размер частиц, тем выше эффективность колонки, но также выше и противодавление. Постоянство формы имеет решающее значение для воспроизводимости и производительности.
Скорость потока суспензии
- Скорость потока в процессе упаковки должна быть оптимальной. Слишком медленный поток может не дать эффективного уплотнения, а слишком быстрый может привести к образованию каналов или неравномерному уплотнению.
Выбор растворителя для суспензии
- Растворитель должен быть совместим с материалом набивки и обеспечивать равномерную суспензию частиц. Растворитель также может влиять на смачивание и оседание частиц в колонке.
Размеры колонны
- Более длинные колонки обычно обеспечивают более высокое разрешение, но могут привести к более высокому противодавлению. Внутренний диаметр колонки влияет на пропускную способность и скорость анализа.
Влияние упаковки на производительность
Эффективность и разрешение
- Хорошо упакованная колонка обеспечивает максимальное взаимодействие между аналитом и неподвижной фазой, что приводит к лучшему разделению (более высокому разрешению) соединений. Эффективность часто коррелирует с тем, насколько равномерно подвижная фаза проходит через набивку.
Проблемы с давлением и противодавлением
- Неравномерная упаковка, агрегация частиц или наличие пустот могут привести к повышению противодавления, которое может превысить пределы возможностей системы ВЭЖХ. Это также может привести к несоответствию скорости потока и повлиять на время удерживания.
Срок службы колонки и воспроизводимость результатов
- Равномерная упаковка не только обеспечивает стабильность результатов, но и продлевает срок службы колонок. Плохо упакованные колонки могут привести к ускоренной деградации неподвижной фазы или увеличению вероятности засорения.
Причины и последствия ченнелинга (каналообразования)
- Каналообразование возникает, когда подвижная фаза находит пути наименьшего сопротивления через колонку, минуя большую часть стационарной фазы. Это может привести к снижению эффективности колонки, появлению пиковых хвостов и снижению чувствительности. Для предотвращения этого явления крайне важны правильная упаковка колонки и ее обслуживание.
Устранение распространенных проблем с упаковкой
Пиковые фронты и хвосты
- Причина: Неравномерная упаковка может привести к разным путям потока, что приводит к искажению пика.
- Решение: Переупакуйте колонку, обеспечив равномерное распределение частиц. Рассмотрите возможность использования колонок с меньшим размером частиц для повышения эффективности.
Высокое противодавление в колонне
- Причина: Может быть вызвано попаданием пузырьков воздуха, агрегацией частиц или засорением остатками образца.
- Решение: Обеспечьте тщательную дегазацию суспензии перед упаковкой. Регулярно очищайте и регенерируйте колонку в соответствии с рекомендациями производителя. Если проблема сохраняется, рассмотрите возможность переупаковки или замены колонки.
Нестабильное время удерживания
- Причины: Неравномерная упаковка, пустоты в колонке или проблемы с подвижной фазой.
- Решение: Проверьте колонку на наличие видимых пустот и при необходимости переупакуйте ее. Убедитесь, что состав подвижной фазы однороден и что колонка достаточно кондиционирована перед использованием.
Снижение эффективности колонки
- Причины: Деградация неподвижной фазы, износ с течением времени или проблемы, связанные с плохой упаковкой.
- Решение: Переупакуйте колонку или рассмотрите возможность ее замены, если срок службы истек. Регулярное обслуживание и правильное хранение также помогут продлить эффективность колонок.
Видимые пустоты или каналы в колонке
- Причина: Часто возникает из-за некачественной упаковки, в результате чего подвижная фаза обходит части неподвижной фазы.
- Решение: Переупакуйте колонку, обращая внимание на давление упаковки и обеспечивая равномерное распределение суспензии. При самостоятельной упаковке колонок следуйте передовому опыту и при повторении проблемы обратитесь к специалисту.
Потеря селективности колонки
- Причина: Длительное воздействие жестких условий, таких как экстремальные уровни pH, или использование несовместимых растворителей может привести к разрушению стационарной фазы, что повлияет на ее селективность.
- Решение: Убедитесь в совместимости колонки с предполагаемыми условиями анализа. Когда колонка не используется, храните ее в условиях, рекомендованных производителем. Если стационарная фаза сильно повреждена, может потребоваться замена колонки.
Интеллектуальная упаковка хроматографических колонок
на примере колонок AxiChrom
Выбор колонок из платформы AxiChrom™
Колонки AxiChrom - это хроматографические колонки низкого давления с осевым сжатием, предназначенные для разработки и производства биофармацевтической продукции. Осевое сжатие обеспечивает более точный и воспроизводимый контроль набивки по сравнению, например, с традиционной проточной набивкой. После консолидации слой сжимается до заранее определенного и проверенного коэффициента упаковки, что обеспечивает превосходные хроматографические характеристики. Колонки AxiChrom обладают тремя ключевыми особенностями - интеллектуальной упаковкой, интуитивно понятным управлением и предсказуемым масштабированием, - которые вместе делают процесс хроматографии проще, безопаснее и эффективнее.
Упаковка в небольших колонках AxiChrom
 |
 |
|
Система ÄKTA™ с колонной AxiChrom™
|
|
Интеллектуальная упаковка (Intelligent Packing) в небольших колонках AxiChrom включает в себя программное обеспечение UNICORN, контролирующее упаковку колонок AxiChrom с помощью системы ÄKTA. Большие колонки также могут быть упакованы - с использованием системы AxiChrom Master. Для используемых запрограммированных сред система Intelligent Packing обеспечивает оптимальную упаковку колонок и снижает зависимость от оператора. Метод упаковки создается путем ввода значений переменных упаковки в мастере UNICORN Intelligent Packing, который затем рассчитывает объемы суспензии. Затем колонна подключается к системе ÄKTA и заполняется суспензией в соответствии с созданным методом UNICORN. Этот метод управляет потоком гидравлической жидкости для привода адаптера и заполнения колонны. Рисунок ниже иллюстрирует эту процедуру:
- Начало - Переходник (адаптер) перемещается вниз, вытесняя жидкость суспензии.
- Консолидация или уплотнение слоев частиц - Суспензия образует уплотненный слой.
- Начало сжатия - Когда переходник соприкасается с поверхностью уплотненного слоя, оператор запускает сжатие слоя в программе UNICORN. Сжатие происходит в соответствии с заданным коэффициентом уплотнения.
- Упаковано - Достигается заданная высота слоя.
Примечание: Когда слой начинает сжиматься (B на нижнем рисунке), в точке X на графике наблюдается увеличение давления.

.9. Адсорбционная хроматография с расширенным слоем (EBA)

На рис. вызуализируется теория адсорбции в расширенном слое (следует учесть примечание редактора). Когда смола упакована в колонку, бусинки расположены близко друг к другу (1). При псевдоожижении колонки бусинки смолы создают градиент концентрации (2). Проба вводится в колонку, и твердые частицы и остатки клеток (коричневые точки) проходят мимо смолы и выходят из колонки, в то время как интересующее соединение (красные точки) взаимодействует с бусинами (3). Затем колонка переупаковывается (слой уплотняется), поток меняется на противоположный, и соединение вымывается из бусин (4) (это элюирование в упакованном режиме, но есть также в расширенном режиме - ред.).
Прим. редактора: Если в классической колоночной хроматографии используется твердая фаза в виде набивного слоя, то в EBA используются частицы в псевдоожиженном состоянии, в идеале расширенные в 2-3 раза. Однако адсорбция в расширенном слое отличается от хроматографии в псевдоожиженном слое по сути по двум причинам: во-первых, смола EBA содержит частицы разного размера и плотности, что приводит к градиенту размера частиц при расширении (см. рис. 2); и во-вторых, когда слой находится в расширенном состоянии, образуются локальные петли (см. осевое перемешивание на рис. 2.). Частицы, такие как целые клетки или клеточный мусор, которые могли бы забить колонку с набивным слоем, легко проходят через псевдоожиженный слой. Поэтому EBA можно использовать для неочищенных культуральных бульонов или суспензий разрушенных клеток, минуя первоначальные этапы очистки, такие как центрифугирование и фильтрация, которые обязательны при использовании набивных слоев.
Введение
Последующая обработка биологических материалов обычно включает различные операции, в том числе центрифугирование, фильтрацию, хроматографию, кристаллизацию и осаждение (рис. 1). В зависимости от продукта, эти операции могут использоваться несколько раз на разных этапах последующей переработки. Значительная часть затрат на производство биологических продуктов, в частности биофармацевтических препаратов, приходится на последующую обработку. Поэтому уменьшение количества операций на последующих этапах переработки может привести к значительному снижению себестоимости продукции. Сокращение количества операций приводит к снижению капитальных и эксплуатационных затрат, сокращению общего времени процесса и увеличению общего выхода продукции. Одним из возможных подходов для достижения этой цели является объединение нескольких операций в один этап.
Хроматография с адсорбцией в расширенном слое (EBA) была разработана в начале 1990-х годов как многофункциональная интегрированная операция (рис. 1). С помощью этой технологии можно объединить в одну операцию разделение твердой и жидкой фаз (осветление), концентрирование и первичную очистку биологического соединения, например, белка. Несмотря на первоначальный успех (Noda et al., 1996), EBA столкнулась со значительными ограничениями в применении из-за двух важнейших проблем: i) загрязнения распределителя жидкости взвешенными веществами в неочищенном биосырье и ферментационных бульонах; и ii) образования поперечных связей между гранулами адсорбента из-за макромолекул и неочищенных материалов.

Рисунок 1: Сравнение традиционной последующей обработки и обработки с использованием EBA.
Принципы
Метод EBA основан на принципах, аналогичных принципам, лежащим в основе традиционных методов адсорбционной хроматографии. А именно, поток, содержащий целевое соединение, а также загрязняющие вещества, подается в колонку, заполненную функционализированными твердыми матрицами или адсорбентами. При соблюдении определенных условий достигается благоприятное взаимодействие между молекулами-мишенями (или, в редких случаях, загрязняющими веществами) и твердым материалом матрицы, что способствует адсорбции и позволяет загрязнителям проникать внутрь, не связываясь. Затем, при изменении условий, адсорбированная молекула-мишень вымывается из слоя. Однако, в отличие от обычных хроматографических систем, которые питаются сверху, в EBA слою дают возможность псевдоожижаться за счет подачи потока из нижней части колонки и обеспечения пространства для расширения слоя (рис. 2). Такое расширение приводит к увеличению объема пустот в слое. При таких условиях твердые вещества, коллоиды и очень крупные молекулы, содержащиеся в неочищенном биологическом сырье, могут проходить через расширенный слой. Теоретически это позволяет использовать неочищенное биологическое сырье без какой-либо необходимости в осветлении (разделении твердого вещества на жидкое) (Chase, 1994 and Hjorth, 1997). Если продукт был связан с матрицей, его можно сконцентрировать с помощью EBA, применив соответствующую стадию элюирования. Применение неочищенного сырья в обычной хроматографической системе с насадочным слоем, как правило, невозможно из-за загрязнения нерастворимыми материалами, что приводит к закупорке, высокому обратному давлению и необходимости остановки загрузки колонки.
Рисунок 2: Система EBA в сравнении с системами с насадочным (набивным) слоем и псевдоожиженным слоем. Внесение жидкости показано тонкими стрелками. Большие стрелки показывают различия в степени осевого перемешивания в колоннах.
Операция
Этапы работы системы EBA изображены на рисунке 3. Поток уравновешивающего буфера, который обычно является загрузочным буфером, вводится в колонку на первом этапе. После расширения до желаемой степени (приблизительно в 2-3 раза) и примерно через 30 минут происходит стабилизация слоя, сырье закачивается с постоянной скоростью потока, например 200-600 см·ч-1 для поддержания расширения гряды в 2-3 раза. Переходник колонки (выход) держат на расстоянии 5-10 см над поверхностью расширенного слоя. Следует учитывать, что биологические растворы обычно имеют другие характеристики (например, более высокую вязкость), чем равновесный буфер, что приводит к различным характеристикам расширения. Таким образом, положение верхнего адаптера должно быть отрегулировано таким образом, чтобы чрезмерное расширение слоя биологического сырья не влияло отрицательно на производительность (Barnfield-Frej et al., 1994), или необходимо отрегулировать скорость потока. Высокая вязкость или плотность биологического сырья приводит к необходимости использования более низких скоростей потока во время загрузки для поддержания определенного расширения (Draeger and Chase, 1991a), что приводит к снижению производительности. После загрузки закачивается промывной раствор, и слабосвязанные или увлеченные материалы вымываются за счет применения скорости потока, аналогичной скорости подачи. На этом этапе адаптер располагается очень близко к поверхности слоя, чтобы минимизировать расход буфера.

Элюирование целевого соединения выполняется после промывки и может быть выполнено с расширенным слоем. Буфер для элюирования может иметь состав, аналогичный буферу для промывки, за исключением того, что обычно рН или ионная сила изменяются путем добавления кислоты, основания или солей. В процессе элюирования вязкость жидкости может увеличиваться из-за выделения высокой концентрации биологических веществ (например, белка). Это приводит к чрезмерному расширению слоя и требует либо уменьшения расхода, либо поднятия верхнего переходника. Обычно предпочтительным является снижение скорости потока, поскольку это, как правило, приводит к уменьшению осевого перемешивания, уменьшению объема слоя и, следовательно, к снижению объема элюирования и, следовательно, к улучшению коэффициентов концентрации (Chang and Chase, 1996). Для колонн, оснащенных перфорированными пластинами и сеткой в качестве нижней системы распределения жидкости, элюирование также может выполняться в режиме уплотненного слоя (рис. 3). После элюирования слой необходимо соответствующим образом очистить. Для различных адсорбентов и исходного сырья производители колонн и адсорбентов рекомендуют различные протоколы очистки.
Рисунок 3: Этапы работы системы EBA. Стрелками показано направление потока (перерисовано и модифицировано из Thömmes, 1997).
Адсорбенты
Все адсорбирующие бусины (гранулы = шарики), коммерчески доступные для EBA, состоят из двух фаз: (i) полимерного геля или композита, который функционализирован и несет лиганды; и (ii) единого твердого ядра или дисперсного твердого материала, погруженного в полимерный гель или композит. Таким образом, получаются плотные бусины, которые позволяют использовать их при высоких скоростях потока, обычно применяемых в колонках EBA. Многие типы адсорбентов EBA были приготовлены на основе этой фундаментальной конструкции.
Однако в целом их можно разделить на четыре основные категории, имеющие особое значение. В первом случае пористые гелевые материалы, такие как агароза, уплотняются путем инкапсуляции твердых частиц, таких как кварц (например, бусины Streamline, от GE Healthcare), а затем соединяются с лигандами для связывания продукта. Во втором типе EBA-бусин единая твердая сердцевина из стекла, нержавеющей стали или карбида вольфрама (например, UpFront Chromatography A/S; Streamline Direct, GE Healthcare) покрыта пористыми гелевыми материалами, такими как агароза, и дериватизирована лигандами. В некоторых случаях этот дизайн модифицируется путем присоединения щупалец из высокомолекулярных полимеров, таких как декстран, к уплотненному гелевому материалу с последующей функционализацией подходящими лигандами. Это повышает доступность лиганда и, следовательно, способность связывать белки (Thömmes, 1999). К названию этих бусин добавляется суффикс "XL" (например, Streamline Q XL). Третий тип адсорбента производится компанией BioSepra (в настоящее время входит в состав PALL) под названием HyperD или HyperZ и состоит из пористой керамической сердцевины из диоксида кремния или диоксида циркония, заполненной и покрытой непористыми полимерными композитами, содержащими лиганды для связывания. Четвертая конструкция шариков EBA состоит из пористой твердой сердцевины, активируемой и функционализируемой только на поверхности, т.е. полимерные наполнители или покрытия не наносятся. В этом последнем типе бусин адсорбция ограничена внешней поверхностью или порами твердого тела, что приводит к низкой емкости (Zhang et al., 2001), поскольку не использовался высокодериватизированный пористый полимер. Такая конструкция не использовалась для коммерческого производства бусин EBA.
Были получены гранулы EBA с различными связывающими свойствами, включая анионообменные (например, четвертичные или третичные аминогруппы), катионообменные (например, сульфокислотные и карбоксиметильные группы), гидрофобные (например, фенильная группа) и аффинные (например, иммобилизованный металл и протеин А), которые имеются в продаже. Поиск метода и оптимизация процесса очень сильно зависят от типа шариков, функциональности и архитектуры поверхности (Zhang et al., 2001 и Theodossiou and Thomas, 2002). Как правило, наибольшая производительность достигается при использовании ионообменных типов, и, учитывая, что они также являются самыми дешевыми в производстве и устойчивы к жесткой очистке, их обычно считают желательными в качестве универсальной рабочей лошадки EBA.
Гидродинамика
Термин "расширенный слой", введенный Чейзом и Дрегером (1992) и используемый для маркетинга компанией Pharmacia (ныне GE HealthCare), а не псевдоожиженный слой, является важной деталью, на которую стоит обратить внимание. В традиционной адсорбционной системе с псевдоожиженным слоем (Somers et al., 1989) хроматографические бусины не имеют существенных различий в размерах или плотности относительно друг друга. Поэтому неизбежна высокая степень осевого перемешивания в псевдоожиженном слое, что приводит к малому числу равновесных стадий в слое и, как следствие, к низкой эффективности очистки (рис. 2). Однако в системах EBA бусины адсорбента обычно имеют разные размеры. Использование бусин с соотношением размеров 2-3 между самыми крупными и самыми мелкими позволяет классифицировать слой в колонне EBA при подаче потока и расширении слоя (Draeger and Chase, 1991b; Thömmes, 1997 и Hjorth et al., 1998). Расположение отдельной бусинки зависит от ее размера и плотности, которые определяют конечную скорость оседания в соответствии с законом Стока (уравнение 1) (Thelen and Ramirez, 1997):
Ut = ((ρb – ρl)·db2g)) / 18η (1)
Где Ut — конечная скорость, ρb и ρl плотности шариков и жидкости, db - диаметр шарика, g — ускорение силы тяжести, а η - вязкость жидкости. Это уравнение справедливо для бесконечно разбавленных растворов, когда шарик находится далеко от стенки сосуда, а также для условий, при которых число Рейнольдса для шарика (Reb) меньше 0,2 (Hjorth et al., 1998). Последнее можно рассчитать по уравнению 2.
Reb = (ρl·Ui·db) / η (2)
Здесь Ui - это интерстициальная скорость, которая рассчитывается путем деления поверхностной скорости (Us) на пустотность слоя (ε). Чтобы определить среднее значение конечной скорости или Reb шариков в колонне EBA, необходимо использовать средние значения ρb и db.
Во время псевдоожижения крупные бусины (шарики, гранулы) имеют наибольшую скорость осаждения (уравнение 1) и перемещаются на дно, локализуясь там. Их точное расположение определяется взаимодействием между локальными пустотами в разных частях слоя, что определяет локальную скорость жидкости в межслойном пространстве. Если слишком много бусин пытаются занять одно и то же локальное пространство, образование пустот уменьшается, скорость текучей среды увеличивается, и бусины с более низкими скоростями осаждения выталкиваются из этой области в место, где их скорость осаждения уравновешивается локальной скоростью текучей среды. Такая классификация (распределение) шариков приводит к меньшему осевому перемешиванию внутри колонны и к режиму течения, близкому к поршневому (рис. 2).
Классификация бусин в расширенном слое была экспериментально продемонстрирована рядом исследователей, например, Тонг и Сан (Tong and Sun, 2002) показали, что бусины разных размеров присутствовали на разной высоте в колонке EBA диаметром 2.6 см, содержащей шарики с матрицей на кварцевой основе Streamline. (распределение по размерам 80-500 мкм). Они провели это исследование, отбирая образцы из колонны на разной высоте во время расширения. Они показали, что средний размер бусин, расположенных в нижней части колонны, был больше, чем в верхних частях. Обнаружена линейная зависимость между средним размером бусинок и их высотой в изучаемой системе (Tong, Sun, 2002). Интересно, что для изученных шариков не было разницы между плотностью шариков, обнаруженных на разных высотах в колонке, что подчеркивает большое влияние диаметра на скорость осаждения (см. уравнение 1).
Определение характеристик псевдоожижения в колоннах EBA обычно начинается с изучения профиля расширения слоя при различных скоростях потока, и следует ожидать линейной зависимости. Гранулы EBA большего размера и/или более высокой плотности требуют более высоких скоростей потока для достижения определенного расширения. Однако обычно наблюдается значительное отклонение от скорости псевдоожижения, предсказанной из уравнения Стокса, поскольку, хотя влияние стенок обычно можно игнорировать (db / dc > 0,01), гранулы не «разжижаются» бесконечно и, таким образом, могут препятствовать осаждению, а также роению. Ричардсон и Заки разработали эмпирическую корреляцию для описания процесса псевдоожижения. эффекты затрудненного осаждения для крупных стеклянных шариков мономерного размера (уравнение 3), и это часто используется при описании расширения слоя EBA (Thömmes, 1997), даже если допущения в корреляции не выполняются. Ричардсон и Заки (Richardson and Zaki) разработали эмпирическую корреляцию для описания эффектов затрудненного осаждения крупных стеклянных моноразмерных шариков (уравнение 3), которая часто используется при описании расширения слоя EBA (Thömmes, 1997), даже если предположения в этой корреляции не выполняются.
Us = Ut·εn (3)
В этом уравнении n - константа уравнения Ричардсона и Заки. Это уравнение справедливо для очень малых диаметров шарика и колонны (dc), а именно для соотношений (db/dc)>0,01, когда эффект стенки пренебрежимо мал. При этом условии Ричардсон и Заки показали, что n постоянно (4,65), когда Rep<0,2 (Thömmes, 1997; Theodossiou et al., 2002). Средняя пустотность для расширенного слоя (ε) может быть рассчитана по профилю расширения слоя при различных скоростях потока с помощью уравнения 4:
ε = 1 – (H0 / H)·(1 – ε0) (4)
Здесь H0 - высота осевшего слоя, H - высота расширенного слоя, а ε0 - пустотность осевшего слоя, которая обычно принимается равной 0,4 (см. Theodossiou et al., 2002). Согласно уравнениям 3 и 4, n и Ut могут быть рассчитаны путем подгонки кривых экспериментальных данных для ε и Us, полученных из профилей расширения слоя при различных скоростях потока, с использованием корреляции между lnUs и lnε (модифицированная форма уравнения 3), в котором наклон и Y-интерцепт являются n и Ut, соответственно. Значение n, полученное при подгонке кривых, можно сравнить с его теоретическим значением 4,65, определенным Ричардсоном и Заки. Кроме того, Ut, полученное в результате подгонки кривых, также можно сравнить с его теоретическим значением, рассчитанным по уравнению 1 (Thömmes, 1997 и Theodossiou et al., 2002). На практике в расширенных слоях встречаются значения n, отличные от 4,65 (см., например, Theodossiou et al., 2002), поскольку идеальные условия, использованные Ричардсоном и Заки, не применяются, а бусины EBA имеют широкое распределение размеров и плотностей, а не являются крупными монодисперсными стеклянными сферами.
Как было указано выше, для достижения высокоэффективного разделения необходимо минимизировать осевое перемешивание в расширенном слое, чтобы обеспечить течение, приближенное к поршневому потоку. Факторы, влияющие на это, включают конструктивные параметры, например, систему распределения потока и диаметр колонны, а также эксплуатационные параметры, такие как скорость потока, высота слоя и вязкость жидкости, которые будут рассмотрены в последующих частях. Для оценки режима течения в колонне обычно проводят исследование распределения времени пребывания (RTD) и анализируют данные с помощью двух моделей - дисперсионной и модели последовательных резервуаров (Levenspiel, 1999). Для этого в колонку вводится импульс инертного трассера в нулевой момент времени. Расширение полосы индикатора внутри колонки оценивается путем мониторинга концентрации индикатора на выходе (рис. 4).
Дисперсия безразмерной кривой распределения трассера по возрасту на выходе (σθ2) пропорциональна степени перемешивания и осевой дисперсии внутри колонны (модель дисперсии). Для небольших степеней дисперсии (Levenspiel, 1999):
σθ2 = 2·(Dax / UiH) (5)
Рисунок 4. Распространение трассера в соответствии с моделью дисперсии (перерисовано из Levenspiel, 1999).
Dax - коэффициент осевой дисперсии, а член Dax/UiH называется дисперсионным числом сосуда. Погрешность данной модели составляет менее 5%, если Dax/UiH < 0,01. Однако при более высоких значениях дисперсии, когда отклонения от пробочного потока больше, σθ2 коррелирует с дисперсионным числом сосуда (Levenspiel, 1999):

Обратная величина дисперсионного числа сосуда (UiH/Dax) называется числом Пекле (Pe). Следовательно, более высокое Pe указывает на меньшее перемешивание и меньшую осевую дисперсию для всей колонны. В последовательной модели резервуаров σθ2 коррелирует с так называемым количеством теоретических пластин (N), представляющим количество стадий равновесия внутри резервуара или колонны, следующим образом:
σθ2 = 1 / N (7)
Ожидается, что лучшие характеристики хроматографии будут достигнуты при достижении более высокого значения N. Высоту, эквивалентную теоретической пластине (HETP), можно рассчитать по формуле:
HETP = H / N (8)
HETP - это параметр, сопоставимый с Dax, поскольку оба они являются "внутренними" параметрами, описывающими качество потока внутри колонны. Однако Pe, N и (Dax/UiH) являются «системными» параметрами и зависят от характеристик всей системы, а именно от размеров колонны, в частности от ее высоты, и количественно указывают на степень перемешивания в пределах всей колонны. Вышеуказанные модели являются идеализированными и не учитывают отвод газов из-за сшивки адсорбента или проблем с установкой системы (например, отсутствие вертикальной колонны), поэтому при оценке RTD и параметров, полученных с помощью этих двух моделей, следует проявлять значительную осторожность. Например, можно предположить, что очень плохо сшитая или плохо расширенная колонка EBA с несколькими большими каналами может дать почти идеальный импульсный отклик RTD на выходе, и, следовательно, очевидно высокие значения N, Pe и т.д. Таким образом, для уточнения данных может потребоваться изучение фактического времени наблюдения трассера на выходе и грубый расчет ожидаемого времени, а также визуальные наблюдения за слоем, например, с использованием красителей.
Эксплуатационные параметры и их влияние на производительность EBA
Дисперсность жидкости, дисперсность адсорбента, кинетика адсорбции, пленочный массоперенос и внутричастичный массоперенос - важные параметры, влияющие на производительность EBA (Thömmes, 1997 и Clemmitt and Chase, 2003). Существует сложная взаимосвязь между этими параметрами и такими эксплуатационными характеристиками, как скорость потока, вязкость жидкости, состав буфера, ионная сила и концентрация целевых молекул, которые будут кратко рассмотрены ниже.
Пленочный массоперенос (массообмен в пленке). Теория пленок широко применяется для описания массопереноса в системах, в которых присутствуют жидкие фазы. Это старейшая теория массообмена (массопереноса) газ-жидкость, разработанная Льюисом и Уитменом в 1924 году. Теория пленки утверждает, что сопротивление массообмену между фазами жидкости в турбулентном потоке присутствует в тонком слое, прилегающем к границе раздела фаз, называемом пленкой.
Внутричастичный массоперенос (массообмен внутри частиц, диффузия в порах) состоит из диффузии белка в адсорбент и связывания белка с поверхностью адсорбента (поверхностная реакция). Для упрощения моделей, используемых для описания массопереноса в колонке, обычно делается несколько допущений. Во-первых, предполагается, что колонки радиально однородны, и поэтому свойства изменяются только с высотой слоя колонки, но не с радиусом колонки. Во-вторых, для пористых адсорбентов внутричастичный массоперенос регулируется диффузией белка, так как адсорбция белка на неподвижной фазе (поверхностная реакция) происходит гораздо быстрее и не вносит существенного вклада в массоперенос. Предполагается, что процесс адсорбции происходит мгновенно, при этом устанавливается равновесие между белком, адсорбированным на стационарной фазе, и белком, присутствующим в жидком растворе.
Hjorth et al. (1995) показали, что увеличение высоты осевшего слоя среды Streamline SP (т.е. количества адсорбентов) с 5 до 30 см в колонке Streamline 50 (диаметр 5 см) приводит к увеличению динамической связывающей способности для лизоцима при EBA с ~15 до ~70 мг. Разница между динамическими связывающими способностями системы после изменения высоты осевшего слоя с 20 до 30 см была значительно меньше (с 65 до 70 мг·мл-1, соответственно), чем при увеличении с 5 см. Такие результаты могут быть обусловлены рядом эффектов, включая плохое распределение жидкости и значительное осевое перемешивание, которое приводит к низкой емкости при малой высоте слоя, но которое становится менее проблематичным при увеличении высоты слоя, а нижние части слоя способствуют распределению жидкости. Однако полученные данные также могут свидетельствовать о том, что внутричастичный и пленочный массоперенос для используемого сырья и адсорбента является плохим, и увеличение времени пребывания в колонне (за счет большей высоты слоя) повышает производительность. Авторы также показали, что увеличение скорости потока со 100 до 200, 300, 400 и 500 см·ч-1 привело к постоянному снижению динамической связывающей способности сред Streamline DEAE и Streamline SP для BSA и лизоцима, соответственно (Hjorth et al., 1995). Такие эффекты, возможно, объясняются увеличением осевого перемешивания, сокращением времени пребывания или увеличением пустот (влияющих на пленочный массоперенос). Сами авторы не интерпретировали эти данные.
Karau et al. (1997) также обнаружили, что влияние скорости потока на динамическую связывающую способность зависело от высоты осевшего слоя. При псевдоожижении слоя Streamline DEAE с низкой высотой осевшего слоя (14 см) при скорости 420 см·ч-1 динамическая связывающая способность BSA снижалась более чем в 7 раз по сравнению с использованием 90 см·ч-1. Однако, в отличие от результатов Hjorth et al. (1995), связывающая способность существенно не снижалась при использовании более высокой высоты осевшего слоя (33 и 51 см) и изменении скорости потока в том же диапазоне. Эти авторы объяснили полученные результаты улучшенной способностью массообмена, а также меньшим осевым перемешиванием при более высоких высотах осевшего слоя по сравнению с более низкими (Karau et al., 1997).
Результаты, схожие с данными Hjorth et al. (1995), были получены Finette et al. (1998), Wright and Glasser (2001) и Clemmitt and Chase (2003). В частности, Finette et al. (1998) изучали влияние скорости потока в колонке EBA размером 1,6 см × 26 см на адсорбцию человеческого сывороточного альбумина (HSA) и лизоцима на биомиметическом адсорбенте триазинового красителя Cibacron Blue F3G-A, который был иммобилизован на Fractosil 1000 (бусины диаметром 63-100 мкм). Результаты показали, что связывающая способность для обоих белков снижалась при увеличении скорости потока с 38,4 см·ч-1 до 76,8, 153 и 229,2 см·ч-1. Высота осевшего слоя в их экспериментах составляла всего 3 см, что мало по сравнению с тем, что используют большинство других авторов (> 5 см и часто ~15 см), и поэтому можно ожидать, что такая система будет очень чувствительна к качеству распределения жидкости и проблемам со струйными течениями в колонке, что приведет к быстрому прорыву и низкой производительности. Кроме того, использование красящего лиганда может привести к большему вкладу кинетики связывания белка с лигандом в исследуемой системе и потенциально более высокой константе диссоциации по сравнению с дальнодействующими и сильными электростатическими взаимодействиями ионообменников, использованных Hjorth et al. (1995) или Karau et al. (1997) ранее.
Клеммит и Чейз (Clemmitt and Chase, 2003) изучали влияние скорости потока в диапазоне 53,5-153 см·ч-1 на адсорбцию Saccharomyces cerevisiae на деривитизированных перфторуглеродных шариках Concanavalin A в колонке EBA диаметром 1 см. Они показали, что динамическая связывающая способность уменьшилась на 50% из-за изменения скорости потока. Они также показали, что увеличение высоты осевшего слоя с 5 до 20 см увеличивает динамическую связывающую способность примерно на 50%. В этой системе клетки связываются только с внешней поверхностью адсорбентов, поэтому ограничения внутричастичной диффузии в порах отсутствуют, что подчеркивает важность других эффектов, таких как пленочный массоперенос и перемешивание. Результаты, полученные Райтом и Глассером (Wright and Glasser, 2001), также подтверждают негативное влияние увеличения скорости потока на динамическую связывающую способность лизоцима с любым из катионообменных адсорбентов HyperD LS или Streamline SP.
Взаимодействие смешивания, массопереноса, кинетики адсорбции/десорбции и переменных системы не ограничивается только фазой загрузки. Хьорт и др. (Hjorth et al., 1995) показали, что проведение элюирования в расширенном режиме приводит к более высоким элюируемым объемам (в ~35%), что приводит к более низким концентрациям конечного продукта по сравнению с элюированием вниз в режиме насадочного слоя. Однако в работе Lihme et al. (1999) подчеркивается, что процессы ЭБА будут упрощены и более надежны, если проводить элюирование в режиме расширенного слоя. Впоследствии Хьорт (Hjorth, 1999) показал, что объем элюирования может быть уменьшен за счет использования более низких скоростей потока, что уменьшает перемешивание в колонне и, таким образом, приводит к большей эффективности элюирования (Hjorth, 1999).
Чанг и Чейз (Chang and Chase, 1996) исследовали влияние вязкости на производительность EBA в колонке Streamline 50, содержащей Streamline SP при постоянной скорости потока (300 см·ч-1). Авторы обнаружили, что увеличение вязкости жидкости путем добавления глицерина (например, 0%, 25% и 32% v/v глицерина в 100 мМ натрий-ацетатном буфере, pH 5,0) привело к значительному увеличению перемешивания жидкости в колонке, а также к значительному снижению связывающей способности (на ~50%) по сравнению с обработкой растворами без добавления глицерина. Однако, когда обработка проводилась растворами с повышенной вязкостью вместе с уменьшением скорости потока для обеспечения неизменной высоты расширенного слоя (т.е. при всех значениях вязкости), увеличение вязкости само по себе не приводило к существенному изменению дисперсности жидкости или динамической связывающей способности. Эти результаты указывают на то, что изменения в дисперсии жидкости и массопереносе были причиной наблюдений, и подчеркивают сложное взаимодействие между этими различными факторами, а также то, что их можно в определенной степени контролировать путем изменения вязкости и скорости потока. Тем не менее, ряд различных исследований показал, что в колонках с EBA, в которых перемешивание незначительно, лимитирующими факторами для адсорбции белка обычно являются внутричастичный и пленочный массоперенос, а не дисперсия твердых частиц и жидкости (Draeger and Chase, 1991; Change and Chase, 1996; Barnfield-Frej et al., 1997; Wright et al. 1999 и Wright and Glasser, 2001). Ниже приводится краткое рассмотрение пленочного и внутричастичного массопереноса.
Гидродинамические условия в колонне EBA влияют на пленочный массоперенос под воздействием различных факторов, таких как скорость потока и вязкость, и их влияние на пленочный массоперенос (Kf) может быть описано уравнением, разработанным Fan et al. (1960):

Reb рассчитывается с помощью уравнения 2. Число Шмидта (Sc) в уравнении 9 может быть рассчитано по уравнению 10 и определяет соотношение между вязкими силами и силами плавучести в псевдоожиженном слое. Dm (см2·с-1) является коэффициентом молекулярной диффузии и может быть получен из уравнения 11 (Young et al. 1980).

В этом уравнении T - абсолютная температура (K), а MA - относительная молекулярная масса адсорбата (например, белка) в г·моль-1, η - вязкость в cP (прим. ред.: динамическую вязкость (сантипуаз, cP) можно получить из кинематической вязкости (сантистокс), умножив ее значение на плотность жидкости (кг/дм3); Пуаз имеет аналог в системе СИ — паскаль-секунда (Па·с))
Недавно He и Niemeyer (2003) разработали другую корреляцию для коэффициента диффузии белка, основанную на молекулярной массе и радиусе гирации (RG) адсорбента:

В этом уравнении Dm - в м2·с-1, RG - в Å, T - в K, η - в Па·с и M - в кг·кмоль-1.
Исходя из уравнений 9, 11 и 12, увеличение вязкости приводит к уменьшению пленочного массопереноса. Исследование влияния скорости потока на пленочный массоперенос является более сложным из-за множественных и противоположных эффектов на пустоты и Rep. В неподвижных слоях можно ожидать, что увеличение скорости потока уменьшит толщину застойного слоя вокруг шариков (бусин) и, таким образом, увеличит скорость пленочного массопереноса, однако в слоях EBA увеличение скорости потока также приводит к увеличению пустот, что приводит к снижению скорости пленочного массопереноса (см. уравнение 9). Это было экспериментально доказано Karau et al. (1997), которые исследовали кривые прорыва для различных популяций EBA-шариков при различных скоростях потока и использовали для анализа наклоны в начале и середине кривых прорыва. Они показали, что пленочный массоперенос бычьего сывороточного альбумина (BSA) при адсорбции на бусинах Streamline DEAE с распределением по размерам 120-160 мкм уменьшился на 58 % при увеличении скорости потока со 180 до 420 см·ч-1. Однако для тех же типов бусин с распределением по размерам 250-300 мкм скорость массопереноса пленки увеличилась примерно на 11 % при таком же изменении скорости потока. В результате при низких скоростях потока (180 см·ч-1) скорость пленочного массопереноса выше для мелких бусин диаметром 120-160 мкм, чем для крупных бусин диаметром 250-300 мкм, но при увеличении скорости потока (до 420 см·ч-1) эта зависимость меняется на противоположную. Для крупных бусин с высокой конечной скоростью оседания увеличение скорости потока оказывает меньшее влияние на пустотность, чем для мелких бусин. Таким образом, можно ожидать, что крупные бусины при увеличении скорости потока будут оказывать меньшее негативное влияние на скорость пленочного массопереноса, чем мелкие бусины (см. уравнение 9).
Karau et al. (1997) также показали, что диффузия в порах сильно зависит от размера гранул (шариков, бусин). Они обнаружили, что для более мелких гранул (120-160 мкм) диффузия в порах происходит в 3-4 раза быстрее, чем для более крупных (250-300 мкм) при различных скоростях потока (180, 300 и 420 см·ч-1) из-за меньшей длины пути диффузии.
Структура гелевого материала (часть адсорбента, содержащего лиганды) оказывает большое влияние на механизм и степень массопереноса внутри частиц и пленки (Wright et al., 1998 и 1999). В пористых гелях (таких как Streamline EBA beads) молекулы белка перемещаются и диффундируют в жидкой фазе, заключенной в порах. Однако в твердых гелях (таких как HyperD и HyperZ) молекулы перемещаются между лигандами во время диффузии в твердый материал. Плотность заряда геля и заряд молекулы оказывают важное влияние на это движение. Wright et al. (1998 и 1999) показали, что внутричастичный массоперенос (диффузия в порах) в пористом геле (гранулах Streamline SP) снижался за счет увеличения вязкости буфера во время адсорбции лизоцима. Однако при увеличении вязкости и использовании гранулы твердого геля HyperD LS массообмен внутри частиц существенно не изменялся.
Скорость массопереноса пленки снижалась для обоих типов гранул при увеличении вязкости (Wright et al., 1998 и 1999). Wright et al. (1998) также показали, что увеличение концентрации белка снижало динамическую связывающую способность гранул Fractosil 1000, иммобилизованных Cibacron Blue F3G-A (63-100 мкм) для обоих HSA. (диапазон концентраций 0,1-1,0 мг·мл-1) и лизоцима (диапазон концентраций 0,1-0,50 мг·мл-1). Очень похожие результаты были получены Thömmes (1999) для адсорбции поликлональных IgG человека с помощью Streamline Q XL в колонке EBA диаметром 0,5 см с высотой осадительного слоя 53 см и скоростью потока ~150 см·ч-1. Он показал, что увеличение концентрации в диапазоне 1,0-4,8 мг·мл-1 IgG снижало динамическую связывающую способность системы EBA на ~28%. Thömmes объяснил это структурой агарозно-декстрановой композитной среды, используемой в гранулах адсорбента Streamline Q XL, и пришел к выводу, что такую среду можно рассматривать как сравнимую с гомогенной гелевой фазой. Основываясь на его объяснении, было показано, что в условиях ограниченной диффузии в твердом состоянии концентрация растворенного вещества (белка) в объеме влияет на динамическую связывающую способность хроматографических систем (Thömmes, 1999).
На гидродинамику в системе EBA существенно влияет тип и конструкция системы распределения жидкости. Эта тема подробно рассмотрена в главе 2 источника. Arpanaei, A. (2007). Improved Expanded Bed Adsorption Chromatography Systems.
Применение
В 1994-1999 годах был опубликован ряд обзорных статей, в которых сообщалось о применении EBA для обработки различных биологических материалов, а также о самой системе EBA и возникающих при этом проблемах, таких как засорение системы распределения жидкости и взаимодействие между адсорбирующими шариками и клетками, остатками клеток и макромолекулами (например, геномной ДНК) (Hubbuch et al., 2005). Тем не менее, с 1999 года появился ряд новых применений в лабораторных и пилотных масштабах, которые демонстрируют потенциал этой операции, поэтому ниже приводится краткий обзор новых применений.
Pyo et al. (2001) использовали EBA для очистки рекомбинантного гистона H1.5. Колонка EBA диаметром 10 см, содержащая 900 мл адсорбента Streamline SP с сильным катионообменником, была успешно использована для выделения продукта непосредственно из лизата клеток Escherichia coli. Было показано, что с помощью EBA очистка, концентрирование и первичная очистка рекомбинантного гистона H1.5 могут быть объединены в одну операцию (Pyo et al., 2001). (прим. ред.: гистон H1.5 (HH1.5) - это соматический подтип семейства линкерных белков гистона H1, которые расположены в ядре и играют роль в стабилизации структуры хроматина высшего порядка, экспрессии генов, репарации ДНК и пролиферации клеток).
В интересном исследовании Ohashi et al. (2002) разработали метод улавливания in situ иммуноглобулина G подкласса 2a (IgG2a) из 2,2-л реактора с мешалкой, содержащего ферментативную культуру клеток мышиной гибридомы, с помощью колонки EBA диаметром 2,5 см, содержащей адсорбирующие бусины Streamline rProtein A. Многократный процесс ферментации проводился в течение 11 дней, и в течение этого времени продукт очищался полунепрерывно с использованием многоциклового подхода с высоким уровнем восстановления (95%) и чистоты продукта (95%). Производительность этого процесса составила 58 IgG мг·цикл-1 (день-1), в то время как для простой партии она составляла всего 17 IgG мг·день-1.
Choe et al. 2002 сообщили о применении EBA для выделения рекомбинантного белка L1 (основного капсидного белка вируса папилломы человека типа 16) из собранных клеток E. coli после экстракции тел включения продукта непосредственно из клеток с использованием мочевины. Они использовали иммобилизованные металлом аффинные адсорбенты Streamline в колонке EBA Ø 1 см и получили коэффициент чистоты 10 и выход 60 % в неоптимизированных условиях.
EBA также использовалась для очистки биологических продуктов из биомассы микроводорослей. Например, Bermejo et al. (2003) очистили пигмент B-фикоэритрин из красной микроводоросли Porphyridium cruentum, применив 4 этапа, включая осмотический шок биомассы, центрифугирование, EBA и обычную хроматографию с колонкой из DEAE-целлюлозы. В данном исследовании использовалась колонка EBA диаметром 5 см с адсорбирующими шариками Streamline DEAE. При оптимальных условиях был получен общий выход 66 %. Извлечение продукта через колонку EBA составило 80 %.
Разработка процесса выделения предшественника инсулина MI3 была описана Brixius et al. (2005). Они успешно использовали EBA в качестве первичной ступени восстановления в этом процессе. При разработке метода использовали самодельную колонку с ЭБА диаметром 2 см и коммерческую колонку Streamline 25 (2,5 см), а для масштабирования процесса - колонку Streamline 200 (20 см). Использовались адсорбенты Streamline SP, Streamline SP XL и Zirconia S. При загрузке сырья, содержащего 15 % биомассы, не наблюдалось взаимодействия между клетками Saccharomyces cerevisiae и адсорбирующими бусинами. Выход на этапе улавливания с помощью EBA составил 88 %, а масштабируемость была доказана путем увеличения объема процесса с 26 л до 1600 л сырья.
Chang et al. (2006) использовали иммобилизованную металлическую аффинную хроматографию для захвата фактора свертывания IX из неосветленной человеческой плазмы с помощью иммобилизованной металлической аффинной хроматографии с расширенным слоем. Были опробованы различные ионы металлов, включая Cu(II), Ni(II), Zn(II) и Co(II), и Cu(II) оказался наиболее подходящим хелатным лигандом для захвата вышеупомянутого белка в колонке EBA Ø 2,5 см, содержащей 50 мл адсорбирующих бусин. При одноступенчатой очистке с использованием EBA был получен очень высокий коэффициент очистки 83, однако выход был очень низким (16 %).
Charoenrat et al. (2006) провели сравнение эффективности двух адсорбентов EBA: Streamline SP (катионообменник с сульфонильными группами) и Streamline Direct HST 1 (мультимодальный адсорбент со смешанным режимом), представленных компанией Amersham Biosciences (GE HealthCare). Они использовали колонку EBA диаметром 2,5 см, содержащую почти 100 мл адсорбента, для восстановления рекомбинантной β-глюкозидазы из бульона культуры Pichia pastoris с высокой плотностью клеток. Они показали, что такое восстановление может быть проведено с помощью Streamline Direct HST 1 гораздо эффективнее, чем с помощью Streamline SP. Мультимодальный адсорбент Streamline Direct HST 1 успешно извлек фермент из сырья, содержащего 24,8 % биомассы и имеющего проводимость 15 мС·см-1. Единственным недостатком адсорбентов с мультимодальными лигандами может быть неспецифическая адсорбция и удлинение элюирования из-за сложности взаимодействия этих лигандов (Li et al., 2005).
Общие замечания
Недавно в ходе успешных исследований по первичному извлечению биопродуктов был продемонстрирован очень широкий спектр применения EBA. Кроме того, имеется значительный объем информации о рабочих параметрах и их влиянии на эффективность EBA, однако, по-видимому, существует немного по-настоящему масштабных применений. Решение проблем в EBA, особенно связанных с системой распределения жидкости (глава 2 источника) или нежелательным взаимодействием между адсорбентами и клетками, клеточным мусором и макромолекулами (главы 3 и 4 источника), а также растущий прогресс в разработке новых аффинных лигандов и интеллектуальных полимеров (Nicolov and Woodard, 2004) дают надежду на то, что EBA может развиться в действительно широко распространенную, надежную и эффективную технологию последующей переработки биопродуктов.
См. также: Поверхностная энергетика для оценки влияния типа биомассы и взаимодействия биомассы с адсорбентом в расширенных слоях (PDF)
Доп. информация:
-
Хроматографические методы очистки белков (уч.-мет. пособие, 2013)
- Высокоэффективная жидкостная хроматография: уч. пособие для вузов, 2010
-
Ионный обмен и ионная хроматография (мет. к курсу лекций)
-
Сорбционные методы выделения продуктов биосинтеза (уч. пособие, 2018)
-
Аффинная хроматография. Принципы и методы (Amersham Biosciences)
-
Ионообменная хроматография. Принципы и методы (Amersham Biosciences)
-
Препаративная хроматография (Третье издание) ФРГ, изд. Wiley-VCH, 2020
- Характеристика хроматографической смолы для анализа срока службы и производительности при производстве биофарм. продукции (Chika Nweke , University College London, 2017)
Ссылки нумерованные
- Zechmeister, L. Early history of chromatography, Nature, (1951).
- Dorsey, J. G, Foley, J. P, & Cooper, W. T. Liquid chromatography: theory and methodology, Anal Chem, (1990). R-356R.
- Hough, L, Jones, J. K, & Wadman, W. H. Application of paper partition chromatography to the separation of the sugars and their methylated derivatives on a column of powdered cellulose, Nature, (1948).
- Thijssen, H. A. Gas-liquid chromatography. A contribution to the theory of separation in open hole tubes, J Chromatogr, (1963).
- Dorsey, J. G, Cooper, W. T, & Wheeler, J. F. Liquid chromatography: theory and methodology, Anal Chem, (1994). R-546R.
- Cashman, P. J, & Thornton, J. I. High speed liquid adsorption chromatography in criminalistics. I. Theory and practice, J Forensic Sci Soc, (1971).
- Woods, M. C, & Simpson, M. E. Purification of sheep pituitary follicle-stimulating hormone (FSH) by ion exchange chromatography on diethylaminoethyl (DEAE)-cellulose, Endocrinology, (1960).
- Melander, W. R, Corradini, D, & Horvath, C. Salt-mediated retention of proteins in hydrophobic-interaction chromatography. Application of solvophobic theory, J Chromatogr, (1984).
- Biswas, K. M, Devido, D. R, & Dorsey, J. G. Evaluation of methods for measuring amino acid hydrophobicities and interactions, J Chromatogr A, (2003).
- Zhang, Y, & Cremer, P. S. Interactions between macromolecules and ions: The Hofmeister series, Curr Opin Chem Biol, (2006).
- Porath, J, Sundberg, L, & Fornstedt, N. Salting-out in amphiphilic gels as a new approach to hydrophobic adsorption, Nature, (1973).
- Parente, E. S, & Wetlaufer, D. B. Relationship between isocratic and gradient retention times in the high-performance ion-exchange chromatography of proteins. Theory and experiment, J Chromatogr, (1986).
- Molnar, I, & Horvath, C. Reverse-phase chromatography of polar biological substances: separation of catechol compounds by high-performance liquid chromatography, Clin Chem, (1976).
- Sottrup-jensen, L. A low-pH reverse-phase high-performance liquid chromatography system for analysis of the phenylthiohydantoins of S-carboxymethylcysteine and S- carboxyamidomethylcysteine, Anal Biochem, (1995).
- White, E. R, & Zarembo, J. E. Reverse phase high speed liquid chromatography of antibiotics. III. Use of ultra high performance columns and ion-pairing techniques, J Antibiot (Tokyo), (1981).
- Kostanski, L. K, Keller, D. M, & Hamielec, A. E. Size-exclusion chromatography - a review of calibration methodologies, J Biochem Biophys Methods, (2004).
- Paul-dauphin, S, Karaca, F, & Morgan, T. J. Probing Size Exclusion Mechanisms of Complex Hydrocarbon Mixtures: The Effect of Altering Eluent Compositions, Energy Fuels, (2007).
- Chaiken, I. M. Analytical affinity chromatography in studies of molecular recognition in biology: a review, J Chromatogr, (1986).
- Caldes, T, Fatania, H. R, & Dalziel, K. Purification of malic enzyme from bovine heart mitochondria by affinity chromatography, Anal Biochem, (1979).
- Santen, R. J, Collette, J, & Franchimont, P. Partial purification of carcinoembryonic-reactive antigen from breast neoplasms using lectin and antibody affinity chromatography, Cancer Res, (1980).
- Bluestein, B. I, & Vaitukaitis, J. L. Affinity chromatography purification of solubilized FSH testicular membrane receptor, Biol Reprod, (1981).
- Yamada, S, Itaya, H, & Nakazawa, O. Purification of rat intestinal receptor for intrinsic factor-vitamin B-12 complex by affinity chromatography, Biochim Biophys Acta, (1977).
- Healthcare, G. Affinity Chromatography Principles and Methods, (2007).
- Scheich, C, Sievert, V, & Bussow, K. An automated method for high-throughput protein purification applied to a comparison of His-tag and GST-tag affinity chromatography, BMC Biotechnol, (2003).
- Li, Y, Franklin, S, & Zhang, M. J. Highly efficient purification of protein complexes from mammalian cells using a novel streptavidin-binding peptide and hexahistidine tandem tag system: application to Bruton’s tyrosine kinase, Protein Sci, (2011).
Ссылки по имени автора (по алфавиту)
- Barnfield Frej, A.K.; Johansson, H.J.; Johansson, S. and Leijon, P.; 1997; Expanded bed adsorption at production scale: Scale-up verification, process example and sanitization of column and adsorbent; Bioprocess Engineering, 16, 57-64.
- Barnfield-Frej, A.N.; Hjorth, R. and Hammarström, Å.; 1994; Pilot scale recovery of recombinant Annexin V from unclarified Escherichia coli homogenate using expanded bed adsorption; Biotechnology and Bioengineering, 1994, 44, 922-929.
- Bermejo, R.; Acien, F.G.; Ibanez, M.J.; Fernandez, J.M.; Molina, E. and Alvarez-Pez, J.M.; 2003; Preparative purification of B-phycoerythrin from the microalgae Porphyridium cruentum by expanded bed adsorption chromatography; Journal of Chromatography B, 790, 317-325.
- Brixius, P.; Mollerup, I.; Jensen, O.E.; Halfar, M.; Thömmes, J. and Kula, M.R.; 2005; Expanded bed adsorption as a primary recovery step for the isolation of the insulin precursor MI3 process development and scale up; Biotechnology and Bioengineering, 91(3), 14-20.
- Bruce, L.J. and Chase, H.A.; 2001; Hydrodynamics and adsorption behaviour within an expanded bed adsorption column studied using in-bed sampling; Chemical Engineering Science, 56, 3149-3162.
- Chang, Y.K. and Chase, H.A.; 1996; Development of operating conditions for protein purification using expanded bed techniques: the effect of the degree of bed expansion on adsorption performance; Biotechnology and Bioengineering, 1996, 49, 512-526.
- Chang, Y.K.; Horng, J.T.; Haung, R.Z. and Lin, S.Y.; 2006; Direct capture of factor IX from unclarified human plasma by IMEBAC; Biochemical Engineering Journal, 29, 12-22.
- Charoenrat, T.; Ketudat-Carins, Mariena; Jahic, M.; Enforce, S.O. and Veide, A; 2006; Recovery of recombinant β-glucosidase by expanded bed adsorption from Pichia pastoris high-cell-density culture broth; Journal of Biotechnology, 122, 86-98.
- Chase, H.A. and Draeger, N.M.; 1992; Expanded bed adsorption of proteins using ion- exchangers; Separation Science and Technology, 27(14), 2021-2039.
- Chase, H.A.; 1994; Purification of proteins by adsorption chromatography in expanded beds; Trends in Biotechnology, 12, 296-303.
- Choe, W.S.; Clemmitt, R.H.; Chase, H.A. and Middelberg, A.P.J.; 2002; Coupling of chemical extraction and expanded bed adsorption for simplified inclusion body processing: Optimization using surface plasmon resonance; Biotechnology and Bioengineering, 81(2), 221-232.
- Clemmitt, R.H. and Chase, H.A.; 2003; Impact of operating variables on the expanded bed adsorption of Saccharomyces cerevisiae cells using a concanavalin A derivatized perfluorocarbon; Biotechnology and Bioengineering, 82(5), 506-516.
- Draeger, N.M. and Chase, H.A.; 1991a; Liquid fluidized beds for protein purification; Transactions of IChemE, 69, 45-58.
- Draeger, N.M. and Chase, H.A.; 1991b; Liquid fluidized bed adsorption of protein in the presence of cells; Bioseparation, 2, 67-80.
- Fan, L.T.; Yang, Y.C. and Wen, C.Y.; 1960; Mass transfer in semifluidized beds for solid-liquid system; AIChE journal, 6(3), 482-487.
- Finette, G.M.S.; Mao, Q.M. and Hearn, M.T.W.; 1998; Examination of protein adsorption in fluidized bed and packed bed columns at different temperatures using frontal chromatographic methods; Biotechnology and Bioengineering, 58(1), 35-46.
- He, L. and Niemeyer, B.; 2003; A novel correlation for protein diffusion coefficients based on molecular weight and radius of gyration; Biotechnology progress, 19, 544- 548.
- Hjorth, R.; 1999; Expanded bed adsorption: elution in expanded bed mode; Bioseparation, 8, 1-9.
- Hjorth, R.; Kampe, S. and Carlsson, M.; 1995; Analysis of some operating parameters of novel adsorbents for recovery of proteins in expanded beds; Bioseparation, 5, 217- 223.
- Hjorth, R.; Leijon, P; Barnfield Frej, A.K. and Jagersten, C.; 1998; Expanded Bed Adsorption Chromatography; In: Subramanian, G. (ed.), Bioseparation and Bioprocessing, Vol. 8, Wiley-VCH Verlag GmbH, Weinheim, Germany, Pages: 199-226.
- Hjorth, R; 1997; Expanded bed adsorption in industrial bioprocessing: recent developments; TIBTECH, 15, 230-235.
- Hubbuch, J.; Thömmes, J. and Kula, M.R.; 2005; Biochemical engineering aspects of expanded bed adsorption; Advances in Biochemical Engineering/Biotechnology, 92, 101-123.
- Kaczmarski, K. and Bellot, J.C.; 2004; Theoretical investigation of axial and local particle size distribution on expanded bed adsorption process; Biotechnology Progress, 20, 786-792.
- Kaczmarski, K. and Bellot, J.C.; 2005; Influence of particle diameter distribution on protein recovery in the expanded bed adsorption process; Journal of Chromatography A, 1069, 91-97.
- Karau, A.; Benken, J; Thömmes, J. and Kula, M.R.; 1997; The influence of particle size distribution and operating conditions on the adsorption performance in fluidized beds; Biotechnology and Bioengineering, 55(1), 54-64.
- Levenspiel, O.; 1999; Chemical reaction engineering; 3rd ed. New York, John Wiley and Sons, Inc.
- Li, P.; Xiu, G. and Rodrigues, A.E.; 2005; Experimental and modeling study of protein adsorption in expanded bed; AIChE Journal, 51(11), 2965-2977.
- Lihme, A.; Zafirakos, E.; Hansen, M. and Olander, M.; 1999; Simplified and more robust EBA processes by elution in expanded bed mode; Bioseparation, 8, 93-97.
- Nicolov, Z.L. and Woodard, S.L.; 2004; Downstream processing of recombinant proteins from transgenic feedstock; Current Opinion in Biotechnology, 15, 479-486.
- Noda, M.; Sumi, A.; Ohmura, T. and Yokoyama, K.; 1996; Process for purifying recombinant human serum albumin; European patent, EP0699687.
- Ohashi, R.; Otero, J.M.; Chwistek, A.; Yamato, I.; Hamel, J.F.; 2002; On-line purification of monoclonal antibodies using an integrated stirred-tank reactor/expanded-bed adsorption system; Biotechnology Progress, 18(6), 1292-300.
- Pyo, S.H.; Lee, J.H.; Park, H.B.; Hong, S.S. and Kim, J.H.; 2001; A large scale purification of recombinant Histone H1.5 from Escherichia coli; Protein Expression and Purification, 23, 38-44.
- Somers, W.; Van’T Reit, K.; Rozie, H.; Rombouts, F.M. and Visser, J.; 1989; Isolation and purification of endo-polygalacturonase by affinity chromatography in fluidized bed reactor; The Chemical Engineering Journal, 7-19.
- Thelen, T.V. and Ramirez, W.F.; 1997; Bed-height dynamics of expanded beds; Chemical Engineering Science, 52, 3333-3344.
- Theodossiou, I. and Thomas, O.R.T.; 2002; DNA-induced inter-particle cross-linking during expanded bed adsorption chromatography: impact on future support design; Journal of Chromatography A, 971, 73-86.
- Thömmes, J.; 1997; Fluidized bed adsorption as a primary recovery step in protein purification; Advances in Biochemical Engineering /Biotechnology, 58, 185-230.
- Thömmes, J.; 1999; Investigations on protein adsorption to agarose-dextran composite media; Biotechnology and Bioengineering, 62(3), 358-362.
- Tong, X.D. and Sun, Y.; 2002; Particle size and density distributions of two dense matrices in an expanded bed system; Journal of Chromatography A, 977(2), 173-182.
- Wright, P.R. and Glasser, B.J.; 2001; Modeling mass transfer and hydrodynamics in fluidized bed adsorption of proteins; AIChE Journal, 47(2), 474-488.
- Wright, P.R.; Muzzio, F.J. and Glasser, B.J.; 1998; Batch uptake of lyzosyme: effect of solution viscosity and mass transfer on adsorption; Biotechnology progress, 14, 913- 921.
- Wright, P.R.; Muzzio, F.J. and Glasser, B.J.; 1999; Effect of resin characteristics on fluidized bed adsorption of proteins; Biotechnology progress, 15, 932-940.
- Young, M.E.; Carroad, P.A. and Bell, R.L.; 1980; Estimation of diffusion coefficients of proteins; Biotechnology and Bioengineering, 22, 947-955.
- Yun, J.; Yao, S.J.; Lin, D.Q.; Lu, M.H. and Zhao, W.T.; 2004; Modeling axial distributions of adsorbent particle size and local voidage in expanded bed; Chemical Engineering Science, 59, 449-457.
- Zhang, Z.; Burton, S.; Williams, S.; Thwaites, E. and Lyddiatt, A.; 2001; Design and assembly of solid-phases for the effective recovery of nanoparticulate bioproducts in fluidized bed contactors; Bioseparation, 10, 113-132.