ООО "ПРОПИОНИКС"
| пн-пт с 09:00 до 18:00 | |
Выделение и очистка целевых продуктов в процессе культивирования
МЕТОДЫ ВЫДЕЛЕНИЯ И ОЧИСТКИ ПРОДУКТОВ БИОТЕХНОЛОГИЧЕСКИХ ПРОИЗВОДСТВ

|
ОГЛАВЛЕНИЕ
|
СОКРАЩЕНИЯ И ОБОЗНАЧЕНИЯ
|
|
|
|
На странице рассмотрены основные методы выделения и очистки продуктов биотехнологичеких производств. Основное внимание уделено особенностям выделения, очистки и сушки лекарственных продуктов белковой природы. Использован материал из УМП: Методы выделения и очистки продуктов биотехнологических производств: учебно-методическое пособие / В.К. Османов. - Н. Новгород: Изд-во НижГМА, 2014.
ВВЕДЕНИЕ
Биотехнология - стремительно развивающаяся и интегрирующая дисциплина, пронизывающая все биологические науки и направления исследований. Современная биотехнология - это междисциплинарная наука и отрасль производства, которая базируется на использовании биологических объектов и систем при получении пищевых продуктов, энергии, медицинских препаратов; при очистке сточных вод, переработке отходов и др. Междисциплинарная природа биотехнологии выражается в ее связи с такими науками, как генетика, микробиология, биохимическая и химическая технология и механика систем и аппаратов катализа. На развитие биотехнологии существенное влияние оказывают открытия в самых разных областях человеческой деятельности — биологии, физики, химии, материаловедение.
Использование современных продуктов биотехнологии требует выделения, очистки и контроля их качества. Во многих промышленно значимых процессах, львиную долю стоимости производства зачастую составляет не затраты на культивирование продуцентов, а последующие процессы выделения и очистки продукта (постферментация). Стоимость очистки тем выше, чем ниже концентрация вещества в клетках. Это особенно важно в случае фармацевтических препаратов, требующих высокой степени чистоты. Получение продуктов биотехнологии в настоящее время невозможно без использования знаний о их структуре и физико-химических свойствах, позволяющих определить оптимальный метод их выделения и очистки. Целью настоящего учебного пособия является ознакомление студентов с основными методами отделения биомассы клеток от культуральной жидкости, особенностями выделения и очистки и сушкицелевых продуктов, методами переработки биомассы и культуральной среды.
1. МЕТОДЫ ВЫДЕЛЕНИЯ И ОЧИСТКИ ЦЕЛЕВЫХ ПРОДУКТОВ В ПРОЦЕССЕ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ
Завершающей стадией любого микробиологического производства является выделение целевого продукта из культуральной среды и его очистка. Таким целевым продуктом может быть либо биомасса клеток, либо какой-то продукт клеточного метаболизма. Если целевой продукт-метаболит находится внутри клетки (накапливается или входит в состав клеточных структур и оболочки), то он является эндометаболитом, если выделяется клеткой в культуральную жидкость - экзометаболитом.
В большинстве случаев извлечения эндометаболитов необходимо предварительное разрушение клеток. Однако этот процесс удобнее проводить не непосредственно в культуральной среде, извлекаемой из реактора-ферментера, а с концентратом клеток после удаления культуральной жидкости. Поэтому первым этапом выделения большинства продуктов микробиологического синтеза является отделение биомассы микроорганизмов продуцентов от культуральной жидкости. При этом в зависимости от типа используемых микроорганизмов могут применяться самые различные методы.
Для отделения самых мелких по размеру бактериальных клеток использование обычных фильтров, работающих под действием силы тяжести фильтруемой жидкости, невозможно. Для этого используются специальные устройства - вакуум-фильтры и нутч-фильтры, в которых процесс фильтрования ускоряется за счет принудительного увеличения разности давлений над и под фильтрующей перегородкой. В нутч-фильтре (рис.1) избыточное давление создается над слоем фильтруемой жидкости. У вакуум-фильтров (рис.2 - барабанный, рис.3 - ленточный) перепад давлений возникает за счет создания пониженного давления под фильтрующей поверхностью. Фильтрование бактериальных суспензий - процесс очень медленный и сопряжен с большими трудностями, которые обусловлены малым размером клеток и, как следствие, еще меньшим размером пор фильтра, высокой вязкостью суспензий и наличием большого количества примесей микрочастиц различной природы. Поэтому стадии фильтрования обычно предшествует предварительная обработка суспензий с целью максимально возможной коагуляции клеток и примесей в более крупные и легко фильтруемые частицы. Применяются несколько видов коагуляции: тепловая, органическими и неорганическими кислотами, неорганическими солевыми электролитами (Na2SiO3, Na2HPO4), которые взаимодействуют с ионами Са2+, находящимися в культуральной жидкости, с образованием труднорастворимых соединений. Образующиеся частицы осадка захватывают клетки микроорганизмов и примеси.
Ca2+ + Na2SiO3 = CaSiO3 + 2Na+
Ca2+ + Na2HPO4 = CaHPO4 + 2Na+
Процесс коагуляции улучшается при использовании комбинированных методов, таких, как кислотная и тепловая, электролитная и тепловая коагуляция. Эффективным методом коагуляции суспензий является обработка их высокомолекулярными полиэлектролитами - флокулянтами. При этом в отличие от обычной коагуляции образуются флоккулы, или осадки рыхлой структуры, что значительно улучшает процесс фильтрации.
Образующиеся в результате коагуляции и флокуляции крупные частицы перед фильтрованием могут быть подвергнуты процессу седиментации (осаждению под действием силы тяжести) с последующей декантацией - сливом надосадочной жидкости, которая далее может быть дополнительно очищена фильтрованием.
Осадки большинства микробных клеток относятся к разряду сжимаемых, то есть уплотняющихся, поэтому со временем скорость фильтрации будет заметно уменьшаться. Для облегчения фильтрации микробных суспензий и уменьшения перепадов в скоростях фильтрации используют барабанный или ленточный фильтр с намывным слоем - аппарат полунепрерывного действия. Перед работой на фильтрующую поверхность наносят специальный дренажный слой, представляющий собой порошок диатомита, фильтрперлита (размолотые вулканические породы, содержащие SiO2 и Al2O3) или древесной муки. В процессе фильтрования клетки оседают на этот слой. Особенность работы такого фильтра (в отличие от обычного вакуум-барабанного или ленточного) состоит в том, что нож, предназначенный для съема осадка с барабана, имеет специальную регулируемую микрометрическую подачу. С каждым оборотом барабана нож подается к центру, срезая нафильтрованный осадок вместе с тонким слоем дренажа, обновляя, таким образом, фильтрующую поверхность поэтому скорость фильтрации не снижается.
Для предварительного концентрирования (сгущения) более крупных и тяжелых клеток дрожжей и микрогрибов широко используют флотацию. Основной движущей силой флотации являются всплывающие пузырьки газа, которые захватывают клетки и выносят их на поверхность. В результате над слоем отработанной культуральной жидкости образуется пенный слой, в котором сконцентрированы клетки. Процесс проводят в специальных аппаратах - флотаторах, в которых нагнетают воздух и, в зависимости от их конструкции, диспергируют его через барботер или эжектор, пену гасят и выводят сконцентрированную в 4-6 раз суспензию клеток (получение пекарских дрожжей).
Рис. 1. Нутч, работающий под давлением до 3 атмосфер: 1 - корпус; 2 – рубашка; 3 – съемная крышка; 4 – перемещающееся дно; 5 – фильтрованная перегородка; 6 – опорная перегородка; 7 – защитная сетка; 8 – кольцевая перегородка; 9 – штуцер для подачи суспензии; 10 – штуцер для подачи сжатого воздуха; 11 – штуцер для удаления фильтрата; 12 – предохранительный клапан.
Рис. 2. Схема действия барабанного вакуум-фильтра с наружной поверхностью фильтрования: 1 – барабан; 2 – соединительная трубка; 3 – распределительное устройство; 4 – резервуар для суспензии; 5 – качающаяся мешалка; 6, 8 – полости распределительного устройства, сообщающиеся с источником вакуума; 7 – разбрызгивающее устройство; 9 – бесконечная лента; 10 – направляющий ролик; 11, 13 – полости распределительного устройства, сообщающиеся с источником сжатого воздуха; 12 – нож для съема осадка.
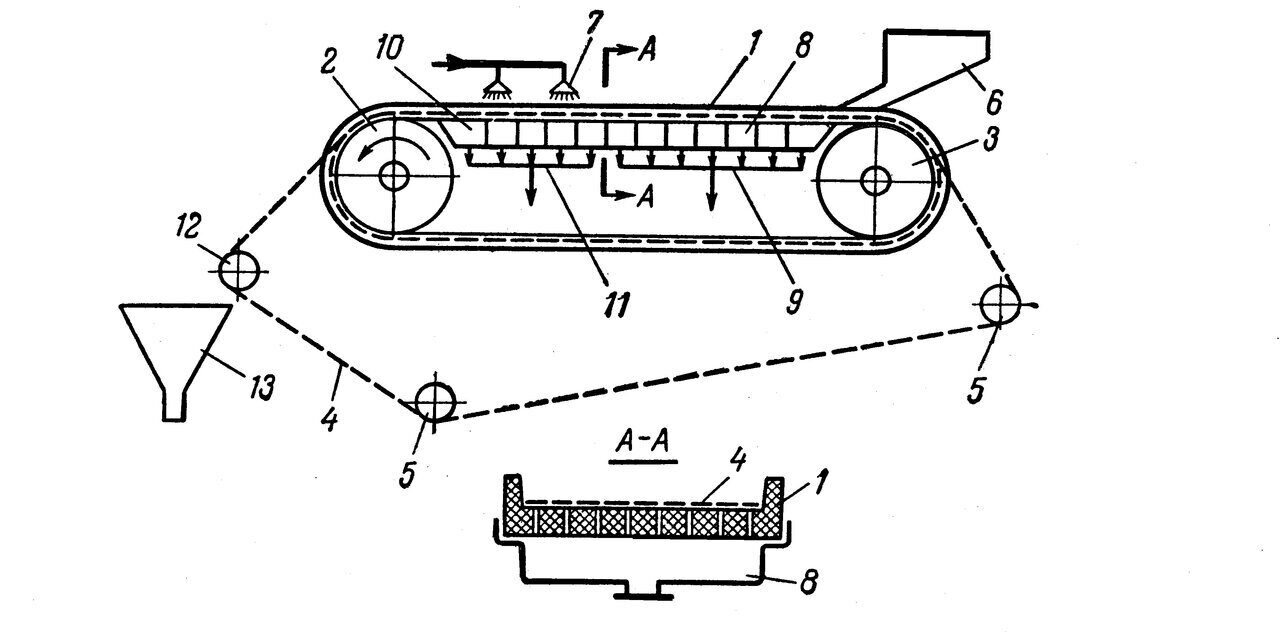
Рис. 3. Ленточный вакуум-фильтр: 1 – опорная резиновая лента; 2 – приводной барабан; 3 – натяжной барабан; 4 – фильтрованная ткань; 5 – натяжные ролики; 6 – лоток для подачи суспензии; 7 – форсунки для подачи промывной жидкости; 8 – вакуум-камеры для фильтрата; 9 – коллектор для фильтрата; 10 – вакуум-камеры для промывной жидкости; 11 – коллектор для промывной жидкости; 12 – направляющий ролик; 13 – бункер для осадка.
Для последующего концентрирования и отделения биомассы грибов и дрожжей используют сепарирование (одноступенчатое или многоступенчатое) для разделения суспензий и эмульсий, а так же центрифугирование для отделения твердых осадков и клеток от культуральной жидкости (рис. 4, 5). Так для сгущения суспензии дрожжей от 20-30 г/л до 550-600г/л с помощью сепаратора-сгустителя непрерывного действия тарельчатого типа СОС-501 К-3, необходимо последовательное сепарирование в 2-3 ступени. С помощью центрифуг различных конструкций удается отделять из культуральных жидкостей бактерии, дрожжи, грибы. Наличие в культуральной жидкости высоковязких компонентов, таких как различные экзополисахариды типа декстрана, аубазидана, пуллулана и др. существенно затрудняет процесс центрифугирования.
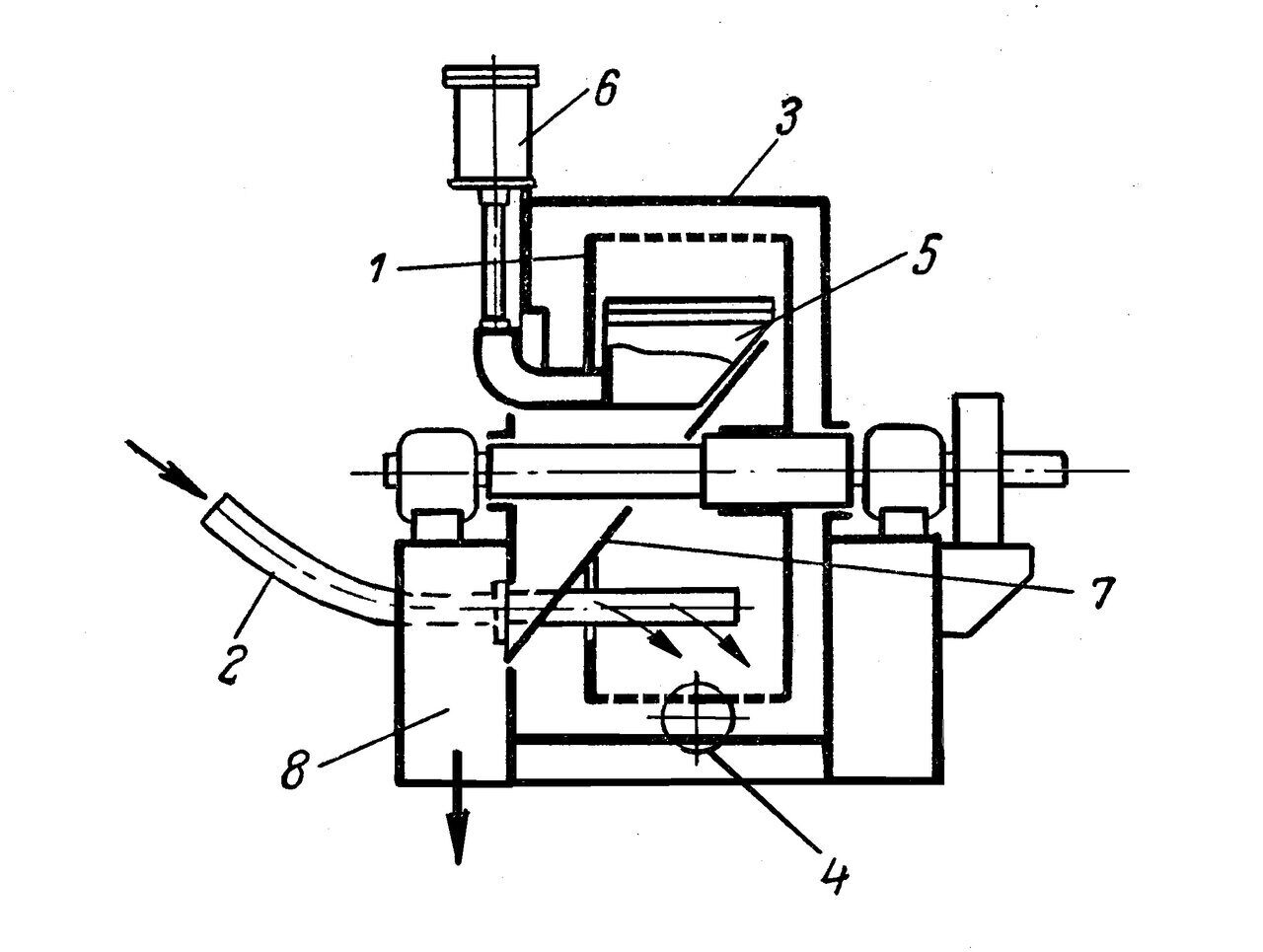
Рис. 4. Горизонтальная центрифуга с ножевым устройством для удаления осадка: 1 – перфорированный ротор; 2 - труба для подачи суспензии; 3 – кожух; 4 - штуцер для удаления фугата; 5 – нож; 6 – гидравлический цилиндр для подъема ножа; 7 – наклонный желоб; 8 – канал для удаления осадка.
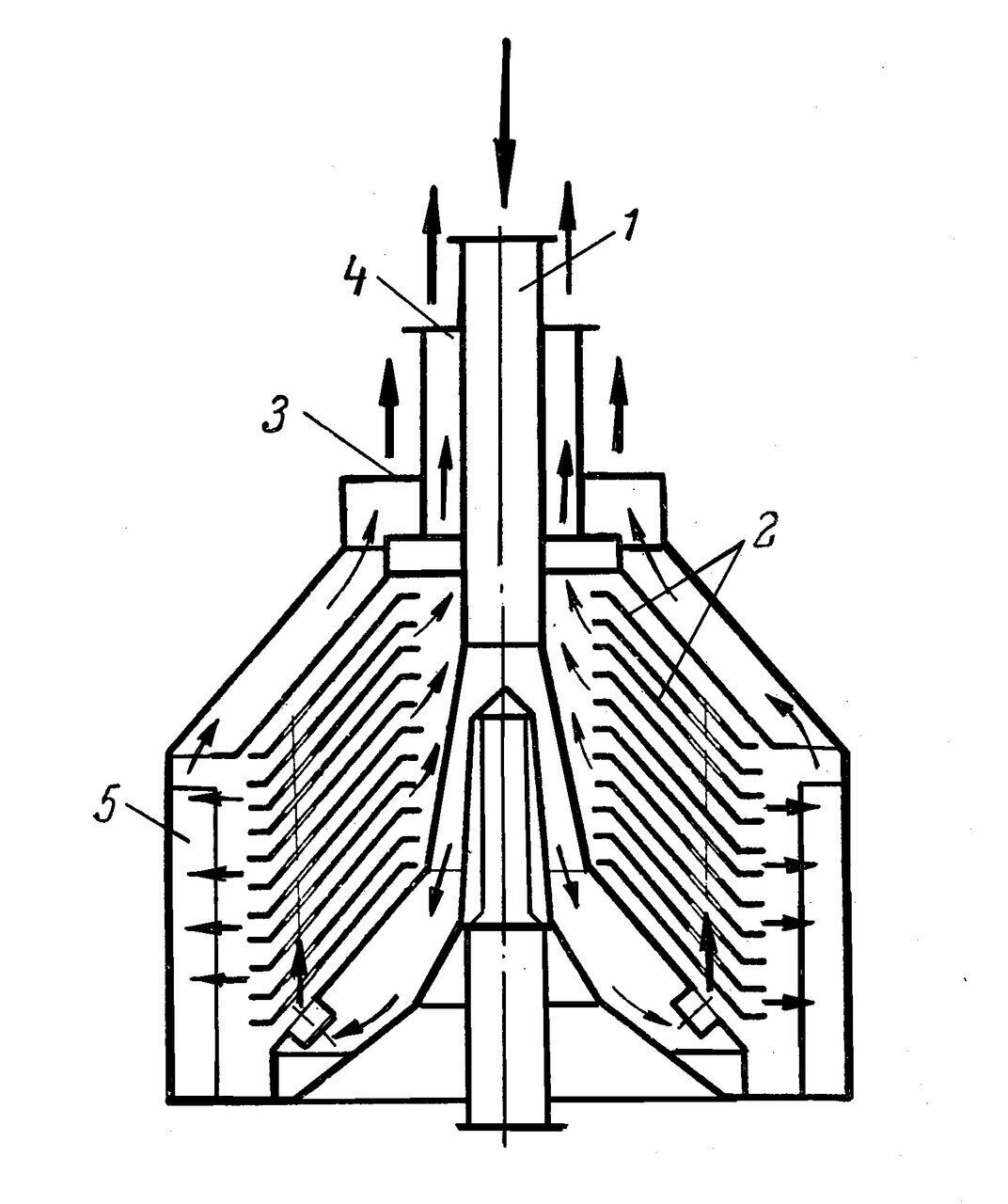
Рис. 5. Жидкостный сепаратор тарельчатого типа: 1 – труба для подачи эмульсии; 2 – тарелки; 3 – отверстие для отвода более тяжелой жидкости; 4 – кольцевой канал для отвода более легкой жидкости; 5 – ребра.
Для извлечения целевых продуктов эндометаболитов из концентрата микробной биомассы ее либо обрабатывают каким-либо экстрагентом без разрушения клеток (экстракция петролейным эфиром биожира из кормовой биомассы дрожжей, извлечение полиеновых антибиотиков), либо клетки разрушают каким-либо из методов, а затем экстрагируют продукты.
Для разрушения (дезинтеграции) клеток применяют целый набор методов, которые можно отнести к трем основным группам: физико-механические, химические и энзиматические (ферментные) методы. Все процедуры должны быть достаточно жесткими, чтобы разрушить клеточную стенку, и в то же время достаточно мягкими, чтобы исключить денатурацию или разрушение целевого продукта. А поскольку клеточные стенки у разных микроорганизмов состоят из различных полимеров (иногда сопоставимых или превосходящих по прочности лучшие сорта сталей), то никакого универсального метода их разрушения не существует. Еще одним фактором, обеспечивающим прочность клеточной стенки, является клеточный тургор - напряжённое состояние клеточной оболочки, создаваемое гидростатическим давлением внутриклеточной жидкости. В клетках внутреннее давление на клеточную стенку всегда значительно превышает давление на неё наружного раствора. У большинства растений тургорное давление лежит в пределах 5-10 атм, у галофитов, грибов - 50-100 атм. Таким образом любая клетка похожа на упругий резиновый мяч, и это значительно повышает ее устойчивость к механическим нагрузкам.
К физическим методам относятся: механическое разрушение клеток путем их растирания с применением кварцевого песка или в дисковой мельнице, дробление замороженных в жидком азоте или в сухом льде клеток; экструдирование (продавливание) клеток под высоким давлением (2-5 атм.) через узкую щель или отверстие; газодекомпрессионная дезинтеграция, основанная на создании в камере с разрушаемым материалом высокого давления и быстрым сбросом его, приводящим к разрыву клеточных стенок; ультразвуковая дезинтеграция.
Энзиматические методы основаны на применении литических ферментов, разрушающих клеточную стенку: лизоцима, выделяемого из белка куриных яиц и разрушающего главным образом оболочки бактериальных клеток; ферментного комплекса, содержащегося в желудочном соке улитки Helix pomatia или продуцируемого некоторыми видами актиномицетов, лизирующего оболочки эукариотических клеток, в частности грибов. Для разрушения клеточных стенок растений используют комплекс целюлолитических ферментов.
Химические методы дезинтеграции основаны на гидролизе клеточной оболочки под воздействием водных растворов щелочей, кислот, а так же под воздействием различных детергентов (моющие средства разрушающие липидные слои клеточной стенки), ингибиторов синтеза оболочки клетки (некоторые антибиотики).
Выбор метода дезинтеграции определяется целью работы: для получения внутриклеточных ферментов наиболее приемлемы физико-механические способы; энзиматические методы широко применяют в научных исследованиях для выделения в целости различных субклеточных структур (органелл, мембран и т.д.), а так же для получения протопластов. Применение химических методов дезинтеграции микроорганизмов ведет к разрушению целостности клеточных структур, инактивации ферментов и гидролизу многих продуктов. Поэтому химические методы обычно применяют для получения пищевого белка и биожира из дрожжей.
В результате обработки клеточной биомассы по одному из методов дезинтеграции получают гомогенат, содержащий неразрушенные клетки, оболочки разрушенных клеток, обрывки мембран, различные клеточные структуры, которые могут быть отделены путем фильтрования. При этом большая часть веществ-эндометаболитов переходит в культуральную жидкость или раствор экстрагента.
Дальнейшее выделение и очистка целевых продуктов из культуральной жидкости или экстрактов зависит от их химической и физической природы.
Для извлечения таких соединений, как спирты, карбонильные соединения, кислоты, их производные, большинство антибиотиков, витаминов, алкалоидов, применяют обычные приемы и методы, используемые в химической технологии (перегонку, выпаривание, экстракцию, перекристаллизацию, возгонку и др.). В качестве примера приведем технологию экстракционного выделения бензил-пенициллина из культуральной жидкости.
Современное производство бензилпенициллина включает в себя стадию глубинного культивирования микроорганизма-продуцента с последующим извлечением целевого продукта из культуральной жидкости.
На первом этапе мицелий отфильтровывается от культуральной жидкости (обычно на барабанных вакуум-фильтрах непрерывного действия). Фильтрат культуральной жидкости (нативный раствор) затем подвергается предварительной обработке (дополнительная фильтрация с применением активированного угля).
Выделение пенициллина из нативного раствора основано на способности пенициллина в виде кислоты растворяться в бутилацетате, в воде он нерастворим. Калиевая соль пенициллина, напротив, хорошо растворима в воде и нерастворима в бутилацетате. В производстве после передачи нативного раствора цеху химической очистки в сборник нативного раствора перед началом экстракции добавляют 0.03-0.06 масс.% дезэмульгатора (авироль) для лучшего разделения эмульсии.
Нативный раствор из сборника подают в эмульгатор, куда одновременно подается 9-12% раствор H2SO4 и охлажденный бутилацетат. В эмульгаторе происходит смешивание всех трех компонентов и экстрагирование бензил- пенициллина (кислоты) бутилацетатом. Температуру процесса поддерживают в пределах 10-120С, рН среды – 2,8 ± 3,0. При таком значении рН резко уменьшается степень диссоциации карбоксильных групп молекул бензил- пенициллина, в недиссоциированном состоянии они переходят в органическую фазу (бутилацетат). Более сильные кислоты и другие электролиты находятся в диссоциированном состоянии и поэтому не растворяются в бутилацетате; в водной фазе остаются почти все минеральные компоненты, аминокислоты, водорастворимые белки. Затем эмульсия поступает в экстрактор, где дополнительно обрабатывается бутилацетатом.

Далее бутилацетатный экстракт последовательно отмывают обессоленной водой и подвергают двухступенчатой экстракции водным раствором бикарбоната натрия NaHCO3 при рН = 7,3 -7,8. При этих условиях пенициллин находится в диссоциированном состоянии и хорошо растворяется в водной фазе и практически не растворим в бутилацетате. На данной стадии удается, очистится от примесей (в основном органических), являющихся более слабыми кислотами, чем бензилпенициллин.
Из бикарбонатного экстракта антибиотик вторично экстрагируют бутилацетатом при рН = 2,2 – 2,5.
Полученный вторичный бутилацетатный экстракт осветляют обработкой с активированным углем, далее вымораживают при -5°С в течение 20-30 минут, отфильтровывают от кусочков льда и кристалликов сульфата натрия, обезвоживая, таким образом, бутилацетатный экстракт.
Выделение калиевой соли бензилпенициллина из бутилацетатного экстракта проводят путем добавления к нему рассчитанного количества насыщенного раствора ацетата калия (раствор ацетата калия готовят в отдельном аппарате).
Полученную калиевую соль дополнительно очищают перекристаллизацией из водно-бутанольного раствора, полученные кристаллы отфильтровывают, промывают безводным бутанолом и сушат.
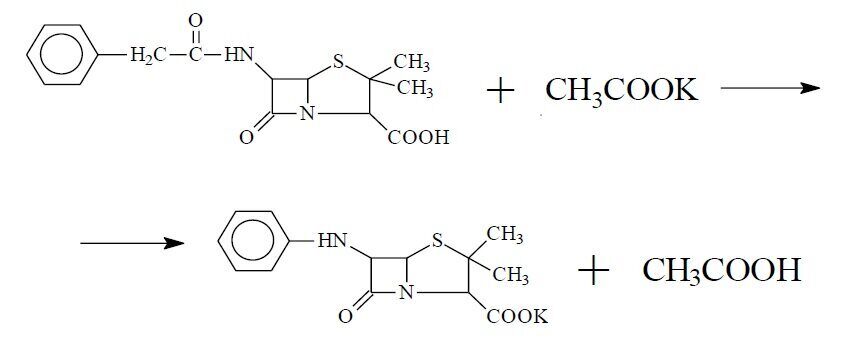
Наибольшую сложность представляет выделение продуктов белковой природы: ферментных препаратов, белковых антител, вакцин, гормонов и других физиологически активных веществ. Поэтому рассмотрим подробнее особенности их выделения и очистки на примере получения ферментных препаратов.
2. ОСНОВЫ ТЕХНОЛОГИИ ВЫДЕЛЕНИЯ, КОНЦЕНТРИРОВАНИЯ И ОЧИСТКИ БЕЛКОВЫХ И ФЕРМЕНТНЫХ ПРЕПАРАТОВ
Проведение этих стадий процесса обусловлено рядом технических сложно- стей, связанных, в основном, с нестабильностью (лабильностью) белков, проявляющейся в необратимой денатурации или частичной потере ими активности под влиянием незначительных изменений внешних условий. Поэтому при выборе технологии выделения, концентрирования и очистки белковых препаратов ищут решения, позволяющие проводить эти процессы в непрерывном режиме, с высокой скоростью, в "мягких" условиях обиваться максимального обезвоживания образующихся осадков. Для уменьшения потерь продуктов применяют различные вещества-стабилизаторы, проводят процесс при оптимальном значении рН растворов, стараются обеспечить максимально возможную механизацию и автоматизацию всех процессов.
Выделение большинства белковых продуктов непосредственно из культуральной жидкости, как правило, не производят. Это связано с тем, что концентрация целевого белка в культуральной жидкости обычно мала и не превышает долей процента. Выпадающий из такого раствора белок образует плохо фильтруемые взвеси и сильно загрязнен примесями. Поэтому стадии осаждения белка из раствора предшествует стадия его концентрирования.
Концентрирование
Для предварительного концентрирования полученных из культуральной жидкости растворов белков перед их осаждением и сушкой используют процесс вакуум-упаривания. Быстрое упаривание водного раствора при атмосферном давлении требует его нагрева до температуры 1000С, т.е. до температуры кипения воды, что совершенно неприемлемо для растворов белков. Поэтому процесс упаривания проводят при пониженном давлении (ниже 50 мм рт. ст.). Для большей стабильности концентрируемых белков его стараются проводить при нейтральных значениях рН раствора. Так при значениях рН раствора меньше 4,5 и больше 8,2 активность выделяемых ферментов начинает падать уже при нагревании раствора выше 35°С. При рН=6 тот же эффект наблюдается лишь при температуре выше 50°С. Установлено, что чем меньше время выпаривания, тем выше может быть температура греющего агента, а выпаривание наиболее очищенного раствора ферментов сопровождается большей потерей активности фермента. Последнее объясняется тем, что присутствующие в растворе примеси "защищают" выделяемый белок от неблагоприятных температурных воздействий.
Процесс выпаривания чаще всего проводят в пленочных или роторных выпарных аппаратах. Потеря активности фермента в таком процессе может достигать 5-20%. С целью возможного снижения этой величины к выпариваемому раствору добавляют белки-стабилизаторы: альбумин, казеин или осуществляют выпаривание вместе с клетками продуцента. В качестве стабилизаторов используют и такие соли, как хлориды кальция, натрия и ацетат кальция. Правильный в качественном и количественном отношении подбор стабилизаторов позволяет при минимально допустимых потерях активности ферментов увеличить скорость процесса выпаривания раствора за счет повышения температуры греющего пара.
Технически более сложно осуществить процесс вакуум-упаривания непосредственно культуральных жидкостей. По сравнению с водными экстрактами содержание сухих веществ в них в 4-5 раз ниже и составляет 2,5- 3,5%. В ходе концентрирования раствора в осадок выпадают гидроксиды, сульфаты, карбонаты и фосфаты кальция, магния и других металлов. Это приводит к изменению солевого состава и рН раствора, что способствует инактивации белка.
Часто, в промышленном производстве ферментных препаратов, полученный в процессе упаривания культуральной жидкости концентрат ферментов отделяют от выпавших в осадок примесей и, не подвергая дальнейшей очистке, добавляют к нему раствор хлорида натрия, чтобы предотвратить инфицирование продукта посторонней микрофлорой. Полученный таким образом 50% раствор препарата марки Г2х разливают по емкостям в 40-50 мл и отправляют потребителю.
Другим вариантом концентрирования белковых растворов является метод вымораживания, который основан на частичном замораживании раствора белка. Поскольку температура замерзания раствора всегда ниже температуры замерзания чистого растворителя, то образующиеся кристаллы представляют собой чистую воду, а белок концентрируется в водной фазе. Затем кристаллы льда отделяют на центрифуге. Подбирая условия замораживания исходного раствора и различные добавки можно фракционировать белки по составу и значительно сконцентрировать целевой фермент.
В отличие от вакуум-выпаривания и вымораживания ультрафильтрация или обратный осмос (фильтрование через фильтры со сверхмалым размером пор) имеет ряд очевидных преимуществ, поскольку проводится в "мягких" условиях, обеспечивающих меньший процент снижения активности фермента. Кроме того, осуществляемое концентрирование сопровождается очисткой от балластных низкомолекулярных примесей и увеличением активности фермента в 100-150 раз. Однако энергозатраты оказываются рентабельными при концентрировании раствора до содержания сухих веществ не более 30%,что связано с забиванием пор мембраны белковыми молекулами и как следствие резким снижением скорости процесса.
Процесс ультрафильтрации в режиме диализа позволяет получать высокоочищенные препараты. Для его осуществления в получаемый концентрат постоянно добавляют чистую воду. Такая пятикратная промывка позволяет в 250-300 раз повысить активность ферментного раствора, т.е. при концентрации 30% раствор содержит практически один белковый ферментный препарат.
На практике процесс ультрафильтрации проводят в циркуляционных аппаратах периодического действия. Перед подачей раствора на стадию ультра- фильтрации из него предварительно удаляют клетки продуцента и для предотвращения развития посторонней микрофлоры на поверхности мембран подвергают стерилизующей фильтрации через специальные бактериальные фильтры. В ходе проведения процесса ультрафильтрации в зависимости от свойств получаемого фермента раствор постоянно охлаждается до температуры 4-15° С.
Недостатком метода ультрафильтрации следует считать забивание пор мембраны осадками или адсорбированными молекулами, что приводит к снижению производительности мембранного аппарата во времени. Последнее требует периодического проведения промывки материала мембраны. Для предотвращения забивания пор мембраны осадками или сорбирующимися молекулами циркуляционный насос, используемый в этих установках, должен обеспечить линейную скорость потока жидкости через мембрану около 2-5 м/с. При таких скоростях наблюдается значительное гидравлическое сопротивление. Для его снижения на практике применяют две конструкции мембранных аппаратов: трубчатые мембранные аппараты и проточные с плоскими мембранными элементами, устанавливаемыми параллельно основному потоку раствора.
Высаждение (осаждение)
Следующей операцией после концентрирования является высаждение (денатурация) белков из раствора. Если необходимо получить осадок фермента или лекарственного белка (инсулин, интерфероны, антитела и т.д.), то это может быть только обратимая денатурация, при которой происходит лишь частичное разрушение гидратной оболочки нативного белка, а все структуры белка (вторичная, третичная и четвертичная) остаются без изменений. Такой осадок белка после удаления денатурирующего агента или фактора будет способен обратно раствориться (ренатурировать) в дистиллированной воде с сохранением своих биохимических и лекарственных свойств. При несоблюдении условий, обеспечивающих обратимую денатурацию, белок денатурируется необратимо, теряя способность к растворению в воде и как следствие свои свойства и биологическую активность.
Для выделения (высаждения) белковых препаратов из растворов часто применяют процесс высаливания. Он основан на уменьшении растворимости большинства белков в солевых растворах. Для обратимого высаждения можно использовать соли щелочных металлов, ионы которых хорошо сольватируются молекулами воды. Соли тяжелых металлов для этих целей использовать нельзя, т.к. катионы тяжелых металлов необратимо связываются с белками образуя нерастворимые комплексы. На практике в производстве используют сульфаты или хлориды натрия или аммония. Хлорид натрия и сульфат аммония дешевые и хорошо растворимые реагенты. Однако они являются сильными корозионно-активными реагентами, что обусловлено наличием анионов хлора или выделением аммиака в процессе гидролиза, особенно при повышенных значениях рН раствора. Это приводит к коррозии металлических частей оборудования.
Хороший эффект высаливания достигается при использовании сульфата натрия вместо сульфата аммония. Однако из-за меньшей по сравнению с сульфатом аммония растворимостью его можно использовать при температурах раствора не ниже 35-40°С. При охлаждении раствора наблюдается выпадение осадка сульфата натрия, что создает возможность его регенерации и повторного использования. Недостатком использования сульфата натрия является необходимость более высоких энергозатрат на нагревание растворов, а пребывание белков в условиях повышенных температур способствует их инактивации.
При проведении процесса высаливания большое значение имеет режим осуществления контакта соли с раствором белка. Для высаливания можно брать соль в виде тонко измельченного порошка или в виде насыщенного раствора, что гораздо удобнее технологически. Однако установлено, что наибольший эффект - минимально необходимое количество соли на 1 кг осаждаемого белка - достигается при использовании соли в виде тонко измельченного порошка. Наименьший эффект достигается при непрерывном смешении насыщенного раствора соли с раствором фермента. Это обусловлено тем, что ионы в сухой соли связывают (сольватируют) гораздо больше молекул воды, чем те же ионы в концентрированном растворе, где они уже в значительной степени сольватированы. Для достижения того же процента высаливания в последнем случае соли требуется в 1,3-1,5 раза больше.
Время образования осадков при высаливании для различных белков колеблется в пределах 0,5-12 часов. Время высаливания и необходимое для проведения процесса количество соли зависят от количества (процентного содержания) растворенных веществ. Чем их больше, тем меньшее количество воды подлежит связыванию. Так, например, для получения 1 кг препарата из культуральной жидкости требуется 45-50 кг соли, а из упаренного до 30%-ной концентрации раствора - только 1,4-1,6 кг.
В получаемых таким образом осадках белка содержится 60-85% балластных веществ, в том числе 30-45% соли. Повторное использование операций растворение - высаждение дает возможность получать высокоочищенные белковые препараты для медицинских целей.
Варьируя такие параметры, как температура и рН среды, в ряде случаев, возможно, осуществить фракционное высаждение белков. Для этого в присутствии соли изменяют рН исходного раствора или температуру, добиваясь денатурации балластной фракции белка. Последние необратимо выпадают в осадок, который отделяют от маточного раствора. На последующей стадии уже выделяют целевой белковый препарат.
Довольно часто вместо соли используют полиэтиленгликоль с молекулярной массой 6000. Он оказывает стабилизирующее воздействие на активные белки, легко отделяется от белка методом ионообменной хроматографии или ультрафильтрации.
В технологии выделения ферментов методом осаждения значительное место занимает процесс получения активных белков осаждением их с помощью органического растворителя. Действие органических растворителей основано на снижении диэлектрической проницаемости среды (раствора), которая определяет величину силы электростатического взаимодействия между молекулами растворенного белка и растворителя (воды). Устойчивость белковых растворов обусловлена толщиной гидратного слоя, окружающего молекулу белка. При разрушении этого гидратного слоя молекулы белка начнут образовывать конгломераты и выпадать в осадок. Для осуществления такого процесса необходимо использовать вещества более гидрофильные, чем осаждаемый белок. Однако эти вещества не должны изменять значение рН среды и не реагировать с функциональными группами белковых молекул. В качестве растворителей используют, в основном, этанол, метанол, изопропанол и ацетон. Варьируя тип органического растворителя, его количество, величину рН раствора можно проводить избирательное осаждение той или иной фракции белков.
В технологии процесс осаждения органическим растворителем проводят в реакторе непрерывного и периодического действия. Для снижения процента потерь активности выделяемого фермента при смешении растворителя с водным раствором активных белков обе жидкости первоначально охлаждают до температур соответственно -5±8°С и 5±6°С. Полученную смесь, содержащую не менее 8-10% белков, тщательно перемешивают, и через 20-30 мин происходит выпадение мелких частиц белка. Процесс осаждения проводят в вертикальном цилиндрическом аппарате с коническим днищем, снабженным мешалкой и рядом штуцеров для удаления жидкой фазы. Потеря активности ферментов на этой стадии составляет около 15%, в основном, по причине длительного контакта фермента с органическим растворителем. Организация процесса по способу непрерывного осаждения при времени контакта 10-15 мин позволяет снизить потери активности фермента на 20-25%.
Полученный на этой стадии осадок отделяют на центрифуге, промывают чистым этанолом и вновь сепарируют до остаточной влажности 30-35%.
Для получения высокоочищенных белковых препаратов, полученные на стадии выделения осадки белков снова растворяют в воде и подвергают специальным видам очистки. Одним из самых распространенных методов является сорбционная чистка. Поскольку в молекуле фермента присутствуют функциональные группы, сообщающие ей кислотный или основной характер, то обычно для этой цели используют метод ионного обмена на ионитах, полученных на основе целлюлозы: катионит КМЦ (карбоксиметил-целлюлоза) и анионит ДЭАЭ (диэтиламино-этил-целлюлоза).
В последние годы число различных ионитов сильно возросло, и для производства конкретного белкового препарата существует возможность выбрать наилучший. Среди ионитов, получивших достаточно широкое распространение, необходимо отметить такие, как обработанный крахмал, сефадексы на основе декстрана, катиониты на основе полиметакриловой кислоты, аниониты на основе поливинилового спирта и др.
Процесс проводят в насадочных колоннах, через которые пропускается раствор очищаемого белка, или в аппаратах с мешалкой. В последнем случае предполагается последующее отделение твердой фазы.
Десорбцию осуществляют элюирующими растворами, специально подобранными для каждого фермента и сорбента. Потери фермента на стадии сорбционной чистки не превышают 15%.
|
Для получения более высокоочищенных белков используют и другие препаративные методы. Среди них наибольшее распространение получили такие, как диализ, гельфильтрация, электрофорез, различные виды хроматографии и др.
|
Диализ - процесс диффузии ионов через полимерную мембрану под действием градиента концентраций. При этом за счет диффузии через мембрану удаляются соли и другие низкомолекулярные продукты, а их место в исходном растворе ферментного препарата занимают молекулы растворителя, в данном случае воды. И хотя исходный раствор фермента при этом увеличивается в объеме, но активность его возрастает в 3-4 раза.
В последние годы с развитием промышленности по производству синтетических пленок сильно возрос интерес к использованию процесса диализа в промышленном масштабе и был создан для его осуществления ряд промышленных установок.
Разновидностью процесса диализа является электродиализ. Перенос ионов через мембраны осуществляется в этом случае не за счет градиента концентраций, а под действием электрического поля.
ИСПОЛЬЗОВАНИЕ МЕТОДОВ ХРОМАТОГРАФИИ
|
Гель-фильтрация или Эксклюзионная хроматография
|
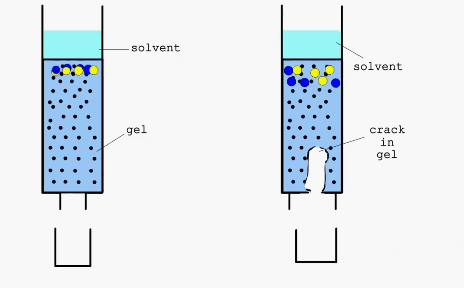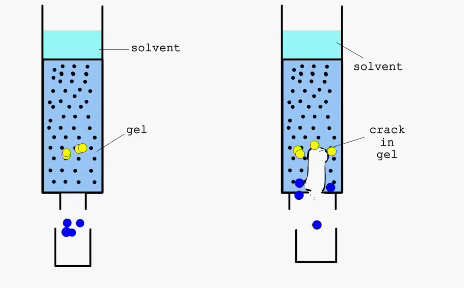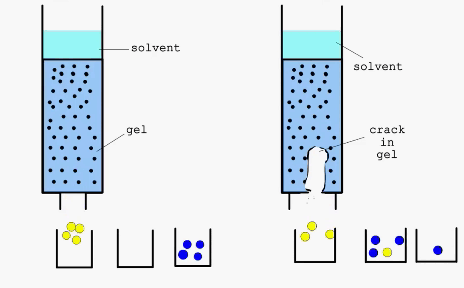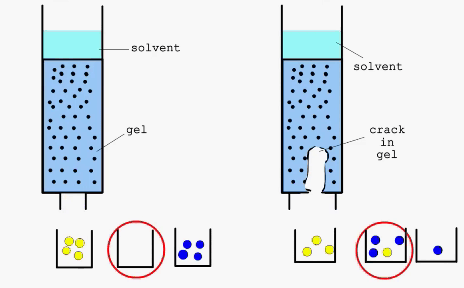
Справа - дефект в набивном слое хроматографической колонки
|
Если GIF-анимация ↑ по теме хроматографии не очень понятная, то рекомендуем освежить знания по приведенной ниже ссылке:
Разделение веществ путем хроматографии основано на их неодинаковом распределении между двумя несмешивающимися фазами. Наряду с достаточно простыми, классическими методами хроматографии, такими как колоночная, тонкослойная или бумажная, в последнее время широко применяют такие высокоэффективные методы как гельфильтрация или аффинная хроматография.
Гельфильтрация (метод “молекулярных сит) - хроматографиический метод разделения, основанный на использовании высокопористых носителей со строго определенным размером пор. При этом молекулы, способные проникнуть в поры носителя, дольше задерживаются в его материале, так как проходят при этом больший путь. В качестве материалов для проведения процессов гельфильтрации используют декстраны с поперечными связями, полиакриламид, стекло, силикагель, цеолиты и др.
Аффинная хроматография – метод, основанный на способности ферментов или других белков избирательно связывать те или иные лиганды - субстраты, коферменты, конкурентные ингибиторы, аллостерические эффекторы и т.п. Такое связывание весьма специфично, что позволяет выделить тот или иной целевой белок из множества других белков.
Для синтеза аффинного сорбента, соответствующего специфичности данного фермента, лиганд (субстрат или его аналог) присоединяют к инертной матрице (макропористые гидрофильные гели, синтетические полимеры, неорганические носители).
Преимущество аффинной хроматографии состоит в том, что с ее помощью можно в одну стадию осуществить полную очистку продукта из сложной многокомпонентной смеси (культуральной жидкости, цельных клеточных экстрактов и т. п.), тогда как другие способы требуют многоэтапной очистки и сопряжены с большими затратами труда и времени. Однако метод имеет и ряд недостатков, в частности высокая цена материалов, используемых в аффинной хроматографии (например, веществ, применяемых в качестве лигандов), а также быстрое забивание колонки пропускаемыми веществами, что позволяет использовать их только в периодическом режиме. После каждого выделения продукта колонки промывают и частицы заполняющего геля также подвергаются очистке.
Весьма эффективный метод разделения и очистки белковых и небелковых веществ основан на взаимодействии антигенов и антител. Разработанный на основании таких взаимодействий способ получил название имунно-аффинной хроматографии, который существенно повысил разрешающую способность при введении в практику использования моноклональных антител. Блестящей иллюстрацией его эффективности является высокая степень одноэтапной очистки человеческого интерферона (чистота повышается примерно в 500 раз).
Аффинная преципитация и аффинное разделение. Помимо аффинной хроматографии (которая иногда называется еще аффинной адсорбцией в геле) в крупномасштабных биотехнологических процессах для очистки продуктов все шире применяют аффинную преципитацию и аффинное разделение.
- При аффинной преципитации лиганд соединяется с растворимым носителем и, после взаимодействия с соответствующим выделяемым соединением, образующийся комплекс по мере его формирования выпадает в осадок. Иногда ускорение выпадения преципитата достигается путем добавления различных электролитов.
- Аффинное разделение основано на использовании системы, состоящей из двух водорастворимых полимеров, один из которых несет специфические лиганды, а другой обладает сродством к примесным компонентам. В качестве примера можно привести разделение нуклеиновых кислот и белков. Для полимера, соединяемого с лигандом, берется полиэтиленгликоль, а другим компонентом является декстран.
Электрофорез. Наряду с хроматографией перспективными методами разделения веществ при биотехнологических процессах являются электрофорез и его модификации. В этих методах разделяемая смесь помещается в мощное электрическое поле, обеспечивающее движение ионизированных компонентов смеси. Различие в электрофоретической подвижности позволяет пространственно разделить входящие в ее состав компоненты. Современные варианты электрофореза используют (как и хроматография) пластинки или колонки с образующими гель наполнителями (агароза, полиакриламид, сефароза, оксиапатит и др.).
Модификацией метода электрофореза является изоэлектрическая фокусировка или электрофокусировка. В этом методе раствор, насыщающий гель, содержит соединение с кислотно-основными группами. Под влиянием электрического поля кислотно-основные группы буферного соединения меняют степень ионизации, создавая тем самым градиент рН в направлении электрического поля. Электрически заряженные компоненты разделяемой смеси, нанесенной на гель, мигрируют по направлению к электроду противоположного знака. Поскольку эти компоненты передвигаются по градиенту рН, то они постепенно теряют свои заряды и в зоне, где рН соответствует изоэлектрической точке (точке электронейтральности), их движение прекращается. Каждый компонент концентрируется (фокусируется) в определенной области геля.
3. ОСНОВЫ ТЕХНОЛОГИИ СУШКИ БЕЛКОВЫХ И ФЕРМЕНТНЫХ ПРЕПАРАТОВ
Процессу высушивания могут подвергаться как осадки активного белка, полученные путем высаждения из растворов, так и сконцентрированные растворы, экстракционные вытяжки и культуральные жидкости.
Если белок находится в растворенном состоянии, то процесс сушки проводят в распылительных сушилках. Метод получения сухих веществ в распылительных сушилках широко применяется в химической технологии. Наиболее эффективным вариантом высушивания термостабильных веществ является противоточная сушка, когда высушиваемый раствор распыляется навстречу потоку нагретого воздуха. В результате, наиболее высушенные частицы вещества взаимодействуют с самым горячим воздухом. Однако из-за термолабильности белков такой метод сушки растворов неприемлем. К процессу сушки белковых растворов предъявляют ряд общих требований:
- Содержание сухих веществ в растворе не должно превышать 20-22%. Это достигается правильным проведением предварительного процесса упаривания нативных растворов.
- Температура теплоносителя (горячего воздуха) не должна превышать 130°С на входе в сушильную камеру и 50-70°С на выходе из нее.
- Время контакта высушиваемых частиц с теплоносителем не должно превышать нескольких секунд. Теплоноситель и высушиваемые частицы должны двигаться в одном направлении (движение в токе теплоносителя). Недопустимо противоточное движение теплоносителя и высушиваемых частиц.
- Гидродинамика потоков в сушильной камере должна обеспечить отсутствие контакта высушиваемых частиц с ее стенками или свести ее к минимуму.
- При сушке обязательно добавляют наполнители в количестве 100% от полной массы сухих растворенных веществ. Наполнитель предотвращает слипание высушиваемых частиц. В качестве наполнителя обычно используют хлорид натрия или сульфат магния. Последний обладает также свойством стабилизатора высушиваемого ферментного препарата.
Потери активности фермента при распылительной сушке с наполнителями - стабилизаторами не более 5-6%, без них 25-30%. После сушки препарат должен содержать не более 6-8% остаточной влаги. Тогда при сроке хранения до 1 года не наблюдается потери его активности.
Более сложным является процесс сушки белковых осадков, полученных высаливанием или осаждением летучим органическим растворителем. Влажность таких осадков может достигать 70-80%, а сами они представляют собой плотную, вязкую и липкую массу. Цикл их высушивания достаточно длительный и занимает до 14-16 часов. Для снижения потерь сушку проводят в вакууме при температуре 50-60°С. Для ускорения процесса и более равномерного прогрева высушиваемого продукта сушильные камеры снабжаются различными перемешивающими устройствами.
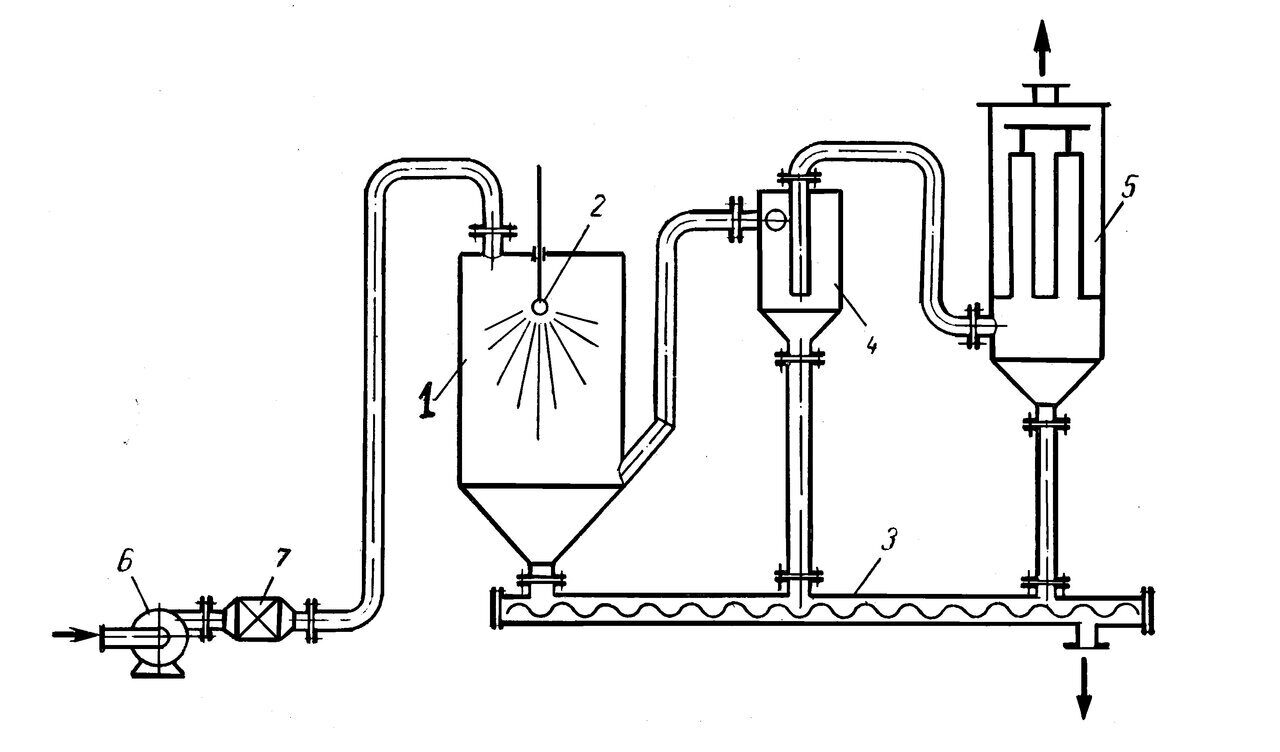
Рис. 6. Распылительная сушилка: 1 – камера сушилки; 2 – форсунка; 3 – шнек для выгрузки высушенного материала; 4 – циклон; 5 – рукавный фильтр; 6 – вентилятор; 7 – калорифер.
Однако, несмотря на использование таких приемов как сушка при пониженном давлении или в распылительной сушилке, использование повышенной температуры может приводить к значительному снижению активности и других потребительских свойств (растворимость, срок хранения и др.) белковых, витаминных и других термолабильных продуктов и препаратов. Более эффективным и щадящим способом сушки, широко используемым в фармацевтической и пищевой промышленности, является лиофильная сушка.
4. ЛИОФИЛЬНАЯ СУШКА
1. Общие принципы и преимущества метода лиофилизации.
Процесс удаления жидкости (воды) из осадков при глубоком вакууме (ниже 1 мм рт. ст.) называется лиофильной сушкой или лиофилизацией. Название процесса - лиофильная сушка, не совсем верно описывает суть процесса. Например, температура кипения воды при 4,6 мм рт. ст. равна 0°С, а при 0,034 мм рт. ст. составляет -50°С. При температуре ниже 00С вода замерзает, и поэтому процесс упаривания представляет собой не сушку (фазовый переход жидкость-пар), а возгонку (фазовый переход твердое вещество-пар). Принцип проведения лиофильной сушки весьма прост. Водный раствор, осадок или например ягоды, полностью замораживают и выдерживают в вакууме 0,01-2 мм рт. ст. Возгоняющиеся водяные пары улавливают в охлаждаемых ловушках или при помощи химических поглотителей.
Основные преимущества метода лиофильной сушки следующие:
- в процессе упаривания продукт находится при низкой температуре. Это имеет особенно важное значение для обезвоживания белков, антибиотиков, вирусов, микроорганизмов и нестабильных фармацевтических продуктов и свежих продуктов питания;
- лиофилизация не сопровождается вспениванием;
- благодаря низкой температуре удается обезвоживать вещества, которые при обычной перегонке захватываются водяными парами;
- в процессе упаривания объем смеси меняется очень мало, благодаря чему образуются мелкокристаллические продукты, которые вследствие своей исключительно большой поверхности легко растворяются при дальнейших операциях (например, лиофилизированный белок растворяется в воде в течение нескольких секунд);
- метод лиофилизации применим также для высушивания гидрофобных веществ, в том числе нестабильных липидных компонентов липопротеидов;
- так как во время всей операции продукт находится при низкой температуре, нет опасности его микробиологического заражения, а ферментативное расщепление сведено до минимума;
- поскольку работу проводят в относительно глубоком вакууме, нет опасности окисления нестабильных веществ кислородом воздуха;
- полученные продукты содержат около 0,5% влаги, благодаря чему их можно хранить длительное время, не опасаясь их разрушения микроорганизмами.
2. Технология лиофильной сушки.
При проведении лиофильной сушки всегда следует стремиться к тому, чтобы лиофилизируемый раствор замерз, возможно быстрее. При медленном замораживании увеличивается концентрация растворенного вещества в еще незамерзшей части жидкости, что может ухудшить качество сушки. Быстрое замораживание жидкости может быть достигнуто несколькими способами. Наиболее простой и чаще всего употребляемый в лаборатории способ состоит в следующем: колбу вращают рукой в наклонном положении в бане со спиртом, охлажденным до -40°С, или со смесью твердой углекислоты со спиртом или ацетоном. Колбу наполняют замораживаемым раствором, примерно на 1/5 объема. После образования слоя замерзшего раствора на поверхности колбы содержимому дают полностью застыть при температуре от -20 до -400С. Для замораживания больших количеств жидкости было предложено специальное вращающееся устройство, в котором колбы с раствором интенсивно вращаются вокруг своей оси при -40°С. Замерзающая жидкость образует на стенках слой с относительно большой поверхностью.
Другой, менее употребительный способ замораживания заключается в быстром испарении части воды в вакууме. За счет теплоты испарения этой воды происходит замораживание остальной части раствора. Этот способ применяют только в промышленности. Для устранения вспенивание при упаривании растворы помещают в пробирках, установленных в центрифугу. Центробежная сила препятствует образованию пены, и раствор намерзает на внешних стенках пробирки.
В качестве источника вакуума при лиофильной сушке в лаборатории удобнее всего использовать масляные насосы. В промышленных производствах наряду с насосами большой производительности используют многоступенчатые паровые эжекторы, выполняющие одновременно функции создания вакуума и улавливания (конденсирования) паров воды.
Водяные пары улавливают двумя основными способами:
- Пары улавливают при помощи охлаждаемых ловушек. Обычно в лабораториях для охлаждения ловушек используют смесь твердой углекислоты со спиртом или ацетоном. Для конденсации 1 г льда требуется примерно 6 г твердой углекислоты.
- Пары улавливают химическими поглотителями в специальных сосудах. В качестве поглотителя воды можно использовать безводный хлористый кальций (90 г на 1 г воды), едкий натр, пятиокись фосфора (3 г на 1 г воды) и т. п.
В промышленности в качестве поглотителей влаги иногда используют гигроскопичные охлажденные растворы солей. Так, например, в некоторых промышленных установках раствор хлористого лития, охлажденный до 0°С, подают в конденсирующее устройство прибора для лиофильной сушки, где он уменьшает количество водяных паров. Регенерированный упариванием и охлажденный раствор снова возвращают в конденсирующее устройство.
В процессе сушки большинство продуктов благодаря интенсивному испарению воды охлаждается до слишком низких температур, вследствие чего процессе замедляется. Поэтому рекомендуется погружать колбы в баню с температурой 20 - 30°С.
Точную информацию о ходе сушки и степени дегидратации при работе в лабораторном масштабе получить трудно. Приблизительно можно оценить, продолжается ли процесс осушения продукта или он уже сухой по тому, охлаждается ли колба с осушаемым веществом или нет. Более точную информацию можно получить, поместив в лиофилизируемый раствор термопару. Когда температура начинает повышаться выше 0°С и продукт остается твердым, сушку можно считать законченной.
Приближенно можно считать, что за 1 час возгоняется слой льда толщиной примерно 1 мм. Скорость возгонки, однако, во многом зависит от типа прибора. На последней стадии сушки (от 5 до 0,5% влаги) вещества осушаются более медленно, и для удаления остаточного количества воды обычно требуется больше времени, чем для удаления основной массы воды.
Иногда комбинируют два способа конденсации: главную массу воды (до остаточной влажности около 2%) удаляют при помощи охлаждаемой ловушки, а досушивание (до остаточной влажности 0,5%) проводят с применением химического поглотителя.
3. Применение лиофильной сушки.
Лиофильная сушка широко применяется в химии высокомолекулярных природных веществ, фармацевтическо-биотехнологическом производстве, биохимии и биологии. Лиофильная сушка является конечной стадией в производстве пенициллина, стрептомицина и некоторых витаминных препаратов.
Новейшая техника фракционирования и консервирования плазмы крови при низких температурах, включает стадию быстрого высушивания конечных продуктов лиофильной сушкой. Сконструировано оборудование, позволяющее упаривать этим способом тысячи литров воды в день.
Современная техника лиофильной сушки не менее важна для исследований бактериальных токсинов, при приготовлении больших количеств чистых белков для работ, связанных с установлением их строения, и в энзимологии. Путем лиофилизации можно легко законсервировать ряд биологических сред.
Некоторые бактериальные и вирусные культуры (препараты - пробиотики) можно после лиофилизации долгое время сохранять в вакууме. В случае необходимости через несколько лет такую культуру можно снова перенести в нормальные физиологические условия и вызвать ее размножение. Так были законсервированы культуры Haemophilus influenzae, Neisseria gonorrheae, Eberthella typhosa, а также вирус гриппа, холерный вибрион, бактериофаги и многие другие.
Большое значение имеет применение одной из модификаций лиофильной сушки для изучения тканей в гистологии и цитологии.
В пищевой промышленности лиофильную сушку используют для получения сушеных овощей, фруктов, растворимого кофе, сушеного свежего мяса и других продуктов.
5. СТАНДАРТИЗАЦИЯ И НОМЕНКЛАТУРА ФЕРМЕНТНЫХ ПРЕПАРАТОВ
Все получаемые в промышленности ферментные препараты могут быть классифицированы по способу получения и очистки.
Всем ферментным препаратам, полученным методом поверхностного или глубинного культивирования, присваивают соответственно индексы Пх и Гх. Далее после индексов ставятся цифры 2,3,10,15,20,30, указывающие, в результате какой последовательности технологических операций был получен данный ферментный препарат.
Продукты с цифровым индексом "2" обозначают технические ферментные препараты, которые получают в результате экстракции ферментов водой из культуры продуцента, выращенного поверхностным способом, с последующим упариванием водного экстракта или культуральной жидкости (в случае глубинного культивирования) до 50% содержания сухих веществ. Препараты группы П3х и Г3х представляют собой высушенные до порошкообразного состояния продукты П2х и Г2х.
Очищенные ферментные препараты группы П10х и Г10х получают осаждением органическими растворителями непосредственно из культуральной жидкости или водного экстракта биомассы. Препараты группы П15х и Г15х выделяют из тех же водных растворов сульфатом аммония. П20х и Г20х готовят на основе препаратов П10х и Г10х, подвергая последние очистке методом ультрафильтрации. П30х и Г30х представляют собой высушенные после ультрафильтрации препараты группы П20х и Г20х.
Активность любого фермента или ферментного препарата в общем, виде характеризуется скоростью катализируемой реакции.
За единицу активности (U или Е) любого фермента принимают то его количество, которое катализирует превращение одного микромоля субстрата за одну минуту при стандартных условиях (температура 30°С). Если количество субстрата не может быть выражено в микромолях (при отсутствии точного значения его молекулярной массы), то величину активности оценивают по количеству микроэквивалентов участвующих в реакции групп. Например, при гидролизе белка расчет активности ведут не по числу гидролизованных микромолей вещества, а по количеству образовавшихся в ходе гидролиза свободных карбоксильных или аминогрупп. Аналогично при гидролизе крахмала - по числу гидролизованных глюкозидных связей.
Кроме единицы активности для чистого фермента используют величину называемую катал (кат).
Катал (1 кат) - это количество фермента, которое вызывает превращение 1 моля субстрата в течение 1 секунды.
Поскольку катал – большая величина, каталитическую активность выражают в долях катала (микро-, нано- и пикокаталах).
1 ед.акт.(Е) = 1мкмоль/мин =16,67 нкат
Активность фермента, выражаемая числом микромолей субстрата, прореагировавших в 1 мин с 1 мг фермента, называется удельной активностью; ее размерность (мкмоль/мин.мг), или (ед.акт./мг). Если ферментативная актив- ность выражается в каталах, удельная активность должна выражаться в (кат/кг).
В производственных условиях активность получаемого ферментного препарата оценивают по количеству микромолей субстрата, прореагировавших под действием 1мл ферментного раствора или 1 г препарата в оптимальных условиях за 1 мин. Если ферментный препарат не содержит балластных белков, то его удельная активность выражается в стандартных единицах. Если же балласт присутствует, то удельную активность считают на 1 мг белка в ферментном препарате.
6. ТИПОВЫЕ ПРИМЕРЫ ВЫДЕЛЕНИЯ И ОЧИСТКИ ФЕРМЕНТНЫХ ПРЕПАРАТОВ
Современное производство ферментных препаратов представляет собой многостадийный процесс, число стадий в котором достигает 15-17-ти.
Рассмотрим в качестве примеров последовательность отдельных технологических операций, осуществляемых при выделении и очистке ферментных препаратов.
6.1. Получение a-амилазы из культуральной жидкости.
- На первой стадии осуществляют отделение биомассы продуцента, пигментов, балластных белков. Для этого в культуральную жидкость, имеющую рН раствора около 6,0 и охлажденную до 15°С, добавляют на 1м 65л 2М раствора хлорида кальция. Образующийся в результате взаимодействия с присутствующими в культуральной жидкости фосфат-анионами фосфат кальция сорбирует на себе пигменты и белки и выпадает вместе с ними в осадок. Избыток ионов кальция способствует коагуляции биомассы. Далее полученный осадок отфильтровывают.
- На второй стадии осуществляют отделение α-амилазы. Для этого в фильтрат, охлажденный до температуры 5°С, добавляют ацетон в соотношении 1:1. При этом осаждаются амилаза и часть (5-8%) протеазы. Сахара, соли, и другие низкомолекулярные продукты остаются в растворе. Полученный осадок отфильтровывают.
- На третьей стадии проводят очистку от остаточных балластных примесей. Для этого осадок, полученный на предыдущей стадии, растворяют в воде, нерастворившуюся часть отделяют сепарацией, а к раствору добавляют смесь солей хлорида кальция и гидрофосфата аммония. Образующийся после этого осадок вновь отфильтровывают.
- Данная стадия представляет собой дополнительную очистку от балластных белков. Ее осуществляют путем дробного добавления ацетона к раствору, полученному на предыдущей стадии, до соотношения 1:0,3. Вновь выпавший осадок направляют на фильтрацию.
- На этой стадии осуществляют очистку от остатков протеазы путем повторного прибавления ацетона к водному раствору фермента с предыдущей технологической операциии в соотношении 1:1. Выпавший осадок отфильтровывают и направляют на стадию обесцвечивания.
- Данную операцию проводят при растворении осадка, полученного на предыдущей стадии, в 0,02 М растворе ацетата кальция с последующим добавлением 5% активированного угля. После 24 часовой выдержки при небольшом перемешивании уголь отделяют сепарацией, а раствор фермента направляют на кристаллизацию.
- Для этого исходный раствор охлаждают и дробно прибавляют ацетон до прекращения помутнения раствора. Выпавший осадок отделяют на центрифуге и высушивают.
В результате проведения всех технологических операций получают готовый ферментный препарат с выходом порядка 50%.
6.2. Получение нейтральной и щелочной протеаз. Технология процесса включает в себя следующие основные стадии:
- Как и в предыдущем случае первоначально отделяют биомассу микро- организма - продуцента, пигменты и балластные белки в результате добавления хлорида кальция к раствору культуральной жидкости.
- На данной стадии осуществляют концентрирование и обессоливание нативного раствора с помощью ультрафильтрации. Процесс проводят при температуре 12°С и значении рН раствора, близкого к 7,0. В результате ультрафильтрации нативный раствор концентрируется в 20 раз.
- Стадия хроматографической очистки от пигментов на сорбенте ДЭАЭ - целлюлозе. Протеазы при этом не сорбируются.
- Стадия дополнительной хроматографической очистки на сорбенте карбоксиметилцеллюлозе с последующим элюированием через него раствора хлорида натрия.
- Заключительная стадия - кристаллизация. Ее проводят из водно-ацетонового раствора. Выпавшие кристаллы направляют на сушку.
Доп. информация:
Микробная биотехнология (начальная страница).
- Выделение и очистка продуктов биотехнолгии. Методическое пособие / Д.А. Новиков – Минск.: БГУ, 2014. –256 с.
- Выделение и очистка продуктов биотехнологии. Метод. пособие к лабораторным занятиям / Д.А. Новиков. – Минск.: БГУ, 2014. – 70 с.
- Сорбционные методы выделения продуктов биосинтеза : учеб. пособие / В. С. Берсенёва, В. А. Бакулев. — Екатеринбург : Изд-во Урал. ун-та, 2018. — 80 c.
- Методы хроматографии (ссылки на PDF)