ООО "ПРОПИОНИКС"
| пн-пт с 09:00 до 18:00 | |
Нацеленность на кишечную микробиоту: новые терапевтические возможности при рассеянном склерозе
« НазадЛЕЧЕНИЕ РАССЕЯННОГО СКЛЕРОЗА С УЧЁТОМ ВЗАИМОДЕЙСТВИЯ С МИКРОБИОМОМ КИШЕЧНИКА

Нацеленность на кишечную микробиоту: новые терапевтические возможности при рассеянном склерозе
Рассеянный склероз (РС) вызывает длительное многоочаговое поражение центральной нервной системы. Сложный фон РС связан с аутоиммунным воспалением и процессами нейродегенерации, и на него потенциально влияют многие факторы, в том числе изменение состава и функции микробиоты кишечника. В данном обзоре представлены современные экспериментальные и клинические данные о характеристиках дисбиоза кишечника при РС, а также о его связи с течением заболевания и дисрегуляцией иммунного ответа и метаболических путей, вовлеченных в патологию РС. Кроме того, обсуждаются терапевтические последствия этих исследований, а также ряд фармакологических, диетических и других вмешательств, направленных на микробиом кишечника и способных оказать благоприятное воздействие на течение РС.
Введение
Рассеянный склероз (РС) - одно из наиболее распространенных хронических заболеваний центральной нервной системы (ЦНС). Диссеминированное поражение головного и спинного мозга, включающее воспалительную демиелинизацию и потерю аксонов, вызывает целый ряд симптомов неврологического дефицита и приводит к нарастающей инвалидизации. 1 Течение заболевания длительное и очень вариабельное, чаще всего рецидивирующе-ремиттирующее, но на некоторых стадиях также прогрессирующее. Основной процесс, лежащий в основе патологии РС, связан с дисрегуляторным, аутореактивным ответом иммунной системы, направленным на антигены ЦНС. Медленно развивающийся нейродегенеративный процесс сопровождает иммуноопосредованное воспаление. Однако этиология заболевания представляется сложной, и некоторые ее аспекты до сих пор не до конца выяснены, несмотря на значительный прогресс в этой области.2
В последние годы был достигнут консенсус относительно важности взаимодействия генов и окружающей среды в запуске и модуляции аутоиммунного ответа, имеющего отношение к развитию РС. Предполагается, что на генетические факторы приходится ок. 30% риска развития РС. К настоящему времени выявлено до 200 генетических вариантов (в основном связанных с иммунной системой, например, аллели HLA-DR и DQ) и их эпигенетических модификаций, связанных с риском развития РС или модуляцией его течения. Также появляется все больше доказательств значительной роли факторов окружающей среды, связанных с генетической предрасположенностью, в определении возникновения и прогрессирования РС. К таким факторам относятся: курение, воздействие солнечного света, уровень витамина D3, стресс, ожирение, компоненты диеты и инфекции. 2-4
Согласно гигиенической гипотезе, инфекции в детском и подростковом возрасте усиливают регуляторные свойства иммунной системы в дальнейшем; таким образом, ограниченный контакт с инфекционными патогенами может способствовать развитию аутоиммунных заболеваний. 4 Более того, в качестве связи между инфекциями и возникновением РС или его дальнейшими обострениями предлагается несколько механизмов. К ним относятся «молекулярная мимикрия», распространение эпитопов, «активация случайного прохожего», свойства суперантигенов патогенов, а также экспрессия криптических антигенов вследствие повреждения тканей. Все эти механизмы могут способствовать активации аутореактивных иммунокомпетентных клеток, их пролиферации и миграции через гематоэнцефалический барьер (ГЭБ), что приводит к воспалительной демиелинизации в ЦНС. 3 Исследования, посвященные вирусным агентам, показали, что инфекция/сероконверсия вируса Эпштейна-Барр (EBV) является основным фактором риска развития РС, воздействие HHV6 и HSV-1 умеренно повышает этот риск, в то время как предшествующая инфекция CMV, по-видимому, оказывает защитное действие. 2,3,5 Предполагается, что бактериальные агенты оказывают влияние как потенциальные факторы риска РС в основном через свои токсины. На животных моделях токсины стафилококков и Clostridium perfringens стимулировали аутореактивные Т-клетки, проникали через ГЭБ и связывались с миелиновыми волокнами нейронов. И наоборот, коклюшный токсин оказывал защитное действие, снижая инфильтрацию Т-клеток, активируя микроглию и повышая уровень регуляторных клеток. 6 Было также показано, что Helicobacter pylori, которая встречается у пациентов с рассеянным склерозом реже, чем в общей популяции, облегчает экспериментальную воспалительную демиелинизацию. 3
В последнее время все большее внимание уделяется роли микроорганизмов, обитающих в кишечнике человека (микробиота кишечника), а также их геномов, метаболитов и окружающих условий (определяемых как микробиом кишечника) 7 на фоне заболеваний ЦНС.
Ось «кишечник-мозг» включает двунаправленную связь между желудочно-кишечным трактом и ЦНС, в том числе эндокринные, метаболические, иммунные и нейротрансмиттерные связи. Микробиом кишечника играет важную роль в этих взаимодействиях, например, через вагальную стимуляцию, высвобождение метаболитов в циркуляцию и стимулирование иммунокомпетентных клеток в стенке кишечника. Имеются данные о влиянии микробиома кишечника на созревание и дифференцировку нейронов и глиальных клеток, функциональную целостность ГЭБ, а также на поддержание баланса между про- и противовоспалительными компонентами иммунного ответа. Таким образом, значение микробиома кишечника в развитии и динамике РС представляется особенно привлекательным. 8, 9
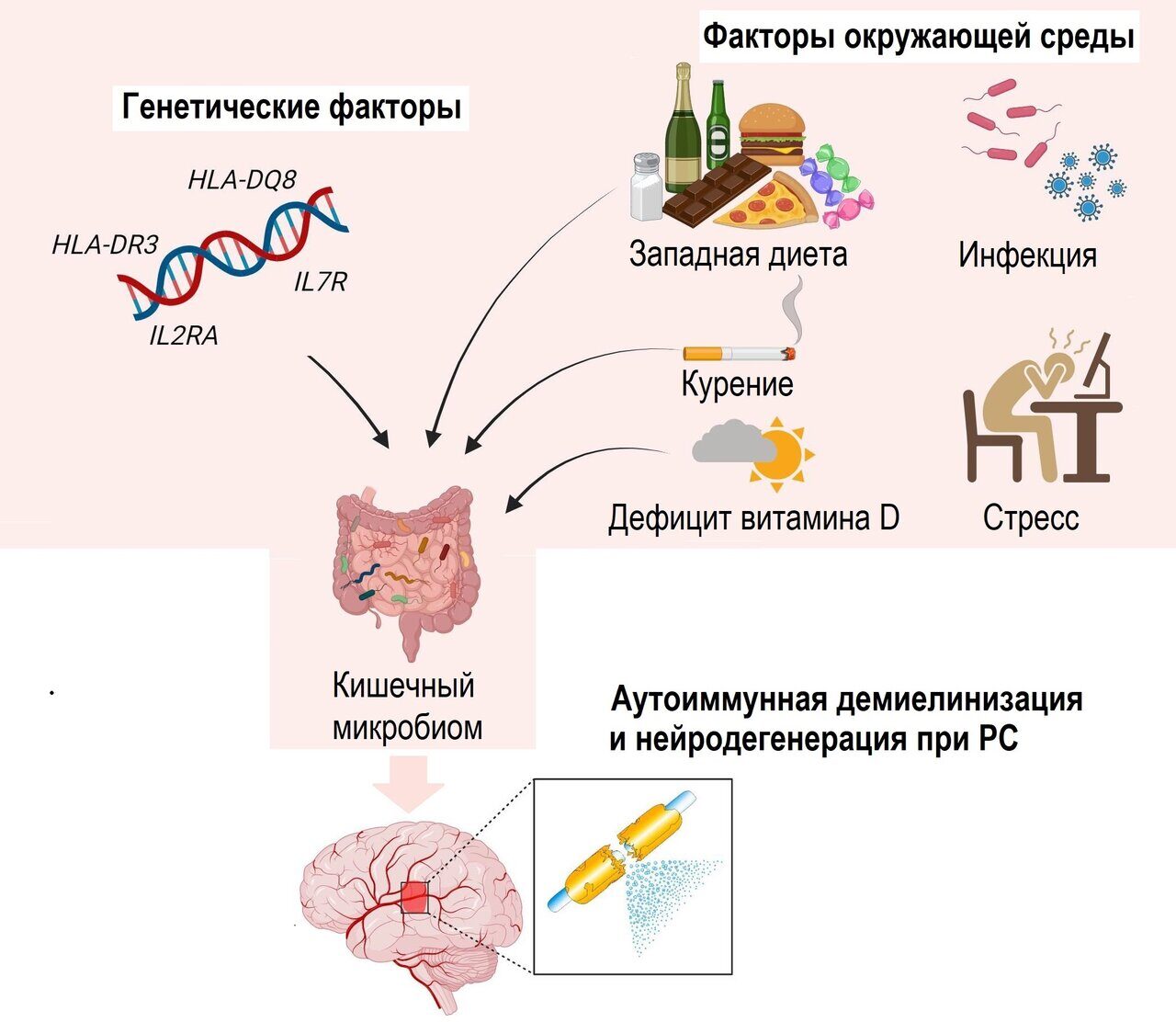
Отмечены интересные связи между микробиомом кишечника и генетическими или экологическими факторами риска развития РС (рис. 1). В целом, сложные взаимодействия между хозяином и микробиотой кишечника влияют на состав и функции последней. Метаболизм бактерий основан на субстратах, определяемых генетикой хозяина, а экспрессия генов хозяина и бактерий может взаимно регулироваться специфическими миРНК.10 Роль этих взаимодействий в определении восприимчивости к аутоиммунитету ЦНС была продемонстрирована на животных моделях. Были получены доказательства значительной роли генов HLA-DQ8 и HLA-DR3 в формировании микробиоты кишечника мышей, а также их взаимосвязанного вклада в восприимчивость или резистентность к экспериментальному аутоиммунному энцефаломиелиту (EAE).11 Кроме того, у мышей были выявлены различные микробные профили, связанные с определенными генотипами, а введение несовместимых штаммов бактерий (например, Lactobacillus reuteri) генетически восприимчивым хозяевам способствовало обострению EAE.12
Рисунок 1. Вклад генетических и средовых факторов в развитие РС.
Считается, что генетические и средовые факторы, а также их взаимные взаимодействия играют значительную роль в возникновении и развитии РС. Данные о связи некоторых из этих факторов с микробиомом кишечника подтверждают гипотезу о его значимости для процессов, лежащих в основе РС.
Геномные исследования ассоциаций выявили некоторые ассоциации между составом микробиоты и вариантами гена рецептора витамина D (VDR). 13 Более того, уровень витамина D3 влияет на кишечное всасывание кальция и, следовательно, на кишечную моторику, а также на целостность слизистой кишечного барьера. Таким образом, дефицит витамина D3 способствует стазу (застою) кишечника с повышением проницаемости кишечника для бактерий и продуктов их жизнедеятельности. Курение, рассматриваемое как еще один фактор риска РС (из-за влияния на провоспалительные цитокины и миграцию Т-клеток через ГЭБ), может изменять содержание и функции микробиоты кишечника за счет токсических веществ, содержащихся в табачном дыме, и/или иммуноопосредованных механизмов. 2,4,14
До сих пор остается дискуссионным вопрос о том, выступает ли микробиом кишечника в качестве пускового и модулирующего фактора аутоиммунного ответа на фоне РС, или, возможно, дисбиоз кишечника развивается как следствие нарушения баланса между про- и противовоспалительными механизмами и метаболическими изменениями в ходе заболевания. Тем не менее, изучение состава и функций микробиома кишечника у людей с РС (pwMS, people with MS) может дать более полное представление о предпосылках РС и динамике его клинического течения. 8,15
Несмотря на достигнутый в последнее время прогресс в лечении РС, перед нами все еще стоят определенные задачи, связанные, в частности, с индивидуальными различиями в течении заболевания и ответе на лечение. Продолжается поиск биомаркеров активности и прогрессирования заболевания. В современных терапевтических рекомендациях по РС подчеркивается тенденция к персонализированным и комплексным стратегиям лечения, когда болезнь-модифицирующая терапия (БМТ) дополняется модификацией образа жизни. 16,17 В связи с этим профиль микробиоты кишечника может рассматриваться как сигнатура индивидуальных иммунных или метаболических свойств и, таким образом, перспективный маркер для выбора БМТ или поддерживающих терапевтических вмешательств.
Таким образом, в данном обзоре мы обсуждаем современные данные о роли микробиома кишечника в процессах, лежащих в основе патологии РС, уделяя особое внимание возникающим потенциальным терапевтическим последствиям.
Методы
Поиск литературы в Интернете проводился с использованием баз данных PubMed и Scopus, охватывая период публикаций с начала 2010 года до 1 марта 2023 года. Использовалась следующая комбинация ключевых поисковых терминов: «рассеянный склероз», «микробиом/микробиота кишечника» и «лечение». После исключения рефератов конференций и статей, написанных не на английском языке, обзоры и оригинальные исследования были отобраны и проанализированы на предмет их соответствия теме. Кроме того, были изучены списки ссылок на найденные публикации и выявлены другие потенциально релевантные работы. Первоначально поиск литературы был выполнен первым автором, его результаты были рассмотрены, а дальнейшие этапы поиска проверены другими авторами.
Характеристика микробиома кишечника при рассеянном склерозе
Состав микробиоты кишечника у пациентов с РС
С 2015 года состав микробиоты кишечника при РС стал предметом пристального интереса. Одно из первых исследований показало, что эпсилон-токсин, продуцируемый Clostridium perfringens (комменсалом кишечника), может модулировать целостность ГЭБ, достигать ЦНС и выступать в качестве потенциального триггера аутоиммунного ответа, связанного с РС.18 Несколько последующих сообщений показали, что состав основных бактериальных таксонов в кишечнике был значительно изменен у пациентов с РС по сравнению со здоровыми субъектами (HS) (табл. 1). Выявленные изменения были гетерогенными и различались в зависимости от исследуемой популяции и методологии (в частности, платформы секвенирования и исследуемого участка гена 16S рРНК). Несмотря на такое разнообразие, на таксономическом уровне, похоже, наметился консенсус относительно относительной численности отдельных бактериальных штаммов. Наиболее часто выявляемые обедненные бактериальные таксоны включали Bacteroides,19-25 Faecalibacterium,21,22,25-27 Prevotella 23,24,28,29 и Roseburia,21,22,26,30, тогда как обогащенные включали Akkermansia19,28,30-34 и Streptococcus. 23,24,30,33,35,36 Состав микробиоты кишечника различался у пациентов с различными типами РС. 30,32,33,39 Релапсивно-ремиттирующий тип (RRMS) был связан с пониженным количеством Faecalibacterium prausnitzii, Eubacterium rectale и Roseburia,21,32 в то время как первично-прогрессирующий тип (PPMS) был связан с повышенным уровнем Enterobacteriaceae и Clostridium g24 FCEY и пониженным уровнем Blautia и Agathobaculum. 32 У пациентов с вторично-прогрессирующим типом (SPMS) наблюдалось относительное увеличение количества штаммов Clostridium и Streptococcus.33
Таблица 1. Изменения микробиоты кишечника у пациентов с РС без назначенного лечения.
|
Изменение бактерий
|
Выявлено в / По сравнению с
|
Ref
|
|
Clostridium perfringens тип B↑
|
26 RRMS и 4 SPMS / 31 HS
|
18
|
|
Akkermansia muciniphila↑, Acinetobacter calcoaceticus↑, Parabacteroides↓
|
71 RRMS / 71 HS
|
19
|
|
Atopobium↑, Bifidobacterium↑, Bacteroidaceae↓
|
54 MS/HS (кол-во в контроле не указано)
|
20
|
|
Bacteroides fragilis↓, Butyrivibrio↓, Clostridium↓, Coprococcus↓, Eubacterium rectale↓, Faecalibacterium prausnitzii↓, Lawsonella↑, Roseburia↓
|
129 RRMS/58 HS
|
21
|
|
Bacteroides↓, Faecalibacterium prausnitzii↓, Roseburia↓
|
25 RRMS/14 HS
|
22
|
|
Firmicutes/Bacteroides ratio↑, Prevotella↓, Streptococcus↑
|
19 RRMS/17 HS
|
23
|
|
Bacteroides coprocola↓, Bacteroides coprophilus↓, Bacteroides stercoris↓, Eggerthella lenta↑, Prevotella copri↓, Streptococcus thermophilus↑, Sutterella wadsworthensis↓
|
20 RRMS/40 HS
|
24
|
|
Bacteroides↓, Faecalibacterium↓, Ruminococcus↑
|
5 RRMS/8 HS
|
25
|
|
Bilophila↓, Blautia↑, Butyricicoccus↓, Clostridium XIVb↓, Dorea↓, Faecalibacterium↓, Flavonifractor↑, Gemella↓,
Granulicatella↓, Haemophilus↓, Roseburia↓
|
22 RRMS/33 HS
|
26
|
|
Faecalibacterium↓
|
34 RRMS/165 HS
|
27
|
|
Akkermansia↑, Clostridium↑, Prevotella↓
|
40 RRMS, мультиэтническое происхождение /41 HS
|
28
|
|
Prevotella↓
|
13 RRMS/14 HS
|
29
|
|
Coprococcus↓, Lachnospira↓, Roseburia↓, Streptococcus↑
|
26 RRMS/38 HS
|
30
|
|
Akkermansia↑, Coprococcus↓, Roseburia↓
|
12 SPMS/38 HS
|
30
|
|
Akkermansia↑
|
34 пары близнецов MS/HS
|
31
|
|
Akkermansia↑, Blautia wexlerae↓, Clostridium bolteae↑, Dorea formicigenerans↓, Erysipelotrichaceae CCMM↓, Ruthenibacterium lactatiformans↑
|
199 RRMS и 44 с прогрессирующим MS/40 HS
|
32
|
|
Anaerococcus vaginalis↓, Blautia faecis ↓, Clostridium g24 FCEY↑, Dorea longicatena↓,
Enterobacteriaceae↑, Ruminococcaceae FJ366134↑
|
44 с прогрессирующим MS/199 RRMS и 40 HS
|
32
|
|
Akkermansia↑, Clostridium↑, Eubacterium↓, Lachnospiraceae↓, Megamonas↓, Streptococcus↑
|
62 RRMS/55 HS
|
33
|
|
Clostridium↑, Streptococcus↑
|
15 SPMS/55 HS
|
33
|
|
Acinetobacter calcoaceticus↑, Akkermansia muciniphila↑
|
64 MS/64 HS
|
34
|
|
Prevotella↓, Streptococcus↑
|
34 RRMS/34 NMOSD и 34 HS
|
35
|
|
Actinomyces↑, Clostridium III↑, Eggerthella↑, Faecalicoccus↑, Gemmiger↓, Lachnospiraceae↓,
Sporobacter↓, Streptococcus↑
|
19 RRMS/21 RA и
20 CD и 19 UC and 23 HS |
36
|
|
Gemmiger↑, Ruminococcus↑
|
15 PPMS/15 HS
|
37
|
|
Bacteroides↑, Clostridium↓, Coprococcus↓, Firmicutes↓, Methanobrevibacter↓, Paraprevotella↓, Proteobacteria↓,
Ruminococcaceae↓
|
26 RRMS/39 HS
|
38
|
Изменения указаны стрелками. Сокращения: CD - болезнь Крона, HS - здоровые субъекты, NMOSD - расстройство спектра нейромиелита оптического, RA - ревматоидный артрит, RRMS - рецидивирующе-ремиттирующий рассеянный склероз, SP - вторично-прогрессирующий рассеянный склероз, PPMS - первично-прогрессирующий рассеянный склероз, UC - язвенный колит.
Дальнейшие клинические исследования были направлены на изучение факторов, способствующих изменению состава и функции микробиома кишечника при РС.31,40 Исследование, включавшее близнецов, дискордантных по заболеванию, показало взаимодействие экологических и генетических факторов в этой области. 31 Международный консорциум по изучению микробиома рассеянного склероза (International MS Microbiome Study Consortium) объединил пациентов с рассеянным склерозом с домашними HS (чтобы минимизировать влияние диетических привычек) и продемонстрировал связь между изменениями микробиома кишечника и риском РС и стадией заболевания.40,41 На изменчивость микробного состава при РС могут также влиять возраст и пол, компоненты диеты, сопутствующие заболевания и сопутствующая терапия (например, прием антибиотиков).
До сих пор остается спорным, может ли дисбиоз кишечника запускать (через ось кишечник-мозг) аутоиммунный ответ, участвующий в фоне РС, или же он просто отражает нарушенный баланс между про- и противовоспалительными компонентами этого аутоиммунного ответа. Для выяснения этих взаимосвязей и выявления их соответствующих аспектов были проведены экспериментальные и клинические исследования.
Роль дисбиоза кишечника в патологии рассеянного склероза
Экспериментальные исследования
Исследования, проведенные на животной модели РС - экспериментальном аутоиммунном энцефалите (EAE), - показали сходную с человеческими исследованиями картину изменений в микробиоме кишечника, связанную с течением заболевания. Анализ микрофлоры кишечника в предначальной, начальной, пиковой и хронической фазах EAE показал, что численность семейства Lactobacillaceae была снижена, в то время как другие популяции, такие как Clostridiaceae, Ruminococcaceae и Peptostreptococcaceae, увеличивались в течение болезни. 42 Gandy et al. обнаружили различные микробные популяции, характерные для мышей SJL/J с рецидивирующе-ремиттирующей EAE (RR-EAE) и мышей C57BL/6 с хронической прогрессирующей EAE (CP-EAE). У мышей с RR-EAE наблюдалось значительное увеличение численности Bacteroidales (включая Bacteroides, Parabacteroides, Prevotella, Rikenellaceae и Odoribacter) по сравнению с CP-EAE. В свою очередь, у мышей с CP-EAE было выявлено значительно большее количество Akkermansia muciniphila.43 Moles et al. оценили связь между составом микробиома и симптомами заболевания на примере EAE и модели демиелинизации с использованием купризона (последняя характеризуется прогрессирующим течением).44 В обеих моделях в начале клинических симптомов наблюдалось увеличение Firmicutes и снижение Bacteroides, сопровождавшееся заметным уменьшением Actinobacteria, представленных в основном Bifidobacterium. Изменения, характерные только для модели с купризоном, включали явный рост филума Verrucomicrobiota, представленного исключительно Akkermansia, а также популяции Sutterella, которая появилась после воздействия купризона и во время процесса ремиелинизации. Кроме того, разнообразие микробиоты коррелировало с тяжестью демиелинизации и оценкой клинических симптомов.
Дальнейшие экспериментальные исследования предоставили некоторые доказательства причинно-следственной связи между дисбиозом кишечника и аутоиммунным поражением ЦНС. Было показано, что у безмикробных (GF) мышей (лишенных микробиоты кишечника или получавших антибиотики) не развивался EAE или наблюдалась задержка и снижение активности заболевания.45 В свою очередь, колонизация GF-мышей сегментированными нитевидными бактериями приводила к повышению уровня IL-17 в кишечнике, что способствовало пролиферации Th17 и в конечном итоге вызывало развитие EAE. 46 В отличие от этого, моноколонизация Bacteroides fragilis предотвращала EAE у этих мышей, индуцируя толерогенные CD103+ дендритные клетки (DCs)47 и усиливая выработку кишечных клеток Tregs, секретирующих IL-10. 48 Этот защитный эффект B. fragilis был приписан его структурному компоненту, полисахариду A. Еще одно интересное исследование, в котором тестировался один пробиотический штамм - Lactobacillus helveticus49 - на эффект EAE, также показало дифференциальную модуляцию аутоиммунного ответа, что привело к ослаблению EAE. Примеры других бактерий, способных ослаблять EAE, включают штаммы Lactobacillus (Lactobacillus crispatus, Lactobacillus rhamnosus, Lactobacillus paracasei, Lactobacillus plantarum и Lactobacillus reuteri)42,50-52, а также штаммы Bifidobacterium (Bifidobacterium animalis и Bifidobacterium bifidum). 53, 54 Есть также сообщения, демонстрирующие, что сочетание двух пробиотических штаммов - Bifidobacterium animalis с Lactobacillus plantarum55 или Enterococcus faecium с Prevotella histicola56 - усиливало нейровоспаление в модели EAE. Удивительно, но оказалось, что лечение пробиотической смесью из Streptococcus thermophilus, Lactobacillus reuteri, Bifidobacterium bifidum, Lactobacillus acidophilus и Lactobacillus casei во время индукции EAE отсрочило начало заболевания.54
Инфекция ЦНС, вызванная вирусом энцефаломиелита Тайлера (TMEV), - экспериментальная модель прогрессирующего РС - изменила состав микробиоты кишечника мышей SJL/J в сторону умеренного дисбиоза на определенных стадиях заболевания. В острой фазе наблюдалось снижение популяции Alloprevotella, на досимптоматической стадии - Akkermansia и Anaerotruncus, а на хронической стадии - Streptococcus. Напротив, численность Clostridium и Eubacteria увеличивалась на протяжении всего заболевания. Кроме того, TMEV-инфекция увеличивала проницаемость кишечника и количество CD4+ T-клеток в собственной пластинке. 57 Другое исследование на мышиной модели TMEV-инфекции показало ее селективное влияние на микробиоту кишечника с увеличением численности родов Marvinbryantia и Coprococcus. Были выявлены связи между этими бактериальными родами и транскриптомом ЦНС для Т-клеточного рецептора, иммуноглобулинов, основного комплекса гистосовместимости (MHC) и генов комплемента. 58
В модели демиелинизации, вызванной купризоном, у мышей было обнаружено изменение β-разнообразия микробиома кишечника, а также положительная корреляция между относительной численностью некоторых видов (включая Eisenbergiella и Faecalibaculum) и степенью демиелинизации ЦНС и активацией микроглии.59 Более того, поддиафрагмальная ваготомия у мышей, обработанных купризоном, ослабляла демиелинизацию и активацию микроглии в мозолистом теле, а также частично восстанавливала аномальное β-разнообразие микробиоты кишечника (в том числе за счет увеличения относительной численности Lactobacillus и Turicibacter). Эти результаты позволили предположить участие блуждающего нерва (как компонента оси «кишечник-мозг») в патомеханизмах демиелинизации ЦНС, вызванной купризоном.60
Интересные наблюдения были основаны на переносе содержимого кишечника между людьми или животными. Передача фекалий, полученных от мышей с EAE на пике активности заболевания, наивным мышам (до их иммунизации) подавляла развитие заболевания у реципиентов. Было показано, что фекалии животных с EAE (а также нелеченых pwMS) обогащены микроРНК-30d, которая регулирует экспрессию лактазы, необходимой для роста Akkermansia muciniphila. Увеличение численности Akkermansia в кишечнике было связано со стимуляцией Tregs и соответствующих цитокинов, что, предположительно, способствовало улучшению (смягчению) воспаления ЦНС.61
Кроме того, было показано, что введение животным Akkermansia, выделенной из pwMS, улучшает EAE за счет снижения уровня RORγt+ и IL-17, продуцируемых γδ Т-клетками. 32 EAE также развился у мышей GF после трансплантации микробиоты кишечника, полученной от pwMS, в отличие от тех, кто получил ее от HS. 19, 31 Эти результаты свидетельствуют о потенциальной значимости оси микробиота-кишечник-мозг в патогенезе РС.
В целом, приведенные выше данные in vivo свидетельствуют о том, что дисбиоз кишечника функционально связан со смещением регуляторных компонентов аутоиммунного ответа в сторону провоспалительных. Предполагалось, что на эти результаты влияют микробные метаболиты, в основном продукты ферментации SCFA. Было показано, что SCFA (например, пропионат) могут непосредственно влиять на подмножества Т-клеток, снижая дифференцировку Th17-клеток 62 и повышая дифференцировку Tregs и их повышенную супрессивную способность. 63
Более того, было показано, что микробные SCFA влияют на проницаемость ГЭБ 64 и на резидентные клетки ЦНС, такие как микроглия. 65 У мышей с GF по сравнению с мышами с нормальной микрофлорой кишечника снижена экспрессия белков плотного соединения, что приводит к повышению целостности ГЭБ. Проницаемость ГЭБ может регулироваться бактериями, продуцирующими SCFA, или непосредственно их метаболитами, такими как бутират. 64 У мышей GF также наблюдалось аномальное созревание и дифференцировка клеток микроглии; их функция могла быть восстановлена с помощью метаболитов SCFA или после заселения микробиотой, способной продуцировать SCFA. 65
Вышеупомянутые результаты экспериментальных исследований поддерживают дальнейшее тщательное клиническое изучение микробиома кишечника у пациентов с РС, учитывая более сложную природу заболевания по сравнению с животной моделью и наличие дополнительных факторов, сбивающих с толку.
У RRMS-пациентов наблюдалось увеличение количества Akkermansia muciniphila, бактерий, разрушающих муцин, и Acinetobacter calcoaceticus, которые, как было установлено, провоцировали провоспалительную активность in vitro.19 В частности, Akkermansia muciniphila, полученная при РС, усиливала дифференцировку человеческих Т-клеток в сторону Th1-клеток,19 а Prevotella (в других случаях сниженная у больных РС)66 усиливала дифференцировку клеток в сторону Th17-экспансии. Кроме того, Jangi et al. сообщили, что повышенное содержание Akkermansia и Methanobrevibacter положительно коррелирует с экспрессией генов провоспалительных Т-клеток и моноцитов, которые вовлечены в патогенез РС.67 Более того, повышенное содержание антител против Acinetobacter в сыворотке крови больных РС предполагает возможную роль этой бактерии в аутоиммунной перекрестной реактивности.68 Другим примером, связывающим микробные изменения с дисрегуляцией иммунного ответа при РС, является часто выявляемое истощение бактерий Bacteroides,19-25 связанное с более низким уровнем липида 654, лиганда TLR2, имеющего значение для врожденного иммунитета.69 Cekanavicute et al. обнаружили, что определенный вид Bacteroides, Parabacteroides distasonis, может усиливать функцию Tregs in vitro. Таким образом, низкая численность этого вида может приводить к подавлению иммунорегуляторной активности. 34 Кроме того, было обнаружено, что Bacteroides fragilis модулирует созревание иммунной системы с помощью бактериального полисахарида, исправляя недостаток Т-клеток и дисбаланс Th1/Th2, а также вызывая выработку соответствующих цитокинов. 70
Результаты клинических исследований также указывают на некоторые метаболические изменения, потенциально связанные с микробиомом кишечника. У пациентов с RRMS было обнаружено снижение активности микробных продуцентов SCFA, а также снижение уровня их метаболита - масляной кислоты, в отличие от повышенного уровня капроевой кислоты (среднецепочечной FA с провоспалительными свойствами). Отсутствие бутират-продуцирующих Fusobacteria или Methanobrevibacter 38 было связано с более коротким временем до рецидива РС71.
Функциональные различия в микробиоте кишечника были продемонстрированы при различных фенотипах РС.33 Как указывалось выше, у пациентов с RRMS отмечается снижение количества регуляторных бактерий, таких как Parabacteroides и Prevotella (Bacteroidetes), Adlercreutzia и Collinsella (Actinobacteria), а также Erysipelotrichaceae (Firmicutes). 66 Adlercreutzia, Parabacteroides и Prevotella могут перерабатывать фитоэстрогены в мономерные соединения, снижая уровень хемоаттрактивных протеинов-1 и IL-6, тем самым уменьшая окислительный стресс и активность воспалительных цитокинов.72 В свою очередь, Erysipelotrichaceae играют важную роль в метаболизме желчных кислот и обеспечивают гомеостаз на поверхности слизистой оболочки. 73 В отличие от пациентов с RRMS, пациенты с SPMS характеризовались повышенным уровнем маркеров окислительного стресса, таких как: I) увеличение количества микробных генов, участвующих в репарации мутаций ДНК, и II) повышенное соотношение персульфида цистеина к цистеину, что указывает на чрезмерное окисление ДНК.33 Кроме того, наличие штаммов Clostridium как при RRMS, так и при RRMS было связано с более высокими показателями инвалидизации и утомляемости.33
Механистические представления о вкладе микробиома кишечника в развитие рассеянного склероза
Экспериментальные и клинические данные выявили связь между дисбиозом кишечника при РС и дисрегуляцией иммунного ответа, а также измененными метаболическими путями, соответствующими клиническому течению заболевания. Ключевыми моментами этого исследования стали: I) дисбаланс между провоспалительными и противовоспалительными / регуляторными компонентами иммунного ответа на фоне РС и II) способность комменсальных бактерий способствовать развитию про- или противовоспалительного пути через различные механизмы. 74
Влияние на аутоиммунный ответ и индукцию заболеваний
Среди потенциальных механизмов микробиома кишечника, провоцирующих воспаление ЦНС, есть данные о молекулярной мимикрии - перекрестной реактивности между самоантигенами ЦНС и микробными пептидами. Определенное сходство было обнаружено между основным белком миелина (MBP) и белками видов Bacteroides и Bifidobacterium. Гомологичная реактивность клонов CD4+ T-клеток была продемонстрирована также для эпитопов MBP и GDP-L-фукозосинтазы Akkermansia и Prevotella. Влияние бактерий из семейства Erysipelotrichaceae и L. reuteri на EAE было связано с молекулярной мимикрией белка миелин-олигодендроцитов (MOG).75,76
Кроме того, было установлено, что продукты жизнедеятельности бактерий (например, пептидогликан или N-ацетилмурамилдипептид) стимулируют рецепторы на антигенпрезентирующих клетках, вызывая выработку провоспалительных медиаторов и способствуя активации сторонних лимфоцитов.
Другие патогенные механизмы влияния микробиома кишечника на аутореактивное воспаление ЦНС могут быть связаны с его прямым воздействием на иммунокомпетентные клетки. Некоторые микробы (например, сегментированные нитчатые бактерии) способны индуцировать дифференцировку Th17-клеток в подвздошной кишке. Провоспалительные свойства этих клеток могут быть активированы присутствием некоторых пищевых соединений (солей или длинноцепочечных жирных кислот). После миграции в лимфатические узлы клетки Th17 могут снижать порог активации аутореактивных Т-клеток, способствуя развитию аутоиммунного ответа.
Интересно, что защитные противовоспалительные эффекты наблюдались и в отношении других бактерий (Clostridia, Bacteroides, Prevotella). Было высказано предположение, что эти эффекты связаны с их особыми компонентами, такими как полисахарид А и липид 654, лиганд TLR2. Соответствующая роль этих молекул включает влияние на дифференцировку Treg в толстой кишке, содействие расширению FoxP3+ Tregs, коррекцию дисбаланса Th1/Th2, стимулирование выработки противовоспалительных цитокинов, индукцию толерогенных DCs и супрессивных макрофагов. 10,47,48,70,75
Влияние на метаболические пути и их связь с иммунной системой и центральной нервной системой
Метаболиты микробиома кишечника участвуют в ряде метаболических путей, имеющих отношение к воспалительным и нейродегенеративным процессам в ЦНС.
SCFAs
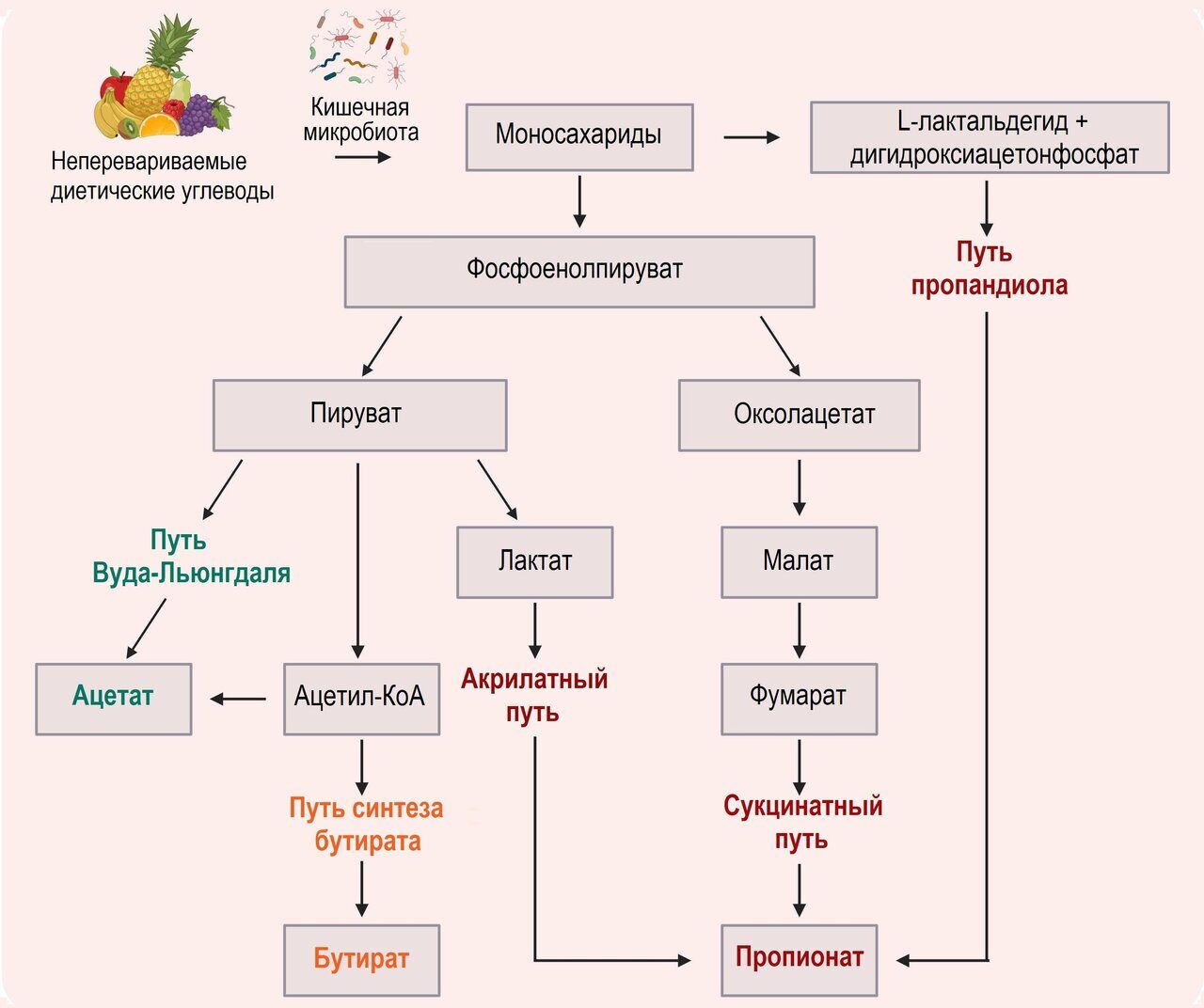
Короткоцепочечные жирные кислоты (SCFAs), побочные продукты ферментации сложных и неперевариваемых углеводов в толстой кишке, т.е. ацетат (C2), пропионат (C3) и бутират (C4) (рис. 2), известны как мощные иммуномодуляторы. Кроме того, SCFAs способны преодолевать ГЭБ, что связано с экспрессией: I) протон- или натрий-зависимых монокарбоксилатных транспортеров (MCT и SMCT, соответственно) и II) различных рецепторов, включая внеклеточные рецепторы, связанные с белками G (GPR), а именно рецепторы свободных жирных кислот (FFAR), которые широко экспрессируются в различных тканях и иммунных типах клеток.77 Эти данные предполагают прямое влияние SCFAs на функции резидентных клеток ЦНС, влияющих на гомеостаз (Таблица 2). Основные процессы, запускаемые SCFAs, включали активацию FFAR2 и FFAR3, также известных как GPR43 и GPR41.77 SCFAs активируют сигнальные пути ERK,78 JNK,62,78 p38-MAPK62 NRF281 и NF-κB78, которые модулируют активность как врожденных, так и адаптивных иммунных клеток. Также было замечено, что метаболиты SCFAs - ацетат, пропионат и бутират - способствуют выработке IL-10 и FoxP3 на периферии 88 и ингибируют TNF-α и IL-1β в ЦНС90 Кроме того, попадая в клетки, SCFAs могут ингибировать деацетилазу гистонов (HDACs)80,82,84,86 и непосредственно влиять на экспрессию генов, вызывая, в частности, повышение регуляции регуляторных медиаторов (IL-10, FoxP3)63,80,87,88 или снижение регуляции провоспалительных медиаторов (iNOS, IL-6 и IL-12).84
Рисунок 2. Метаболические пути бактериальной ферментации, приводящие к образованию компонентов короткоцепочечных жирных кислот
Таблица 2. Механизмы действия бактериальных метаболитов жирных кислот на события, связанные с рассеянным склерозом.
|
Жирно-кислотные метаболиты
|
Влияет на
|
Предложенный механизм
|
Модель исследования
|
Ref
|
|
Формиат, ацетат
пропионат, бутират, пентаноат
|
Различные ткани и клетки млекопитающих
|
Активация FFAR2 и FFAR3
|
In vitro
|
77
|
|
Ацетат
|
Микроглия
|
Регуляция FFAR3 и подавление пути ERK/JNK/NF-κB.
|
In vitro и
in vivo
|
78
|
|
Ацетат
|
Липиды
|
Повышение метаболизма ацетил-КоА изменяет метаболизм жирных кислот и содержание ганглиозидов GD3 и GD1a, предотвращает потерю миелина и холестерина (но не холестериловых эфиров) и восстанавливает уровень цитозольной фосфолипазы A2 (cPLA2)
|
In vivo
|
79
|
|
Пропионовая кислота
|
Т-клетки
|
Супрессивная способность за счет продуцирующих IL-10 Treg-клеток и повышенного митохондриального дыхания
|
In vitro и
ex vivo
|
63
|
|
Пропионат
|
Т-клетки
|
Ингибирование HDAC повышает экспрессию IL-10 и FoxP3 в FFAR2-зависимой манере
|
In vivo
|
80
|
|
Пропионат
|
ГЭБ
|
Ингибирование путей, связанных с неспецифическими микробными инфекциями, через CD14-зависимый механизм, подавление экспрессии LRP-1 и защита ГЭБ от окислительного стресса через Nrf2 (NFE2L2) сигнализацию
|
Ex vivo и
in vitro
|
81
|
|
Бутират
|
Т-клетки
|
Индуцированная экспансия Tregs за счет усиленного ацетилирования гистона H3 в промоторе и консервативных областях некодирующих последовательностей локуса FoxP3
|
In vivo
|
82
|
|
Бутират
|
Т-клетки
|
Облегчение TGF-β1-зависимой генерации FoxP3+ Tregs, индукция экспрессии T-bet и IFN-γ, а также индукция ацетилирования H3 в локусе tbx21 и Ifnγ во время их дифференцировки, и содействие поляризации Th1 в FFAR2-, FFAR3- и SMCT1-независимой манере.
|
In vivo
|
83
|
|
Бутират
|
Макрофаги
|
Снижение уровня провоспалительных медиаторов, включая iNOS, IL-6 и IL-12 - эффекты, опосредованные ингибированием деацетилаз гистонов
|
In vitro and
in vivo
|
84
|
|
Бутират
|
Олигодендроциты
|
Вызывал подавление демиелинизации и усиление ремиелинизации; эти эффекты не зависели от микроглии и, вероятно, были опосредованы его активностью как ингибитора HDAC
|
In vivo
|
85
|
|
Бутират, пропионат и валерат
|
Т-клетки
|
Увеличение числа Tregs при поступлении бутирата связано с потенцированием экстратимической дифференцировки Tregs, зависящей от интронного энхансера консервативной некодирующей последовательности 1 и потенцированной пропионатом de novo генерации Tregs на периферии, другой SCFA, способной ингибировать деацетилазу гистонов
|
In vivo
|
86
|
|
Валерат/пентаноат
|
Т-клетки и В-клетки
|
Повышение окисления глюкозы, опосредованное пентаноатом, запускающим сигнальный путь Akt/mTOR (увеличение продукции IL-10 клетками Bregs и эффекторными Т-клетками), а также его HDAC-ингибирующая активность (снижение экспрессии IL-17A)
|
In vivo
|
87
|
|
SCFAs
|
Проницаемость ГЭБ
|
Повышенная экспрессия белков плотного соединения окклюдина и клаудина-5
|
In vivo
|
64
|
|
SCFAs
|
Т-клетки
|
Расширение кишечных Tregs путем подавления JNK1 и p38-MAPK пути
|
In vivo
|
62
|
|
SCFAs
|
Т-клетки
|
Двунаправленные регуляторные потенциалы, обусловленные: 1) индукцией Т-клеток, продуцирующих IL-10, и 2) стимулированием экспрессии IL-10 путем кондиционирования резидентных APC в ЦНС.
|
In vitro и
in vivo
|
88
|
|
SCFAs
|
Микроглия
|
Понижение уровня FFAR2 ответственно за дефекты микроглии.
|
In vivo
|
89
|
|
SCFAs
|
Микроглияподобные клетки
|
Снижение секреции IL-1β, MCP-1, TNF-α и цитотоксинов (эффект, не опосредованный FFAR2/3), а также снижение фагоцитарной активности и продукции АФК.
|
In vitro
|
90
|
|
SCFAs
|
Проницаемость ГЭБ
|
Снижение экспрессии белков плотных соединений окклюдина и клаудина-5.
|
In vivo
|
64
|
|
LCFAs
|
Т-клетки
|
Усиленная дифференцировка и пролиферация клеток Th1 и/или Th17 и нарушение их секвестрации в кишечнике по пути p38-MAPK.
|
In vivo
|
62
|
Сокращения: Akt – серин/треониновая протеинкиназа, APC – антигенпрезентирующая клетка, ГЭБ – гематоэнцефалический барьер, ЦНС – центральная нервная система, cPLA2 – цитозольная фосфолипаза А2, ERK – внеклеточная сигнал-регулируемая киназа, FFAR – рецептор свободных жирных кислот, HDAC – гистондеацетилаза, iNOS – индуцированная синтаза оксида азота, JNK – Jun N-концевая киназа, LCFA – длинноцепочечная жирная кислота, MAPK – митоген-активируемая протеинкиназа, MCP-1 – моноцитарный хемоаттрактантный белок 1, mTOR – мишень рапамицина у млекопитающих , NFE2L2 – связанный с NFE2 фактор 2, NFκB - усилитель легкой цепи ядерного фактора каппа активированных В-клеток, Nrf2 – фактор-2, связанный с эритроидным ядерным фактором 2, АФК – активные формы кислорода, SCFA – жирные кислоты с короткой цепью, SMCT1 – транспортер 1 монокарбоксилата, связанный с натрием.
Сообщалось также, что SCFAs поддерживают и повышают целостность ГЭБ за счет увеличения экспрессии белков плотного соединения окклюдина и клаудина-5. 64 У пациентов с РС, имевших более низкое соотношение масляной кислоты (BA) / капроновой кислоты (CA), наблюдалась более высокая проницаемость кишечника и большее количество Th1-клеток. Увеличение соотношения BA/CA положительно коррелировало с подмножествами Treg-клеток и отрицательно - с IFN-γ-продуцирующими лимфоцитами. 30
Более того, считается, что ацетат-опосредованный синтез жирных кислот в олигодендроцитах и HDAC-зависимое действие бутирата способствуют защите олигодендроглии ЦНС, подавляя демиелинизацию79 и усиливая ремиелинизацию.85
Полиненасыщенные жирные кислоты
Полиненасыщенные жирные кислоты (ПНЖК) характеризуются наличием множества двойных связей в цепи жирной кислоты, что определяет их свойства. Особый интерес вызывают ПНЖК омега-3, например, α-линоленовая кислота (ALA), эйкозапентаеновая кислота (EPA) и докозагексаеновая кислота (DHA). Омега-3 ПНЖК могут изменять разнообразие и численность микроорганизмов в кишечнике, особенно влияя на полезные бактерии, такие как Bifidobacterium и Akkermansia. Кроме того, они улучшают функцию слизистого барьера кишечника, увеличивая его толщину и уменьшая повреждения, вызванные воспалительными и окислительными процессами (например, ЛПС, перекисью водорода, повышенной митохондриальной активностью).91 Что еще более важно, омега-3 ПНЖК регулируют гомеостаз кишечника и его иммунитет. Известно, что они модулируют кишечный иммунитет через ядерный транскрипционный фактор κB (NF-κB) и сигнальные пути MAPK92 , а также через метаболический путь арахидоновой кислоты.93 Эти кислоты также обладают способностью контролировать уровень провоспалительных (например, эндотоксинов и IL-17) и противовоспалительных (например, SCFAs и их солей) медиаторов. 94
Метаболиты триптофана
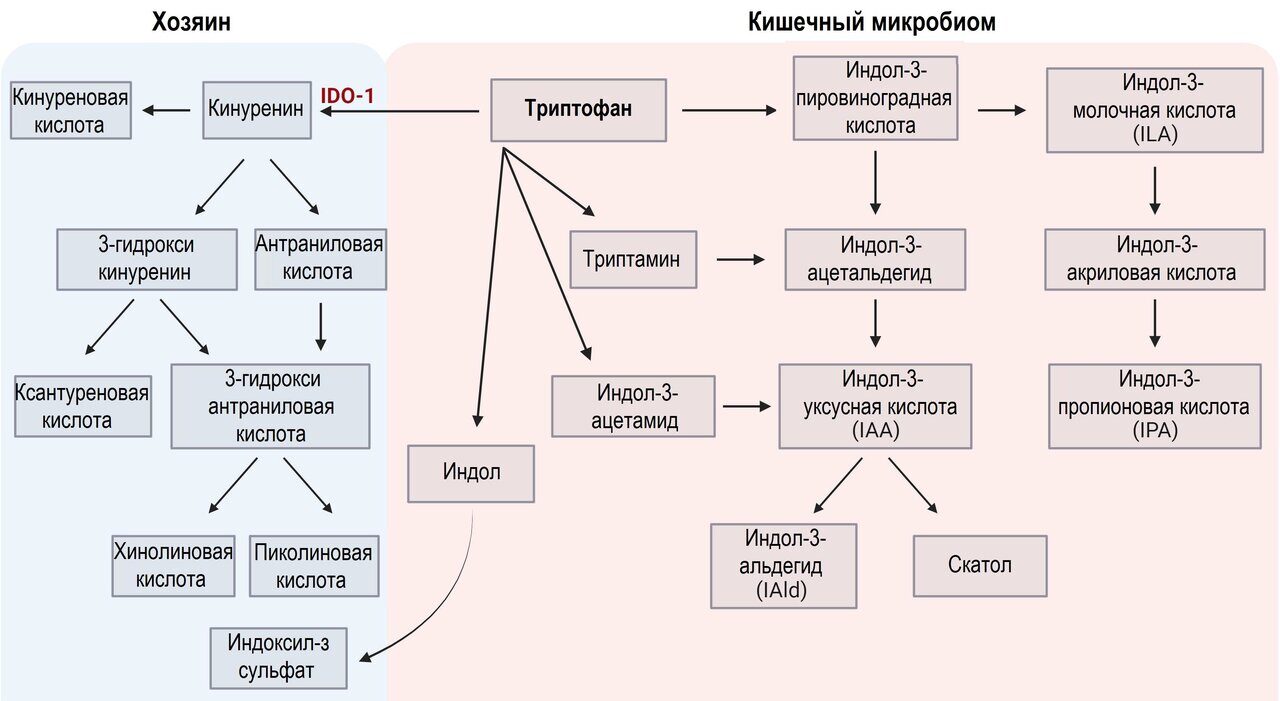
Триптофан - незаменимая аминокислота, метаболизируемая микробиотой кишечника в индол-содержащие соединения. В частности, было показано, что штаммы Lactobacillus напрямую используют триптофан в качестве субстрата и метаболизируют его в индол-3-молочную кислоту (ILA), индол-3-уксусную кислоту (IAA) и индол-3-альдегид (IAld) в кишечнике. 95 Более того, сам триптофан может транспортироваться из кишечника в кровоток и метаболизироваться по кинурениновому и серотониновому пути (Рисунок 3). Как триптофан, так и его метаболиты могут действовать как мощные иммуномодуляторы, связываясь с рецептором ариловых углеводородов (AhR) (Таблица 3). У пациентов с RRMS были обнаружены различные уровни циркулирующих лигандов AhR в зависимости от активности заболевания. 96
Рисунок 3. Пути метаболизма триптофана.
Показан только катаболизм триптофана по индольному и кинуреиновому путям; серотонический путь исключен. Индольный путь происходит в просвете кишечника через микробиом кишечника, хотя триптофан также может быть преобразован в кинурин в организме хозяина через индоламин-2,3-диоксигеназу (IDO-1).
Таблица 3. Механизмы действия метаболитов триптофана на события, связанные с развитием РС.
|
Метаболит(ы)
триптофана
|
Влияет на
|
Предложенный механизм
|
Модель исследования
|
Ref
|
|
I3C, индол, I3S, индирубин, кинуренин
|
Лиганды AhR
|
Снижение уровня циркулирующих лигандов AhR при RRMS по сравнению с активным РС или доброкачественным РС
|
Ex vivo
|
96
|
|
IPA, I3C
|
Т-клетки
|
Защита от заболевания, опосредованная диетическим триптофаном, через микробиота-зависимое ослабление аутореактивных Т-клеток
|
In vivo
|
97
|
|
IAld
|
Т-клетки
|
Подавление поляризации Th17 и выработки IL17
|
In vivo
|
98
|
|
IAld
|
Поверхность слизистой оболочки
|
Индукция мукозального IL-22 через AhR
|
In vivo
|
99
|
|
IPA
|
Поверхность слизистой оболочки
|
Регулирование целостности слизистой оболочки через PXR-зависимый способ и TLR4-сигнализацию
|
In vivo
|
100
|
|
I3S, IPA и IAld
|
Астроциты
|
I3S, IPA и IAId опосредованно ограничивают выработку Il-6, TNF-α, CCL2 и iNOS в астроцитах посредством AhR-сигнализации, что приводит к улучшению состояния при РС
|
In vivo
|
101
|
|
I3S
|
Микроглия и астроциты
|
Диетические метаболиты триптофана контролируют микроглиальную активацию, выработку TGF-α и VEGF-B и модулируют активность астроцитов через AhR
|
In vivo и
in vitro
|
102
|
|
Метаболиты кинуренина
|
ГЭБ
|
Базолатеральная секреция кинуренина (эндотелиальными клетками ГЭБ), далее метаболизируется до хинолиновой кислоты, что приводит к нейротоксическому эффекту
|
In vitro
|
103
|
|
Метаболиты кинуренина
|
Т-клетки
|
Подавляющий эффект Т-клеток, опосредованный IDO-1, приводит к более хронической форме активации пути кинуренина, что приводит к прогрессированию рассеянного склероза за счет продукции эксайтотоксичной хинолиновой кислоты и увеличения соотношения хинолиновая кислота/кинуреновая кислота за счет инфильтрации макрофагов.
|
Ex vivo
|
104
|
|
Хинолиновая кислота
|
Микроглия
|
Обнаруживаемое количество продукции хинолиновой кислоты микроглией, недостаточная выработка хинолиновой кислоты нейронами
|
In vitro
|
105
|
|
Лаквинимод
|
Астроциты
|
Улучшение состояния за счет активации AhR в астроцитах с помощью лаквинимода
|
In vivo
|
106
|
Сокращения: AhR - арил-углеводородный рецептор, ГЭБ - гематоэнцефалический барьер, CCL2-хемокиновый (С-С мотив) лиганд 2, I3C - индол-3-карбинол, I3S - индол-3-сульфат, IAld - индол-3-альдегид, IDO-1-индоламин-2,3-диоксигеназа, iNOS - индуцированная синтаза оксида азота, IPA - индол-3-пропионовая кислота, PXR - прегнан X-рецептор, RRMS - рецидивирующий рассеянный склероз, TLR - толл-подобный рецептор, VEGF-B - сосудистый эндотелиальный фактор роста B.
Метаболиты триптофана могут модулировать дифференцировку подмножеств Т-клеток, либо способствуя развитию Th1/Th17 клеток, либо генерируя Tregs.97,107 Было обнаружено, что IAld ингибирует поляризацию Th17, снижает продукцию IL1798 и индуцирует мукозальный IL-22 через AhR.99 Благоприятное влияние лактобацилл на исход EAE было приписано свойствам этого метаболита.51,108 Индол и индол-3-пропионовая кислота (IPA) также способствуют образованию плотных соединений, действуя непосредственно на эпителиальные клетки в зависимости от прегнан X рецептора (PXR).100
Продукты метаболизма кинуренинового пути могут влиять на эпителиальные клетки мозга в зависимости от состояния. В основном эндотелиальные клетки превращают триптофан в кинуреновую кислоту. Однако в присутствии провоспалительных цитокинов, TNF-α и IFN-γ, эндотелиальные клетки экспрессируют индоламин-2,3-диоксигеназу (IDO-1), которая превращает триптофан в кинуренин, далее метаболизируемый периваскулярными макрофагами и микроглией в хинолиновую кислоту.103 Сообщалось, что продукция хинолиновой кислоты активированной микроглией и инфильтрирующими макрофагами оказывает нейровоспалительное и нейродегенеративное действие. 105 Повышенное соотношение хинолиновой кислоты и кинуреновой кислоты у пациентов с прогрессирующим типом РС может предполагать, что хинолиновая кислота имеет отношение к нейродегенеративному компоненту фона заболевания. 104 С другой стороны, индолсодержащие метаболиты, а именно индол-3-сульфат (I3S), IPA и IAld, ограничивают выработку Il-6, TNF-α, CCL2 и iNOS астроцитами, что приводит к облегчению течения заболевания.101 Кроме того, было показано, что диетические метаболиты триптофана контролируют микроглиальную активацию и выработку TGF-α и VEGF-B, и, как следствие, модулируют активность астроцитов через AhR.102 Было высказано предположение, что улучшение течения болезни в животных моделях РС с помощью синтетических производных индола опосредовано AhR-сигнализацией в астроцитах106
Помимо этих основных метаболических путей с участием триптофана (лиганды AhR и PXR), есть также некоторые доказательства значимости других (например, триптофан-производных серотонина)109 в связях между микробиомом кишечника и РС, ч требует дальнейших исследований.
Полиамины
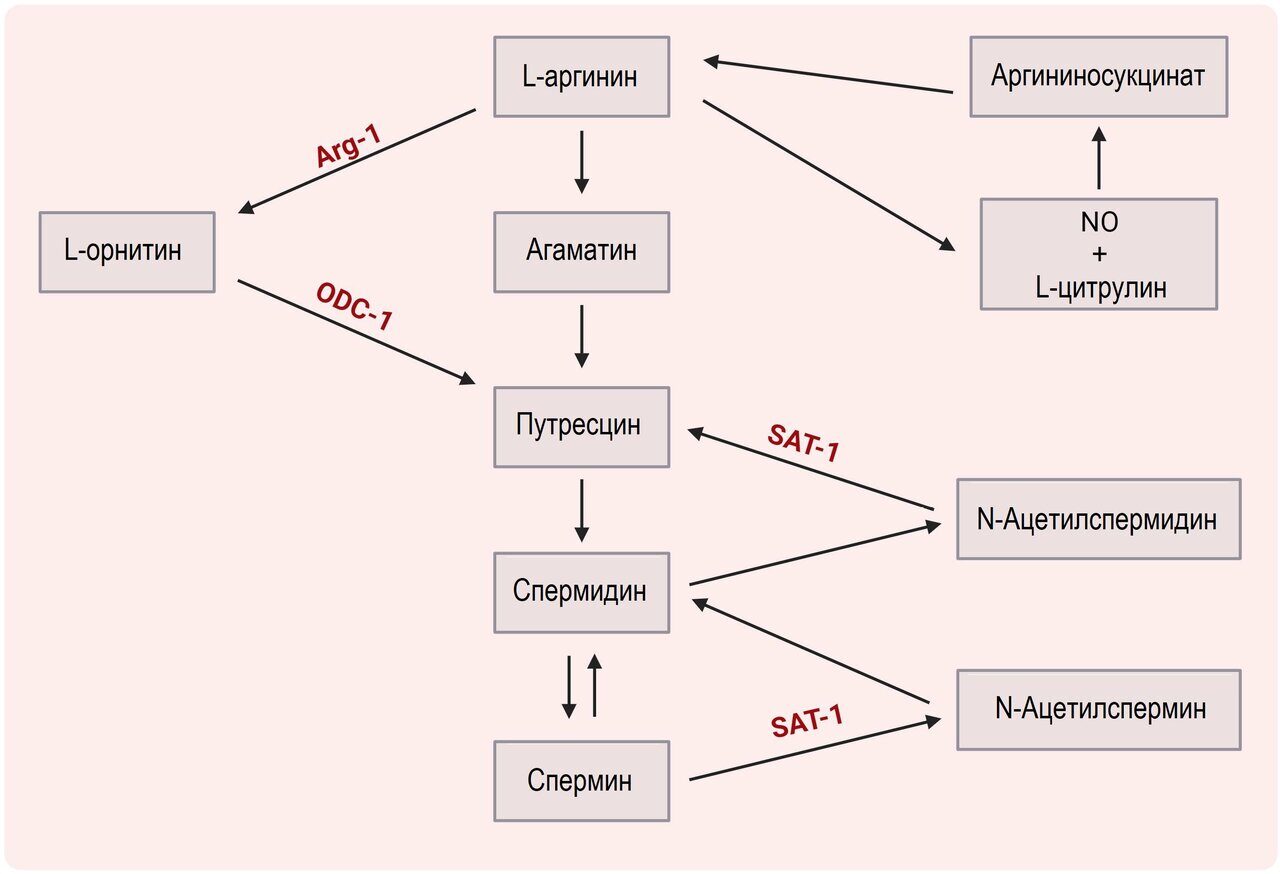
Полиамины (путресцин, спермидин и спермин), образующиеся в результате метаболического пути L-аргинина (рис. 4), могут вырабатываться как хозяином, так и микробиотой кишечника (т.е. Bacteroides thetaiotaomicron, Fusobacterium varium, Enterococcus, Bifidobacterium).
Рисунок 4. Метаболизм полиаминов.
Сокращения: Arg-1 - аргиназа 1, ODC-1 - орнитиндекарбоксилаза 1, SAT-1 - спермидин/спермин N1 ацетилтрансфераза 1.
Эти соединения могут уменьшать нейровоспаление путем модуляции Т-клеток или модуляции микроглии/макрофагов (табл. 4). Было обнаружено, что спермидин сдвигает поляризацию Th17-клеток в сторону Tregs в кишечнике мышей TGF-β-зависимым образом. 111 Поразительно, что подавление орнитин-декарбоксилазы 1 (ODC-1) или спермидин/спермин N1-ацетилтрансферазы 1 (SAT-1) - ферментов, участвующих в метаболизме полиаминов, - может специфически ограничивать функцию Th17 в путресцин-зависимом режиме. 110
Таблица 4. Механизмы действия полиаминовых метаболитов на события, связанные с развитием РС.
|
Метаболит(ы) полиаминов
|
Влияет на
|
Предложенный механизм
|
Модель
исследования
|
Ref
|
|
Путресцин
|
Т-клетки
|
Подавление ODC1 или SAT1 ограничивает функцию Th17 путресцин-зависимым образом
|
In vitro
|
110
|
|
Спермидин
|
Т-клетки
|
Сдвиг поляризации клеток Th17 в сторону дифференцировки FoxP3+ Treg в зависимости от TGF-β
|
In vitro and
in vivo
|
111
|
|
Спермидин
|
Макрофаги и Т-клетки
|
Синергическое действие на активацию и пролиферацию Т-клеток путем: I) подавления экспрессии провоспалительных цитокинов IL-1β, IL-12 и ко-стимуляторных молекул CD80 и CD86 в макрофагах за счет снижения активности пути NF-κB и II) повышения экспрессии Arg-1 в макрофагах, что приводит к переходу к фенотипу M2
|
In vivo
|
112
|
|
Спермидин
|
Астроциты
|
Подавление продуцируемых астроцитами хемокинов (MIP-1α, MCP-1, RANTES)
|
In vivo
|
113
|
|
Спермидин, спермин
|
Т-клетки
|
Подавление экспрессии LFA-1 на Т-лимфоцитах человека
|
Ex vivo и
in vitro
|
114
|
Сокращения: Arg-1 - аргиназа 1, LFA-1 - ассоциированный с функцией лимфоцитов антиген 1, MCP-1 - моноцитарный хемоаттрактантный протеин-1, MIP-1α - макрофагальный воспалительный протеин-1α, NFκB - усилитель легкой цепи ядерного фактора каппа активированных В-клеток, ODC-1 - орнитиндекарбоксилаза 1, RANTES - хемокиновый (С-С мотив) лиганд 5 (хемокин, участвующий в миграции Т-клеток и других лимфоидных клеток), SAT-1 - спермидин/спермин N1 ацетилтрансфераза 1.
После лечения спермидином наблюдалось улучшение EAE, связанное с уменьшением секреции провоспалительных цитокинов IL-1β и IL-12, снижением уровней ко-стимулирующих молекул CD80 и CD86 за счет ингибирования пути NF-κB и повышения экспрессии аргиназы 1 (Arg-1) в макрофагах 112, что привело к переходу к фенотипу M2. Также сообщалось, что спермин и спермидин уменьшают инфильтрацию иммунных клеток в ЦНС в результате снижения высвобождения хемокинов, продуцируемых астроцитами, таких как MIP-1a, MCP-1 и RANTES 113 или прямого ингибирования LFA-1 на Т-клетках. 114
Полифенолы
Полифенолы можно разделить на флавоноиды (например, апигенин, эпигаллокатехин-3-галлат, гесперидин А) и нефлавоноиды (например, ресвератрол). Они оказывают защитное действие на нейроны, противодействуя окислительному стрессу и подавляя провоспалительный путь NF-κB. Микробиота кишечника способствует биотрансформации полифенолов в их биодоступные формы и активные метаболиты, участвующие в синтезе нейротрансмиттеров.
Эллаговая кислота, еще одно полифенольное соединение, метаболизируется в кишечнике бактериями Gordonibacter urolithinfaciens и Gordonibacter pamelaeae и образует уролитины. Исследования показали, что уролитины оказывают влияние на Т-клетки, DCs, микроглии, олигодендроциты и нейроны (табл. 5). Интересно, что эллаговая кислота, предшественник уролитина А, защищает от миелин-ассоциированной потери сфинголипидов, влияя на синтез церамида.120 Кроме того, Zhang et al. сообщили, что активация и пролиферация Т-клеток может быть подавлена уролитином А через вмешательство в кальциевый механизм на основе miR-10a-5p-зависимого механизма.115 В соответствии с этим наблюдалось снижение инфильтрации Th1/Th17 клеток и моноцитов в ЦНС за счет воздействия на AhR.116 Влияние приема уролитина А также включало снижение уровней ко-стимулирующих молекул CD80, CD86 и MHC-II на DCs, а также снижение доли провоспалительного типа микроглии M1.116
Таблица 5. Механизмы действия метаболитов уролитина на события, связанные с развитием РС.
|
Метаболит(ы) уролитина
|
Влияет на
|
Предложенный механизм
|
Модель исследования
|
Ref
|
|
Уролитин A
|
Т-клетки
|
Подавление активации и пролиферации Т-клеток путем модуляции кальциевого механизма (снижение экспрессии Orai1/STIM1/2) на основе miR-10a-5p-зависимого эффекта.
|
In vivo
|
115
|
|
Уролитин A
|
Т-клетки, DC и микроглия
|
Снижение уровня CD80, CD86 и MHC-II на DC, уменьшение количества микроглии типа M1, активированных DC, а также снижение инфильтрации Th1/Th17 клеток и моноцитов за счет таргетного воздействия на AhR и модуляции сигнальных путей
|
In vitro и
in vivo
|
116
|
|
Уролитин A
|
Целостность кишечного барьера
|
Регуляция белков эпителиального плотного соединения через AhR и Nrf2-зависимые пути
|
In vitro и
in vivo
|
117
|
|
Уролитин A
|
Нейроны
|
Нейропротекторный и противовоспалительный эффект за счет активации/фосфорилирования сигнальных путей AMPK, p65NFκB, p38MAPK и BACE1
|
In vivo
|
118
|
|
Уролитин A и
уролитин B
|
Микроглия и нейроны
|
Снижение секреции провоспалительных маркеров (NO, IL-6, простагландина E2, TNF-α), смягчение апоптоза и высвобождения каспаз 3/7 и 9.
|
In vitro
|
119
|
|
Уролитин A и
уролитин B
|
Олигодендроциты
|
Предотвращение потери сфинголипидов, связанных с миелином, путем стимуляции синтеза церамида
|
In vitro и
in vivo
|
120
|
|
Уролитин B
|
Нейроны
|
Нейропротекция за счет подавления активации c-JNK и высвобождения цитохрома c, а также активации ERK и PI3K-пути, а также фосфорилирования и активации Akt и p44/42 MAPK
|
In vivo
|
121
|
Сокращения: AhR - арил-углеводородный рецептор, Akt - серин/треониновая протеинкиназа, AMPK - аденозинмонофосфат-активируемая протеинкиназа, BACE1 - β-сайт фермента расщепления белка-предшественника амилоида 1, DC - дендритная клетка, ERK - внеклеточная сигнал-регулируемая киназа, JNK - Jun N-концевая киназа, MAPK - митоген-активируемая протеинкиназа, MHC-II - главный комплекс гистосовместимости класса II, NFκB - ядерный фактор «каппа-би», Nrf2 - фактор-2, связанный с эритроидным ядерным фактором 2, Orai1 - активируемый высвобождением кальция кальциевый модулятор 1, PI3K - фосфоинозитид-3-киназа, STIM - молекула взаимодействия стромальных клеток.
Кроме того, было показано, что уролитин А снижает эпителиальную кишечную проницаемость и ослабляет воспаление в Ahr-Nrf2-зависимой форме через модуляцию белков плотного соединения.117 Нейропротекторный эффект уролитинов был дополнительно связан с сигнальными путями AMPK, MAPK, JNK, ERK.118,119,121
Кишечные бактерии и продукты их жизнедеятельности могут легче распространяться и становиться объектом воздействия иммунной системы из-за нарушения кишечного барьера (феномен «дырявого кишечника»). Это может быть связано с потерей толерантности к бактериальным антигенам и запуском местного иммунного ответа, а также генерализованной аутоиммунной активности. Провоспалительные цитокины (например, IFN-γ и IL-17) могут влиять на функцию кишечных плотных сочленений и способствовать нарушению кишечного барьера. Как уже говорилось выше, целостность кишечника может быть нарушена и метаболическими изменениями (например, снижением уровня ПНЖК или повышением уровня уролитина). В целом, «дырявый кишечник» может быть результатом дисбиоза кишечника, но также усиливать его последствия, что подчеркивает сложность и взаимный характер связей между микробиомом кишечника и воспалительными процессами. 8,75,76
Влияние лечения, модифицирующего болезнь (DMT), на микробиом кишечника при рассеянном склерозе
Согласно современным терапевтическим стандартам, сразу после установления точного диагноза РС необходимо начать DMT, направленную на достижение контроля над активностью РС и поддержание стабильного состояния пациентов. Благодаря значительному прогрессу в знаниях о предыстории РС в настоящее время доступны несколько DMT, различающихся по эффективности и иммуномодулирующим/иммуносупрессивным свойствам, что позволяет индивидуализировать терапевтическую стратегию. Однако DMT в основном подходят для лечения RRMS и направлены на воспалительные процессы, в то время как лечение прогрессирующей фазы РС, включая нейропротективные и ремиелинизирующие эффекты, по-прежнему остается сложной задачей. Поэтому в этой области ведутся постоянные исследования в поисках поддерживающих или новых терапевтических вариантов.
В уже упоминавшемся крупном исследовании, включавшем пациентов с РС совместно с домашними здоровыми субъектами (HS)41, состав микробиома кишечника у пациентов с РС отличался между теми, кто не получал лечения, и теми, кто получал DMT. Некоторые изменения бактериальных таксонов, обнаруженные в подгруппе больных РС без лечения по сравнению с HS (включая виды Parabacteroides и Akkermansia), не были воспроизведены в подгруппе, получавшей DMT. Более того, применение DMT было связано с изменениями в видах микроорганизмов, которые не отличали нелеченых субъектов с РС от контрольных (например, уменьшение видов Bacteroides, Clostridium, Roseburia, Prevotella и Blautia и увеличение Phascolarctobacterium и Eubacterium).
Влияние отдельных DMT на микробиом кишечника изучалось и ранее, но обычно на небольших и/или гетерогенных группах (табл. 6). Необходимо учитывать разнообразие в способе действия DMT и способе введения (инъекционный или пероральный).
Таблица 6. Модуляция микробиоты кишечника у пациентов с РС после определенной болезнь-модифицирующей терапии.
|
Отмеченные наблюдения
|
Выявлено в / по сравнению с
|
Лечение
|
Ref
|
|
Различия в: Bacteroidaceae, Clostridium,
other Clostridiales, Faecalibacterium,
Lactobacillaceae, Ruminococcus
|
5 RRMS с DMT / 2 RRMS без лечения
|
5 RRMS с лечением GA,
2 RRMS без лечения
|
25
|
|
Bifidobacterium↓, Faecalibacterium↑
|
36 RRMS с DMT / 165 HS
|
27 RRMS с лечением DMF
3 RRMS с лечением GA,
3 RRMS с лечением пегинтерфероном-β1a,
2 RRMS с лечением IFN-β1b,
1 RRMS с лечением IFN-β1a
|
27
|
|
Alistipes↑, Anaerotruncus↑, Butyricicoccus↓,
Clostridium cluster IV↑, Gemminger↓,
Intestinibacter↓, Lactobacillus↑,
Methanobrevibacter↑, Olsenella↑,
Parabacteroides↑, Roseburia↓,
Ruminococcus↑, Sporobacter↑
|
98 РС (в том числе 26 PPMS,
20 доброкачественных РС,
24 активных нелеченых RRMS,
24 RRMS с DMT,
4 RRMS с рецидивом / 120 HS
|
24 RRMS с лечением IFN-β
|
39
|
|
Butyricicoccus↓
|
26 PPMS / 72 РС
(включая 20 доброкачественных РС,
24 активных нелеченых RRMS,
24 RRMS с DMT,
4 RRMS с рецидивом)
|
24 RRMS с лечением IFN-β
|
39
|
|
Akkermansia muciniphila↑, Bacteroides finegoldii↓, Blautia↓, Eisenbergiella tayi↑,
Faecalibacterium prausnitzii↓,
Hungatella hathewayi↑, Roseburia faecis↓,
Ruthenibacterium lactatiformans↑
|
576 РС (367 с DMT, 209 РС без лечения) / 576 домашних HS
|
71 MS с лечением FTY720,
86 MS с лечением DMF,
68 MS с лечением GA,
87 MS с лечением IFN
28 MS с лечением анти-CD20 антителами,
27 MS с лечением NZ,
209 MS без лечения
|
41
|
|
Adlercreutzia↓, Blautia↑, Collinsella↓,
Dorea↑, Haemophilus↑, Lactobacillus↓,
Mycoplana↑, Parabacteroides↓,
Prevotella↓, Pseudomonas↑
|
31 RRMS (20 RRMS с DMT, 11 RRMS без лечения) / 36 HS
|
14 с лечением IFN-β,
1 с лечением GA,
5 с лечением NZ,
11 без лечения
|
66
|
|
Akkermansia↑, Butyricimonas↓,
Methanobrevibacter↑
|
60 RRMS пациентов (32 RRMS с DMT, 28 RRMS без лечения) / 43 HS
|
14 RRMS с лечением GA,
18 RRMS с лечением IFN-β, 28 RRMS без лечения
|
67
|
|
Prevotella↑, Sarcina↓, Sutterella↑
|
32 RRMS с DMT /
28 RRMS без лечения
|
14 RRMS с лечением GA,
18 RRMS с лечением IFN-β, 28 RRMS без лечения
|
67
|
|
Absence of Fusobacteria phylum
|
17 RRMS
(9 RRMS с DMT, 8 RRMS без лечения)
|
5 RRMS с лечением GA,
3 RRMS с лечением IFN-β,
1 RRMS с лечением NZ,
8 RRMS без лечения
|
71
|
|
Различия в: Actinobacteria, Firmicutes,
Lentisphaerae, Proteobacteria,
Prevotella copri при нелеченном РС по сравнению с HS↓,
Prevotella copri при леченном РС по сравнению с нелеченным ↑
|
30 RRMS / 14 HS
|
15 RRMS с лечением IFN-β,
15 RRMS без лечения
|
122
|
|
Clostridiales↓, Firmicutes↓, Fusobacteria↓,
Lachnospiraceae↑, Veillonellaceae↑
|
93 RRMS с DMT / 75 RRMS без лечения
|
33 RRMS с лечением DMF,
60 RRMS с лечением GA
|
123
|
|
Atypical E. coli↑, Enterobacter sp.↑,
Normal E. coli↓
|
34 RRMS с DMT
|
17 RRMS с лечением GA,
17 RRMS с лечением FTY720
|
124
|
|
Bacteroidaceae↓, Bacteroides fragilis↓,
Bifidobacterium↑, Bilophila↑, Butyricimonas↓,
Christensenellaceae↑, Desulfovibrio↑,
Faecalibacterium↓, Lachnospiraceae↓,
Methanobrevibacter↑, Ruminococcaceae↓
|
18 RRMS (9 RRMS с DMT, 9 RRMS без лечения) / 17 HS
|
3, с лечением IFN-β,
5, с лечением GA,
1, с лечением NZ,
9 без лечения
|
125
|
|
Было отмечено несколько ассоциаций между иммунными маркерами и определенной микробиотой кишечника, включая Bacteroidetes и Actinobacteria
|
15 RRMS (7 RRMS с DMT, 8 RRMS без лечения) / 9 HS
|
2 RRMS, с лечением IFN-β,
5 RRMS, с лечением GA,
8 RRMS без лечения
|
126
|
Изменения указаны стрелками. Сокращения: DMF - диметилфумарат, FTY720 - финголимод, GA - глатирамера ацетат, HS – здоровые люди, NZ - натализумаб, PPMS - первично-прогрессирующий рассеянный склероз, RRMS - рецидивирующе-ремиттирующий рассеянный склероз.
Лечение IFN-β было связано со снижением микробного богатства, особенно уменьшением присутствия Ruminococcus sp., Clostridium sp., F. prausnitzii, Roseburia, но с одновременным увеличением Parabacteroides distasonis и Bacteroides uniformis.39,41 Также иногда отмечалось увеличение обилия Prevotella (сравнимое с HS). Интересно, что введение Prevotella histicola трансгенным мышам подавляло EAE так же эффективно, как IFN-β, тогда как комбинация пробиотика и препарата не повышала эффективность лечения.122,127 Аналогичный эффект на численность Prevotella наблюдался у пациентов с РС, получавших глатирамера ацетат (GA).127 В экспериментальной модели введение GA мышам EAE было связано с увеличением количества Prevotella в кишечнике, а комбинированное лечение пробиотиком и GA ослабляло болезнь сильнее, чем только GA.25 В клинических исследованиях лечение GA было связано с уменьшением количества Sutterella и двух семейств Clostridial - Lachnospiraceae и Veillonellaceae123 - а также с увеличением количества атипичных форм E. coli, Enterobacter, Proteus и Parvimonas micra. 124
Аналогично эффекту GA, при обработке диметилфумаратом (DMF) наблюдалось снижение численности Lachnospiraceae и Veillonellaceae, что сопровождалось уменьшением численности Firmicutes и Fusobacteria и увеличением численности Bacteroidetes.123 Также было обнаружено, что DMF специфически уменьшает количество видов Bacteroides stercoris, Clostridium и Eubacterium,41 и, как правило, нормализует низкое обилие Faecalibacterium124 и кратковременное истощение Bifidobacterium,27 хотя эти эффекты не были постоянными во всех исследованиях. Кроме того, DMF и агенты с похожей химической структурой (α, β ненасыщенные карбонилы) подавляли рост Clostridium perfringens in vitro.128 Финголимод и его гомолог сфингозин также были признаны мощными ингибиторами C. perfringens.128 Другие эффекты финголимода на микробиом кишечника включали увеличение количества атипичных форм E. coli, Enterobacter, Proteus и Parvimonas micra,124 а также уменьшение количества Bacteroides finegoldii, Roseburia faecis и Blautia species.41
Существует мало доказательств влияния других DMT на микробный состав. Лечение натализумабом было связано с уменьшением количества Bacteroides uniformis, видов Prevotella и Bifidobacterium longum и увеличением Phascolarctobacterium sp, В то время как у пациентов, получавших анти-CD20 антитела, наблюдалось снижение Bacteroides finegoldii и Blautia sp..41 Эффекты алемтузумаба наблюдались только в обезьяньей модели EAE, при этом наблюдались глубокие изменения в численности Lactobacillales, Enterobacterales, Clostridiales, Prevotella и Faecalibacterium.129
Несмотря на некоторое разнообразие в сообщаемых эффектах DMT на определенные таксоны бактерий, их общее воздействие связано с изменением состава микробиоты кишечника в пользу противовоспалительных штаммов. Было высказано предположение, что DMT оказывают свое иммуномодулирующее / иммуносупрессивное действие в кишечной среде. IFN-β и терифлуномид опосредуют локальную пролиферацию трегов. Было продемонстрировано, что финголимод регулирует миграцию лимфоидных клеток из собственной пластинки кишечника и регулирует созревание плазмобластов в Пейеровых бляшках. Предполагается, что натализумаб, блокируя миграцию Т-клеток, уменьшает их воздействие на микробные антигены и последующую активацию и экспансию. Было установлено, что некоторые из DMT (DMF, GA и алемтузумаб) также стабилизируют кишечный барьер и способствуют целостности тканей.15,123
Другие механизмы, объясняющие влияние DMT на микробиоту кишечника, по-видимому, включают общие метаболические пути. Пути бактериального метаболизма ретинола и метана были идентифицированы как мишени DMF и GA.123 Поскольку фумараты деградируют в цитратном цикле, при лечении DMF наблюдалось увеличение промежуточных продуктов позднего цитратного цикла как в сыворотке крови пациентов, так и в метаболизме микробов кишечника.130 Ингибирующий эффект DMF на рост Clostridium perfringens нейтрализовался глутатионом (обладающим антиокислительными свойствами), что говорит о модуляции окислительного стресса как еще одной потенциальной связи между DMT и бактериями.128 Результаты обширного метаболомного анализа в сыворотке и стуле пациентов с РС41 показали, что пути, связанные с синтезом лизина, L-орнитина, сахарных нуклеотидов и ненасыщенных жирных кислот, специфически модулируются определенными DMT. Наиболее заметные изменения были вызваны финголимодом и IFN-β. Было высказано предположение, что низкий уровень пирувата, ацетата и пропионата в кале и сыворотке крови пациентов с РС, получающих эту терапию, объясняется истощением запасов F. prausnitzii, бактерии, продуцирующей SCFAs, и микробных путей, ведущих к выработке пирувата. В качестве механизма, способствующего этому, было также выдвинуто предположение об увеличении абсорбции пропионата, получаемого из бактерий, через регуляцию SCFA-транспортера MCT1.41
Интересное направление исследований было посвящено взаимосвязи между изменениями микробиоты кишечника и побочными эффектами DMT. Что касается DMF, то в одном из пилотных исследований27 не удалось установить связь между микробным составом и жалобами на проблемы со стороны желудочно-кишечного тракта, распространенными на ранней стадии лечения. Интересно, что в другом исследовании130 было обнаружено, что определенный исходный микробиом (присутствие A. muciniphila и отсутствие P. copri) может предсказать возникновение лимфопении, актуального побочного эффекта DMF.
Результаты исследований влияния DMT на микробиом кишечника послужили стимулом для дальнейшего изучения терапевтических вмешательств, изменяющих микробный состав, которые могли бы дополнить лечение DMT (оптимизировать ответ на лечение, снижая его побочные эффекты) или повлиять на другие исходы заболевания, не рассмотренные до сих пор.
Фармакологические вмешательства, нацеленные на микробиом кишечника при рассеянном склерозе
Пробиотики - это живые микроорганизмы, которые приносят пользу организму при введении в достаточных количествах. Они могут взаимодействовать с микробиомом кишечника и оказывать влияние на иммунологическую систему и функцию ЦНС (например, через нейротрофические факторы и активность нейромедиаторов).131 Таким образом, было проведено исследование роли пробиотических добавок, влияющих на течение рассеянного склероза.
Исследования на животных моделях продемонстрировали некоторые положительные эффекты штаммов Lactobacillus, Escherichia coli и Prevotella (при пероральном или внутрибрюшинном введении), которые предотвращали развитие EAE или облегчали его течение.132
Близнецов мармозеток (мартышек) разделили на две группы и перед иммунизацией кормили либо диетой на основе йогурта (YBD), либо диетой на основе воды (WBD). У близнецов, получавших YBD, было меньше демиелинизации и снижен провоспалительный ответ со стороны Т-клеток, В-клеток и цитокинов. У некоторых мартышек, получавших YBD, не наблюдалось никаких симптомов EAE. Состав микробиома кишечника у этих мармозеток изменился только после иммунизации, что, вероятно, связано с взаимодействием между рационом и реакцией иммунной системы.133
Введение пробиотического коктейля мышам в хронической фазе TMEV-инфекции уменьшало тяжесть заболевания и возникающую двигательную инвалидность, а также влияло на состав микробиоты кишечника, увеличивая обилие Bacteroidetes, Actinobacteria, Tenericutes и таксонов TM7. Также были обнаружены уменьшение глиоза, инфильтрации лейкоцитами и экспрессии IL-1β и IL-6 в ЦНС, а также увеличение уровня бутирата и ацетата в плазме крови134.
Сообщалось, что пробиотики способствуют сохранению целостности кишечного барьера и оказывают иммуномодулирующее действие (повышают уровень регуляторных и противовоспалительных клеточных подмножеств и их продуктов и подавляют провоспалительные).135 Как уже говорилось, бактериальные метаболиты (например, SCFAs) также могут способствовать снижению регионального и системного иммуноопосредованного ответа.136 Однако были получены и противоречивые данные: штаммы Lactobacillus reuteri способствовали обострению EAE, вероятно, в результате взаимодействия с другими бактериями и активации молекулярной мимикрии132.
Существует мало доказательств благоприятного воздействия пробиотиков на пациентов с РС. Результаты нескольких клинических исследований показали, что прием пробиотиков (например, капсул, содержащих штаммы Lactobacillus и Bifidobacterium) был связан с улучшением показателей инвалидности, депрессии и общего состояния здоровья, а также снижением экспрессии провоспалительных цитокинов и благоприятным влиянием на маркеры инсулинорезистентности, профиль липидов и метаболитов оксида азота.137-139
В исследовании Tankou et al.140 особое внимание уделялось влиянию пробиотиков на микробиом кишечника. После приема смеси пробиотиков (Lactobacillus, Bifidobacterium и Streptococcus) в течение двух месяцев у пациентов с РС и у здоровых субъектов изменился состав микробиоты: увеличилось относительное обилие упомянутых видов и снизилось α-разнообразие. Также наблюдалось снижение экспрессии CD14 и CD80 на моноцитах периферической крови. Микробные и иммунологические изменения прекратились после отмены пробиотиков. Из-за относительно небольшого размера выборки, короткой продолжительности и ряда сопутствующих факторов (диетические привычки, применяемая DMT) значимость результатов этих исследований ограничена, и, по-видимому, необходимы дальнейшие исследования.8
Антибиотики
Бактерицидные или бактериостатические эффекты антибиотиков могут влиять на микробиом кишечника, поэтому антибиотики рассматриваются как возможные полезные вмешательства при РС.
В нескольких исследованиях на экспериментальных моделях аутоиммунного воспаления ЦНС пероральное введение антибиотиков широкого спектра действия перед иммунизацией предотвращало или облегчало течение заболевания.141,142
Дисбиоз кишечника был обнаружен в мышиной модели EAE без диабета с ожирением, напоминающей SPMS. Уменьшение тяжести заболевания и смертности у мышей, получавших смесь антибиотиков широкого спектра действия, позволило предположить взаимное влияние между воспалительной демиелинизацией ЦНС и составом микробиома кишечника.45
Изменения микробиоты кишечника у мышей с EAE (снижение филогенетического разнообразия и богатства, уменьшение соотношения Firmicutes/Bacteroidetes) были связаны с усилением ответа Treg143 и изменением функции клеток iNKT.144 После введения антибиотиков также наблюдалось подавление молекул, продуцируемых L. reuteri и Erysipelotrichaceae, и последующее снижение накопления MOG-специфических Th17 клеток.145 Пероральное введение антибиотиков мышам, инфицированным TMEV, вызывало глубокий, но временный дисбиоз и изменение иммуноопосредованных реакций: снижение уровня CD4+ и CD8+ Т-клеток в ЦНС и периферических лимфатических узлах. Более того, после прекращения приема антибиотиков наблюдалось увеличение смертности в ходе TMEV-инфекции.57
Однако воздействие антибиотиков было ограничено, если они применялись во время уже сформировавшегося аутоиммунного воспаления, как и их влияние на дифференцировку клеток-предшественников олигодендроцитов и ремиелинизацию.146 В отличие от перорального лечения, внутрибрюшинное введение ампициллина вызывало ухудшение EAE; сопутствующее снижение количества бактерий, способных превращать триптофан в агонисты AhR, указывает на потенциальный патомеханизм.101
Эти результаты не нашли отражения в клинических исследованиях. В исследованиях, посвященных анализу взаимосвязи между риском развития РС и применением антибиотиков в связи с инфекциями, были получены противоречивые результаты.147,148 Два небольших исследования показали положительное влияние доксициклина (в сочетании с IFN-β) или миноциклина на клинические и рентгенологические показатели активности РС, однако состав микробиоты кишечника при этом не учитывался.149,150 Несмотря на некоторые многообещающие результаты, неблагоприятные последствия длительного лечения антибиотиками (включая рост условно-патогенных и устойчивых возбудителей) являются значительным препятствием для использования этих вмешательств у лиц с РС.
Диетические вмешательства
Несмотря на значительную роль фармакологического лечения (в основном DMT) в лечении РС, сохраняется интерес к вспомогательной роли диетических вмешательств и их способности влиять на исходы, связанные с РС. Отдельные компоненты диеты или режимы питания изучались с точки зрения их влияния на течение заболевания (частоту и тяжесть рецидивов), его специфические симптомы (например, боль или усталость), а также на общие вопросы здоровья и качество жизни. Из-за разнообразия дизайна исследований и исследуемых переменных, последовательных и убедительных доказательств пользы диетического вмешательства у пациентов с РС до сих пор нет151.
Значительная часть исследований диетических вмешательств при РС сосредоточена на их взаимодействии с микробиомом кишечника через множество путей. Определенные диетические соединения, как метаболические субстраты, могут непосредственно поддерживать рост одних штаммов бактерий и подавлять другие, формируя таким образом микробный состав. Косвенные эффекты включают влияние диеты на иммунные взаимодействия между хозяином и микробиотой, например, иммунный отбор в кишечных Пейеровых бляшках. Кроме того, диета может влиять на целостность и функционирование кишечного барьера. Учитывая эти связи и потенциал воздействия на микробиом кишечника с помощью различных диетических вмешательств, была изучена их предполагаемая роль в комплексном терапевтическом подходе к РС (рис. 5).152,153
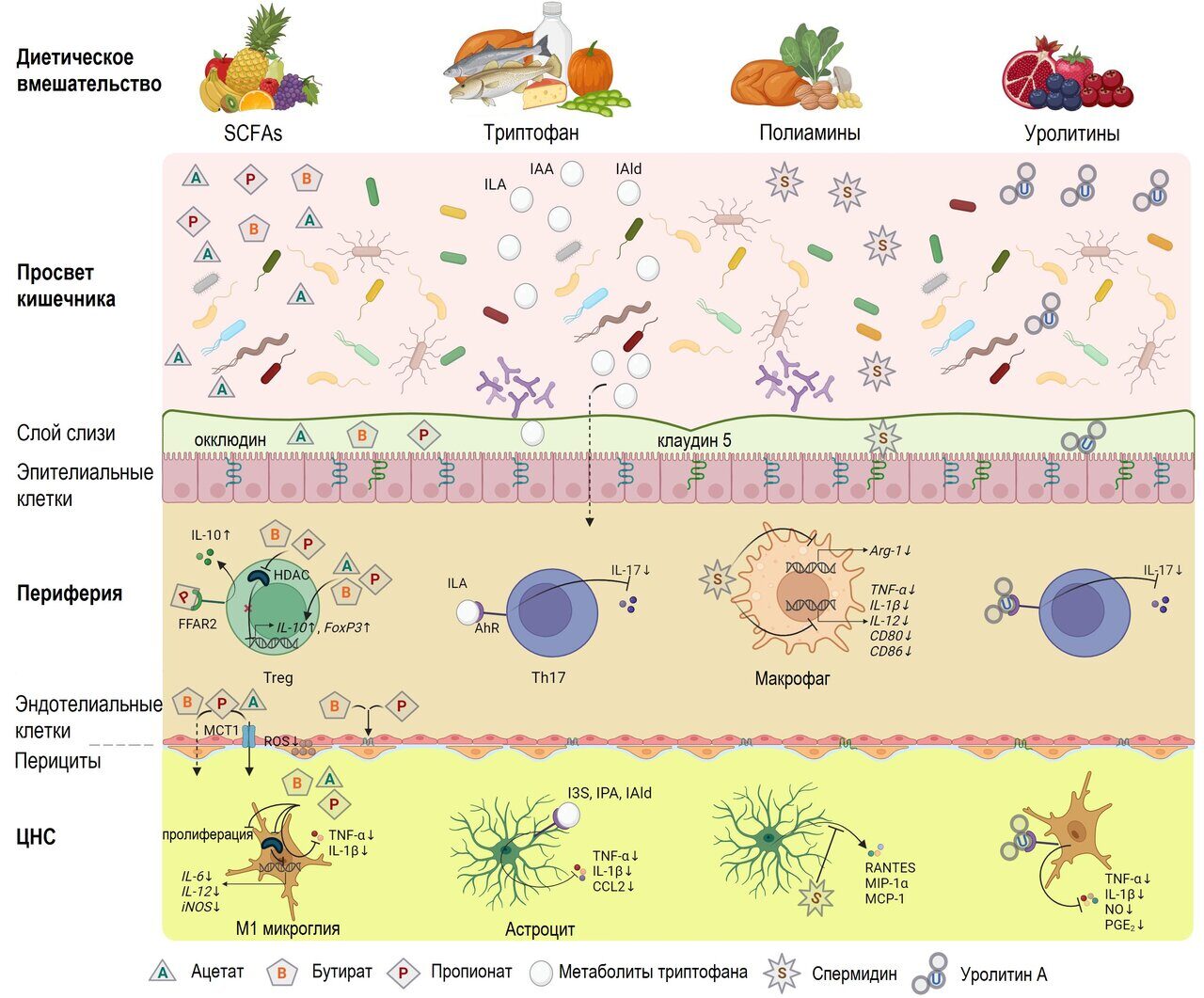
Рисунок 5. Влияние диетического вмешательства на дисбиоз кишечника и процессы, вовлеченные в патологию РС.
SCFAs, триптофан, полиамины и уролитин, получаемые из компонентов рациона, являются наиболее значимыми метаболитами, которые могут взаимодействовать с иммунной и нервной системой.
Известно, что бактерии кишечника вырабатывают основные SCFAs (ацетат, пропионат и бутират), спермидин (конечный продукт метаболизма L-аргинина) и уролитины, а также увеличивают количество метаболитов триптофана (ILA, IAA, IAld).
SCFAs модулируют Tregs в системной циркуляции, способствуя транскрипции генов, кодирующих IL-10 и FoxP3, ингибируя HDAC, и стимулируют выработку IL-10 через FFAR2-зависимый механизм. ILA и уролитин А ингибируют поляризацию Th17 и снижают выработку IL-17 через AhR. Спермидин подавляет экспрессию провоспалительных цитокинов и ко-стимулирующих молекул в макрофагах за счет снижения активности пути NF-κB, а также повышает экспрессию Arg-1 в макрофагах.
SCFAs пересекают ГЭБ и попадают в ЦНС путем диффузии или через MCT1. Они могут повышать целостность ГЭБ, восстанавливая экспрессию белков плотного соединения (окклюдина и клаудина 5) и предотвращая выработку АФК в эндотелиальных клетках.
В ЦНС SCFAs подавляют выработку TNF-α, IL-1β, IL-6, IL-12 и iNOS провоспалительными микроглиями M1 и ограничивают их пролиферацию. Уролитин А снижает секрецию провоспалительных маркеров (TNF-α, IL-1β, NO, PGE2). Метаболиты триптофана (I3S, IPA и IAld) подавляют выработку TNF-α, IL-6 и CCL2 астроцитами в AhR-зависимой манере, в то время как спермидин подавляет выработку астроцитами хемокинов (MIP-1α, MCP-1, RANTES).
Сокращения: AhR - арил-углеводородный рецептор, Arg-1 - аргиназа 1, CCL2 - хемокиновый (C-C мотив) лиганд 2, CNS - центральная нервная система, FFAR2 - рецепторы свободных жирных кислот 2, FoxP3 - скурфин, HDAC - деацетилаза гистонов, I3S - индол-3-сульфат, IAA - индол-3-уксусная кислота, IAld - индол-3-альдегид, IL - интерлейкин, ILA - индол-3-молочная кислота, iNOS - индуцибельная синтаза оксида азота, IPA - индол-3-пропионовая кислота, MCP-1 - моноцитарный хемоаттрактантный протеин-1, MCT1 - протон-зависимый монокарбоксилатный транспортер 1, MIP-1α - макрофагальный воспалительный протеин-1α, NO - оксид азота, PGE2 - простагландин E2, RANTES - хемокиновый (C-C мотив) лиганд 5, ROS - реактивные формы кислорода, SCFAs - короткоцепочечные жирные кислоты, Th - Т-хелперы, TNF-α - фактор некроза опухоли альфа, Treg - регуляторные Т-клетки.
Диетические компоненты
Низкий уровень витамина D рассматривается как фактор риска развития и активности РС с умеренной силой доказательств, полученных в рандомизированных исследованиях.2,154 Сообщалось о некотором благоприятном влиянии витамина D на маркеры воспаления и клинические и/или рентгенологические показатели активности РС.155,156 Однако необходимо учитывать сопутствующие эффекты DMT, а также взаимодействие между солнечным облучением, географическим распределением и диетическим потреблением витамина D.2
Что касается связи с микробиомом кишечника, известно, что дефицит витамина D3 влияет на всасывание кальция в кишечнике, нарушает гомеостаз кишечника и повышает проницаемость кишечника для бактерий и их продуктов, что приводит к одновременному увеличению количества бактериальных токсинов.14 Исследование микробиома кишечника у здоровых субъектов с дефицитом витамина D показало лишь временные изменения в соотношении Firmicutes/Bacteroidetes при восстановлении уровня витамина, а микробное α-разнообразие и β-разнообразие не изменилось на протяжении всего исследования.157 После приема витамина D здоровыми взрослыми с избыточным весом/ожирением наблюдалось увеличение численности Lachnospira и снижение численности Blautia.158 Исследование, оценивающее влияние приема витамина D на бактериальное сообщество у пациенток с РС (без лечения или получавших GA), показало увеличение численности родов Faecalibacterium, Akkermansia и Coprococcus в подгруппе без лечения.25
Пребиотики
Пребиотики - субстраты, используемые кишечными бактериями, - включают фруктовые, галактоолигосахариды и так называемый резистентный крахмал. Неперевариваемые для хозяина, они могут быть разложены штаммами бактерий до продуктов, которые служат пищей для других бактерий или входят в дальнейшие метаболические пути, например, фолаты, индолы, вторичные желчные кислоты, триметиламин-N-оксид (ТМАО), лактат, сукцинат и SCFAs. Прием пребиотиков может модулировать состав микробиома кишечника, способствуя увеличению количества бифидобактерий и других продуцентов SCFAs. Кроме того, пребиотики могут взаимодействовать с рецепторами иммунных клеток и вызывать экспрессию цитокинов159.
На животной модели было показано, что введение в рацион неферментируемой клетчатки, которая предотвращает развитие EAE, влияет на состав микробиоты кишечника (общее снижение разнообразия с увеличением количества Ruminococcaceae, Helicobacteraceae и Enterococcaceae и снижением количества Sutterellaceae, Lactobacillaceae и Coriobacteriaceae) и изменяет метаболический профиль с увеличением количества длинноцепочечных жирных кислот, что, как сообщается, способствует подавлению Th2-ответа.160 В клиническом исследовании была обнаружена связь между потреблением пищевых волокон у больных РС и показателями системного воспаления, антропометрическими показателями и уровнем инвалидности161.
SCFAs
Как обсуждалось ранее, пониженный уровень SCFAs у людей с РС, возможно, связанный с изменениями в микробиоме кишечника, может указывать на благоприятное воздействие добавок SCFAs. Duscha et al.63 исследовали эту концепцию на большой когорте пациентов с РС (включая различные типы заболевания и применяемую DMT) и отметили первоначальное истощение Butyricimonas (продуцентов SCFA) и обогащение Flavonifractor, Escherichia/Shigella и Collinsella (чему способствуют условия с низким содержанием SCFAs), что сопровождалось снижением количества пропионовой кислоты в сыворотке и стуле пациентов (особенно у тех, кто не получал лечения). Было установлено, что пероральный прием пропионовой кислоты, которая, как считается, восстанавливает эубиоз кишечника, вызывает индукцию супрессивной функции Tregs и снижение Th1/Th17. Кроме того, это улучшило клинические показатели заболевания, включая частоту рецидивов и прогрессирование инвалидности.
Исследования на животных моделях показали, что введение SCFAs, в частности ацетата, уменьшало тяжесть EAE в зависимости от IL-10.88 Аналогичные результаты показали, что колонизация микробиоты, полученной от пациентов с РС, приводила к повышению экспрессии генов, связанных с Tregs, но только в том случае, если этому предшествовало лечение пропионатом.62 Кроме того, уменьшение воспаления и демиелинизации ЦНС наблюдалось после профилактического лечения бутиратом162 и пропионатом.62 Интересно, что введение бутирата после начала заболевания практически не повлияло на течение болезни,162 в то время как лечение пропионатом в том же режиме привело к восстановлению аксональной плотности, хотя при профилактическом подходе бутират снижал демиелинизацию и инфильтрацию иммунными клетками.62 Таким образом, иммуномодулирующие свойства SCFAs и их связь с микробиомом кишечника могут указывать на терапевтический потенциал для РС.
ПНЖК
Полиненасыщенные жирные кислоты (в частности, ПНЖК омега-3) содержатся в продуктах питания растительного или морского происхождения, а также широко доступны в качестве добавок к рациону.
Исследования на экспериментальных моделях РС показали благотворное влияние ПНЖК, обусловленное их иммуномодулирующими свойствами, подавляющими активность Т-клеток периферии и ЦНС. Было показано, что они предотвращают демиелинизацию163 , а также способствуют нейропротекции и ремиелинизации164 , что соответствует облегчению течения заболевания и задержке его начала.165 Прием конъюгированной линоленовой кислоты (CLA) вызывал увеличение количества миелоидных супрессорных клеток в ламинарной оболочке кишечника, что было связано с подавлением воспаления. Анализ главных компонент и относительное обилие типов микробиома кишечника выявили глубокие различия, например, увеличение Porphyromonadaceae, Lachnospiraceae, Bacteroides, Lactobacillus и Akkermansia у больных животных. Однако лечение антибиотиками не отменяло благотворного влияния CLA на течение EAE, что ставит под сомнение концепцию о том, что микробиом кишечника опосредует это воздействие165.
Клинические исследования влияния ПНЖК на течение РС не столь убедительны, как исследования на животных моделях, и дают противоречивые результаты.166,167 Исследование Fleck et al. показало, что прием CLA у пациентов с RRMS, принимающих DMT, значительно улучшил противовоспалительные профили и функциональные характеристики циркулирующих миелоидных клеток. Однако состав микробиома кишечника человека не анализировался.165
Полифенолы
Полифенолы (наряду с другими соединениями растительного происхождения) могут влиять на состав микробиоты кишечника. Исследования на здоровых субъектах показали, что полифенолы способствуют росту Clostridia, Bifidobacteria и Lactobacilli и снижают численность патогенных штаммов Clostridium и Bacteroides168.
До сих пор эффекты полифенолов изучались на экспериментальной модели EAE, и результаты были отчасти противоречивыми. Сообщалось, что флавоноиды снижают уровень провоспалительных цитокинов и облегчают симптомы заболевания,169-171 но также задерживают восстановление после острой фазы.172 Ресвератрол ассоциировался с обострением EAE,173 но при этом поддерживал ремиелинизацию в другой доклинической модели РС.174 Данные клинических исследований о благоприятном воздействии полифенолов при РС скудны. Сообщалось, что лечение нанокуркумином снижает экспрессию провоспалительных цитокинов и параметров, связанных с Th17, повышает активность Treg-клеток и восстанавливает профиль экспрессии миРНК, а также снижает уровень инвалидизации и улучшает качество жизни у больных РС.175 Однако прямое воздействие полифенолов на микробиом кишечника и их новый терапевтический потенциал при РС требуют дальнейших исследований.
Хлорид натрия
Повышенное потребление NaCl, характерное для «западной диеты» (WD), влияет на местное и системное воспаление тканей и может изменять состав и функции кишечного микробиома. Исследования показали, что высокая концентрация NaCl во внеклеточной среде приводит к увеличению количества Lachnospiraceae, Ruminococcus и Prevotella spp. и снижению количества Lactobacillus в кишечнике мышей с EAE.176,177 Также было показано, что повышенный уровень NaCl приводит к дисрегуляции иммунного гомеостаза, примером которой является повышенная активация провоспалительных макрофагов M1 и клеток Th17 и подавление индукции противовоспалительных макрофагов M2 и Tregs, в частности, в собственной пластинке кишечника.178 Предполагаемый сценарий развития событий таков: истощение запасов лактобактерий нарушает целостность кишечного барьера, препятствует выработке противовоспалительного бутирата и сопровождается повышением активности Th17 и снижением активности Treg, скорее всего, опосредованным снижением выработки индол-3-молочной кислоты, метаболита триптофана.179 Эти процессы в конечном итоге приводят к обострению EAE, которое может быть обращено вспять или смягчено после введения лактобактерий.98
Клинические исследования, посвященные влиянию NaCl на РС, весьма ограничены, а их результаты противоречивы. Farez et al. сообщили, что диета, обогащенная NaCl, связана с увеличением числа демиелинизирующих поражений на МРТ и более высокой частотой рецидивов.180 Однако в других исследованиях не было выявлено влияния высокого потребления NaCl на риск развития РС или время до последующего рецидива.181-183 В этих исследованиях не изучалось влияние потребления NaCl в рационе больных РС на дисбиоз кишечника.
Диетические режимы
Прерывистое голодание и кетогенная диета
Хроническое или периодическое ограничение потребления пищи (с недоеданием или без него) и кетогенная диета, имитирующая голодание, связаны с образованием кетоновых тел, которые являются альтернативным источником энергии. Эти условия влияют на сигнальные пути, участвующие в воспалительных процессах и окислительном стрессе (например, факторы транскрипции FOXO, сиртуины, антиоксидантные ферменты), и стимулируют экспрессию нейротрофических факторов. Ограничение рациона питания изменяет микробиом кишечника, вызывая обогащение противовоспалительными штаммами и уменьшение провоспалительных бактериальных продуктов. Влияние этих диетических вмешательств на ЦНС дополнительно опосредовано активацией эндокринной и вегетативной функции.184,185
Благотворное влияние голодания и кетогенной диеты было продемонстрировано в нескольких исследованиях на мышиной модели EAE.186-188 Эти диетические вмешательства отсрочили начало заболевания и ослабили или даже обратили вспять его двигательные и когнитивные симптомы. Клиническое улучшение сопровождалось повышением уровня кортикостерона, адипонектина и иммунорегуляторных маркеров, в то время как провоспалительные цитокины и подмножества клеток, а также продукция реактивных видов кислорода были подавлены. Кроме того, патологоанатомические данные включали уменьшение воспалительной инфильтрации и демиелинизации спинного мозга, что способствовало ремиелинизации и регенерации предшественников олигодендроцитов.
В исследовании Cignarella et al.,189 было обнаружено, что голодание приводит к обогащению семейств Bacteroidaceae, Prevotellaceae и Lactobacillaceae в кишечнике мышей, а также к усилению микробного антиоксидантного метаболизма. Интересно, что FMT от мышей на прерывистом голодании улучшила течение EAE у мышей на нормальной диете, что подчеркивает роль микробиома кишечника в воздействии голодания на аутоиммунное заболевание ЦНС.
Хотя влияние различных режимов голодания на течение РС было изучено, лишь немногие из этих исследований рассматривали их связь с микробиотой кишечника.
Cignarella et al., основываясь на результатах, полученных на животной модели, провели пилотное клиническое исследование с участием пациентов с РС во время рецидива, которые получали кортикостероиды и подвергались прерывистому голоданию по сравнению с необязательной диетой. Количество Faecalibacterium, Lachnospiracea incertae sedis и Blautia в микробиоте кишечника имело тенденцию к увеличению после прерывистого голодания, а уровень Faecalibacterium коррелировал с одновременным снижением уровня лептина189.
Swidsinski et al. проанализировали состав микробиома кишечника у пациентов с РС в течение 6 месяцев кетогенной диеты. Общая концентрация и разнообразие групп бактерий были снижены на исходном уровне. Во время диетического вмешательства эти показатели еще больше снизились, но через 12 недель вернулись к исходным значениям, а к 23-24 неделям значительно превысили их, приблизившись к значениям здорового контроля. Эти колебания были особенно значимы для штаммов Akkermansia.22
Ожидается, что продолжающееся клиническое исследование, изучающее клинические, иммунологические и метаболические результаты лечения пациентов с рассеянным склерозом, использующих голодание или кетогенную диету, предоставит дополнительные доказательства связи между микробиомом кишечника и этими диетическими вмешательствами при РС.190
Другие виды диеты
В продольном исследовании, проведенном среди лиц с РС, не получавших лечения, Cantoni et al.191 проанализировали взаимосвязь между микробиомом кишечника, иммунными и метаболическими параметрами, рационом питания и клиническими исходами заболевания. Хотя изменения в микробиоме кишечника и соответствующая иммунная дисрегуляция были обнаружены у лиц с РС по сравнению со здоровыми субъектами, они не зависели от общего состава рациона питания. Однако была выявлена специфическая связь между потреблением мяса с обилием связанных с мясом метаболитов в крови и снижением количества Bacteroides thetaiotaomicron (бактерий, переваривающих полисахариды), а также увеличением количества Th17-клеток.
Saresella et al. проанализировали состав микробиоты кишечника и иммунологические профили в двух группах пациентов с РС, которые находились на высокорастительной/низкобелковой диете (HV/LP) или на WD. Результаты показали, что представители семейства Lachnospiraceae были значительно более многочисленны, а количество IL-17-продуцирующих Т-клеток было ниже в группе HV/LP по сравнению с группой WD. Диета HV/LP также повлияла на клинические показатели: частоту рецидивов и уровень инвалидизации192.
Среди других режимов питания, считающихся потенциально полезными при РС, в рандомизированных клинических исследованиях были протестированы модифицированная палеолитическая диета193, элиминационная диета Уолса/Сванка (Wahls/Swank)194 и растительная диета с низким содержанием жира195 . Результаты, хотя и противоречивые, показали некоторое улучшение показателей ловкости рук, утомляемости и качества жизни. Однако в этих исследованиях не оценивалось влияние диетических вмешательств на микробиом кишечника.
Трансплантация фекальной микробиоты (FMT)
FMT - это инфузия образцов кала здорового донора в желудочно-кишечный тракт реципиента с целью восстановления микробного баланса (эубиоза). FMT в основном используется для лечения инфекции Clostridium difficile, а также других воспалительных или функциональных заболеваний желудочно-кишечного тракта.196,197 Кроме того, потенциальные эффекты FMT также изучались при системных аутоиммунных заболеваниях и расстройствах с первичным или вторичным поражением ЦНС.198,199
Что касается экспериментальных исследований рассеянного склероза, FMT от здоровых мышей иммунизированным мышам приводила к изменению состава их кишечных бактериальных таксонов и была связана с более легкой выраженностью симптомов EAE, снижением экспрессии маркеров нейродегенерации и уменьшением патологических симптомов (демиелинизация и потеря аксонов).200 В интересном исследовании Berer et al. проводилась колонизация мышей SJL (животная модель спонтанного RRMS) человеческой микробиотой кишечника близнецов, дискордантных по диагнозу РС.31 Ухудшение течения болезни наблюдалось только после введения кала, полученного от людей, страдающих РС, что сопровождалось обилием штаммов Sutterella и усилением иммунорегуляторного профиля.
Изучение терапевтического потенциала FMT при РС было стимулировано сообщениями о случаях, описывающими пациентов с РС, которые лечились этим методом из-за серьезных желудочно-кишечных проблем.201 После FMT у них наблюдалась длительная (до нескольких лет) стабилизация течения заболевания с минимальным улучшением показателей инвалидизации и функциональных показателей. Более позднее исследование с участием одного испытуемого202 , основанное на годичном наблюдении за пациентом с РС после двойной FMT, предоставило доказательства возможных механизмов благоприятного эффекта FMT. Улучшение показателей походки сопровождалось изменением микробных параметров (обилие Faecalibacterium prausnitzii, увеличение соотношения Firmicutes / Bacteroidetes и Prevotellaceae / Bacteroidaceae), повышением концентрации ацетата, пропионата и бутирата в последующих образцах стула и усилением геномных путей SCFAs, что коррелировало с сывороточным уровнем нейротрофического фактора мозга (BDNF).
Пилотное рандомизированное контролируемое исследование было проведено на небольшой группе пациентов с RRMS, которым ежемесячно проводилась FMT в качестве раннего или позднего вмешательства в течение 6 месяцев.203 После FMT были обнаружены донорские изменения в составе микробиома кишечника, хотя высокая внутриличностная вариабельность не позволила оценить изменения в α- и β-разнообразии видов. Повышенная кишечная проницаемость у некоторых испытуемых нормализовалась после серии FMT. На протяжении всего исследования не наблюдалось значительных изменений сывороточных уровней провоспалительных и иммунорегуляторных биомаркеров. Однако исследование было досрочно прекращено по немедицинским причинам, поэтому не все запланированные результаты были достигнуты.
Ожидается, что дальнейшие исследования (включая текущие клинические испытания фазы 1) позволят получить больше данных об эффектах, переносимости и оптимальном порядке проведения FMT, что будет способствовать дальнейшему внедрению этого метода в лечение РС.
Другие вмешательства
По некоторым данным, заражение паразитами может улучшать клиническую и рентгенологическую активность при РС. Этот эффект (отменяемый антигельминтными препаратами) объяснялся индукцией Tregs и секрецией иммуносупрессивных цитокинов.204,205 Были предприняты попытки оценить влияние преднамеренного заражения анкилостомами человека на дисбиоз кишечника при РС, учитывая возможные взаимодействия между этими микроорганизмами. Jenkins et al.206 наблюдали значительное увеличение α-разнообразия в образцах фекалий инфицированных пациентов с РС по сравнению с группой плацебо и различия в численности нескольких бактериальных таксонов (например, Parabacteroides), которые, вероятно, обладают иммуномодулирующими функциями. В группе плацебо было обнаружено большее количество представителей семейства Lachnospiraceae, что, как считается, связано с переходом к провоспалительному микробному профилю и развитием заболевания. Это наблюдение кажется противоречащим предыдущим результатам, поскольку представители семейства Lachnospiraceae являются продуцентами SCFAs.
Еще одна интересная попытка воздействовать на микробиом кишечника у больных РС была связана с физической активностью. Barone et al.207 оценили влияние многомерной реабилитационной программы на различные исходы РС. В результате вмешательства улучшилась эффективность походки и снизилась утомляемость, что сопровождалось снижением уровня провоспалительных иммунных маркеров (CD4+/IFN-γ+Th1, CD4+/ROR-γ+ и CD4+/IL-17+ Th17) и концентрации липополисахарида в сыворотке крови. Кроме того, значительные изменения наблюдались в составе микробиоты кишечника. В исходном состоянии у пациентов с РС наблюдалось истощение нескольких семейств бактерий (Lachnospiraceae и Ruminococcaceae) и обогащение других (Coriobacteriaceae, Veillonellaceae, Prevotellaceae, Enterobacteriaceae). Что касается их функций, то наблюдалось снижение количества SCFA-продуцирующих бактерий (Roseburia, Coprococcus и Blautia), и увеличение количества бактерий, проявляющих провоспалительную активность (Collinsella и Prevotella). После программы реабилитации специфические изменения микробиома кишечника включали относительное обилие Actinobacteria (аналогичное HS), устойчивое преобладание Bacteroidetes и Proteobacteria над Firmicutes, а также пониженные уровни (ниже референсных значений для HS) Ruminococcus и Dorea (производители SCFA, провоспалительный профиль). Кроме того, снижение численности Collinsella положительно коррелировало с уровнем CD4+/ROR-γ+ Th17, что позволяет предположить связь между этим бактериальным родом и провоспалительным компонентом аутоиммунного ответа.
Выводы
Предполагается, что изменения состава и функции микробиоты кишечника, продемонстрированные у пациентов с PC, играют важную роль в комплексном фоне заболевания. Экспериментальные и клинические исследования выявили связь между дисбиозом кишечника и дисрегуляцией иммунного ответа (преимущественным преобладанием провоспалительных компонентов над регуляторными), а также бактериальными метаболическими путями. Анализ этих взаимодействий между хозяином и бактериями может дать более полное представление о процессах, способствующих развитию РС и влияющих на его течение. Кроме того, изучение дисбиоза кишечника при РС может позволить уточнить известные в настоящее время терапевтические мишени и, как мы надеемся, выявить потенциальные новые. Помимо DMT, другие вмешательства, направленные на микробиоту кишечника, по-видимому, обладают определенным потенциалом влияния на активность и течение заболевания (табл. 7). Из-за проблем с переводом экспериментальных данных в клинические модели для подтверждения положительного эффекта этих вмешательств при РС необходимы дальнейшие исследования и рандомизированные испытания.
Таблица 7. Экспериментальные и клинические исследования терапии на основе комменсалов кишечника и диетических вмешательств, влияющих на микробиом кишечника при РС.
|
Вмеша-тельство
|
Модель исследования
|
Влияние на микробиом
кишечника
|
Другие эффекты
|
Ref
|
|
Пробиотики
|
Эксперимент:
rhMOG-индуцированный EAE;
Пары близнецов мармозеток;
Добавка на основе йогурта (YBS) против добавки на основе воды
|
Близнецы на вскармливании YBS после иммунизации: Bifidobacteria↑,
Bacteroides barnesiae↓, Blautia stercoris↓,
M. formatexigens↓
|
Частота индукции EAE от 100% до 75%↓, демиелинизация спинного мозга ↓, экспрессия каллитрихинового вируса герпеса 3↓
|
133
|
|
Эксперимент:
TMEV-IDD
мыши SJL / J Пробиотический коктейль Vivomixx |
Bacteroidetes↑, Actinobacteria↑,
Tenericutes↑,
TM7↑
|
Улучшение (снижение) двигательных нарушений, микроглиоз↓, астроглиоз↓, инфильтрация лейкоцитами↓, экспрессия гена IL-10↑, уровень бутирата и ацетата в плазме↑
|
134
|
|
|
Клиника:
9 pwMS/13 HS
Пробиотик – VSL3
|
Lactobacillus↑, Bifidobacterium↑,
Streptococcus↑, Akkermansia↓, Blautia↓
|
Частота воспалительных моноцитов↓, экспрессия CD80 на моноцитах↓, экспрессия HLA на дендритных клетках↓, изменения микробных метаболических путей, связанных, например, с метаболизмом метана
|
140
|
|
|
Пребиотики
|
Эксперимент:
Спонтанный EAE - OSE и мыши дикого типа C57BL/6
Диета, богатая неферментируемой клетчаткой (целлюлозой), по сравнению с контрольной диетой
|
Значительно измененное бета-разнообразие
Уменьшенное содержание OTU в анализе альфа-разнообразия
Ruminococcaceae↑, Helicobacteraceae↑,
Enterococcaceae↑, Sutterellaceae↓,
Lactobacillaceae↓, Coriobacteriaceae↓
|
IFN-γ-продуцирующие Th1-клетки в собственной пластинке кишечника↓, уровень IL-4 и IL-5, вырабатываемых Th2-клетками↑, масляная кислота ↓, LCFAs↑
|
160
|
|
SCFAs
|
Эксперимент:
MOG35-55-индуцированный EAE у мышей C57BL/6;
Потребление пропионовой кислоты (PA) по сравнению с потреблением лауриновой кислоты (LA) по сравнению с контрольной диетой
|
EAE не изменил состав микробиома при потреблении LA: сдвиг в сторону
Prevotellaceae↓ и Bacteroidetes↓
|
Употребление LA: более тяжелое течение заболевания, Th17-клетки в ЦНС↑, Th1 и Th17-клетки в селезенке↑, LCFAs↑, SCFAs (особенно PA) в кале↓
Употребление PA: восстановление нарушенного баланса между Т-регуляторами и эффекторными Т-клетками
|
62
|
|
ПНЖК
|
Эксперимент:
спонтанный EAE
-OSE у мышей IgHMOGxTCRMOG, получавших конъюгированную линолевую кислоту (CLA) в сравнении с контрольной диетой |
Глубокие изменения в общем
Состав микробиома (анализ основных компонентов) Porphyromondaceae↑,
Lachnospiraceae↑, Bacteroides↑,
Lactobacillus↑, Akkermansia↑
|
Ухудшение течения заболевания, инфильтрация иммунных клеток в спинном мозге и собственной пластинке кишечника↓, MDSC-подобные клетки в собственной пластинке ↑, провоспалительный Т-клеточный ответ↓
|
165
|
|
NaCl
|
Эксперимент:
MOG35-55-индуцированный EAE у мышей FVB/N
на ысокосолевой диете (HSD) против нормальной солевой диеты
|
Отсутствие явной закономерности в общем
Микробный состав (на основе OTUs)
HSD: Lactobacillus↓, Oscillibacter↓, Pseudoflavonifractor↓, Clostridium XIVa↑, Johnsonella↑, Rothia Parasutterella↑
|
Измененный уровень центральных углеродных и азотных метаболитов в кале
|
98
|
|
Витамин D
|
Клиника:
7 pwMS (5 с GA и 2 без лечения) по сравнению с HS (все с дефицитом витамина D)
Витамин D3
5000 IU/d
|
После приема витамина D:
Faecalibacterium↑, Enterobacteriaceae↑, Ruminococcus↓
Нелеченные pwMS:
Akkermansia↑, Faecalibacterium↑, Coprococcus↑
pwMS, леченные GA:
Janthinobacterium↑ Eubacterium↓,
Ruminococcus↓
|
25
|
|
|
Прерывистое голодание
|
Эксперимент:
Модель индуцированного EAE,
мыши C57BL / 6, голодающие через день по сравнению с обычной диетой |
Общее увеличение разнообразия
кишечных бактерий, Lactobacillaceae↑, Bacteroidaceae↑,
Prevotellaceae↑
|
Th17 клетки↓, Tregs↑, инфильтрация воспалительных клеток и демиелинизация спинного мозга↓, антиоксидантные микробные метаболические пути↑, синтез и деградация кетоновых тел↑, метаболизм глутатиона↑, биосинтез липополисахарида↓, лептин↓, адипонектин↑
|
189
|
|
Клиника:
16 pwMS
IER в сравнении с потреблением свободных калорий
|
Faecalibacterium↑, Lachnospiracea
incertae sedis↑, Blautia↑
Обилие Faecalibacterium коррелирует с уровнем адипонектина
|
Плазматические B-клетки↓
|
189
|
|
|
Кетогенная диета
|
Клиника:
25 pwMS (кетогенная диета по сравнению с обычной), 14 HS
|
Roseburia↓, Bacteroides↓,
Faecalibacterium prausnitzii↓
|
22
|
|
|
Другие режимы питания
|
Клиника:
24 нелеченных pwMS и 25 контролных субъектов
Сбалансированная диета (потребление основных видов пищи)
|
Faecalibacterium↓, Prevotella↓,
Lachnospiraceae↓, Anaerostipes↓
(относительное обилие OTU) Корреляция между микробиотой и уровнем инвалидности B. thetaiotaomicron↓ коррелирует с потреблением мяса
|
Th17-клетки↑, обилие метаболитов в крови, связанных с потреблением мяса↑
|
191
|
|
Клиника:
20 pwMS
Высокоовощная / низкобелковая диета (HV/LP) по сравнению с“западной диетой”
|
Подгруппа HV/LP: Lachnospiraceae↑
|
IL -17-продуцирующие Т-клетки↓, частота рецидивов↓,
уровень инвалидности↓
|
192
|
|
|
FMT
|
Эксперимент:
MOG35-55-индуцированный EAE
мыши C57BL / 6, получавшие FMT, по сравнению с необработанными иммунизированными мышами и нормальным контролем |
Увеличение индекса Шеннона для α-разнообразия после FMT у мышей с EAE, получавших FMT: Bacteroidetes↑ Firmicutes↓, Tenericutes↓, Cyanobacteria↓ (сдвиг в сторону уровней, характерных для нормального контроля);
Показатели тяжести EAE: Lachnoclostridium, Lachnospiraceae - отрицательная корреляция, Mollicutes_RF9, Ruminococcaceae, Turicibacter, Thalassospira - положительная корреляция
|
Активация микроглии и астроцитов↓, улучшение целостности ГЭБ
|
200
|
|
Эксперимент:
Безмикробные мыши RR SJL/J;
FMT от пар человеческих близнецов, дискордантных по РС
|
FMT от здорового близнеца:
Adlercreutzia↑, Tannerella↑, Ruminococcus↓
FMT от близнеца с РС:
Sutterella↓
|
Выработка IL-10↓
|
31
|
|
|
Клиника:
динственный пациент с рассеянным склерозом,
2 FMT 12-месячное наблюдение |
Повышение микробного богатства
Firmicutes по отношению к Bacteroidetes↑, Prevotellaceae по отношению к Bacteroidaceae↑, Faecalibacterium prausnitzii↑
|
Концентрация ацетата, пропионата и бутирата в фекалиях↑, геномные пути SCFA↑, уровень BDNF в сыворотке↑, улучшение показателей походки
|
202
|
|
|
Клиника:
9 pwMS
Ежемесячные FMT в течение 6 месяцев
|
На исходном уровне: Bacteroides↑, Blautia faecis↑, Bacteroides uniformis↑, Prevotella↓, Paraprevotella↓ Значительных изменений в разнообразии микробиоты после повторных FMTs не произошло
|
Частичная нормализация повышенной кишечной проницаемости, про- или противо-воспалительные маркеры не изменяются
|
203
|
Изменения указаны стрелками. Сокращения: BDNF - нейротрофический фактор мозга, EAE - экспериментальный аутоиммунный энцефаломиелит, FMT - трансплантация фекальной микробиоты, GA - глатирамера ацетат, HLA - человеческий лейкоцитарный антиген, IER - прерывистое ограничение энергии (интервальное голодание), OSE - спонтанный оптико-спинальный энцефаломиелит, OTU - операционная таксономическая единица, ПНЖК - полиненасыщенные жирные кислоты, pwMS - люди с рассеянным склерозом, (rh) MOG - рекомбинантный человеческий миелин, олигодендроцитарный гликопротеин, SCFAs - короткоцепочечные жирные кислоты, LCFAs - длинноцепочечные жирные кислоты, TMEV-IDD - демиелинизирующая болезнь, индуцированная вирусом мышиного энцефаломиелита Тайлера (TMEV).
Аббревиатуры
|
=
|
арил-углеводородный рецептор
|
|
|
=
|
серин/треониновая протеинкиназа
|
|
|
=
|
аденозинмонофосфат-активируемая протеинкиназа
|
|
|
=
|
антигенпрезентирующая клетка
|
|
|
=
|
аргиназа 1
|
|
|
=
|
фермент 1 для расщепления β-сайта белка-предшественника амилоида
|
|
|
BBB (ГЭБ)
|
=
|
гематоэнцефалический барьер
|
|
=
|
нейротрофический фактор мозга
|
|
|
=
|
хемокиновый (С-С мотив) лиганд 2
|
|
|
=
|
болезнь Крона
|
|
|
CNS (ЦНС)
|
=
|
центральная нервная система
|
|
=
|
цитозольная фосфолипаза А2
|
|
|
=
|
спинномозговая жидкость
|
|
|
=
|
дендритная клетка
|
|
|
=
|
диметилфумарат
|
|
|
=
|
болезнь-модифицирующая терапия
|
|
|
=
|
экспериментальный аутоиммунный энцефаломиелит
|
|
|
=
|
расширенная шкала оценки состояния инвалидности
|
|
|
=
|
внеклеточная сигнал-регулируемая киназа
|
|
|
=
|
рецептор свободных жирных кислот
|
|
|
=
|
трансплантация фекальной микробиоты
|
|
|
=
|
вилочковая коробка P3, также известная как скурфин
|
|
|
=
|
финголимод
|
|
|
=
|
глатирамера ацетат
|
|
|
=
|
свободный от микробов
|
|
|
=
|
рецептор, связанный с белком G
|
|
|
=
|
деацетилаза гистонов
|
|
|
=
|
человеческий лейкоцитарный антиген
|
|
|
HS
|
=
|
здоровые субъекты
|
|
=
|
индол-3-карбинол
|
|
|
=
|
индол-3-сульфат (индоксил 3-сульфат)
|
|
|
=
|
индол-3-уксусная кислота
|
|
|
=
|
индол-3-альдегид
|
|
|
=
|
1-индоламин-2,3-диоксигеназа
|
|
|
IER
|
=
|
прерывистое ограничение энергии (Intermittent energy restriction)
|
|
=
|
интерлейкин
|
|
|
=
|
индол-3-молочная кислота
|
|
|
=
|
инвариантные естественные Т-клетки-киллеры
|
|
|
=
|
индуцированная синтаза оксида азота
|
|
|
=
|
индол-3-пропионовая кислота
|
|
|
=
|
Jun-N-концевая киназа
|
|
|
=
|
длинноцепочечные жирные кислоты
|
|
|
=
|
ассоциированный с функцией лимфоцитов антиген 1
|
|
|
=
|
митоген-активируемая протеинкиназа
|
|
|
=
|
основной белок миелина
|
|
|
=
|
моноцитарный хемоаттрактант протеин-1
|
|
|
=
|
протон-зависимый монокарбоксилатный транспортер 1
|
|
|
=
|
главный комплекс гистосовместимости класс II
|
|
|
=
|
макрофагальный воспалительный протеин-1α
|
|
|
=
|
миелин-олигодендроцитарный гликопротеин
|
|
|
MS (РС)
|
=
|
рассеянный склероз
|
|
=
|
мишень рапамицина для млекопитающих
|
|
|
(Nrf2)
|
=
|
связанный с NFE2 фактор 2 (ядерный фактор-2, подобный фактору эритроидного происхождения 2)
|
|
=
|
ядерный фактор каппа - усилитель легкой цепи активированных В-клеток
|
|
|
=
|
расстройство спектра оптиконейромиелита
|
|
|
=
|
оксид азота
|
|
|
=
|
натулизумаб
|
|
|
=
|
орнитин декарбоксилаза 1
|
|
|
=
|
активируемый высвобождением кальция кальциевый модулятор 1
|
|
|
OSE
|
=
|
спонтанный оптикоспинальный энцефаломиелит
|
|
=
|
оперативная таксономическая единица
|
|
|
=
|
простагландин Е2
|
|
|
=
|
фосфоинозитид-3-киназа
|
|
|
=
|
первично-прогрессирующий рассеянный склероз
|
|
|
PUFAs (ПНЖК)
|
=
|
полиненасыщенные жирные кислоты
|
|
pwMS
|
=
|
люди с рассеянным склерозом
|
|
=
|
прегнан X-рецептор
|
|
|
=
|
ревматоидный артрит
|
|
|
=
|
хемокиновый (С-С мотив) лиганд 5
|
|
|
(Rh) MOG
|
=
|
рекомбинантный человеческий MOG
|
|
ROS (АФК)
|
=
|
реактивные виды кислорода (активные формы кислорода)
|
|
=
|
рецидивирующе-ремиттирующий рассеянный склероз
|
|
|
=
|
сфингозин-1-фосфат
|
|
|
=
|
спермидин/спермин N1 ацетилтрансфераза 1
|
|
|
=
|
короткоцепочечные жирные кислоты
|
|
|
=
|
натрий-связанный монокарбоксилатный транспортер 1
|
|
|
=
|
вторично-прогрессирующий рассеянный склероз
|
|
|
=
|
молекулы стромального взаимодействия | |
|
=
|
Т-хелпер
|
|
|
=
|
толл-подобный рецептор
|
|
|
=
|
Вирус мышиного энцефаломиелита Тайлера (TMEV)-индуцированная демиелинизирующая болезнь
|
|
|
=
|
фактор некроза опухоли альфа
|
|
|
=
|
регуляторная Т-клетка
|
|
|
=
|
язвенный колит
|
|
|
=
|
рецептор витамина D
|
|
|
=
|
фактор роста эндотелия сосудов B
|
|
|
=
|
западная диета
|
К разделу: Микробиом, ЦНС и функции мозга
- Рассеянный склероз и микробиом кишечника
- Растительная диета в сочетании со здоровым микробиомом может защитить от рассеянного склероза
- Влияние микрофлоры на развитие рассеянного склероза
- Кишечные бактерии защищают от вирусов, вызывающих рассеянный склероз
- Роль кишечного микробиома в патогенезе диабета, рассеянного склероза и ревматоидного артрита
- Кишечные бактерии участвуют в развитии рассеянного склероза
- Filippi M, Bar-Or A, Piehl F, Preziosa P, Solari A, Vukusic S, Rocca MA.. Multiple sclerosis. Nat Rev Dis Primers. 2018;4(1):1–37. doi: 10.1038/s41572-018-0041-4. [PubMed] [CrossRef] [Google Scholar]
- Waubant E, Lucas R, Mowry E, Graves J, Olsson T, Alfredsson L, Langer‐Gould A. Environmental and genetic risk factors for MS: an integrated review. Ann Clin Transl Neurol. 2019;6(9):1905–1922. doi: 10.1002/acn3.50862. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Marrodan M, Alessandro L, Farez MF, Correale J. The role of infections in multiple sclerosis. Mult Scler. 2019;25(7):891–901. doi: 10.1177/1352458518823940. [PubMed] [CrossRef] [Google Scholar]
- Tarlinton RE, Khaibullin T, Granatov E, Martynova E, Rizvanov A, Khaiboullina S. The interaction between viral and environmental risk factors in the pathogenesis of multiple sclerosis. IJMS. 2019;20(2):303. doi: 10.3390/ijms20020303. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Bjornevik K, Cortese M, Healy BC, Kuhle J, Mina MJ, Leng Y, Elledge SJ, Niebuhr DW, Scher AI, Munger KL, et al. Longitudinal analysis reveals high prevalence of Epstein-Barr virus associated with multiple sclerosis. Sci. 2022;375(6578):296–301. doi: 10.1126/science.abj8222. [PubMed] [CrossRef] [Google Scholar]
- Yin JX, Tang Z, Gan Y, Li L, Shi F, Coons S, Shi J. Pertussis toxin modulates microglia and T cell profile to protect experimental autoimmune encephalomyelitis. Neuropharmacology. 2014;81:1–5. doi: 10.1016/j.neuropharm.2014.01.027. [PubMed] [CrossRef] [Google Scholar]
- Marchesi JR, Ravel J. The vocabulary of microbiome research: a proposal. Microbiome. 2015;3(1):31. doi: 10.1186/s40168-015-0094-5. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Ghezzi L, Cantoni C, Pinget GV, Zhou Y, Piccio L. Targeting the gut to treat multiple sclerosis. J Clin Invest. 2021;131(13). doi: 10.1172/JCI143774. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Shahi SK, Freedman SN, Mangalam AK. Gut microbiome in multiple sclerosis: the players involved and the roles they play. Gut Microbes. 2017;8(6):607–615. doi: 10.1080/19490976.2017.1349041. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Maglione A, Zuccala M, Tosi M, Clerico M, Rolla S. Host genetics and gut microbiome: perspectives for multiple sclerosis. Genes (Basel). 2021;12(8):1181. doi: 10.3390/genes12081181. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Shahi SK, Ali S, Jaime CM, Guseva NV, Mangalam AK. HLA class II polymorphisms modulate gut microbiota and experimental autoimmune encephalomyelitis phenotype. Immunohorizons. 2021;5(8):627–646. doi: 10.4049/immunohorizons.2100024. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Montgomery TL, Künstner A, Kennedy JJ, Fang Q, Asarian L, Culp-Hill R, D’Alessandro A, Teuscher C, Busch H, Krementsov DN, et al. Interactions between host genetics and gut microbiota determine susceptibility to CNS autoimmunity. Proc Natl Acad Sci U S A. 2020;117(44):27516–27527. doi: 10.1073/pnas.2002817117. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Wang J, Thingholm LB, Skiecevičienė J, Rausch P, Kummen M, Hov JR, Degenhardt F, Heinsen F-A, Rühlemann MC, Szymczak S, et al. Genome-wide association analysis identifies variation in vitamin D receptor and other host factors influencing the gut microbiota. Nat Genet. 2016;48(11):1396–1406. doi: 10.1038/ng.3695. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Ghareghani M, Reiter RJ, Zibara K, Farhadi NL, Vitamin D. Melatonin, and gut microbiota act in concert to initiate multiple sclerosis: a New mechanistic pathway. Front Immunol. 2018;9:2484. doi: 10.3389/fimmu.2018.02484. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Boziki MK, Kesidou E, Theotokis P, Mentis AFA, Karafoulidou E, Melnikov M, Sviridova A, Rogovski V, Boyko A, Grigoriadis N, et al. Microbiome in multiple sclerosis; where are we, what we know and do not know. Brain Sci. 2020;10(4):234. doi: 10.3390/brainsci10040234. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Inojosa H, Proschmann U, Akgun K, Ziemssen T. The need for a strategic therapeutic approach: multiple sclerosis in check. Ther Adv Chronic Dis. 2022;13:20406223211063032. doi: 10.1177/20406223211063032. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Weld-Blundell IV, Grech L, Learmonth YC, Marck CH. Lifestyle and complementary therapies in multiple sclerosis guidelines: systematic review. Acta Neurol Scand. 2022;145(4):379–392. doi: 10.1111/ane.13574. [PubMed] [CrossRef] [Google Scholar]
- Rumah KR, Linden J, Fischetti VA, Vartanian T, Esteban FJ. Isolation of Clostridium perfringens type B in an individual at first clinical presentation of multiple sclerosis provides clues for environmental triggers of the disease. PloS One. 2013;8(10):e76359. doi: 10.1371/journal.pone.0076359. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Cekanaviciute E, Yoo BB, Runia TF, Debelius JW, Singh S, Nelson CA, Kanner R, Bencosme Y, Lee YK, Hauser SL, et al. Gut bacteria from multiple sclerosis patients modulate human T cells and exacerbate symptoms in mouse models. Proc Natl Acad Sci U S A. 2017;114(40):10713–10718. doi: 10.1073/pnas.1711235114. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Baum K, Rejmus R, Dorffel Y. Commensal gut flora in MS: spatial organization and composition. Mult Scler. 2015;21:458–159. [Google Scholar]
- Levi I, Gurevich M, Perlman G, Magalashvili D, Menascu S, Bar N, Godneva A, Zahavi L, Chermon D, Kosower N, et al. Potential role of indolelactate and butyrate in multiple sclerosis revealed by integrated microbiome-metabolome analysis. Cell Rep Med. 2021;2(4):100246. doi: 10.1016/j.xcrm.2021.100246. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Swidsinski A, Dörffel Y, Loening-Baucke V, Gille C, Göktas Ö, Reißhauer A, Neuhaus J, Weylandt K-H, Guschin A, Bock M, et al. Reduced Mass and diversity of the colonic microbiome in patients with multiple sclerosis and their improvement with Ketogenic Diet. Front Microbiol. 2017;8:1141. doi: 10.3389/fmicb.2017.01141. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Cosorich I, Dalla-Costa G, Sorini C, Ferrarese R, Messina MJ, Dolpady J, Radice E, Mariani A, Testoni PA, Canducci F, et al. High frequency of intestinal T H 17 cells correlates with microbiota alterations and disease activity in multiple sclerosis. Sci Adv. 2017;3(7):e1700492. doi: 10.1126/sciadv.1700492. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Miyake S, Kim S, Suda W, Oshima K, Nakamura M, Matsuoka T, Chihara N, Tomita A, Sato W, Kim S-W, et al. Dysbiosis in the gut microbiota of patients with multiple sclerosis, with a striking depletion of species belonging to Clostridia XIVa and IV clusters. PloS One. 2015;10(9):e0137429. doi: 10.1371/journal.pone.0137429. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Cantarel BL, Waubant E, Chehoud C, Kuczynski J, DeSantis TZ, Warrington J, Venkatesan A, Fraser CM, Mowry EM. Gut microbiota in multiple sclerosis: possible influence of immunomodulators. Journal Of Investigative Medicine. 2015;63(5):729–734. doi: 10.1097/JIM.0000000000000192. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Ling Z, Cheng Y, Yan X, Shao L, Liu X, Zhou D, Zhang L, Yu K, Zhao L, et al. Alterations of the fecal microbiota in Chinese patients with multiple sclerosis. Front Immunol. 2020;11:590783. doi: 10.3389/fimmu.2020.590783. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Storm-Larsen C, Myhr K-M, Farbu E, Midgard R, Nyquist K, Broch L, Berg-Hansen P, Buness A, Holm K, Ueland T, et al. Gut microbiota composition during a 12-week intervention with delayed-release dimethyl fumarate in multiple sclerosis – a pilot trial. Mult Scler J Exp Transl Clin. 2019;5(4):2055217319888767. doi: 10.1177/2055217319888767. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Ventura RE, Iizumi T, Battaglia T, Liu M, Perez-Perez GI, Herbert J, Blaser MJ. Gut microbiome of treatment-naïve MS patients of different ethnicities early in disease course. Sci Rep. 2019;9(1):16396. doi: 10.1038/s41598-019-52894-z. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Oezguen N, Yalcinkaya N, Kücükali CI, Dahdouli M, Hollister EB, Luna RA, Türkoglu R, Kürtüncü M, Eraksoy M, Savidge TC, et al. Microbiota stratification identifies disease-specific alterations in neuro-Behçet’s disease and multiple sclerosis. Clin Exp Rheumatol. 2019;37 Suppl 121(6):58–66. [PubMed] [Google Scholar]
- Saresella M, Marventano I, Barone M, La Rosa F, Piancone F, Mendozzi L, d’Arma A, Rossi V, Pugnetti L, Roda G, et al. Alterations in circulating fatty acid are associated with gut microbiota dysbiosis and inflammation in multiple sclerosis. Front Immunol. 2020;11:1390. doi: 10.3389/fimmu.2020.01390. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Berer K, Gerdes LA, Cekanaviciute E, Jia X, Xiao L, Xia Z, Liu C, Klotz L, Stauffer U, Baranzini SE, et al. Gut microbiota from multiple sclerosis patients enables spontaneous autoimmune encephalomyelitis in mice. Proc Natl Acad Sci U S A. 2017;114(40):10719–10724. doi: 10.1073/pnas.1711233114. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Cox LM, Maghzi AH, Liu S, Tankou SK, Dhang FH, Willocq V, Song A, Wasén C, Tauhid S, Chu R, et al. Gut microbiome in progressive multiple sclerosis. Ann Neurol. 2021;89(6):1195–1211. doi: 10.1002/ana.26084. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Takewaki D, Suda W, Sato W, Takayasu L, Kumar N, Kimura K, Kaga N, Mizuno T, Miyake S, Hattori M, et al. Alterations of the gut ecological and functional microenvironment in different stages of multiple sclerosis. Proc Natl Acad Sci U S A. 2020;117(36):22402–22412. doi: 10.1073/pnas.2011703117. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Cekanaviciute E, Debelius, JW, Singh S, Runia T, Nelson C, Yoo B, Kanner R, Crabtree-Hartman E, Mazmanian S, Knight R et al. Gut dysbiosis is a feature of MS and it is characterized by bacteria able to regulate lymphocyte differentiation in vitro. Mult Scler. 2016;22(S3):58–59. [Google Scholar]
- Zeng Q, Gong J, Liu X, Chen C, Sun X, Li H, Zhou Y, Cui C, Wang Y, Yang Y, et al. Gut dysbiosis and lack of short chain fatty acids in a Chinese cohort of patients with multiple sclerosis. Neurochem Int. 2019;129:104468. doi: 10.1016/j.neuint.2019.104468. [PubMed] [CrossRef] [Google Scholar]
- Forbes JD, Chen C-Y, Knox NC, Marrie R-A, El-Gabalawy H, de Kievit T, Alfa M, Bernstein CN, Van Domselaar G. A comparative study of the gut microbiota in immune-mediated inflammatory diseases—does a common dysbiosis exist? Microbiome. 2018;6(1):221. doi: 10.1186/s40168-018-0603-4. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Kozhieva M, Naumova N, Alikina T, Boyko A, Vlassov V, Kabilov MR. Primary progressive multiple sclerosis in a Russian cohort: relationship with gut bacterial diversity. BMC Microbiol. 2019;19(1):309. doi: 10.1186/s12866-019-1685-2. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Choileain SN, Kleinewietfeld M, Raddassi K, Hafler DA, Ruff WE, Longbrake EE. CXCR3+ T cells in multiple sclerosis correlate with reduced diversity of the gut microbiome. J Transl Autoimmunity. 2020;3:100032. doi: 10.1016/j.jtauto.2019.100032. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Reynders T, Devolder L, Valles‐Colomer M, Van Remoortel A, Joossens M, De Keyser J, Nagels G, D’hooghe M, Raes J. Gut microbiome variation is associated to multiple sclerosis phenotypic subtypes. Ann Clin Transl Neurol. 2020;7(4):406–419. doi: 10.1002/acn3.51004. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Zhou X, Singh S, Baumann R, Barba P, Landefeld J, Casaccia P, Sand IK, Xia Z, Weiner H, Chitnis T, et al. Household paired design reduces variance and increases power in multi-city gut microbiome study in multiple sclerosis. Mult Scler. 2021;27(3):366–379. doi: 10.1177/1352458520924594. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Zhou X, Baumann R, Gao X, Mendoza M, Singh S, Katz Sand I, Xia Z, Cox LM, Chitnis T, Yoon H. iMSMS & consortium. Gut microbiome of multiple sclerosis patients and paired household healthy controls reveal associations with disease risk and course. Cell. 2022;185(19):3467–3486.e16. doi: 10.1016/j.cell.2022.08.021. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Johanson DM 2nd, Goertz JE, Marin IA, Costello J, Overall CC, Gaultier A. Experimental autoimmune encephalomyelitis is associated with changes of the microbiota composition in the gastrointestinal tract. Science Reports. 2020;10(1):15183. doi: 10.1038/s41598-020-72197-y. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Gandy KAO, Zhang J, Nagarkatti P, Nagarkatti M. The role of gut microbiota in shaping the relapse-remitting and chronic-progressive forms of multiple sclerosis in mouse models. Sci Rep. 2019;9(1):6923. doi: 10.1038/s41598-019-43356-7. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Moles L, Egimendia A, Osorio-Querejeta I, Iparraguirre L, Alberro A, Suárez J, Sepúlveda L, Castillo-Triviño T, Muñoz-Culla M, Ramos-Cabrer P, et al. Gut microbiota changes in experimental autoimmune encephalomyelitis and cuprizone mice models. ACS Chem Neurosci. 2021;12(5):893–905. doi: 10.1021/acschemneuro.0c00695. [PubMed] [CrossRef] [Google Scholar]
- Colpitts SL, Kasper EJ, Keever A, Liljenberg C, Kirby T, Magori K, Kasper LH, Ochoa-Repáraz J. A bidirectional association between the gut microbiota and CNS disease in a biphasic murine model of multiple sclerosis. Gut Microbes. 2017;8(6):561–573. doi: 10.1080/19490976.2017.1353843. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Lee YK, Menezes JS, Umesaki Y, Mazmanian SK. Proinflammatory T-cell responses to gut microbiota promote experimental autoimmune encephalomyelitis. Proc Natl Acad Sci USA. 2011;Suppl 108(supplement_1):4615–4622. doi: 10.1073/pnas.1000082107. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Ochoa-Reparaz J, Mielcarz DW, Ditrio LE, Burroughs AR, Begum-Haque S, Dasgupta S, Kasper DL, Kasper LH. Central nervous system demyelinating disease protection by the human commensal Bacteroides fragilis depends on polysaccharide a expression. The Journal Of Immunology. 2010;185(7):4101–4108. doi: 10.4049/jimmunol.1001443. [PubMed] [CrossRef] [Google Scholar]
- Telesford KM, Yan W, Ochoa-Reparaz J, Pant A, Kircher C, Christy MA, Begum-Haque S, Kasper DL, Kasper LH. A commensal symbiotic factor derived from Bacteroides fragilis promotes human CD39 + Foxp3 + T cells and T reg function. Gut Microbes. 2015;6(4):234–242. doi: 10.1080/19490976.2015.1056973. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Yamashita M, Ukibe K, Matsubara Y, Hosoya T, Sakai F, Kon S, Arima Y, Murakami M, Nakagawa H, Miyazaki T, et al. Lactobacillus helveticus SBT2171 attenuates experimental autoimmune encephalomyelitis in mice. Front Microbiol. 2017;8:2596. doi: 10.3389/fmicb.2017.02596. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Lavasani S, Dzhambazov B, Nouri M, Fåk F, Buske S, Molin G, Thorlacius H, Alenfall J, Jeppsson B, Weström B, et al. A novel probiotic mixture exerts a therapeutic effect on experimental autoimmune encephalomyelitis mediated by IL-10 producing regulatory T cells. PloS One. 2010;5(2):e9009. doi: 10.1371/journal.pone.0009009. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- He B, Hoang TK, Tian X, Taylor CM, Blanchard E, Luo M, Bhattacharjee MB, Freeborn J, Park S, Couturier J, et al. Lactobacillus reuteri reduces the severity of experimental autoimmune encephalomyelitis in mice by modulating gut microbiota. Front Immunol. 2019;10:385. doi: 10.3389/fimmu.2019.00385. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Consonni A, Cordiglieri C, Rinaldi E, Marolda R, Ravanelli I, Guidesi E, Elli M, Mantegazza R, Baggi F. Administration of bifidobacterium and lactobacillus strains modulates experimental myasthenia gravis and experimental encephalomyelitis in Lewis rats. Oncotarget. 2018;9(32):22269–22287. doi: 10.18632/oncotarget.25170. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Ezendam J, de Klerk A, Gremmer ER, van Loveren H. Effects of Bifidobacterium animalis administered during lactation on allergic and autoimmune responses in rodents. Clin Exp Immunol. 2008;154(3):424–431. doi: 10.1111/j.1365-2249.2008.03788.x. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Kwon HK, Kim G-C, Kim Y, Hwang W, Jash A, Sahoo A, Kim J-E, Nam JH, Im S-H. Amelioration of experimental autoimmune encephalomyelitis by probiotic mixture is mediated by a shift in T helper cell immune response. Clinical Immunology. 2013;146(3):217–227. doi: 10.1016/j.clim.2013.01.001. [PubMed] [CrossRef] [Google Scholar]
- Salehipour Z, Haghmorad D, Sankian M, Rastin M, Nosratabadi R, Soltan Dallal MM, Tabasi N, Khazaee M, Nasiraii LR, Mahmoudi M, et al. Bifidobacterium animalis in combination with human origin of Lactobacillus plantarum ameliorate neuroinflammation in experimental model of multiple sclerosis by altering CD4+ T cell subset balance. Biomed Pharmacother. 2017;95:1535–1548. doi: 10.1016/j.biopha.2017.08.117. [PubMed] [CrossRef] [Google Scholar]
- Mangalam A, Shahi SK, Luckey D, Karau M, Marietta E, Luo N, Choung RS, Ju J, Sompallae R, Gibson-Corley K, et al. Human gut-derived commensal bacteria suppress CNS inflammatory and demyelinating disease. Cell Rep. 2017;20(6):1269–1277. doi: 10.1016/j.celrep.2017.07.031. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Carrillo-Salinas FJ, Mestre L, Mecha M, Feliú A, Del Campo R, Villarrubia N, Espejo C, Montalbán X, Álvarez-Cermeño JC, Villar LM, et al. Gut dysbiosis and neuroimmune responses to brain infection with Theiler’s murine encephalomyelitis virus. Sci Rep. 2017;7(1):44377. doi: 10.1038/srep44377. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Omura S, Sato F, Park A-M, Fujita M, Khadka S, Nakamura Y, Katsuki A, Nishio K, Gavins FNE, Tsunoda I, et al. Bioinformatics analysis of gut microbiota and CNS transcriptome in virus-induced acute myelitis and chronic inflammatory demyelination; potential association of Distinct bacteria with CNS IgA upregulation. Front Immunol. 2020;11:1138. doi: 10.3389/fimmu.2020.01138. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Wang X, Chang L, Wan X, Tan Y, Qu Y, Shan J, Yang Y, Ma L, Hashimoto K. (R)-ketamine ameliorates demyelination and facilitates remyelination in cuprizone-treated mice: a role of gut–microbiota–brain axis. Neurobiology Of Disease. 2022;165:105635. doi: 10.1016/j.nbd.2022.105635. [PubMed] [CrossRef] [Google Scholar]
- Wang X, Eguchi A, Yang Y, Chang L, Wan X, Shan J, Qu Y, Ma L, Mori C, Yang J, et al. Key role of the gut–microbiota–brain axis via the subdiaphragmatic vagus nerve in demyelination of the cuprizone-treated mouse brain. Neurobiol Dis. 2023;176:105951. doi: 10.1016/j.nbd.2022.105951. [PubMed] [CrossRef] [Google Scholar]
- Liu S, Rezende RM, Moreira TG, Tankou SK, Cox LM, Wu M, Song A, Dhang FH, Wei Z, Costamagna G, et al. Oral administration of miR-30d from feces of MS patients suppresses MS-like symptoms in mice by expanding Akkermansia muciniphila. Cell Host & Microbe. 2019;26(6):779–794.e8. doi: 10.1016/j.chom.2019.10.008. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Haghikia A, Jörg S, Duscha A, Berg J, Manzel A, Waschbisch A, Hammer A, Lee D-H, May C, Wilck N, et al. Dietary fatty acids directly impact central nervous system autoimmunity via the small intestine. Immunity. 2015;43(4):817–829. doi: 10.1016/j.immuni.2015.09.007. [PubMed] [CrossRef] [Google Scholar]
- Duscha A, Gisevius B, Hirschberg S, Yissachar N, Stangl GI, Dawin E, Bader V, Haase S, Kaisler J, David C, et al. Propionic acid shapes the multiple sclerosis disease course by an immunomodulatory mechanism. Cell. 2020;180(6):1067–1080.e16. doi: 10.1016/j.cell.2020.02.035. [PubMed] [CrossRef] [Google Scholar]
- Braniste V, Al-Asmakh M, Kowal C, Anuar F, Abbaspour A, Tóth M, Korecka A, Bakocevic N, Ng LG, Kundu P, et al. The gut microbiota influences blood-brain barrier permeability in mice. Sci Transl Med. 2014;6(263):263ra158. doi: 10.1126/scitranslmed.3009759. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Mossad O, Erny D. The microbiota–microglia axis in central nervous system disorders. Brain Pathology. 2020;30(6):1159–1177. doi: 10.1111/bpa.12908. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Chen J, Chia N, Kalari KR, Yao JZ, Novotna M, Paz Soldan MM, Luckey DH, Marietta EV, Jeraldo PR, Chen X, et al. Multiple sclerosis patients have a distinct gut microbiota compared to healthy controls. Sci Rep. 2016;6(1):28484. doi: 10.1038/srep28484. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Jangi S, Gandhi R, Cox LM, Li N, von Glehn F, Yan R, Patel B, Mazzola MA, Liu S, Glanz BL, et al. Alterations of the human gut microbiome in multiple sclerosis. Nat Commun. 2016;7(1):12015. doi: 10.1038/ncomms12015. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Hughes LE, Bonell S, Natt RS, Wilson C, Tiwana H, Ebringer A, Cunningham P, Chamoun V, Thompson EJ, Croker J, et al. Antibody responses to Acinetobacter spp. And Pseudomonas aeruginosa in multiple sclerosis: prospects for diagnosis using the myelin-acinetobacter-neurofilament antibody index. Clin Diagn Lab Immunol. 2001;8(6):1181–1188. doi: 10.1128/CDLI.8.6.1181-1188.2001. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Farrokhi V, Nemati R, Nichols FC, Yao X, Anstadt E, Fujiwara M, Grady J, Wakefield D, Castro W, Donaldson J, et al. Bacterial lipodipeptide, lipid 654, is a microbiome-associated biomarker for multiple sclerosis. Clin & Trans Imm. 2013;2(11):e8. doi: 10.1038/cti.2013.11. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Mazmanian SK, Liu CH, Tzianabos AO, Kasper DL. An immunomodulatory molecule of symbiotic bacteria directs maturation of the host immune system. Cell. 2005;122(1):107–118. doi: 10.1016/j.cell.2005.05.007. [PubMed] [CrossRef] [Google Scholar]
- Tremlett H, Fadrosh DW, Faruqi AA, Hart J, Roalstad S, Graves J, Lynch S, Waubant E, Aaen G, Belman A, et al. Gut microbiota composition and relapse risk in pediatric MS: a pilot study. J Neurol Sci. 2016;363:153–157. doi: 10.1016/j.jns.2016.02.042. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Cady N, Peterson SR, Freedman SN, Mangalam AK. Beyond metabolism: the complex interplay between dietary phytoestrogens, gut bacteria, and cells of nervous and immune systems. Front Neurol. 2020;11:150. doi: 10.3389/fneur.2020.00150. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Freedman SN, Shahi SK, Mangalam AK. The “gut feeling”: breaking down the role of gut microbiome in multiple sclerosis. Neurotherapeutics. 2018;15(1):109–125. doi: 10.1007/s13311-017-0588-x. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Cocchi M, Mondo E, Romeo M, Traina G. The inflammatory conspiracy in multiple sclerosis: a crossroads of clues and insights through mast cells, platelets, inflammation, gut microbiota, mood disorders and stem cells. Int J Mol Sci. 2022;23(6):3253. doi: 10.3390/ijms23063253. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Garabatos N, Santamaria P. Gut microbial antigenic mimicry in autoimmunity. Front Immunol. 2022;13:873607. doi: 10.3389/fimmu.2022.873607. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Elsayed NS, Aston P, Bayanagari VR, Shukla SK. The gut microbiome molecular mimicry piece in the multiple sclerosis puzzle. Front Immunol. 2022;13:972160. doi: 10.3389/fimmu.2022.972160. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Brown AJ, Goldsworthy SM, Barnes AA, Eilert MM, Tcheang L, Daniels D, Muir AI, Wigglesworth MJ, Kinghorn I, Fraser NJ, et al. The Orphan G protein-coupled receptors GPR41 and GPR43 are activated by propionate and other short chain carboxylic acids. J Biol Chem. 2003;278(13):11312–11319. doi: 10.1074/jbc.M211609200. [PubMed] [CrossRef] [Google Scholar]
- Liu J, Li H, Gong T, Chen W, Mao S, Kong Y, Yu J, Sun J. Anti-neuroinflammatory effect of short-chain fatty acid acetate against Alzheimer’s disease via upregulating GPR41 and inhibiting ERK/JNK/NF-κB. J Agric Food Chem. 2020;68(27):7152–7161. doi: 10.1021/acs.jafc.0c02807. [PubMed] [CrossRef] [Google Scholar]
- Chevalier AC, Rosenberger TA. Increasing acetyl-CoA metabolism attenuates injury and alters spinal cord lipid content in mice subjected to experimental autoimmune encephalomyelitis. J Neurochem. 2017;141(5):721–737. doi: 10.1111/jnc.14032. [PubMed] [CrossRef] [Google Scholar]
- Smith PM, Howitt MR, Panikov N, Michaud M, Gallini CA, Bohlooly-Y M, Glickman JN, Garrett WS. The microbial metabolites, short-chain fatty acids, regulate colonic T reg cell homeostasis. Sci. 2013;341(6145):569–573. doi: 10.1126/science.1241165. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Hoyles L, Snelling T, Umlai U-K, Nicholson JK, Carding SR, Glen RC, McArthur S. Microbiome–host systems interactions: protective effects of propionate upon the blood–brain barrier. Microbiome. 2018;6(1). doi: 10.1186/s40168-018-0439-y. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Furusawa Y, Obata Y, Fukuda S, Endo TA, Nakato G, Takahashi D, Nakanishi Y, Uetake C, Kato K, Kato T, et al. Commensal microbe-derived butyrate induces the differentiation of colonic regulatory T cells. Nature. 2013;504(7480):446–450. doi: 10.1038/nature12721. [PubMed] [CrossRef] [Google Scholar]
- Kespohl M, Vachharajani N, Luu M, Harb H, Pautz S, Wolff S, Sillner N, Walker A, Schmitt-Kopplin P, Boettger T, et al. The microbial metabolite butyrate induces expression of Th1-associated factors in CD4(+) T cells. Front Immunol. 2017;8:1036. doi: 10.3389/fimmu.2017.01036. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Chang PV, Hao L, Offermanns S, Medzhitov R. The microbial metabolite butyrate regulates intestinal macrophage function via histone deacetylase inhibition. Proc Natl Acad Sci U S A. 2014;111(6):2247–2252. doi: 10.1073/pnas.1322269111. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Chen T, Noto D, Hoshino Y, Mizuno M, Miyake S. Butyrate suppresses demyelination and enhances remyelination. J Neuroinflammation. 2019;16(1):165. doi: 10.1186/s12974-019-1552-y. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Arpaia N, Campbell C, Fan X, Dikiy S, van der Veeken J, deRoos P, Liu H, Cross JR, Pfeffer K, Coffer PJ, et al. Metabolites produced by commensal bacteria promote peripheral regulatory T-cell generation. Nature. 2013;504(7480):451–455. doi: 10.1038/nature12726. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Luu M, Pautz S, Kohl V, Singh R, Romero R, Lucas S, Hofmann J, Raifer H, Vachharajani N, Carrascosa LC, et al. The short-chain fatty acid pentanoate suppresses autoimmunity by modulating the metabolic-epigenetic crosstalk in lymphocytes. Nat Commun. 2019;10(1):760. doi: 10.1038/s41467-019-08711-2. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Park J, Wang Q, Wu Q, Mao-Draayer Y, Kim CH. Bidirectional regulatory potentials of short-chain fatty acids and their G-protein-coupled receptors in autoimmune neuroinflammation. Sci Rep. 2019;9(1):8837. doi: 10.1038/s41598-019-45311-y. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Erny D, Hrabě de Angelis AL, Jaitin D, Wieghofer P, Staszewski O, David E, Keren-Shaul H, Mahlakoiv T, Jakobshagen K, Buch T, et al. Host microbiota constantly control maturation and function of microglia in the CNS. Nat Neurosci. 2015;18(7):965–977. doi: 10.1038/nn.4030. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Wenzel TJ, Gates EJ, Ranger AL, Klegeris A. Short-chain fatty acids (SCFAs) alone or in combination regulate select immune functions of microglia-like cells. Mol Cell Neurosci. 2020;105:103493. doi: 10.1016/j.mcn.2020.103493. [PubMed] [CrossRef] [Google Scholar]
- Sundaram TS, Giromini C, Rebucci R, Baldi A. Omega-3 Polyunsaturated fatty acids counteract inflammatory and oxidative damage of non-transformed porcine enterocytes. Anim (Basel). 2020;10(6):956. doi: 10.3390/ani10060956. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Denys A, Hichami A, Khan NA. N-3 PUFAs modulate T-cell activation via protein kinase C-α and -ε and the NF-κB signaling pathway. J Lipid Res. 2005;46(4):752–758. doi: 10.1194/jlr.M400444-JLR200. [PubMed] [CrossRef] [Google Scholar]
- Djuricic I, Calder PC. Beneficial outcomes of omega-6 and omega-3 Polyunsaturated fatty acids on human health: an update for 2021. Nutrients. 2021;13(7):2421. doi: 10.3390/nu13072421. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Fu Y, Wang Y, Gao H, Li D, Jiang R, Ge L, Tong C, Xu K. Associations among dietary omega-3 Polyunsaturated fatty acids, the gut microbiota, and intestinal immunity. Mediators Of Inflammation. 2021;2021:1–11. doi: 10.1155/2021/8879227. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Montgomery TL, Eckstrom K, Lile KH, Caldwell S, Heney ER, Lahue KG, D’Alessandro A, Wargo MJ, Krementsov DN. Lactobacillus reuteri tryptophan metabolism promotes host susceptibility to CNS autoimmunity. Microbiome. 2022;10(1):198. doi: 10.1186/s40168-022-01408-7. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Rothhammer V, Borucki DM, Garcia Sanchez MI, Mazzola MA, Hemond CC, Regev K, Paul A, Kivisäkk P, Bakshi R, Izquierdo G, et al. Dynamic regulation of serum aryl hydrocarbon receptor agonists in MS. Neurol Neuroimmunol Neuroinflamm. 2017;4(4):e359. doi: 10.1212/NXI.0000000000000359. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Sonner JK, Keil M, Falk-Paulsen M, Mishra N, Rehman A, Kramer M, Deumelandt K, Röwe J, Sanghvi K, Wolf L, et al. Dietary tryptophan links encephalogenicity of autoreactive T cells with gut microbial ecology. Nat Commun. 2019;10(1):4877. doi: 10.1038/s41467-019-12776-4. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Wilck N, Matus MG, Kearney SM, Olesen SW, Forslund K, Bartolomaeus H, Haase S, Mähler A, Balogh A, Markó L, et al. Salt-responsive gut commensal modulates T(H)17 axis and disease. Nature. 2017;551(7682):585–589. doi: 10.1038/nature24628. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Zelante T, Iannitti R, Cunha C, De Luca A, Giovannini G, Pieraccini G, Zecchi R, D’Angelo C, Massi-Benedetti C, Fallarino F, et al. Tryptophan catabolites from microbiota engage aryl hydrocarbon receptor and balance mucosal reactivity via interleukin-22. Immunity. 2013;39(2):372–385. doi: 10.1016/j.immuni.2013.08.003. [PubMed] [CrossRef] [Google Scholar]
- Venkatesh M, Mukherjee S, Wang H, Li H, Sun K, Benechet A, Qiu Z, Maher L, Redinbo M, Phillips R, et al. Symbiotic bacterial metabolites regulate gastrointestinal barrier function via the xenobiotic sensor PXR and toll-like receptor 4. Immunity. 2014;41(2):296–310. doi: 10.1016/j.immuni.2014.06.014. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Rothhammer V, Mascanfroni ID, Bunse L, Takenaka MC, Kenison JE, Mayo L, Chao C-C, Patel B, Yan R, Blain M, et al. Type I interferons and microbial metabolites of tryptophan modulate astrocyte activity and central nervous system inflammation via the aryl hydrocarbon receptor. Nat Med. 2016;22(6):586–597. doi: 10.1038/nm.4106. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Rothhammer V, Borucki DM, Tjon EC, Takenaka MC, Chao C-C, Ardura-Fabregat A, de Lima KA, Gutiérrez-Vázquez C, Hewson P, Staszewski O, et al. Microglial control of astrocytes in response to microbial metabolites. Nature. 2018;557(7707):724–728. doi: 10.1038/s41586-018-0119-x. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Owe-Young R, Webster NL, Mukhtar M, Pomerantz RJ, Smythe G, Walker D, Armati PJ, Crowe SM, Brew BJ. Kynurenine pathway metabolism in human blood–brain–barrier cells: implications for immune tolerance & neurotoxicity. J Neurochem. 2008;105(4):1346–1357. doi: 10.1111/j.1471-4159.2008.05241.x. [PubMed] [CrossRef] [Google Scholar]
- Lim CK, Bilgin A, Lovejoy DB, Tan V, Bustamante S, Taylor BV, Bessede A, Brew BJ, Guillemin GJ. Kynurenine pathway metabolomics predicts and provides mechanistic insight into multiple sclerosis progression. Sci Rep-Uk. 2017;7(1). doi: 10.1038/srep41473. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Guillemin GJ, Smythe G, Takikawa O, Brew BJ. Expression of indoleamine 2,3-dioxygenase and production of quinolinic acid by human microglia, astrocytes, and neurons. Glia. 2005;49(1):15–23. doi: 10.1002/glia.20090. [PubMed] [CrossRef] [Google Scholar]
- Rothhammer V, Kenison JE, Li Z, Tjon E, Takenaka MC, Chao C-C, Alves de Lima K, Borucki DM, Kaye J, Quintana FJ, et al. Aryl hydrocarbon receptor activation in astrocytes by laquinimod ameliorates autoimmune inflammation in the CNS. Neurol Neuroimmunol Neuroinflamm. 2021;8(2):e946. doi: 10.1212/NXI.0000000000000946. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Haase S, Haghikia A, Wilck N, Muller DN, Linker RA. Impacts of microbiome metabolites on immune regulation and autoimmunity. Immunology. 2018;154(2):230–238. doi: 10.1111/imm.12933. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Calvo-Barreiro L, Eixarch H, Ponce-Alonso M, Castillo M, Lebrón-Galán R, Mestre L, Guaza C, Clemente D, Del Campo R, Montalban X, et al. A commercial probiotic induces tolerogenic and reduces pathogenic responses in experimental autoimmune encephalomyelitis. Cells. 2020;9(4):906. doi: 10.3390/cells9040906. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- San Hernandez AM, Singh C, Valero DJ, Nisar J, Trujillo Ramirez JI, Kothari KK, Isola S, Gordon DK. Multiple sclerosis and serotonin: potential therapeutic applications. Cureus. 2020;12:e11293. doi: 10.7759/cureus.11293. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Wagner A, Wang C, Fessler J, DeTomaso D, Avila-Pacheco J, Kaminski J, Zaghouani S, Christian E, Thakore P, Schellhaass B, et al. Metabolic modeling of single Th17 cells reveals regulators of autoimmunity. Cell. 2021;184(16):4168–4185.e21. doi: 10.1016/j.cell.2021.05.045. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Carriche GM, Almeida L, Stüve P, Velasquez L, Dhillon-LaBrooy A, Roy U, Lindenberg M, Strowig T, Plaza-Sirvent C, Schmitz I, et al. Regulating T-cell differentiation through the polyamine spermidine. J Allergy Clin Immun. 2021;147(1):335–348.e11. doi: 10.1016/j.jaci.2020.04.037. [PubMed] [CrossRef] [Google Scholar]
- Yang Q, Zheng C, Cao J, Cao G, Shou P, Lin L, Velletri T, Jiang M, Chen Q, Han Y, et al. Spermidine alleviates experimental autoimmune encephalomyelitis through inducing inhibitory macrophages. Cell Death Differ. 2016;23(11):1850–1861. doi: 10.1038/cdd.2016.71. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Guo X, Harada C, Namekata K, Kimura A, Mitamura Y, Yoshida H, Matsumoto Y, Harada T. Spermidine alleviates severity of murine experimental autoimmune encephalomyelitis. Invest Ophthalmol Vis Sci. 2011;52(5):2696–2703. doi: 10.1167/iovs.10-6015. [PubMed] [CrossRef] [Google Scholar]
- Soda K, Kano Y, Nakamura T, Kasono K, Kawakami M, Konishi F. Spermine, a natural polyamine, suppresses LFA-1 expression on human lymphocyte. The Journal Of Immunology. 2005;175(1):237–245. doi: 10.4049/jimmunol.175.1.237. [PubMed] [CrossRef] [Google Scholar]
- Zhang S, Al-Maghout T, Cao H, Pelzl L, Salker MS, Veldhoen M, Cheng A, Lang F, Singh Y. Gut bacterial metabolite Urolithin a (UA) mitigates Ca(2+) entry in T cells by regulating miR-10a-5p. Front Immunol. 2019;10:1737. doi: 10.3389/fimmu.2019.01737. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Shen PX, Li X, Deng S-Y, Zhao L, Zhang Y-Y, Deng X, Han B, Yu J, Li Y, Wang Z-Z, et al. Urolithin a ameliorates experimental autoimmune encephalomyelitis by targeting aryl hydrocarbon receptor. EBioMedicine. 2021;64:103227. doi: 10.1016/j.ebiom.2021.103227. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Singh R, Chandrashekharappa S, Bodduluri SR, Baby BV, Hegde B, Kotla NG, Hiwale AA, Saiyed T, Patel P, Vijay-Kumar M, et al. Enhancement of the gut barrier integrity by a microbial metabolite through the Nrf2 pathway. Nat Commun. 2019;10(1). doi: 10.1038/s41467-018-07859-7. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Gong Z, Huang J, Xu B, Ou Z, Zhang L, Lin X, Ye X, Kong X, Long D, Sun X, et al. Urolithin a attenuates memory impairment and neuroinflammation in APP/PS1 mice. J Neuroinflammation. 2019;16(1):62. doi: 10.1186/s12974-019-1450-3. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- DaSilva NA, Nahar PP, Ma H, Eid A, Wei Z, Meschwitz S, Zawia NH, Slitt AL, Seeram NP. Pomegranate ellagitannin-gut microbial-derived metabolites, urolithins, inhibit neuroinflammation in vitro. Nutritional Neuroscience. 2019;22(3):185–195. doi: 10.1080/1028415X.2017.1360558. [PubMed] [CrossRef] [Google Scholar]
- Busto R, Serna J, Perianes-Cachero A, Quintana-Portillo R, García-Seisdedos D, Canfrán-Duque A, Paino CL, Lerma M, Casado ME, Martín-Hidalgo A, et al. Ellagic acid protects from myelin-associated sphingolipid loss in experimental autoimmune encephalomyelitis. Biochim Biophys Acta Mol Cell Biol Lipids. 2018;1863(9):958–967. doi: 10.1016/j.bbalip.2018.05.009. [PubMed] [CrossRef] [Google Scholar]
- Chen P, Chen FC, Lei JX, Wang GH, Zhou BH. The gut microbiota metabolite Urolithin B improves cognitive deficits by Inhibiting Cyt C-Mediated apoptosis and promoting the survival of neurons through the PI3K pathway in aging mice. Front Pharmacol. 2021;12:768097. doi: 10.3389/fphar.2021.768097. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Castillo-Alvarez F, Perez-Matute P, Oteo JA, Marzo-Sola ME. The influence of interferon β-1b on gut microbiota composition in patients with multiple sclerosis. Neurología (English Ed). 2021;36(7):495–503. doi: 10.1016/j.nrleng.2020.05.006. [PubMed] [CrossRef] [Google Scholar]
- Katz Sand I, Zhu Y, Ntranos A, Clemente JC, Cekanaviciute E, Brandstadter R, Crabtree-Hartman E, Singh S, Bencosme Y, Debelius J, et al. Disease-modifying therapies alter gut microbial composition in MS. Neurol Neuroimmunol Neuroinflamm. 2019;6(1):e517. doi: 10.1212/NXI.0000000000000517. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Abdurasulova IN, Tarasova EA, Nikiforova IG, Il’ves AG, Ivashkova EV, Matsulevich AV, Tatarinov AE, Shangina LV, Ermolenko EI, Klimenko VM, et al. The intestinal microbiota composition in patients with multiple sclerosis receiving different disease-modifying therapies DMT. Zh Nevrol Psikhiatr Im S S Korsakova. 2018;118(8):62–69. doi: 10.17116/jnevro201811808262. [PubMed] [CrossRef] [Google Scholar]
- Tremlett H, Fadrosh DW, Faruqi AA, Zhu F, Hart J, Roalstad S, Graves J, Lynch S, Waubant E. Gut microbiota in early pediatric multiple sclerosis: a case−control study. Euro J Of Neurology. 2016;23(8):1308–1321. doi: 10.1111/ene.13026. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Tremlett H, Fadrosh DW, Faruqi AA, Hart J, Roalstad S, Graves J, Spencer CM, Lynch SV, Zamvil SS, Waubant E, et al. Associations between the gut microbiota and host immune markers in pediatric multiple sclerosis and controls. BMC Neurol. 2016;16(1):182. doi: 10.1186/s12883-016-0703-3. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Shahi SK, Freedman SN, Murra AC, Zarei K, Sompallae R, Gibson-Corley KN, Karandikar NJ, Murray JA, Mangalam AK. Prevotella histicola, a human gut commensal, is as potent as COPAXONE® in an animal model of multiple sclerosis. Front Immunol. 2019;10:462. doi: 10.3389/fimmu.2019.00462. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Rumah KR, Vartanian TK, Fischetti VA. Oral multiple sclerosis drugs inhibit the in vitro growth of epsilon toxin producing gut bacterium, Clostridium perfringens. Front Cell Infect Microbiol. 2017;7:11. doi: 10.3389/fcimb.2017.00011. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Li QR, Wang CY, Tang C, He Q, Li N, Li JS. Reciprocal interaction between intestinal microbiota and mucosal lymphocyte in cynomolgus monkeys after alemtuzumab treatment. Am J Transplant. 2013;13(4):899–910. doi: 10.1111/ajt.12148. [PubMed] [CrossRef] [Google Scholar]
- Diebold M, Meola M, Purushothaman S, Siewert LK, Pössnecker E, Roloff T, Lindberg RL, Kuhle J, Kappos L, Derfuss T, et al. Gut microbiota composition as a candidate risk factor for dimethyl fumarate-induced lymphopenia in multiple sclerosis. Gut Microbes. 2022;14(1):2147055. doi: 10.1080/19490976.2022.2147055. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Dehghani F, Abdollahi S, Shidfar F, Clark CCT, Soltani S. Probiotics supplementation and brain-derived neurotrophic factor (BDNF): a systematic review and meta-analysis of randomized controlled trials. Nutr Neurosci. 2022;1–11. doi: 10.1080/1028415X.2022.2110664. [PubMed] [CrossRef] [Google Scholar]
- Valizadeh S, Majdi Seghinsara A, Maleki Chollou K, Bahadori A, Abbaszadeh S, Taghdir M, Behniafar H, Riahi SM. The efficacy of probiotics in experimental autoimmune encephalomyelitis (an animal model for MS): a systematic review and meta-analysis. Lett Appl Microbiol. 2021;73(4):408–417. doi: 10.1111/lam.13543. [PubMed] [CrossRef] [Google Scholar]
- Kap YS, Bus-Spoor C, van Driel N, Dubbelaar ML, Grit C, Kooistra SM, Fagrouch ZC, Verschoor EJ, Bauer J, Eggen BJL, et al. Targeted diet modification reduces multiple sclerosis–like disease in adult marmoset monkeys from an outbred colony. J Immunol. 2018;201(11):3229–3243. doi: 10.4049/jimmunol.1800822. [PubMed] [CrossRef] [Google Scholar]
- Mestre L, Carrillo-Salinas FJ, Feliú A, Mecha M, Alonso G, Espejo C, Calvo-Barreiro L, Luque-García JL, Estevez H, Villar LM, et al. How oral probiotics affect the severity of an experimental model of progressive multiple sclerosis? Bringing commensal bacteria into the neurodegenerative process. Gut Microbes. 2020;12(1):1813532. doi: 10.1080/19490976.2020.1813532. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Delgado S, Sanchez B, Margolles A, Ruas-Madiedo P, Ruiz L. Molecules produced by probiotics and intestinal microorganisms with immunomodulatory activity. Nutrients. 2020;12(2):391. doi: 10.3390/nu12020391. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Moravejolahkami AR, Paknahad Z, Chitsaz A. Dietary intake of energy and fiber in MS patients; an approach to prebiotics role. Nutr Food Sci. 2019;49(6):1039–1050. doi: 10.1108/NFS-01-2019-0001. [CrossRef] [Google Scholar]
- Mirashrafi S, Hejazi Taghanaki SZ, Sarlak F, Moravejolahkami AR, Hojjati Kermani MA, Haratian M. Effect of probiotics supplementation on disease progression, depression, general health, and anthropometric measurements in relapsing-remitting multiple sclerosis patients: a systematic review and meta-analysis of clinical trials. Int J Clin Pract. 2021;75(11):e14724. doi: 10.1111/ijcp.14724. [PubMed] [CrossRef] [Google Scholar]
- Jiang J, Chu C, Wu C, Wang C, Zhang C, Li T, Zhai Q, Yu L, Tian F, Chen W, et al. Efficacy of probiotics in multiple sclerosis: a systematic review of preclinical trials and meta-analysis of randomized controlled trials. Food Funct. 2021;12(6):2354–2377. doi: 10.1039/D0FO03203D. [PubMed] [CrossRef] [Google Scholar]
- Kouchaki E, Tamtaji OR, Salami M, Bahmani F, Daneshvar Kakhaki R, Akbari E, Tajabadi-Ebrahimi M, Jafari P, Asemi Z. Clinical and metabolic response to probiotic supplementation in patients with multiple sclerosis: a randomized, double-blind, placebo-controlled trial. Clin Nutr. 2017;36(5):1245–1249. doi: 10.1016/j.clnu.2016.08.015. [PubMed] [CrossRef] [Google Scholar]
- Tankou SK, Regev K, Healy BC, Tjon E, Laghi L, Cox LM, Kivisäkk P, Pierre IV, Hrishikesh L, Gandhi R, et al. A probiotic modulates the microbiome and immunity in multiple sclerosis. Ann Neurol. 2018;83(6):1147–1161. doi: 10.1002/ana.25244. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Zeraati M, Enayati M, Kafami L, Shahidi SH, Salari AA. Gut microbiota depletion from early adolescence alters adult immunological and neurobehavioral responses in a mouse model of multiple sclerosis. Neuropharmacology. 2019;157:107685. doi: 10.1016/j.neuropharm.2019.107685. [PubMed] [CrossRef] [Google Scholar]
- Bianchimano P, Britton GJ, Wallach DS, Smith EM, Cox LM, Liu S, Iwanowski K, Weiner HL, Faith JJ, Clemente JC, et al. Mining the microbiota to identify gut commensals modulating neuroinflammation in a mouse model of multiple sclerosis. Microbiome. 2022;10(1):174. doi: 10.1186/s40168-022-01364-2. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Chen H, Ma X, Liu Y, Ma L, Chen Z, Lin X, Si L, Ma X, Chen X. Gut microbiota interventions with Clostridium butyricum and norfloxacin modulate immune response in experimental autoimmune encephalomyelitis mice. Front Immunol. 2019;10:1662. doi: 10.3389/fimmu.2019.01662. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Yokote H, Miyake S, Croxford JL, Oki S, Mizusawa H, Yamamura T. NKT cell-dependent amelioration of a mouse model of multiple sclerosis by altering gut flora. The American Journal Of Pathology. 2008;173(6):1714–1723. doi: 10.2353/ajpath.2008.080622. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Miyauchi E, Kim S-W, Suda W, Kawasumi M, Onawa S, Taguchi-Atarashi N, Morita H, Taylor TD, Hattori M, Ohno H, et al. Gut microorganisms act together to exacerbate inflammation in spinal cords. Nature. 2020;585(7823):102–106. doi: 10.1038/s41586-020-2634-9. [PubMed] [CrossRef] [Google Scholar]
- McMurran CE, Guzman de la Fuente A, Penalva R, Ben Menachem-Zidon O, Dombrowski Y, Falconer J, Gonzalez GA, Zhao C, Krause FN, Young AMH, et al. The microbiota regulates murine inflammatory responses to toxin-induced CNS demyelination but has minimal impact on remyelination. Proc Natl Acad Sci U S A. 2019;116(50):25311–25321. doi: 10.1073/pnas.1905787116. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Suleiman L, Waubant E, Aaen G, Belman A, Benson L, Candee M, Chitnis T, Gorman M, Goyal M, Greenberg B, et al. Early infectious exposures are not associated with increased risk of pediatric-onset multiple sclerosis. Mult Scler Relat Disord. 2018;22:103–107. doi: 10.1016/j.msard.2018.03.015. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Baldin E, Zenesini C, Antonazzo IC, Bartolomei I, Caniatti L, Costa M, Curti E, Ferraro D, Foschi M, Granella F, et al. Antibiotic use and risk of multiple sclerosis: a nested case-control study in Emilia-Romagna region, Italy. Neuroepidemiology. 2021;55(3):224–231. doi: 10.1159/000515682. [PubMed] [CrossRef] [Google Scholar]
- Metz LM, Li D, Traboulsee A, Myles ML, Duquette P, Godin J, Constantin M, Yong VW. Glatiramer acetate in combination with minocycline in patients with relapsing—remitting multiple sclerosis: results of a Canadian, multicenter, double-blind, placebo-controlled trial. Mult Scler. 2009;15(10):1183–1194. doi: 10.1177/1352458509106779. [PubMed] [CrossRef] [Google Scholar]
- Sorensen PS, Sellebjerg F, Lycke J, Färkkilä M, Créange A, Lund CG, Schluep M, Frederiksen JL, Stenager E, Pfleger C, et al. Minocycline added to subcutaneous interferon β-1a in multiple sclerosis: randomized RECYCLINE study. Eur J Neurol. 2016;23(5):861–870. doi: 10.1111/ene.12953. [PubMed] [CrossRef] [Google Scholar]
- Parks NE, Jackson-Tarlton CS, Vacchi L, Merdad R, Johnston BC. Dietary interventions for multiple sclerosis-related outcomes. Cochrane Database Syst Rev. 2020;2020(5):CD004192. doi: 10.1002/14651858.CD004192.pub4. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Sanchez JMS, DePaula-Silva AB, Libbey JE, Fujinami RS. Role of diet in regulating the gut microbiota and multiple sclerosis. Clin Immunol. 2022;235:108379. doi: 10.1016/j.clim.2020.108379. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Valburg C, Sonti A, Stern JN, Najjar S, Harel A. Dietary factors in experimental autoimmune encephalomyelitis and multiple sclerosis: a comprehensive review. Mult Scler. 2021;27(4):494–502. doi: 10.1177/1352458520923955. [PubMed] [CrossRef] [Google Scholar]
- Bhargava P, Cassard S, Steele SU, Azevedo C, Pelletier D, Sugar EA, Waubant E, Mowry EM. The vitamin D to ameliorate multiple sclerosis (VIDAMS) trial: study design for a multicenter, randomized, double-blind controlled trial of vitamin D in multiple sclerosis. Contemporary Clinical Trials. 2014;39(2):288–293. doi: 10.1016/j.cct.2014.10.004. [PubMed] [CrossRef] [Google Scholar]
- Rosjo E, Steffensen LH, Jørgensen L, Lindstrøm JC, Šaltytė Benth J, Michelsen AE, Aukrust P, Ueland T, Kampman MT, Torkildsen Ø, et al. Vitamin D supplementation and systemic inflammation in relapsing-remitting multiple sclerosis. J Neurol. 2015;262(12):2713–2721. doi: 10.1007/s00415-015-7902-5. [PubMed] [CrossRef] [Google Scholar]
- Fitzgerald KC, Munger KL, Köchert K, Arnason BGW, Comi G, Cook S, Goodin DS, Filippi M, Hartung H-P, Jeffery DR, et al. Association of vitamin D levels with multiple sclerosis activity and progression in patients receiving interferon beta-1b. JAMA Neurol. 2015;72(12):1458–1465. doi: 10.1001/jamaneurol.2015.2742. [PubMed] [CrossRef] [Google Scholar]
- Shieh A, Lee, SM, Lagishetty V, Gottleib C, Jacobs, JP, Adams, JS. Pilot trial of vitamin D3 and calcifediol in healthy vitamin D deficient adults: does it change the fecal microbiome? J Clin Endocrinol Metab. 2021;106(12):3464–3476. doi: 10.1210/clinem/dgab573. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Naderpoor N, Mousa A, Fernanda Gomez Arango L, Barrett HL, Dekker Nitert M, de Courten B. Effect of vitamin D supplementation on faecal microbiota: a randomised clinical trial. Nutrients. 2019;11(12):2888. doi: 10.3390/nu11122888. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Enam F, Mansell TJ. Prebiotics: tools to manipulate the gut microbiome and metabolome. J Ind Microbiol Biotechnol. 2019;46(9–10):1445–1459. doi: 10.1007/s10295-019-02203-4. [PubMed] [CrossRef] [Google Scholar]
- Berer K, Martínez I, Walker A, Kunkel B, Schmitt-Kopplin P, Walter J, Krishnamoorthy G. Dietary non-fermentable fiber prevents autoimmune neurological disease by changing gut metabolic and immune status. Sci Rep. 2018;8(1):10431. doi: 10.1038/s41598-018-28839-3. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Moravejolahkami AR, Paknahad Z, Chitsaz A. Dietary intake of energy and fiber in MS patients; an approach to prebiotics role. Nutr Food Sci. 2019;49(6):1039–1050. doi: 10.1108/NFS-01-2019-0001. [CrossRef] [Google Scholar]
- Calvo-Barreiro L, Eixarch H, Cornejo T, Costa C, Castillo M, Mestre L, Guaza C, Martínez-Cuesta MDC, Tanoue T, Honda K, et al. Selected Clostridia strains from the human microbiota and their metabolite, butyrate, improve experimental autoimmune encephalomyelitis. Neurotherapeutics. 2021;18(2):920–937. doi: 10.1007/s13311-021-01016-7. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Di Biase A, Salvati S, Di Benedetto R, Attorri L, Martinelli A, Malchiodi F. Eicosapentaenoic acid pre-treatment reduces biochemical changes induced in total brain and myelin of weanling wistar rats by cuprizone feeding. Prostaglandins, Leukotrienes And Essential Fatty Acids. 2014;90(4):99–104. doi: 10.1016/j.plefa.2013.11.004. [PubMed] [CrossRef] [Google Scholar]
- Torkildsen Ø, Brunborg LA, Thorsen F, Mørk SJ, Stangel M, Myhr K-M, Bø L. Effects of dietary intervention on MRI activity, de- and remyelination in the cuprizone model for demyelination. Exp Neurol. 2009;215(1):160–166. doi: 10.1016/j.expneurol.2008.09.026. [PubMed] [CrossRef] [Google Scholar]
- Fleck AK, Hucke S, Teipel F, Eschborn M, Janoschka C, Liebmann M, Wami H, Korn L, Pickert G, Hartwig M, et al. Dietary conjugated linoleic acid links reduced intestinal inflammation to amelioration of CNS autoimmunity. Brain. 2021;144(4):1152–1166. doi: 10.1093/brain/awab040. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Dong TA, Sandesara PB, Dhindsa DS, Mehta A, Arneson LC, Dollar AL, Taub PR, Sperling LS. Intermittent fasting: a heart healthy dietary pattern? The American Journal Of Medicine. 2020;133(8):901–907. doi: 10.1016/j.amjmed.2020.03.030. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Catenacci VA, Pan Z, Ostendorf D, Brannon S, Gozansky WS, Mattson MP, Martin B, MacLean PS, Melanson EL, Troy Donahoo W, et al. A randomized pilot study comparing zero-calorie alternate-day fasting to daily caloric restriction in adults with obesity. Obesity (Silver Spring). 2016;24(9):1874–1883. doi: 10.1002/oby.21581. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Duenas M, Muñoz-González I, Cueva C, Jiménez-Girón A, Sánchez-Patán F, Santos-Buelga C, Moreno-Arribas MV, Bartolomé B. A survey of modulation of gut microbiota by dietary polyphenols. BioMed Research International. 2015;2015:1–15. doi: 10.1155/2015/850902. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Ginwala R, McTish E, Raman C, Singh N, Nagarkatti M, Nagarkatti P, Sagar D, Jain P, Khan ZK. Apigenin, a natural flavonoid, attenuates EAE severity through the modulation of dendritic cell and other immune cell functions. J Neuroimmune Pharmacol. 2016;11(1):36–47. doi: 10.1007/s11481-015-9617-x. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Aktas O, Prozorovski T, Smorodchenko A, Savaskan NE, Lauster R, Kloetzel P-M, Infante-Duarte C, Brocke S, Zipp F. Green Tea Epigallocatechin-3-Gallate Mediates T Cellular NF-κB inhibition and exerts Neuroprotection in autoimmune encephalomyelitis. J Immunol. 2004;173(9):5794–5800. doi: 10.4049/jimmunol.173.9.5794. [PubMed] [CrossRef] [Google Scholar]
- Haghmorad D, Mahmoudi, MB, Salehipour Z, Jalayer Z, Rastin M, Kokhaei P, Mahmoudi M. Hesperidin ameliorates immunological outcome and reduces neuroinflammation in the mouse model of multiple sclerosis. J Neuroimmunol. 2017;302:23–33. doi: 10.1016/j.jneuroim.2016.11.009. [PubMed] [CrossRef] [Google Scholar]
- Verbeek R, van Tol EA, van Noort JM. Oral flavonoids delay recovery from experimental autoimmune encephalomyelitis in SJL mice. Biochem Pharmacol. 2005;70(2):220–228. doi: 10.1016/j.bcp.2005.04.041. [PubMed] [CrossRef] [Google Scholar]
- Sato F, Martinez NE, Shahid M, Rose JW, Carlson NG, Tsunoda I. Resveratrol exacerbates both autoimmune and viral models of multiple sclerosis. The American Journal Of Pathology. 2013;183(5):1390–1396. doi: 10.1016/j.ajpath.2013.07.006. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Ghaiad HR, Nooh MM, El-Sawalhi MM, Shaheen AA. Resveratrol promotes remyelination in cuprizone model of multiple sclerosis: biochemical and histological study. Mol Neurobiol. 2017;54(5):3219–3229. doi: 10.1007/s12035-016-9891-5. [PubMed] [CrossRef] [Google Scholar]
- Dolati S, Babaloo Z, Ayromlou H, Ahmadi M, Rikhtegar R, Rostamzadeh D, Roshangar L, Nouri M, Mehdizadeh A, Younesi V, et al. Nanocurcumin improves regulatory T-cell frequency and function in patients with multiple sclerosis. J Neuroimmunol. 2019;327:15–21. doi: 10.1016/j.jneuroim.2019.01.007. [PubMed] [CrossRef] [Google Scholar]
- Wang C, Huang Z, Yu K, Ding R, Ye K, Dai C, Xu X, Zhou G, Li C. High-salt diet has a certain impact on protein Digestion and gut microbiota: a sequencing and proteome combined study. Front Microbiol. 2017;8:1838. doi: 10.3389/fmicb.2017.01838. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Ferguson JF, Aden LA, Barbaro NR, Van Beusecum JP, Xiao L, Simons AJ, Warden C, Pasic L, Himmel LE, Washington MK, et al. High dietary salt–induced DC activation underlies microbial dysbiosis-associated hypertension. JCI Insight. 2019;5(13). doi: 10.1172/jci.insight.126241. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Hernandez AL, Kitz A, Wu C, Lowther DE, Rodriguez DM, Vudattu N, Deng S, Herold KC, Kuchroo VK, Kleinewietfeld M, et al. Sodium chloride inhibits the suppressive function of FOXP3+ regulatory T cells. J Clin Invest. 2015;125(11):4212–4222. doi: 10.1172/JCI81151. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Haase S, Wilck N, Haghikia A, Gold R, Mueller DN, Linker RA. The role of the gut microbiota and microbial metabolites in neuroinflammation. Eur J Immunol. 2020;50(12):1863–1870. doi: 10.1002/eji.201847807. [PubMed] [CrossRef] [Google Scholar]
- Farez MF, Fiol MP, Gaitan MI, Quintana FJ, Correale J. Sodium intake is associated with increased disease activity in multiple sclerosis. J Neurol Neurosurg Psychiatry. 2015;86(1):26–31. doi: 10.1136/jnnp-2014-307928. [PubMed] [CrossRef] [Google Scholar]
- Fitzgerald KC, Munger KL, Hartung H-P, Freedman MS, Montalbán X, Edan G, Wicklein E-M, Radue E-W, Kappos L, Pohl C, et al. Sodium intake and multiple sclerosis activity and progression in BENEFIT. Ann Neurol. 2017;82(1):20–29. doi: 10.1002/ana.24965. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- McDonald J, Graves J, Waldman A, Lotze T, Schreiner T, Belman A, Greenberg B, Weinstock-Guttman B, Aaen G, Tillema J-M, et al. A case-control study of dietary salt intake in pediatric-onset multiple sclerosis. Mult Scler Relat Disord. 2016;6:87–92. doi: 10.1016/j.msard.2016.02.011. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Nourbakhsh B, Graves J, Casper TC, Lulu S, Waldman A, Belman A, Greenberg B, Weinstock-Guttman B, Aaen G, Tillema J-M, et al. Dietary salt intake and time to relapse in paediatric multiple sclerosis. J Neurol Neurosurg Psychiatry. 2016;87(12):1350–1353. doi: 10.1136/jnnp-2016-313410. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Phillips MCL. Fasting as a Therapy in neurological disease. Nutrients. 2019;11(10):2501. doi: 10.3390/nu11102501. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Storoni M, Plant GT. The therapeutic potential of the ketogenic diet in treating progressive multiple sclerosis. Mult Scler Int. 2015;2015:681289. doi: 10.1155/2015/681289. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Choi IY, Piccio L, Childress P, Bollman B, Ghosh A, Brandhorst S, Suarez J, Michalsen A, Cross A, Morgan T, et al. A diet mimicking fasting promotes regeneration and reduces autoimmunity and multiple sclerosis symptoms. Cell Rep. 2016;15(10):2136–2146. doi: 10.1016/j.celrep.2016.05.009. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Razeghi Jahromi S, Ghaemi A, Alizadeh A, Sabetghadam F, Moradi Tabriz H, Togha M. Effects of intermittent fasting on experimental Autoimune encephalomyelitis in C57BL/6 mice. Iran J Allergy Asthma Immunol. 2016;15:212–219. [PubMed] [Google Scholar]
- Bai M, Wang Y, Han R, Xu L, Huang M, Zhao J, Lin Y, Song S, Chen Y. Intermittent caloric restriction with a modified fasting-mimicking diet ameliorates autoimmunity and promotes recovery in a mouse model of multiple sclerosis. J Nutr Biochem. 2021;87:108493. doi: 10.1016/j.jnutbio.2020.108493. [PubMed] [CrossRef] [Google Scholar]
- Cignarella F, Cantoni C, Ghezzi L, Salter A, Dorsett Y, Chen L, Phillips D, Weinstock GM, Fontana L, Cross AH, et al. Intermittent fasting confers protection in CNS autoimmunity by altering the gut microbiota. Cell Metab. 2018;27(6):1222–1235.e6. doi: 10.1016/j.cmet.2018.05.006. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Bahr LS, Bock M, Liebscher D, Bellmann-Strobl J, Franz L, Prüß A, Schumann D, Piper SK, Kessler CS, Steckhan N, et al. Ketogenic diet and fasting diet as nutritional approaches in multiple sclerosis (NAMS): protocol of a randomized controlled study. Trials. 2020;21(1). doi: 10.1186/s13063-019-3928-9. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Cantoni C, Lin Q, Dorsett Y, Ghezzi L, Liu Z, Pan Y, Chen K, Han Y, Li Z, Xiao H, et al. Alterations of host-gut microbiome interactions in multiple sclerosis. EBioMedicine. 2022;76:103798. doi: 10.1016/j.ebiom.2021.103798. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Saresella M, Mendozzi L, Rossi V, Mazzali F, Piancone F, LaRosa F, Marventano I, Caputo D, Felis GE, Clerici M, et al. Immunological and clinical effect of diet modulation of the gut microbiome in multiple sclerosis patients: a pilot study. Front Immunol. 2017;8:1391. doi: 10.3389/fimmu.2017.01391. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Wahls TL, Titcomb TJ, Bisht B, Eyck PT, Rubenstein LM, Carr LJ, Darling WG, Hoth KF, Kamholz J, Snetselaar LG, et al. Impact of the Swank and Wahls elimination dietary interventions on fatigue and quality of life in relapsing-remitting multiple sclerosis: the WAVES randomized parallel-arm clinical trial. Mult Scler J Exp Transl Clin. 2021;7(3):20552173211035399. doi: 10.1177/20552173211035399. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Irish AK, Erickson CM, Wahls TL, Snetselaar LG, Darling WG. Randomized control trial evaluation of a modified Paleolithic dietary intervention in the treatment of relapsing-remitting multiple sclerosis: a pilot study. Degener Neurol Neuromuscul Dis. 2017;7:1–18. doi: 10.2147/DNND.S116949. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Yadav V, Marracci G, Kim E, Spain R, Cameron M, Overs S, Riddehough A, Li DKB, McDougall J, Lovera J, et al. Low-fat, plant-based diet in multiple sclerosis: a randomized controlled trial. Mult Scler Relat Disord. 2016;9:80–90. doi: 10.1016/j.msard.2016.07.001. [PubMed] [CrossRef] [Google Scholar]
- Halkjaer SI, Boolsen AW, Gunther S, Christensen AH, Petersen AM. Can fecal microbiota transplantation cure irritable bowel syndrome? World J Gastroenterol. 2017;23(22):4112–4120. doi: 10.3748/wjg.v23.i22.4112. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Paramsothy S, Kamm MA, Kaakoush NO, Walsh AJ, van den Bogaerde J, Samuel D, Leong RWL, Connor S, Ng W, Paramsothy R, et al. Multidonor intensive faecal microbiota transplantation for active ulcerative colitis: a randomised placebo-controlled trial. Lancet. 2017;389(10075):1218–1228. doi: 10.1016/S0140-6736(17)30182-4. [PubMed] [CrossRef] [Google Scholar]
- Xue LJ, Yang X-Z, Tong Q, Shen P, Ma S-J, Wu S-N, Zheng J-L, Wang H-G. Fecal microbiota transplantation therapy for Parkinson’s disease: a preliminary study. Med. 2020;99(35):e22035. doi: 10.1097/MD.0000000000022035. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Mao D, Jiang Q, Sun Y, Mao Y, Guo L, Zhang Y, Man M, Ouyang G, Sheng L. Treatment of intestinal graft-versus-host disease with unrelated donor fecal microbiota transplantation capsules: a case report. Med. 2020;99(38):e22129. doi: 10.1097/MD.0000000000022129. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Li K, Wei S, Hu L, Yin X, Mai Y, Jiang C, Peng X, Cao X, Huang Z, Zhou H, et al. Protection of fecal microbiota transplantation in a mouse model of multiple sclerosis. Mediators Of Inflammation. 2020;2020:1–13. doi: 10.1155/2020/2058272. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Makkawi S, Camara-Lemarroy C, Metz L. Fecal microbiota transplantation associated with 10 years of stability in a patient with SPMS. Neurol Neuroimmunol Neuroinflamm. 2018;5(4):e459. doi: 10.1212/NXI.0000000000000459. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Engen PA, Zaferiou A, Rasmussen H, Naqib A, Green SJ, Fogg LF, Forsyth CB, Raeisi S, Hamaker B, Keshavarzian A, et al. Single-arm, non-randomized, time series, single-subject study of fecal microbiota transplantation in multiple sclerosis. Front Neurol. 2020;11:978. doi: 10.3389/fneur.2020.00978. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Al KF, Craven LJ, Gibbons S, Parvathy SN, Wing AC, Graf C, Parham KA, Kerfoot SM, Wilcox H, Burton JP, et al. Fecal microbiota transplantation is safe and tolerable in patients with multiple sclerosis: a pilot randomized controlled trial. Mult Scler J Exp Transl Clin. 2022;8(2):20552173221086662. doi: 10.1177/20552173221086662. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Tanasescu R, Tench CR, Constantinescu CS, Telford G, Singh S, Frakich N, Onion D, Auer DP, Gran B, Evangelou N, et al. Hookworm treatment for relapsing multiple sclerosis: a randomized Double-blinded placebo-controlled trial. JAMA Neurol. 2020;77(9):1089–1098. doi: 10.1001/jamaneurol.2020.1118. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Correale J, Farez MF. The impact of parasite infections on the course of multiple sclerosis. J Neuroimmunol. 2011;233(1–2):6–11. doi: 10.1016/j.jneuroim.2011.01.002. [PubMed] [CrossRef] [Google Scholar]
- Jenkins TP, Pritchard DI, Tanasescu R, Telford G, Papaiakovou M, Scotti R, Cortés A, Constantinescu CS, Cantacessi C. Experimental infection with the hookworm, necator americanus, is associated with stable gut microbial diversity in human volunteers with relapsing multiple sclerosis. BMC Biol. 2021;19(1):74. doi: 10.1186/s12915-021-01003-6. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Barone M, Mendozzi L, D’Amico F, Saresella M, Rampelli S, Piancone F, La Rosa F, Marventano I, Clerici M, d’Arma A, et al. Influence of a high-impact multidimensional rehabilitation program on the gut microbiota of patients with multiple sclerosis. Int J Mol Sci. 2021;22(13):7173. doi: 10.3390/ijms22137173. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Комментарии
Комментариев пока нет