ООО "ПРОПИОНИКС"
| пн-пт с 09:00 до 18:00 | |
Биосинтез пропионовой кислоты и трегалозы пропионибактериями из отходов пищевого производства
Микробиологический синтез пропионовой кислоты и трегалозы в среде из отходов с/х и пищевой промышленности
Использование штамма Propionibacterium freudenreichii T82 для эффективного биосинтеза пропионовой кислоты и трегалозы в среде с экстрактом яблочных выжимок и картофельными сточными водами
Аннотация
Пропионовокислые бактерии являются источником многих метаболитов, например, пропионовой кислоты и трегалозы. По сравнению с микробиологическим синтезом, производство этих метаболитов нефтехимическим путем или ферментативной конверсией является более выгодным. Компоненты микробиологических сред составляют значительную часть затрат, связанных с пропионовой ферментацией, из-за высоких требований Propionibacterium к питанию. Эту проблему можно решить, создав среду на основе побочных продуктов технологических процессов, которые могут выступать в качестве источников питания и в то же время заменять дорогостоящие лабораторные препараты (например, пептон и дрожжевой экстракт). Метаболическую активность P. freudenreichii исследовали на двух различных средах размножения: на среде, содержащей пептон, дрожжевой экстракт и биотин, и на среде на основе отходов, состоящей только из яблочных выжимок и картофельных сточных вод. Наибольшая продукция пропионовой кислоты в количестве 14,54 г/л была получена на среде, содержащей яблочные выжимки и чистые лабораторные добавки, с выходом 0,44 г/г. Важно отметить, что параметры производства кислоты на среде с отходами достигли практически того же уровня (12,71 г/л, 0,42 г/г), что и на среде с чистыми добавками. Синтез уксусной кислоты был более эффективным в отработанной среде, которая также характеризовалась более высоким уровнем накопленной трегалозы (59,8 мг/г с.о.) (прим. ред.: с.о. = сухой осадок). Таким образом, полученные результаты показывают, что бактерии P. freudenreichii проявляли относительно высокую метаболическую активность в среде, где в качестве источника углерода использовались яблочные выжимки, а в качестве источника азота - картофельные сточные воды. Такой способ получения пропионита может быть более дешевым и устойчивым, чем химический.
1. Введение
Пропионовокислые бактерии (ПКБ) представляют собой грамположительные неспорообразующие палочки. Их классифицируют как анаэробные или относительно анаэробные. Оптимальными условиями роста пропионибактерий являются pH в диапазоне 6,0–7,0 и температура в диапазоне 30–37 °C. Propionibacterium freudenreichii использовались в производстве сыра, кормового силоса и в питании животных в качестве пробиотиков. ПКБ являются источником многих ценных метаболитов, включая пропионовую кислоту, витамины группы В (например, В12), бактериоцины, трегалозу и гликоген [1].
Ежегодное производство пропионовой кислоты составляет более 400 000 тонн, а мировым магнатом является немецкая компания BASF [2]. Для промышленных целей пропионат синтезируют нефтехимическими методами — процессами Реппе и Ларсона. Процесс Реппе включает конверсию этилена, оксида углерода и водяного пара в пропионовую кислоту, а в процессе Ларсона пропионовую кислоту получают из этанола и оксида углерода в присутствии катализатора (трифторида бора) [2,3]. Пропионовая кислота используется в основном в пищевой и кормовой промышленности в качестве консерванта для подавления роста дрожжей и плесени. Кроме того, пропионовая кислота и ее производные используются в качестве субстратов при производстве целлюлозных волокон, гербицидов, парфюмерии и фармацевтических препаратов [4]. (см.: размер рынка пропионовой кислоты и прогноз - ред.)
Трегалоза встречается в растениях, беспозвоночных и микроорганизмах, включая клетки ПКБ. В промышленных масштабах трегалоза производится путем трансформации мальтодекстринов или крахмала (из картофеля, кукурузы и тапиоки), которая катализируется в основном ферментами, выделенными из бактерий Arthobacter ramosus Q36 - мальто-олигозилтрегалоза синтазой и мальто-олигозилтрегалоза трегалогидролазой. Использование ферментативной трансформации привело к значительному снижению цены на трегалозу (со 100 до 5-6 долларов за килограмм) и повышению ее доступности на рынке. В настоящее время ежегодное производство трегалозы составляет около 30 000-50 000 тонн [5]. Благодаря своим уникальным свойствам трегалоза имеет широкий спектр применения. Трегалоза в два раза слаще сахарозы и снижает секрецию инсулина, что делает ее идеальной для производства продуктов питания для диабетиков [4]. Трегалоза также является компонентом глазных капель (для лечения сухости глаз), растворов, используемых для хранения тканей, органов, ферментов и вакцин. Кроме того, она используется в кремах и косметических лосьонах для удержания влаги или повышения их стабильности при хранении [6]. Кроме того, предпринимались попытки использовать трегалозу для лечения остеопороза и нейродегенеративных заболеваний, таких как болезни Альцгеймера, Паркинсона и Хантингтона [7,8,9,10].
Растущее общественное сознание и забота об окружающей среде в совокупности способствовали увеличению спроса на экологичные пищевые и косметические продукты. Интересной альтернативой, позволяющей экономично и устойчиво производить промышленно ценные вещества, представляется биотехнологическая утилизация промышленных отходов с использованием микроорганизмов, таких как ПКБ [11,12,13,14,15,16]. Они имеют статусы GRAS и QPS, что указывает на возможность использования живых клеток и метаболитов этих микроорганизмов в производстве продуктов питания, косметики и лекарств.
Пищевая промышленность производит значительное количество сточных вод и твердых отходов, представляя тем самым серьезную угрозу для окружающей среды. Утилизация этих отходов - дело хлопотное и дорогостоящее. По этой причине ведется поиск эффективных методов их утилизации, которые были бы одновременно экологически безопасными и коммерчески выгодными. Использование ПКБ для утилизации отходов может быть полезным, так как позволяет получить метаболиты этих микроорганизмов. Это может позволить отказаться от нефтехимического пути синтеза пропионовой кислоты, а также снизить затраты на производство отдельных соединений и, в конечном итоге, целевых продуктов (отходы широко доступны и дешевы, являются резервуаром биологически активных соединений, таких как сахара, источники азота, витамины и минералы, и, таким образом, могут снизить затраты на питательные среды). Кроме того, потребители могут быть обеспечены продуктами микробиологического происхождения без химического синтеза. Но самое главное - это эффективная утилизация отходов, улучшающая качество окружающей среды. Это особенно важно, учитывая, что химические процессы требуют невозобновляемого нефтехимического сырья, а также загрязняют окружающую среду.
Переработка яблок приводит к образованию твердых отходов и сточных вод. Количество яблочных выжимок зависит от сорта яблок и используемой технологии прессования и составляет 10-30 % от массы плодов [17]. В основном они содержат воду, которая составляет около 70 % массы этих отходов. В состав сухого вещества выжимки входят сахариды, белки, минеральные вещества, пектин, клетчатка, липиды, органические кислоты, витамины, а также красящие и ароматические вещества [18]. Яблочные выжимки используются как компонент корма для животных, а также могут применяться в биогазовых установках. Консервация выжимки путем замораживания или сушки требует затрат на оборудование (приобретение, обслуживание) и энергию. Яблочные выжимки являются нестабильным материалом и подвержены микробиологическому заражению в свежем (не консервированном) виде, в основном из-за высокого содержания воды и биологически активных соединений [19,20,21]. Неконтролируемый рост микроорганизмов в яблочных выжимках может привести к потере их ценных технологических свойств, в том числе содержания питательных веществ. Поэтому альтернативным решением является биотехнологическая утилизация свежих выжимок сразу после процесса прессования, например, утилизация с помощью ПКБ.
Картофельные сточные воды образуются в процессе производства картофельного крахмала. В Европе ежегодно производится около 1,7 миллиона тонн картофельного крахмала. Подсчитано, что переработка 1000 тонн картофеля приводит к образованию около 600 тонн картофельных сточных вод. Картофельные сточные воды содержат около 2,9-4,3% сухого вещества, из которых белок составляет 0,93-1,57%, сахара - 0,5-0,8%, жир - 0,2%, минеральные вещества - 1%. Это также богатый источник белка и витаминов, в основном группы В. Картофельные сточные воды не имеют специального применения - чаще всего они используются для удобрения полей в качестве источника азота, поглощаемого растениями. Однако сточные воды картофеля имеют высокую степень загрязнения, поэтому их использование в качестве удобрения может привести к водной эвтрофикации и ухудшению плодородия почвы [22,23]. Поэтому по-прежнему существует необходимость поиска новых эффективных способов утилизации этих отходов.
В большинстве научных отчетов описывается, что ПКБ можно выращивать в среде, содержащей отходы, что часто требует добавления дорогостоящих источников азота или других элементов в виде чистых лабораторных препаратов. В более ранних исследованиях [11,12] в качестве источника углерода использовались яблочные выжимки, а в качестве источника азота - пептон и дрожжевой экстракт. Принимая во внимание эффективность процесса и понесенные затраты, было показано, что производство пропионата в этих условиях нерентабельно (цена 1 кг пропионата = 3 долл.) [12], так как затраты на компоненты субстрата (пептон, дрожжевой экстракт, биотин и минеральные соли) очень высоки. Это привело к необходимости исследовать, можно ли заменить дорогостоящие добавки гораздо более дешевым сырьем, которое довольно опасно для окружающей среды, таким как картофельные сточные воды, которые являются богатым источником азота, минералов и витаминов. Поэтому целью настоящего исследования было проанализировать способность отобранного штамма ПКБ расти на среде, содержащей отходы сельского хозяйства и пищевой промышленности в качестве источников углерода и азота (яблочные выжимки и картофельные сточные воды), а также синтез пропионовой кислоты и накопление трегалозы.
В этом исследовании были проведены три варианта культивирования в колбах, и использовались следующие среды: (1) только яблочные выжимки; (2) яблочные выжимки и чистые лабораторные препараты (дрожжевой экстракт, пептон, биотин); (3) яблочные выжимки и картофельные сточные воды. Кроме того, для каждого варианта использовались две различные концентрации источников углерода (2% и 4%). Используемые концентрации были определены исходя из содержания сахара в тестируемых отходах.
2. Результаты и обсуждение
2.1. Состав яблочных выжимок и сточных вод картофеля

Картофельные сточные воды характеризовались более высоким уровнем pH и содержанием азота по сравнению с яблочными выжимками (табл. 1). В 100 мл картофельных сточных вод содержалось 0,214 г азота, в то время как в 100 мл экстракта выжимки - только 0,022 г. Общее содержание сахаров в экстракте яблочной выжимки составило 4,54 г/100 мл. Доля фруктозы была самой высокой в общем содержании сахара (53 %), за ней следовали глюкоза (42 %) и сахароза (5 %). С другой стороны, в 100 мл картофельных сточных вод было обнаружено всего 0,51 г сахаров. Аналогично данному исследованию, Мадьяр и другие [20] в своем исследовании отметили, что большинство сахаров в использованных выжимках представлены глюкозой и фруктозой, а сахароза составляет 1%. В свою очередь, в выжимках, использованных Скиннером и др. [21], сахара составляли до 57 % состава, большую часть которых составляли фруктоза (44 %) и глюкоза (около 18 %). Общей чертой всех исследованных образцов яблочных выжимок было незначительное количество белка. В картофельных сточных водах, использованных в исследованиях Kot et al. [24, 25], концентрация азота составляла 0,206 и 0,232 г/100 мл, соответственно, а прямых редуцирующих сахаров - 1,38 и 0,73 г/100 мл, соответственно. Следует помнить, что химический состав отходов зависит, помимо прочего, от сорта сырья, климатических и атмосферных условий при выращивании, времени сбора урожая и метода хранения или переработки сырья [26].
Таблица 1. Характеристики отходов
|
Компонент/параметр
|
Экстракт яблочных выжимок
|
Картофельные сточные воды
|
|
Общее количество сахаров (г/100 мл)
|
4.54 ± 0.11
|
0.51 ± 0.08
|
|
Глюкоза (г/100 мл)
|
1.91 ± 0.11 (42%)
|
0.24 ± 0.02 (47%)
|
|
Фруктоза (г/100 мл)
|
2.42 ± 0.14 (53%)
|
0.27 ± 0.00 (53%)
|
|
Сахароза (г/100 мл)
|
0.21 ± 0.08 (5%)
|
0.00 ± 0.00 (0%)
|
|
Общий белок (г/100 мл)
|
0.138 ± 0.020
|
1.338 ± 0.057
|
|
Азот (г/100 мл)
|
0.022 ± 0.030
|
0.214 ± 0.009
|
|
pH
|
3.82
|
5.09
|
|
C/N
|
39.2:1
|
0.5:1
|
Молярное соотношение углерода и азота составило 0,5:1 в сточных водах картофеля и 39,2:1 в яблочных выжимках. Этот результат показывает, что сточные воды картофеля могут использоваться в качестве источника азота и, таким образом, заменять пептон или дрожжевой экстракт, которые являются довольно дорогими. В свою очередь, благодаря содержанию сахара, яблочные выжимки могут служить источником углерода для микроорганизмов. Однако самостоятельное (отдельное) использование картофельных сточных вод или яблочных выжимков не даст положительных результатов из-за низкого содержания отдельных субстратов в этих отходах - азота в случае выжимки и сахара в случае картофельных сточных вод. Это приведет к очень высокому или очень низкому молярному соотношению углерода и азота в питательной среде, что, в свою очередь, ограничит метаболическую активность микроорганизмов [11]. В предыдущих исследованиях уже было описано, что тип и концентрация источников азота и витаминов влияют на метаболическую активность ПКБ [27,28]. Fröhlich-Wyder et al. [29] также показали, что недостаток аспаргиновой кислоты в среде подавлял рост Propionibacterium. Кроме того, некоторые аминокислоты (в основном аргинин и аспаргиновая кислота) действуют как буфер, стабилизируя метаболизм ПКБ и улучшая кинетику ферментации за счет снижения ингибирующего действия кислот на эти бактерии [30].
2.2. Потребление источников углерода и рост штамма Propionibacterium freudenreichii T82
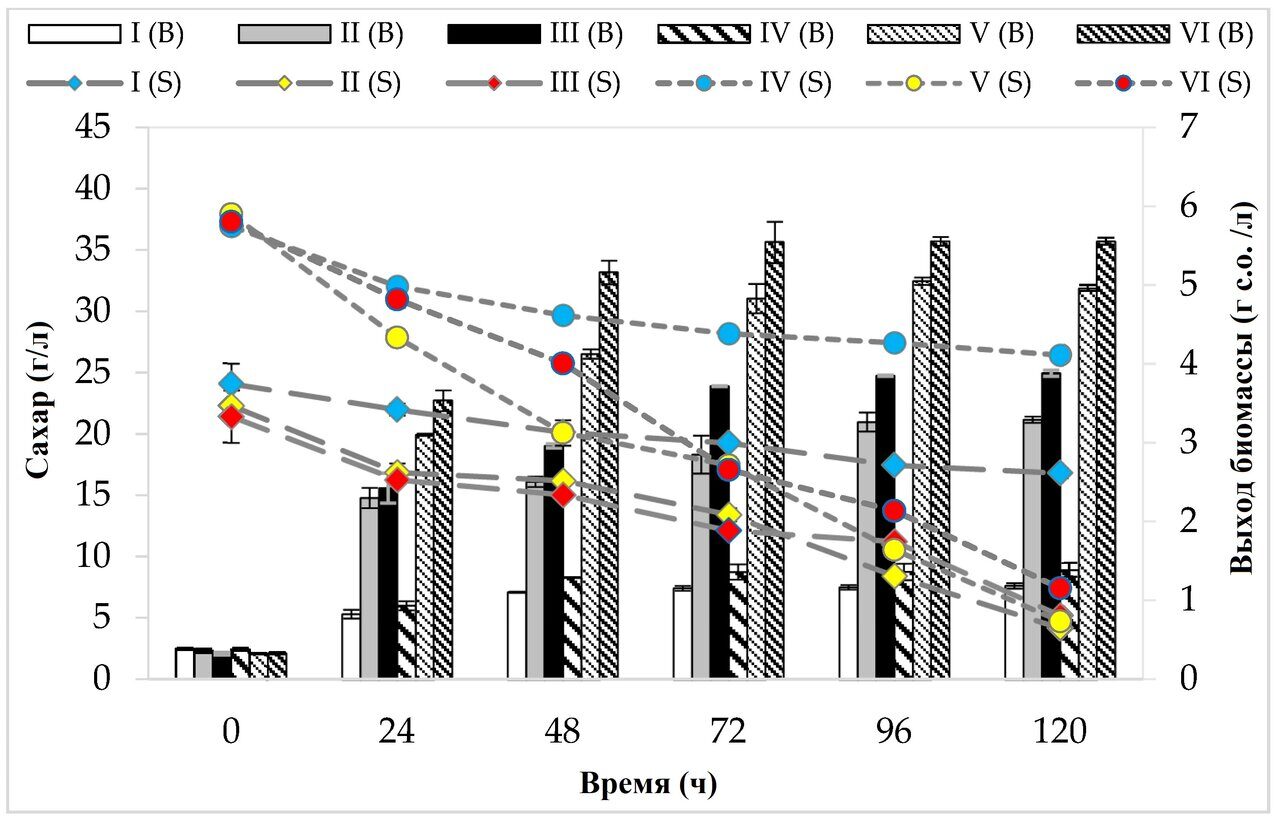
В начале культивирования среды I, II и III содержали около 20 г/л редуцирующих сахаров (суммарно глюкозы и фруктозы). Максимальная утилизация источников углерода тестируемым штаммом независимо от варианта среды отмечена при 120 ч культивирования. Установлено, что ни в одном из проанализированных вариантов не потреблялось все количество сахаров, имеющихся в субстрате (рис. 1). Наибольшая утилизация глюкозы и фруктозы (81%, 18,08 г/л) наблюдалась на среде с пептоном, дрожжевым экстрактом и другими добавками (среда II). Среды IV, V и VI характеризовались более высокой концентрацией источников углерода — содержание глюкозы и фруктозы составляло 3,7–3,9%. Максимальное использование источников углерода (редуцирующих сахаров) зафиксировано в последний день ферментации на среде V (88%, 33,39 г/л).
Рисунок 1. Потребление источников углерода и рост штамма P. freudenreichii T82. В график включены редуцирующие сахара (глюкоза и фруктоза); потребление сахарозы не учитывалось, так как исследуемый штамм не усваивает и не ферментирует этот дисахарид/ Содержание сахарозы в отдельных средах: (г/100 мл): I - 0,08 ± 0,02; II — 0,09 ± 0,01; III — 0,07 ± 0,00; IV — 0,15 ± 0,02; В — 0,16 ± 0,03; VI — 0,15 ± 0,01.
Наибольший выход биомассы (5,55 г с.о./л) исследуемого штамма был обнаружен через 72 ч культивирования на среде VI, содержащей яблочные выжимки и картофельные сточные воды (рис. 1). Самый слабый рост штамма P. freudenreichii T82, независимо от концентрации источников углерода, был обнаружен на средах, состоящих только из экстракта яблочных выжимок (среда I-1,16 г д.с./л, среда IV-1,36 г д.с./л). Это было связано со следовым количеством азота и высоким молярным соотношением углерода и азота (36,6:1 и 34,9:1, соответственно) в этих средах.
На основании полученных результатов можно сделать вывод, что штамм P. freudenreichii T82 способен расти на среде, состоящей из экстракта яблочной выжимки и сточных вод картофеля. Более того, наибольшее увеличение биомассы тестируемого штамма было зафиксировано на среде, содержащей картофельные сточные воды, что свидетельствует о том, что источники азота в исследуемых отходах хорошо усваивались ПКБ (аминокислоты, амины, пептиды). Лучший рост бактерий, наблюдаемый на среде, содержащей картофельные сточные воды, мог быть обусловлен, например, большей доступностью более подходящих источников азота по сравнению с дрожжевым экстрактом или пептоном (например, аргинина или аспаргиновой кислоты) [29]. Это также может быть связано с тем, что молярное соотношение углерода и азота в среде с картофельными сточными водами было ниже по сравнению со средой, содержащей дрожжевой экстракт, пептон и другие добавки, что свидетельствует о более высоком содержании азота, который направлял бактериальный метаболизм на образование биомассы. Производство карбоновых кислот (например, пропионовой кислоты) происходит при наличии благоприятных условий для роста бактерий - избыточного количества углерода и ограниченного количества азота. С другой стороны, когда среда содержит слишком много азота, большая часть углерода используется бактериями для роста клеток, а не для биосинтеза кислот [31].
2.3. Производство пропионовой кислоты
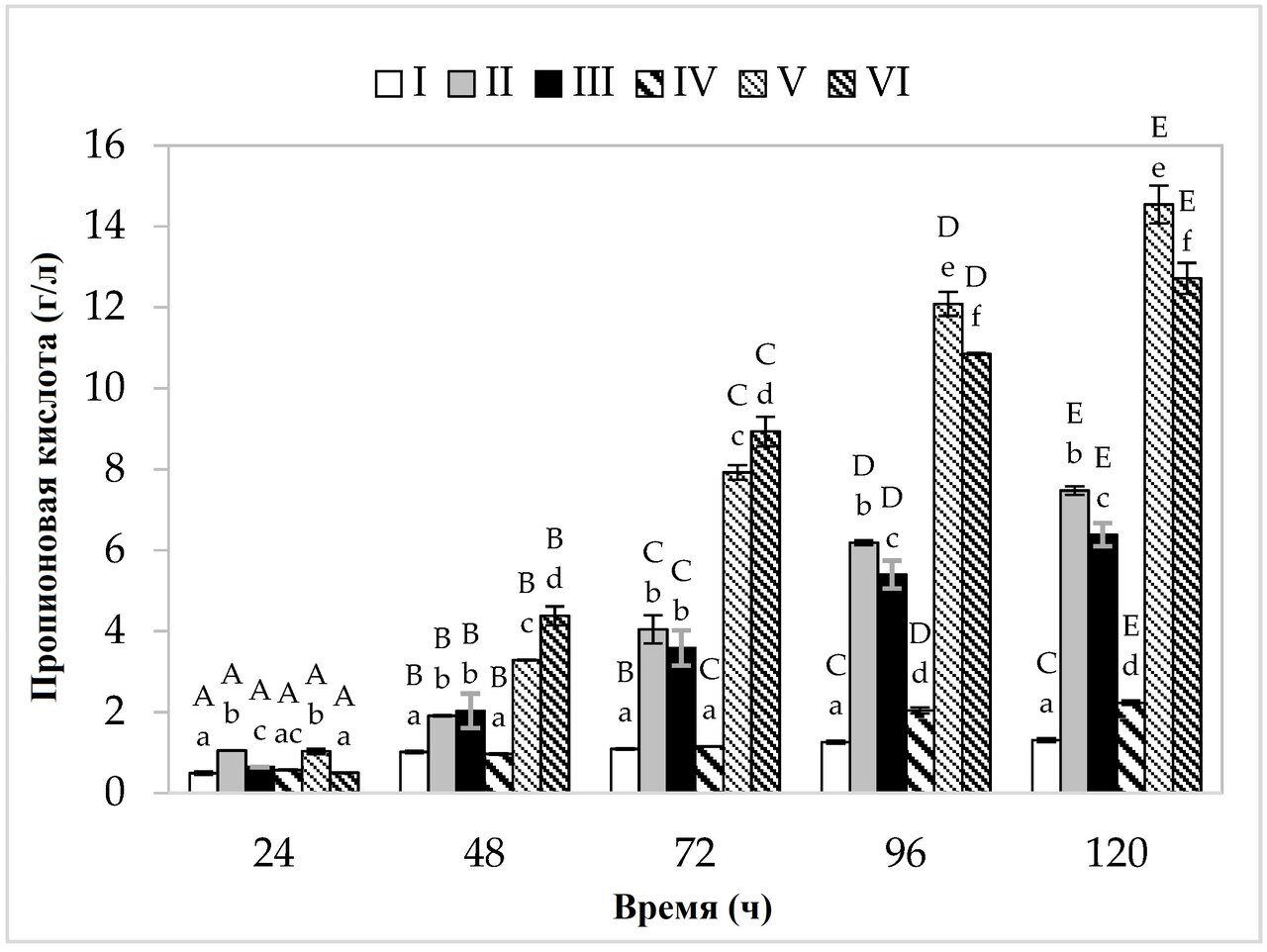
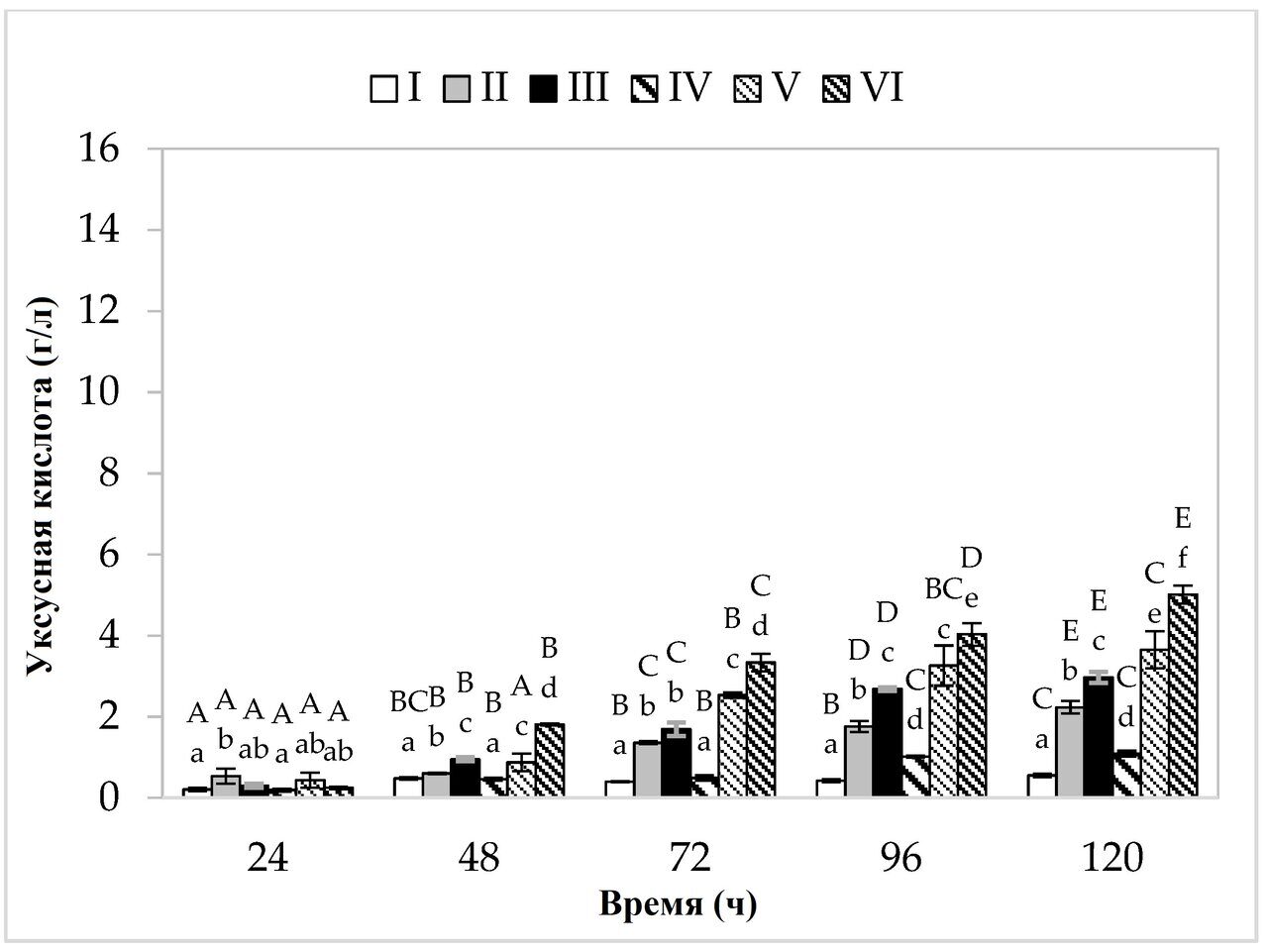
Что касается производства пропионовой кислоты (рис. 2), то на среде, содержащей дрожжевой экстракт, пептон и другие добавки, в варианте культивирования с более низким содержанием сахара, максимальный синтез (7,48 г/л) был обнаружен через 120 ч ферментации. На среде с яблочными выжимками и картофельными сточными водами бактерии продуцировали в среднем 6,39 г/л пропионата (рис. 3). На средах с более высоким содержанием сахара наблюдалось увеличение выхода обеих кислот. Наибольшее количество пропионовой кислоты (14,54 г/л) образовалось в среде V, содержащей дрожжевой экстракт и пептон, в то время как в среде, содержащей только отходы (яблочные выжимки и картофельные сточные воды), уровень этого метаболита достиг 12,72 г/л. Максимальное производство уксусной кислоты (5,01 г/л) было обнаружено в среде с картофельными сточными водами (с примерно 4 % содержанием источников углерода) через 120 ч ферментации.
Рисунок 2. Производство пропионовой кислоты. A, B, C, D и E - однородные группы по влиянию времени культивирования на продукцию пропионовой кислоты - тест Тьюки (проведен односторонний дисперсионный анализ); a, b, c, d, e и f - однородные группы по влиянию среды на продукцию пропионовой кислоты - тест Тьюки (проведен односторонний дисперсионный анализ).
Рисунок 3. Производство уксусной кислоты. A, B, C, D и E - однородные группы по влиянию времени культивирования на производство уксусной кислоты - тест Тьюки (проведен односторонний дисперсионный анализ); a, b, c, d, e и f - однородные группы по влиянию среды на производство уксусной кислоты - тест Тьюки (проведен односторонний дисперсионный анализ).
Наибольшая эффективность производства пропионовой кислоты наблюдалась на среде V (вариант с повышенным содержанием сахара) (табл. 2). На этой среде бактерии произвели 0,44 г пропионовой кислоты из 1 г источника углерода, при относительно низкой эффективности производства уксусной кислоты (0,11 г/г). Среди вариантов с картофельными сточными водами наилучшие результаты были достигнуты на среде с 4%-ным содержанием сахара, где из 1 г источника углерода было произведено 0,42 г пропионовой кислоты. Важно отметить, что на средах, содержащих эти отходы, отмечена более высокая эффективность синтеза уксусной кислоты (среда III - 0,18 г/г, среда VI - 0,16 г/г). В случае Propionibacterium производство пропионовой кислоты тесно связано с ростом клеток. Как производство пропионата, так и процессы роста клеток связаны с путями, включающими фосфорилирование на субстратном уровне и баланс внутриклеточных окислительно-восстановительных процессов (гликолиз, пентозофосфатный путь, путь Вуда-Веркмана). При образовании клеточной биомассы и синтезе пропионовой кислоты (субстратом в обоих случаях является пируват) NADH окисляется до NAD+ (при образовании биомассы образуется 5,75 молей NAD+, а при производстве кислоты - два моля). Среда с картофельными сточными водами (независимо от концентрации сахара) показала более высокий выход биомассы, чем среды II и V, и эффективное производство пропионовой кислоты, что, вероятно, привело к более эффективному синтезу уксусной кислоты. Для поддержания внутриклеточного окислительно-восстановительного баланса ПКБ вырабатывают компенсаторный метаболит в виде уксусной кислоты, в процессе которого NAD+ восстанавливается до NADH [32,33].
Таблица 2. Параметры пропионовокислого брожения.
|
Среда
|
Выход PA
|
Выход AA
|
Продуктивность PA
|
Продуктивность AA
|
Соотношение P/A
|
|
(г/г)
|
(г/лч)
|
||||
|
I
|
0.18
|
0.08
|
0.011
|
0.005
|
2.37:1
|
|
II
|
0.41
|
0.12
|
0.062
|
0.019
|
3.53:1
|
|
III
|
0.39
|
0.18
|
0.053
|
0.025
|
2.15:1
|
|
IV
|
0.21
|
0.10
|
0.019
|
0.009
|
2.05:1
|
|
V
|
0.44
|
0.11
|
0.121
|
0.030
|
3.99:1
|
|
VI
|
0.42
|
0.16
|
0.106
|
0.042
|
2.53:1
|
Наиболее благоприятное весовое соотношение пропионовой и уксусной кислот было отмечено на средах, содержащих дрожжевой экстракт и пептон (3,5:1 и 3,9:1) (табл. 2). Следует помнить, что экстракция пропионовой кислоты из культуральной жидкости ингибируется уксусной кислотой. Таким образом, низкая концентрация уксусной кислоты в среде повышает эффективность экстракции пропионовой кислоты. Хотя уксусная кислота снижает выход пропионовой кислоты, ее производства нельзя избежать в случае некоторых субстратов. Поскольку гликолиз не может обеспечить достаточное количество NADH для синтеза пропионовой кислоты (при использовании глюкозы в качестве источника углерода), производство уксусной кислоты обеспечивает дополнительную реакцию восстановления для поддержания внутриклеточного окислительно-восстановительного баланса. Производство пропионовой кислоты из глюкозы, которая имеет более низкую степень восстановления, чем пропионовая кислота, требует совместного производства более окисленного метаболита (например, уксусной кислоты). Поэтому, чтобы повысить эффективность производства пропионата и его экстракции, необходимо ограничить синтез уксусной кислоты. В этом контексте среды с дрожжевым экстрактом и пептоном являются более предпочтительными (высокое соотношение P/A и низкий выход продукции уксусной кислоты).
Выход пропионовой кислоты из яблочных выжимок и картофельных сточных вод оказался относительно высоким. Однако ферментация этих отходов может быть усовершенствована для снижения синтеза уксусной кислоты, что приведет к повышению эффективности производства пропионата и улучшению весового соотношения P/A в посткультурной жидкости. Этого можно достичь, используя отработанный глицерин в качестве дополнительного источника углерода. Глицерин характеризуется той же степенью восстановления, что и пропионовая кислота, и поэтому его превращение в пируват может обеспечить достаточное количество NADH для биосинтеза пропионовой кислоты без необходимости совместного производства уксусной кислоты в качестве компенсирующего метаболита. Гораздо более благоприятный баланс производства пропионовой кислоты при использовании питательных сред, дополненных дрожжевым экстрактом и пептоном, может быть достигнут в результате дополнительного обогащения биотином [11]. Биотин является кофактором, играющим важную роль в синтезе пропионовой кислоты. Он участвует в реакции транскарбоксилирования, катализируемой ферментом метилмалонил-КоА карбоксилтрансферазой, который переносит карбоксильную группу от метилмалонил-КоА к пирувату с образованием щавелевой кислоты и пропионил-КоА. Предполагалось, что оптимальная концентрация этого кофактора в среде повышает сродство пути Вуда-Веркмана к пирувату, что приводит к более высокому выходу пропионата и более благоприятному весовому соотношению метаболитов. Однако в данном исследовании среда, содержащая картофельные сточные воды, не дополнялась биотином, поскольку целью было проанализировать, как ПКБ будет справляться в среде, полностью состоящей из отходов.
Для культивирования ПКБ использовали различные источники азота, как в виде лабораторных препаратов (дрожжевой экстракт, пептон, (NH4)2SO4), так и в виде промышленных отходов (кукурузная пульпа, выжимки сахарного тростника, соевая меласса, жидкие кислые белковые остатки сои, побочный продукт мокрого помола кукурузы, багасса сладкого сорго, кукурузный крутой щелок). В случае с отходами побочный продукт часто служит одновременно источником углерода, азота и других компонентов, необходимых для эффективного метаболизма микроорганизмов [13,14,27,34,35,36,37,38]. Данное исследование показывает, что яблочные выжимки из-за низкого содержания белка являются плохим источником азота и поэтому не могут быть использованы в качестве единственного ингредиента. Эффективность производства пропионовой кислоты на среде, состоящей исключительно из выжимки, составила всего 0,21 г/г. Это указывает на необходимость дополнительного обогащения данного отхода. Добавление к выжимкам дрожжевого экстракта и пептона повышает эффективность производства пропионовой кислоты (0,41-0,44 г/г), но является нерентабельным. По данным Piwowrek et al. [12], рыночная цена 1 кг пропионовой кислоты в этом случае составит около 3 долларов (в основном из-за затрат на добавки), в то время как текущая рыночная цена 1 кг химически полученного пропионата составляет 1-2 доллара. Поэтому для конкурентоспособного биотехнологического синтеза пропионовой кислоты с использованием Propionibacterium и яблочных выжимок необходимо использовать более дешевый заменитель источника азота. В данном исследовании показано, что картофельные сточные воды (0,39-0,42 г/г) могут быть перспективным источником азота. Общая цель исследования - использовать дешевые или совсем бесполезные (из-за отсутствия управления) отходы для экологического производства соединений промышленного значения, которые впоследствии будут иметь более низкую рыночную цену из-за снижения себестоимости (за счет использования отходов в качестве субстратов). Кроме того, переработка биоотходов в промышленно ценные вещества связана с рядом других преимуществ, таких как менее негативное воздействие на окружающую среду, утилизация отходов, снижение потребности в энергии и воде.
Использование сточных вод картофеля в качестве источника азота, витаминов и минералов в среде яблочной выжимки представляется весьма перспективным по сравнению с другими отработанными средами, использовавшимися до сих пор. Более низкие или близкие выходы пропионовой кислоты с помощью ПКБ были зафиксированы при использовании гидролизата артишока (эффективность со свободными клетками - 0,38 г/г, эффективность с иммобилизованными клетками - 0,43 г/г) [39], соевой мелассы (или ее гидролизата) с кукурузным крутым щелоком (0,39, 0,42 и 0,46 г/г в зависимости от варианта культивирования) [37] и гидролизата кукурузной соломы (0,44 г/г) [35]. С другой стороны, в научных отчетах описывается значительно более высокий выход пропионата при использовании ПКБ и отходов. Ферментация гидролизата сладкой багассы из сорго привела к выходу пропионовой кислоты 0,51 г/г [13]. Однако следует отметить, что такая эффективность была получена при добавлении к отходам дрожжевого экстракта, соевого триптического бульона, K2HPO4 и MnSO4, что в конечном итоге приводит к значительному увеличению затрат на производство. Максимальный выход пропионата из выжимки и картофельных сточных вод (без дополнительной добавки) составил 0,42 г из 1 г источников углерода. Такой выход был обеспечен культивированием свободных клеток в колбах, поэтому можно предположить, что, как и в вышеупомянутых работах, использование иммобилизованных клеток P. freudenreichii T82 и культивирование в биореакторной среде позволит интенсифицировать синтез пропионовой кислоты. Преимущество использования яблочных выжимок и картофельных сточных вод заключается в том, что эти отходы не требуют ферментативного гидролиза, а содержащийся в них углерод напрямую усваивается ПКБ. Это позволяет сэкономить затраты, связанные с процессом ферментативного гидролиза (время, вода, энергия, оборудование и покупка ферментов).
2.4. Накопление трегалозы
Известно несколько путей метаболизма трегалозы - OtsAB, TreS, TreYZ, TreP и TreT, из которых первые два используются Propionibacterium. Согласно данным, опубликованным в 2007 году, виды P. freudenreichii синтезируют это соединение по пути OtsAB, в то время как путь TreS отвечает за его катаболизм [40,41]. Путь OtsAB включает два ферментативных этапа, которые катализируются трегалозо-6-фосфат синтазой (OtsA) и трегалозо фосфатазой (OtsB), соответственно [42]. ПКБ накапливают трегалозу в ответ на осмотический, окислительный [43], кислотный или тепловой стресс [40,42]. В стрессовых условиях трегалоза поддерживает тургор клеток (т.е. гидростатическое давление в случае повышенного осмотического давления) или стабилизирует клеточные мембраны (белки и мембраны организма), когда клеткам приходится выдерживать сильный перепад рН в кислой среде.
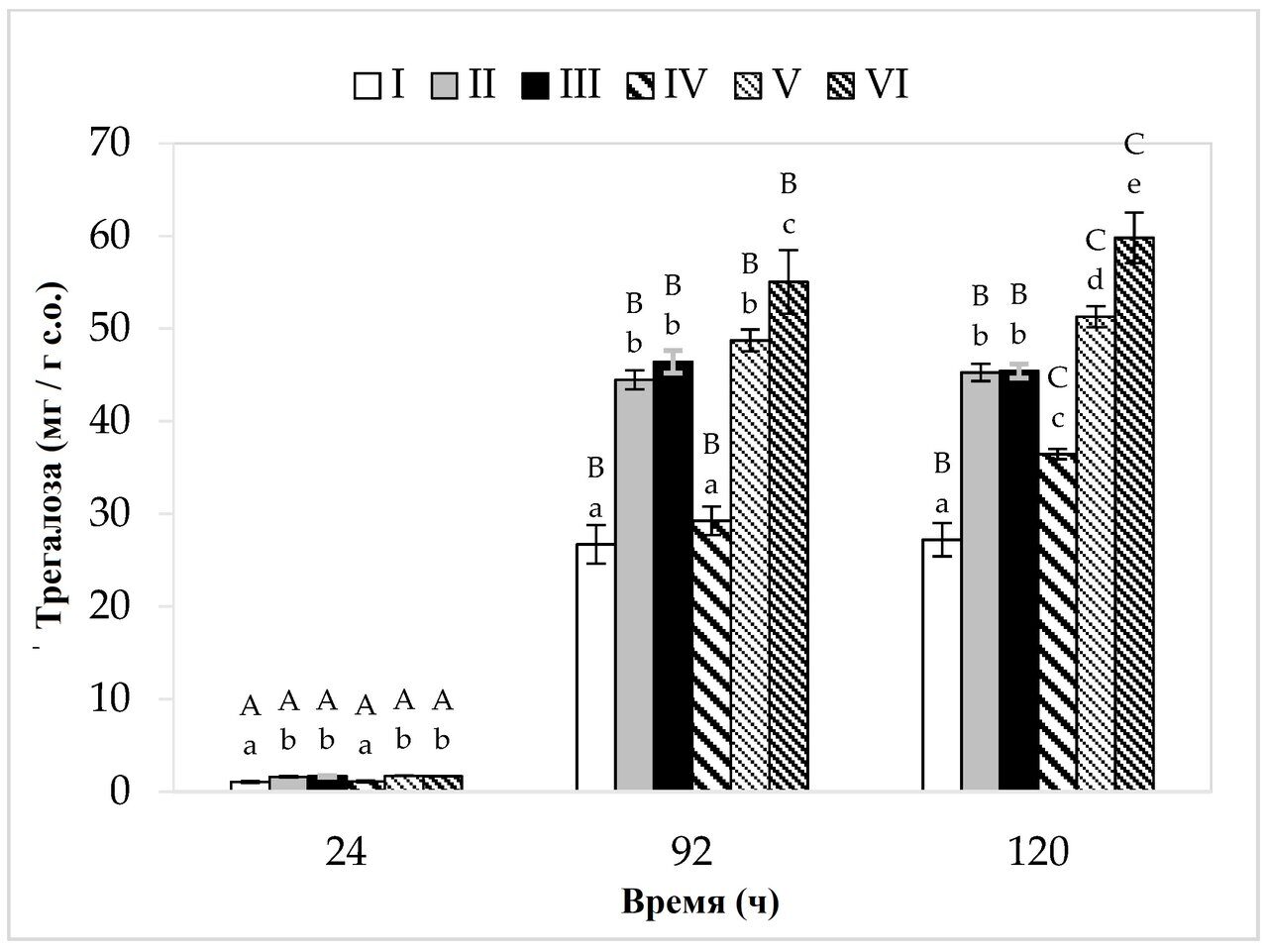
Среди проанализированных вариантов культивирования самая низкая концентрация этого дисахарида была обнаружена в клеточной биомассе бактерий, выращенных на средах I и IV (состоящих только из экстракта яблочной выжимки) (рис. 4). Это может быть связано с ограниченным метаболизмом бактерий в данных условиях выращивания из-за низкого содержания азота и, соответственно, незначительным его увеличением у исследуемого штамма. Наибольшее количество трегалозы (59,80 мг/г д.в.) P. freudenreichii накапливал в среде VI (яблочные выжимки и картофельные сточные воды). Самый высокий выход клеточной биомассы (5,55 г д.с./л) также был зафиксирован в этом варианте среды. Рухал и Чоудхури [42] показали, что чем выше выход клеточной биомассы, тем больше количество внутриклеточно накопленной трегалозы. В данном исследовании на средах с меньшим содержанием сахара накопление трегалозы продолжалось до 96 ч культивирования, а на средах с более высокой концентрацией источников углерода - до 120 ч. В вариантах культивирования IV-VI (более высокое содержание сахара) в биомассе бактериальных клеток было обнаружено более высокое содержание трегалозы по сравнению с соответствующими субстратами I-III (более низкое содержание сахара). Вероятно, это связано с присутствием большего количества сахара в этих средах размножения и, следовательно, с более высоким осмотическим давлением. Трегалоза накапливается бактериями в логарифмической и стационарной фазах роста, и, помимо защитной функции, этот дисахарид также выступает в качестве резервного материала. Накопление трегалозы в клеточной биомассе ПКБ происходит в результате действия стрессоров на микробные клетки. Важным фактором также является наличие в среде источников углерода, которые могут быть преобразованы микроорганизмами в трегалозу (клетки должны быть хорошо обеспечены питанием). В данном исследовании, независимо от содержания источников углерода, ни в одном из проанализированных вариантов культивирования не наблюдалось потери ранее накопленной трегалозы, несмотря на то, что она служит резервным материалом. Это связано с тем, что ни в одной из сред доступные источники углерода (глюкоза и фруктоза) не были полностью использованы. В течение всего периода культивирования бактерии имели доступ к сахарам из отходов, поэтому им не приходилось использовать накопленную трегалозу. Cardoso et al. [44] показали, что только после истощения запасов глюкозы или лактозы ПКБ начинали использовать сахар трегалозу, накопленный в процессе ферментации.
Рисунок 4. Накопление трегалозы. A, B и C - однородные группы по влиянию времени культивирования на накопление трегалозы - тест Тьюки (проведен односторонний дисперсионный анализ); a, b, c, d и e - однородные группы по влиянию среды на накопление трегалозы - тест Тьюки (проведен односторонний дисперсионный анализ).
По сравнению с литературными данными, содержание трегалозы, определенное в клеточной биомассе P. freudenreichii T82 в настоящем исследовании, является относительно низким. Однако следует помнить, что для синтеза пропионовой кислоты P. freudenreichii T82 в исследовании были использованы оптимальные параметры культуры (pH: 6,5-7,0, температура культуры: 37 °C) [11]. Накопление трегалозы в биомассе бактериальных клеток в каждом из вариантов сред указывало на то, что микроорганизмы, в конце концов, подверглись воздействию какого-то стрессового фактора. Исследование, проведенное Cardoso et al. [44], показало, что снижение рН с 7,0 до 4,7 приводило к почти двукратному усилению накопления трегалозы (увеличение содержания с примерно 200 мг/г с.о. до примерно 400 мг/г с.о.). Разумеется, в данном исследовании субстраты нейтрализовали каждые 24 часа, но между очередными нейтрализациями значения рН снижались даже до ⁓5,0, что может быть стрессовым фактором для ПКБ. Можно предположить, что накопление органических кислот в среде между очередными нейтрализациями стимулировало P. freudenreichii T82 к накоплению трегалозы. Общей особенностью тестируемых сред было то, что все они содержали экстракт яблочных выжимок, который мог быть источником стрессовых факторов, например, тяжелых металлов, остатков средств защиты растений или соединений, повышающих осмотическое давление среды размножения (например, пектина). Наибольшее количество трегалозы было обнаружено в бактериальной биомассе, полученной на среде, содержащей яблочные выжимки и картофельные сточные воды (среда VI). Таким образом, можно сделать вывод, что картофельные сточные воды увеличивают содержание трегалозы в биомассе исследуемого штамма. Это может быть связано, например, с токсичным гликоалкалоидом соланином, содержащимся в этих отходах. Кроме того, отходы могут содержать вещества, способные повышать осмотическое давление среды размножения. Pawlicka-Kaczorowska и Czaczyk [45] показали, что с увеличением осмолярности среды увеличивается и накопление трегалозы в биомассе клеток штамма P. freudenreichii 1 (2% глицерина — 26,55 мг/г с.о., 5% глицерина -51,23 мг/г с.о., а 8%-ный глицерин - 55,81 мг/г с.о.). Метаболизм и, следовательно, накопление трегалозы является индивидуальной особенностью каждого штамма или вида, поэтому уровень синтеза этого соединения у разных микроорганизмов различен. В своем исследовании Pawlicka-Kaczorowska и Czaczyk [45] культивировали четыре различных штамма ПКБ (P. freudenreichii 1, Acidipropionibacterium acidipropionici 9, Acidipropionibacterium jenesii 9 и P. freudenreichii DSM 4902) в одинаковых условиях (5% глицерина, 30 °C, 3 дня культивирования, начальный рН = 7,0/без нейтрализации) и получили различные выходы трегалозы (50,44, 32,57, 17,36 и 16,86 мг/г с.о., соответственно).
3. Материалы и методы.
3.1. Биологический материал
В исследовании использовался бактериальный штамм P. freudenreichii T82, полученный из коллекции чистых культур кафедры пищевой биотехнологии и микробиологии Варшавского университета естественных наук. Бактерии хранили в нейтрализованной среде VL (франц.: Gélose viande levure – ред.) при температуре 4°С и замораживали в среде глицерина, -80°С.
Выжимки состояли из отходов прессования различных польских сортов яблок. Хранили при 20 °С, содержание сахара определяли ферментативным методом с использованием набора Sucrose/D-Fructose/D-Glucose Assay Kit фирмы Megazyme (согласно инструкции производителя, прилагаемой к приобретенному тесту). Общее содержание азота и белка определяли по методу Кьельдаля.
Картофельную сточную воду готовили из картофеля сорта Ирга. Подготовка проводилась по методике, разработанной на основе технологического процесса получения картофельного крахмала на крахмальных заводах. Вымытый картофель подвергали механическому измельчению, из мякоти картофеля выделяли клеточный сок. Остатки крахмала из сточных вод удаляли центрифугированием при 3000 об/мин в течение 20 мин (Roto Silenta 630 RS, Hettich Zentrifugen, Tuttlingen, Германия). Картофельный белок осаждали, подкисляя сточные воды раствором соляной кислоты до pH 5,0 и нагревая полученный раствор при 117 °C (10 мин). Белок отделяли от раствора путем фильтрации, а полученную картофельную сточную воду стерилизовали (121 °C в течение 20 мин). В завершение сточную воду хранили в стеклянных бутылках при комнатной температуре до использования. Содержание сахара и азота определяли, как описано выше.
3.2. Культуральная среда
Бактерии размножали в среде VL (Btl, Варшава, Польша) следующего состава: глюкоза (1 г/л), мясной экстракт (3 г/л), пептон (10 г/л), хлорид натрия (5 г/л), дрожжевой экстракт (5 г/л) и гидрохлорид L-цистеина (0,40 г/л). Перед засевом среда стерилизовалась в автоклаве (20 минут при 117 °C). Активная кислотность среды была установлена на уровне 7,0 путем добавления 20% NaOH.
Среды на основе яблочных выжимок и/или картофельных сточных вод готовили следующим образом. Один литр дистиллированной воды или картофельных сточных вод (в зависимости от варианта среды) добавляли к 1 кг выжимки в стеклянных бутылках (1:1 m/v), и весь раствор нагревали (экстрагировали) в течение 30 минут при 75 °C. После нагревания нерастворимые вещества удаляли фильтрованием. Затем проводили центрифугирование (3500 об/мин, 10 мин, Roto Silenta 630 RS, Hettich Zentrifugen, Tuttlingen, Germany), и супернатант (экстракт) использовали для приготовления экспериментальных сред, как показано в таблице 3. Приготовленные среды стерилизовали при 121 °C в течение 15 минут, а их pH корректировали до 7,0 с помощью 20% NaOH.
Табл. 3. Состав сред
|
Компоненты
|
Среда
|
|||||
|
I *
|
II *
|
III *
|
IV
|
V
|
VI
|
|
|
Яблочные выжимки (кг/л)
|
1.00
|
1.00
|
1.00
|
1.00
|
1.00
|
1.00
|
|
Картофельные сточные воды (л)
|
-
|
-
|
1.00
|
-
|
-
|
1.00
|
|
Дрожжевой экстракт (г/л)
|
-
|
10.00
|
-
|
-
|
20.00
|
-
|
|
Пептон (г/л)
|
-
|
5.00
|
-
|
-
|
10.00
|
-
|
|
Дигидрогенфосфат калия (г/л)
|
-
|
2.50
|
-
|
-
|
2.50
|
-
|
|
Дикалийгидрофосфат (г/л)
|
-
|
1.50
|
-
|
-
|
1.50
|
-
|
|
L-цистеина гидрохлорид (г/л)
|
0.40
|
0.40
|
0.40
|
0.40
|
0.40
|
0.40
|
|
Биотин (мг/л)
|
-
|
0.20
|
-
|
-
|
0.20
|
-
|
|
Дистиллированная вода (л)
|
1.00
|
1.00
|
-
|
1.00
|
1.00
|
-
|
|
C/N **
|
36.6:1
|
4.6:1
|
3.6:1
|
34.9:1
|
4.4:1
|
3.5:1
|
* Экстракты разбавляли в 2 раза, чтобы получить среду с более низкой концентрацией источников углерода. ** В расчетах учитывались глюкоза, фруктоза (редуцирующие сахара), сахароза и азот / в исследовании не обсуждалось потребление сахарозы исследуемым штаммом, поскольку P. freudenreichii T82 не усваивает и не ферментирует этот дисахарид.
3.3. Условия культивирования
Инокуляционные культуры проводили в колбах Эрленмайера объемом 250 мл, содержащих 100 мл жидкой среды VL, в статических условиях при 30 °C. Размножение бактерий происходило до достижения суспензией оптической плотности 2,0, которую измеряли спектрофотометрически каждые 12 ч. Полученный инокулят использовали для инокуляции жидких экспериментальных сред в заданной серии. Перед инокуляцией производственных сред заквасочные культуры центрифугировали. Для этого 40 мл посткультурной жидкости собирали в пробирки объемом 50 мл и центрифугировали (10 000 об/мин, 10 мин, Centrifuge 5804R, Eppendorf, Hamburg, Germany). Надосадочную жидкость отделяли от гранул, а биомассу суспендировали в подходящей тестовой среде.
Экспериментальные культуры выращивали в статических условиях в колбах Эрленмайера объемом 500 мл, содержащих 250 мл жидкой среды. Инокулят составлял 10 % от объема производственной среды. Культивирование проводили в течение 120 ч при 37 °C. Среду нейтрализовали 20%-ным NaOH с интервалом в 24 ч. Образцы для анализа отбирали через 0, 24, 48, 72, 96 и 120 ч процесса. Культивирование проводили одновременно в трех колбах (колба 1 - 24 и 48 ч, колба 2 - 72 и 96 ч, колба 3 - 120 ч), чтобы минимизировать влияние истощающейся среды на метаболическую активность бактерий.
3.4. Аналитические методы
Выход клеточной биомассы определяли путем взвешивания. Содержание сахаров (в пересчете на глюкозу) в исследуемых средах и культуральной жидкости определяли спектрофотометрически при λ = 550 нм (спектрофотометр V-1200, VWR, Leuven, Belgium) с использованием 3,5-динитросалициловой кислоты (метод Миллера). Для определения содержания сахарозы образцы подвергали гидролизу.
Определение трегалозы в клеточной биомассе проводили с помощью ферментного анализа Megazyme Trehalose Assay Kit (Wicklow, Ирландия). Вкратце, 100 мг замороженной клеточной биомассы взвешивали в пробирках Эппендорфа с известным весом. К каждому образцу добавляли реагент B-PER (Thermo Scientific, Waltham, Massachusetts, MA, USA) (0,5 мл) для разрушения клеточных структур и извлечения трегалозы. Образцы инкубировали в течение 30 мин при комнатной температуре (перемешивали каждые 5 мин для интенсификации процесса) и центрифугировали при 10 000 об/мин в течение 10 мин (Centrifuge 5804R, Eppendorf, Hamburg, Germany). Полученный супернатант использовали для определения содержания трегалозы. Затем осадок высушивали (80 °C, 24 ч), а высушенную биомассу использовали для расчета массы трегалозы. Остальные процедуры проводили в соответствии с инструкциями, прилагаемыми к приобретенному тесту (Megazyme Trehalose Assay Kit enzyme assay).
Анализ полученных кислот - пропионовой и уксусной - проводили с помощью газового хроматографа, оснащенного пламенно-ионизационным детектором (Trace 1300 Gas Chromatography, Thermo Scientific, Waltham, MA, USA). Для освобождения свободных органических кислот от солей пропионовой и уксусной кислот (образующихся в результате регулярного подщелачивания среды во время ферментации) в посткультурную жидкость добавляли 25% серной кислоты (VI) (объем зависел от количества 20% NaOH, внесенного в среду во время культивирования). Фракцию карбоновых кислот экстрагировали из среды смесью гексана и диэтилового эфира (1/1, v/v). Хроматографическое разделение проводили на колонке ZB-WAXplus (30 м × 0,25 мм × 0,25 мкм). Качественный анализ кислот проводился путем сравнения времени удерживания исследуемых образцов со временем удерживания стандартов. Количественные расчеты проводили с использованием аналитического стандарта (ундеканоиновой кислоты). По полученным результатам определяли эффективность производства кислоты, продуктивность и весовое соотношение пропионовой и уксусной кислот.
3.5. Статистический анализ
Результаты, полученные в трех независимых сериях, были подвергнуты статистическому анализу в программе Statistica (версия 10.0, StatSoft, Польша). Нормальность распределения данных определяли с помощью теста Шапиро-Уилка, а однородность дисперсии - с помощью теста Левене. Значимость различий между средними значениями анализировали с помощью одностороннего дисперсионного анализа и теста Тьюки. Анализ проводили при уровне значимости α = 0,05.
4. Выводы
Результаты данного исследования показали, что среда, состоящая из экстракта яблочных выжимок и картофельных сточных вод, является благоприятной средой для культивирования ПКБ. Об этом свидетельствует относительно высокая эффективность производства пропионовой кислоты (по сравнению с другими научными данными) и высокий выход биомассы штамма P. freudenreichii T82. Более низкое накопление трегалозы в биомассе бактериальных клеток по сравнению с литературными данными свидетельствует о том, что условия культивирования, использованные в данном исследовании, не оказывали экстремального стрессового воздействия на исследуемый штамм. Таким образом, проведенное исследование показало, что ПКБ можно успешно выращивать на средах, содержащих несколько отходов. Оно также подтвердило, что сточные воды картофеля могут служить богатым источником азота и, таким образом, заменять дорогостоящие добавки, такие как пептон или дрожжевой экстракт. Это может позволить эффективно управлять отходами, улучшить качество природной среды и снизить цену биотехнологически произведенной пропионовой кислоты.
Доп. информация
- Пропионовая кислота и пропионаты (кратко)
- Трегалоза - важный метаболит пропионовокислых бактерий (кратко)
- Propionibacterium spp. - источник важных для промышленности метаболитов
- Многогранные свойства молочных пропионибактерий
Литература
- Falentin, H.; Deutsch, S.M.; Jan, G.; Loux, V.; Thierry, A.; Parayre, S.; Maillard, M.B.; Dherbécourt, J.; Cousin, F.J.; Jardin, J.; et al. The Complete Genome of Propionibacterium freudenreichii CIRM-BIA1T, a Hardy Actinobacterium with Food and Probiotic Applications. PLoS ONE 2010, 5, e11748. [Google Scholar] [CrossRef] [PubMed] [Green Version]
- Gonzalez-Garcia, R.A.; McCubbin, T.; Navone, L.; Stowers, C.; Nielsen, L.K.; Marcellin, E. Microbial Propionic Acid Production. Fermentation 2017, 3, 21. [Google Scholar] [CrossRef]
- Vidra, A.; Németh, Á. Bio-produced Propionic Acid: A Review. Period. Polytech. Chem. Eng. 2018, 62, 57–67. [Google Scholar] [CrossRef]
- Piwowarek, K.; Lipińska, E.; Hać-Szymańczuk, E.; Kieliszek, M.; Ścibisz, I. Propionibacterium spp.—source of propionic acid, vitamin B12, and other metabolites important for the industry. Appl. Microbiol. Biotechnol. 2018, 102, 515–538. [Google Scholar]
- Cai, X.; Seitl, I.; Mu, W.; Zhang, T.; Stressler, T.; Fischer, L.; Jiang, B. Biotechnical production of trehalose through the trehalose synthase pathway: Current status and future prospects. Appl. Microbiol. Biotechnol. 2018, 102, 2965–2976. [Google Scholar] [CrossRef]
- Othake, S.; Wang, Y.J. Trehalose: Current use and future applications. J. Pharm. Sci. 2011, 100, 2020–2053. [Google Scholar]
- Teramoto, N.; Sachinvala, N.D.; Shibata, M. Trehalose and Trehalose-based Polymers for Environmentally Benign, Biocompatible and Bioactive Materials. Molecules 2008, 13, 1773–1816. [Google Scholar] [CrossRef] [Green Version]
- Yu, W.B.; Jiang, T.; Lan, D.M.; Lu, J.H.; Yue, Z.Y.; Wang, J.; Zhou, P. Trehalose inhibits fibrillation of A53T mutant alpha-synuclein and disaggregates existing fibrils. Arch. Biochem. Biophys. 2012, 523, 144–150. [Google Scholar] [CrossRef] [PubMed]
- Chaudhary, R.K.; Kardani, J.; Singh, K.; Banerjee, R.; Roy, I. Deciphering the Roles of Trehalose and Hsp104 in the Inhibition of Aggregation of Mutant Huntingtin in a Yeast Model of Huntington’s Disease. Neuromol. Med. 2014, 16, 280–291. [Google Scholar] [CrossRef] [PubMed]
- Eş, I.; Khaneghah, A.M.; Hashemi, S.M.B.; Koubaa, M. Current advances in biological production of propionic acid. Biotechnol. Lett. 2017, 39, 635–645. [Google Scholar] [CrossRef]
- Piwowarek, K.; Lipińska, E.; Hać-Szymańczuk, E.; Rudziak, A.; Kieliszek, M. Optimization of propionic acid production in apple pomace extract with Propionibacterium freudenreichii. Prep. Biochem. Biotechnol. 2019, 43, 1–13. [Google Scholar] [CrossRef]
- Piwowarek, K.; Lipińska, E.; Hać-Szymańczuk, E.; Pobiega, K. Propionic acid production from apple pomace in bioreactor using Propionibacterium freudenreichii: An economic analysis of the process. 3 Biotech. 2021, 11, 1–15. [Google Scholar] [CrossRef]
- Ammar, E.M.; Martin, J.; Brabo-Catala, L.; Philippidis, G.P. Propionic acid production by Propionibacterium freudenreichii using sweet sorghum bagasse hydrolysate. Appl. Microbiol. Biotechnol. 2020, 104, 9619–9629. [Google Scholar] [CrossRef]
- Wang, P.; Shen, C.; Li, L.; Guo, L.; Cong, Q.; Lu, J. Simultaneous production of propionic acid and vitamin B12 from corn stalk hydrolysates by Propionibacterium freudenreichii in an expanded bed adsorption bioreactor. Prep. Biochem. Biotechnol. 2020, 50, 763–767. [Google Scholar] [CrossRef] [PubMed]
- Xie, C.; Coda, R.; Chamlagain, B.; Varmanen, P.; Piironen, V.; Katina, K. Co-fermentation of Propionibacterium freudenreichii and Lactobacillus brevis in Wheat Bran for in situ Production of Vitamin B12. Front. Microbiol. 2019, 10, 1–10. [Google Scholar] [CrossRef] [PubMed]
- Xie, C.; Coda, R.; Chamlagain, B.; Edelmann, M.; Varmanen, P.; Piironen, V.; Katina, K. Fermentation of cereal, pseudo-cereal and legume materials with Propionibacterium freudenreichii and Levilactobacillus brevis for vitamin B12 fortification. LWT-Food Sci. Technol. 2021, 137, 110431. [Google Scholar] [CrossRef]
- Grigoras, C.G.; Destandau, E.; Fougere, L.; Elfakir, C. Evaluation of apple pomace extracts as a source of bioactive compounds. Ind. Crop Prod. 2013, 49, 794–804. [Google Scholar] [CrossRef]
- Grigelmo-Miguel, N.; Martın-Belloso, O. Comparison of dietary fibre from by-products of processing fruits and greens and from cereals. LWT-Food Sci. Technol. 1999, 32, 503–508. [Google Scholar] [CrossRef]
- Awasthi, M.K.; Ferreira, J.A.; Sirohi, R.; Sarsaiya, S.; Khoshnevisan, B.; Baladi, S.; Sindhu, R.; Binod, P.; Pandey, A.; Juneja, A.; et al. A critical review on the development stage of biorefinery systems towards the management of apple processing-derived waste. Renew. Sustain. Energ. Rev. 2021, 143, 1–18. [Google Scholar] [CrossRef]
- Magyar, M.; Sousa, L.C.; Jin, M.; Sarks, C.; Balan, V. Conversion of apple pomace waste to ethanol at industrial relevant conditions. Appl. Microbiol. Biot. 2016, 100, 7349–7358. [Google Scholar] [CrossRef]
- Skinner, R.C.; Gigliotti, J.C.; Ku, K.-M.; Tou, J.C. A comprehensive analysis of the composition, health benefits, and safety of apple pomace. Nutr. Rev. 2018, 76, 893–909. [Google Scholar] [CrossRef] [PubMed]
- Kot, A.M.; Pobiega, K.; Piwowarek, K.; Kieliszek, M.; Błażejak, S.; Gniewosz, M.; Lipińska, E. Biotechnological Methods of Management and Utilization of Potato Industry Waste—A Review. Potato Res. 2020, 63, 431–447. [Google Scholar] [CrossRef]
- Kieliszek, M.; Piwowarek, K.; Kot, A.M.; Pobiega, K. The aspects of microbial biomass use in the utilization of selected waste from the agro-food industry. Open Life Sci. 2020, 15, 787–796. [Google Scholar] [CrossRef]
- Kot, A.; Błażejak, S.; Kurcz, A.; Bryś, J.; Gientka, I.; Bzducha-Wróbel, A.; Maliszewska, M.; Reczek, L. Effect of initial pH of medium with potato wastewater and glycerol on protein, lipid and carotenoid biosynthesis by Rhodotorula glutinis. Electron. J. Biotechnol. 2017, 27, 25–31. [Google Scholar] [CrossRef]
- Kot, A.M.; Błażejak, S.; Kieliszek, M.; Gientka, I.; Bryś, J. Simultaneous Production of Lipids and Carotenoids by the Red Yeast Rhodotorula from Waste Glycerol Fraction and Potato Wastewater. Appl. Biochem. Biotechnol. 2019, 189, 589–607. [Google Scholar] [CrossRef]
- Antonic, B.; Jancikova, S.; Dordevic, D.; Tremlova, B. Apple pomace as food fortification ingredient: A systematic review and meta-analysis. J. Food Sci. 2020, 85, 2977–2983. [Google Scholar] [CrossRef]
- Dishisha, T.; Ståhl, A.; Lundmark, S.; Hatti-Kaul, R. An economical biorefinery process for propionic acid production from glycerol and potato juice using high cell density fermentation. Bioresour. Technol. 2013, 135, 504–512. [Google Scholar] [CrossRef] [PubMed] [Green Version]
- Dishisha, T.; Ibrahim, M.H.A.; Cavero, V.H.; Alvarez, M.T.; Hatti-Kaul, R. Improved propionic acid production from glycerol: Combining cyclic batch and sequential batch fermentations with optimal nutrient composition. Bioresour. Technol. 2015, 176, 80–87. [Google Scholar] [CrossRef] [Green Version]
- Fröhlich-Wyder, M.T.; Bachmann, H.P.; Casey, M.G. Interaction between propionibacteria and starter/non-starter lactic acid bacteria in Swiss-type cheeses. Lait 2002, 82, 1–15. [Google Scholar] [CrossRef] [Green Version]
- Guan, N.; Liu, L.; Shin, H.D.; Chen, R.R.; Zhang, J.; Li, J.; Du, G.; Shi, Z.; Chen, J. Systems-level understanding how Propionibacterium acidipropionici respond to propionic acid stress at the microenvironment levels: Mechanism and application. J. Biotechnol. 2013, 167, 56–63. [Google Scholar] [CrossRef]
- Wang, Z.; Sun, J.; Zhang, A.; Yang, S.-T. Propionic acid fermentation. In Bioprocessing Technologies in Biorefinery for Sustainable Production of Fuels, Chemicals, and Polymers, 1st ed.; Yang, S.T., El-Enshasy, H.A., Thongchul, N., Eds.; Wiley: New York, NY, USA, 2013; pp. 331–350. [Google Scholar]
- Wang, Z.; Yang, S.T. Propionic acid production in glycerol/glucose co-fermentation by Propionibacterium freudenreichii subsp. shermanii. Bioresour. Technol. 2013, 137, 116–123. [Google Scholar] [CrossRef] [PubMed]
- Zhang, A.; Yang, S.T. Propionic acid production from glycerol by metabolically engineered Propionibacterium acidipropionici. Process Biochem. 2009, 44, 1346–1351. [Google Scholar] [CrossRef]
- Quesada-Chanto, A.; Costa, J.; Silveira, M.; Schroeder, A.; Schmid-Meyer, A.; Jonas, R. Influence of different vitamin-nitrogen sources on cell growth and propionic acid production from sucrose by Propionibacterium shermanii. Acta BioTechnol. 1998, 18, 267–274. [Google Scholar] [CrossRef]
- Wang, X.; Salvachua, D.; Nogue, V.; Michener, W.; Bratis, A.; Dorgan, J.; Beckham, G. Propionic acid production from corn stover hydrolysate by Propionibacterium acidipropionici. BioTechnol. Biofuels 2017, 10, 1–13. [Google Scholar] [CrossRef]
- Feng, X.; Chen, F.; Xu, H.; Wu, B.; Li, H.; Li, S.; Ouyang, P. Green and economical production of propionic acid by Propionibacterium freudenreichii CCTCC M207015 in plant fibrous-bed bioreactor. Bioresour. Technol. 2011, 102, 6141–6146. [Google Scholar] [CrossRef]
- Yang, H.; Wang, Z.; Lin, M.; Yang, S.T. Propionic acid production from soy molasses by Propionibacterium acidipropionici: Fermentation kinetics and economic analysis. Bioresour. Technol. 2018, 250, 1–9. [Google Scholar] [CrossRef]
- Acosta de Assis, D.; Matte, C.; Aschidamini, B.; Rodrigues, E.; Antônio, M.; Ayub, Z. Biosynthesis of vitamin B12 by Propionibacterium freudenreichii subsp. shermanii ATCC 13673 using liquid acid protein residue of soybean as culture medium. BioTechnol. Progress 2020, 36, 1–9. [Google Scholar]
- Liang, Z.X.; Li, L.; Li, S.; Cai, Y.H.; Yang, S.T.; Wang, J.F. Enhanced propionic acid production from Jerusalem artichoke hydrolysate by immobilized Propionibacterium acidipropionici in a fibrous-bed bioreactor. Bioprocess Biosyst. Eng. 2012, 35, 915–921. [Google Scholar] [CrossRef] [PubMed]
- Cardoso, F.S.; Castro, R.F.; Borges, N.; Santos, H. Biochemical and genetic characterization of the pathways for trehalose metabolism in Propionibacterium freudenreichii, and their role in stress response. Microbiology 2007, 153, 270–280. [Google Scholar] [CrossRef] [Green Version]
- Ruhal, R.; Kataria, R.; Choudhury, B. Trends in bacterial trehalose metabolism and significant nodes of metabolic pathway in the direction of trehalose accumulation. Microbial BioTechnol. 2013, 6, 493–502. [Google Scholar] [CrossRef] [PubMed]
- Ruhal, R.; Choudhury, B. Improved trehalose production from biodiesel waste using parent and osmotically sensitive mutant of Propionibacterium freudenreichii subsp. shermanii under aerobic conditions. J. Ind. Microbiol. BioTechnol. 2012, 39, 1153–1160. [Google Scholar] [CrossRef]
- Benaroudj, N.; Lee, D.H.; Goldberg, A.L. Trehalose accumulation during cellular stress protect cells and cellular proteins from damage by oxygen radicals. J. Biol. Chem. 2001, 276, 24261–24267. [Google Scholar] [CrossRef] [PubMed] [Green Version]
- Cardoso, F.S.; Gaspar, P.; Hugenholtz, J.; Ramos, A.; Santos, H. Enhancement of trehalose production in dairy propionibacteria through manipulation of environmental conditions. Int. J. Food Microbiol. 2004, 91, 195–204. [Google Scholar] [CrossRef]
- Pawlicka-Kaczorowska, J.; Czaczyk, K. Effect of crude and pure glycerol on biomass production and trehalose accumulation by Propionibacterium freudenreichii ssp. shermanii 1. Acta Biochim. Pol. 2017, 64, 621–629. [Google Scholar] [CrossRef] [PubMed]