ООО "ПРОПИОНИКС"
| пн-пт с 09:00 до 18:00 | |
Выделение продуктов микробиологического синтеза
ТЕХНОЛОГИЯ МИКРОБНОГО СИНТЕЗА

ПРОМЫШЛЕННОЕ ПОЛУЧЕНИЕ МИКРОБНОЙ БИОМАССЫ И МЕТАБОЛИТОВ: БЕЛКОВ, ВИТАМИНОВ, ФЕРМЕНТОВ, АНТИБИОТИКОВ, КИСЛОТ, ПОЛИСАХАРИДОВ И Т.П.
ОГЛАВЛЕНИЕ
- Введение
- 1. Биологические агенты
- 2. Сырье и питательные среды в микробиологических производствах
- 3. Получение стерильного воздуха
- 4. Промышленные способы культивирования микроорганизмов
- 5. Ферментационные процессы
- 5.1. Получение посевного материала
- 5.2. Ферментация
- 5.3. Роль кислорода и диоксида углерода в ферментационном процессе
- 5.4. Обеспечение условий асептики в процессе ферментации
- 5.5. Оптимальные режимы термической стерилизации оборудования и коммуникаций
- 6. Выделение продуктов микробиологического синтеза
- 7. Производство белка одноклеточных
- 8. Технология ферментных препаратов
- 9. Производство антибиотиков
- 9.1. Технология кормовых препаратов антибиотиков
- 9.2. Производство тилозина
- 10. Микробиологические средства защиты растений
- 10.1. Бактериальные энтомопатогенные препараты
- 10.2. Грибные энтомопатогенные препараты
- 10.3. Вирусные энтомопатогенные препараты
- 11. Бактериальные удобрения
- 12. Витамины
- 12.1. Технология кормового препарата витамина В12
- 12.2. Технология кормового препарата витамина В2
- 12.3. Микробиологический синтез β-каротина
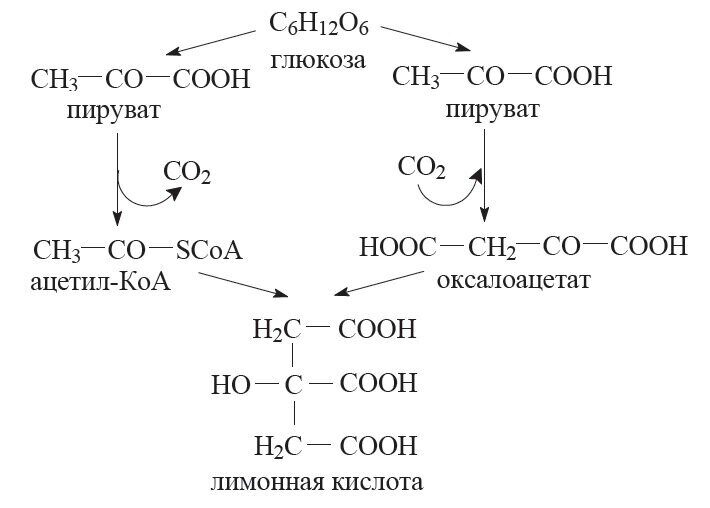
- 13. Производство лимонной кислоты
- 14. Технология микробного жира
- 15. Микробиологический синтез полисахаридов и нуклеозидов
- 15.1. Полисахариды
- 15.2. Перспективы получения и использования нуклеозидов
- 16. Техника безопасности на микробиологических производствах
- Дополнительная информация
- Литература
Приведена характеристика биологических агентов, применяемых в биотехнологии, сырья и основных компонентов питательных сред; рассмотрены процессы приготовления и стерилизации питательных сред и получения стерильного воздуха, промышленные способы культивирования микроорганизмов, основы асептики в ферментационных процессах, методы выделения продуктов микробиологического синтеза. Представлены технологии современного промышленного производства продуктов микробного синтеза: белка одноклеточных, ферментных препаратов, антибиотиков, микробиологических средств защиты растений, бактериальных удобрений, витаминов, лимонной кислоты, микробного жира, а также информация о перспективах промышленного производства полисахаридов и нуклеозидов. Рассмотрены вопросы безопасности в биотехнологических производствах.
ВВЕДЕНИЕ
Микробиологический синтез составляет основу биотехнологических производств, разнообразие которых определяется свойствами используемых микроорганизмов, являющихся продуцентами биологически активных веществ. Знание основ технологии микробиологического синтеза является одним из важнейших критериев, определяющих уровень профессиональной подготовки биотехнологов.
Задачей дисциплины является изучение теории и практики промышленного производства важнейших продуктов микробного синтеза, что необходимо для обеспечения эффективной производственной деятельности инженеров-биотехнологов.
Материал курса лекций условно разделен на две неразрывно связанные между собой части, в одной из которых изложены теоретические основы, особенности аппаратурного оформления и методы реализации технологических процессов, составляющих современное промышленное биотехнологическое производство, а в другой представлены технологические линии производства конкретных продуктов микробиологического синтеза с использованием различных видов сырья и продуцентов биологически активных веществ.
В первой части лекционного курса рассмотрены биологические агенты, сырье и компоненты питательных сред, приготовление и стерилизация питательных сред, получение стерильного воздуха, промышленные способы культивирования микроорганизмов, методы получения посевного материала, мероприятия, обеспечивающие асептические условия ферментации, способы выделения и сушки продуктов микробного синтеза.
Вторая часть лекций базируется на предыдущем материале и посвящена современным технологиям производства препаратов кормового белка, антибиотиков, ферментных препаратов, средств защиты растений, бактериальных удобрений, кормовых препаратов, витаминов, лимонной кислоты, технического микробного жира.
Завершают курс лекций раздел, посвященный перспективным процессам биосинтеза полисахаридов и нуклеозидов, и раздел по технике безопасности в микробиологических производствах.
I. БИОЛОГИЧЕСКИЕ АГЕНТЫ
Важнейшими компонентами биотехнологических процессов, определяющими получение целевого продукта, являются биологические агенты. Номенклатура используемых в биотехнологической практике биологических агентов разнообразна и неуклонно расширяется. Современные биотехнологические производства базируются на использовании следующих групп биологических агентов:
- клеток микроорганизмов;
- растительные и животные тканевых клеток, клеток тканей
- человека;
- компонентов клеток (протопластов, мембран, митохондрий,
- хлоропластов и др.);
- рекомбинантов, полученных методами генетической инженерии;
- внеклеточных продуктов (ферментов, коферментов);
- вирусов.
Прим. редактора. Определение "биологическим агентам" для целей биотехнологии в различных источника дается разное:
Часто встречается такое определение (близкое к предыдущему): Биологические агенты - это микроорганизмы, растительные или животные клетки, клеточные компоненты (мембраны клеток, рибосомы, митохондрии, хлоропласты), а также биологические макромолекулы (ДНК, РНК, белки - чаще всего ферменты). Биотехнология использует также вирусную ДНК или РНК для переноса чужеродных генов в клетки.
Если же следовать пункту 3.2.2. "биологические агенты" из ГОСТа Р 57095-2016, то получим, что биологические агенты - это объекты биотехнологических исследований, включающие клетки микроорганизмов, животных, растений; вирусы; компоненты клеток, внеклеточные продукты; иммобилизованные клетки микроорганизмов, животных, растений, их компоненты и внеклеточные продукты.
А вот согласно "Введению в биотехнологию" (Учеб. пособие. – СПб.: НИУ ИТМО; ИХиБТ, 2013. 95с.) - Биологическими объектами (агентами) биотехнологии являются различные представители живой природы, которые делятся на три надцарства: акариоты (безъядерные), прокариоты (предъядерные) и эукариоты (ядерные) и 5 царств: вирусы, бактерии, в том числе микроскопические водоросли, грибы, а также растения и животные, в их числе и простейшие.
В производственной практике наиболее широко используется традиционный биологический агент – микробная клетка. Выявляются все новые виды микроорганизмов, которые могут быть использованы в биотехнологии как продуценты полезных веществ. В связи с этим важное значение приобретают специализированные банки биологических агентов, коллекции генетически охарактеризованных микроорганизмов, криобанки клеток тканей животных и растений. Наиболее крупные коллекции промышленных микроорганизмов созданы в США: Coli-центр, Bacillus-центр, грибной центр и др. Основная задача коллекции – сохранение жизнеспособности и генетических свойств штаммов. Коллекции культур играют также важную роль в процедуре правовой защиты новых патентуемых штаммов.
С ростом номенклатуры биопродуктов сформировались современные тенденции в использовании микробных клеток, которые связаны с применением термофильных микроорганизмов, анаэробных культур, смешанных культур микроорганизмов и их ассоциаций, иммобилизованных клеток микроорганизмов.
Термофильные микроорганизмы отличаются высокой конкурентоспособностью, при их культивировании предъявляются менее жесткие требования к уровню стерильности и снижаются затраты на охлаждение ферментационной среды, возможна самопроизвольная дистилляция целевого метаболита (например, при спиртовом брожении). Возрождается интерес к использованию анаэробных микроорганизмов, которые часто также являются термофилами. Анаэробные процессы привлекают внимание исследователей малыми энергетическими затратами на процесс (нет необходимости в аэрации и интенсивном перемешивании питательной среды), а также возможностью получения в качестве побочного продукта энергоносителя – биогаза или водорода. В связи с этим анаэробные процессы можно относить не только к энергосберегающим, но и к энергопродуцирующим.
Расширяется применение смешанных культур микроорганизмов и их ассоциаций. В природе микроорганизмы существуют в виде сообществ различных популяций, тесно связанных между собой. Ассоциации культур в сравнении с монокультурами имеют ряд преимуществ:
- способность ассимилировать сложные субстраты, малодоступные для монокультур;
- более высокая продуктивность;
- повышенная устойчивость к токсичным веществам и изменяющимся факторам окружающей среды.
Основная область применения смешанных культур – биодеградация сложных по составу или обладающих токсичностью субстратов. В частности, ассоциации микроорганизмов перспективны в процессах биоконверсии целлюлозосодержащих субстратов.
Практически все биологические агенты могут быть использованы в биотехнологических процессах в иммобилизованной форме. В природных условиях закрепление микробных клеток на различного вида носителях является естественным и распространенным процессом.
В биотехнологических производствах применяют следующие виды иммобилизации микробных клеток и ферментов:
- включение в гели, капсулы;
- адсорбция на поверхности твердых носителей;
- ковалентное связывание с носителем;
- сшивка бифункциональными реагентами без использования носителя;
- «самоагрегация» интактных клеток при создании определенных условий с образованием хлопьев и гранул.
Создание и использование биосистем с иммобилизованными биологическими агентами – одно из современных направлений развития биотехнологической отрасли, что обусловлено существенными преимуществами иммобилизованных клеток и ферментов перед свободными:
- удержание биоагентов в объеме реактора;
- возможность создания высокой регулируемой концентрации биоагента в реакторе;
- возможность организации непрерывного процесса с многократным использованием агента и высокой скоростью протока среды;
- удешевление процесса выделения целевого продукта из культуральной среды, не содержащей клеточной массы;
- более высокая активность (продуктивность) и стабильность биоагента в иммобилизованном состоянии;
- повышение устойчивости иммобилизованных биоагентов к неблагоприятным факторам среды;
- возможность промышленного использования дорогостоящих биоагентов (например, ферментов);
- использование иммобилизованных биоагентов в создании биологических микроустройств (ферментных электродов, биологических датчиков, запоминающих устройств и т. д.).
Набор биологических агентов непрерывно пополняется новыми, нетрадиционными объектами, появляются нестандартные биотехнологические процессы.
Особое внимание в настоящее время уделяется созданию не существующих в природе биологических агентов методами генетической инженерии. Сформировалось направление конструирования искусственных клеток.
Разрабатываются подходы к созданию искусственных ферментов и аналогов ферментов, обладающих повышенной стабильностью и активностью.
К нетрадиционным биологическим агентам на данном этапе развития биотехнологии относятся растительные и животные тканевые клетки, а также клетки тканей человека.
Биотехнология клеток растений – это молодая отрасль. Культуры растительных клеток могут быть использованы:
- в биосинтетических и биотрансформирующих реакциях;
- для изучения метаболизма растений, а также системы «растение – паразит» (вирусы, грибы, насекомые и т. д.);
- при микроразмножении и получении новых форм растений в агротехнике.
Растительные клетки можно культивировать как на твердой среде, так и глубинным способом. При крупномасштабном культивировании суспензии клеток растений следует учитывать, что эти клетки чрезвычайно чувствительны к эффекту среза и быстро лизируются при интенсивном механическом перемешивании среды (большинство клеток погибает уже к 20–30-му часу культивирования). Клетки растений имеют также тенденцию агрегироваться, что затрудняет контроль параметров процесса и нарушает массообмен.
Получение культуры клеток растений начинают с отбора в асептических условиях кусочка ткани растения. Используют различные ткани любого органа растения (чаще ствол или листья). Ткань помещают в среду, содержащую питательные вещества и факторы роста. Рост происходит в виде каллуса, который в дальнейшем культивируют на твердой среде или используют для получения суспензии клеток. Каллус представляет собой дезорганизованную массу недифференцированных клеток, способных к росту и образованию метаболитов. Ткань каллуса гетерогенна по морфологии и биохимическим свойствам. Для получения суспензионной культуры небольшое количество каллусной ткани помещают в жидкую среду и культивируют на качалке в течение 2–3-х недель. Суспензионная культура более гомогенна и растет быстрее. Часть клеток образует агрегаты различных размеров. Предпочитают в дальнейшем использовать суспензию из отдельных клеток. Время генерации клеток растений составляет в среднем 30–70 ч.
Культуры клеток растений могут быть использованы для биосинтеза вторичных метаболитов (аминокислот, витаминов, гормонов, красителей, липидов, нуклеиновых кислот, полисахаридоы, стероидов, ферментов, терпенов, регуляторов роста и т. д.), а также для биотрансформации химических соединений. Однако экономически выгодных биотрансформационных процессов мало. Культивирование клеток осуществляют в условиях асептики. Для получения метаболитов можно использовать иммобилизованные клетки растений. Важнейшим их преимуществом является повышенная устойчивость к механическим повреждениям.
В настоящее время основными недостатками использования культур тканей растения для получения метаболитов являются:
- высокий уровень инфицирования ферментационной среды;
- низкая скорость роста (время генерации клеток примерно в 100 раз больше, чем у микроорганизмов);
- низкий выход продуктов при большой продолжительности процесса.
В настоящее время культуры клеток растений рассматриваются как биологические агенты для получения дорогостоящих, требующихся в небольшом количестве соединений.
Особый интерес представляет способность культур растений к тотипотенции, т. е. регенерации целого растения из отдельной клетки (в любой клетке растения заложена информация, необходимая для дифференцирования клеток при делении). Это явление используется в агротехнике. Микроразмножение растений имеет следующие преимущества:
- возможность получения растений, не содержащих возбудителей болезней;
- возможность быстрого размножения (в течение круглого года) медленно растущих растений или новых видов растений;
- однородность рассадочного материала;
- возможность длительного хранения генетического материала и обмена им;
- возможность создания новых генотипов растений.
Новые формы растений создают с использованием приемов клеточной инженерии: гибриды получают с помощью парасексуальной гибридизации путем слияния протопластов. Этот метод отличается тем, что в качестве родительских используются не половые клетки (гаметы), а соматические клетки растения. В большинстве случаев применяют протопласты листа либо протопласты из каллусных тканей. Из гибридных клеток, полученных таким путем, регенерируют целые растения – гибриды.
Традиционный селекционный процесс (основанный на применении полового скрещивания как средства генетического обмена) отличается длительностью (несколько лет), и скрещивание возможно между филогенетически близкими растениями.
Путем слияния протопластов успешно осуществляют гибридизацию при межвидовых, межродовых и даже межсемейственных скрещиваниях. В настоящее время при селекционных центрах создаются лаборатории клеточной инженерии, в которых отрабатывается техника парасексуальной гибридизации.
В промышленных условиях культура клеток растений в виде каллусной ткани применялась при производстве спиртового экстракта биоженьшеня.
Культуры клеток тканей животных и человека используются в следующих основных направлениях:
- производстве вирусных вакцин, изучении действия вирусов и влияния различных факторов на вирусную инфекцию;
- получении физиологически активных веществ, например интерферонов;
- трансплантации тканей человека (пересадка клеток поджелудочной железы для больных сахарным диабетом);
- производстве моноклональных антител;
- получении препаратов стволовых клеток для терапевтических целей.
Крупномасштабное культивирование клеток животных и человека осложнено тем, что клетки вне организма растут плохо. Для культивирования клеток используются естественные среды (сыворотка, сгустки плазмы, тканевые экстракты). Созданные синтетические среды (среда Маккоя, среда Игла и др.) имеют сложный состав (более 50 компонентов). Большинство клеток растут на поверхности субстрата в виде монослоя (поверхностно-зависимые клетки). Суспензионный метод культивирования свободных клеток в реакторе требует специальной аппаратуры: конструкция должна обеспечивать интенсивное перемешивание среды без разрушения клеток. В связи с этим разрабатываются суспензионные методы выращивания клеток на носителях. Проблема создания крупномасштабных систем для культивирования клеток животных и человека не решена.
Основой современной промышленной биотехнологии является микробиологический синтез, в котором используются различные группы микроорганизмов для получения широкого ассортимента продуктов (рисунок).

Важнейшими преимуществами микробиологического синтеза являются использование дешевого сырья, часто в виде промышленных отходов, возможность синтеза сложных органических соединений в одну стадию в мягких условиях (низкая температура, невысокое давление).
Эффективность микробиологического синтеза определяется прежде всего возможностями микроорганизмов – продуцентов целевых продуктов. К промышленным продуцентам предъявляются определенные требования, в числе которых:
- высокая скорость роста;
- непатогенность штаммов, нетоксичность биомассы;
- термотолерантность;
- высокий выход биомассы (или метаболита) от субстрата;
- фагоустойчивость;
- легкость выделения клеток из культуральной жидкости;
- конкурентоспособность, устойчивость в процессе непрерывного культивирования;
- возможность культивирования в нестерильных условиях;
- минимальное накопление второстепенных продуктов метаболизма в культуральной жидкости.
II. СЫРЬЕ И ПИТАТЕЛЬНЫЕ СРЕДЫ В МИКРОБИОЛОГИЧЕСКИХ ПРОИЗВОДСТВАХ
Важнейшим фактором, влияющим на рост микроорганизмов и биосинтез ими различных биологически активных веществ, является состав питательной среды, а также условия ее приготовления и стерилизации. Производственная питательная среда должна быть полноценной, т. е. содержать обоснованный и сбалансированный набор компонентов, необходимых для построения клеточной массы и синтеза целевого продукта. В питательной среде должны присутствовать все элементы, из которых формируется клетка. Состав среды для каждого вида используемого в производстве микроорганизма индивидуален. Универсальной среды не существует.
В технологии микробного синтеза используют разнообразные среды (рис. 2.1).

Натуральные среды – это комплексные среды неизвестного или неопределенного состава, полученные на основе природных веществ растительного или животного происхождения (молоко, пшеничные отруби, кукурузный экстракт, зерновое сусло, молочная сыворотка и др.). Комплексные натуральные среды используют, в частности, в производстве этанола, ферментных препаратов. Особенность натуральных сред состоит в том, что они сложны и непостоянны по со- ставу, это часто делает их малопригодными для крупнотоннажного производства.
Синтетические среды включают комплекс органических и неорганических химических соединений известной природы, взятых в определенных количествах. Преимущество синтетических сред – постоянство состава и воспроизводимость, отсутствие балластных веществ, затрудняющих получение высокоочищенного целевого продукта. Однако для обеспечения полноценности таких сред необходимо, как правило, вносить микродобавки – факторы роста.
Полусинтетические среды, кроме органических и неорганических веществ известного состава, содержат в определенном количестве компоненты природного происхождения (мелассу, пшеничную муку, кукурузный экстракт и др.). К полусинтетическим средам относят кондиционированные гидролизаты растительных материалов.
Рассмотренное разделение питательных сред условно. Многие специалисты-биотехнологи считают целесообразным строгое разделение сред на синтетические и натуральные, в состав которых входят какие-либо природные продукты или отходы производств.
Основными компонентами питательных сред являются источники углерода, азота, фосфора, микроэлементов, факторов роста. В наибольшем количестве в средах присутствует углеродсодержащий компонент. В производственной практике в качестве источника углерода чаще всего используют углеводы (прежде всего сахарозу, крахмал), а также органические кислоты (уксусная кислота), спирты (этанол, метанол), н-парафины (фракция С11–С18). В асептических производствах (аминокислот, антибиотиков) распространенным компонентом питательных сред является отход свеклосахарного производства – меласса, которая представляет собой сиропообразную жидкость темнокоричневого цвета, содержащую 70–85% сухих веществ (плотность – 1300 кг/м3), в том числе 45–50% сахарозы, 50–120 мг/т витамина В7. В мелассе содержатся аминокислоты, органические кислоты, макро- и микроэлементы. Ресурс мелассы в Республике Беларусь составляет около 1 млн. т в год.
Состав мелассы непостоянен. Качество ее зависит от ряда факторов: климатических условий вегетации свеклы, времени уборки и условий хранения корнеплодов, технологии производства сахара, условий хранения мелассы и др. При длительном хранении мелассы ее качество ухудшается: развиваются микроорганизмы, расщепляются углеводные и белковые компоненты, протекают сахароаминные реакции, повышается температура в хранилище (до 70–90°С), возрастает кислотность, в объеме мелассы скапливаются выделяющиеся газы (СО2, Н2, NН3 и др.), возникает угроза газового выхлопа. Необходимо соблюдать определенные правила при хранении мелассы:
- хранилища перед заполнением тщательно дезинфицируются;
- при сливе мелассы из цистерны допускается минимально необходимый разогрев с последующим охлаждением массы в хранилище;
- осуществляется контроль за температурой мелассы в хранилище;
- предусматривается механическая или пневматическая гомогенизация мелассы при хранении;
- не допускается длительное хранение инфицированной и кислой мелассы с содержанием сухих веществ менее 74%.
При культивировании ауксотрофных мутантных штаммов, дефицитных по аминокислотам, необходимым компонентом питательной среды является кукурузный экстракт – сиропообразная жидкость коричневого цвета (плотность – 1200 кг/м3). Получают в крахмало-паточном производстве в результате гидротермической обработки кукурузного зерна при 50°С в течение 40–50 ч. Полученные замочные воды упаривают до содержания сухих веществ 40–50%. Кукурузный экстракт стабилен при хранении, широко применяется в микробиологическом синтезе. Он является источником азотистых веществ (40–50% от СВ), причем более половины из них представлены аминокислотами. Содержит также белки, витамины (биотин), углеводы, макро- и микроэлементы. Основный недостаток – нестабильность состава.
Аналогом кукурузного экстракта может выступать дрожжевой экстракт, а также гидролизат кормовых или пищевых дрожжей.
В составе питательных сред в качестве источника углеводов часто используется кукурузная мука, содержащая 65–75% крахмала, до 10% других углеводов (клетчатка, пентозаны), 10–12% белка, до 4% жира, 0,8–1% минеральных веществ. Соевая мука входит в состав питательных сред как источник азотистых веществ – белков (до 30% от СВ).
Пшеничные отруби – отход мукомольного производства – являются полноценным сырьем и могут входить в состав питательной среды единственным компонентом. Широко используются в питательных средах для производства ферментных препаратов, а также как наполнитель в различных биопрепаратах кормового назначения. Основными компонентами пшеничных отрубей являются крахмал (16–20%), клетчатка (12–15%), белок (10–12%).
Наряду с рассмотренными компонентами в состав питательных сред входят минеральные соли, содержащие азот, фосфор, калий, магний и другие элементы. Из минеральных азотсодержащих веществ наиболее часто применяют водный аммиак, мочевину и аммонийные соли серной, соляной или азотной кислот. Для биосинтеза многих соединений оказался наиболее пригодным (NH4)2SO4. В результате использования азота микроорганизмами в ферментационной среде накапливаются неассимилируемые анионы кислот, возрастает кислотность среды (по этой причине такие соли называют «физиологически кислыми»). Во избежание закисления в состав исходной среды добавляют мел в количестве около 1% или корректируют рН среды щелочью в процессе ферментации.
Источником фосфора в питательных средах являются диаммонийфосфат (полностью ассимилируемая соль), а также одно- и двухзамещенные фосфорнокислые соли калия.
Микроэлементы вводят в питательную среду в виде соответствующих солей – сульфатов, реже в виде хлоридов (хлор-ион обладает более высоким коррозионным действием на материал оборудования).
В аэробных ферментационных процессах культуральная жидкость вспенивается в результате интенсивной аэрации. В связи с этим в составе среды предусматривается присутствие пеногасящего вещества (растительные масла, животный жир, синтетические полиэфиры (пропинол Б-400) и др.). Однако в процессе стерилизации питательной среды пеногаситель, обволакивая микробные клетки, повышает их устойчивость к температуре. По современным требованиям пеногаситель дозируют непосредственно в ферментатор по сигналу датчика уровня пены в аппарате.
Потребность микроорганизмов в тех или иных соединениях определяется их физиологическими особенностями. В самом первом приближении потребность микроорганизмов в питательных веществах можно определить по химическому составу биомассы микробной клетки, однако в этом случае не учитывается количество и состав метаболитов, удаленных клеткой во внешнюю среду, а также то обстоятельство, что химический состав клетки зависит от состава среды обитания и варьируется в значительных пределах.
Формирование состава питательных сред осуществляют по следующей схеме (рис. 2.2).
|
Удовлетворение
питательных
потребностей
микроорганизмов
|
→
|
Выбор сырьевых
источников
и компонентов
|
→
|
Оптимизация
состава
питательных сред
|
Рис. 2.2. Формирование состава питательных сред
В производстве продуктов микробного синтеза в качестве питательных сред используют жидкие отходы промышленных производств, например, молочную сыворотку, послеспиртовую барду, сульфитный щелок (отход производства целлюлозы сульфитным методом). Перспективно использование гидролизатов растительных материалов, являющихся возобновляемым сырьем.
III. ПОЛУЧЕНИЕ СТЕРИЛЬНОГО ВОЗДУХА
В аэробных ферментационных процессах воздух не только обеспечивает потребность культивируемых микроорганизмов в кислороде, но и отводит газообразные продукты метаболизма и тепло, выделяемое микроорганизмами в процессе жизнедеятельности, а также осуществляет гомогенизацию питательной среды и микробной суспензии. Кроме того, стерильный сжатый воздух используется как транспортирующий агент при передаче питательных сред и микробных суспензий из одной емкости в другую.
В асептических производствах очистке от микроорганизмов подлежит не только воздух, подаваемый в ферментатор, но и отработанный воздух, удаляемый из ферментационной системы.
В 1 м3 атмосферного воздуха содержится в среднем 0,2−1,0 мг/м3 мелкодисперсных частиц органического и неорганического происхождения, в том числе 1000−10 000 клеток и спор микроорганизмов. Содержание микроорганизмов в воздухе зависит от времени года, погодных условий, высоты и ряда других факторов. В зимнее время и с увеличением высоты микробная загрязненность воздуха убывает.
Подаваемый в ферментатор воздух должен быть полностью очищен от частиц и микроорганизмов размером до 1 мкм. Большинство известных методов очистки и стерилизации газов («мокрая» очистка, электрофильтры, термообработка и др.) не могут гарантировать высокую степень очистки воздуха. В зарубежной и отечественной практике получил распространение метод фильтрации воздуха через волокнистые (синтетические ткани, стекловолокно, картон), пористые (поливиниловый спирт, фторопласт) и зернистые (металлокерамика) материалы. Фильтрующий материал должен отвечать следующим требованиям: гидрофобность, устойчивость к температуре при стерилизации, высокая эффективность очистки воздуха, относительно небольшое гидравлическое сопротивление и невысокая стоимость. Наиболее распространенные фильтрующие материалы представлены в табл. 3.1. Технология получения стерильного воздуха (рис. 3.1) включает трехступенчатую фильтрационную очистку с отделением сконденсированных в охлажденном сжатом воздухе паров влаги.
Атмосферный воздух забирается на высоте 6−20 м и для защиты нагнетателя от преждевременного износа очищается от крупных частиц пыли в фильтре предварительной очистки. Сжимаемый нагнетателем воздух (давление 0,2−0,3 МПа) разогревается до 100−180°С.
Таблица 3.1. Свойства фильтрующих материалов
|
Материал
|
Диаметр волокон
или пор, мкм
|
Масса
1 м3, кг
|
Термо-
стойкость, °С
|
Гидравлическое
сопротивление, Па
|
Эффективность
по масляному
туману, %
|
|
Стекловолокно
|
2,5–3,0
|
0,40
|
400
|
8
|
98,56
|
|
Базальтовое супертонкое волокно
|
1
|
0,56
|
600
|
100
|
99,92
|
|
Картон базальтовый
|
1
|
0,30
|
150
|
61
|
99,93
|
|
Картон целлюлозный
|
20
|
0,36
|
150
|
59
|
94,10
|
|
Фторопласт
|
25
|
3,60
|
260
|
200
|
99,97
|
|
Полиэтилен
|
50
|
2,25
|
80
|
58
|
94,80
|
|
Поливиниловый спирт (фильтр «Эко», Япония)
|
25
|
1,07
|
150
|
139
|
99,00
|
Часть горячего воздуха охлаждается в воздушном (или водяном) теплообменнике до 30−35°С, в результате чего конденсируются содержащиеся в воздухе водяные пары. Конденсат удаляется из системы, и общее содержание влаги в воздухе уменьшается на 50−70%. Ресивер сглаживает колебания расхода воздуха. В головном фильтре воздух очищается от микробных клеток не менее чем на 98% (число клеток не должно превышать 10 на 1 м3 очищенного в фильтре воздуха). Окончательная стерилизующая очистка воздуха осуществляется в индивидуальных фильтрах тонкой очистки (ФТО), которыми оснащен каждый ферментатор.
Фильтры каждой ступени очистки воздуха имеют различное устройство. На стадии предварительной очистки используют кассетные сухие (или промасленные) фильтры. Единичный фильтр имеет прямоугольный корпус с площадью рабочего сечения 0,22 м2, в котором закреплены 10−15 слоев гофрированной стальной сетки (фильтр Рекке). Пропускная способность фильтра – 1540 м3/ч. Из единичных фильтров можно собрать фильтрующие панели любой производительности по очищаемому воздуху. Пылеемкость и производительность фильтров увеличиваются, если стальные сетки покрывают масляной пленкой. Но регенерация масляных фильтров требует значительных затрат ручного труда. Мельчайшие капельки масла уносятся воздухом в виде тумана, воздух приобретает запах, что часто недопустимо в микробиологических производствах.
Рис. 3.1. Технологическая схема очистки и стерилизации воздуха: 1 – воздухозаборник; 2 – фильтр предварительной очистки; 3 – нагнетатель воздуха; 4 – воздушный холодильник; 5 – влагоотделитель; 6 – ресивер; 7 – подогреватель; 8 – головной фильтр; 9 – индивидуальный фильтр
На заводах большой мощности отдают предпочтение рулонным автоматическим фильтрам (рис. 3.2) производительностью 20−120 тыс. м3/ч, в которых фильтрующий материал в виде упругого слоя из стекловолокна поступает непрерывно с малой скоростью (или периодически через определенные паузы в автоматическом режиме) с одной катушки, а загрязненный наматывается в таком же режиме на другую. Один рулон может быть рассчитан на работу в течение года.
Рис. 3.2. Рулонный фильтр: 1 – чистый рулон; 2 – фильтрующий слой; 3 – опорная решетка; 4 – рулон отработанного фильтрующего материала
Головной фильтр (рис. 3.3) представляет собой вертикальную цилиндрическую емкость со съемной крышкой и установленными внутри опорной (нижней) и прижимной (верхней) решетками, между которыми помещается волокнистый фильтрующий материал − стекловолокно или базальтовое волокно (или слои из этих волокон). Базальтовое волокно получают из магматической горной породы, оно отличается более высокой термостойкостью, большей механической прочностью и меньшим раздражающим действием на кожу человека. Производительность типовых головных фильтров по воздуху 110, 380 и 550 м3/мин.
При набивке фильтра используют средства индивидуальной защиты, а фильтрующий материал смачивают водой, чтобы уменьшить пыление. После набивки фильтр стерилизуют острым паром при температуре 125−135°С в течение 1,5−2,0 ч, а затем подсушивают горячим очищенным воздухом в течение 3 ч. В процессе эксплуатации головные фильтры стерилизуют не реже 1 раза в месяц, а перенабивку фильтров производят не реже 1 раза в год (фильтрующий материал не регенерируется). При проектировании обязательно предусматривают резервный головной фильтр.
Рис. 3.3. Головной фильтр: 1 – опорная решетка; 2 – фильтрующий материал; 3 – прижимная решетка; 4 – паровая рубашка
Фильтры тонкой очистки (рис. 3.4) устанавливают к каждому ферментатору. Они обеспечивают стерильность воздуха. В последние годы получили распространение ФТО со сменными фильтрующими элементами, изготовленными из фторопласта, базальтового картона, многослойной термостойкой ткани.
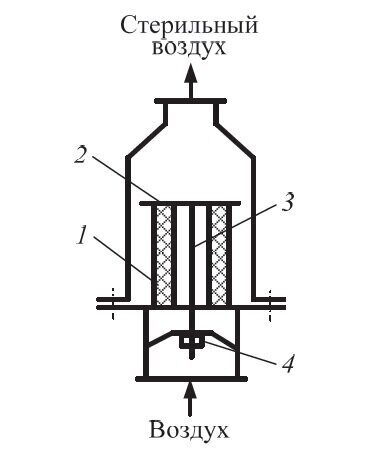
Рис. 3.4. Фильтр тонкой очистки: 1 – фильтрующий элемент; 2 – прижимная пластина; 3 – шток; 4 – гайка
Перспективно использование фильтрующих патронов из металлокерамики, прессованного металлического порошка (нержавеющая сталь, титан). Конструкция фильтров позволяет быстро заменить фильтрующий элемент, имеющий небольшие размеры (диаметр 200–400 мм, высота 400−800 мм). ФТО стерилизуется острым паром одновременно со стерилизацией ферментатора перед каждой загрузкой аппарата. Типовой ряд фильтров − ФТО-60, ФТО-100, ФТО-500, ФТО-750, ФТО-1000, ФТО-2000, где цифры указывают производительность по воздуху (м3/ч). Температура воздуха на выходе из ФТО должна составлять 40−60°С. При необходимости очищаемый воздух подогревается в теплообменнике (см. рис. 3.1). Повышенная температура воздуха в совокупности с операцией частичного удаления из сжатого воздуха водяных паров должна исключить конденсацию влаги в головных и индивидуальных фильтрах, так как при увлажнении фильтрующего материала резко снижается эффективность очистки воздуха.
Удаляемый из ферментатора воздух имеет влажность около 100% и содержит капельную влагу в количестве 40−60 г/м3, содержащую живые клетки микроорганизмов – продуцентов биологически активных веществ. Современные требования охраны труда и окружающей среды предписывают очистку отработанного воздуха от микробных клеток перед выбросом в атмосферу.
Отделение от воздуха капельной влаги приводит к удалению с жидкостью до 90% микробных клеток. В связи с этим на практике для очистки отработанного воздуха применяют систему «циклон + фильтр сетчатый». Циклон выполняет функции каплеотделителя, а фильтр, представляющий собой многослойный тканевый патрон из тонких стальных нитей, обеспечивает доочистку воздуха.
При очистке отработанного воздуха, имеющего высокую влажность, хорошо зарекомендовали себя металлокерамические фильтры, которые применяются в виде парного автоматизированного комплекса: один фильтр рабочий, другой – регенерируется продувкой паром. Переключение фильтров осуществляется в автоматическом режиме при увеличении гидравлического сопротивления фильтра до определенной (заданной) величины. Каждый ферментатор оборудуется авто- номной системой очистки отработанного воздуха, что исключает передачу инфекции по коммуникациям из одного ферментатора в другой.
IV. ПРОМЫШЛЕННЫЕ СПОСОБЫ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ
Производственное культивирование микроорганизмов – основная стадия технологического процесса, во многом определяющая техникоэкономические показатели производства биопрепаратов. В биотехнологической практике находят применение различные методы культивирования микроорганизмов (рис. 4.1), в основе которых лежит глубинное или поверхностное культивирование.
Рис. 4.1. Классификация способов и процессов культивирования микроорганизмов
Поверхностный способ культивирования применим только для аэробных микроорганизмов, которых выращивают на поверхности жидкой или твердой (плотной или сыпучей) среды. В промышленных условиях поверхностное культивирование микроорганизмов находит ограниченное применение (например, выращивание мицелиальных грибов в производстве ферментных препаратов, органических кислот (лимонная, итаконовая)) по ряду причин: низкий уровень механизации и автоматизации технологического процесса (большие затраты ручного труда); невысокая производительность ферментационного оборудования – растильных камер, занимающих большие производственные площади; не исключается контакт работающих с поверхностной культурой (мицелиальные грибы и их конидии), что недопустимо по санитарно-гигиеническим требованиям; низкая степень использования компонентов питательной среды.
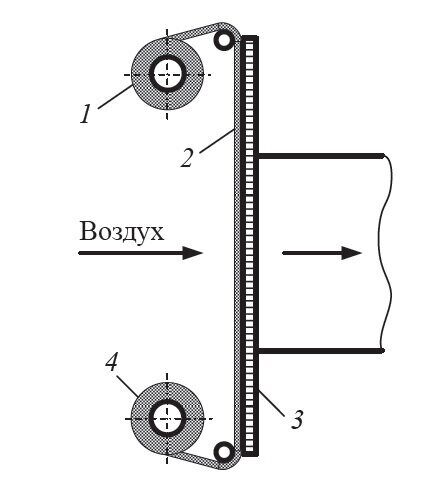
Простейшие растильные камеры (рис. 4.2) имеют стационарные горизонтальные стеллажи или подвижные этажерки, на которых ярусами располагаются прямоугольные открытые кюветы с высотой бортика 30–150 мм, заполненные жидкой или сыпучей (пшеничные отруби) средой. Камеры аэрируются стерильным, кондиционированным по температуре и влажности воздухом, расход которого рассчитывается на отвод выделяющегося биологического тепла.
Рис. 4.2. Схема растильной камеры: 1 – прозрачная стенка камеры; 2 – стеллажи с кюветами; 3 – шибер; 4 – фильтр; 5 – кондиционер
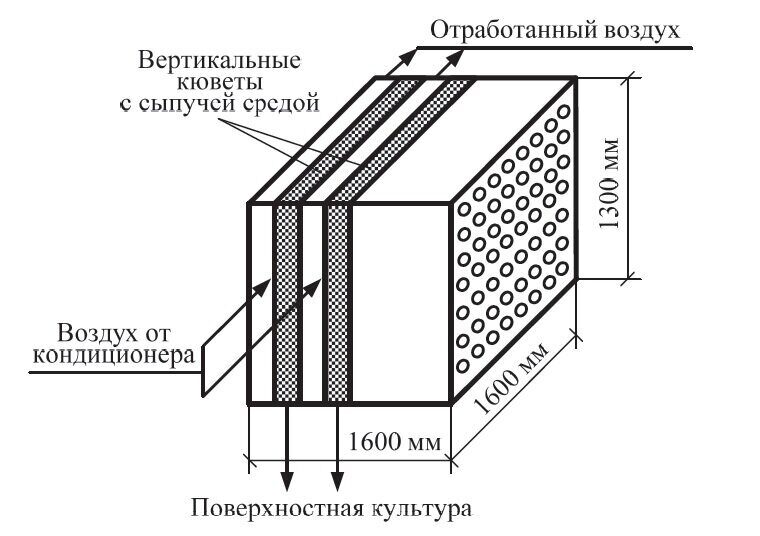
Более совершенны механизированные установки (рис. 4.3), в которых в закрытой камере располагаются растильные блоки размером 1600×1600×1300 мм с вертикальными перфорированными перегородками, образующими 23 вертикальные кюветы шириной 55–70 мм (рис. 4.4). Просветы между кюветами выполняют роль воздушных каналов. Снизу и сверху кюветы имеют открывающиеся крышки. Кюветы блока одновременно загружаются сыпучей средой на вибрационном столе и по замкнутому рельсовому пути передаются в растильную камеру. Разгрузка кювет также производится на вибрационном столе, после чего блок моют и стерилизуют паром, и рабочий цикл повторяется. Вместимость каждого блока – 500 кг по сухим отрубям. Преимущества установки заключаются в механизации процесса выращивания культуры, в возможности локализации и ликвидации очага инфекции, возникшей в процессе культивирования.
Рис. 4.3. Механизированная установка с вертикальными кюветами: 1 – стерилизатор питательной среды; 2 – вибрационный загрузочный стол; 3 – перегородка, отделяющая стерилизационное отделение от растильного с герметичными дверями; 4 – рельсовый путь; 5 – воздуховоды для отработанного воздуха; 6 – воздуховоды от кондиционеров, подающих воздух в растильные блоки; 7 – подвижные растильные блоки; 8 – растильная камера; 9 – поворотный круг; 10 – разгрузочный вибрационный стол; 11 – приемный бункер для культуры; 12 – камера мойки и стерилизации растильных блоков
Рис. 4.4. Растильный блок
Современным требованиям в наибольшей степени отвечают вертикальные колонные аппараты с горизонтальными жалюзийными тарелками, на которых располагается слой сыпучей среды толщиной до 300 мм (рис. 4.5). Аппарат имеет 8–10 тарелок. Инокулированная сыпучая среда подается на верхнюю тарелку. После выдержки при непрерывном механическом разрыхлении среды на тарелке в течение суток горизонтальные жалюзи переводятся в вертикальное положение и культура пересыпается на нижележащую тарелку. Процесс повторяется до выхода культуры из аппарата. Противотоком в колонну подается стерильный воздух. Аппарат работает в непрерывном режиме.
Рис. 4.5. Аппарат для поверхностного культивирования грибов в слое сыпучей среды: 1 – жалюзийная тарелка; 2 – гребок; 3 – охлаждающие змеевики; 4 – водяная рубашка
При глубинном (суспензионном) культивировании микробные клетки растут во всем объеме жидкой питательной среды, в которой они суспендированы и находятся во взвешенном состоянии. Глубинный метод пригоден для выращивания как аэробных, так и анаэробных микроорганизмов. Подавляющее большинство производственных продуцентов – аэробные культуры, требующие интенсивной принудительной аэрации среды. Глубинный способ культивирования имеет ряд очевидных преимуществ перед поверхностным:
- позволяет исключить тяжелый непроизводительный ручной труд и значительно сократить производственные площади;
- обеспечивает высокий уровень стерильности процесса;
- улучшает гигиену труда;
- упрощает автоматизацию производства;
- дает возможность осуществлять непрерывный процесс ферментации;
- обеспечивает более полное использование питательных веществ среды.
Глубинный метод культивирования микроорганизмов требует более высокого уровня культуры производства, однако указанные выше достоинства метода обусловили его широкое распространение. В производственной практике глубинное культивирование микроорганизмов осуществляют в периодическом или непрерывном режиме.
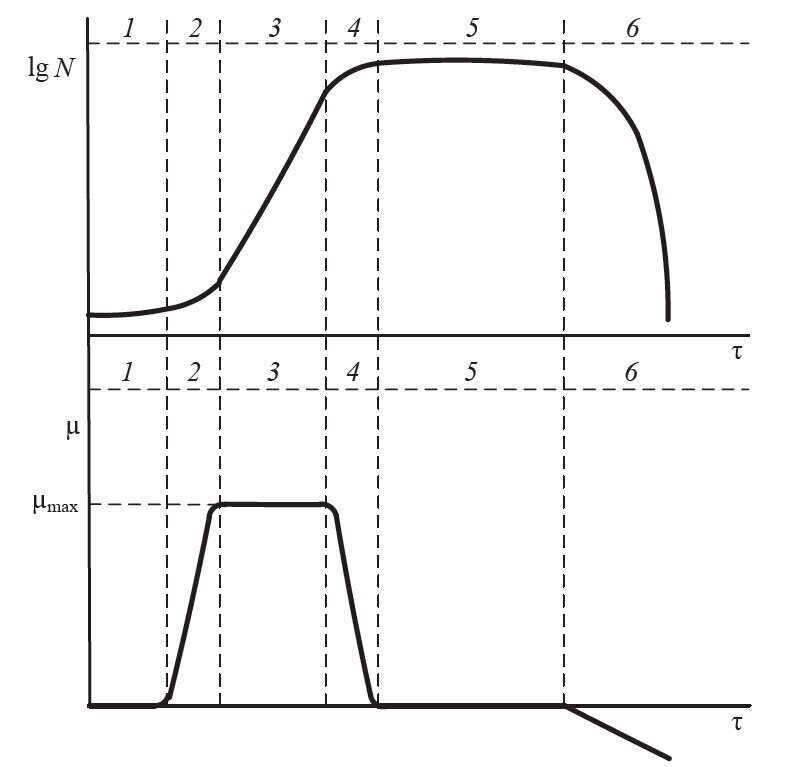
Принцип периодического метода культивирования состоит в том, что в аппарат в процессе культивирования не вносятся дополнительные питательные компоненты и из него не выводится среда с биомассой и продуктами метаболизма. В этом случае рост популяции протекает по S-образной кривой, на которой различают шесть стадий (фаз) роста (рис. 4.6).
Развитие культуры начинается с лаг-фазы. В этот период плотность популяции не возрастает (в некоторых случаях наблюдается снижение концентрации). Клетки посевного материала переходят из состояния голодания в состояние, соответствующее способности к размножению. Размер клеток увеличивается, активно протекают биохимические процессы, связанные с подготовкой к размножению. Длительность лаг-фазы зависит от:
- доброкачественности питательной среды;
- свойств и физиологической активности культуры;
- количества посевного материала и других факторов.
Фаза ускорения роста характеризуется началом деления клеток и увеличением удельной скорости роста популяции до максимальной. Обычно эта фаза непродолжительна.
Лог-фаза – фаза наиболее активного роста клеток. Удельная скорость роста является максимальной и в большинстве случаев постоянной. Логарифм числа клеток линейно зависит от времени.
Рис. 4.6. Рост популяции в периодической культуре: 1 – лаг-фаза (начальная); 2 – фаза ускорения роста; 3 – экспоненциальная фаза; 4 – фаза замедления роста; 5 – стационарная фаза; 6 – фаза отмирания
Развитие популяции в этой фазе не лимитируется питательными веществами и не тормозится продуктами жизнедеятельности. Эта фаза не может быть длительной. Со временем популяция начинает испытывать недостаток в одном или нескольких элементах питания. Среда истощается, в ней накапливаются продукты обмена веществ, ингибирующие рост микроорганизмов. Возникает и пространственная ограниченность: клетки мешают друг другу, уменьшается поверхность их контакта со средой, ухудшается поступление питательных веществ в клетку и выброс продуктов метаболизма. Скорость роста снижается, наступает фаза замедления скорости роста. По мере потребления питательных веществ концентрация биомассы продолжает расти, но медленнее, удельная скорость роста популяции снижается. Популяция переходит в стационарную фазу развития, в которой скорость роста снижается до нуля. Концентрация биомассы не возрастает и к концу фазы уменьшается. Количество вновь образовавшихся клеток становится равным количеству отмерших клеток.
Популяция постепенно переходит в фазу ускоренного отмирания. Все фазы развития микробной популяции постепенно переходят одна в другую, границы их условны. Если ставится задача получения в периодическом процессе культивирования биомассы продуцента, то процесс целесообразно вести до перехода культуры в фазу замедления роста. Если целевым является продукт метаболизма, то окончание процесса определяется максимальным уровнем накопления метаболита.
Каждая популяция характеризуется определенной скоростью роста. Различают общую скорость роста (v = dx/dτ) и удельную (μ = (dx/dτ) • (1/x)), которая выражает прирост каждой единицы биомассы популяции в единицу времени. Любая микробная популяция при росте удваивает свою биомассу за определенный промежуток времени, который называется временем генерации.
Лог-фаза является наиболее удобной для математического описания процесса роста популяции. Если принять, что начальная концентрация биомассы x0, то через n генераций x = x0 · 2n . Если n = τ : g, где τ – время роста; g – время генерации, то x = x0 · 2 (τ/g) . Отсюда можно определить экспериментальным путем время генерации:
g = 0,69τ / (ln x – ln x0), (1)
Для лог-фазы скорость роста популяции выражается зависимостью:
dx / dτ = μx,
или в интегральной форме:
x = x0 · eμτ.
Логарифмируя эту формулу, получаем выражение:
ln x = ln x0 + μτ,
или
μ = (ln x - ln x0) / τ , (2)
Сравнивая выражения (1) и (2), получаем:
g = ln 2 / μ = 0,69 / μ
Характерными негативными особенностями периодического процесса являются цикличность операций, низкая производительность оборудования, сложность автоматизации процесса, нестабильность физиологического состояния популяции микроорганизмов. Однако периодический способ культивирования микроорганизмов широко применяется при получении аминокислот, антибиотиков, ферментных препаратов и других продуктов микробного синтеза.
Сложность обеспечения асептических условий при непрерывном культивировании микроорганизмов обусловливает широкое использование периодического метода в ряде производств. Преимущество периодического способа – высокая надежность при проведении ферментационного процесса в условиях асептики.
Условием непрерывного глубинного культивирования микробной популяции является непрекращающееся поступление питательной среды в ферментатор с одновременным отбором из аппарата культуральной жидкости с приросшей биомассой и продуктами метаболизма. Процесс протекает в условиях установившегося режима и позволяет поддерживать необходимое физиологическое состояние микробной популяции при постоянных параметрах процесса (концентрация биомассы, субстрата и продуктов метаболизма и т. д.).
Периодическую культуру можно перевести в непрерывную и застабилизировать на длительное время практически в любой точке s-образной кривой. Для промышленного процесса наибольшее значение имеет фаза замедления роста. При большой скорости роста микробной популяции в этой фазе достигается высокая степень утилизации субстрата.
Различают одноступенчатые и многоступенчатые процессы непрерывного культивирования. При одноступенчатом непрерывном культивировании микробная популяция развивается в одном ферментаторе, в котором все компоненты питательной среды и микроорганизмы равномерно распределены по всему объему аппарата. При многоступенчатом непрерывном культивировании процесс протекает в батарее соединенных между собой ферментаторов, через которые непрерывно протекает питательная среда. В этом случае в каждом ферментаторе поддерживаются определенные условия для роста сформировавшейся популяции.
В производственных условиях накопление биомассы микроорганизмов осуществляют непрерывным культивированием в режиме хемостата. В этом случае скорость роста и плотность популяции ограничиваются концентрацией лимитирующего субстрата, поступление которого в ферментатор регулируется изменением скорости протока среды. На практике пользуются параметром, называемым скоростью (коэффициентом) разбавления среды D, ч-1, который определяется по следующему выражению:
D = F / V,
где F – скорость протока среды, м3/ч; V– полезный объем ферментатора, м3.
Величина D характеризует долю объема жидкости в ферментаторе, заменяемой на свежую питательную среду за один час.
При непрерывном культивировании в экспоненциальной фазе скорость прироста биомассы определяется выражением
dx / dτ = μx,
а скорость вымывания культуры составляет
dx / dτ = -Dx.
Скорость изменения концентрации микробной суспензии в ферментаторе складывается из суммы этих величин
dx / dτ = μx - Dx.
При установившемся режиме непрерывного культивирования популяция находится в состоянии динамического равновесия, при котором dx / dτ = 0. Следовательно, μx = Dx и μ = D. Это означает, что в стабилизированной проточной культуре удельная скорость роста популяции равна скорости разбавления. Величина μx (или Dx) выражает количество биомассы, г/(дм3•ч), продуцируемой в единицу времени в единице объема среды, и называется продуктивностью культуры.
Изучая рост микробной популяции в хемостате, Моно установил, что зависимость скорости роста от концентрации субстрата можно описать уравнением, напоминающим уравнение Михаэлиса − Ментен, применяемое в ферментативной кинетике:
μ = μmax (S / (Ks + S)),
где μmax – максимальная удельная скорость роста культуры при отсутствии лимитации субстратом; S – концентрация субстрата в среде; Ks – константа насыщения для субстрата, численно равная концентрации лимитирующего субстрата, при которой μ = 0,5 μmax.
Значение Ks для многих микроорганизмов имеет небольшую величину. При культивировании дрожжей Candida scottii на среде с глюкозой константа насыщения составляет 30–35 мг/дм3.
Поскольку в уравнении Моно величина S / (Ks + S) < 1, то удельная скорость роста популяции всегда ниже теоретически возможной.
Уравнение Моно получило наибольшее признание среди альтернативных моделей, описывающих зависимость скорости роста от концентрации субстрата. Оно базируется на ряде упрощающих допущений, которые приемлемы для многих, но не для всех систем.
Концентрация субстрата не является единственным фактором, лимитирующим скорость роста микроорганизмов. По мере потребления питательных веществ среда обогащается продуктами метаболизма, которые также могут лимитировать рост культуры. Н. Д. Иерусалимский установил, что при высокой плотности популяции рост культуры затормаживают продукты метаболизма. Тогда
μ = μmax (S / (Ks + S)) · (Kp / (Kp + P)) ,
где P – концентрация продуктов обмена; Kp – константа, численно равная концентрации продуктов метаболизма, при которой скорость роста вдвое меньше максимальной.
Из уравнения следует, что если S >> Ks, то скорость роста лимитируется продуктами обмена. В условиях, когда Kp >> P, скорость роста ограничена концентрацией субстрата. На практике рост культуры микроорганизмов зависит еще от целого ряда других факторов: величины рН, температуры, концентрации в среде ингибиторов и растворенного кислорода и т. д.
Для хемостата баланс лимитирующего субстрата можно представить следующим уравнением:
dS / dτ = DS0 - DS - μ (x/y),
где D – скорость разбавления; S0 и S – концентрации лимитирующего субстрата в поступающей среде и в ферментаторе соответственно; y – экономический коэффициент; dS / dτ – скорость изменения концентрации субстрата в ферментаторе.
Выражение DS0 характеризует приток субстрата, DS – количество субстрата, удаляемого с культуральной жидкостью, μ(x/y) – количество потребленного субстрата.
В состоянии динамического равновесия системы dS / dτ = 0, а D = μ.
Следовательно,
D (S - S0) = μ (x / y)
или
x = y (S - S0)
Из уравнения Моно
S = μKs / (μmax - μ)
или
S = DKs / (μmax - D)
С учетом этого можем записать
x = y · (S0 - DKs/(Dc - D))
где Dс – критическая скорость разбавления, соответствующая максимальной удельной скорости роста μmax.
Из приведенных уравнений видно, что когда D приближается к μmax, концентрация лимитирующего субстрата S резко возрастает и стремится к бесконечности (на практике S ≤ S0, т. е. S → S0). Однако, когда D → μmax и S → S0, то значение x стремится к нулю. Следовательно, в этих условиях происходит вымывание культуры и поддержание скорости разбавления, равной максимальной удельной скорости роста, невозможно.
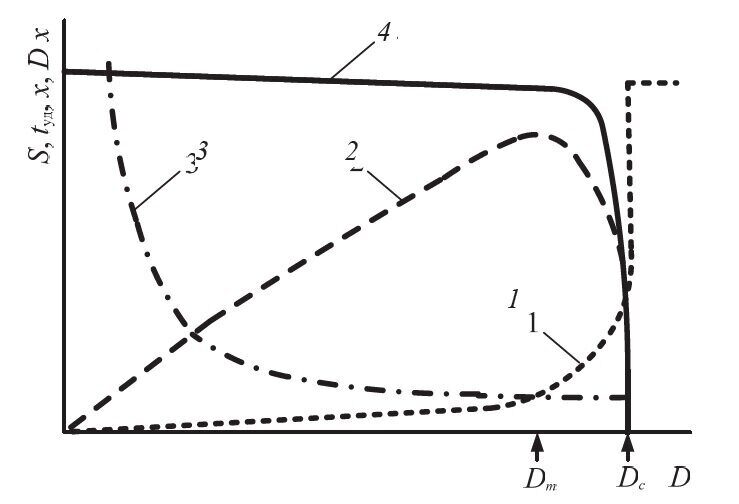
На рис. 4.7 представлено влияние скорости разбавления на основные показатели хемостатной культуры: плотность популяции, продолжительность удвоения биомассы, концентрация лимитирующего субстрата в культуральной жидкости и продуктивность культуры. С увеличением скорости разбавления от нуля до величины, близкой к критической, плотность популяции меняется незначительно. Это связано с тем, что на увеличение скорости протока культура отвечает повышением скорости роста (продолжительность удвоения биомассы уменьшается), и плотность популяции возрастает. Концентрация субстрата в ферментаторе в широком диапазоне скорости разбавления близка к нулю. Когда скорость разбавления приближается к критиче- ской (при этом μ → μmax), резко усиливается вымывание культуры из ферментатора. Следовательно, устойчивое состояние хемостатной культуры невозможно при максимальной скорости роста в связи с вымыванием культуры при малейшем увеличении скорости протока. Стабильность динамического равновесия культуры в хемостате достигается тем, что ее рост лимитирован концентрацией субстрата. При условии, что μ < μmax, хемостат работает как устойчивая саморегулирующаяся система.
Рис. 4.7. Теоретическая зависимость показателей роста культуры в хемостате от скорости разбавления среды:
1 – концентрация субстрата; 2 – продуктивность культуры Dх; 3 – продолжительность удвоения tуд; 4 – плотность популяции х
Продуктивность популяции достигает максимального значения при величине скорости разбавления Dm, близкой к критической. Численное значение Dm, при котором Dx максимально, можно рассчитать по следующей формуле:
Dm = μmax (1 - √(Ks/(Ks+S0)).
Показатели μmax, Ks, у, необходимые для управления процессом непрерывного культивирования, находят экспериментальным путем при периодическом или непрерывном культивировании микроорганизмов. Для определения Ks и μmax производят выращивание культуры при двух скоростях протока (D1 и D2) и измеряют соответствующие им концентрации субстрата в культуральной жидкости (S1 и S2). Учитывая, что константа насыщения Ks не зависит от скорости разбавления, величины μmax и Ks находят из системы тождественных уравнений
Ks = S1 · ((μmax - D1) / D1) ,
Ks = S2 · ((μmax - D2) / D2) .
В некоторых микробиологических производствах (например, в производстве бактериальных средств защиты растений) важное значение имеет синхронность развития культуры. В синхронной культуре все клетки делятся одновременно. В естественных культурах такое явление не наблюдается. Даже в экспоненциальной фазе развития популяции в культуре содержатся клетки, находящиеся на разных стадиях роста. Синхронное деление клеток вызывают искусственно, воздействуя на культуру различными факторами. Распространенными методами синхронизации являются воздействие пониженной (субоптимальной) или повышенной (супероптимальной) температуры, вынужденное голодание, отбор клеток одинакового размера фильтрованием культуральной жидкости через специальные фильтры, центрифугирование. Чаще применяют простой в исполнении метод воздействия температурой. Неблагоприятная температура культивирования в большей степени затормаживает развитие более чувствительных делящихся клеток. За это время к делению подготавливаются другие клетки, и таким образом достигается синхронность в развитии культуры.
V. ФЕРМЕНТАЦИОННЫЕ ПРОЦЕССЫ
5.1. Получение посевного материала
Технологический процесс получения продуктов микробного синтеза состоит из трех основных стадий: получение посевного материала, поверхностное или глубинное культивирование микроорганизма, получение биопрепаратов из культуральной жидкости или поверхностной культуры.
Посевным материалом называют чистую культуру микроорганизма, полученную путем последовательного постадийного накопления массы культуры продуцента.
Для получения посевного материала используют исходную музейную культуру продуцента, которая поступает в заводскую лабораторию из отраслевого НИИ или с посевной станции. Необходимое количество посевного материала выращивается в отделении чистой культуры (ОЧК) в асептических условиях, гарантирующих отсутствие примесей других микроорганизмов. Чистая культура поступает на предприятие, как правило, в пробирках на скошенных агаризованных средах. Каждая производственная культура сопровождается паспортом, в котором указаны продуцент, его коллекционный номер, дата изготовления, средняя активность серии и срок годности, характеристика среды для выращивания и хранения. Культуру проверяют на микробиологическую чистоту и биохимическую активность.
Хранение исходных штаммов продуцентов – ответственная и сложная задача. При длительном хранении могут возникать спонтанные мутации. Наибольшая возможность проявления спонтанной изменчивости культуры возникает в тех случаях, когда исходным штаммом является мутант. В связи с этим необходимо периодически проводить рассев культуры и проверку по морфологическим и физиологическим признакам. При рассевах отбирают колонии, дающие наилучшие результаты. Такая непрерывная селекция позволяет сохранить в активной форме культуру продуцента. Длительные промежутки между пересевами недопустимы в связи с тем, что микроорганизмы в процессе роста и хранения потребляют из среды питательные вещества и выделяют в нее продукты обмена, вредно влияющие на их свойства.
Исходную культуру хранят чаще всего на агаризованной среде в пробирках при температуре 4–6°С. Более длительное время можно хранить культуру под слоем медицинского вазелинового масла. Слой стерильного масла должен иметь толщину около 1 см.
Лиофильно высушенные культуры могут сохраняться до 5 лет без потери способности к быстрому росту и накоплению целевого продукта. Грибные и дрожжевые культуры успешно хранят в замороженном состоянии в жидком азоте при температуре от –165 до –196°С. Культуру замораживают в 10%-ном водном растворе глицерина в запаянных ампулах, которые содержат в контейнере с жидким азотом. В этих условиях активность культуры полностью сохраняется до 5 лет.
Промышленные культуры актиномицетов хранят в производственных условиях на разваренном стерильном пшене. Выросшую на зерне культуру продуцента высушивают под вакуумом при комнатной температуре до влажности зерна 7–8%. В таком виде культура актиномицетов может храниться несколько месяцев.
Приготовление посевного материала для поверхностного культивирования микроорганизмов. Поверхностный способ применяют в основном при культивировании мицелиальных грибов. В этом случае посевной материал может быть приготовлен в виде:
- культуры, выращенной на твердой питательной среде;
- спорового материала;
- мицелиальной массы продуцента, выращенной на жидкой питательной среде глубинным способом.
Посевную культуру на твердой питательной среде готовят выращиванием микроорганизмов в возрастающем количестве в 3–4 этапа. Состав питательной среды определяется свойствами микроорганизма-продуцента. Чаще всего для этой цели используют увлажненные пшеничные отруби. Влажность среды после стерилизации должна составлять в зависимости от вида продуцента 35–65%. Для рыхлости к отрубям иногда добавляют древесные опилки, солодовые ростки, свекловичный жом.
На первом этапе приготовления посевного материала исходную культуру продуцента пересевают в пробирку с 1,0–1,5 г стерильных отрубей и выращивают при оптимальной температуре до обильного спорообразования.
На втором этапе продуцент культивируют в тех же условиях и на той же среде в колбах емкостью 0,75–1,0 дм3, содержащих 40–100 г влажной среды (из одной пробирки засевают среду в 3–4 колбах).
На третьем этапе (дополнительный этап, при малом спорообразовании у продуцента) культивирование осуществляют в колбах с 300 г влажных отрубей до наступления обильного спорообразования.
На четвертом этапе полученный посевной материал используют для засева посевных кювет. Кюветы прямоугольной формы размером
600×400 мм и высотой борта 20–30 мм выполнены из сплошного листа оцинкованного железа, снабжены крышками с одним или двумя отверстиями, которые закрываются ватно-марлевыми подушками. Вместимость посевных кювет 400–500 г воздушно-сухих отрубей. Питательную среду стерилизуют в автоклаве в биксах по 2 кг при давлении 0,15 МПа в течение 1 ч, а посевные кюветы – в стерилизационных шкафах при температуре 120–130°С в течение 2,0–2,5 ч.
Содержимым одной колбы засевают 20 посевных кювет. Посевной материал смешивают с питательной средой в отдельной емкости с соблюдением всех правил асептики и раскладывают в кюветы слоем толщиной 0,8–1,2 см. Между кюветой и крышкой укладывают слой непроклеенной бумаги для предотвращения возможной конденсации влаги на крышке и создания зон излишнего увлажнения растущей культуры. Кюветы со средой помещают на стеллажи в растильные камеры, в которых поступающим через кондиционер воздухом поддерживается определенная влажность и температура. Камеры заполняют кюветами, исходя из удельной нагрузки по культуре 1–2 кг засеянной среды (по сухой массе) на 1 м3 объема камеры. При этом обмен воздуха в камере должен быть равен 2–3 объемам камеры за 1 ч.
Готовый посевной материал снимают с кювет и во влажном состоянии помещают в стерильные пакеты, которые затем хранятся при температуре 3–4°С. Длительность хранения посевного материала не должна превышать 5–6 суток (влажная культура подвержена лизису, и активность ее снижается). При необходимости более длительного хранения посевной материал подсушивают до влажности 10–12% в растильной камере воздухом при температуре 28–30°С, предварительно сняв крышки с кювет. Приготовленный посевной материал представляет собой спороносящую культуру продуцента и должен содержать не менее 0,7 млрд спор в 1 г. Для получения засевной суспензии посевной материал смешивают со стерильной водой в специальной емкости. Суспензия используется для засева среды в производственных условиях.
Споровой материал отличается от спороносящей культуры незначительным содержанием самой питательной среды и состоит главным образом из спор продуцента при небольшом содержании мицелия. Споровой материал содержит 7–10 млрд спор в 1 г. Для получения спорового посевного материала поверхностную культуру подсушивают до влажности 9–10% и подают в вибросепаратор, из которого воздушным потоком (вакуум-насосом) конидии отделяются от среды и собираются в приемник. Споровой материал расфасовывают в полиэтиленовые пакеты в боксе-манипуляторе. Полученный таким образом конидиальный материал может храниться без значительных изменений при температуре 8–24°С до 1,5 лет. За год хранения конидии теряют всхожесть в среднем на 8%.
Споры (конидии) обладают свойством гидрофобности – плохо смачиваются водой. Это приводит к неравномерности засева среды и, следовательно, к неодинаковой скорости роста культуры. Однородную суспензию конидий можно получить добавлением в воду на каждый грамм спорового материала 25–50 см3 ПАВ (алкилбензол-сульфата). При этом смачиваемость спор сильно возрастает при неизменной всхожести.
Применение спорового материала облегчает технологический процесс, позволяет более полно механизировать его. Однако получение спорового посевного материала приводит к сильному загрязнению воздуха конидиями. Несмотря на наличие аспирационных устройств, насыщенность воздуха конидиями может достигать 3·102–1·104 на 1 м3, что недопустимо в санитарно-гигиеническом отношении. Это приводит к необходимости применять специальную одежду и индивидуальные средства защиты. Чтобы исключить возможность проникновения посторонней микробиоты, в помещениях цеха чистой культуры поддерживается подпор воздуха (ризб = 0,01–0,02 МПа).
Наиболее безопасным является получение посевного материала глубинным культивированием в виде мицелиальной массы. Отличие этого способа от рассмотренных состоит в том, что культура, выращенная в колбах на отрубях, поступает для засева жидкой питательной среды в лабораторных ферментаторах объемом до 40 дм3. Продолжительность культивирования обычно составляет 24–30 ч. Молодая, активно растущая мицелиальная масса служит посевным материалом для засева производственной среды. Такой способ позволяет в 2,5–3,0 раза сократить длительность приготовления посевного матерала, в 4–5 раз уменьшить площадь отделения чистой культуры, улучшить условия труда, снизить спорообразование в готовой производственной культуре.
Приготовление посевного материала для глубинного культивирования микроорганизмов. При глубинном культивировании микроорганизмов посевной материал готовят также глубинным способом с постадийным увеличением массы культуры-продуцента. В зависимости от мощности предприятия число стадий колеблется от 2 до 5. Общая схема получения посевного материала в асептических производствах представлена на рис. 5.1.
Рис. 5.1. Принципиальная схема получения посевного материала в асептических производствах
Ферментаторы малого объема (до 10 м3) засевают посевным материалом из качалочных колб. На предприятиях большой мощности биомассу чистой культуры накапливают в инокуляторе, а затем в посевном аппарате с соблюдением условий строгой асептики. Число стадий получения посевного материала стремятся максимально сократить, чтобы снизить вероятность появления инфекции. Продолжительность каждой стадии накопления биомассы культуры составляет, как правило, 24–36 ч (культура передается с одной стадии на другую в активной (логарифмической) фазе роста).
Питательная среда для получения посевного материала часто отличается от производственной по качественному или (и) количественному составу. Передачу посевного материала из одного аппарата в другой осуществляют пережимом сжатым стерильным воздухом без нарушения асептики.
Количество посевного материала составляет 8–10% от объема засеваемой питательной среды.
В нестерильных производствах (производство кормового белка) посевной материал получают в отделении чистой культуры накоплением биомассы в каскаде ферментаторов с последовательно возрастающим объемом: 0,63 м3; 6,3 м3; 63 м3.
5.2. Ферментация
Биореакторы для глубинного культивирования микроорганизмов отличаются большим разнообразием конструкций. В общем случае конструкция биореактора должна обеспечить выполнение следующих функций и требований:
- исключить проникновение посторонних микроорганизмов в аппарат;
- обеспечить возможность введения субстрата и воздуха, а также выведения газообразных продуктов метаболизма с отработанным воздухом;
- осуществить интенсивное диспергирование газовой фазы в жидкой;
- обеспечить удаление выделяющегося в процессе ферментации тепла.
Промышленные биореакторы можно разделить на три группы:
- неаэрируемые (метантенки, бродильные аппараты);
- аэрируемые без механического перемешивания;
- с механическим перемешиванием и аэрацией.
Биореакторы первой группы используются в анаэробных процессах. Вторая группа аппаратов включает биореакторы, в которых распределение воздуха в жидкой среде производится с помощью насосов (рис. 5.2, а, б) или за счет избыточного давления воздуха (рис. 5.2, в, г), а также аппараты с непрерывной газовой фазой (рис. 5.2, д, е).
Биореакторы последнего типа применяют преимущественно в процессах очистки сточных вод. В этих аппаратах микроорганизмы закрепляются на поверхности насадки или вращающихся дисков в виде биопленки.
Третья группа объединяет биореакторы, в которых распределение воздуха в жидкой фазе осуществляется за счет механического перемешивания (рис. 5.2, ж, з).
Несмотря на разнообразие конструкций, существуют типы ферментаторов, которые занимают доминирующее положение в отрасли. В частности, в промышленном производстве кормовой биомассы микроорганизмов на средах с растворенным субстратом широко применяются малоэнергоемкие ферментаторы эрлифтного типа, в которых перемешивание среды (диспергирование газовой и жидкой фаз) осуществляется только за счет энергии вводимого воздуха с использованием принципа эрлифта, обеспечивающего циркуляцию жидкости вокруг направляющего диффузора (или циркуляционной трубы) за счет разности плотностей между увлекаемой (насыщенной) воздухом жидкостью внутри диффузора и дегазированной жидкостью (вне диффузора).
В асептических производствах наибольшее распространение получили ферментаторы барботажного типа с механическим перемешиванием ферментационной среды. На отечественных предприятиях используют ферментаторы объемом до 100 м3 (15, 50, 63, 100 м3), зарубежом – до 300 м3.
Рис. 5.2. Принципиальные схемы биореакторов различных типов:
В связи с необходимостью строгого соблюдения требований асептики ферментацию осуществляют в периодическом режиме со стерилизацией ферментатора и коммуникаций после каждой операции по выращиванию микроорганизмов. Выбор объема аппарата определяется не только мощностью производства по целевому метаболиту, но и достигнутым уровнем асептики производства. Нестерильная операция в ферментаторе большой емкости приводит к потере значительного количества питательной среды, часто содержащей дорогостоящие компоненты. Ферментатор представляет собой герметичную цилиндрическую емкость из нержавеющей стали со сферическими крышкой и днищем (рис. 5.3).
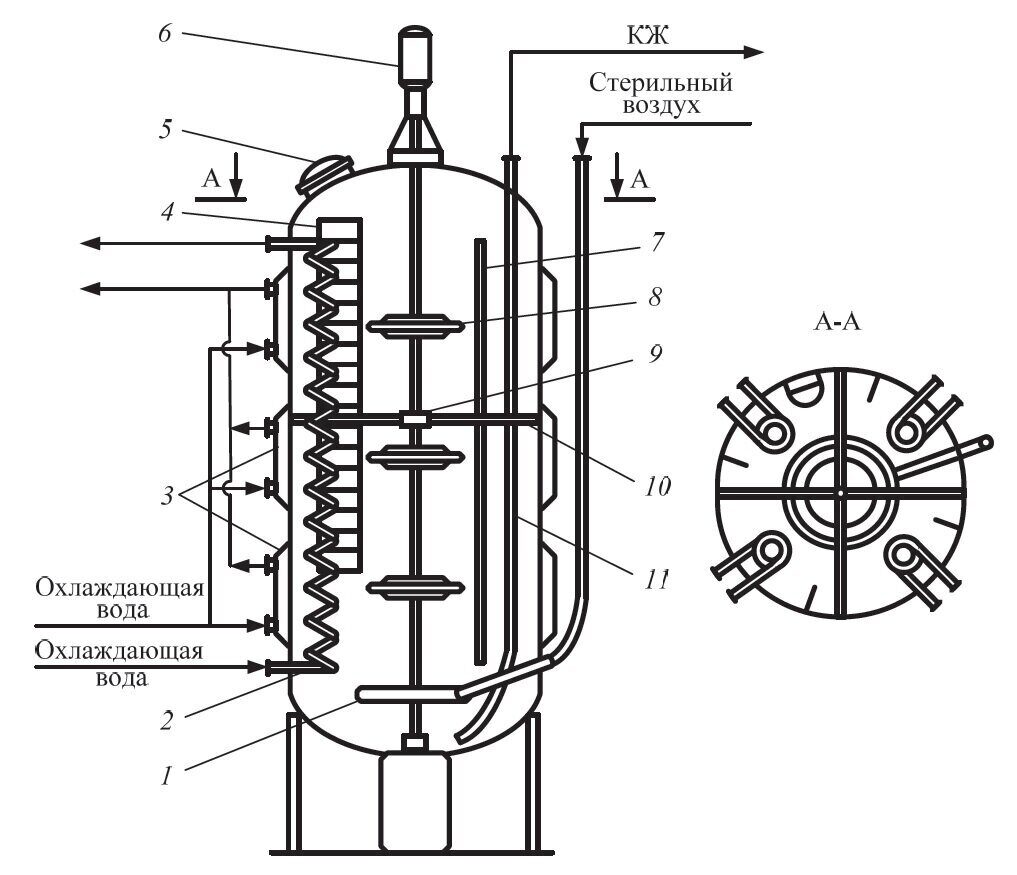
Рис. 5.3. Ферментатор емкостью 100 м3: 1 – кольцевой барботер; 2 – змеевиковый теплообменник; 3 – секции водяной рубашки; 4 – лестница; 5 – люк; 6 – электропривод; 7 – отбойник; 8 – турбинная мешалка; 9 – соединительная муфта; 10 – крепление вала; 11 – пережимная труба
Аппарат оборудован перемешивающим устройством в виде одно-, двух- или трехъярусной мешалки (чаще турбинного типа), барботером для подачи воздуха и коммуникациями для ввода питательной среды, посевного материала, пеногасителя, нейтрализующего агента и вывода отработанного воздуха. В процессе ферментации выделяется большое количество тепла в результате жизнедеятельности микроорганизмов (биологическое тепло) и за счет работы мешалки. Охлаждение среды до оптимальной температуры производится с помощью наружной секционированной водяной рубашки ферментатора и внутренних змеевиковых теплообменников. При необходимости охлаждающие устройства используются в качестве греющих при стерилизации ферментатора и питательной среды. Современные ферментаторы укомплектованы регулирующими устройствами и контрольно-измерительными приборами (автоматическое регулирование температуры, рН ферментационной среды, расхода воздуха, уровня пены, а также контроль давления, уровня жидкости, температуры и рН среды).
Перед каждой загрузкой ферментатора питательной средой производят его подготовку к работе, которая включает ряд последовательных операций.
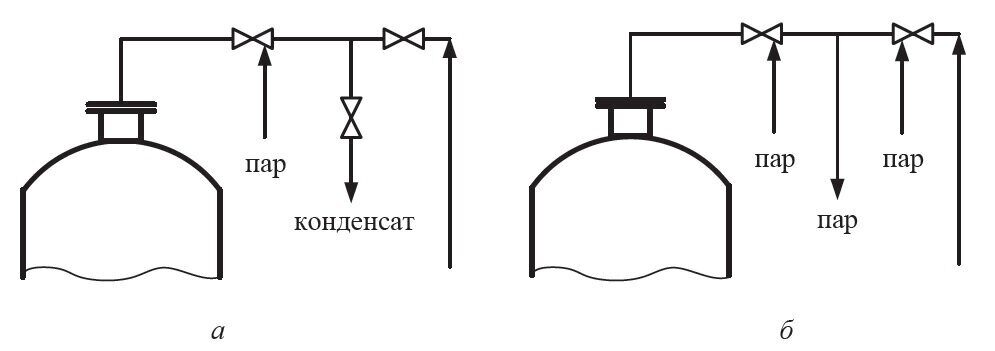
После слива культуральной жидкости ферментатор промывают водой с помощью специальной моечной машинки, прогревают острым паром до температуры 100°С и охлаждают до 30–40°С. Используя люк-лаз, производят внутренний технический осмотр аппарата: проверяют состояние соединительных муфт вала, мешалок, барботера, датчиков КИП и устраняют обнаруженные дефекты. Затем ферментатор герметизируют и создают воздушное давление в аппарате 0,15–0,20 МПа. Аппарат считают герметичным, если в течение 45–60 мин давление падает не более чем на 0,005 МПа. При наличии утечки с помощью мыльного раствора проверяют на герметичность все фланцевые соединения, сварные швы и сальниковые уплотнения запорной арматуры. Если аппарат и прилегающие коммуникации герметичны, производят их стерилизацию. Ферментатор нагревают путем подачи острого пара через все входные и выходные коммуникации до 100–104°С при открытом выходе на линии отработанного воздуха, затем закрывают вентиль на выходе воздуха и продолжают нагрев до температуры 130–135°С, при которой выдерживают в течение 1–2 ч. Одновременно с ферментатором стерилизуют фильтр тонкой очистки воздуха и пеногаситель в бачке.
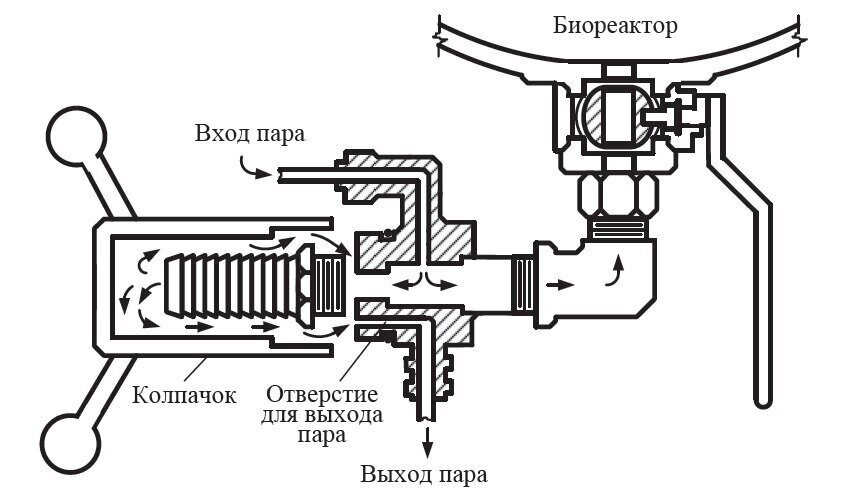
По окончании стерилизации в ферментатор подают стерильный воздух, а в охлаждающие системы – холодную воду. Через УНС в ферментатор загружают стерильную питательную среду. В аппарате постоянно поддерживают давление воздуха 20–30 кПа, чтобы исключить проникновение инфекции в ферментатор с наружным воздухом. С этой же целью все незадействованные в процессе ферментации коммуникации защищают паровыми затворами.
Коэффициент заполнения питательной средой геометрического объема ферментатора составляет 0,6–0,7. Свободное пространство используется для компенсации повышения уровня среды за счет увеличения газосодержания при аэрации и для регулирования уровня пены. Высокая пенообразующая способность питательных сред обусловливается наличием растворенных белков, пектиновых веществ, коллоидно-растворенных соединений. В процессах ферментации наличие пены, с одной стороны, способствует интенсификации массообмена и увеличивает концентрацию кислорода в среде. С другой стороны, интенсивное пенообразование уменьшает полезный объем ферментатора. На практике уровень пены в аппарате постепенно возрастает от 0 до максимально допустимой величины, при достижении которой автоматически включается система пеногашения. Наибольшее распространение получили химические и механические способы пеногашения. Механические методы основаны на ударном воздействии на пену твердой поверхности (вращающийся гладкий диск, «беличье» колесо, пакет конических тарелок).
Механизм действия химического пеногасителя заключается в том, что он вытесняет менее активный пенообразователь из поверхностного слоя пузырьков пены. Стенки пузырьков под действием молекул химического пеногасителя истончаются и легко разрушаются. При добавлении большого количества ПАВ пеногасящий эффект теряется и пенообразование, наоборот, усиливается.
Уровень пены в аппарате можно стабилизировать также временным уменьшением подачи воздуха или временным прекращением механического перемешивания ферментационной среды.
В качестве химических пеногасителей применяют растительные масла (соевое, подсолнечное), жиры животного происхождения (рыбий и свиной), синтетические поверхностно-активные вещества, например, органический полиэфир – пропинол Б-400. Для гашения пены в ферментаторах чаще всего используют предварительно простерилизованные химические пеногасители (пропинол Б-400), которые автоматически дозируются в ферментационную среду в виде водной эмульсии (соотношение пеногаситель: вода = 1 : 5–1 : 8) по сигналу датчика уровня пены в аппарате.
Эффективен комбинированный метод гашения пены, например, подачей химического пеногасителя на поверхность вращающегося гладкого диска.
Несмотря на непрерывное совершенствование конструкции, современные биореакторы обладают такими несовершенствами, как недостаточно высокая скорость растворения кислорода в ферментационной среде, ограниченные возможности по отводу биологического тепла, ингибирование культуры продуктами метаболизма.
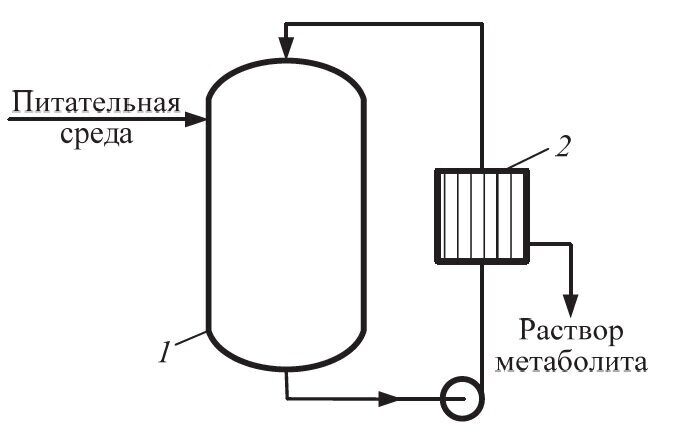
К биореакторам нового поколения относят мембранные биореакторы, оснащенные погружным (расположенным внутри аппарата) или вынесенным в циркуляционный контур мембранным модулем, обеспечивающим отделение и возврат в биореактор микробных клеток с одновременным отбором раствора целевого метаболита (рис. 5.4).
Рис. 5.4. Схема мембранного рециркулирующего биореактора: 1 – биореактор; 2 – мембранный модуль
В мембранных биореакторах используются полупроницаемые разделяющие элементы различных типов и конфигураций: трубчатые, плоскорамные, половолоконные мембранные элементы, органические (полиамид, фторопласт и др.), металлические (прессованный порошок металлов) и неорганические (керамические) микрофильтрационные и ультрафильтрационные мембраны.
Биореакторы мембранного типа применяют при очистке сточных вод, перспективно использование их в микробиологическом производстве органических растворителей.
5.3. Роль кислорода и диоксида углерода в ферментационном процессе
Эффективность аэробной ферментации зависит от скорости растворения и концентрации кислорода в ферментационной среде. Микроорганизмы потребляют кислород только из раствора. Обеспечение микроорганизмов кислородом часто является лимитирующим фактором в ферментационном процессе. Растворимость кислорода в воде из воздуха при температуре 38°С и атмосферном давлении составляет около 7 мг/дм3. Растворимость чистого кислорода в воде при тех же условиях – 33 мг/дм3. Неорганические и органические компоненты питательной среды понижают растворимость кислорода в среднем на 10%.
В условиях полного смешения массопередача кислорода описывается уравнением
q = k · a (c* - c) = α · μ · x,
где q – скорость массопередачи кислорода из газовой фазы в жидкость, кгО2/(м3·ч); k – константа, зависящая от степени турбулизации среды, м/ч; а – удельная поверхность раздела газовой и жидкой фаз, м2/м3; k · а – объемный коэффициент переноса кислорода, ч–1; с*, с – равновесная и рабочая концентрации кислорода в жидкости, кг/м3; α – потребность культуры в кислороде, кгО2/кгАСБ; µ – скорость роста культуры, ч–1; x – концентрация биомассы, кгАСБ/м3.
Правая часть уравнения отражает потребление кислорода микробной массой.
Потребность культуры в кислороде определяется природой субстрата. Например, при выращивании продуцентов белка (дрожжи, бактерии) на углеводных средах требуется кислорода (кг/кгАСБ) 0,9–1,1, на этаноле – 1,7–1,9, на н-парафинах – 2,2–2,5, на метане – 3,5–5,0. Чем выше доля углерода в субстрате, тем больше потребность в кислороде и тем больше тепловыделения при ферментации. В среднем тепловыделения при выращивании микроорганизмов составляют 14,2–14,4 кДж на 1 г потребленного кислорода.
Объемный коэффициент переноса кислорода (k · а) зависит от условий ферментации: объема ферментатора, мощности привода мешалки, соотношения диаметра и высоты аппарата, типа аэрационной системы, температуры процесса, реологических свойств культуральной среды (увеличение вязкости среды снижает коэффициент массопереноса).
В промышленных ферментаторах с точки зрения массообменных процессов лимитирующим фактором является не столько концентрация растворенного кислорода, сколько скорость его растворения, которая определяется прежде всего расходом аэрирующего агента (воздуха или технического кислорода), концентрацией кислорода в нем, а также конструкцией системы распределения воздуха.
Проблема лимитации роста микроорганизмов кислородом в производственных условиях может быть решена следующими путями:
- использованием для аэрации среды в ферментаторах воздуха, обогащенного кислородом (30–35% О2), или технического кислорода;
- проведением процесса ферментации при повышенном давлении
- (до 0,8 МПа);
- использованием колонных ферментаторов большой высоты (до 40 м) – высокое гидростатическое давление повышает растворимость кислорода в среде.
О роли СО2 известно гораздо меньше, чем о роли кислорода. На растущие микробные клетки СО2 может влиять двойственно: низкие его концентрации необходимы для роста клеток, а высокие концентрации обладают ингибирующим действием. Полное отсутствие СО2 отрицательно сказывается на росте большинства микроорганизмов (если не всех микроорганизмов вообще).
СО2-лимитирующие условия могут возникнуть в начале роста культуры (в результате удлиняется лаг-фаза) или при чрезмерной аэрации среды, что бывает редко. Вместе с тем при парциальном давлении больше 25–100 кПа СО2 задерживает рост большинства микроорганизмов, хотя устойчивость микроорганизмов к СО2 сильно различается. В частности, наиболее чувствительны к СО2 бактерии рода Pseudomonas, наименее чувствительны – молочнокислые гомоферментативные бактерии. Лимитирование по кислороду, а также низкие значения рН среды усиливают ростоингибирующее действие СО2. Отрицательное действие СО2 на микроорганизмы усиливают также некоторые субстраты, в частности этанол.
5.4. Обеспечение условий асептики в процессе ферментации
Стерильность оборудования и коммуникаций имеет первостепенное значение при проведении ферментации в асептических условиях.
Борьба с посторонними микроорганизмами ведется путем механической чистки, мойки, дезинфекции и стерилизации оборудования и трубопроводов. В качестве дезинфицирующего агента чаще всего используют в производственных условиях 0,1–0,2%-ный раствор каустической соды. Аппаратуру и коммуникации стерилизуют острым паром при температуре 120–140°С.
При массовом развитии инфекции в дополнение к стерилизации оборудования предварительно проводят следующие операции:
- механическую чистку загрязненных мест и мойку холодной водой;
- дезинфекцию 0,1–0,2%-ным раствором каустической соды при полном заполнении аппарата и перемешивании при температуре 50–70°С;
- ополаскивание холодной водой (при перемешивании).
При мойке аппаратов особое внимание обращают на гнезда для контрольно-измерительных приборов, фланцевые соединения, пробоотборные краны, тупики. Стерилизации острым паром подвергают как сам ферментатор, так и систему трубопроводов.
Для автоматического контроля и регулирования параметров технологического процесса ферментаторы оборудованы датчиками. Наиболее важное требование к датчикам – способность выдерживать многократную стерилизацию острым паром. Наиболее чувствительны к температурным изменениям датчики рН среды.
Необходимо учитывать, что различные патрубки и люки плохо поддаются стерилизации из-за образования в них воздушных пробок, которые резко нарушают условия прогрева стенок. При конструировании аппаратов стремятся к сокращению числа отводящих и подводящих штуцеров, увеличению их диаметра и уменьшению высоты.
Для обеспечения асептических условий ферментации, помимо операций по стерилизации воздуха, питательных сред и оборудования, должны быть выполнены следующие требования:
- наличие термических (паровых) затворов на коммуникациях;
- ввод добавок в ферментатор и отбор проб без нарушения условий асептики;
- использование сильфонной арматуры и многофункционального сильфон-коллектора;
- герметичность оборудования и коммуникаций.
Термические затворы предусматривают на всех не задействованных в период ферментации коммуникациях. Затворы (рис. 5.5) могут быть тупиковыми (более экономичны по затратам тепловой энергии) или с пролетным паром (более эффективны, но энергозатратны).
Рис. 5.5. Схема термического затвора: а – тупиковый; б – с пролетным паром
Для эффективной стерилизации арматуры целесообразна врезка паровой трубки непосредственно в корпус вентиля (или задвижки).
На шлемовой части ферментатора (рис. 5.6) располагается большое число штуцеров для входных и выходных коммуникаций, что не способствует поддержанию высокого уровня асептики.
Рис. 5.6. Схема обвязки ферментатора: 1 – посевной материал; 2 – воздух; 3 – питательная среда; 4 – пеногаситель; 5 – отработанный воздух; 6 – подпитка; 7 – выдача КЖ; 8 – моющий раствор; 9 – пробоотборник
Число штуцеров на верхней части ферментатора сокращается при использовании сильфон-коллектора (рис. 5.7).
Рис. 5.7. Сильфон-коллектор
Сильфонная арматура отличается тем, что в задвижках сальниковое уплотнение штока заменено на двойной стальной сильфон (рис. 5.8).
Двойная стальная гофра, сжимаясь и растягиваясь, не препятствует движению штока и исключает проникновение инфекции в коммуникацию через арматуру.

Рис. 5.8. Схема сильфонной арматуры
Дополнительные элементы и узлы во внутренних полостях ферментаторов затрудняют достижение требуемой температуры при стерилизации, особенно в тупиковых полостях. Такими элементами являются змеевики для охлаждения КЖ, барботеры для воздуха, трубы передавливания, термометры сопротивления, датчики различных КИП и т. д.
В производственных условиях для обеспечения высокого уровня асептики частота ввода добавок в ферментатор и отбора проб культуральной жидкости должна быть сведена к минимуму.
Засев посевного аппарата или производственного ферментатора (объемом до 10 м3) чистой культурой производят из качалочных колб через посевной штуцер, закрытый колпачком и оснащенный кольцевым каналом для размещения смоченного спиртом фитиля. Перед засевом шлемовую часть аппарата обрабатывают раствором антисептика (формалина, хлорной извести, хлорамина), выключают вентиляцию в помещении, уменьшают подачу стерильного воздуха в ферментатор. Кольцевой фитиль поджигают, специальным ключом отвинчивают колпачок и через пламя вводят микробную суспензию из качалочной колбы. Колпачок обжигают в пламени, закрывают им штуцер и гасят пламя.
Ввод добавок или отбор проб КЖ можно осуществлять с помощью аппарата Боброва (рис. 5.9), который подсоединяется к ферментатору. Приемный сосуд с добавкой (или для пробы КЖ) отсоединяется от промежуточной камеры и стерилизуется в лабораторном автоклаве. После подсоединения сосуда промежуточная камера стерилизуется острым паром с контролем температуры по давлению. Содержимое сосуда пережимается стерильным воздухом в ферментатор (при отборе проб в сосуде создают разрежение).
Рис. 5.9. Устройство для отбора проб и введения добавок в асептических условиях (аппарат Боброва): 1 – приемный сосуд; 2 – бактериальный фильтр; 3 – сильфонный вентиль; 4 – промежуточная камера; 5 – манометр; 6 – стальная диафрагма; 7 – конденсатоотборник; 8 – ферментатор
Для стерильного отбора проб и передачи культуральной жидкости из биореактора фирмой NBS (США) разработана конструкция эффективных затворов (рис. 5.10, 5.11).
Рис. 5.10. Затвор для стерильного отбора проб: 1 – сварной входной штуцер; 2 – накидная гайка; 3 – шаровой кран; 4 – сменный наконечник для присоединения шланга; 5 – паровый колпак
Рис. 5.11. Затвор для стерильной передачи культуральной жидкости
5.5. Оптимальные режимы термической стерилизации оборудования и коммуникаций
Тепловая стерилизация оборудования занимает большое место в топливно-энергетическом балансе предприятий и во многом обусловливает энергоемкость микробиологических производств.
Эффективность стерилизации оборудования оценивают по величине безразмерного критерия Дейндорфера (критерия стерилизации):
D = k × τ,
где k – константа скорости отмирания микроорганизмов, мин–1; τ – продолжительность стерилизации аппарата в изотермическом режиме, мин. Условия стерилизации выбирают такими, чтобы величина критерия Дейндорфера составляла не менее 80 (уровень асептики – нестерильна одна операция из ста).
Проведенные на предприятиях расчеты показали, что на практике критерий D по действующим режимам стерилизации оборудования составляет 200–300 и более, что не рационально с позиций энергетических затрат. Оптимальным считают такой режим стерилизации, который обеспечивает достижение требуемой величины критерия D (80– 100) при минимальных величинах расхода пара и продолжительности термообработки. Такой режим стерилизации оборудования может быть эффективным на практике при отсутствии так называемых «слабых точек» (длинных и узких штуцеров, гнезд КИП, тупиковых областей, в которых создаются воздушные пробки).
Рассмотрим пример. Аппарат стерилизуют при температуре 126°С в течение 1 ч. Из справочных данных константа отмирания микроорганизмов при 126°С k = 5,9. Следовательно, критерий стерилизации
D = 5,9 · 60 = 354.
Очевидно, что режим стерилизации не является рациональным (так как D >> 80) и приводит к перерасходу пара и увеличению времени подготовки аппарата к работе.
Для оптимизации процесса предлагается учитывать суммарный стерилизующий эффект на стадиях нагревания, выдержки и охлаждения аппарата. При этом предполагается, что стерилизующий эффект, который следует учитывать, обеспечивается лишь при температуре не менее 100°С, а зависимость температуры от времени на стадиях нагревания и охлаждения линейна. При изменяющейся температуре критерий стерилизации рассчитывают из выражения
Dнагр (охл) = Dстер · (τнагр (охл) / (tстер – 100))
где Dстер – критерий при температуре стерилизации (tстер); τнагр(охл) – продолжительность изменения температуры от 100°С до tстер.
Рассмотрим пример. Ферментатор прогревается от 100°С до температуры стерилизации за 45 мин, стерилизуется при 124°С и охлаждается от tстер до 100°С в течение 60 мин. Тогда
Dнагр = 18, 66 · (45 / (124 - 100)) = 35,0;
Dохл = 18, 66 · (60 / (124 – 100)) = 46,6;
где 18,86 – табличное значение критерия стерилизации при 124°С.
Суммарный критерий
D = 35,0 + 46,6 = 81,6.
Следовательно, в принятых в примере условиях стерилизации требуемые значения критерия достигаются без применения выдержки.
VI. ВЫДЕЛЕНИЕ ПРОДУКТОВ МИКРОБИОЛОГИЧЕСКОГО СИНТЕЗА
Культуральная жидкость представляет собой сложную смесь, содержащую микробные клетки, продукты метаболизма, остатки компонентов питательной среды, пеногаситель.
Технология получения продуктов микробного синтеза из культуральной жидкости зависит от происхождения и товарной формы биопрепарата. Различают следующие группы препаратов: на основе инактивированной биомассы клеток (кормовые препараты белков, аминокислот, антибиотиков и т. д.), на основе очищенных продуктов метаболизма микроорганизмов (ферменты, антибиотики, витамины, органические кислоты и др.), препараты в виде жизнеспособных микроорганизмов (бактериальные удобрения, средства защиты растений, закваски и др.). Товарными формами биопрепаратов являются жидкие концентраты (45–50% сухого вещества), пасты (20–40% влаги), кристаллические вещества (1,5–5,0% свободной влаги), сухие порошкообразные и гранулированные продукты (8–11% влаги). Себестоимость жидких концентратов и паст значительно ниже, чем сухих продуктов.
Целевым продуктом биосинтеза может быть непосредственно микробная масса либо продукты метаболизма микроорганизмов, растворенные в межклеточной жидкости или находящиеся внутри клеток. Иногда целевые метаболиты могут находиться одновременно и внутри клеток, и в межклеточной жидкости.
Низкая концентрация биомассы и метаболитов в культуральной жидкости обусловливает необходимость проведения ряда последовательных операций по концентрированию и очистке целевого компонента. Количество операций возрастает с повышением требований к чистоте продукта. Общая схема переработки культуральной жидкости представлена на рис. 6.1.
В большинстве производств переработка культуральной жидкости начинается с отделения микробной массы. Для этого применяют осаждение в поле центробежных сил (сепарацию, центрифугирование); фильтрование; флотацию; обработку культуральной жидкости коагулянтами (FeCl3, Al2(SO4)3), флокулянтами полисахаридной природы или синтетического происхождения (высокомолекулярными полиэлектролитами), гелеобразующими агентами (суспензия Ca(OH)2 + H3PO4) с последующим отделением осадка фильтрованием.

Рис. 6.1. Общая схема переработки культуральной жидкости: 1– производство кормовой биомассы; 2 – целевой продукт – экзометаболит; 3, 4 – целевой продукт – эндометаболит
По современным представлениям поверхность клеток микроорганизмов имеет мозаичную структуру, сформированную из катионных и анионных групп. На одну клетку приходится 106–107 положительных и 107–108 отрицательных зарядов, т. е. клетки большинства микроорганизмов имеют избыточный отрицательный заряд. Высокие значения плотности поверхностного заряда клеток приводят к их электростатическому отталкиванию, что является одной из причин агрегативной устойчивости микробных суспензий, которые можно рассматривать как биоколлоидные системы. Кроме того, клетки микроорганизмов являются типичными лиофильными объектами, для которых характерно взаимодействие с дисперсионной средой, приводящее к образованию сольватных оболочек, что также обусловливает агрегативную устойчивость биоколлоидов.
Обработка микробной суспензии коагулянтами, флокулянтами, гельобразующими агентами позволяет не только дестабилизировать биоколлоидную систему и осадить клетки, но и очистить в определенной степени содержащую целевой метаболит межклеточную жидкость от балластных примесей (белков, красящих веществ и др.).
Фильтруемость культуральной жидкости зависит от ряда факторов: вида микроорганизма-продуцента (размера и структуры клеточных образований), состава питательной среды и степени потребления компонентов, длительности ферментации. Присутствие в значительном количестве неассимилированных питательных веществ, жиров, применяемых в качестве пеногасителя, а также лизис клеток в результате продолжительного культивирования негативно влияют на скорость фильтрования.
Мицелий грибов, имеющий нити диаметром 10–40 мкм, отделяется от жидкой фазы фильтрованием без особых затруднений. Тонкие (0,2–1,0 мкм) нити мицелия актиномицетов забивают поры фильтрующего материала и образуют осадок с высоким гидравлическим сопротивлением. Поэтому культуральные жидкости после выращивания актиномицетов, как и других бактерий, подвергают специальной обработке. Наиболее распространенные приемы улучшения фильтруемости – тепловая коагуляция при 70–75°С (вызывает денатурацию и коагуляцию белков, что снижает сопротивление осадка), обработка полиэлектролитами, добавление реагентов, образующих малорастворимые осадки (Ca(OH)2 + H3PO4), предварительное нанесение на фильтрующий материал намывного слоя толщиной 5–50 мм из перлита или древесной муки.
Чаще других применяют барабанные вакуум-фильтры и фильтр-пресс ФПАКМ. Важнейшим достоинством фильтра-пресса является низкая влажность получаемого осадка (около 60%).
Широкое распространение получил сепарационный метод концентрирования микробных (прежде всего дрожжевых) суспензий, который позволяет с высокой скоростью обрабатывать большие объемы труднофильтруемой культуральной жидкости.
Заслуживает внимания флотационный способ сгущения дрожжевой суспензии, при котором концентрирование дрожжей достигается за счет перехода клеток в пену в результате продувки суспензии мелкодиспергированным воздухом. Флотационный способ концентрирования дрожжей имеет ряд преимуществ перед сепарационным: простота и доступность оборудования, низкие энергозатраты на процесс, повышение качества продукта благодаря отделению нефлотирующихся примесей. Однако не все дрожжевые культуры обладают достаточной флотационной способностью, которая зависит от физиологических особенностей штамма и химического состава культуральной жидкости. В связи с этим флотация находит ограниченное применение, например, для концентрирования дрожжей Candida scottii (продуцентов белка), выращенных на гидролизном сусле.
При производстве биопрепаратов на основе инактивированной биомассы клеток широко используют упаривание культуральной жидкости в трех-, четырехкорпусных выпарных установках до содержания сухих веществ в концентрате 20–45%. Целевые продукты микробного синтеза термолабильны, поэтому упаривание осуществляют под разрежением и при режимах, обеспечивающих минимальные потери биологической активности продуктов. Как правило, температура кипения жидкости в первом корпусе выпарной установки составляет 80–85°С, в последнем – 50–55°С. Наибольшее распространение получили трехкорпусные выпарные установки со стекающей пленкой, которые отличаются компактностью, высокой производительностью по испаряемой влаге и небольшим временем пребывания упариваемой жидкости в аппарате.
При необходимости сгущения концентрата до высокого содержания сухих веществ (60–65%) применяют роторные испарители.
Целевыми продуктами микробного синтеза могут быть внутриклеточные биополимеры (нуклеиновые кислоты, белки, липиды), а также эндометаболиты (антибиотики, витамины, ферменты). Некоторые компоненты можно извлечь без предварительного разрушения клеточной стенки (например, экстракцией), в других случаях (для выделения внутриклеточных биополимеров) требуется дезинтеграция клеточной массы, которую осуществляют различными методами. При химической дезинтеграции клеточную суспензию обрабатывают агентами (щелочью, глицерином, толуолом, пероксидом водорода), которые повышают проницаемость клеточных стенок. Биологические способы разрушения оболочки основаны на действии собственных гидролитических ферментов (автолиз) или специальных ферментных препаратов (лизоцим, зимолиаза и др.). Наибольшее промышленное значение имеют физические методы, которые более экономичны, чем химические и ферментативные. Чаще всего применяют обработку клеточной массы ультразвуком. Могут быть использованы такие приемы, как растирание с кварцевым песком, замораживание – оттаивание, продавливание массы через узкие отверстия под высоким давлением, декомпрессия (сжатие клеточной суспензии с последующим резким снижением давления). Фрагменты клеточных стенок отделяют центрифугированием или фильтрованием.
Выделение целевых компонентов из сложной смеси дезинтегратов клеток – трудоемкий и дорогостоящий процесс, который целесообразен в производстве только очень ценных биологически активных веществ. В биотехнологии предпочтение отдают использованию штаммов микроорганизмов, экскретирующих целевой компонент. В этом случае технология получения чистых препаратов существенно упрощается.
Распространенными промышленными методами выделения экзометаболитов из культуральной жидкости являются ионный обмен с использованием сухих и жидких ионообменных смол – катионитов и анионитов (производство аминокислот), экстракция органическими растворителями (производство антибиотиков), осаждение из растворов солями и органическими растворителями (ферментные препараты), кристаллизация (витамины, антибиотики, аминокислоты). Выделить целевой продукт с высокой степенью чистоты одним способом практически невозможно. В производственных условиях применяют комбинации различных методов.
В последнее десятилетие сформировалось новое и исключительно перспективное для биотехнологии направление – мембранные методы разделения сложных смесей, главная отличительная особенность которых – наличие полупроницаемой мембраны, обладающей избирательной проницаемостью по отношению к компонентам разделяемой смеси. Мембранные технологии обладают явными преимуществами перед традиционными методами разделения:
- осуществление процесса при температуре окружающей среды без фазовых превращений и подвода тепла, что позволяет уменьшить потери термолабильных биологически активных веществ;
- малая энергоемкость;
- возможность одновременной очистки от низкомолекулярных примесей и концентрирования продуктов;
- исключение применения химических реагентов, что снижает стоимость процессов и уменьшает загрязнение сточных вод;
- универсальность – использование одной и той же установки для получения различных препаратов.
Для промышленного разделения сложных систем наиболее перспективны ультрафильтрация и обратный осмос.
Движущей силой этих процессов является градиент давлений: ультрафильтрацию осуществляют при избыточном давлении 0,2–0,3 МПа, в установках обратного осмоса давление достигает 0,4– 0,6 МПа. Четкой границы, разделяющей процессы ультрафильтрации и обратного осмоса, нет. Считают, что обратноосмотические мембраны способны задерживать частицы размером 5 · 10–4 мкм, т. е. гидратированные неорганические ионы. Ультрафильтрационные мембраны обеспечивают селективное концентрирование частиц размером более 5 · 10–3 мкм, т. е. органических молекул и ионов. Это обстоятельство и обусловило преимущественное применение ультрафильтрации в промышленной микробиологической практике.
Ультрафильтрационные мембраны изготавливают из различных материалов (поливинилиденфторид, полиамид, полиакрилонитрил, фторопласт и др.).
Существенный недостаток мембран – невысокая водопроницаемость, что в значительной степени связано с явлением «концентрационной поляризации» мембран, сущность которого заключается в формировании примембранного слоя молекул и ионов, тормозящего транспорт через мембрану низкомолекулярных соединений. На практике пропускная способность мембран составляет обычно 20–100 дм3/(м2 · ч).
Этот недостаток можно компенсировать только большой удельной поверхностью мембран в промышленных установках.
Негативный эффект явления «концентрационной поляризации» мембран минимизируют созданием непрерывного турбулизованного протока жидкости над мембраной в замкнутом циркуляционном контуре (рис. 6.2).
Принципиальное отличие ультрафильтрации от обычного фильтрования – отсутствие гетерогенности. Исходная смесь, а также продукт, прошедший через мембрану (пермеат), и продукт, оставшийся над мембраной (концентрат), находятся в жидкой фазе и различаются лишь составом, т. е. соотношением количеств компонентов. Образование осадка на поверхности мембраны недопустимо, так как это резко ухудшает условия ее работы.
Рис. 6.2. Принципиальная схема ультрафильтрационной установки для концентрирования ферментных препаратов: А, Б, В – ступени концентрирования; 1 – насос; 2 – сборник КЖ; 3 – циркуляционный насос; 4 – вентиль; 5 – расходомер; 6 – пять последовательно установленных ультрафильтрационных модулей (I, II, III, IV, V); 7 – холодильник; 8 – регулирующий вентиль
В условиях промышленной эксплуатации ультрафильтрационные установки регулярно промывают водой или раствором химических агентов (гипохлорита натрия, органических кислот).
По способу укладки мембран различают установки с плоскими, трубчатыми, спиральными мембранными элементами, а также с мембранами в виде полых волокон. Установки с полыми волокнами имеют очень большую удельную поверхность фильтрования (до 20 000 м2/м3) и, следовательно, высокую производительность. Ультрафильтрационный метод незаменим при концентрировании растворов ферментов, которые весьма чувствительны к воздействию повышенных температур.
В тонких малотоннажных биотехнологических производствах высокоактивных и дорогостоящих соединений применяют такие современные методы разделения веществ, как гель-хроматография, аффинная и препаративная жидкостная хроматография, хроматография на «молекулярных ситах».
В технологии получения биопрепаратов на основе жизнеспособных микроорганизмов наиболее ответственной операцией является обезвоживание биомассы, в результате которого клетки резко замедляют жизнедеятельность на длительное время, но сохраняют жизнеспособность. Для обезвоживания живых микроорганизмов (а также концентрата высокоактивных термолабильных метаболитов) наиболее пригодна сублимационная сушка, т. е. высушивание материала из замороженного состояния при температуре не выше 28°С без оттаивания при глубоком разрежении (влага переходит из твердого состояния в газообразное, минуя стадию жидкой фазы). Сублимационной сушке подвергают концентрат суспензии микроорганизмов, в который предварительно вводят криозащитные вещества, например, глицерин, мелассу, раствор глюкозы. Криопротекторы предотвращают механическое повреждение клеточных структур кристаллами льда и концентрирование внутриклеточных электролитов, вызывающих денатурацию белка. На выживаемость клеток большое влияние оказывают скорость замораживания и остаточная влажность препарата, которые уточняют для данного объекта экспериментальным путем.
Сублимационная сушка – энергоемкий и дорогостоящий процесс, но в производстве ряда биопрепаратов (прежде всего для медицинских целей) она незаменима.
В крупнотоннажных производствах сушку концентрированных суспензий микроорганизмов производят в высокопроизводительных распылительных сушилках при прямом контакте диспергированной до капелек суспензии с горячим воздухом или топочными газами от сжигания природного газа. Температура сушильного агента на входе в сушилку колеблется в пределах 120–350°С в зависимости от термоустойчивости продукта. Короткое время сушки (5–25 с) и низкая температура высушиваемого продукта (не более 45°С) позволяют избежать существенных потерь биологически активных веществ и использовать метод для сушки термолабильных продуктов, в том числе ферментных препаратов.
VII. ПРОИЗВОДСТВО БЕЛКА ОДНОКЛЕТОЧНЫХ
Мировой дефицит белка оценивается в 15–30 млн т в год. Белковый дефицит может быть устранен интенсификацией сельскохозяйственного производства, использованием ресурсов Мирового океана, органическим или микробиологическим синтезом белков.
Микробиологический синтез белка имеет ряд преимуществ: высокую скорость роста микробных клеток по сравнению с растительными и животными, «мягкие» условия процесса биосинтеза (температура 30–45°С, рН 4–6, атмосферное давление), возможность применения дешевого сырья в виде отходов производств, независимость накопления биомассы от климатических условий.
В развитых западных странах в кормопроизводстве широко используется белок сои. Мировой уровень производства соевых бобов составляет более 120 млн т в год. Большая часть территории бывшего СССР малопригодна для эффективного возделывания этой культуры, что и предопределило быстрое развитие крупнотоннажной отрасли по получению микробного белка. Крупнейшие в мире заводы, производящие сухую микробную биомассу, были построены в Республике Беларусь. Повышение цен на энергоносители до уровня мировых привело к резкому снижению рентабельности и сокращению производства микробного белка.
Потребность в кормовом белке для животноводства и птицеводства по Республике Беларусь на 2010 г. оценивается в 120 тыс. т при фактическом уровне производства около 6 тыс. т в год.
Из-за высоких энергетических затрат на производство сухой биомассы микробный белок не может конкурировать с более дешевым белком сои. Однако все развитые страны располагают отработанными на промышленных установках технологическими процессами производства микробного белка с использованием различных видов сырья.
Качество белоксодержащего продукта оценивается прежде всего по содержанию истинного белка и по его аминокислотному составу. Микробная биомасса содержит 42–50% истинного белка от сухой массы и превосходит по этому показателю соевую муку (35–37%), не уступая по содержанию незаменимых аминокислот. Повышает кормовую ценность микробной биомассы высокое содержание витаминов группы В.
Питательная среда для культивирования продуцентов белка одноклеточных должна содержать источник углерода (субстрат), азот, фосфор, калий в доступной для микробных клеток форме и микроэлементы (Fe, Mg, Mn, Zn и др.). В промышленных условиях применяют разнообразные субстраты: углеводы различного происхождения (в составе гидролизатов растительного сырья, сульфитных щелоков, свеклосахарной мелассы), углеводороды (фракция н-парафинов С11–С18), спирты (этанол, метанол), метан (в составе природного газа), а также жидкие отходы пищевой промышленности (молочную сыворотку, послеспиртовую барду, картофельный сок и др.).
Технология производства белка одноклеточных мало зависит от вида используемого субстрата. Существенные различия имеют место только на стадии культивирования продуцентов белка, аппаратурное оформление которой и технологический режим процесса определяются видом применяемого источника углерода.
Типовая технологическая схема производства сухой микробной массы включает следующие операции: приготовление питательной среды, получение посевного материала, производственную ферментацию, сгущение микробной суспензии в центробежных машинах, термообработку суспензии для получения легкоусваиваемого плазмолизата, концентрирование биомассы упариванием под разряжением, сушку концентрата с получением порошкообразного или гранулированного продукта, фасовку и упаковку товарного продукта.
В качестве продуцентов кормового белка широко используют дрожжи (точнее дрожжеподобные грибы), реже применяют бактерии и очень редко – мицелиальные грибы. Предпочтение отдают дрожжевым культурам, как наиболее изученным и не требующим, в отличие от бактерий, асептических условий культивирования. Массовое развитие посторонних микроорганизмов (бактерий) при нестерильном выращивании дрожжей ограничивается пониженным значением величины рН ферментационной среды (4,2–4,5), которое не оказывает негативного влияния на скорость накопления биомассы продуцентом белка. В то же время кислая среда не препятствует размножению «диких» дрожжей. Состояние популяции считают удовлетворительным, если доля основной культуры дрожжей составляет не менее 80%.
Бактериальные культуры отличаются высоким выходом белка от ассимилированного субстрата, но необходимость асептических условий культивирования резко повышает энергетические и капитальные затраты, а малые размеры бактериальных клеток осложняют реализацию технологической операции по сгущению микробной суспензии.
Использование мицелиальных грибов в крупнотоннажном производстве белка ограничивается их низкой удельной скоростью роста (0,12–0,15 ч–1).
Важнейшими характеристиками культур – продуцентов белка – являются выход биомассы от ассимилированного субстрата (экономический коэффициент), удельная скорость роста популяции, содержание белка в биомассе и продуктивность культуры по абсолютно сухой биомассе (АСБ), г АСБ/(дм3 · ч).
Для промышленных продуцентов белка выход биомассы на различных субстратах колеблется в пределах 33–100% и определяется главным образом физиологическими особенностями штамма, долей углерода в молекуле субстрата и доброкачественностью питательной среды. Чем больше доля углерода в молекуле субстрата, тем выше ожидаемый выход биомассы.
В производственных условиях накопление биомассы продуцентов белка осуществляют непрерывным культивированием в режиме хемостата, когда скорость роста и плотность популяции ограничена концентрацией лимитирующего субстрата, поступление которого в ферментатор регулируется изменением скорости протока среды.
Продуценты белка нуждаются в растворенном в ферментационной среде кислороде, потребность в котором высокая и сильно зависит от природы субстрата. Чем больше восстановлена молекула субстрата, тем выше потребность в кислороде на ее окисление. Например, потребность в кислороде на синтез 1 кг абсолютно сухой биомассы при культивировании продуцентов белка на глюкозе составляет в среднем 0,9 кг, на н-парафинах – 2,2 кг, на метане – 5 кг.
Скорость растворения кислорода в жидкой фазе определяется конструкцией системы воздухораспределения ферментатора. Для каждого конкретного типа ферментатора существует предельное значение скорости растворения кислорода, которому соответствует критическая концентрация биомассы продуцента. Концентрация биомассы в ферментаторе не может быть выше критической из-за недостатка кислорода. Исходя из величины критической концентрации, определяют паспортную производительность ферментатора по биомассе. Рабочая концентрация микробной массы в ферментаторе должна быть близка к критической. Из уравнений материального баланса ферментации можно рассчитать предельную концентрацию субстрата Сн, %, в приточной среде
Сн ≤ xкр / (40 × 0, 01 y + Ск)
где xкр – критическая концентрация биомассы, кг/м3; y – экономический коэффициент, %; Cк – остаточная концентрация субстрата в микробной суспензии, %.
В прямой пропорциональной зависимости от потребности в кислороде находится еще одна важная характеристика ферментационного процесса – удельное тепловыделение. Количество биологического тепла, выделяющегося в процессе синтеза 1 кг АСБ при культивировании продуцентов белка на глюкозе, составляет в среднем 13 МДж, на н-парафинах – 28 МДж, на метане – 60 МДж.
Тепловыделения настолько велики, что в летнее время года существует проблема отвода биологического тепла в ферментаторах охлаждающей водой для поддержания оптимальной температуры процесса. В связи с этим значимой характеристикой производственного штамма продуцента белка является высокая оптимальная температура культивирования.
Представленные факторы – важнейшие из числа определяющих эффективность ферментационного процесса при биосинтезе микробной массы. Рассмотрим характерные особенности производства кормового белка на различных видах сырья.
Наибольшим потенциалом в производстве микробного белка обладают растительные целлюлозосодержащие материалы. Растительное сырье ежегодно возобновляется и при рациональном природопользовании практически неисчерпаемо, что и определяет перспективность использования его в микробиологическом синтезе. На практике отработаны технологические процессы производства микробного белка с использованием в качестве сырья древесных отходов в виде щепы и опилок, подсолнечной лузги, стержней кукурузных початков, торфа, хлопковой шелухи. В принципе в производство могут быть вовлечены любые растительные материалы, например, льняная костра, солома, камыш, тростник и др. Широкое использование растительного сырья в биотехнологии ограничивается необходимостью предварительного гидролиза целлюлозосодержащих материалов в присутствии катализаторов (минеральных кислот, ферментов) и большими затратами (прежде всего энергетическими) на этот процесс.
Основными компонентами растительного сырья являются целлюлоза, гемицеллюлозы и лигнин. Промышленная ценность сырья (табл. 7.1) определяется содержанием углеводного комплекса (целлюлоза + гемицеллюлозы), в котором основная доля принадлежит целлюлозе.
Таблица 7.1. Содержание основных компонентов в растительном сырье, %
|
Компоненты
|
Древесина
|
Сельскохозяйственные отходы
|
|||
|
Сосна
|
Береза
|
Стержни
кукурузных
початков
|
Пшенич-ная
солома
|
Подсол-нечная
лузга
|
|
|
Полисахариды:
- легкогидролизуемые (гемицеллюлозы)
- трудногидролизуемые (целлюлоза)
|
17,8
47,7
|
26,5
39,4
|
37,9
33,4
|
23,4
39,0
|
21,9
28,7
|
|
Лигнин
|
24,7
|
19,7
|
15,2
|
24,5
|
28,2
|
|
Минеральные вещества
|
0,2
|
0,1
|
1,1
|
5,9
|
2,2
|
|
Теоретический
выход моносахаридов
|
72,5
|
73,2
|
79,3
|
64,6
|
52,8
|
Степень полимеризации целлюлозы древесины составляет 3000–8000. Макромолекулы целлюлозы за счет межмолекулярных водородных связей образуют обособленные структуры (микрофибриллы) диаметром 3·10–9 м. Причем плотность упаковки макромолекул в продольном направлении неодинакова. Плотно упакованные участки (160–200 элементарных звеньев) чередуются с участками с рыхлой структурой (15–25 элементарных звеньев). Каждая макромолекула целлюлозы проходит через 10–20 плотных и рыхлых участков микрофибриллы. Содержание рыхлой фракции в древесной целлюлозе составляет 10–15%. Надмолекулярная структура целлюлозы определяет ее реакционную способность.
Участки с рыхлой упаковкой макромолекул целлюлозы гидролизуются легко (катализатор имеет доступ к макромолекулам), гидролиз плотно упакованных участков протекает медленно, в гетерогенных условиях (катализатор действует на поверхности микрофибриллы, доступ внутрь ограничен).
Гемицеллюлозы, в отличие от целлюлозы, имеют нерегулярное строение, хотя большинство компонентов гемицеллюлоз можно отнести к полисахаридам со скрытой регулярностью строения. Основными полисахаридами гемицеллюлозной части лиственной древесины являются 4-о-метилглюкуроноксилан и глюкоманнан. Гемицеллюлозы хвойной древесины представлены главным образом галакто-глюкоманнаном и арабиногалактаном. Макромолекулы гемицеллюлоз построены из остатков различных моносахаридов. Степень полимеризации гемицеллюлоз преимущественно 100–250 (70–600).
Макромолекулы имеют боковые цепи. В основных цепях преобладают 1–4 β-гликозидные связи, в точках разветвления 1–2 β- (реже 1–3 β- и 1–6 β-) гликозидные связи.
Гидролиз гемицеллюлоз протекает быстро, в гомогенных условиях. Лигнин – инкрустирующий биополимер с дальним порядком регулярности строения. Макромолекула лигнина построена из фенилпропановых структур:

Содержание лигнина в одревесневшей растительной ткани составляет 18–30% (содержится в первичной оболочке клеток и межклеточном веществе). Лигнин выполняет в основном механические функции (инкрустирующий полимер), придавая жесткость растительной ткани, прочность и биологическую стойкость древесине. В макромолекулах лигнина фенилпропановые структурные звенья связаны между собой разнообразными химическими связями (главным обра- зом простыми эфирными и углерод-углеродными связями). Большинство авторов считают, что нет строгого порядка в чередовании типов этих связей (известна модель фрагмента лигнина по Фрайденбергу). Для лигнина характерна гетерогенность (неоднородность) структуры, которая проявляется в наличии низкомолекулярной (в небольшом количестве) и высокомолекулярной фракций.
Макромолекулы лигнина связаны между собой поперечными связями в различных направлениях, образуя трехмерную пространственную сетку. Имеются химические связи между лигнином и гемицеллюлозными полисахаридами растительной ткани (образуется суперсетчатая структура).
При гидролизе растительного сырья лигнин образует негидролизуемый остаток и затрудняет доступ катализатора к полисахаридам.
В производственной практике апробированы различные методы гидролиза растительных материалов:
- гидролиз разбавленным раствором серной кислоты (0,5–0,6%);
- гидролиз концентрированной серной кислотой (≥ 75%);
- ферментативный гидролиз;
- автогидролиз.
Механизм гидролиза состоит в том, что ион гидроксония (H3O+), образующийся в результате диссоциации серной кислоты в воде, протонирует гликозидный кислород в макромолекуле полисахарида, что приводит к активации и разрыву гликозидной связи. По месту разрыва связи присоединяется молекула воды.
Наиболее отработан в промышленных масштабах гидролиз разбавленной серной кислотой при температуре 180–190°С. Процесс проводят в периодически действующих гидролизаппаратах объемом 50–80 м3 в режиме перколяции (протока) варочного раствора (0,5–0,6% H2SO4) через слой гидролизуемого материала (смесь щепы и опилок). Длительное промышленное использование метода и разработанные приемы совершенствования перколяционного процесса не устранили его главных недостатков: больших затрат энергии (пара) на поддержание температуры процесса (180–190°С); низкой биологической доброкачественности гидролизата, содержащего продукты распада моносахаридов (фурфурол, гидрокси-метилфурфурол), ингибирующие рост дрожжей – продуцентов белка; невысокого выхода моносахаридов (46–48% от абсолютно сухой древесины).
Гидролиз концентрированной серной кислотой проводят при температуре 50°С. При этом целлюлоза переходит в растворенное состояние и легко гидролизуется. Благодаря низкой температуре реакционной среды распад образующихся моносахаридов минимальный, биологическая доброкачественность получаемого гидролизата высокая. Однако этот метод гидролиза отягощен рядом технологических недостатков: большой расход кислоты на единицу массы сырья; сложность равномерного распределения концентрированной кислоты в большом объеме гидролизуемого материала; необходимость подсушивания сырья для удаления влаги, разбавляющей кислоту; реверсия части моносахаридов в присутствии концентрированной кислоты (водоотнимающий агент) с образованием олигосахаридов, которые дрожжами-продуцентами белка не ассимилируются.
Автогидролиз отличается тем, что катализатором процесса является уксусная кислота, образующаяся в результате отщепления ацетильных групп гемицеллюлоз в присутствии воды в условиях высокотемпературоной обработки (200–230°С). Промышленного значения этот процесс пока не имеет.
В настоящее время наиболее перспективен в переработке растительного сырья ферментативный гидролиз, осуществляемый с использованием ферментных препаратов, обладающих целлюлазной активностью. Ферментативный гидролиз протекает при низкой температуре (40–50°С), что, помимо энергосбережения, практически исключает распад образующихся моносахаридов и накопление в гидролизате токсичных для продуцентов белка соединений.
Однако при разработке технологического процесса выявлены недостатки метода, которые до настоящего времени не удается устранить: низкая скорость гидролиза целлюлозы, связанная с ее надмолекулярной структурой и блокированием углеводного комплекса лигнином (продолжительность процесса ферментативного гидролиза около 50 часов); ингибирование ферментов конечными продуктами гидролиза; большой расход ферментного препарата при его высокой стоимости.
Таким образом, единственным методом гидролиза растительного сырья, реализованным в промышленных масштабах, остается высокотемпературный (180–190°С) гидролиз разбавленной серной кислотой.
Основной углеродсодержащий субстрат в гидролизатах – углеводы, представленные пентозными (ксилоза и арабиноза) и гексозными (глюкоза, манноза и галактоза) моносахаридами, объединяемыми под общим названием редуцирующие вещества (РВ), а также органические кислоты (главным образом уксусная и левулиновая). Содержание РВ в гидролизате − 3,0–3,5%.
Перед биохимической переработкой гидролизаты подвергают кондиционированию: нейтрализация известковым молоком до рН 4,2– 4,4, удаление токсичных соединений продувкой воздухом, охлаждение до температуры ферментации, обогащение гидролизного сусла биогенными элементами (азот, фосфор, калий).
Промышленные продуценты белка на гидролизатах – дрожжеподобные грибы Candida scottii, Hansenula anomala, Trichosporon cutaneum. Наиболее продуктивна культура C. scottii: выход сухой биомассы составляет 48–50% от РВ, удельная скорость роста лежит в пределах 0,25–0,28 ч-1, размножается почкованием, очень хорошо флотируется. Оптимальная температура роста – 38–39°С.
Дрожжи ассимилируют прежде всего моносахариды и уксусную кислоту, которые по предпочтительности для дрожжевых клеток располагаются в следующем ряду:
глюкоза > уксусная кислота > манноза > ксилоза > галактоза > арабиноза.
Выращивание дрожжеподобных грибов осуществляют в ферментаторах эрлифтного типа объемом 600 или 1300 м3 с децентрализованной системой распределения воздуха.
Жидкие н-парафины. Под этим термином понимают фракцию углеводородов нормального строения (СnН2n + 2) с числом атомов углерода от 9 до 24, выкипающую в температурных пределах 200–340°С. Промышленные продуценты белка с высокой скоростью ассимилируют углеводороды С11–С18 и практически не ассимилируют «тяжелые» н-парафины С20–С24, парафины разветвленного строения, ароматические углеводороды.
В качестве продуцентов белка на средах с н-парафинами используют дрожжеподобные грибы рода Candida (C. guilliermondii, C. parapsilosis, C. salmonicola, C. maltosa), которые отличаются высоким выходом биомассы (96–98%) от ассимилированного субстрата. Оптимальная температура культивирования продуцентов – 30–32°С.
Жидкие н-парафины практически нерастворимы в воде, что исключает применение малоэнергоемких ферментаторов эрлифтного типа. Чтобы обеспечить высокую скорость ассимиляции н-парафинов, их эмульгируют в воде мешалкой турбинного типа до капель размером не более 3 мкм. Промышленный ферментатор АДР-900-76 объемом 900 м3 оснащен 13-ю турбинными мешалками, мощность привода каждой из них – 315 кВт. По сравнению с углеводными средами накопление дрожжевой биомассы на жидких н-парафинах отличается значительными энергетическими затратами на диспергирование субстрата, более высокой потребностью в кислороде для окисления углеводородов и большими тепловыделениями.
Сухой белоксодержащий продукт, полученный на жидких н-парафинах, получил торговое название паприн. Характерная особенность паприна состоит в том, что он содержит до 2% «тяжелых» углеводородов (С20–С24), проникших внутрь клеток, но не ассимилированных дрожжами. Присутствие углеводородов снижает качество паприна как кормовой добавки.
Природный газ. Основу природного газа составляет метан (92–98%). Природный газ имеет невысокую стоимость, легко транспортируется, не содержит примесей, ингибирующих рост продуцентов белка, которые способны накапливать биомассу с выходом до 86% от субстрата.
В промышленном производстве биопротеина на природном газе наибольшую значимость как продуцент белка имеет облигатный метилотроф Methylococcus capsulatus, который, в отличие от других бактериальных культур, с высокой скоростью накапливает биомассу при повышенной температуре (42°С) и пониженной величине рН среды (5,5–5,7). Специфика субстрата и условий культивирования продуцента белка позволяет осуществлять ферментационный процесс в нестерильных условиях. Переработка газообразного субстрата с очень низкой растворимостью в воде (0,02 г/дм3) обусловила применение ферментаторов специальной конструкции, предусматривающей размещение в одном аппарате различных систем диспергирования газовой и жидкой фаз: барботаж газов (метан и технический кислород) в жидкости через диспергирующие контактные тарелки; эжекция газов в жидкость под давлением, создаваемым циркуляционными насосами; эжекция газов в жидкость по принципу «падающей струи». Производительность ферментатора типа ФКЭР (ферментатор колонный эжекционный с рециркуляцией газовой и жидкой фаз) объемом 750 м3 достигает 120 т/сут по товарному продукту.
Серьезный недостаток метана – образование взрывоопасных смесей с воздухом (или техническим кислородом). Предел взрываемости смеси метана с техническим кислородом широкий и составляет 6–60% об. Снижает взрывоопасность ферментационного процесса присутствие в газовой фазе метаболита – диоксида углерода, содержание которого достигает 30% об. и более. В производственных условиях безопасность ферментации обеспечивается автоматическим регулированием содержания кислорода в отработанном газе (на выходе из ферментатора) на уровне не более 9% об.
Сухая бактериальная биомасса (торговое название гаприн) имеет высокое содержание истинного белка (50–55%). Из-за сильного аллергического действия гаприн производят не в порошкообразном, а только в гранулированном виде.
Метанол. Производство белка одноклеточных на спиртах (метаноле, этаноле) очень перспективно. К преимуществам этих субстратов относятся высокая чистота, отсутствие канцерогенных примесей, хорошая растворимость в воде, высокая летучесть, исключающая накопление субстрата в готовом продукте. Присутствие в молекулах спиртов атома кислорода уменьшает потребность в нем и, соответственно, тепловыделения при ферментации (по сравнению с н-парафинами и метаном), что в целом снижает затраты на производство продукта. Однако необходимо учитывать высокую токсичность метанола для обслуживающего персонала, существующую вероятность образования взрывоопасных смесей паров метанола с воздухом, а также возможные потери спирта при ферментации из-за его высокой летучести.
В качестве продуцентов белка на средах с метанолом могут быть использованы как дрожжи, так и бактерии. Из дрожжевых культур рекомендованы Candida boidinii, Hansenula polimorpha, которые в оптимальных условиях развития (температура 34–36°С, рН 4,2–4,5) накапливают биомассу с выходом 30–33% от ассимилированного субстрата при скорости протока 0,12–0,16 ч-1. Дрожжи не требуют асептических условий культивирования (в этом их преимущество), но сильно уступают бактериальным штаммам по скорости роста и выходу биомассы.
Бактериальные культуры Pseudomonas methylotropha, Pseudomonas clara развиваются при температуре 32–34°С, рН 6,0–6,4 и ассимилируют метанол с выходом биомассы 70% при скорости протока 0,2–0,3 ч-1. Большие затраты на поддержание асептики при культивировании бактерий нивелируют их явные преимущества перед дрожжами.
Хорошая растворимость метанола в воде обусловливает возможность применения ферментаторов эрлифтного типа. При концентрации в среде выше 15 г/дм3 метанол вызывает гибель клеток.
Этанол. Как субстрат имеет те же достоинства и недостатки, что и метанол. Отличается меньшей токсичностью и легкостью ассимиляции, широким кругом микроорганизмов. Последнее обстоятельство серьезно затрудняет культивирование дрожжевых продуцентов белка в нестерильных условиях из-за развития посторонних микроорганизмов («диких» культур дрожжей). Для промышленного производства микробной биомассы на этаноле рекомендуется использовать дрожжи Candida utilis или Hansenula anomala, выращивать их с соблюдением условий асептики в ферментаторах с высокими массообменными характеристиками при аэрации техническим кислородом или обогащенным кислородом воздухом. Выход сухой дрожжевой массы от ассимилированного этанола (экономический коэффициент) составляет около 70%. При концентрации в среде более 30 г/дм3 проявляется стерилизующее действие этанола. Зарубежные специалисты считают, что этанол наиболее пригоден как субстрат для культивирования дрожжей с целью получения белковых концентратов или изолятов пищевого назначения.
Биоконверсия целлюлозолигниновых (ЦЛ) материалов. Теоретически представляет интерес производство белоксодержащих кормовых препаратов на целлюлозо-лигниновых материалах прямым твердофазным культивированием микроорганизмов, обладающих целлюлолитической и лигнолитической активностью. Однако при синтезе белка на нерастворимых ЦЛ-субстратах возникает ряд проблем. В природе практически не существуют микроорганизмы, способные осуществить этот процесс с высокой скоростью и экономичностью. Наиболее перспективными продуцентами белка на ЦЛ-материалах являются мицелиальные грибы (Trichoderma viride, Trichoderma lignorum, Chaetomium cellulolyticum). При глубинном культивировании грибов на пшеничной соломе, подвергнутой термощелочной обработке, количество белка составляет 15– 19% от сухого вещества через 60–72 ч ферментации. Эффективность конверсии полисахаридов в белок возрастает при использовании ассоциаций культур. Например, при культивировании ассоциации Trichoderma viride + Endomycopsis fibuligera методом твердофазной ферментации на термообработанной соломе содержание белка достигает 12%.
Резистентность природных ЦЛ-материалов к действию различных гидролизующих агентов определяется двумя факторами: кристалличностью природной целлюлозы и защитной матрицей, образованной лигнином, в которую погружены целлюлозные фибриллы.
По данным исследователей, целлюлолитические микроорганизмы способны утилизировать ЦЛ-субстраты, если содержание лигнина в них не превышает 18–20%. То же относится и к действию анаэробных бактерий в желудке жвачных животных, которые утилизируют целлюлозу только при низком содержании лигнина в корме. Увеличение доступности субстрата может быть достигнуто механическим помолом и делигнификацией субстрата. Биодеградация лигнина протекает медленно и существенно отличается от деградации других биополимеров. Этот процесс еще недостаточно изучен.
Послеспиртовая барда. Производство этанола из углеводсодержащего сырья сопровождается образованием крупнотоннажного отхода – послеспиртовой барды, количество которой во много раз превосходит выход продукта и достигает 135–150 м3 на 1000 дал (декалитров абсолютного (безводного)) этанола. Основным сырьем для производства высококачественного этанола является зерно злаков (пшеница, рожь, тритикале). При масштабах производства этанола в Республике Беларусь 11,4 млн дал в год общий объем послеспиртовой барды составляет 1,5 млн м3.
В настоящее время на предприятиях отрасли барда является обременительным отходом, создающим угрозу экологической обстановке вокруг предприятия.
Зерновая послеспиртовая барда содержит 6–8% сухих веществ, которые включают 26–28% сырого протеина, 13–14% клетчатки, 6,0–7,5% жира, 40–50% безазотистых экстрактивных веществ, 7,6–7,8% минеральных веществ. Около 50% сухих веществ находятся в барде в растворенном состоянии, а остальная часть – в виде взвешенных веществ (дробина). В барде присутствуют мертвые клетки дрожжей-продуцентов этанола (источник протеина), органические кислоты, аминокислоты, витамины, микро- и макроэлементы. Наличие протеина и биологически активных веществ придает барде самостоятельную кормовую ценность, в связи с чем основным методом утилизации послеспиртовой барды в отечественной практике является реализация натуральной барды в качестве кормовой добавки. Однако барда не подлежит длительному хранению (развиваются гнилостные процессы), имеет место сезонность спроса на барду, существенны затраты на доставку ее потребителю. Кроме того, перевариваемость сырого протеина барды низкая и составляет около 52%. Этот показатель может быть увеличен до 85–89% обогащением барды белком в результате аэробного культивирования на барде микроорганизмов. При этом резко возрастает кормовая ценность барды, появляется возможность получения полноценной кормовой белково-витаминной добавки. Такой метод микробиологической переработки барды применяется на ряде спиртовых заводов Российской Федерации, а также на Бобруйском заводе биотехнологий.
Несмотря на то что накоплен достаточно большой мировой опыт переработки барды, главным препятствием для реализации имеющихся технологий являются большие энергетические затраты на производство сухих продуктов из-за высокой влажности барды.
В качестве продуцентов белка на зерновой послеспиртовой барде используют дрожжеподобные грибы родов Candida, Crypticoccus, Rhodotorula, Trichosporon. Наиболее пригоден штамм Trichosporon cutaneum BKR Y-495, который характеризуется способностью к гидролитическому расщеплению углеводных компонентов зерновой барды и высокой степенью ассимиляции углеводов и органических кислот. Этот штамм устойчив при непрерывном культивировании без соблюдения условий асептики (рН 4,0–4,5), продуктивность его по биомассе достигает 2,2 г/(дм3·ч).
Посевной материал Trichosporon cutaneum накапливают в лабораторном ферментаторе и в дрожжерастильных аппаратах отделения чистой культуры (инокулятор, дрожжанка) с применением разбавленной в два раза водой и обогащенной питательными солями зерновой барды при температуре 33–35°С.
Технология производства кормовой белково-витаминной добавки на зерновой послеспиртовой барде предусматривает выращивание продуцентов белка на натуральной барде (рис. 7.1) или после предварительного отделения дробины (частиц оболочек зерна).
Горячая зерновая барда поступает из брагоректификационного отделения с температурой 95–98°С в приемник-стерилизатор 1, в котором выдерживается в течение 30–40 мин для более полного уничтожения микробиоты. Приемник оборудован перемешивающим устройством, предотвращающим осаждение мертвых дрожжей-продуцентов этанола и взвешенных веществ барды.
После выдержки горячая зерновая барда охлаждается в кожухотрубчатом теплообменнике 3 до температуры 60–65°С и поступает в сборник-смеситель 4, в котором смешивается с раствором питательных солей. Для обеспечения роста продуцента белка зерновая барда обогащается азотом (1,5 г/дм3 NH4H2PO4) и калием (0,3 г/дм3 KCl).
В сборнике-смесителе барда при необходимости разбавляется водой. Разбавление зерновой барды повышает удельную скорость роста культуры, уменьшает пенообразование, однако одновременно увеличивает объем жидкостного потока подлежащей концентрированию дрожжевой суспензии.
Доохлаждение питательной среды до температуры ферментации (33–35°С) производится в кожухотрубчатом теплообменнике 3.
Дрожжи выращивают в ферментаторе эрлифтного типа 8 с децентрализованной системой воздухораспределения. Расход воздуха составляет 50–60 м3/(м3·ч). В процессе культивирования дрожжей на зерновой барде рН среды повышается за счет потребления органических кислот. Требуемую величину рН (4,0–4,4) поддерживают подачей серной кислоты в трубчатый смеситель 7.
Продуктивность культуры Trichosporon cutaneum BKR Y-495 по биомассе на зерновой барде составляет 1,8–2,0 г/(дм3·ч). Концентрация абсолютно сухой биомассы в дрожжевой суспензии – 8–12 г/дм3.
Значительное количество поверхностно-активных веществ (белков, аминокислот) придает суспензии способность к интенсивному пенообразованию, поэтому она поступает в деэмульгатор 9, в котором осуществляется отделение и гашение пены с использованием механического и химического пеногасителей.
Рис. 7.1. Технологическая схема производства белково-витаминной добавки на натуральной зерновой послеспиртовой барде (начало, окончание см. на с. 77): 1 – приемник-стерилизатор барды; 2 – поверхностный конденсатор; 3 – теплообменник; 4 – сборник питательной среды; 5 – вибросито; 6 – мерник раствора солей; 7 – трубчатый смеситель; 8 – ферментатор; 9 – деэмульгатор; 10 – дегазатор; 11 – сборник дрожжевой суспензии; 12 – сепаратор
Рис. 7.1. Окончание (начало см. выше 7.1): 13 – сборник отработанной культуральной жидкости; 14 – плазмолизатор; 15 – фильтр сетчатый; 16 – сушилка распылительная; 17 – основная группа циклонов; 18 – продуктовый циклон; 19 – вентилятор; 20 – бункер белково-витаминной добавки
Наличие в барде твердых включений в виде дробины затрудняет сепарационное концентрирование дрожжевой суспензии. В связи с этим дробина отделяется на вибросите 5 с отверстиями размером 0,22–0,25 мм. Освобождение барды от дробины до стадии выращивания дрожжей считают менее целесообразным из-за значительных потерь субстрата с отделяемой фракцией. Сход с вибросита (дробина) смешивается с дрожжевым концентратом, поступающим на термолиз. Выход фильтрата составляет 75–85% от дрожжевой суспензии.
Дрожжевую суспензию концентрируют сепарацией в две ступени. При этом сепараторы второй ступени работают по методу круговой сепарации со сгущением суспензии до 300–400 г/дм3 по биомассе 75%-ной влажности. Термолиз дрожжевого концентрата производят в течение 45 мин при 85–90°С в плазмолизаторе 14, обогреваемом глухим или острым паром. Сушку термолизованного дрожжевого концентрата в смеси с дробиной осуществляют в распылительной сушилке с дисковым распылителем 16. Следует отметить, что присутствие дробины способствует накоплению отложений на внутренних поверхностях сушилки.
Для охраны окружающей среды технологической схемой предусматривается оснащение приемника-стерилизатора барды и сборника-плазмолизатора обратными холодильниками. Газовые выбросы из ферментаторов, от сепараторов 12 и сборников дрожжевой суспензии 13, а также отработанный теплоноситель из сушилки очищают в установках «мокрой» очистки газов.
Жидкий отход производства белково-витаминной добавки – отработанная культуральная жидкость со станции сепарации – частично может быть использован для приготовления питательной среды в основном производстве или направляется для очистки на локальные очистные сооружения предприятия.
Молочная сыворотка является крупнотоннажным отходом молокоперерабатывающих производств. Годовой объем молочной сыворотки по Республике Беларусь составляет около 1 млн т. До настоящего времени не решена проблема полной переработки сыворотки с получением ценных продуктов, что негативно сказывается на экологической обстановке.
По химическому составу (табл. 7.2) молочная сыворотка представляет собой полноценную питательную среду для культивирования микроорганизмов – продуцентов белка.
Таблица 7.2. Химический состав молочной сыворотки, %
|
Вид сыворотки
|
Сухие вещества
|
Белок
|
Жиры
|
Лактоза
|
Минеральные вещества
|
|
Подсырная
|
6,2–6,5
|
0,4–1,0
|
0,05–0,4
|
4,5–4,8
|
0,5–0,7
|
|
Творожная
|
6,0–6,5
|
0,5–1,0
|
0,2–0,3
|
4,0–4,7
|
0,6–0,7
|
Кроме основного субстрата (лактозы) сыворотка содержит органические кислоты, моносахариды, витамины. В качестве продуцентов белка на молочной сыворотке используют дрожжеподобные грибы Trichosporon cutaneum, Candida utilis, Candida humicola. Подготовка сыворотки к микробиологической переработке заключается в денатурации белков термообработкой (85°С, 10–15 мин) с последующим отделением осадка (фильтрованием, центрифугированием).
Дрожжеподобные грибы ассимилируют прежде всего органические кислоты (молочную, уксусную), а затем лактозу, которая является трудноассимилируемым сахаром. При переработке натуральной сыворотки дрожжевая биомасса отличается низким содержанием белка (около 20%). Внесение в сыворотку источников азота в виде мочевины или сульфата аммония в количестве до 1% незначительно увеличивает выход биомассы (примерно на 10%), но резко повышает (в 2–2,5 раза) содержание белка в продукте.
Микробиологическую переработку молочной сыворотки ограничивает рассредоточенность сырья, не позволяющая организовать крупномасштабное промышленное производство кормового продукта.
VIII. ТЕХНОЛОГИЯ ФЕРМЕНТНЫХ ПРЕПАРАТОВ
Источниками ферментов являются растительные материалы - пророщенное зерно злаков (солод); органы и ткани животных - поджелудочная железа, слизистые оболочки желудков, сычуги крупного рогатого скота; микроорганизмы - бактерии, грибы, дрожжи, актиномицеты.
По современной классификации идентифицировано более 2000 ферментов. В промышленных условиях производят около 250 наименований ферментных препаратов, но 99% всей продукции составляют только 18 ферментов. В мировой практике в наибольших масштабах производятся протеиназы, широко используемые в синтетических моющих средствах, и амилазы для переработки крахмала. На их долю приходится до 65% общего объема выпуска ферментных препаратов.
Ферменты применяются в ряде отраслей: пищевой промышленности - пивоварение и виноделие, хлебопечение, сыроделие, производство соков и глюкозо-фруктозных сиропов; текстильной промышленности; кожевенной промышленности - обезволашивание и мягчение кож; медицине - при лечении воспалительных процессов, ожогов, тромбозов; сельском хозяйстве - для обработки грубых кормов; аналитической химии; органическом синтезе; генетической инженерии.
Ферменты как биокатализаторы обладают высокой активностью и избирательностью действия. В ряде случаев они характеризуются абсолютной специфичностью. Для каждого фермента существует оптимальная область величины рН, в которой его каталитическое действие максимально. Повышение температуры ускоряет ферментативную реакцию, но многие ферменты при температуре более 40–50°С инактивируются (денатурируют).
В международной практике за стандартную единицу активности фермента принимают количество фермента, которое катализирует превращение 1 мкмоль субстрата за 1 мин в стандартных условиях. По требованиям стандарта активность определяют при температуре 30°С по начальной скорости реакции, остальные условия реакции индивидуальны для каждого фермента. Активность ферментного препарата выражают в условных единицах активности, приходящихся на 1 мл ферментного раствора или 1 г препарата. В производ- ственной практике пользуются понятием условная тонна ферментного препарата, под которой понимают 1 т товарного препарата со стандартной активностью.
Наибольший интерес в качестве источника ферментов представляют микроорганизмы, поскольку для них характерна высокая интен- сивность функционирования ферментных систем при большой скорости прироста биомассы. Получение ферментных препаратов из клеток микроорганизмов, и особенно из культуральной среды, намного экономичнее, чем из растительных и животных тканей. Некоторые ферменты обнаружены только у микроорганизмов: рацемазы; кератиназы, которые гидролизуют белки-кератины, входящие в состав волос, перьев, рогов и копыт; нитрогеназы, участвующие в восстановлении молекулярного азота до аммиака, и др. Некоторые микроорганизмы, способные расти при повышенной температуре (45–80°С), образуют термостабильные ферменты, сохраняющие активность при температуре более 70°С.
Многие микробные ферменты уникальны по своей активности в кислых и щелочных средах: кислые протеазы стабильны при рН 1,5-3,5, а щелочные проявляют высокую активность при рН больше 8,0. И, наконец, известно, что ферменты, катализирующие одну и ту же реакцию, но полученные из разных микроорганизмов, могут существенно различаться по свойствам.
Микроорганизмы способны синтезировать самые разнообразные ферменты: амилолитические, протеолитические, пектолитические, целлюлолитические, липолитические и др. Основными поставщиками ферментов микробного происхождения являются грибы (Aspergillus, Penicillium, Fusаrium, Rhizopus). В последнее время все более широкое применение находят ферменты бактерий (Bacillus, Escherihia), дрожжей и дрожжеподобных грибов (Candida, Endomycopsis, Saccharomyces). Для промышленного получения ферментных препаратов используют как природные штаммы, так и мутанты. Микроорганизмы синтезируют комплекс ферментов с преимущественным накоплением какого-либо одного фермента, но среди мутантных штаммов имеются «моноферментные» продуценты, способные продуцировать определенный фермент.
Промышленные препараты ферментов содержат балластные вещества и имеют разную степень чистоты. Наименование препарата складывается из сокращенного названия основного фермента и видового названия продуцента. Например: протосубтилин - основной фермент протеиназа, продуцент - Bacillus subtilis; глюкаваморин - глюкоамилаза, Aspergillus awamori; амилосубтилин - амилаза, Bacillus subtilis; пектофоетидин - пектиназа, Aspergillus foetidus; амилоризин - амилаза, Aspergillus oryzae. В наименовании препарата указываются также способ культивирования микроорганизма (П - поверхностный, Г - глубинный) и индекс, характеризующий степень очистки препарата, в виде цифры перед буквой «х» (х, 2х, 3х, 10х и т. д.). Чем больше цифра, тем выше степень очистки:
- Пх, Гх - исходная культура продуцента без какой-либо очистки;
- П2х, Г2х - жидкий концентрат растворимых веществ исходной культуры (40-50% сухого вещества), освобожденный от нерастворимых веществ;
- П3х, Г3х - сухие ферментные препараты, полученные сушкой экстракта поверхностной культуры или жидких концентратов П2х, Г2х;
- П10х, Г10х - сухие препараты, полученные осаждением ферментов из водных растворов органическим растворителем или высаливанием;
- П20х, Г20х - высокоочищенные, но не кристаллические ферментные препараты, содержащие до 25% балластных веществ.
Препараты ферментов с индексом 10х и выше относят к очищенным, с меньшей величиной индекса - к техническим.
В производственных условиях продуценты ферментов культивируют как глубинным, так и поверхностным методом. Независимо от способа характерным свойством многих ферментов является их индуцибельность. Индуктором биосинтеза ферментов чаще всего выступает субстрат, на который данный фермент действует, а также продукты частичного гидролиза или некоторые аналоги субстрата. Например, индуктор биосинтеза амилаз – крахмал, пектиназ - пектиновые вещества.
Для поверхностного культивирования продуцентов ферментов (мицелиальных грибов) используется кюветный способ. Открытые кюветы (600×800×30 мм) с перфорированным днищем располагаются ярусами высотой до двух метров на стационарных стеллажах или подвижных этажерках, которые размещаются в растильной камере объемом 90 м3 (3×3×10 м). Растильная камера оборудована кондиционером для стабилизации параметров (температуры и влажности) подаваемого в камеру воздуха. Расход воздуха рассчитывают не только на обеспечение растущих грибов кислородом, но и на отвод выделяемого ими биологического тепла.
Основной компонент среды при поверхностном культивировании – пшеничные отруби, содержащие все необходимые питательные вещества для роста и развития грибов. Для повышения активности ферментов в питательную среду вводят различные добавки: свекловичный жом (индуктор синтеза пектолитических ферментов), соевую муку (индуктор протеаз), пивную дробину или солодовые ростки (индуктор амилаз), овсяную шелуху, древесные опилки (разрыхлители среды). Питательную среду стерилизуют в шнековом стерилизаторе, обогреваемом глухим паром.
Оптимальная для продуцирования ферментов влажность среды - 55–70%. Чрезмерное увлажнение нарушает рыхлую структуру среды, уменьшает доступ кислорода к культуре и замедляет биосинтез. Низкая влажность способствует ускоренному переходу культуры к спорообразованию, что используют при производстве посевного материала.
Посевной материал представляет собой поверхностную культуру, выращенную на твердой среде, споровый материал или мицелиальную массу продуцента, накопленную глубинным культивированием. Посевную поверхностную культуру получают выращиванием гриба во всевозрастающем количестве в 3 или 4 этапа: в пробирке с 1,0–1,5 г стерильных отрубей, в колбах со 100 г той же среды, в колбах (банках) с 300–500 г среды и в посевных кюветах. На всех этапах выращивание осуществляют при температуре (28 ± 2)°С до обильного спорообразования. Чтобы продлить срок хранения, посевную культуру подсушивают до влажности 10–12% продувкой воздухом в растильной камере и хранят в полиэтиленовых пакетах при 4–6°С.
Для получения спорового материала в специальном вибросепараторе потоком воздуха отделяют конидии от основной массы поверхностной культуры. Мицелиальную массу накапливают культивированием гриба на жидкой среде в инокуляторе.
Выращивание поверхностной культуры длится 36–48 ч. За этот период гриб проходит три стадии роста. Первая стадия (10–12 ч) - набухание конидий и их прорастание. На этом этапе воздухообмен в камере составляет 4–5 объемов в час, температура воздуха – 28°С. Вторая стадия (14–18 ч) - активный рост мицелия, сопровождающийся выделением большого количества тепла (около 4000 кДж/кг культуры). В растильную камеру подают 40–60 объемов воздуха в час при температуре 26–28°С. Третья стадия (12–18 ч) характеризуется замедлением процессов обмена при еще активном образовании ферментов и начале образования конидий. Воздухообмен уменьшают в 3-5 раз по сравнению со второй стадией. По завершении третьего этапа в растильную камеру подают воздух с температурой 38–40°С и в течение 3–6 ч подсушивают культуру до влажности 35–45%, что облегчает отделение ее от перфорированной поверхности кювет и последующую обработку. Растильные камеры работают по следующему режиму: загрузка - 2 ч, культивирование гриба - 22–30 ч, подсушка культуры - 3–6 ч, разгрузка - 2 ч, уборка и мойка камеры - 1 ч, обработка формалином, аммиаком (для удаления формалина) и паром - 3 ч, аэрирование - 3 ч.
Поверхностный метод отличается большими затратами ручного труда, малой производительностью растильных камер, потребностью в больших производственных площадях. Преимущество метода - высокое содержание фермента в массе поверхностной культуры.
В современных условиях поверхностное культивирование грибов производят в механизированных установках, среди которых наибольший интерес представляет колонный аппарат с жалюзийными тарелками, на которых грибы выращивают в слое сыпучей среды толщиной до 300 мм.
Глубинное культивирование продуцентов ферментов имеет ряд преимуществ перед поверхностным: позволяет значительно сократить производственные площади, исключает непроизводительный ручной труд, улучшает гигиену труда, позволяет автоматизировать производство. При глубинном культивировании улучшается степень использования компонентов питательной среды, сокращается объем отходов производства, облегчается получение очищенных препаратов ферментов.
Ферментацию осуществляют в строго асептических условиях. Основные компоненты питательных сред при глубинном культивировании продуцентов ферментов - картофельный и кукурузный крахмал, кукурузная мука, кукурузный экстракт, макро- и микроэлементы. Одним из важнейших микроэлементов, стимулирующих образование протеиназ мицелиальными грибами, является цинк. При глубинном культивировании более отчетливо выражена индуцибельность синтеза ферментов. Большинство ферментов - экстрацеллюларные продукты, выделяющиеся в окружающую жидкую среду. В мицелии остается, как правило, не более 10–15% от всех ферментов.
Оптимальное значение рН среды для биосинтеза ферментов зависит от особенностей продуцента, но имеются и общие закономерности. Грибы и дрожжи хорошо растут и образуют ферменты при рН среды 3,8–5,6, бактерии лучше всего развиваются при рН, близком к нейтральному (6,2–7,4). В зависимости от состава среды и продуктов метаболизма рН среды при ферментации может понижаться или повышаться. Уровень и скорость образования ферментов зависит от интенсивности аэрации ферментационной среды. В целом увеличение степени аэрирования среды приводит, как правило, к интенсификации биосинтеза ферментов и сокращению длительности культивирования.
Поверхностная культура содержит большое количество балластных веществ, поэтому из глубинных культур легче получить очищенные препараты ферментов. Но в этом случае выделять ферменты приходится из очень разбавленных растворов. Доля собственно ферментов составляет около 1% в поверхностных и не более 0,1% в глубинных культурах. На рис. 8.1 представлена принципиальная схема выделения и очистки ферментов из поверхностной и глубинной культур.
В некоторых отраслях возможно использование неочищенных препаратов ферментов. Поверхностная культура нестабильна при хранении из-за повышенной влажности. Ее измельчают в дробилках до частиц размером 5−6 мм и высушивают в барабанных или конвейерных сушилках до влажности 10–12% при температуре теплоносителя 80–85°С. При этом материал не должен разогреваться до температуры более 40–42°С. Глубинная культура может быть использована в виде культуральной жидкости, освобожденной или не освобожденной от взвешенных веществ. Такие простейшие препараты имеют марку Пх и Гх соответственно.
Очищенные ферментные препараты получают из экстракта поверхностной культуры и фильтрата культуральной жидкости. Ферменты являются водорастворимыми белками и экстрагируются водой. Для извлечения ферментов из дрожжей или бактерий необходимо предварительное разрушение клеточных стенок. Диффузионное сопротивление оболочек мицелия намного меньше, и дезинтеграция культур грибов не требуется.
Экстракцию ферментов из сухой и измельченной поверхностной культуры проводят в диффузионной батарее из 8–10 аппаратов объемом по 300 л или в экстракторах непрерывного действия. Применяемая в качестве экстрагента вода содержит антисептик и имеет температуру 25–28°С. В большинстве случаев ферменты наиболее полно извлекаются при рН 5–7. Экстракцию проводят в режиме противотока с расходом воды 200–400% по отношению к массе культуры. Экстракт содержит 10–14% сухих веществ.
Экстракт из поверхностной культуры грибов и фильтрат глубинной культуры нестабильны при хранении. Для получения товарных форм ферментных препаратов их необходимо сконцентрировать.
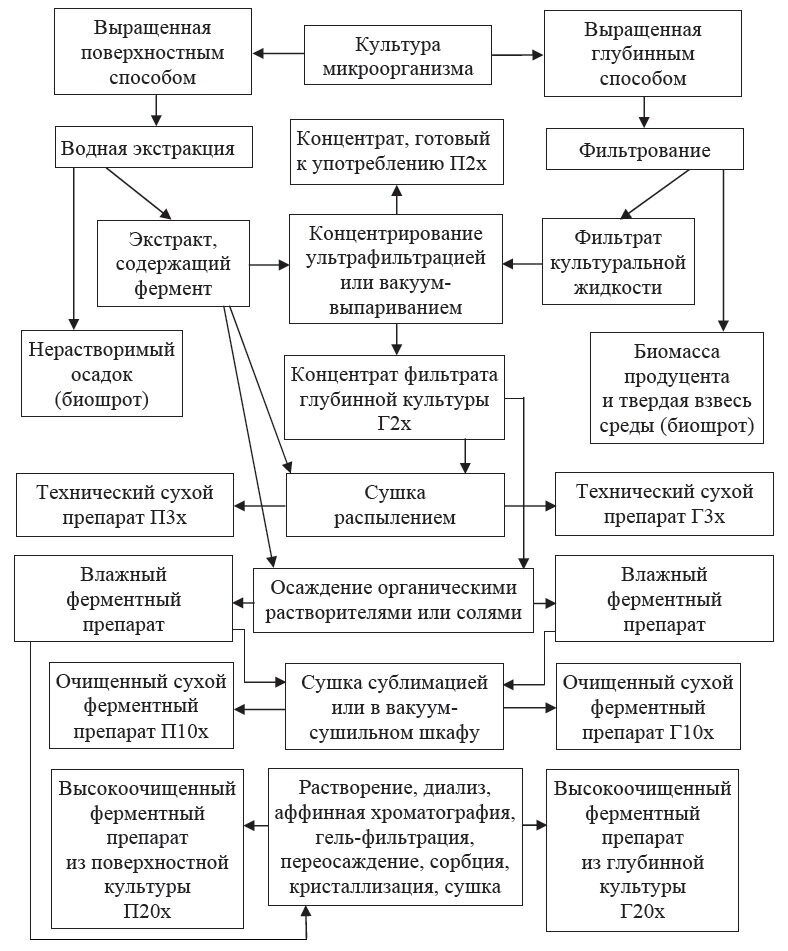
Рис. 8.1. Принципиальная схема получения технических и очищенных ферментных препаратов из культур микроорганизмов
Ферменты очень чувствительны к термической обработке и нуждаются в мягких режимах концентрирования. Известно, что примеси в растворе повышают термическую устойчивость фермента. Чем чище перерабатываемый раствор фермента, тем больше его потери в результате термической инактивации. В производственных условиях концентрирование растворов чаще всего осуществляют упариванием при глубоком вакууме (температура кипения раствора до 30°С). Но избежать значительных потерь активности не удается.
Наиболее перспективный метод концентрирования ферментных растворов - ультрафильтрация, которую проводят при комнатной температуре с малыми энергетическими затратами и при отсутствии тепловой инактивации фермента. Рабочим элементом ультрафильтрационной установки является полупроницаемая мембрана, которая обладает высокой селективностью и обеспечивает разделение низко- и высокомолекулярных соединений с получением концентрата высокомолекулярных соединений (ферментов). Таким образом, ультрафильтрация позволяет сконцентрировать ферментный раствор и одновременно очистить его.
Кроме селективности мембраны должны обладать высокой пропускной способностью, механической прочностью, химической и биологической инертностью, стабильностью пористой структуры. Наиболее высокопроизводительны и компактны установки с элементами из полых волокон диаметром 50–250 мкм и толщиной стенки 15–100 мкм. Фильтрующая поверхность таких установок достигает 20 000 м2/м3 (производитель фирма «DuPont», США). Метод ультра- фильтрации перспективен как на стадии концентрирования ферментных растворов, так и в качестве способа очистки ферментов.
В производстве очищенных ферментных препаратов широко применяется метод осаждения ферментов из растворов органическими растворителями или (реже) высококонцентрированными растворами солей (высаливание). Эффект осаждения белков связан с тем, что органические растворители и ионы солей разрушают гидратную оболочку молекулы белка. При этом растворимость белков падает, происходит агрегирование и осаждение белковых молекул. Агрегирование белков осуществляется за счет электростатических и Ван-дер-Ваальсовых взаимодействий между белковыми молекулами.
В производстве для осаждения ферментов используют этанол, ацетон, изопропанол. Наиболее эффективен изопропанол. Белки осаждаются при сравнительно низкой концентрации изопропанола (52–53%), а препараты содержат меньше балластных веществ. Последовательным увеличением концентрации растворителя в растворе можно осуществить фракционирование ферментного комплекса. Например, при концентрации этанола 48–52% осаждается протеаза из раствора комплекса ферментов Aspergillus oryzae. После отделения осадка протеазы концентрацию этанола повышают до 70–74%, и в осадок выпадает амилаза.
При смешивании растворителя и водного раствора фермента выделяется тепло и температура смеси повышается на 5–10°С. При температуре смеси 10–15°С наблюдается инактивация фермента. Причем имеет место не только термоинактивация. Увеличение температуры в присутствии растворителя приводит к нарушению структуры фермента и часто к изменению конформации активного центра с потерей ферментом каталитической активности. В связи с этим длительность его контакта с растворителем должна быть сведена к минимуму. Оптимальная температура осаждения, равная 3–5°С, достигается охлаждением раствора фермента до 1–3°С, а растворителя - до температуры от -8 до -10°С. Наиболее полно ферменты осаждаются при величине рН, близкой к изоэлектрической точке. Отклонение величины рН от данной точки снижает выход осадка и активность фермента.
Для высаливания ферментов часто используют сульфат аммония, реже – хлорид натрия, сульфат цинка и другие соли. Осаждение проводят раствором с концентрацией соли 0,5-0,9 от полного насыщения. Осажденные ферментные препараты содержат 20–80% соли от массы осадка, что не всегда удовлетворяет потребителя. В отличие от растворителей, которые легко регенерируют ректификацией, регенерация соли представляет собой сложную задачу. Положительным фактором является то, что осадки, полученные при высаливании, содержат меньше балластных веществ и лучше растворяются в воде, что важно для их дальнейшей обработки.
Белки могут агрегироваться без денатурации в присутствии высокомолекулярных нейтральных водорастворимых полимеров. Например, в промышленных условиях используют полиэтиленгликоль (ПЭГ) с молекулярной массой 6000 и 20 000 Да, декстраны. Для осаждения ферментов требуются низкие концентрации ПЭГ в смеси - 6-12%.
В лабораторной практике при получении высокоочищенных ферментов применяют ряд других методов, перспективных для промышленного использования: ионообменную хроматографию, аффинную адсорбционную хроматографию, хроматографию на окрашенных адсорбентах (фермент проявляет сродство к красителю) и некоторые другие. Весьма эффективен для разделения и очистки ферментов в производственных условиях метод гель-фильтрации.
Завершает стадии выделения и очистки сушка ферментных препаратов. Жидкие полупродукты сушат в распылительных сушилках в мягких условиях: температура теплоносителя на входе не должна превышать 130°С, на выходе - 50–70°С. Снижает потери ферментативной активности введение в жидкий полупродукт наполнителя (например, NaCl). Влажные осадки высушивают в вакуумных сушильных камерах или в барабанных вакуум-сушилках, обогреваемых водой с температурой 50–60°С. Продолжительность сушки – 10–14 ч. В качестве примера рассмотрим отечественную технологию производства глюкаваморина Г2х.
Продуцентом амилаз является гриб Aspergillus awamori ВУДТ-2, который размножают на среде Чапека с сахарозой или крахмалом (2– 3%). Глюкоамилазная активность культуры – не менее 180 ед./см3. Конидиальный посевной материал получают на твердой питательной среде (пшеничные отруби и солодовые ростки в соотношении 1 : 1 по массе) в колбах объемом 750 см3 (30–40 г среды). После засева культурой из пробирок со средой Чапека колбы термостатируют 5–6 суток при температуре 30°С, а затем выдерживают при комнатной температуре 7–8 суток (до обильного конидиеобразования). Поученным конидиальным материалом в виде водной суспензии засевают посевной аппарат из расчета 10–15 г культуры на 1 м3 питательной среды, имеющей следующий состав (в %): кукурузная мука – 5,0; кукурузный экстракт – 1,0. Величина рН исходной среды – 4,8–5,0. В смесителе готовят водно-мучную суспензию, добавляют кукурузный экстракт, подогревают до 57–80°С и подают в посевной аппарат, в котором питательную среду стерилизуют при 125–130°С в течение 1,5 ч. Охлажденную до 28–30°С питательную среду засевают культурой из колб. Продолжительность накопления биомассы гриба в посевном аппарате – 20–24 ч.
Производственная среда содержит (в кг/м3): кукурузную муку – 300; ячменный солод для разжижения мучного замеса – 1,5; гидрофосфат аммония – 4,5; ячменный солод для осахаривания крахмала – 7,5. Величина рН среды – 3,5–4,8. Технологическая схема приготовления питательной среды представлена на рис. 8.2.
Кукурузная мука смешивается в шнековом смесителе с водой (температура 40°С) в соотношении 1 : 3. Водно-мучная суспензия в емкостном смесителе обогащается гидрофосфатом аммония и разжижается ячменным солодом при перемешивании в течение 20–30 мин с повышением температуры до 60°С. Полученная масса разваривается при 130°С с выдержкой 15 мин (нагревательная колонка + выдерживатель). Разваренная масса охлаждается в теплообменнике типа «труба в трубе» до 60°С и подвергается осахариванию ячменным солодом в течение 10–15 мин. Осахаренная масса направляется на стерилизацию (нагревательная колонка + выдерживатель) при температуре 120–123°С в течение 15 мин и после охлаждения поступает в ферментатор.
Рис. 8.2. Приготовление и стерилизация питательной среды: 1 – шнековый смеситель; 2 – емкостный смеситель; 3 – фильтр сетчатый; 4 – нагревательная колонка; 5 – выдерживатель; 6 – холодильник; 7 – осахариватель
Производственную ферментацию осуществляют в условиях асептики при температуре 32°С в течение 5–6 сут. Расход воздуха на аэрацию среды в ферментаторе – 50 м3/(м3·ч). Культуральную жидкость хранят в сборниках в захоложенном состоянии (12–15°С) без существенных потерь активности до 200 ч. КЖ может быть реализована как ферментный препарат глюкаваморин Гх. Для получения препарата с индексом Г2х отделяют биомассу гриба фильтрованием на фильтре- прессе ФПАКМ, фильтрат концентрируют с одновременной очисткой от низкомолекулярных примесей на ультрафильтрационной установке с получением жидкого концентрата амилаз (активность 800–1000 ед./дм3). Продукт стабилизируют введением консерванта (например, бензойнокислого натрия).
IX. ПРОИЗВОДСТВО АНТИБИОТИКОВ
Антибиотики (АБ) – это продукты обмена веществ микроорганизмов (вторичные метаболиты), способные избирательно подавлять рост клеток определенных групп микроорганизмов и убивать их. Это одна из форм проявления антагонизма в мире микробов. Еще в конце XIX в. ученые обратили внимание, что многие непатогенные бактерии и плесневых грибов способны выделять компоненты, ингибирующие рост других микроорганизмов. В 1940 г. был получен пенициллин. В 1945 г. всего было известно 32 антибиотика, в 1964 г. – 1600, в настоящее время – более 6000 антибиотических веществ. Практическое применение находят около 200 антибиотиков.
АБ отличают следующие признаки:
- высокая биологическая активность при малых концентрациях;
- избирательность действия: воздействуют только на определенные группы микроорганизмов и практически безвредны (нетоксичны) для человека и животных.
Единой общепринятой классификации АБ до настоящего времени нет.
По спектру биологического действия различают:
- противобактериальные АБ. Подавляют развитие грамположительных бактерий (пневмококки, стрептококки и др.). Это такие АБ, как пенициллин, эритромицин, грамицидин, бацитрацин. Противобактериальные АБ с широким спектром действия подавляют развитие как грамположительных, так и грамотрицательных бактерий (кишечная палочка, возбудители дифтерии, брюшного тифа и т. д.). К этой группе АБ относятся тетрациклины, стрептомицин, неомицин, хлоромицин и др. Грамположительные бактерии более чувствительны к АБ, чем грамотрицательные;
- противогрибковые АБ – нистатин, леворин, гризеофульвин и др.;
- противоопухолевые АБ действуют на опухолевые клетки человека и животных – актиномицин, митомицины и др.;
- противотуберкулезные АБ – стрептомицин;
- противоамебные АБ – фумагиллин.
Наиболее правильной многие ученые считают классификацию, основанную на химическом строении АБ:
- алифатические – нистатин;
- алициклические – тетрациклины;
- АБ-хиноны – фумигатин;
- азотсодержащие гетероциклические АБ – пенициллин и его производные;
- гетероциклические кислородсодержащие АБ – гризеофульвин;
- АБ-полипептиды – грамицидин;
- АБ-макролиды – эритромицин, тилозин (имеют большую молекулярную массу, построены из нескольких компонентов, например, имеют лактонное кольцо, связанное с аминосахарами).
Классификация АБ по механизму биологического действия:
- ингибирующие синтез клеточной стенки (пенициллин, бацитрацин, цефалоспорин);
- нарушающие функции мембран (грамицидин, нистатин, трихомицин);
- подавляющие синтез нуклеиновых кислот (гризеофульвин (РНК), митомицины (РНК + ДНК));
- подавляющие синтез белка (тетрациклины, эритромицин);
- ингибирующие дыхание и окислительное фосфорилирование (олигомицины);
- АБ-антиметаболиты.
АБ могут накапливаться внутри клеток продуцента и (или) выделяться в ферментационную среду. Для ряда АБ механизм их биологического действия еще не установлен.
Из около 6000 АБ примерно 3000 – актиномицетные.
Биосинтез АБ микроорганизмами – наследственная особенность. Каждый вид способен образовывать один или несколько строго характерных для него антибиотических веществ. Особенность биосинтеза АБ микроорганизмами-продуцентами – двухфазность процесса: накопление биомассы (тропофаза) и антибиотических веществ (идиофаза).
Применение АБ:
- терапия инфекционных заболеваний человека и животных (медицина и ветеринария);
- кормовые добавки, стимулирующие рост сельскохозяйственных животных;
- консерванты пищевых продуктов;
- средства борьбы с заболеваниями растений;
- средства борьбы с посторонними микроорганизмами в некоторых биотехнологических производствах (например, в производстве этанола).
Биологическая активность препаратов АБ выражается в условных единицах на 1 см3 раствора или 1 мг (г) сухого препарата. За единицу биологической активности принимается минимальное количество АБ, которое подавляет рост стандартного штамма микроорганизмов (тест-культуры, чувствительной к данному АБ). Например, при определении активности препаратов пенициллина в качестве тест-культуры используют золотистый стафилококк – Staphylococcus aureus 209-P. Часто (но далеко не для всех АБ) 1 мг чистого АБ соответствует 1000 единицам биологической активности.
9.1. Технология кормовых препаратов антибиотиков
В США рынок кормовых препаратов АБ оценивается в 170 млн долларов в год. Каждый миллион долларов, затраченный на производство препаратов, приносит в животноводстве доход в 5–10 млн долларов. Изучением и производством АБ занимаются известные биотехнологические фирмы США – «Eli Lilly», «Pfizer» и др.
Применение АБ в животноводстве обеспечивает дополнительный прирост массы животных при откорме и снижение расхода кормов на 5–10%. Для кормовых целей применяют неочищенные препараты АБ, представляющие собой высушенную биомассу продуцента, содержащую кроме АБ белки, аминокислоты, витамины и другие биологически активные вещества. В развитых странах широко используют кормовые препараты АБ.
К АБ, применяемым в кормовых целях, предъявляется ряд требований. Они не должны:
- использоваться в медицине (в терапевтических целях) и не должны вызывать резистентности бактерий к АБ, применяемым в медицине;
- изменять своей структуры в организме;
- способствовать возникновению аллергии;
- распространяться и накапливаться в тканях и органах животных.
В отечественной практике освоено производство кормовых препаратов биовит (антибиотик хлортетрациклин (ХТЦ)), кормогризин (гризин), бацилихин (бацитрацин).
Производство биовита. Активное начало препарата – хлортетрациклин (биомицин):

Товарные формы препарата:
- биовит-80 – 80 г/кг ХТЦ и 8 мг/кг В12;
- биовит-120 – 120 г/кг ХТЦ и 12 мг/кг В12;
- биовит-160 – 160 г/кг ХТЦ и 16 мг/кг В12.
Продуцент – актиномицет Streptomyces aureofaciens ТБ 633 ФУ. Питательная среда для производственной ферментации: мука кукурузная – 7,0%; экстракт кукурузный – 0,9%; NH4Cl – 0,6%; CaCO3 – 0,6%; бензил роданистый (стимулятор синтеза АБ) – 3 г/м3; CoCl2 (для биосинтеза витамина В12) – 3 г/м3; пеногаситель (технический рыбий жир) – 0,2%; рН 6,6–6,8.
Режим ферментации: температура культивирования – 26–28°С; расход воздуха – 60–70 м3/(м3·ч); продолжительность ферментации – 70–90 ч. Активность КЖ – 3800–5000 ед./см3 (3,8–5,0 кг/м3). Тепловыделение при ферментации около 10000 кДж/(м3·ч).
В условиях глубинного культивирования актиномицеты размножаются вегетативно, путем отделения фрагментов мицелия. На твердых питательных средах актиномицеты образуют колонии, на поверхности которых развиваются спорангии, содержащие споры круглой или овальной формы.
В качестве посевного материала используют споры, которые при температуре 2–6°С можно хранить до 3 месяцев. Споровой материал выращивают на разваренном пшене.
Накопление посевного материала производят в две стадии – в качалочных колбах объемом 750 см3 (200 см3 среды) и в посевном аппарате на питательной среде следующего состава: мука кукурузная (или ржаная) – 5–6%; экстракт кукурузный – 5–6%; пеногаситель (технический рыбий жир) – 1,0%; рН 6,6–7,0.
В качалочных колбах выращивание длится 24–30 ч при температуре 26–28°С. Для засева посевного аппарата используют 600–800 см3 посевного материала из колб. Продолжительность процесса в посевном аппарате составляет 30–36 ч при температуре 26–28°С. Допустимо хранение посевного материала при температуре 16–18°С до 20 ч (или при 20–22°С не более 10 ч).
Муку заваривают при 80°С в течение 15 мин, затем задают кукурузный экстракт, соли, тщательно перемешивают и стерилизуют на УНС при температуре 135–140°С 20–30 мин.
Перед засевом в ферментатор задают роданистый бензил, растворенный в стерильном рыбьем жире.
К концу ферментации характерно повышение рН до 7,0–7,2. Одновременно с образованием ХТЦ Streptomyces aureofaciens синтезирует также витамин В12. Большая часть ХТЦ (90%) и витамина В12 (70%) находится в мицелии. КЖ содержит 3,0–3,5% сухих веществ.
Существуют различные технологические варианты переработки КЖ с получением сухого продукта (рис. 9.1).
По варианту III КЖ концентрируют упариванием под вакуумом до 12–14% СВ.
Концентрат сушат распылением в мягких условиях. Температура теплоносителя на входе в сушилку составляет 200–220°С, на выходе – 70–80°С. Рекомендуется добавлять консервант – пиросульфат натрия в количестве 2–3 кг на 1 м3 КЖ.
ХТЦ обладает наибольшей антибиотической активностью в кислой среде (рН 3,5–4,0). В щелочной среде ХТЦ быстро разрушается. При рН 7,6 через 12 ч выдержки ХТЦ инактивируется на 50%. Наиболее стабилен солянокислый ХТЦ. В связи с этим перед упариванием целесообразно понижение рН КЖ до 5.
Рассмотренный технологический процесс требует значительных энергетических затрат (прежде всего на упаривание КЖ).
По варианту II биомассу продуцента отделяют фильтрованием, гранулируют и высушивают гранулы в сушилке кипящего слоя. Недостаток процесса состоит в том, что при отделении биомассы теряется часть ХТЦ с фильтратом (активность фильтрата – 50–100 ед./см3).
Наиболее приемлем вариант I, в котором предусматривается осаждение растворенного ХТЦ обработкой щелочью (например, NH4OH с расходом 2,2–2,3 дм3/м3 КЖ) с повышением показателя рН до 8,0–8,5. В этих условиях образуется ХТЦ-основание, слабо растворимое в воде, и потери антибиотика при выделении из КЖ снижаются.
Влажность продукта – до 8%. Продукт стандартизируют добавлением наполнителя (пшеничные отруби, соевая мука и др.).
Необходимое количество наполнителя Х, кг рассчитывают из выражения
Х = 100·(Ан - Аст)/(Аст - Ао)
где Ан – активность нативного препарата, г/кг; Аст – активность стандартного препарата, г/кг; Ао – активность наполнителя, г/кг.
Рис. 9.1. Процессуальная схема получения биовита
Биовит представляет собой порошок (или гранулы) коричневого цвета. Обладает аллергическим действием и повышает общую заболе- ваемость при концентрации в воздухе рабочей зоны более 22 мг/м3.
ПДК в воздухе рабочей зоны – 0,1 мг/м3 по ХТЦ.
В животноводстве применяют и некоторые другие кормовые препараты антибиотиков.
Кормогризин 5; 10; 40. Содержит 5; 10; 40 г/кг антибиотика гризин, продуцируемого Streptomyces griseus. Стимулирует рост и плодовитость животных.
Бацилихин 10; 20; 30. Содержит полипептидный АБ бацитрацин. Продуцент – Bacillus licheniformis.
9.2. Производство тилозина
В современном животноводстве тилозин имеет три основных назначения: терапевтическое средство для лечения ряда инфекционных заболеваний (дизентерия, микоплазмоз и др.), профилактика инфекций, биостимулирующее средство. Производятся препараты кормового назначения, возможно применение в ветеринарной практике. Объем производства за рубежом – 500–600 т/год. В числе ведущих производителей крупнейшие биотехнологические фирмы «Eli Lilly» – США, «Dista Products» – Великобритания.
Тилозин относится к группе макролидных антибиотиков (молекулярная масса 915 Да). Продуцентом тилозина является актиномицет Streptomyces fradiae 3830 (активность около 1500 ед./см3) (1 мг чистого антибиотика соответствует 1000 ед. активности по ингибированию Bacillus subtilis). Получены штаммы (за рубежом) с активностью до 5000 ед./см3.
Тилозин действует на микроорганизмы путем подавления белкового синтеза (связывается с рибосомами, выводя из строя рибосомный комплекс). Обладает широким антибактериальным спектром действия, в основном против грамположительных бактерий. Чистый тилозин (бесцветные кристаллы с температурой плавления 128–132°С) проявляет свойства слабого основания. Хорошо растворим в большинстве органических растворителей из-за присутствия в молекуле различных функциональных групп. Растворимость в воде при 25°С составляет 0,5%. Хорошо реагирует с органическими и неорганическими кислотами, образуя соли.
Молекула тилозина включает углеводные компоненты (сахара: микароза, микаминоза, мициноза) и тилактонное кольцо:
Биосинтез тилозина протекает в три этапа: синтез тилактона, синтез сахаров, конверсия тилактона в тилозин. Для биосинтеза компонентов, составляющих структуру молекулы тилозина, питательная среда должна содержать глюкозу, жирные кислоты и аминокислоты.
В настоящее время разработан ряд прописей питательных сред, где в качестве источников необходимых элементов предложены самые различные вещества.
Для получения посевного материала используют независимую среду на основе соевой муки (источник азота) и глюкозы (источник углерода). В состав этой среды входят (%): соевая мука – 2,5; глюкоза – 2,5; кукурузный экстракт – 1,0; хлорид натрия – 0,2; мел – 0,5; подсолнечное масло – 0,2.
В случае замены глюкозы на соевое масло состав среды может измениться следующим образом (%): соевая мука – 0,58; кукурузный экстракт – 0,35; дрожжи кормовые – 0,58; соевое масло – 0,58; мел – 0,35.
Для культивирования продуцента в промышленных ферментаторах предложены следующие ферментационные среды (таблица).
Накопление тилозина происходит в идиофазе. В трофофазе антибиотик в заметных количествах не образуется.
Состав производственных сред для микробного синтеза тилозина, %
|
Компонент среды
|
Среда 1
|
Среда 2
|
Среда 3
|
|
Мука соевая
|
2,5
|
–
|
–
|
|
Мука кукурузная
|
–
|
2,0
|
–
|
|
Мука рыбная
|
–
|
–
|
1,75
|
|
Глюкоза
|
2,5
|
–
|
–
|
|
Меласса
|
–
|
2,0
|
2,0
|
|
Хлорид натрия
|
0,2
|
0,2
|
0,1
|
|
Экстракт кукурузный
|
1,0
|
–
|
–
|
|
Хлорид аммония
|
–
|
0,7
|
–
|
|
K2HPO4
|
–
|
0,03
|
–
|
|
Сульфат магния
|
–
|
0,5
|
–
|
|
(NH4)2HPO4
|
–
|
–
|
0,4
|
|
Мел
|
0,5
|
0,5
|
0,2
|
|
Масло подсолнечное
|
3,0
|
1,5
|
–
|
|
Масло соевое
|
–
|
–
|
3,0
|
Ферментацию проводят в условиях асептики при температуре 27–29°С и рН среды 7,0–7,2. Интенсивность аэрации 1,5–0,9 об./(об. · мин). Наиболее интенсивное потребление кислорода наблюдается в трофофазе (вторые сутки), затем оно снижается. Эффективный синтез тилозина происходит при концентрации растворенного кислорода, составляющей не менее 30% от насыщения. Трофофаза длится 2–3 суток (антибиотик практически не образуется). Общая продолжительность процесса биосинтеза – до 220 ч (характерно повышение рН к концу процесса до 7,8–8,0). В настоящее время тилозин выделяют из нативного раствора двумя методами: адсорбционным (сорбция на ионообменной смоле) и экстракционным. Большое распространение получил экстракционный метод с использованием в качестве экстрагентов полярных растворителей (бутилацетат, этилацетат и др.).
К концу биосинтеза мицелий актиномицета частично лизирует и большая часть тилозина сосредотачивается в культуральной среде (вне мицелиальной структуры), что упрощает выделение антибиотика.
Обработку КЖ с целью полного вывода антибиотика из клетки и очистки его от примесей осуществляют различными методами (флокуляция, коагуляция, термический нагрев, изменение рН и др.). Широкое распространение получил способ, основанный на введении в КЖ сульфата цинка (0,5%), вызывающего частичный лизис клеток и коагуляцию коллоидных и взвешенных веществ. Для удаления ионов Ca2+, содержащихся в КЖ, вводят щавелевую кислоту (около 0,5%) до рН 3,9–4,0. Фильтрационные свойства КЖ улучшаются при добавлении перлита (1–2% от объема КЖ). Фильтрацию осуществляют на фильтре-прессе ФПАКМ. Количество влажного осадка составляет около 4% от объема КЖ. Осадок высушивают (после гранулирования) и используют как кормовой препарат фрадизин.
Технологический процесс экстракционного выделения тилозина бутилацетатом состоит из следующих стадий (рис. 9.2):
- обработка КЖ щавелевой кислотой (0,5%) и сульфатом цинка (0,5%) при температуре 60°С;
- фильтрация КЖ на фильтре-прессе;
- экстракция тилозина бутилацетатом в соотношении нативный раствор : бутилацетат = 2,7 : 1 при рН 8,8–8,9 (25%-ный раствор NaOH);
- реэкстракция тилозина водным раствором винной кислоты (2%) при соотношении бутилацетатный экстракт : раствор винной кислоты = (5–6) : 1 с получением водорастворимой соли – тилозин-тартрата;
- нейтрализация экстракта 10%-ным раствором NaOH (или NH4OH) до рН 4,5 и очитска раствора на ионообменной смоле SBW (или AB-17) в OH–-форме;
- концентрирование экстракта в роторно-пленочном испарителе в 2–3 раза;
- сушка концентрата распылением в мягких условиях (температура теплоносителя на входе в сушилку 120–160°С).
Рис. 9.2. Схема экстракционного выделения тилозина из культуральной жидкости: 1 – коагулятор; 2 – фильтр-пресс ФПАКМ; 3 – сборник фильтрата; 4, 7 – смеситель трубчатый; 5, 8 – экстрактор-сепаратор «Россия»; 6 – сборник экстракта; 9 – сборник реэкстракта; 10 – ионообменная колонна; 11 – промежуточный сборник; 12 – роторный испаритель; 13 – сборник концентрата
X. МИКРОБИОЛОГИЧЕСКИЕ СРЕДСТВА ЗАЩИТЫ РАСТЕНИЙ
По данным Международной продовольственной организации (ФАО) потери урожая в сельском хозяйстве от вредителей, болезней, сорняков и грызунов составляют ежегодно около 30%.
В мировой практике применяют различные методы защиты растений:
- обработку химическими пестицидами;
- использование биопрепаратов на основе бактерий родов Bacillus, Pseudomonas, Erwinia против вредных насекомых и фитопатогенных грибов;
- вакцинацию – заблаговременное введение слабопатогенного штамма-возбудителя опрыскиванием рассады соком растения-накопителя;
- генетический метод – насыщение популяции вредителя генетически неполноценными особями, не способными к воспроизводству потомства или с недостаточной жизнеспособностью, закрепленной наследственно.
Биологические препараты наиболее успешно применяются для борьбы с вредителями сельскохозяйственных растений, насчитывающими более 15 тысяч видов насекомых.
Широкое использование химических агентов выявило их серьезные недостатки:
- химические инсектициды не обладают достаточной селективностью действия, в связи с чем их применение наносит огромный урон полезным насекомым и другим животным;
- пестициды подавляют биологическую активность почв, усиливают их эрозию, нарушают генетическую чистоту высокопродуктивных сортов растений;
- химические препараты в большинстве являются высокоактивными и оказывают мутагенное, аллергенное, канцерогенное действие на млекопитающих, они опасны для всей флоры и фауны, а также для человека;
- пестициды медленно деструктируются в естественных условиях, следовательно, существует тенденция накопления их в окружающей среде;
- длительное использование химических агентов вызывает возникновение резистентности у вредных насекомых.
Биологические инсектициды имеют неоспоримые преимущества перед химическими: обладают высокой селективностью действия и безвредны для полезных насекомых, животных и человека; резистентность к биопрепаратам у вредных насекомых-мишеней вырабатывается редко и в ограниченных масштабах; накопление их в природных биогеоценозах не приводит к негативным экологическим последствиям. По современным представлениям наиболее эффективно и целесообразно интегрирование биологических и химических методов защиты растений с учетом особенностей биологии вредителя, почвенно-климатических условий, агротехнических приемов, экологической обстановки.
В борьбе с вредными насекомыми используются бактерии, микроскопические грибы, вирусы.
10.1. Бактериальные энтомопатогенные препараты
Потенциальными агентами в биологической защите растений являются более 90 видов бактерий, но лучшими микробными инсектицидами признаны препараты на основе Bacillus thuringiensis. К ним восприимчивы около 400 видов насекомых. К настоящему времени известно более 1000 штаммов B. thuringiensis, составляющих три патотипа: патотип А – патогены чешуекрылых (плодожорки, листовертки, шелкопряды, моли и др.), патотип В – патогены двукрылых (мошки, мухи, комары и др.), патотип С – патогены жесткокрылых (колорадский жук).
Биологическое действие бактериальных энтомопатогенных препаратов («энтомо» – насекомое) обеспечивается входящими в их состав спорами Bacillus thuringiensis, параспоральными кристаллами (d-эндотоксином), а также (намного реже) термостабильным b-экзотоксином. Обладают токсичным действием и соединения, синтезируемые клетками, проросшими из спор (дополнительный фактор вирулентности бактериальных инсектицидов). Образование помимо эндоспор параспоральных кристаллов является характерной особенностью кристаллоносных бактерий. В оболочках спор B. thuringiensis содержатся субъединицы d-эндотоксина, поэтому споры также оказывают токсичное действие на насекомых-мишеней, что одновременно способствует прорастанию спор.
Основным токсичным компонентом бактериальных инсектицидов является d-эндотоксин (кристаллический токсин), образующийся одновременно со спорой в противоположной части клетки (параспорально). После созревания спор и кристаллов клеточная стенка лизируется и оба образования (кристалл и спора) высвобождаются в культуральную среду.
Основу кристаллов d-эндотоксина составляют белковые субъединицы. Кроме белков в сотаве кристаллов обнаружены небольшие количества нуклеиновых кислот, сахаров и соединений фосфора (гликопептиды, фосфополипептиды), а также протеолитические ферменты.
Кристаллы штаммов B. thuringiensis содержат несколько видов токсичных для насекомых белков, представленных в различных соотношениях. Биохимия кристаллов изучена недостаточно.
Споры бактерий в высушенном состоянии могут сохраняться при комнатной температуре до 10 лет и более. При высокой влажности они погибают при 100°С в течение 5–10 минут.
Споры бактерий, поглощенные восприимчивым насекомым, прорастают в его кишечнике. Вегетативные клетки проникают в полость тела, быстро размножаются, разрушая ткани. Эта стадия заражения получила название септицемии.
Белок кристалла растворяется в щелочной среде (рН 12–14) кишечника насекомого и трансформируется протеолитическими ферментами кишечника насекомого-мишени в действующий (активный) токсин. Специфичность действия эндотоксина определяется несколькими факторами: щелочной средой кишечника насекомого, составом белковых субъединиц кристалла и присутствием в кишечнике насекомого специфических протеолитических ферментов, активирующих прототоксин кристалла.
Молекулярная модель инсектицидного действия d-эндотоксина окончательно не разработана. Предложена гипотеза двухступенчатого действия d-эндотоксина: первый этап – связывание молекулы со специфическим рецептором на клеточной мембране, второй этап – образование пор в мембране диаметром 0,5–1,0 нм. Это приводит к дополнительному поступлению ионов в клетку, выходу из клетки молекул воды, но не макромолекул, следствием чего является коллоидно- осмотический лизис клеток кишечника насекомого-мишени.
Кристаллы d-эндотоксина термолабильны. Нагревание до 80–100°С в течение 30–40 мин разрушает структуру кристалла и инактивирует прототоксин.
b-экзотоксин представляет собой структурный аналог АТФ, конкурирующий с АТФ за связывающий участок на некоторых ферментах. Он нарушает биосинтез РНК, действует как специфический ингибитор ДНК-зависимой РНК-полимеразы. Токсическое действие b-экзотоксина на насекомых не является высокоспецифичным и проявляется медленнее, чем действие d-эндотоксина.
b-экзотоксин – термостабильный, продуцируется во время вегетативного роста культуры и выделяется в культуральную среду. Для его накопления требуется определенный состав питательной среды. В культуральной жидкости накапливается до 120 мг/дм3 b-экзотоксина. У восприимчивых насекомых b-экзотоксин повреждает клетки кишечника, способствует проникновению бактерий в полости тела.
На основе B. thuringiensis в промышленных условиях получают ряд энтомопатогенных препаратов: бацитурин, энтобактерин, дендробациллин, инсектин и другие (табл. 10.1).
Таблица 10.1. Характеристика бактериальных препаратов
|
Название
|
Штамм
бактерий
|
Товарная форма
|
Титр
спор, млрд/г
|
Спектр действия
|
|
Бацитурин
|
B. thuringiensis
var. darmstadiensis 24
|
Паста
|
20
|
Вредители защищенного грунта: паутинный клещ, капустная белянка, личинки колорадского жука
|
|
Энтобактерин
|
B. thuringiensis
var. galleria
|
Смачива- ющийся порошок
|
30
|
Листогрызущие чешуе-крылые: яблонная плодожорка,
листовертки, пилильщик
|
|
Инсектин
|
B. thuringiensis
var. insectus
|
То же
|
30
|
Вредители леса: непареный шелкопряд, дубовая листовертка
|
|
Битоксибациллин
|
B. thuringiensis
var. thuringiensis
|
То же
|
30
|
Тля, капустная совка,
колорадский жук
|
Технологические процессы получения энтомопатогенных препаратов различаются разновидностью применяемых штаммов бактерий Bacillus thuringiensis и, следовательно, видом синтезируемых токсинов, условиями культивирования, титром накапливаемых в культуральной жидкости спор и кристаллов, способами концентрирования культуральной жидкости и формой выпускаемого препарата.
Первые промышленные препараты выпускали в виде сухого порошка – высушенный концентрат КЖ с наполнителем. Применяют эти препараты главным образом в виде водных суспензий (сухой дуст расходуется в большем количестве). Основные недостатки сухих препаратов:
- малая физическая стабильность рабочих суспензий;
- недостаточная смачиваемость листьев и прилипаемость;
- высокая чувствительность биоагента к воздействию солнечного света (УФ-лучи);
- ограниченный срок хранения.
Более совершенными товарными формами являются смачивающиеся порошки (включают различные добавки) и стабилизированные пасты.
В качестве добавок используют:
- консервант (хлорид натрия – 10–20%, хлороформ – 0,4–0,5%);
- наполнитель (каолин – 5–30%);
- прилипатель (карбоксиметилцеллюлоза или желатин, казеин – до 10%);
- смачиватель (поверхностно-активное вещество сульфанол – до 5%);
- стабилизатор суспензии (сульфитно-спиртовая барда – до 20%);
- защитные (от УФ-излучения) вещества (меласса, активированный уголь – 2–3%).
Для глубинного культивирования B. thuringiensis используют кукурузно-глюкозную (0,7% глюкозы, 4% кукурузного экстракта) и дрожжеполисахаридную (3% дрожжей, 1,5% кукурузной муки) среды.
Дрожжеполисахаридная среда (ДПС) обеспечивает более высокий титр клеток в КЖ, но имеет ряд недостатков:
- сильное вспенивание из-за большого количества дрожжей;
- наличие нерасщепленных дрожжевых клеток, затрудняющих сепарацию;
- низкий коэффициент использования питательных компонентов при высокой стоимости среды;
- высокое содержание аминного азота (900–1300 мг/дм3), приводящее к нарушению синхронности в развитии культуры, что увеличивает время ферментации (к концу ферментации в культуральной жидкости много вегетативных клеток, в которых не сформировались споры).
Наиболее рациональным признано использование полусинтетических сред (табл. 10.2).
Полусинтетические среды имеют более низкую стоимость, чем ДПС, обеспечивают эффективный рост и синхронное развитие культуры.
Таблица 10.2. Полусинтетические среды для культивирования B. thuringiensis
|
Компонент
|
Содержание в среде, %
|
ПС-1
|
ПС-2
|
ПС-3
|
|
Дрожжи кормовые
|
1,0
|
+
|
+
|
+
|
|
Кукурузная мука
|
1,5
|
+
|
+
|
+
|
|
Аммоний сернокислый
|
0,15–0,2
|
+
|
–
|
+
|
|
Диаммонийфосфат
|
0,15–0,2
|
–
|
+
|
–
|
|
Калий фосфорнокислый
(1- или 2-замещенный)
|
0,15–0,1
|
+
|
–
|
+
|
|
Натрий хлористый
|
0,2
|
+
|
–
|
–
|
|
Магний сернокислый
|
0,1
|
+
|
+
|
+
|
|
Мел
|
0,15
|
+
|
+
|
–
|
|
Кальций хлористый
|
0,15
|
–
|
–
|
+
|
Среды производственного состава используются при получении посевного материала на всех этапах накопления биомассы чистой культуры, начиная с качалочных колб. Исходную культуру рассевают и хранят в пробирках с мясо-пептонным агаром. Посевной материал накапливают в условиях асептики при температуре 30°С в течение 35–40 ч до образования спор. Величина рН питательной среды естественная (6,2–6,5), уровень аэрации – 0,5 м3/(м3 · мин). Количество посевного материала для засева производственной среды составляет около 0,0015% при титре 1,7 · 109 спор в 1 см3.
Выращивание культуры в производственном ферментаторе проводят в течение 36–42 ч при тех же параметрах процесса, что и в посевном аппарате.
При нормальном ходе ферментации через 18–20 ч в клетках образуются хорошо просматриваемые под микроскопом споры и кристаллы. Процесс заканчивают при содержании в КЖ значительного количества свободных спор и кристаллов (не менее 10%). Готовую КЖ передают в предварительно простерилизованные сборники.
Процесс ферментации может быть реализован в непрерывно-циклическом режиме, который заключается в следующем: проводят периодическую ферментацию с соблюдением оптимальных параметров до рассыпания культуры на споры и кристаллы. При освобождении ферментатора в нем оставляют около 1% культуральной жидкости, которая выполняет роль посевного материала, и ферментацию повторяют без межцикловой подготовки ферментатора к работе. Основное требование – сохранить синхронность в развитии культуры. Для этого оставшийся в аппарате от предыдущей ферментации посевной материал подвергают тепловой обработке путем подачи первой порции питательной среды с температурой около 100°С. В результате вегетативные клетки и фаг инактивируются, а споры, выдержавшие тепловую обработку, служат посевным материалом для следующей операции. При таком способе ферментации оборот ферментатора значительно сокращается и составляет около 40 ч вместо 60 ч в периодическом режиме. Однако повторить этот процесс возможно не более 8–10 раз.
Для выделения спор и кристаллов из культуральной жидкости используют центрифугирование в бактофугах. Основной формой выпускаемых препаратов являются смачивающиеся порошки. Процесс сушки, помола, стандартизации и фасовки порошков является длительным и энергоемким. При использовании препаратов необходимо готовить водные суспензии порошков, которые долго набухают, оседают на дно емкостей и забивают распыливающие устройства. В настоящее время более перспективной и экономически выгодной формой бактериальных препаратов считается стабилизированная паста. Получить ее проще и дешевле. Общая схема производства бактериальных препаратов выглядит следующим образом (рис. 10.1).
Рис. 10.1. Общая схема получения бактериальных энтомопатогенных препаратов
К концу ферментации рН среды повышается до 8,0–8,5. В щелочной среде кристаллы токсина могут дробиться на более мелкие, которые уносятся с фугатом при последующем центрифугировании. В связи с этим рН культуральной жидкости понижают до 6,0–6,2. В процессе центрифугирования происходит дальнейшее высвобождение спор и кристаллов из клеток (титр культуры в пасте должен составлять около 20 млрд. спор в 1 г). Полученную пасту выдерживают в сборнике при перемешивании в течение 30 мин и отбирают пробу для определения титра, вирулентности, наличия фага. При наличии большого количества спор, не освобожденных от клеточной оболочки, длительность выдержки при температуре 30°С увеличивают до 6 ч. Фугат может быть использован в 2–3 циклах для приготовления питательной среды (при длительном использовании фугата накапливаются вещества, тормозящие развитие культуры). Технологическая схема производства пастообразного продукта представлена на рис. 10.2.
Препарат применяют путем опрыскивания растений 0,5–1,0%-ной водной суспензией в период активного питания вредителей. Исследования показали, что фугат может быть эффективно использован в составе питательной среды для культивирования кормовых дрожжей, которые в свою очередь являются компонентом среды для выращивания B. thuringiensis. Это обстоятельство свидетельствует о возможности создания малоотходного производства бактериальных препаратов при размещении его на территории дрожжевого завода.
Рис. 10.2. Технологическая схема получения бактериальных энтомопатогенных препаратов: 1 – емкость для приготовления питательной среды; 2 – фильтр сетчатый; 3 – нагревательная колонка; 4 – выдерживатель; 5 – холодильник; 6 – ферментатор; 7 – индивидуальный фильтр для очистки воздуха; 8 – циклон-каплеотделитель; 9 – сборник культуральной жидкости; 10 – бактофуга; 11 – сборник отработанной культуральной жидкости; 12 – сборник пасты
10.2. Грибные энтомопатогенные препараты
Грибы способны поражать насекомых-вредителей, вызывая у них заболевания – микозы. В сравнении с энтомопатогенными бактериями и вирусами обладают рядом особенностей:
- поражение происходит не через пищеварительный тракт, а через поверхность (кутикулу);
- насекомое поражается в фазе куколки;
- грибы отличаются огромной репродуктивной способностью, в виде спор могут длительное время находиться в природных условиях;
- высокая специфичность в поражении отдельных видов насекомых, причем вирулентность зависит от штамма гриба (для данного насекомого).
Воздействие грибного препарата начинается с проникновения споры в полость тела через поверхность. Спора прорастает, пускает мицелиальные ростки в тело насекомого. Гифальные тельца и конидии гемолимфой разносятся по телу насекомого. Уже на этой стадии возможно поражение насекомого из-за выделения некоторыми штаммами грибов токсинов. При недостатке токсина мицелий заполняет тело насекомого, поражает мышечную ткань, внутренние органы, разрушая их. Продолжительность периода от прорастания конидий до гибели насекомого – 2–8 суток.
Для промышленного использования наиболее пригодны Beauveria bassiana – возбудитель белой мускардины, поражающий 60 видов насекомых и B. tenella (поражает 10 видов насекомых (жуков)).
Освоено промышленное производство грибного энтомопатогенного препарата Боверина, содержащего конидиоспоры гриба B. bassiana. Препарат получают в виде порошка кремового цвета, содержащего 1,5–6,0 млрд конидий в 1 г. Помимо спор гриб продуцирует активный токсин – боверицин. Препарат безвреден для животных, человека и растений.
Боверин получают глубинным и поверхностным культивированием гриба. Однако при глубинном культивировании главная задача – обеспечить образование конидиоспор, поскольку в жидкой среде гриб размножается вегетативно, образуя только гифальные тельца, которые называют гонидиями. Гонидии менее устойчивы к термическому воздействию при сушке препарата и менее вирулентны. Подбором состава питательной среды можно обеспечить переход 90–92% клеток в конидиоспоры.
Исходный штамм размножают в пробирках с агаризованным пивным суслом или средой Сабуро при 25–28°С, культивируют в течение 3–4 сут. в качалочных колбах, затем в инокуляторе. На всех стадиях культивирования используется питательная среда одного и того же состава: дрожжи кормовые нелизированные – 2%; крахмал – 1%; NaCl – 0,2%; MnCl2 – 0,01%; CaCl2 – 0,05%. Последний (CaCl2) обеспечивает устойчивость конидиоспор к неблагоприятным факторам. Величина рН среды – естественная (5,0–5,6). Продолжительность культивирования спорового посевного материала в инокуляторе – 25–28 ч, продолжительность культивирования в основном ферментаторе – 3–4 сут. в асептических условиях. Уровень аэрации в зависимости от используемого штамма колеблется в пределах 1–1,5 об/(об·мин). На эффективность процесса ферментации сильно влияет содержание в среде аминного азота: его недостаток снижает скорость роста культуры, избыток способствует значительному образованию гонидий.
Присутствие в среде белковых веществ способствует образованию конидий в условиях глубинного культивирования. Титр образовавшихся конидиоспор в зависимости от природы штамма варьируется в пределах 0,3–1,3 млрд в 1 см3. Культура на 90–92% представлена конидиоспорами. КЖ подвергают центрифугированию или фильтрации с получением пасты влажностью 70–80% с титром спор 6–8 млрд., которую направляют на сушку распылением или сублимацией. Сухой продукт имеет влажность до 10% и титр 8 · 109 конидий в 1 г. Стандартизацию продукта осуществляют каолином.
Гриб можно выращивать поверхностным культивированием (что менее экономично) на жидких средах (отвары свеклы, картофеля, зерна, тыквы и т. д.) или на твердых (картофель, морковь, корки арбуза и т. д.). Продолжительность культивирования на твердых средах – 12–15 суток.
Боверин применяют против листогрызущих вредителей сада, леса. Наибольший эффект дает применение боверина против колорадского жука.
Безопасность соединений, продуцируемых энтомопатогенными грибами, изучена недостаточно. Имеются данные о токсичности этих грибов для животных и человека. Некоторые метаболиты B. bassiana и других грибов (Aspergillus) обладают канцерогенными свойствами. Практически нет данных о сохранении энтомотоксинов в окружающей среде (предполагается, что они утилизируются микроорганизмами).
10.3. Вирусные энтомопатогенные препараты
К настоящему времени известно более 450 вирусов насекомых, многие из которых хорошо изучены и перспективны в качестве агентов, подавляющих жизнедеятельность вредных насекомых. Основным преимуществом вирусных препаратов является ярко выраженная видоспецифичность и, следовательно, безопасность для других насекомых, птиц, животных и человека. Вирусы устойчивы к температурным воздействиям окружающей среды, колебаниям влажности, могут сохраняться вне насекомых длительное время (до 10–15 лет). Трудности получения вирусных препаратов состоят в том, что вирусы размножаются только в живой ткани.
Наиболее изучены и перспективны для практического применения бакуловирусы. Эта группа вирусов характеризуется палочковидными вирионами (греч. «бакулум» – палочка). Бакуловирусы размножаются преимущественно в теле насекомых. По морфологии делятся на две подгруппы: вирусы ядерного полиэдроза (ВЯП) и вирусы гранулеза (ВГ). ВЯП отличаются тем, что вирусные частицы заключены в белковые включения типа многогранников (полиэдров). Полиэдры могут включать более 100 вирионов, имеют размеры до 15 мкм, видимы в световой микроскоп. ВЯП развиваются в ядрах клеток. Подгруппа полиэдрозов наиболее многочисленна. Вирусы гранулеза отличаются тем, что вирионы по одному (редко по два) заключены в гранулу (капсулу) овальной формы. Развитие ВГ также начинается в ядре клетки, но после разрыва мембраны ядра продолжается и в цитоплазме.
Поглощенные насекомым тельца-включения растворяются в кишечнике хозяина при щелочной реакции среды. Заключенные в тельца-включения вирионы высвобождаются, проникают через стенки кишечника в восприимчивые клетки, в ядрах которых происходит репликация вирусов. Высвобождаясь, вирусы заражают другие клетки.
Разработан ряд вирусных препаратов для борьбы с насекомыми: вирин-ГЯП – против яблонной плодожорки, вирин-КШ – против кольчатого шелкопряда, вирин-ЭНШ – против непарного шелкопряда, вирин-КС – против капустной совки и др. Достоинствами вирусных препаратов являются высокая специфичность и отсутствие возникновения устойчивых популяций, поскольку бакуловирусы развиваются вместе с насекомыми и преодолевают их защитные механизмы. Эти препараты устойчивы при хранении (сохраняют активность на протяжении 10–15 лет), при их применении возникают эпизоотии, поэтому нет необходимости обрабатывать большие территории, что делает препараты экономными в использовании.
Производство вирусных препаратов начинается с массового разведения насекомого-хозяина на искусственной среде. Инокулят получают от больных личинок. На определенной стадии развития насекомых заражают, добавляя вирусную суспензию в корм. Через 7–9 суток погибших гусениц собирают, подсушивают при температуре 33–35°С и измельчают. Измельченную массу обрабатывают водой, взвесь фильтруют. Вирионы (одиночные капсулы или тельца-включения) осаждают из фильтрата центрифугированием. Одна зрелая гусеница может дать около 36 млрд телец-включений, что составляет около 30% ее сухой массы. Вирусные препараты могут быть приготовлены в виде дустов, суспензий и масляных форм. При производстве вирина-ЭНШ вирионы из фильтрата осаждают ацетоном (4 : 1 по объему) и высушивают до полного удаления ацетона. Высушенный осадок стандартизируют каолином до получения требуемого титра.
Для получения масляной формы препарата осадок смешивают с 50%-ным глицерином и с таким же объемом солярового масла (титр 1 млрд в 1 см3), перемешивают и разливают во флаконы. Масло и глицерин должны быть стерильными. Вирусные препараты используют либо путем однократного внесения небольших количеств в популяцию насекомых (возникает эпизоотия – вспышка болезни), либо обработкой зараженных участков путем опрыскивания или опыления в период формирования личинок или на ранних фазах их развития.
Перспективность и эффективность вирусных инсектицидов не вызывает сомнения, но для широкого распространения препаратов необходим строгий и постоянный контроль их качества, что обусловлено следующими причинами.
Энтомопатогенные вирусы нарабатывают in vivo – путем размножения вируса в живом организме насекомого-вредителя. Поэтому в препараты вирусных инсектицидов могут попадать все присущие насекомому микроорганизмы.
Среди насекомых широко распространено латентное вирусоносительство, в результате чего вирусное заражение гусениц может индуцировать латентный вирус, присущий данной популяции насекомых. Как правило, этот вирус имеет более низкую инсектицидную активность, и в процессе его размножения снижается активность получаемого продукта. В то же время в популяции насекомых могут присутствовать разные вирусы, и существует опасность рекомбинации между ними, что может привести к нежелательным последствиям.
Следовательно, необходимы строгие критерии и параметры контроля качества вирусного инсектицида на всех этапах его получения и применения против насекомых-вредителей в полевых условиях.
В связи с этим для размножения вирусов используют чистый вирусный инокулят и популяции только здоровых насекомых, предварительно исследованных на отсутствие опасных патогенов.
Применение вирусных инсектицидов предполагает внесение в экосистему громадного количества инфекционных вирусных частиц, что требует предельной осторожности. Не исключено появление мутантных форм вируса с измененной вирулентностью или иным спектром хозяев. Нельзя не учитывать повышение восприимчивости человека к вирусной инфекции, связанное с иммунодепрессией при высоком вирусном фоне. Возможно также аллергическое действие самого вируса или частиц насекомого-хозяина. Особую опасность представляет канцерогенное действие вирусов. Указанные факторы ограничивают масштабы практического применения вирусных энтомопатогенных препаратов.
XI. БАКТЕРИАЛЬНЫЕ УДОБРЕНИЯ
Для обеспечения высокой урожайности растений в почву вносится огромное количество органических и минеральных удобрений, вместе с которыми в почву попадают токсичные для человека и животных элементы и соединения (фтор, тяжелые металлы, нитриты, мышьяк и др.). Больше всего почвы нуждаются в соединениях азота, который в то же время является основным компонентом воздуха. Попытки генетиков придать растениям способность к фиксации атмосферного азота не привели к успеху. В связи с этим исключительно важна роль микроорганизмов-азотфиксаторов, на основе которых производятся альтернативные химическим бактериальные удобрения, представляющие собой препараты живых клеток бактерий.
К фиксации атмосферного азота способны развивающиеся в симбиозе с бобовыми растениями клубеньковые бактерии рода Rhizobium, свободноживущие аэробные бактерии Azotobacter и анаэробные бактерии Clostridium. В производстве бактериальных удобрений используют ризобактерии и азотобактерии, которые являются основой наиболее широко применяющихся в сельском хозяйстве препаратов – ризоторфина и азотобактерина.
Ризобактерии – это грамотрицательные палочки (при старении округляются) размером (0,5–0,9)×(1,2–3,0) мкм, аэробные, бесспоровые, размножаются делением. Подразделяются на быстрорастущие (бактерии гороха, клевера, фасоли, люцерны) и медленнорастущие (бактерии люпина, сои, арахиса и др.). Обладают видовой специфичностью по отношению к бобовым растениям: R. japonicum – соя, R. leguminosarum – горох, R. lupini – люпин, R. phaseoli – фасоль, R. trifolii – клевер.
Ризобактерии проникают в корни бобовых и вызывают образование клубеньков, внутри которых они развиваются как внутриклеточные симбионты и фиксируют атмосферный азот. По отдельности ни бобовые растения, ни бактерии Rhizobium не могут усваивать азот, это свойство возникает при их взаимодействии. В образовании из молекулярного азота аммиака участвует фермент нитрогеназа, который активен лишь в анаэробных условиях. В то же время ризобактерии являются строгими аэробами. Условия для действия нитрогеназы создаются с помощью железосодержащего пигмента – леггемоглобина, который, как и гемоглобин крови, обратимо связывает молекулярный кислород. Образование леггемоглобина бобовыми наблюдается только в клубеньках (чем краснее клубеньки, тем больше в них леггемоглобина и тем интенсивнее идет фиксация азота).
Леггемоглобин связывается с молекулярным кислородом так, что нитрогеназа не ингибируется, но связанный кислород доступен в дыхательных центрах в цитоплазме клеток хозяина. Некоторые растения-хозяева способны «сотрудничать» с широким спектром ризобактерий, тогда как другие – высокоспецифичны.
Оптимальная температура для развития ризобактерий – 28–30°С, величина рН среды – 6,5–7,5.
Размножают клубеньковые бактерии на агаризованной среде, содержащей 100 г/дм3 отвара гороха и 10–20 г/дм3 сахарозы (для быстрорастущих клубеньковых бактерий (БКБ)). Для медленнорастущих клубеньковых бактерий (МКБ) агаризованная среда отличается тем, что содержит не сахарозу, а смесь сахарозы и глюкозы в соотношении 1 : 1. Питательная среда для качалочных колб и производственного ферментатора имеет один и тот же состав (г/дм3): сульфат аммония – 0,5; фосфат калия однозамещенный и фосфат калия двузамещенный – по 0,5; сульфат магния – 0,2; углекислый кальций – 1,0; кукурузный экстракт или отвар гороха – 7–10; сахароза – 20 (для БКБ) или глюкоза в том же количестве для МКБ. Продолжительность культивирования ризобактерий в качалочных колбах 36–48 ч для БКБ и до 72 ч для МКБ. В производственных ферментаторах биомассу ризобактерий накапливают в условиях асептики при указанных ниже режимных параметрах (таблица).
Условия производственного культивирования ризобактерий
|
Бактерии
|
Температура
процесса, °С
|
Уровень аэрации,
м3/(м3 · мин)
|
Продолжительность
ферментации, ч
|
Титр КЖ,
млрд/см3
|
|
БКБ
|
28–30
|
0,8–1,2
|
40–48
|
8–9
|
|
МКБ
|
28–30
|
0,5–1,0
|
60–72
|
3–4
|
Культуральную жидкость при хранении захолаживают до температуры 10–15°С. В производстве ризоторфина в качестве наполнителя используют кислый или слабокислый торф (рН 3,0–6,0). Предварительно торф подсушивают до влажности 25–30%, добавляют мел до рН 6,8–7,0, размалывают до размера частиц не более 0,1 мм и расфасовывают в полиэтиленовые пакеты по 150–160 г с заполнением пакета на 40–50% (для газообмена). Толщина пленки пакета не более 100 мкм (обеспечивает газообмен). Заполненные пакеты стерилизуют γ-излучением радиоактивного кобальта (термическая стерилизация непригодна). В каждый пакет через полую иглу диаметром 5–8 мм вводят 50–60 см3 культуральной жидкости. Инокуляцию проводят в стерильном боксе. Место прокола заклеивают липкой лентой. Содержимое пакетов усредняют во вращающемся барабане. Влажность препарата в пакете – 55–60%. Титр клеток ризобактерий 0,5–1,5 млрд/г. В препарате бактерии продолжают расти в течение 4–5 недель, после чего численность жизнеспособных клеток снижается, если не выдерживать продукт при 4°С и ниже. Для поддержания высокого титра жизнеспособных клеток содержимое пакета обогащают легкоусваиваемым субстратом: вводят 3–5% мелассы в виде стерильного 80%-ного раствора для БКБ или 2,5% глюкозы в виде стерильного 40%-ного раствора для МКБ.
Препараты БКБ хранят при температуре 5–10°С, препараты МКБ – при 12–15°С. Продолжительность хранения в указанных условиях – до 6 месяцев. Ризоторфин вносят в почву во время сева в смеси с семенами (после тщательного перемешивания). Доза препарата – 200 г на 1 га (содержимое пакета – одна га-порция). При прорастании семян значительная часть клеток ризобактерий гибнет. Противостоять этому может только высокий титр клеток в препарате. Производство ризоторфина сезонное, число рабочих дней в году – 180.
Разработана технология получения препарата «сухой нитрагин» из культуральной жидкости, содержащей ризобактерии. Для этого биомассу бактерий отделяют в бактофугах с получением пастообразного концентрата, в который вводят криопротектор (20% мелассы и 1% тиомочевины) и обезвоживают в сублимационной сушилке при 30°С под разрежением из замороженного состояния до остаточной влажности 2–5%. Высушенную биомассу размалывают в шаровых мельницах и смешивают с наполнителем (торф, бентонит) с получением сухого препарата, содержащего 9–10 млрд клеток клубеньковых бактерий в 1 г.
Азотобактерин – препарат на основе клеток аэробной бесспоровой свободноживущей почвенной бактерии Azotobacter chroococcum, фиксирующей атмосферный азот.
Молодые клетки имеют вид коротких палочек с закругленными концами. При старении клетки покрываются слизью, которая переходит в защитную капсулу. Бактерии чувствительны к содержанию в среде фосфора. Недостаток его резко замедляет развитие бактерий и снижает азотфиксацию. Стимулируют азотфиксирующую активность бактерий соединения молибдена.
Технология производства препаратов азотобактерина аналогична технологии получения ризоторфина и сухого нитрагина. При использовании в качестве наполнителя торфа его обогащают суперфосфатом (0,1–0,2%).
Эффект действия азотобактерина на растения связан не только с процессом азотфиксации и улучшения азотного питания растений, но и с обогащением почвы биологически активными соединениями, синтезируемыми бактериями (витамины группы B, аминокислоты). Однако эти бактерии активно развиваются только в плодородных почвах.
Микробиологическая промышленность производит также бактериальный препарат фосфоробактерин на основе спор Bacillus megaterium var. phosphaticum. В почве эти бактерии трансформируют сложные фосфорорганические соединения (нуклеиновые кислоты, нуклеопротеины и др.), а также трудноусваиваемые минеральные фосфаты в доступную для растений форму. Фосфоробактерин не может заменить фосфорные удобрения и не действует при их отсутствии. Препарат стимулирует рост растений и за счет обогащения почвы биологически активными веществами.
XII. ВИТАМИНЫ
Биологическая роль витаминов определяется их каталитическим, некоферментным и антимутагенным действием. Многие витамины (практически все витамины группы В) входят в состав коферментов различных ферментов, например, витамин В2 – в состав коферментов ФАД, ФМН, витамин В5 – в состав НАД и НАДФ, витамин В3 – в состав КоА и т. д.
Некоферментные функции витаминов заключаются в участии их в регуляции синтеза нуклеиновых кислот и белков, в формировании структуры клеточных мембран. Важное значение имеет антимутагенное действие витаминов С, Е (α-токоферола) и β-каротина (провитамина А). Они могут нивелировать как спонтанные мутации, так и мутации, индуцированные ионизирующими излучениями и канцерогенами. В природе источником витаминов являются главным образом растения и микроорганизмы. Животные получают витамины с пищей, а также в результате жизнедеятельности микроорганизмов кишечника.
Организм человека многих витаминов не синтезирует.
Мировой рынок витаминов составляет более 70 тыс. т в год. Около 50% от общего объема производства составляет витамин С. Ведущее место в производстве витаминов занимает швейцарский концерн «Hoffman La Roche», на долю которого приходится 50–70% от общего объема производства витаминов.
Большая часть витаминов производится химическим синтезом. Микробиологическим путем получают витамины В2, В12, D2, С (стадия биотрансформации D-сорбита в L-сорбозу), β-каротин.
12.1. Технология кормового препарата витамина В12
Витамин В12 имеет самое сложное строение среди неполимерных соединений. Его молекула включает корриновое кольцо из четырех пятичленных азотсодержащих гетероциклов, связанных с атомом кобальта четырьмя координационными связями. Все разнообразие аналогов витамина В12 обусловлено природой верхнего и нижнего лигандов атома кобальта. В истинном витамине В12 (цианкобаламине) верхним лигандом является цианогруппа. Ее место могут занимать другие заместители: группа -ОН – оксикобаламин, -СН3 – метилкобаламин, 5-дезоксиаденозил – аденозилкобаламин и др. При этом образуются производные витамина, обладающие биологической активностью для животных и человека.
Нижним лигандом атома кобальта в молекуле витамина В12 является специфическое азотистое основание – 5,6-диметилбензимидазол (5,6-ДМБ), которое в природе встречается только в этом соединении. Непосредственным предшественником 5,6-ДМБ является рибофлавин. Наличие 5,6-ДМБ определяет биологическую активность корриноидов. Микроорганизмы могут синтезировать производные витамина, содержащие в качестве нижнего лиганда другие заместители: 5-оксибензимидазол (производное имеет название фактор III), 5-метоксибензимидазол (фактор IIIm), метиладенин (фактор А), аденин (псевдовитамин В12). Нижний лиганд может отсутствовать (фактор В). Биологической активностью обладают лишь формы, содержащие в качестве нижнего лиганда 5,6-ДМБ. В меньшей степени биологически активны фактор III и фактор IIIm. Псевдовитамин В12 и фактор А активностью не обладают.
Промышленным способом получения витамина В12 является микробиологический синтез (химический синтез осуществлен, но отличается большой сложностью). В природе корриноиды обнаруживают в растениях, развивающихся в симбиозе с азотфиксирующими бактериями. Происхождение этих корриноидов окончательно не установлено. Организм животных и человека не способен к самостоятельному синтезу витамина В12. Не образуют корриноиды дрожжи и мицелиальные грибы. Способность к биосинтезу корриноидов широко распространена среди прокариот.
Путь биосинтеза витамина В12 известен. Общим интермедиатом на начальном этапе биосинтеза корриноидов является аминолевулиновая кислота, которая образуется у большинства микроорганизмов в результате конденсации глицина и янтарной кислоты в виде сукцинил-КоА.
Препараты витамина В12 широко применяются в медицине (лечение лучевой болезни, злокачественного малокровия, болезни Боткина, дистрофии, язвы желудка и т. д.), а также для обогащения кормов (улучшают усвоение белка и повышают прирост массы животных на 10–15%).
Мировое производство витамина В12 составляет около 10 т в год, из которых 6,5 т направлено на медицинские цели. В промышленном производстве в качестве продуцентов витамина В12 используют пропионовокислые бактерии (Propionibacterium shermanii), актиномицеты (Nocardia rugosa), термофильные (реже мезофильные) метаногенные бактерии.
Кормовой препарат витамина В12 для нужд животноводства получают термофильным метановым сбраживанием жидких отходов микробиологического производства органических растворителей – ацетоно-бутиловой и спиртовой барды, содержащей сухих веществ 2,2–2,6% и 6,0–8,0% соответственно. В состав сухих веществ барды входят белки, аминокислоты, углеводы, летучие жирные кислоты, витамины, неорганические соединения.
Для метанового брожения применяют декантат ацетоно-бутиловой барды (рис. 12.1). Осадок взвешенных веществ, содержащий мертвые клетки продуцентов ацетона и бутанола, используют в качестве кормовой добавки. Декантированную барду охлаждают от 100 до 55–57°С (температура метанового сбраживания). Выход корриноидов значительно увеличивается при добавлении к барде метанола (5 кг/м3) и хлорида кобальта (5 г/м3). Непрерывное сбраживание барды осуществляют в железобетонных метантенках объемом 2000–4000 м3 по одно- или двухступенчатому режиму. При термофильном метановом брожении в анаэробных условиях развивается биоценоз бактерий, осуществляющих сложный взаимосвязанный процесс расщепления органических веществ до СО2 и СН4. Можно выделить четыре основные группы бактерий: гидролизующие (расщепляют биополимеры), углеводсбраживающие, сульфатвосстанавливающие и метанобразующие.
В первой фазе процесса развиваются бактерии-аммонификаторы (разлагают белки, пептиды, аминокислоты до жирных кислот и аммиака) и бродильщики. В результате образования аммиака и нейтрализации жирных кислот рН ферментационной среды повышается до 7,0–7,5. Наступает вторая фаза брожения, в которой интенсивно развиваются сульфатвосстанавливающие и метанобразующие бактерии.
В производственных условиях метановое брожение целесообразно осуществлять в двух последовательно соединенных метантенках (по двухступенчатому режиму), что приводит к специализации бактерий, развивающихся в аппаратах первой и второй ступеней, в соответствии с фазами брожения и к сокращению продолжительности процесса с 3,0–3,5 сут. (сбраживание в одну ступень) до 2,5–3,0 сут. (две ступени сбраживания). Процесс метанового брожения протекает устойчиво и не нуждается в условиях асептики.
В сброженном растворе накапливается 4–5 г/м3 корриноидов, из которых в среднем 50% приходится на истинный витамин В12, 30% – на фактор III. Установлено, что группа метанобразующих бактерий синтезирует около 75% витамина В12 от общего количества.
Видовая принадлежность анаэробных бактерий, продуцирующих витамин В12, окончательно не установлена. Подтверждена продукция корриноидов метанобразующими бактериями Methanosarcina barkeri, Methanobacterium formicum.
Рис. 12.1. Технологическая схема получения кормового концентрата витамина В12 из послеспиртовой барды: 1 – сборник барды; 2 – поверхностный конденсатор; 3 – декантатор; 4 – сборник декантата; 5 – теплообменник; 6 – анаэробный реактор; 7 – стабилизатор бражки; 8 – теплообменник; 9 – газоотделитель; 10 – газгольдер
Установлено, что кокковые формы, составляющие 8–10% от всех бактерий, синтезируют примерно 65% корриноидов, а палочки (90– 92%) продуцируют остальные 35%.
В процессе брожения образуется биогаз (в среднем 20 м3 на 1 м3 жидкой среды), имеющий следующий усредненный состав (%): СН4 – 65, СО2 – 30, Н2 и Н2S – 5.
Сброженная барда имеет величину рН 7,5–8,0. В щелочной среде витамин В12 неустойчив, поэтому для стабилизации витамина метановую бражку подкисляют до рН 5,5–6,0 и вводят в нее 0,2–0,3% сульфита натрия. Перед подачей на упаривание для обеспечения безопасности процесса бражку подвергают дегазации нагреванием в теплообменнике до 90–95°С с последующим отделением газов в объемном сепараторе. Дегазированную бражку сгущают до 20% сухих веществ упариванием в трех- или четырехкорпусных вакуум-выпарных установках. Концентрат высушивают в распылительной сушилке при температуре теплоносителя на входе в сушилку 280°С. Продукт – кормовой препарат витамина – представляет собой порошок коричневого цвета и содержит витамин В12 в количестве не менее 100 мг/кг, а также сырой протеин – не менее 25%.
Витамин В12 для медицинских целей получают культивированием бактерий Propionibacterium shermanii периодическим методом при температуре 28–30°С в анаэробных условиях с соблюдением правил асептики на питательной среде, содержащей глюкозу (40 г/л), кукурузный экстракт (40 г/л), сульфат аммония (2 г/л) и хлорид кобальта (0,005 г/л); рН среды – 6,8–7,0. Ферментация протекает в две фазы. В первой фазе продолжительностью 65–70 ч бактерии интенсивно размножаются с накоплением пропионовой и уксусной кислот, подлежащих нейтрализации, и предшественника витамина В12 – фактора В (без нижнего лиганда). На долю фактора В приходится более 80% от всех синтезированных корриноидов (остальное – цианкобаламин (8–10%), псевдовитамин В12 и фактор А).
Вторая фаза ферментации начитается с момента внесения в среду 5,6-ДМБ в количестве 10–20 г/м3, в результате чего происходит трансформация неактивных аналогов в истинный витамин В12. Продолжительность второй фазы – 24 ч. К концу процесса культуральная жидкость содержит около 30 мг/л витамина В12, накопленного в клетках бактерий.
Биомассу отделяют сепарацией и экстрагируют из нее витамин водой, подкисленной до рН 4,5–5,0, при температуре 85–90°С в течение часа. После отделения остатка биомассы раствор охлаждают, доводят рН до 6,8–7,0 и осаждают белки коагуляцией в присутствии Al2(SO4)3 или FeCl3. Осадок отделяют фильтрованием, а раствор витамина очищают на ионообменной смоле СГ-1, с которой витамин В12 элюируют водным раствором аммиака. Элюат упаривают и дополнительно очищают на колонке с окисью алюминия (очистка кобаламинов от аналогов). Элюируют витамин В12 водным ацетоном и кристаллизуют из раствора при температуре 3–4°С в течение 24–48 ч. Кристаллы промывают ацетоном, затем диэтиловым эфиром и сушат под вакуумом.
12.2. Технология кормового препарата витамина В2
Витамин В2 (рибофлавин) в промышленных условиях производят для кормовых целей. Продуцентами рибофлавина в природе являются высшие растения, дрожжи, мицелиальные грибы и бактерии. Большинство микроорганизмов образуют свободный рибофлавин и две его коферментные формы – ФМН и ФАД. Основной формой флавинов, синтезируемых микроорганизмами, является рибофлавин. Гетероциклическая система рибофлавина представлена тремя конденсированными циклами: ароматическим (А), пиразиновым (В) и пиримидиновым (С). К пиразиновому кольцу присоединен спирт рибит:

Рибофлавин – светочувствительное оранжево-желтое красящее вещество. Водные растворы рибофлавина флуоресцируют на свету, давая желто-зеленое окрашивание. Флуоресцирующая способность витамина используется при его количественном определении. Окислительно-восстановительные свойства флавинов обусловлены наличием в составе молекулы системы, способной к обратимому окислению и восстановлению:
С этим связана биологическая роль витамина В2, которую в клетках выполняют моно- и динуклеотидные формы рибофлавина.
Путь синтеза рибофлавина в микробных клетках установлен. Его предшественником является гуанозинтрифосфат.
Микроорганизмы, как правило, синтезируют рибофлавин в больших количествах, чем необходимо для удовлетворения потребности клетки. Например, дрожжеподобные грибы синтезируют до 6 г/дм3 рибофлавина, в то время как потребность в нем не превышает 0,1 мг/дм3. Высокой рибофлавинпродуцирующей способностью отличаются дрожжеподобные грибы Eremothecium ashbyii (до 2,5 г/дм3 витамина В2) и Ashbya gossypii (до 6 г/дм3), применяемые в промышленном производстве витамина В2.
Для большинства микроорганизмов выход рибофлавина увеличивается при дефиците железа в среде. Предполагают, что ионы железа участвуют в регуляции синтеза рибофлавина. Однако для штаммов-сверхсинтетиков E. ashbyii и A. gossypii дефицит железа не влияет на рибофлавинсинтетическую активность. Считают, что указанные продуценты рибофлавина являются природными мутантами с нарушенной регуляцией синтеза витамина.
Получены мутантные штаммы бактерий Bacillus subtilis, способные синтезировать витамин В2 в количестве до 6 г/дм3. В отечественной практике используют гриб Eremothecium ashbyii. Колонии гриба имеют оранжевый цвет. Интенсивность окраски колоний коррелирует с рибофлавин-синтетической способностью. Недостаток культуры – нестабильность при хранении. Гриб легко теряет способность к сверхсинтезу витамина, поэтому осуществляют систематический отбор наиболее интенсивно окрашенных колоний. Культура A. gossypii (применяется за рубежом) более стабильна, хорошо развивается, используя в качестве источника углерода углеводы (глюкозу, сахарозу), но лучше всего – соевое и кукурузное масло.
Рибофлавин накапливается в мицелии в виде желтых кристаллов, а к концу ферментации около 80% рибофлавина выходит из клеток в результате автолиза.
Гриб E. ashbyii после шести дней роста образует на дрожжевой агаризованной среде (дрожжевой экстракт 0,2–0,4%, пептон 0,3%, глюкоза 1%) ярко-оранжевые колонии диаметром 5–8 мм. На соевой агаризованной среде (мука соевая 4,0%, сахароза 2,0%) колонии гриба имеют диаметр 17–25 мм. Для получения посевного материала отбирают типичные колонии с интенсивной окраской. В качестве субстрата для получения спорового материала используют подготовленное пшено высшего качества. Флаконы со стерильным пшеном засевают суспензией (смыв культуры с агаризованной среды) и инкубируют при температуре 30°С в течение 8–9 сут. Пшено после прорастания гриба приобретает ярко-желтый цвет. Полученный посевной материал хранят в темноте при комнатной температуре.
Материалом из флакона засевают качалочные колбы и выращивают культуру 10–14 ч. В качалочных колбах и посевных аппаратах используется среда, содержащая кукурузный экстракт 2%, сахарозу 1%, фосфат калия 0,1% и технический жир 0,5%. Величина рН среды – 6,8–7,2. Продолжительность ферментации в посевных аппаратах – 24–27 ч при температуре 28–32°С и уровне аэрации 50–60 м3/(м3 · ч).
Среда для производственной ферментации содержит соевую муку, кукурузный экстракт, мел, технический жир. В первые сутки культивирования гриб накапливает биомассу, а затем переходит к спорообразованию. В этот период интенсивно синтезируется рибофлавин. Примерно с 60-го часа ферментации начинается автолиз культуры и переход рибофлавина в среду. Продолжительность ферментации – 65–68 ч, процесс проводят в условиях асептики.
Культуральную жидкость стабилизируют подкислением до значения рН 4,5–5,0, упаривают под вакуумом до содержания сухого вещества 18–20%, концентрат высушивают распылением в мягких условиях (температура сушильного агента на входе в сушилку – 150–160°С). Продукт содержит 20–40 г витамина на 1 кг препарата.
Примерно 70% рибофлавина, произведенного в мире, получают путем химического синтеза из рибозы.
12.3. Микробиологический синтез β‐каротина
Ежегодно в природе образуется около 100 млн т каротиноидов. Значительная их часть содержится во фруктах, овощах, чем объясняется их разнообразная окраска. Известно более 400 природных каротиноидов. Биологически активны лишь 10, среди которых β-каротин, являющийся провитамином ретинола (витамина A). В организме человека β-каротин подвергается ферментативному окислительному расщеплению с образованием витамина A. На обоих концах молекулы β-каротина, включающей алифатическую цепь с 11 двойными связями, имеются кольцевые структуры β-ионона, обусловливающие провитаминную активность. Из одной молекулы β-каротина образуется две молекулы витамина A.
Каротиноиды синтезируются растениями и микроорганизмами, но не синтезируются в организмах животных и человека. Основной функцией каротиноидов в клетках считают протекторную – защиту клеток от фотодинамического действия света, ионизирующей радиации. Потребность человека в витамине А – 1,5–2,0 мг/сут. При его дефиците развивается ночная слепота.
В недалеком прошлом β-каротин получали исключительно экстракцией из растительного сырья (морковь, тыква, мука люцерны). Из-за низкого выхода продукта (из 1 т моркови можно получить 60– 65 г каротина) этот метод в настоящее время утратил свое значение.
В мировой практике преобладают химические методы синтеза как самого витамина А, так и β-каротина (исходное сырье – β-ионон, процесс включает 12–15 стадий), с которыми все успешнее конкурирует микробиологический синтез.
Мировое производство препаратов β-каротина оценивается в 5–10 тыс. т в год.
Области использования препаратов β-каротина:
- пищевой краситель для окрашивания кремов, сыра, маргарина, макаронных изделий и т. д.;
- кормовая добавка в животноводстве и птицеводстве;
- лечебно-профилактические средства;
- косметическая промышленность.
В разбавленных растворах β-каротин, как и другие каротиноиды, чувствителен к нагреванию, свету, кислороду, кислотам, легко подвергается изомеризации.
При микробиологическом синтезе в качестве микроорганизмов-продуцентов, способных к сверхсинтезу каротина, используют гетероталлические микроскопические грибы (Blakeslea trispora, Phycomyces blakesleanus) и дрожжи (Rodotorula, Sporobolomyces, Cryptococcus). Основными промышленными продуцентами β-каротина являются различные штаммы гетероталлического гриба Blakeslea trispora. Гетероталлизм грибов выражен в образовании женского (+) и мужского (–) мицелия, при слиянии клеток которых образуются зиготы. Мицелий плюс-формы содержит больше β-каротина (окрашен в более яркую желтую окраску), чем мицелий минус-формы. Однако максимальное количество β-каротина накапливается в мицелии при совместном культивировании (+)-и (–)-форм (в 5–15 раз больше, чем при раздельном культивировании форм культуры). Высокопродуктивные штаммы Blakeslea trispora способны накапливать в культуральной жидкости до 3000–4000 мг/дм3 β-каротина (для сравнения: в 1 кг моркови содержится около 60 мг β-каротина). Образование β-каротина индуцируют триспоровые кислоты (выделены из культуральной жидкости B. trispora). Эти кислоты не включаются в молекулу каротина, но стимулируют синтез изменением активности ферментных систем клеток гриба. Наиболее эффективно стимулирует синтез β-каротина β-ионон. Он также не включается в молекулу β-каротина, а служит активатором процесса биосинтеза. β-ионон токсичен для гриба, но в присутствии растительных масел (соевое, подсолнечное, кукурузное) действует как стимулятор. Выход β-каротина возрастает в 1,5–2,0 раза при добавлении к питательной среде очищенного керосина. Вне клетки β-каротин малостабилен, поэтому в питательную среду вводят антиоксиданты (сантохин, аскорбиновую кислоту).
Гриб B. trispora может размножаться половым, бесполым и вегетативным путями. Половое размножение осуществляется при совместном выращивании (+)- и (–)-форм, бесполое размножение – спорами, вегетативное – фрагментами мицелия. При совместном выращивании (+)- и (–)-форм максимальная активность культуры зависит от их соотношения, которое определяется экспериментально для каждого штам- ма. В среднем соотношение (+)- и (–)-форм составляет 1 : 15.
Интенсивный биосинтез и накопление в клетках гриба β-каротина происходит главным образом во второй фазе развития культуры после прекращения роста мицелия.
Исходные культуры гриба представляют собой споровый или вегетативный материал раздельно хранящихся (+)- и (–)-форм.
Общая схема производства препаратов β-каротина представлена на рис. 12.2.
Рис. 12.2. Технологическая схема производства β-каротина микробиологическим синтезом
Состав питательной среды и условия культивирования для обеих форм гриба одинаковы (температура культивирования – 26–30°С, рН среды – 6,0–6,4, асептика, уровень аэрации – 60–70 м3/(м3·ч).
Жидкая среда в качалочных колбах содержит кукурузный экстракт, кукурузный крахмал, фосфат калия, тиамин. Питательная среда для производственной ферментации включает кукурузную муку, гидрол или глюкозу, соевое масло, тиамин, сантохин (или аскорбиновую кислоту). Через 40–48 ч роста культуры в ферментационную среду добавляют β-ионон (1 г/дм3), керосин (до 5 см3/дм3).
По окончании ферментации мицелий гриба инактивируют термообработкой, отделяют фильтрованием, высушивают под вакуумом, измельчают. Кормовой препарат содержит не менее 10 г/кг каротина и представляет собой порошок от оранжево-красного до красно-коричневого цвета.
Витамин С (L-аскорбиновая кислота) производят химическим синтезом из глюкозы по методу Райхштейна. На одной из стадий технологического процесса осуществляют биотрансформацию D-сорбита, полученного восстановлением глюкозы, в L-сорбозу с помощью бактерий Acetobacter xylinum, Acetobacter suboxydans или Glugonobacter oxydans. В условиях глубинного аэробного культивирования в течение 26–28 ч на среде, содержащей 10–20% сорбита и кукурузный экстракт, бактерии трансформируют D-сорбит с выходом L-сорбозы 90–96% от теоретического.
Предшественником витамина D2 является эргостерин (одноатомный полициклический спирт), который превращается в витамин D2 при облучении ультрафиолетовым светом с длиной волны 280– 300 нм. Эргостерин – основной стерин дрожжей, на который приходится 60–90% от общего количества стеринов. Дрожжи чаще всего содержат эргостерин в количестве 0,2–0,5% от сухой массы. Для промышленного производства эргостерина можно использовать дрожжи Saccharomyces cerevisiae, но наибольшее количество эргостерина (до 10% от сухой массы) накапливают дрожжи Saccharomyces carlsbergen- sis и Saccharomyces ellipsoideus.
Для получения кристаллического витамина D2 дрожжевую массу гидролизуют раствором HCl при 110°С. Гидролизованную массу после охлаждения фильтруют. Фильтрат упаривают до содержания в нем 50% сухих веществ и используют как концентрат витаминов группы B. Витамин D2 получают из массы, оставшейся после фильтрации. Массу промывают, сушат, измельчают и дважды экстрагируют этиловым спиртом при 78°С при соотношении этанол : масса = 3 : 1. Спиртовой экстракт упаривают до 70% СВ. Полученный липидный концентрат омыляют раствором NaOH, стерины при этом остаются в неомыленной фракции. При охлаждении раствора до 0°С выпадают кристаллы эргостерина. Очистку кристаллов производят двукратной перекристаллизацией из спиртового раствора (70%), кристаллы сушат, растворяют в эфире, облучают УФ-светом (перевод в D2), эфир отгоняют, витамин кристаллизуют. Препарат реализуют в виде масляного концентрата.
XIII. ПРОИЗВОДСТВО ЛИМОННОЙ КИСЛОТЫ
Микробиологическим синтезом получают различные органические кислоты: лимонную, уксусную, итаконовую, молочную, глюконовую, янтарную и другие, из которых в наибольших масштабах в мировой практике производят лимонную кислоту (около 400 тыс. т в год). Она широко применяется в пищевой, фармацевтической, текстильной (при окраске тканей) и химической промышленностях.
В природе лимонная кислота в значительных количествах содержится в цитрусовых. Способность к образованию лимонной кислоты на углеводных средах широко распространена среди мицелиальных грибов. Чаще всего в качестве продуцента лимонной кислоты в промышленных условиях используют мутантные штаммы Aspergillus niger. Разработан метод получения лимонной кислоты для технических целей культивированием дрожжей рода Candida (C. lipolytica, C. parapsilosis) на средах с н-парафинами нефти. При этом выход лимонной кислоты от н-парафинов составляет около 140%, а содержание в ферментационной среде – до 140 г/дм3.
Биосинтез лимонной кислоты связан с функционированием цикла Кребса: лимонная кислота образуется в результате конденсации оксало-ацетата и ацетил-КоА в присутствии цитратсинтазы. Необходимые для реакции оксалоацетат и ацетил-КоА образуются из двух молекул пирувата, одна из которых подвергается декарбоксилированию с образованием ацетил-КоА, вторая карбоксилируется, образуя оксалоацетат (рис. 13.1).
Рис. 13.1. Схема биосинтеза лимонной кислоты
Сверхсинтез лимонной кислоты мицелиальными грибами обеспечивается лимитированием роста грибов одним или несколькими минеральными компонентами среды (Fe, Mn, N, P), избыточным содержанием источника углерода и низкой величиной рН ферментационной среды. Гриб прекращает рост после полного поглощения из среды дефицитного элемента, но продолжает потреблять имеющийся в среде источник углерода. В клетках гриба накапливается лимонная кислота, которая не может метаболизироваться в цикле трикарбоновых кислот из-за ингибирования ряда ферментов (аконитазы, изоцитратдегидрогеназы и др.) и выделяется в окружающую среду.
Посевной материал Aspergillus niger получают в виде конидий. В производственных условиях посевной материал накапливают в кюветах площадью 10–12 дм2 на агаризованной среде следующего состава: пивное сусло, разбавленное до 7% по сахарометру; 1–2% NaCl, 0,1% мочевины, 0,001 мг% CuSO4, 2–3% агара.
Среду разливают в 10–20 алюминиевых кювет слоем толщиной 1,5 см, засевают конидиями с помощью пульверизатора и выдерживают в растильной камере 7–8 сут.
На поверхности среды развивается плотная мицелиальная пленка, покрытая конидиями. Пленку подсушивают в растильной камере при температуре 32°С в течение 1–2 сут. Кюветы просматривают в стерильном боксе и отбраковывают по морфологическим признакам (незрелое спороношение или инфекция). Конидии собирают с поверхности пленки отсасыванием воздуха специальным устройством (работающим по принципу пылесоса), подсушивают в термокамере при 28–30°С, а затем смешивают со стерильным активированным углем (марки КАД) в соотношении 1 : 2 и расфасовывают в стерильные колбы (или банки) емкостью 0,5–1,0 л, закрытые ватными пробками. Хранят посевной материал при комнатной температуре, избегая воздействия прямых солнечных лучей. Срок годности спорового материала – 6 месяцев.
При производстве лимонной кислоты применяют поверхностное или глубинное культивирование гриба-продуцента на мелассной среде. Меласса содержит большое количество микроэлементов (прежде всего железа), которые затормаживают кислотообразование. Поэтому мелассу обрабатывают желтой кровяной солью K4[Fe(CN)6] при кипячении раствора в течение часа. В результате соли железа и других тяжелых элементов осаждаются и удаляются из раствора, раствор стерилизуется. При поверхностном культивировании гриба Aspergillus niger Р-3 используют раствор мелассы с содержанием сахарозы 13-15%.
Стерильный раствор по пропаренным коммуникациям подается в кюветы прямоугольной формы размером 1,5×6,0 м (высота слоя жидкости в кювете – 12 см), расположенные в растильной камере. Каждая кювета имеет внизу штуцер для подачи и слива раствора. Штуцера всех кювет соединены с расположенным вне камеры вертикальным коллектором, через который в кюветы подается и выводится раствор. К каждому ярусу кювет по воздуховодам поступает стерильный кондиционированный воздух. Среду в кюветах засевают конидиальным посевным материалом (50–100 мг конидий на 1 м2 площади кювет), который специальным устройством распыляется в воздушном потоке и через воздуховоды поступает на поверхность среды. В первые 24–36 ч роста гриба интенсивность аэрации растильной камеры составляет 3–4 м3/(м2 × ч) при температуре воздуха 34–36°С, затем подачу воздуха увеличивают до 18 м3/(м2 × ч), а температуру понижают до 30–32°С.
Максимальный рост мицелия гриба достигается на четвертые сутки культивирования. Мицелий гриба в виде прочной пленки покрывает всю поверхность раствора. В процессе ферментации происходит постепенное нарастание общей кислотности. Начальное значение рН среды 6,8–7,0 снижается в течение первых трех суток до 4,5, а к концу процесса – до 3,0. Максимальная активность кислотообразования пленки гриба наблюдается на 5–6 сут. (около 100 г кислоты на 1 м2 пленки в час) и далее сохраняется на высоком уровне (50–60 г/(м2 × ч)).
Различают три режима поверхностного культивирования: бессменный, односменный, бессменный с доливами (доливной). При бессменном режиме гриб культивируют на одной и той же питательной среде до окончания кислотообразования (8–9 сут.). Односменный режим отличается тем, что через 6–7 сут. культуральную жидкость сливают, пленку гриба промывают стерильной водой и заливают под пленку новый раствор. При высокой активности пленки гриба сменить раствор можно не один, а даже несколько раз.
Наиболее эффективным является доливной способ, суть которого заключается в том, что, начиная с 5–6 сут. культивирования гриба, через каждые 36–48 ч проводится долив питательной среды (один или несколько раз) под пленку гриба в количестве 30–35% от начального объема. Общая продолжительность процесса возрастает до 11–12 сут. Доливной режим обеспечивает увеличение выхода лимонной кислоты с 1 м2 поверхности кювет на 15–20% и снижает удельный расход мелассы на 10–15% по сравнению с другими методами.
Ферментацию прекращают при снижении содержания сахара в растворе до 1–2%. Общая кислотность ферментационного раствора достигает 20%. Кроме лимонной кислоты в культуральной жидкости присутствуют глюконовая, щавелевая и некоторые другие кислоты. На долю лимонной кислоты приходится 90–98% от всех органических кислот в растворе. Выход лимонной кислоты от сахарозы составляет 68–80%.
После слива культуральной жидкости под пленку гриба для промывки подают горячую воду (70–75°С). Кислую промывную воду присоединяют к основному раствору. Инактивированный мицелий после высушивания используют в качестве кормовой добавки.
При глубинном способе культивирования продуцентов лимонной кислоты применяют специально отселекционированные природные или мутантные штаммы Aspergillus niger. Штаммы, используемые в качестве продуцентов при поверхностном культивировании, непригодны. Для глубинного культивирования гриба готовят два мелассных раствора: основной (3–4% сахара) и доливной (25–28% сахара). Основной раствор обогащают минеральными компонентами (NH4Cl, MgSO4, K2HPO4), мелассу освобождают от железа и других металлов обработкой желтой кровяной солью. Солевой и мелассный растворы стерилизуют раздельно на УНС при температуре соответственно 120–125°С и 128–130°С. Для засева производственного ферментатора применяют посевной материал в виде мицелиальной массы гриба, полученной из конидиального материала выращиванием глубинным методом в течение 30–36 ч в посевном аппарате на основном растворе.
Ферментация длится 5–7 сут. при температуре 32–33°С и постепенном увеличении уровня аэрации в течение суток с 2 до 20 м3/(м3 × ч). Начиная со вторых суток культивирования, производят 2–3 долива мелассным раствором из расчета достижения конечной концентрации сахара в ферментационной среде 12–15%. По окончании процесса культуральную жидкость нагревают до 60–65°С и отделяют мицелий фильтрованием с промывкой горячей водой. Фильтрат содержит 5–12% органических кислот (в зависимости от качества мелассы и активности штамма), количество лимонной кислоты – 80–95% от общей суммы кислот.
Несмотря на общие преимущества глубинного способа, производство лимонной кислоты поверхностным культивированием продуцента является более экономичным: энергетические затраты и себестоимость продукта значительно ниже. На практике в промышленном производстве лимонной кислоты применяют оба метода.
Лимонную кислоту выделяют из раствора в виде труднорастворимой соли кальция (рис. 13.2).
Рис. 13.2. Схема выделения лимонной кислоты из культуральной жидкости
Культуральную жидкость нагревают до кипения и нейтрализуют известковым или меловым молоком до рН 7,0–7,5. Цитрат и оксалат кальция образуют осадок, а глюконат кальция и основная часть органических и минеральных веществ мелассы остаются в растворе.
Осадок промывают горячей водой и разлагают цитрат кальция серной кислотой при таких условиях, когда оксалат кальция остается в осадке. Разложение цитрата осуществляют при температуре 60°С после взмучивания осадка в воде (1 : 3 по массе) в присутствии активированного угля для осветления раствора (2% к массе лимонной кислоты) при перемешивании в течение 20 мин и расходе серной кислоты 0,425 дм3 на 1 кг лимонной кислоты в цитрате. В конце процесса в реактор вводят сульфид бария для осаждения тяжелых металлов.
Раствор лимонной кислоты, полученный в реакторе, отделяют фильтрованием от осадка, содержащего гипс, оксалат кальция, уголь, сульфиды металлов. Фильтрат упаривают под вакуумом при температуре 70°С в две ступени, в промежутке между которыми отделяют фильтрованием выпавший в осадок гипс. На первой ступени фильтрат упаривают до плотности 1240–1260 кг/м3, на второй – до 1350–1360 кг/м3, что соответствует концентрации лимонной кислоты в растворе около 80%.
Концентрат охлаждают до температуры 8–10°С и кристаллизуют лимонную кислоту в присутствии затравки – мелких кристаллов лимонной кислоты – в течение 40–50 мин. Кристаллы отделяют центрифугированием с промывкой деионизированной водой и отжимом до влажности 2–3%. Высушивают кристаллы в барабанной сушилке горячим воздухом при температуре 35°С.
XIV. ТЕХНОЛОГИЯ МИКРОБНОГО ЖИРА
Свойство микроорганизмов накапливать в клетках значительное количество липидов от общей биомассы находит применение в биотехнологии для получения технического микробного жира, который может быть использован в различных отраслях промышленности (лакокрасочной, фармацевтической, кожевенной, горнорудной, металлургической и др.) взамен масел и жиров растительного и животного происхождения, что позволяет высвободить их для пищевых нужд.
Под липидами подразумевают сложную фракцию клеточных компонентов, растворимых в неполярных органических растворителях. Эти компоненты условно разделяют на три группы: простые липиды (нейтральные жиры, воски), сложные липиды (фосфолипиды, гликолипиды) и производные липидов (свободные жирные кислоты, спирты, углеводороды, витамины D, E, K).
Нейтральные жиры (основное резервное вещество клеток) представляют собой эфиры глицерина и жирных кислот (моно-, ди- и три- ацилглицериды). Воски – это эфиры высших жирных кислот и алифатических спиртов с длинной углеродной цепью. К воскам относят также эфиры витаминов А и D.
Основной компонент нейтральных жиров – триацилглицериды. Нейтральные жиры в значительных количествах синтезируются дрожжами и мицелиальными грибами (у бактерий преобладают сложные липиды). Нейтральные жиры наиболее пригодны для использования в производстве мыла, а также в качестве смазочного материала (например, при холодной и горячей обработке металлов).
К фосфолипидам относятся фосфоглицериды (эфиры фосфоглицериновой кислоты и спиртов) и сфинголипиды (производные амино-спиртов и жирной кислоты, содержащие остаток фосфорной кислоты). Фосфолипиды входят в состав биомембран клеток и представляют интерес как сырье для производства лекарственных препаратов.
Гликолипиды, в отличие от фосфолипидов, содержат в молекуле остатки углеводов (глюкозы, маннозы, галактозы и др.) при отсутствии остатка фосфорной кислоты.
Жирные кислоты представлены главным образом насыщенными и ненасыщенными кислотами нормального строения с четным числом атомов углерода (пальмитиновой, стеариновой, олеиновой, линолевой). Свободные жирные кислоты находят применение в лакокрасочной и мыловаренной промышленности, в качестве флотоагента при обогащении руд.
В липидах в составе спиртов присутствуют стерины (одноатомные полициклические спирты). Дрожжи способны накапливать в значительных количествах эргостерин, который при облучении ультрафиолетовым светом преобразуется в витамин D2. Различное соотношение компонентов и состав жирных кислот обусловливают все разнообразие жиров и масел.
Липиды присутствуют в биомассе всех микроорганизмов, однако способностью накапливать их в значительном количестве обладают немногие из дрожжей, микроскопических грибов, бактерий и водорослей. Наибольшее промышленное значение как продуценты липидов имеют дрожжи. В оптимальных условиях культивирования дрожжи Rhodotorula gracilis могут накапливать 30–35% липидов от сухой массы клетки, Cryptococcus terricolus – 50–60%, Lipomyces lipoferus – 30–58%, Trichosporon pullulans – 30–55%, Candida humicola – 10–30%, Candida guilliermondii – 6–18%, Hansenula anomala – 8–16%.
Для большинства дрожжей характерен двухстадийный биосинтез белка и липидов: на первой стадии развития культуры осуществляется интенсивный синтез белка с медленным накоплением липидов, на второй – прекращается рост дрожжей, усиленно накапливаются липиды.
Типичными (истинными) липидообразователями являются дрожжи Cryptococcus terricolus, которые активно синтезируют липиды в любых условиях, даже наиболее благоприятных для синтеза белка. Слабо выражена стадийность накопления белка и липидов у дрожжей Lipomyces lipoferus и Rhodotorula gracilis.
Липиды мицелиальных грибов по своему составу наиболее близки к растительным маслам и представлены в основном нейтральными жирами и фосфолипидами. Однако низкая скорость роста грибов ограничивает их использование в качестве промышленных продуцентов микробного жира.
Бактерии отличаются специфичностью фракционного состава липидов, в которых преобладают фосфо- и гликолипиды при малой доле нейтральных жиров, и разнообразием состава жирных кислот.
Водоросли способны накапливать в оптимальных условиях культивирования до 85% жира от сухой массы клеток, но малая скорость роста не позволяет применять их в промышленном производстве.
Некоторые виды дрожжей (представители родов Cryptococcus, Sporobolomyces, Rhodotorula, Candida) способны к экскреции липидов. Эндо- и экзолипиды сильно различаются по своему составу, что свидетельствует об их различном происхождении. В экзолипидах практически отсутствуют триглицериды, преобладают фосфолипиды, в значительном количестве присутствуют сфинголипиды, полиоловые эфиры жирных кислот. Причины и место биосинтеза внеклеточных липидов окончательно не установлены. Наиболее благоприятны для накопления экзолипидов дрожжами среды с С5–С6-полиолами, что очень важно для создания более экономичной технологии производства микробного жира.
В настоящее время биотехнологическая промышленность располагает отработанной технологией получения микробного жира на углеводородах нефти (фракция очищенных н-парафинов или дизельное топливо) и на смеси гидролизатов торфа и древесины (углеводный субстрат).
Условия культивирования липидообразующих дрожжей сильно влияют на соотношение липидных фракций и уровень накопления липидов. Общее количество липидов в клетках значительно возрастает при замене углеводного субстрата углеводородным. Углеводороды стимулируют синтез липидов. Это связано с тем, что липиды, накапливаясь в клетках, играют роль растворителя при транспорте н-парафинов от клеточной стенки к месту окисления. При культивировании дрожжей на средах, содержащих н-парафины с нечетным числом углеродных атомов, в составе дрожжевых липидов образуется большое количество жирных кислот с нечетным числом атомов углерода, которые не характерны для высших организмов и не усваиваются ими. Это обстоятельство ограничивает применение продукта в кормовых целях.
Для обеспечения направленного биосинтеза липидов важное значение имеет соотношение углерода и азота в среде. Повышение концентрации азота смещает процесс в сторону накопления белка. Недостаток азота при обеспеченности углеводами приводит к снижению выхода биомассы при высоком содержании жира. Оптимальное соотношение азота и углерода зависит от вида микроорганизма и природы используемых источников углерода и азота. Например, для Rhodotorula gracilis на глюкозосодержащей среде оптимальным является соотношение N : C = 1 : 30.
Влияние фосфора на липидообразование аналогично действию азота: недостаток фосфора ведет к неполной ассимиляции источника углерода и снижению выхода биомассы, а избыток – к накоплению нелипидных компонентов.
Фракционный состав синтезируемых липидов существенно изменяется при отклонении от оптимальной величины значения рН среды, температуры культивирования, а также зависит от интенсивности аэрации среды. Повышение рН приводит к увеличению содержания фосфоглицеридов и жирных кислот с одновременным уменьшением количества триацилглицеридов. Оптимальные температуры роста и липидообразования для дрожжей совпадают. Температура культивирования влияет на соотношение насыщенных и ненасыщенных жирных кислот. Понижение температуры ведет к увеличению общей ненасыщенности синтезируемых липидов.
При оптимальной аэрации липиды содержат в четыре раза больше триацилглицеридов, в два раза меньше фосфоглицеридов и в восемь раз меньше свободных жирных кислот, чем при ограниченном обеспечении кислородом воздуха. Изменяя условия культивирования продуцентов, можно в определенной степени управлять биосинтезом липидов и получать микробный жир для целенаправленного применения в той или иной области. Этот факт подтверждается составом технического микробного жира, полученного в производственных условиях (таблица).
Состав технического микробного жира, %
|
Компоненты
|
Субстрат
|
|
|
Углеводы гидролизатов торфа и древесины
|
Очищенные н-парафины
|
|
|
Триацилглицериды
|
70–75
|
16–19
|
|
Моно- и диацилглицериды
|
7–10
|
2–6
|
|
Фосфолипиды
|
5–7
|
18–50
|
|
Стерины
|
5–6
|
1–2
|
|
Воски и стериновые эфиры
|
1,7–2,0
|
0,5–4,0
|
|
Свободные жирные кислоты
|
2–10
|
4–22
|
Промышленные испытания показали, что при соотношении гидролизатов торфа и древесины 1 : 4 достигается высокий выход биомассы дрожжей (10 г/дм3) при максимальном содержании липидов (51% от сухой массы дрожжей) и высоком экономическом коэффициенте ассимиляции субстрата (0,54). Однако технологический процесс отличается большими энергетическими затратами на гидролиз сырья и сложностью подготовки гидролизата к биохимической переработке.
Наиболее экономичной является технология комплексной микробиологической переработки нефтяных дистиллятов (дизельного топлива с температурой кипения 240–360°С), позволяющая получить при культивировании дрожжей рода Candida (C. guilliermondii, C. silvicola и др.) три продукта: обезжиренную белоксодержащую биомассу дрожжей (кормовую добавку), технический микробный жир и дизельное топливо арктических сортов с низкой температурой застывания.
Нефтяные дистилляты, в отличие от очищенных н-парафинов, имеют более низкую стоимость, содержат 15–40% н-парафинов, селективно ассимилируемых дрожжами. Концентрация дистиллятов в ферментационной среде – 10–30%.
После микробиологической депарафинизации дизельное топливо отделяют от водной фазы декантацией. Дрожжевую биомассу, сосредоточенную в органической фазе, концентрируют двухступенчатой сепарацией с промывкой горячей водой в присутствии ПАВ, упаривают под разрежением; концентрат сушат в распылительной сушилке. Микробный жир извлекают из дрожжевой массы экстракцией бензиновой фракцией углеводородов «Нефрас А 75/65» (температура начала и конца перегонки – 65–75°С).
Дрожжевой порошок отличается высоким диффузионным сопротивлением: для полного извлечения микробного жира требуемая продолжительность контакта с растворителем составляет более 70 ч. Для резкого снижения диффузионного сопротивления осуществляют специальную подготовку дрожжевого порошка. По технологии английской фирмы «Rous Dauns» (рис. 14.1) дрожжевой порошок кондиционируют по температуре и влажности (подогрев водяным паром при перемешивании с повышением температуры до 100°С и влажности до 16–18%), массу гранулируют (диаметр гранул 3–4 мм, длина 9–10 мм), гранулы расплющивают между вращающимися вальцами в лепесток толщиной 0,1–0,2 мм. Дрожжевой лепесток подсушивают в конвейерной сушилке до влажности 6–8% (влага мешает проникновению растворителя при экстракции липидов) и просеивают на сите с размером отверстий 2 мм. Некондиционный лепесток возвращают на стадию кондиционирования дрожжевого порошка. В результате мощного термомеханического воздействия на дрожжевой порошок улучшается микроструктура частиц, возрастает поверхность массопередачи и продолжительность экстракции из сформированного лепестка уменьшается до 4 ч.
Рис. 14.1. Технологическая схема экстракционного извлечения липидов из дрожжевого порошка: 1 – бункер-накопитель; 2 – конвейер; 3 – нория; 4 – секция кондиционирования дрожжевого порошка; 5 – гранулятор; 6 – плющильные вальцы; 7 – конвейерная сушилка; 8 – сито; 9 – экстрактор; 10 – сборник мисцеллы; 11 – десольвататор
Экстракцию липидов осуществляют в роторном экстракторе ячейкового типа в режиме противотока при температуре растворителя 50–55°С и двукратном его расходе по отношению к дрожжевой массе.
Экстрактор имеет герметичный цилиндрический корпус диаметром 7 м и высотой 5,8 м, в котором медленно с регулируемой скоростью вращается вокруг вертикальной оси ротор, разделенный радиальными перегородками на 18 ячеек. Сверху ячейки открыты. Днище каждой ячейки закрыто перфорированной открывающейся дверцей, удерживающей лепесток и свободно пропускающей жидкость. Нижняя коническая часть корпуса экстрактора, находящаяся под ротором, разделена вертикальными радиальными перегородками на 6 камер, пять из которых предназначены для сбора экстракта, а одна – для приемки проэкстрагированного лепестка, удаляемого из ячейки. На крышке корпуса экстрактора радиально расположены пять распределительных гребенок (каскад штуцеров) для орошения содержимого ячеек ротора растворителем (одна гребенка) и экстрактом (четыре гребенки). Дрожжевой лепесток подается в экстрактор шнековым питателем, оснащенным пневматическим скользящим затвором, закрывающим выходное отверстие при неработающем питателе (исключает утечку паров растворителя в подготовительное отделение). При проходе ячеек вращающегося ротора под питателем они заполняются лепестком. Загруженный в ячейки материал непрерывно движется по окружности, подвергаясь при этом противоточному орошению экстрактом (мисцеллой). На конечной стадии (ступени) экстракции дрожжи орошаются чистым растворителем, который подается в экстрактор через пятую гребенку (рис. 14.2). Проходя сверху вниз через слой лепестка в ячейке, растворитель извлекает липиды и остаточные углеводороды и стекает в нижнюю часть корпуса экстрактора в камеру мисцеллы четвертой ступени, из которой циркуляционным насосом подается в гребенку штуцеров, расположенных над камерой мисцеллы третьей ступени. Мисцелла проходит через лепесток в ячейках, укрепляется (повышается концентрация липидов), стекает в камеру третьей ступени в днище экстрактора и насосом подается в гребенку над камерой мисцеллы второй ступени.
Такой процесс повторяется четыре раза (четыре циркуляционных насоса). При последовательном движении растворителя от последующей к предыдущей ступени концентрация мисцеллы возрастает. Концентрированная мисцелла орошает исходный (загруженный) лепесток и собирается в пятой камере днища аппарата, из которой выводится насосом. Проэкстрагированный лепесток после контакта с чистым растворителем выгружается через открывшуюся в днище дверцу в приемную камеру днища аппарата, из которой выводится винтовым конвейером.
Рис. 14.2. Схема процесса противоточной экстракции липидов из дрожжевого лепестка в роторном экстракторе: 1 – корпус экстрактора; 2 – ячейки ротора; 3 – гребенки штуцеров; 4 – циркуляционный насос
Для повышения скорости массопередачи экстракцию проводят при температуре 50–55°С, которую поддерживают подачей в экстрактор подогретого растворителя (экстрагента). Растворитель (нефрас) имеет высокую летучесть, горюч, смеси его паров с воздухом взрывоопасны. Чтобы исключить проникновение паров растворителя из экстрактора в производственное помещение, в аппарате создают разрежение (0,05–0,2 кПа) вытяжным вентилятором.
Экстракт (мисцелла) содержит около 4% микробного жира и остаточных углеводородов, которые извлекаются растворителем из клеточной массы одновременно с липидами. Технический микробный жир получают отгонкой растворителя из мисцеллы дистилляцией в две (или три) ступени (рис. 14.3).
Рис. 14.3. Технологическая схема дистилляции мисцеллы: 1 – подогреватель мисцеллы; 2 – дистиллятор I ступени; 3 – дистиллятор II ступени; 4 – конденсаторы дистиллятора; 5 – паровой эжектор; 6 – колонна парового контакта; 7 – конденсаторы колонны парового контакта; 8 – разделительная емкость; 9 – переливная перегородка; 10 – колонна для удаления растворителя из воды; 11 – абсорбер; 12 – холодильник; 13 – подогреватель; 14 – десорбер
Подогретая до 60–65°С мисцелла поступает в дистиллятор I ступени (испаритель с восходящей пленкой), работающий при атмосферном давлении. В этом аппарате из мисцеллы удаляется до 90% растворителя. Дистиллятор II ступени работает под разрежением (остаточное давление 16–17 кПа) и представляет собой тарельчатую колонну (ситчатые тарелки), оснащенную паровой рубашкой. Под нижнюю тарелку дистиллятора подается острый перегретый пар. При противоточном взаимодействии перегретого пара с концентратом мисцеллы остатки растворителя полностью удаляются из микробного жира. Перегретый пар проходит дистиллятор не конденсируясь и поступает в теплообменники-конденсаторы. В первом теплообменнике конденсируются главным образом пары воды (при небольшом количестве растворителя), конденсат направляется в колонну для отгонки растворителя, обогреваемую острым паром. Конденсат из второго теплообменника представляет собой растворитель с примесью воды и направляется в разделительную емкость, в которой растворитель от воды отделяется декантацией.
Содержащие растворитель пары (из дистиллятора I ступени, колонны для отгонки бензина, дистиллятора II ступени, десорбера) направляются в колонну парового контакта, в которой конденсируются за счет орошения конденсатом из теплообменников – конденсаторов этой колонны. Колонна парового контакта работает по принципу саморегулирования при любых изменениях объема поступающих паров, а также температуры охлаждающей воды, что является достоинством этого аппарата.
Разделительная емкость за счет вертикальной переливной перегородки обеспечивает отделение легкой фазы (растворителя) от тяжелой (воды). Растворитель возвращается на экстракцию, вода направляется в колонну для отгонки остатков растворителя.
Технология фирмы «Rous Dauns» предусматривает рекуперацию растворителя из паровоздушной смеси, удаляемой из экстрактора и колонны парового контакта. Установка включает две колонны с насадкой из колец Рашига – абсорбер и десорбер. В абсорбере растворитель улавливается из паровоздушной смеси орошением в противоточном режиме индустриальным маслом при низкой температуре (30°С). Насыщенное растворителем масло подогревается и направляется в десорбер, в котором в противоточном режиме оно контактирует с перегретым водяным паром, удаляющим легколетучий растворитель из масла при температуре 105–110°С. Пары из десорбера поступают в колонну парового контакта. Горячее регенерированное масло охлаждают и возвращают в абсорбер, обеспечивая его непрерывную циркуляцию в замкнутой системе.
Проэкстрагированные (обезжиренные) дрожжи содержат остатки растворителя, который удаляют в специальном колонном аппарате – десольвататоре, оснащенном 6–8 полыми горизонтальными тарелками, обогреваемыми глухим паром, и вертикальным валом с перемешивающими гребками для каждой тарелки. Дрожжевая масса шнековым питателем подается на верхнюю тарелку, нагревается при перемешивании и через люк пересыпается на нижележащую тарелку. Процесс повторяется 6–8 раз (люки расположены в шахматном порядке). На каждой тарелке растворитель испаряется. Пары из верхней части аппарата поступают в колонну парового контакта. Под нижнюю тарелку десольвататора подают острый перегретый пар, регулируя расход которого, обеспечивают полное удаление растворителя из дрожжевой массы.
Технический микробный жир – вязкая маслянистая жидкость темно-коричневого цвета, содержащая около 10% углеводородов и не более 3% влаги. Хранится в герметично закрытых емкостях.
XV. МИКРОБИОЛОГИЧЕСКИЙ СИНТЕЗ ПОЛИСАХАРИДОВ И НУКЛЕОЗИДОВ
Полисахариды микроорганизмов чрезвычайно разнообразны, большинство из них имеет уникальную структуру, специфическую для вида или серологической группы вида. Большая часть микробных полисахаридов представлена гетерополимерами, построенными из молекул сахаров и уроновых кислот. В соответствии с локализацией полисахариды микроорганизмов делят на внутриклеточные и внеклеточные (экзополисахариды). Последние находят более широкое применение и производятся в больших масштабах.
Использование полисахаридов в медицине определяется их биологической активностью: повышают устойчивость организма к бактериальным и вирусным инфекциям, обладают противоопухолевой активностью, способствуют заживлению ран и регенерации тканей, устраняют болевой синдром, снижают побочное действие лекарственных препаратов и рентгенотерапии.
Гетерополисахаридный комплекс с липидами (продигиозан), выделенный из клеток Serratia marcescens, и препарат из оболочек клеток Saccaromyces cerevisiae (зимозан) нормализуют сдвиги в иммунобиологических реакциях, оказывают положительное действие при лечении опухолей, инфекционных заболеваний. Полисахариды, обладающие антигенной специфичностью, находят применение в качестве диагностических средств. Например, полисахаридные препараты патогенных и условно-патогенных видов дрожжей рода Candida облегчают диагностику заболеваний кандидозной природы. Очищенные специфические полисахариды менингококков используют для получения менингококковых вакцин.
Нейтральные декстраны, продуцируемые Leuconostoc mesenteroides, широко применяются в качестве заменителей плазмы крови. Перспективны как плазмозаменители пуллулан и леваны, синтезируемые Gluconobacter oxydans, Bacillus polymyxa. Сульфаты декстрана обладают антикоагулирующим действием, заменяют гепарин и могут применяться как антитромбогенное средство. В качестве антикоагулятора перспективен также хитин.
Широкое использование микробных полисахаридов в фармацевтической, парфюмерной, пищевой и других отраслях промышленности определяется их свойствами: реологическими характеристиками растворов, способностью к набуханию и взаимодействию с определенными структурами. В фармацевтике они применяются в качестве основы для изготовления лекарственных форм, как мягчители, эмульгаторы и стабилизаторы суспензий, как склеивающие агенты и разрыхлители в мазях, таблетках. Они обеспечивают длительную устойчивость лекарственных препаратов, стабилизируют и пролонгируют их действие. Конъюгаты модифицированных декстранов с ферментами, например, продлевают время сохранения активности ферментов и снижают их аллергическое действие.
Микробные полисахариды применяются как гельобразующие агенты при изготовлении косметических изделий, для создания гидрофильного буфера в кремах, в качестве набухающих веществ при производстве кремов, шампуней, лосьонов.
В пищевой промышленности полисахариды микроорганизмов используются в виде пленок – покрытий продуктов, например сыров, для их защиты от высыхания и плесневения, в качестве стабилизаторов мороженого, фруктовых соков, загустителей сиропов, джемов, желе и других кулинарных изделий. Особенно перспективным в этом плане считается ксантан. Экзополисахариды дрожжей родов Saccaromyces и Cryptococcus, бактерий родов Azotobacter и Arthrobacter могут употребляться для улучшения качества хлеба. Добавление их к муке повышает газоудерживающую способность теста, улучшает его реологические свойства. Хлеб, выпеченный из такого теста, отличается высоким удельным объемом, хорошей пористостью, медленнее черствеет.
Как гельобразующие агенты экзогликаны находят применение при производстве фото- и рентгеновских пленок (полиурониды Azotobacter, Pseudomonas aeruginosa и других микроорганизмов). Как заменители альгиновой кислоты водорослей в пищевой, текстильной, фармацевтической и бумажной промышленности они могут заменять агар (гетерополисахариды Bacillus subtilis и Pseudomonas elodea).
Анионные полисахариды (ксантан, занфло – внеклеточный гетерогликан Erwinia tahitica) стабилизируют и предохраняют от высыхания водные эмалевые краски. Сульфаты ксантана используются как загустители клеев. С другой стороны, способность ряда полисахаридов к образованию поверхностных пленок позволяет употреблять их в качестве антисклеивающих веществ, например, при освобождении слепков от отливочных форм. Декстран рекомендуется применять и в качестве смазочного средства.
Полисахариды, водные растворы которых отличаются особой стабильностью при резких изменениях температуры и в условиях агрессивной среды, используются в нефтяной и газодобывающей промышленности как стабилизаторы и структурообразователи промывных жидкостей, предназначенных для бурения нефтяных и газовых скважин, и обеспечивают более полное извлечение нефти из нефтеносных пластов. Более половины нефти в США добывают с помощью полисахаридов, главным образом ксантана. В качестве стабилизатора буровых глинистых суспензий перспективен линейный внеклеточный гетерогликан бактерий Methylobacillus methylophilus, состоящий из глюкозы, галактозы, маннозы, рамнозы и глюкуроновой кислоты.
Полисахариды ряда микроорганизмов (пуллулан Aerobasidium pullulans, гетерополисахарид бактерий Methylomonas и др.) являются флокулирующими агентами и используются в гидрометаллургии для производства металлсодержащих компонентов в виде гелей.
На основе декстранов получают сефадексы, широко применяемые в лабораторной практике для гельфильтрации.
Полианионные гликаны, например, ксантан, хитин, используют для очистки воды от тяжелых металлов, а также при промышленном синтезе полимеров для извлечения их из органических растворителей. В настоящее время в промышленном масштабе (США, Франция, Япония, страны СНГ) выпускается ряд микробных полисахаридов, имеющих промышленное значение: декстран, ксантан, пуллулан, занфло, курдлан, склероглюкан, или «политран», и некоторые другие.
Производство различных полисахаридов не универсально. Для каждого гликана оно имеет свои особенности, определяемые физиологией продуцента, локализацией и физико-химическими свойствами полимера, областью его использования. Влияние кислотности среды, уровня аэрации и температуры на биосинтез полисахаридов очень разнообразно.
Большинство микроорганизмов синтезирует полисахариды из всех источников углерода, обеспечивающих их рост, – углеводов, спиртов, карбоновых кислот, аминокислот, углеводородов, С1-соединений. Некоторые микроорганизмы образуют гликаны лишь при наличии в питательной среде определенных источников углерода. Например, Leuconostoc mesenteroides растет, потребляя различные углеводы, но синтезирует декстран только на средах с сахарозой. Моносахаридный состав гликанов микроорганизмов не меняется в зависимости от источника углерода. В ряде случаев для максимального образования полисахарида требуется более высокая концентрация источника углерода в среде, чем для накопления биомассы. Обычно синтезу полисахаридов благоприятствует избыток углерода в среде при некотором дефиците азота и фосфора. Повышенные концентрации азота и фосфора часто отрицательно сказываются на синтезе полисахаридов.
Декстран – первый микробный экзополисахарид, полученный в промышленности. Он представляет собой гомополисахарид, построенный из α-D-глюкопиранозных остатков, соединенных главным образом α-1,6-связями:

Разветвления в молекуле декстранов образуются с помощью α-1,2-, α-1,3- и α-1,4-связей. Боковые ветви молекулы состоят обычно из одного или двух остатков глюкозы, реже встречаются более длинные боковые цепи.
Продуценты декстрана Leuconostoc dextranicum, Leuconostoc mesenteroides и другие образуют в больших количествах декстрансахаразу, индуцируемую субстратом. Это грамположительные, неспорообразующие, неподвижные, гетероферментативные, факультативно-анаэробные бактерии. Они расщепляют сахарозу на глюкозу и фруктозу. Фруктоза сбраживается по типу гетероферментативного молочнокислого брожения с образованием молочной и уксусной кислот, маннита и СО2. Глюкоза полимеризуется в декстран. Образование декстрана происходит с высокой скоростью, продукт можно выделить уже через 24 ч.
Декстран образуется внеклеточно. Они имеют молекулярную массу от 15 до 15 000 кДа. Молекулярная масса определяется концентрацией сахарозы и температурой процесса. При высокой концентрации сахара образуются низкомолекулярные декстраны. При небольшой концентрации сахара (10%), температуре 15°С и значении рН 5,0 получаются декстраны с молекулярной массой около 100 кДа.
Декстран извлекают из культуральной жидкости, осаждая органическим растворителем (этанолом), что уменьшает вероятность разрушения и модификации полимера.
Нативный декстран не пригоден для использования в качестве плазмозамещающего средства, так как имеет очень большую молекулярную массу, значительную вязкость, обладает токсическим действием и изменяет иммунореактивные свойства организма. Высокомолекулярные декстраны (более 150 кДа) могут привести к агрегации крови.
С целью снижения молекулярной массы декстран подвергается частичному гидролизу. Можно деполимеризовать выделенный декстран ферментативно, термической обработкой или ультразвуком. Из полученной смеси выделяют среднемолекулярную фракцию, очищают и на ее основе изготавливают лекарственную форму с заданным молекулярно-массовым распределением. По этому критерию плазмозамещающие средства на основе декстрана делят на две основные группы:
- низкомолекулярные (молекулярная масса – 30–40 кДа);
- среднемолекулярные декстраны (50–70 кДа).
Осаждать фракции клинического декстрана с нужной молекулярной массой из смеси декстранов можно, используя определенные приемы. Так, например, более высокие концентрации спирта позволяют осаждать из раствора декстраны с меньшей молекулярной массой, декстраны же с большой степенью полимеризации осаждаются, напротив, при меньших концентрациях спирта.
Для очистки декстран неоднократно растворяют в воде, пере осаждают спиртом и фракционируют. Для удаления нежелательных примесей применяют также многократную обработку раствора активированным углем. При этом варьируют уровень рН, что способствует изменению растворимости различных присутствующих в растворе веществ.
Ксантан образуется внутри клетки продуцента и затем экскретируется из нее. Бактерии Xanthomonas campestris культивируют в аэробных условиях на среде, содержащей 1–5% углеводов (сахар-сырец, мелассу, кукурузный крахмал и др.). Полимер используют в виде вязкой культуральной жидкости или в виде порошка, высушенного в струе горячего воздуха. В последнем случае клетки отделяют центрифугированием и осаждают полисахарид этанолом, метанолом или ацетоном в присутствии электролита.
15.2. Перспективы получения и использования нуклеозидов
Фармацевтическая промышленность Республики Беларусь сильно зависит от закупок субстанций за рубежом. Из местных источников сырья для получения лекарственных средств используется только сырье растительного и животного происхождения, а также целевые метаболиты, получаемые путем микробного синтеза (антибиотики, ферменты, витамины и аминокислоты).
Важным сырьем для производства ряда лекарственных препаратов является РНК, полученная из дрожжевой массы. РНК − исходный материал для выделения индивидуальных рибонуклеозидов (аденозина, гуанозина, цитидина, уридина), которые в свою очередь являются исходным сырьем для синтеза более чем 20 ценных лекарственных препаратов, а также пищевых добавок. В первую очередь, это препараты сердечно-сосудистого действия – АТФ, фосфаден (АМФ), рибоксин, уридин.
Аденозин является исходным материалом для получения противовирусных препаратов (аденинарабинозид – против вируса герпеса), препаратов с антигипертензивной активностью (производные аденозин-5-карбоновой кислоты), противовоспалительных и обезболивающих препаратов.
На основе цитидина получают цитозинарабинозид и циклоцитидин (для лечения лейкозов), 5-фторциклоцитидин (противоопухолевое средство), циклоцитидинмонофосфат (противовирусный препарат).
Производные гуанозина применяются в качестве иммуностимуляторов. На его основе производятся тиогуанин (противолейкозный препарат), ацикловир (противовирусный).
Уридин используется как безвредный стимулятор физических сил организма при напряженной работе, после длительной болезни, для лечения депрессивных состояний, сосудистых заболеваний мозга. Производные 5-фторуридина являются противоопухолевыми средствами.
Интенсивно ведутся научные исследования по созданию новых лекарственных форм на основе нуклеозидов (в том числе для борьбы с вирусным заболеванием СПИД).
Известны следующие основные способы получения нуклеозидов:
- экстракция нуклеиновых компонентов из мышц млекопитающих и птиц;
- химический синтез;
- микробиологический синтез;
- гидролиз нуклеиновых кислот.
Экстракционный метод требует большого количества ценных пищевых продуктов: из 1 кг мышц минтая получают всего 25 мг АТФ, 40 мг АДФ и 35 мг АМФ.
Химический синтез сложен, но некоторые синтетические нуклеозиды коммерчески доступны. Например, химическим аминированием инозина (рибоксина) получают аденозин. Разработан метод ферментативного синтеза нуклеозидов с помощью фермента нуклеозидфосфорилаза, образующего N-гликозидную связь между азотистым основанием и пентозным остатком.
Перспективен микробиологический способ синтеза нуклеозидов. Например, Bacillus subtilis синтезирует 12–13 г/л инозина (рибоксина); получен мутантный штамм Bacillus subtilis 556, образующий до 55 г/л инозина. Бактерии Bacillus pumilus способны накапливать в среде 29,6 г/л инозина и/или 4,2 г/л гуанозина. В Японии получен мутантный штамм Bacillus subtilis, накапливающий 10,4 г/л цитидина в культуральной жидкости.
Самым технологичным и доступным методом промышленного получения всех четырех нуклеозидов риборяда является гидролиз РНК.
Технические препараты РНК производят из дрожжевой массы. Основная задача при этом – достичь высокого выхода РНК (85–90% от РНК, содержащейся в клетках дрожжей) при высоком содержании основного вещества в техническом препарате (не менее 75%).
Существуют различные методы выделения РНК из дрожжевой массы, но наиболее экономичным считают процесс экстракции РНК 10–12%-ным раствором NaCl в щелочной среде при температуре 85–90°С.
Процессуальная схема получения технической РНК представлена на рис. 15.1.
Гидролиз РНК осуществляют различными методами:
- ферментативный гидролиз с использованием иммобилизованных нуклеаз или интактного мицелия штамма Spicaria violacea;
- кислотный гидролиз;
- щелочной гидролиз.
Из ферментативных методов наиболее отработано применение мицелия гриба Spicaria violacea. Полнота гидролиза РНК в этом методе достигает 80%. Однако получение мицелия Spicaria violacea направленным культивированием гриба с содержанием требуемого набора РНК-гидролизующих ферментов в достаточном количестве является дорогостоящим и труднорегулируемым процессом. Ферментный состав мицелия сильно зависит даже от незначительных изменений условий культивирования.

Рис. 15.1. Схема получения технической РНК из дрожжевой массы
Кислотный гидролиз РНК в мягких условиях (рН 4) приводит к получению сложной смеси из-за сопутствующего разрыва гликозидной связи в пуриновых нуклеотидах. Гидролиз формиатом аммония осуществляют в жестких условиях (230°С). В щелочной среде образуется смесь нуклеотидов, нуклеозидов и олигонуклеотидов.
В качестве гидролизующих агентов целесообразно использовать соединения, образующие с ионами РО3- нерастворимый осадок. Этим требованиям отвечают соединения кальция и магния. Разработан процесс гидролиза РНК в присутствии гидроксида свинца (НПО «Биолар», Латвия), но практическое применение метода ограничено серьезными недостатками процесса: экологическими проблемами с отходами, содержащими свинец, и присутствием в препаратах остатков соединений свинца.
Наиболее приемлема разработанная в Республике Беларусь технология гидролиза РНК оксидом кальция. Процесс гидролиза осуществляют при температуре 130–135°С, давлении 0,2–0,3 МПа в течение 3 ч. В этих условиях РНК гидролизуется на 80–90%. При гидролизе образуется фосфат кальция, который выпадает в осадок и легко отделяется фильтрованием.
Из числа нуклеозидов гидролизата наименее растворим в воде гуанозин. Он выпадает в осадок даже из теплых окрашенных гидролизатов без дополнительной обработки. При охлаждении гидролизата гуанозин кристаллизуется. Содержание основного вещества в кристаллах составляет 80–85%. Для получения продукта высокой чистоты технический гуанозин подвергают перекристаллизации с очисткой активированным углем. Обработку углем осуществляют при температуре 80–90°С. После отделения угля раствор охлаждают до комнатной температуры и кристаллизуют в течение 48 ч. Кристаллы отделяют фильтрованием через капроновую ткань, промывают дистиллированной водой и этанолом и сушат при 40–50°С (рис. 15.2).
Гидролизат после выделения гуанозина концентрируют упариванием при 70°С под разрежением и разделяют нуклеозиды ионообменной хроматографией на сильноосновном анионите АВ-17-2М в ОН–-форме. Для элюирования нуклеозидов используют дистиллированную воду, растворы слабых кислот. Цитидин выделяют, используя в качестве элюента дистиллированную воду. Цитидиновую фракцию упаривают под разрежением (70°С), очищают активированным углем (50% угля от массы цитидина) при температуре 95–100°С. После отделения угля раствор упаривают (70°С), в концентрат добавляют этанол и кристаллизуют при 4–6°С в течение 48 ч. Кристаллы сушат при 40–50°С.

Рис. 15.2. Процессуальная технологическая схема получения препаратов индивидуальных рибонуклеозидов
После элюирования цитидина продолжают подачу дистиллированной воды в колонку и собирают аденозинсодержащую фракцию. Аденозин элюируется медленно, и фракция имеет низкую концентрацию аденозина. Чтобы избежать упаривания больших объемов воды, фракцию направляют на колонку с катионитом КУ-2-8 в Н+-форме. Элюируют аденозин с катионита 1 н. раствором NH4OH. Элюат упаривают (70°С) до концентрации аденозина 60–80 г/дм3 и кристалли- зуют при температуре 4–6°С в течение 48 ч. Технический аденозин подвергают перекристаллизации из водного раствора. Раствор охлаждают и кристаллизуют при температуре 4–6°С в течение 48 ч. Кристаллы промывают водой и этанолом и сушат.
При элюировании цитидина и аденозина дистиллированной водой присутствующие в гидролизате окрашенные примеси и уридин задерживаются анионитом. Элюирование уридина осуществляется эффективно 0,5 н. раствором уксусной кислоты. Однако полученная фракция сильно окрашена. Ее подвергают очистке обработкой активированным углем и дополнительно очищают на анионите АВ-17-2М в CH3COO–-форме. С анионита элюируют уридин водой. Раствор упаривают (70°С) до концентрации 300–500 г/дм3, охлаждают, добавляют этанол и кристаллизуют при 4–6°С в течение 48 ч. Кристаллы высушивают при 40–50°С.
Расход технической РНК для получения 1 кг препарата аденозина составляет 8,45 кг; гуанозина – 6,00 кг; цитидина – 11,55 кг; уридина – 9,23 кг.
Полученные препараты нуклеозидов представляют собой растворимые в воде белые порошки.
XVI. ТЕХНИКА БЕЗОПАСНОСТИ НА МИКРОБИОЛОГИЧЕСКИХ ПРОИЗВОДСТВАХ
Основным условием обеспечения безопасности производства является строгое соблюдение технологического регламента, в котором изложены технологические прописи, перечень необходимого оборудования и систем контроля, правила безопасных способов ведения технологического процесса и обращения с опасными веществами. Подавляющее большинство аварий связано с нарушением технологического регламента, прежде всего его раздела «Основные правила безопасного ведения процесса». Оборудование биотехнологических предприятий включает типовую аппаратуру, применяемую в химической и пищевой промышленности, и значительное количество нестандартного оборудования, специально разработанного для данного производства. Инструкции по безопасному обслуживанию оборудования разрабатываются для каждого аппарата и вывешиваются у рабочего места.
В целях безопасности предусматривается опознавательная окраска трубопроводов (10 групп транспортируемых веществ): вода – зеленый цвет, пар – красный, воздух – синий, кислоты – оранжевый, щелочи – фиолетовый, водные полупродукты – серый, газы горючие и негорючие – желтый. В красный цвет должны быть окрашены противопожарные трубопроводы. Тепловая аппаратура и коммуникации для предотвращения ожогов и уменьшения тепловыделений теплоизолируются. При этом температура поверхности аппаратов и трубопроводов не должна превышать 45°С.
Биотехнологические производства характеризуются наличием следующих факторов опасности:
- применение ядовитых, пожаро- и взрывоопасных материалов, сырья и химикатов (аммиак, кислоты, щелочи, метанол, этанол, метан и др.);
- наличие биологических загрязнений в виде жизнеспособных микроорганизмов, относящихся к условно патогенным штаммам, и продуктов их жизнедеятельности;
- производство продуктов, относящихся к пожаро- и взрывоопасным веществам, а также обладающих выраженным аллергическим действием;
- использование оборудования, работающего под давлением (установки для стерилизации питательных сред, варочные колонны, ректификационные колонны, биореакторы и др.);
- возникновение статического электричества при транспорте взрывоопасных жидкостей, газов и порошкообразных материалов по трубопроводам.
Характерными неблагоприятными факторами микробиологических производств, воздействующими на человека, являются живые и мертвые микроорганизмы и продукты их жизнедеятельности. Подавляющее большинство микроорганизмов, используемых в качестве продуцентов в микробиологических производствах, не обладают свойством патогенности (т. е. способностью вызывать заболевания). Но многие из микроорганизмов относятся к так называемым условно патогенным видам, которые способны при определенных условиях оказывать неблагоприятное воздействие на человека. Например, по степени патогенности дрожжи рода Candida образуют следующий ряд: C. albicans > C. krusei > C. tropicalis > C. guilliermondii > C. scottii. Ряд микроорганизмов обладает способностью вызывать различного рода аллергические реакции, а в отдельных случаях оказывают болезнетворное действие. Широко применяемые для получения различных продуктов плесневые грибы могут вызывать микозы, обусловленные размножением плесневых грибов в организме, и аллергические заболевания. Неблагоприятное воздействие на организм работников могут оказывать продукты микробного синтеза – биологически активные вещества: ферменты, антибиотики, белки, витамины и др.
У многих людей наблюдается повышенная чувствительность к продуктам жизнедеятельности микроорганизмов, проявления которой разнообразны (реакция верхних дыхательных путей, отеки, кожные высыпания, расстройство кишечника и т. д.). У лиц, постоянно контактирующих с пылью антибиотиков или спорами гриба-продуцента, чаще встречаются аллергические дерматиты, экземы, ларингиты, дисбактериоз. Сильным аллергическим действием обладает микробный белок: допустимая концентрация дрожжевой пыли по белку в воздухе населенных пунктов составляет 0,003 мг/м3.
Принципиально представляет опасность интродукция (преднамеренное массированное введение) генетически измененных микроорганизмов в окружающую среду. В этом случае вызывающими опасение факторами риска могут быть:
- возможность превращения безопасных микроорганизмов в патогенные в результате трансформации чужеродной ДНК и образования новых комбинаций генов;
- бурное размножение и пространственная экспансия нового микроорганизма в окружающей среде.
Оба этих фактора практического подтверждения пока не получили.
Согласно классификации, предложенной Европейской федерацией биотехнологии, различают четыре класса микроорганизмов по степени патогенности:
- микроорганизмы, не вызывающие заболеваний у людей и не представляющие угрозы для окружающей среды;
- микроорганизмы, способные вызывать заболевания у людей, но распространение их в окружающей среде маловероятно. Профилактические мероприятия разработаны, лечение эффективно;
- микроорганизмы, представляющие серьезную угрозу для работников микробиологических производств, но для населения опасность их сравнительно невелика;
- микроорганизмы, вызывающие тяжелые заболеваний у людей, представляющие опасность как для работников микробиологических производств, так и для всего населения. Профилактические меры не разработаны и нет эффективных способов лечения.
В особую группу Е объединены микроорганизмы, не представляющие опасности для человека, но способные оказывать воздействие на окружающую среду.
Безопасность при культивировании микроорганизмов, содержащих рекомбинантные ДНК, обеспечивается сочетанием биологических и физических мер ограничения распространения их в окружающей среде.
Биологические меры ограничения позволяют снизить опасность распространения рекомбинантных штаммов за счет использования мутантов, не способных к выживанию в природных условиях и не имеющих экологической ниши у человека, животных и растений.
Физические меры ограничения (уровни Р1–Р4) обеспечивают изоляцию микроорганизмов от внешней среды и предотвращают утечку их из системы.
Уровень физического ограничения Р1 предусматривает проведение всех операций с культурами в замкнутой системе, инактивирование культуры до удаления из системы, отбор проб и ввод добавок без нарушения герметичности системы. Отходящие газы стерилизуются. Оборудование стерилизуется до открывания системы.
Уровень физического ограничения Р2 включает все требования уровня Р1 и дополнительные требования: предотвращение утечки жизнеспособных микроорганизмов из-за негерметичности оборудования и в результате образования аэрозоля. Требуется периодическая проверка герметичности системы, на оборудовании должен стоять знак, предупреждающий о биологической опасности.
Уровень физического ограничения Р3 включает все требования уровней Р1 и Р2 и дополнительные требования: в пространстве над культурой в системе должно быть максимально возможное низкое давление; замкнутые системы располагают в контролируемой зоне – помещении, имеющем специальные инженерные конструкции и защитное оборудование. Контролируемая зона должна иметь тамбур, вход в зону ограничен.
Правила культивирования микроорганизмов для уровня физического ограничения Р4 пока не разработаны.
Опыт производства фирмой «Eli-Lilly» (США) инсулина, первого коммерческого генно-инженерного препарата, показал, что при культивировании микроорганизмов, содержащих рекомбинантную ДНК, можно использовать ферментационное оборудование, предназначенное для производства антибиотиков. При этом отходящие газы должны очищаться на фильтрах от всех микроорганизмов или сжигаться.
В настоящее время в качестве основных реципиентов чужеродных генов используются хорошо изученные и безопасные для человека микроорганизмы Escheriсhia coli, Bacillus subtilis, Saccharomyces cerevisiae. Их относят к первому классу и культивируют в соответствии с требованиями уровня физической защиты Р1.
В производственной практике для безопасного проведения технологического процесса предусматривают выполнение следующих требований:
- автоматизация производственных процессов;
- дистанционное управление наиболее опасными технологическими операциями;
- герметизация оборудования;
- защита от статического электричества;
- применение эффективных систем очистки газовых выбросов;
- изолирование наиболее опасных участков производства;
- использование автоматических газоанализаторов, сблокированных со световой и звуковой сигнализацией и вентиляционными установками, для контроля за содержанием взрывоопасных и токсичных веществ в воздухе производственных помещений;
- опознавательная окраска трубопроводов;
- строгое соблюдение правил обслуживания аппаратов, работающих под давлением, и емкостной аппаратуры;
- использование средств индивидуальной защиты.
Работающие под давлением аппараты должны быть оборудованы манометрами и предохранительными клапанами. На аппаратах устанавливают таблички, в которых указывается регистрационный номер аппарата, рабочее и допустимое давление, дата проведенных контрольных испытаний и дата следующих испытаний. Исправность предохранительных клапанов проверяется ежесменно «подрывом».
Для ряда микробиологических производств характерна возможность образования взрывоопасных смесей паров горючих жидкостей, газов и пыли с воздухом. Взрывоопасные концентрации чаще всего могут образовываться внутри производственных помещений, аппаратов и емкостей. Огнеопасные жидкости хранят, как правило, в изолированных цистернах, чаще всего подземных. Большую опасность представляют свободные аппараты, емкости из-под горючих жидкостей, если они длительное время не использовались. В них может образоваться взрывоопасная газовая смесь. Для передавливания горючих жидкостей из аппарата в аппарат необходимо использовать не воздух, а инертный газ, уменьшающий вероятность образования взрывоопасных концентраций газовоздушной смеси.
При необходимости выполнения работ внутри емкости ее промывают водой (емкости из-под горючих жидкостей полностью заполняют водой), проветривают через открытые люки, отключают привод перемешивающих устройств, устанавливают заглушки на коммуникациях, проверяют содержание кислорода в воздушной среде емкости и проводят внутренние работы в присутствии страхующего.
Инициировать взрыв и воспламенение пыле- и газовоздушных смесей может статическое электричество, которое возникает при передвижении веществ-диэлектриков (этанола, метанола, аммиака, порошкообразной микробной массы и др.) по коммуникациям и аппаратам, в частности:
- при транспортировке огне- и взрывоопасных жидкостей и газов по трубам и резиновым шлангам;
- при сливе жидкости из цистерн и аппаратов (и при наполнении их);
- в процессе пневмотранспорта, измельчения и просеивания продуктов;
- при движении пылевоздушных смесей в трубопроводах и аппаратах.
Чем выше скорость движения жидкостей, газов и твердых материалов по трубам, тем больше величина заряда. Основной способ защиты от статического электричества – заземление аппаратов, воздуховодов, трубопроводов.
Для предотвращения разрушения аппаратов в результате взрыва устанавливаются (на распылительных сушилках, трубопроводах пневмотранспорта) разрывные мембраны из тонких листов металла.
Во фланцевых соединениях трубопроводов, аппаратов, корпусов с крышками должна быть создана единая проводящая цепь (запрещается применение шайб из диэлектрических материалов и окрашенных неэлектропроводными красками).
Наиболее опасные места производства: емкости для хранения метанола, этанола, углеводородов, аммиака и трубопроводы для их подачи (загазованность в результате испарения при недостаточной герметичности; предусматривается подвод азота ко всем резервуарам); отделение сепарации, компрессорные, воздуходувные (сильный шум; предусматриваются звукоизолированные комнаты отдыха, в которых располагаются основные приборы управления); распылительные сушильные установки (загорание, взрыв; предусматриваются автоматические системы сигнализации и пожаротушения).
Доп. информация:
Микробная биотехнология (начальная страница)
- Ссылки от редактора →
- Основы Биотехнологии + (промышленная микробиология, энзимология, генная и клеточная инженерия)
- Методы выделения и очистки продуктов биотехнологических производств
- Синтез аминокислот + (ссылка 1, ссылка 2)
- Базовые представления о биотехнологии пробиотических добавок
Источник: Ручай, Н. С. Технология микробного синтеза: электронный курс лекций для студентов специальности 1-48 02 01 «Биотехнология» / Н. С. Ручай, И. А. Гребенчикова. – Минск : БГТУ, 2014. – 167 с.
Литература
- Промышленная микробиология / З. А. Аркадьева [и др.]; под ред. Н. С. Егорова. – М.: Высш. шк., 1989. - 688 с.
- Грачева, И. М. Технология микробных белковых препаратов, аминокислот и жиров / И. М. Грачева, Н. Н. Гаврилова, Л. А. Иванова. – М.: Пищевая промышленность, 1980. - 448 с.
- Мосичев, М. С. Общая технология микробиологических производств / М. С. Мосичев, А. А. Складнев, В. Б. Котов. – М.: Легкая и пищевая промышленность, 1982. – 254 с.
- Холькин, Ю. И. Технология гидролизных производств / Ю. И. Холькин. – М.: Лесная промышленность, 1989. – 496 с.
- Егоров, Н. С. Основы учения об антибиотиках / Н. С. Егоров. − М.: Химия, 1994. – 346 с.
- Виестур, У. Э. Системы ферментации / У. Э. Виестур, А. М. Кузнецов, В. В. Савенков. – Рига: Зинатне, 1986. – 368 с.
- Виестур, У. Э. Биотехнология. Биологические агенты, технология, аппаратура / У. Э. Виестур, И. А. Шмите, А. В. Жилевич. – Рига: Зинатне, 1987. – 263 с.
- Винаров, А. Ю. Ферментационные аппараты для процессов микробиологического синтеза / А. Ю. Винаров [и др.]; под ред. В. А. Быкова. – М.: ДеЛи принт, 2005. – 277 с.
- Калунянц, К. А. Микробные ферментные препараты (технология и оборудование) / К. А. Калунянц, Л. И. Голгер. – М.: Пищевая промышленность, 1985. – 304 с.
- Биотехнология: учебник / А. Я. Самуйленко [и др.]; под ред. А. Я. Самуйленко. – 2-е изд., перераб. – М.: [б. и.], 2013. – 746 с.