ООО "ПРОПИОНИКС"
| пн-пт с 09:00 до 18:00 | |
Воспалительные заболевания кишечника, микробиом и Е-добавки
« НазадПищевые добавки, связанные с изменениями микробиоты кишечника при воспалительных заболеваниях кишечника: друзья или враги?
Резюме
В XXI веке заболеваемость и распространенность воспалительных заболеваний кишечника (ВЗК) растет во всем мире. Несмотря на то, что патогенез ВЗК остается во многом неясным, взаимодействие между воздействием окружающей среды, генетикой хозяина и иммунным ответом способствуют возникновению и развитию этого заболевания. Растущие данные указывают на то, что пищевые добавки могут быть тесно связаны с ВЗК, однако молекулярные механизмы их воздействия до сих пор плохо изучены. Пищевые добавки можно разделить на различные типы в соответствии с их функциями и свойствами, включая искусственные подсластители, консерванты, пищевые красители, эмульгаторы, стабилизаторы, загустители и так далее. Различные виды пищевых добавок играют определенную роль в изменении взаимодействия между микробиотой кишечника и кишечным воспалением. Таким образом, в данном обзоре всесторонне обобщены современные данные о взаимодействии различных пищевых добавок и изменений микробиома кишечника, а также раскрыты потенциальные механизмы изменений микробиоты, связанных с пищевыми добавками и вовлеченных в развитие ВЗК.
1. Введение
Воспалительные заболевания кишечника (ВЗК), к которым относятся болезнь Крона (БК) и язвенный колит (ЯК), характеризуются как хронически рецидивирующие воспалительные заболевания пищеварительного тракта. В последние десятилетия в западных странах данное заболевание встречается примерно в 150-200 случаях на 100 000 населения. Более того, его распространенность во многих новых индустриальных странах имеет тенденцию к быстрому росту, что свидетельствует о решающей роли факторов окружающей среды в развитии заболевания [1]. На сегодняшний день этиология ВЗК остается неясной. Взаимодействие между экологическими триггерами и изменениями микробиома кишечника у генетически восприимчивых людей может стимулировать аберрантное иммунное расстройство и привести к хроническому воспалению кишечника. Как важный фактор окружающей среды, режим питания может играть ключевую роль в изменении кишечной флоры, за которым следует дисрегуляция гомеостаза хозяина и иммунологических процессов [2].
Многие исследования посвящены изучению влияния различных моделей питания или пищевых привычек на развитие ВЗК [3]. Западная диета (WD) - тип питания с повышенным потреблением общего жира, ненасыщенных жирных кислот, рафинированных белков и обработанных углеводов - была соотнесена с более высоким риском обострений ВЗК. Механистически избыточное потребление насыщенных жирных кислот, сахара и обработанного мяса может вызывать дисфункцию кишечного барьера и воспаление кишечника низкой степени [4]. Также появляются изменения в составе кишечной микробиоты, вовлеченной в развитие ВЗК, вызванные диетой [5]. Кроме того, западная диета может сопровождаться повышенным потреблением пищевых добавок. Под пищевыми добавками понимаются химические синтетические или природные вещества, улучшающие качество продуктов питания, продлевающие срок их хранения, облегчающие процесс приготовления пищи и обогащающие ее питательными веществами [6]. Применение пищевых добавок должно осуществляться в соответствии с рекомендациями и соответствующими правилами, утвержденными Управлением по контролю за продуктами и лекарствами (FDA) в США или Европейским управлением по безопасности пищевых продуктов (EFSA) в Европе. Исходя из их функций и свойств, пищевые добавки можно разделить на различные группы, такие как консерванты, искусственные подсластители, пищевые красители, усилители вкуса, эмульгаторы, стабилизаторы и загустители, противослеживающие агенты и так далее [7]. Тем не менее, недавние исследования показали, что некоторые из разрешенных пищевых добавок могут оказывать пагубное воздействие [8]. Пищевые добавки, разрешенные в Европейском союзе до 20 января 2009 года, должны были быть переоценены до 31 декабря 2020 года. Более того, механизмы, лежащие в основе действия различных пищевых добавок на развитие ВЗК, до сих пор неясны.
Клинические и экспериментальные данные свидетельствуют о том, что дисбиоз кишечника и метаболиты, продуцируемые микробиотой кишечника, тесно связаны с возникновением и прогрессированием ВЗК. Разнообразие микробиоты кишечника у больных ВЗК было снижено, уменьшилось количество бактерий, продуцирующих короткоцепочечные жирные кислоты (SCFAs), а также увеличилось количество муколитических и патогенных бактерий [9]. Было выделено несколько метаболитов, включая производные желчных кислот, SCFAs и метаболиты триптофана [9]. Кроме того, была выдвинута гипотеза о том, что микробиота кишечника является средой, связывающей потребление пищевых добавок с воспалением кишечника при ВЗК. Например, предполагалось, что пищевые эмульгаторы вызывают воспаление низкой степени тяжести через нарушение микробиоты [10]. Эти эмульгаторы также снижают уровень SCFAs и изменяют толщину слизи, усугубляя кишечное воспаление у мышей с дефицитом интерлейкина-10 (IL10 KO) и нокаутом толл-подобного рецептора 5 (TLR-5) [11]. Интересно, что изменения микробиоты кишечника, вызванные пищевыми добавками, в чем-то совпадают с таковыми у больных ВЗК. Таким образом, связь между пищевыми добавками и кишечной микробиотой может помочь лучше интерпретировать возникновение и развитие ВЗК.
В данном обзоре обобщены существующие исследования, посвященные изменениям микробиоты кишечника, вызванным пищевыми добавками, которые приводят к воспалению кишечника, и прояснены возможные механизмы влияния пищевых добавок на развитие ВЗК.
2. Искусственные подсластители
Искусственные подсластители, называемые некалорийными искусственными подсластителями (сокр. NAS от Noncaloric Artificial Sweeteners), являются заменителями сахара, не добавляющими калорий и не вызывающими реакции на глюкозу в крови. В соответствии со статьей (5) Регламента (ЕС) № 257/2010, EFSA уже проводила открытый запрос данных по подсластителям в рамках программы переоценки. На основе информации, полученной от заинтересованных сторон и найденной в литературе, была начата оценка этих пищевых добавок [12,13]. Недавно EFSA также объявило о запросе данных по генотоксичности подсластителей. В текущих исследованиях были отмечены изменения микробиоты и метаболитов кишечника, вызванные искусственными подсластителями, такими как аспартам, ацесульфам-К (Ace-K), стевия, сукралоза, сахарин, неотам и соответствующие соединения. Подробная информация представлена в Таблицах 1, 2 и Дополнительной таблице S1.
2.1. Аспартам (E 951)
Аспартам (E 951) - это низкокалорийный и интенсивный искусственный подсластитель. В Европе он разрешен для использования в качестве пищевой добавки в различных продуктах питания и в качестве столового подсластителя. EFSA опубликовала первую полную оценку риска аспартама в декабре 2013 года, и в заключении был сделан вывод, что аспартам и продукты его распада безопасны для населения в целом (включая младенцев, детей и беременных женщин) [14]. Однако люди с фенилкетонурией испытывают трудности с метаболизмом фенилаланина и должны контролировать потребление аспартама. У людей аспартам может изменять не численность, а разнообразие фекальной микробиоты [15,16]. Однако в другом исследовании [17] было обнаружено увеличение количества бактерий, продуцирующих SCFAs, таких как Bifidobacterium и Blautia coccoides, и уменьшение соотношения Bacteroides/Prevotella. В экспериментах на животных после обработки аспартамом увеличилось количество Firmicutes и Clostridium leptum и уменьшилось количество Enterococcus и Parasutterella [18,19]. Концентрация SCFAs, включая пропионовую и масляную кислоты, также была увеличена в сыворотке крови, кале и содержимом кишечника (табл. 2) [18,19]. Обработка in vitro смесями NAS (аспартам и Ace-K) стимулировала размножение кишечной палочки (E. coli). Также наблюдалась сверхэкспрессия эноил АСР-редуктазы, лимитирующего фермента для биосинтеза бутирата [20]. Хотя лишь немногие исследования изучали взаимосвязь между аспартамом, микробиотой кишечника и ВЗК, это вещество может быть «дружественной» пищевой добавкой при ВЗК, обогащая бактерии, продуцирующие SCFAs, и повышая концентрацию SCFAs.
2.2. Ацесульфам К (E 950)
Ace-K, или ацесульфам калия, является широко используемым NAS. Допустимое суточное потребление (ADI) Ace-K составляет 9 мг/кг массы тела (bw), что также подходит для детей 1-3 лет в специальных медицинских целях и не вызывает опасений [21]. В экспериментах на животных количество общих бактерий в группе, получавшей Ace-K, было эквивалентно контрольной группе [22]. Однако в другом исследовании употребление Ace-K показало, что изменение микробиоты кишечника и метаболитов зависит от пола. У самок наблюдалось снижение численности родов Lactobacillus и Clostridium и повышение численности рода Mucispirillum, а у самцов - увеличение численности Bacteroides, Anaerostipes и Sutterella [23]. Воздействие сукралозы и Ace-K на мышей во время беременности и лактации могло изменить α- и β-разнообразие микробиоты кишечника их потомства, показав увеличение численности Firmicutes и резкое снижение численности потенциальной противовоспалительной бактерии Akkermansia muciniphil [24]. Введение Ace-K после лечения антибиотиками также вызывало увеличение численности сульфатредуцирующих бактерий Desulfovibrio и повышение экспрессии провоспалительных цитокинов в толстой кишке. Более того, Ace-K может вызывать вызванное индометацином повреждение кишечника через дисбиоз (см. табл. 1) [25]. Однако Ace-K подавляет рост E. coli [26], что противоречит данным, полученным Mahmud et al., [20].
В образцах кала пациентов с ВЗК отмечается высокий уровень первичных желчных кислот, таких как холевая кислота (CA), и низкая концентрация вторичных желчных кислот, таких как дезоксихолевая кислота (DCA) [27]. Интересно, что у мышей, получавших Ace-K, тенденции изменения CA и DCA были одинаковыми [22]. Некоторые гены, связанные с синтезом липополисахарида (ЛПС) и жгутиков, также были повышены (табл. 2) [23]. Таким образом, после потребления Ace-K отмечается снижение количества антивоспалительных бактерий с некоторыми изменениями бактериальных функций, такими как синтез ЛПС и желчных кислот. Это позволяет предположить, что нарушение микробиома кишечника и метаболитов, вызванное Ace-K, может быть ключевым фактором, нарушающим гомеостаз кишечника, что может привести к повышению риска развития ВЗК.
Таблица 1. Взаимодействие пищевых добавок, кишечной микробиоты и воспалительных заболеваний кишечника.
|
Пищевые добавки
|
Ref
|
Модель
|
Изменения микробиоты кишечника
|
Воспалительные эффекты
|
|
Искусственные подсластители
|
||||
|
Ace-K
|
25
|
Мышь
|
(F) Увеличение в роду Desulfovibrio
|
Индуцирует экспрессию воспалительных цитокинов.
|
|
Сукралоза
|
8
|
Крысы с TNBS-индуцированным колитом
|
(F) Увеличение: Proteobacteria и
Bacteroidetes;
Уменьшение: Firmicutes и Actinomycetes.
|
Обострение колита, усугубленные изменения длины толстой кишки, MPO, TNF-α и IL-1β в тканях кишечника.
|
|
Сукралоза
|
28
|
Мыши с DSS/AOM-индуцированным раком толстой кишки
|
(F) Увеличение: Actinomycetes,
P. stomatis, C. symbiosum,
P. anaerobius
Уменьшение: Proteobacteria |
Обострение колоректальных опухолей; индукция воспалительных цитокинов и путей (TNF-α, IL-1β, IL-6, IL-10).
|
|
Splenda
|
29
|
Мыши SAMP, склонные к илеиту
|
(F) Увеличение: Proteobacteria и E. coli с повышенной бактериальной инфильтрацией в lamina propria; бактерии-носители гена malX
|
Повышение активности MPO; не влияет на тяжесть илеита.
|
|
Сахарин
|
30
|
Мыши с DSS-индуцированным колитом
|
(F) Влияние на β-разнообразие
Увеличение типов Bacteroidetes и Proteobacteria
Уменьшение: С. aureus,
K. pneumonia и P. aeruginosa
|
Улучшение воспаления кишечника с меньшей потерей веса, снижением уровня DAI и гистологических показателей.
|
|
Сахарные спирты
|
||||
|
Лактитол
|
31
|
Мыши с DSS-индуцированным колитом
|
(F) Измененное α-разнообразие; Увеличение: Akkermansia
|
Улучшение воспаления при остром колите у мышей.
|
|
Покрытия и загустители
|
||||
|
MDX
|
32
|
Мыши IL10 KO и NOD2 KO
|
(F) Уменьшение α-разнообразия;
измененное β-разнообразие
|
Ускорял начало колита; повышал инфильтрацию кишечника CD3+ клетками и патологию кишечника; снижал содержание муциновых гранул.
|
|
MDX
|
33
|
Свиньи с NEC
|
(IC) Снижение бактериального разнообразия
Увеличение: Pseudomonas spp., Streptococcus spp., Leuconostoc spp
Уменьшение: Weissella app |
Вызывал повышенную частоту NEC; уменьшал высоту ворсинок.
|
|
MDX
|
34
|
Мыши с сальмонеллезным гастроэнтеритом
|
Усиливает колонизацию Salmonella на слизистых оболочках in vivo.
|
Разрушает кишечный антимикробный барьер in vivo. Подавляет экспрессию NAPDH-оксидазы; уменьшает поступление NADPH-оксидазы в везикулы, содержащие сальмонеллы, что приводит к персистенции сальмонелл в везикулах.
|
|
MDX
|
35
|
AIEC, выделенная от пациентов
|
MDX улучшил образование
специфической биопленки AIEC
|
Индуцирует экспрессию пилей типа I; увеличивает адгезию бактерий к кишечному эпителию.
|
|
Эмульгаторы
|
||||
|
P80
|
36
|
Мыши с колитом, вызванным индометацином
|
(IC) Уменьшение α-разнообразия
в тонком кишечнике
Увеличение: Gammaproteobacteria и
P. mirabilis
|
Обостренный колит; Увеличена экспрессия интерлейкина-1β. Предварительная обработка антибиотиками устранила этот эффект.
|
|
P80
|
37
|
E coli, выделенная от пациентов
|
-
|
Увеличена транслокация кишечной палочки через эпителиальные М-клетки.
|
|
CMC
|
32
|
Мыши IL10 KO
и мыши NOD2 KO
|
(F) Экспрессия жгутиков
микробами была повышена
|
Ускоренное начало колита; повышенная инфильтрация кишечника CD3+ клетками и кишечная патология; снижение содержания гранул муцина.
|
|
CMC
|
38
|
Мыши IL10 KO
|
(Слизистая оболочка кишечника) Избыточный бактериальный рост
|
Расширение промежутков между ворсинками с заполнением этих промежутков бактериями, прилипание бактерий к слизистой оболочке и миграция бактерий на дно крипт.
|
|
CMC и P80
|
39
|
M-SHIME; мыши ASF и GF
|
In vitro: влияние на разнообразие и состав
(F) увеличение бактерий, связанных с воспалением, уменьшение бактерий, связанных со здоровьем
|
Способствовали развитию низкосортного воспаления кишечника.
|
|
CMC и P80
|
11
|
Мыши дикого типа, IL10 KO и TLR5 KO
|
(F) Индуцировали снижение
микробного разнообразия
Увеличение: Тип Verrucomicrobia,
A. muciniphila, Proteobacteria
|
Индуцировали низкосортное воспаление кишечника и способствовали развитию острого колита.
|
|
CMC и P80
|
10
|
Мыши IL10 KO и ASF/GF; DSS-индуцированный колит
|
-
|
Индуцированное хроническое воспаление кишечника и нарушение регуляции метаболизма, особенно при IL10 KO.
|
|
Каррагинан
|
40
|
Мыши GF
|
Мыши GF, инокулированные
B. xylanisolvens 38F6A4 или
E. coli 38F6C1
|
Увеличение проницаемости кишечника и было связано с началом колита.
|
|
Каррагинан
|
41
|
Мыши
|
(CC) Уменьшение: A.muciniphila
|
Индуцированный колит низкой степени тяжести.
|
|
Каррагинан
|
42
|
Мыши с HFD-индуцированным колитом
|
(F) Увеличение: A. finegoldii и
B. acidifaciens
|
Обострившееся воспаление кишечника у мышей с колитом.
|
|
Каррагинан
|
43
|
Мыши с колитом, вызванным Citrobacter freundii DBS100
|
-
|
Обострившееся воспаление кишечника у мышей с колитом.
|
|
Каррагинан
|
44
|
Мыши с DSS-индуцированным колитом
|
Ингибирует бактериальную
агрегирующую функцию DMBT1
|
Нарушает защиту слизистой оболочки, обеспечиваемую DMBT1.
|
|
Каррагинан
|
45
|
Мышам, инокулированныеAIEC
|
(IC) Уменьшение бактериального
богатства и состава
Увеличение: Proteobacteria и Deferribacteres
Уменьшение: Firmicutes, Actinobacteria, Bacteroidetes
|
Индуцированный колит у мышей.
|
|
Каррагинан
|
46
|
Морские свинки
|
-
|
Вызывал изъязвление слепой кишки; не оказывал влияния на свинок GF.
|
|
Каррагинан
|
47
|
Морские свинки; мыши GF
|
-
|
У инокулированных B. vulgatus развились язвы кишечника.
|
|
GML
|
48
|
Мыши
|
(F) Увеличение: Barnesiella;
Clostridium XIVa, Oscillibacter,
Parasutterella
|
Поддерживает кишечный барьер; способствует противовоспалительной среде.
|
|
GML
|
49
|
Мыши, получавшие HFD
|
(F) Увеличение: Bifidobacterium pseudolongum
|
Уменьшает метаболические нарушения и воспаление кишечника.
|
|
GML
|
50
|
Мыши, получавшие HFD
|
(F) GML устраняет дисбиоз
микробиоты кишечника
Увеличение: B. uniformis, Akkermansia,
Bifidobacterium, Lactobacillus
Уменьшение: E. coli, Lactococcus, Flexispira
|
Уменьшает метаболические нарушения и снижает уровень TNF-α в сыворотке крови.
|
|
GML
|
51
|
Мыши с колитом, вызванным DSS
|
(F) Увеличение: Lactobacillus и
Bifidobacterium
Уменьшение: Helicobacter ganmani |
Улучшение течения колита у мышей.
|
|
Пищевые красители
|
||||
|
TiO2
|
52
|
Мыши, получавшие HFD
|
(F)Увеличение: Firmicutes
Уменьшение: Bacteroidetes, Bifidobacterium, Lactobacillus
|
Вызывал сильное воспаление толстой кишки, особенно у мышей с ожирением.
|
|
TiO2
|
53
|
Мыши, получавшие HFD
|
(F) Увеличение: Firmicutes;
Уменьшение: Bacteroidete
|
Усилил низкосортное воспаление, вызванное HFD, через кишечный микробиом; разрушил слой слизи.
|
|
TiO2
|
54
|
Мыши
|
(CC) Уменьшение: Akkermansia,
Barnesiella, Bacteroides
Увеличение: Barnesiella |
Вызвал воспаление кишечника; снижение слизистого барьера кишечника.
|
|
TiO2
|
55
|
Мыши
|
(CC) Влияет на колонизацию бактерий, ассоциированных
со слизистой оболочкой.
|
Вызывает воспалительную реакцию в подвздошной кишке.
|
|
TiO2
|
56
|
Крысы
|
(F) Увеличение: L. gasseri,
Turicibacter, группа L. NK4A136
Уменьшение: Veillonella
|
Индуцированная воспалительная инфильтрация и митохондриальные аномалии.
|
|
TiO2
|
57
|
Мыши
|
(F) Способствует образованию биопленки E. faecalis или E. coli
|
Нарушил кишечный барьер и вызвал воспаление кишечника.
|
|
TiO2
|
58
|
Мыши с DSS-индуцированным колитом
|
(F) Повлияло на разнообразие
Уменьшение: Bifidobacterium, Lactobacillus
|
Индуцированное воспаление кишечника; обострение колита.
|
|
TiO2
|
59
|
Мыши с DSS-индуцированным колитом
|
(F) Никакого влияния
|
Никакого влияния
|
|
Азо-красители
|
60
|
Мыши GF, Rag1-/-и R23FR
|
(F) Не оказывает влияния на бактериальный состав.
|
Red 40 и ANSA-Na способствовали развитию колита.
|
|
Азо-красители
|
61
|
Карась
|
(IC) Увеличение: Bdellovibrio Shewanella
Уменьшение: Roseomonas, Rhodococcu, Bacillus,
Bacteroides, Clostridium
|
Индуцировали окислительный стресс; вызывали склонность к воспалению кишечника.
|
|
Пищевые консерванты
|
||||
|
Mixture
|
62
|
Дикий тип, мыши NOD2 KO
|
(F) Увеличение: типа Proteobacteria
Уменьшение: порядка Clostridiales |
Был вызван дисбактериоз, особенно у мышей NOD2 KO.
|
|
Сульфит
|
63
|
P. mirabilis,
M. morganii,
E. fergusonii,
K. pneumoniae
|
Снижена скорость роста всех штаммов.
|
Влияет на кинетику роста патобионтов болезни Крона, что может инициировать и способствовать развитию заболевания.
|
|
TCS
|
64
|
Мыши с DSS-индуцированным колитом; мыши IL10 KO
|
(F) Снижение α- и β-разнообразия
Увеличение: Firmicutes Уменьшение: Bacteroidetes, Actinomycetes, Cyanobacteria
|
Индуцированное низкосортное воспаление толстой кишки, усиленный колит и обострение рака толстой кишки, ассоциированного с колитом, у мышей
|
Сокращения: Ace-K — ацесульфам К; MDX — мальтодекстрин; CMC — карбоксиметилцеллюлоза; P80 — полисорбат 80; GML — Глицерин-монолаурат; TiO2 — наночастицы диоксида титана; Mixture — смесь распространенных консервантов, включая бензоат, нитрит и сорбат; TCS —триклозан; TNBS—2, 4, 6, тринитробензол сульфоновая кислота; DSS — декстрансульфат натрия; Мыши IL10 KO — мыши с дефицитом интерлейкина-10; мыши NOD2 KO — мыши с дефицитом нуклеотидсвязывающего домена олигомеризации 2; мыши TLR5 KO - мыши с нокаутом toll—подобного рецептора 5; NEC - некротизирующий энтероколит; SAMP— Штамм мыши SAMP1/YitFc, представляющий модель илеита, подобного болезни Крона; AIEC — ассоциированная с болезнью Крона адгезивная инвазивная кишечная палочка; мыши ASF - мыши с измененной флорой Шедлера; мыши GF — мыши без микробов; M-SHIME - имитатор слизистой оболочки модели микробной экосистемы кишечника человека; HFD — диета с высоким содержанием жиров; F — кал; IC - содержимое кишечника; CC— содержимое толстой кишки; MPO— миелопероксидаза; DAI — индекс активности заболевания; ANSA-натриевая соль Na—1-амино-2-нафтол-6-сульфоната.
Таблица 2. Влияние различных пищевых добавок на метаболиты кишечника.
|
Пищевые добавки
|
Ref
|
Образец
|
Метаболитные изменения
|
||
|
Увеличение
|
Уменьшение
|
||||
|
Искусственные подсластители
|
Аспартам
|
[17]
|
F
|
Общее количество SCFAs, уксусная кислота, пропионовая кислота, каприловая кислота
|
Валериановая кислота, капроевая кислота; BCFAs (такие как изомасляная кислота, изовалериановая кислота)
|
|
[18]
|
S
|
Пропионат, ацетат и бутират
|
-
|
||
|
[19]
|
CC
|
Пропионат, бутират и изобутират
|
-
|
||
|
Сукралоза
|
[22]
|
CC
|
Соотношение CA/CDCA
|
-
|
|
|
[65]
|
F
|
Аммоний, муравьиная кислота, фенилмолочная кислота, HO-фенилмолочная кислота; масляная кислота
|
Бензойная кислота
|
||
|
Сахарин
|
[65]
|
F
|
Аммоний, муравьиная кислота, фенилмолочная кислота, HO-фенилмолочная кислота; уксусная и масляная кислота
|
Бензойная кислота, пропионовая кислота
|
|
|
[66]
|
F
|
Пропионат и ацетат
|
-
|
||
|
[67]
|
F
|
Дайдзеин, дигидродайдзеин и О-десметиланголензин; хинолиновая кислота
|
Эквол, линолеол, этаноламид, N, N-диметилсфингозин
|
||
|
Неотам
|
[68]
|
F
|
Холестерин, кампестерол и стигмастанол
|
Яблочная кислота, манноза-6-фосфат, 5-аминовалериановая кислота и глицериновая кислота; 1,3-дипальмитат, 1-монопальмитин, линолевая кислота и стеариновая кислота
|
|
|
Цикламат
|
[65]
|
F
|
Муравьиная кислота, фенилмолочная кислота, HO-фенилмолочная кислота; уксусная кислота
|
Бензойная кислота, пропионовая кислота
|
|
|
Splenda
|
[69]
|
F
|
Масляная и пентановая кислота
|
-
|
|
|
Сахарные спирты
|
Изомальт
|
[70]
|
F
|
Не влияет на содержание SCFAs, лактата, желчных кислот и нейтральных стеринов.
|
|
|
Лактитол
|
[71]
|
F
|
Не оказывает влияния на SCFAs.
|
||
|
[72]
|
F
|
Уксусная кислота, молочные кислоты
|
Пропионовая, масляная и валериановая кислоты
|
||
|
[73]
|
F
|
Пропионовая и масляная кислоты
|
Уксусная и молочная кислоты
|
||
|
[74]
|
F
|
Бутират
|
-
|
||
|
[75]
|
IC
|
Путресцин
|
Соотношение уксусной и пропионовой кислот
|
||
|
Покрытия и загустители
|
MDX
|
[17]
|
F
|
Общее количество SCFAs, пропионовая кислота; каприловая кислота
|
Валериановая кислота, капроевая кислота; изомасляная и изовалериановая кислоты
|
|
[33]
|
IC
|
Муравьиная кислота, уксусная кислота, масляная кислота
|
Молочная кислота, янтарная кислота
|
||
|
[76]
|
F
|
Общее количество SCFAs, ацетата, бутирата и валерата
|
-
|
||
|
Эмульгаторы
|
P80
|
[11]
|
F
|
Флагеллин
|
-
|
|
CMC
|
[39]
|
F
|
Бутират; LCA, HDCA/UDCA, αMCA, GLCA, TCDCA, TDCA, THDCA/TUDCA, TCA
|
-
|
|
|
[11]
|
F
|
Бутират, гептаноат; αMCA
|
-
|
||
|
[17]
|
F
|
-
|
Изовалериановая кислота
|
||
|
Каррагинан
|
[17]
|
F
|
Не оказывает влияния на SCFAs и BCFAs
|
||
|
[45]
|
CC
|
-
|
Масляная и уксусная кислоты
|
||
|
Пищевые красители
|
TiO2
|
[52]
|
CC
|
-
|
Масляная и пропионовая кислота; уксусная и изовалериановая кислоты у мышей с ожирением
|
|
[56]
|
F
|
N-ацетилгистамин, капролактам и глицерофосфохолин
|
4-метил-5-тиазолэтанол, L-гистидин и L-орнитин
|
||
|
[57]
|
S
|
-
|
SCFAs
|
||
|
[77]
|
CC
|
-
|
уровень pH
|
||
|
[78]
|
F
|
Отсутствие влияния на SCFAs.
|
|||
|
[79]
|
F
|
Не влияет на общий состав жирных кислот.
|
|||
|
[17]
|
M
|
Не влияет на SCFAs и BCFAs.
|
|||
|
Азо-красители
|
[80]
|
M
|
-
|
Ацетат, бутират и пропионат
|
|
|
[81]
|
M
|
Метаболиты судана III и IV — анилин и о-толуидин (2-метиланилин) — канцерогенные ароматические амины.
|
|||
|
[82]
|
M
|
1-амино-2-нафтол, общий метаболит красителей, был способен ингибировать рост большинства протестированных бактерий.
|
|||
|
Консерванты
|
Бензойная кислота
|
[83]
|
U
|
Гиппуровая кислота
|
-
|
|
[84]
|
IC
|
-
|
Уксусная кислота
|
||
|
[85]
|
CC
|
Пропионовая кислота и общее количество летучих жирных кислот
|
|||
|
[86]
|
CC
|
Масляная кислота
|
-
|
||
|
Ag NPs
|
[87]
|
F
|
Аммоний
|
-
|
|
|
Антиоксидант
|
Экстракт розмарина
|
[88]
|
F
|
SCFAs (уксусная, пропионовая и масляная кислоты) у мышей с ожирением
|
SCFAs у худых мышей
|
Сокращения: MDX – мальтодекстрин; CMC – карбоксиметилцеллюлоза; Р80 – полисорбат 80; TiO2 – наночастицы диоксида титана; Ag NPs – наночастицы Ag; F — фекалии; S — сыворотка; CC – содержимое толстой кишки; IC — содержимое кишечника; U — моча; М – питательная среда для исследования in vitro; SCFAs – жирные кислоты с короткой цепью; BCFA – жирные кислоты с разветвленной цепью; CA – холевая кислота; CDCA – хенодезоксихолевая кислота; LCA – литохолевая кислота; HDCA – гиодеоксихолевая кислота; UDCA – урсодезоксихолевая кислота; αMCA – α-мурихолевая кислота; GLCA – гликолитохолат; TCDCA – таурохенодезоксихолевая кислота; TDCA – тауродезоксихолевая кислота; THDCA – таурогидезоксихолевая кислота; TUDCA – тауроурсодезоксихолевая кислота; ТСА – таурохолевая кислота.
2.3. Сукралоза (Е 955)
Сукралоза, известная как трихлоргалактосахароза, имеет сладость в 600–650 раз выше, чем сахар. В исследованиях на людях прием сукралозы не модулировал микробиом кишечника при кратковременном лечении [16,89], в то время как десятинедельное употребление у молодых людей могло привести к увеличению количества Blautia coccoides и снижению количества Lactobacillus acidophilus с измененными уровнями инсулина и глюкозы в сыворотке [90]. Однако Uebanso et al. показали дозозависимое снижение количества Clostridium IVXa в кале у животных [22]. В общей сложности 14 родов были поразительно изменены через 3 или 6 месяцев лечения (т. е. количество Ruminococcus увеличилось через 3 месяца; Turicibacter, Roseburia и Akkermansia увеличилось через 6 месяцев; Anaerostipes, Staphylococcus и Bacillales уменьшилось через 3 месяца; Streptococcus уменьшилось через 6 месяцев). [91]. Аналогичные результаты были получены на моделях мышей, получавших диету с высоким содержанием жиров [26]. Splenda является некалорийным искусственным подсластителем (NAS) и в основном состоит из сукралозы и мальтодекстрина. Предполагалось, что он подавляет рост всех анаэробов, включая Bifidobacteria, Lactobacilli, Bacteroides и Clostridia [8,29]. V amanu et al. исследовали изменение кишечной флоры человека с помощью статической системы in vitro под названием GIS1 и выявили сходные результаты: снижение количества полезных бактерий, таких как род Bifidobacterium, и увеличение количества, возможно, патогенных бактерий рода Enterococcaceae [65]. Рост устойчивых к желчи микроорганизмов рода Bilophila, противовоспалительных бактерий Faecalibacterium prausnitzii и двух видов из рода Bacteroides (Bacteroides fragilis и Bacteroides uniformis) был ингибирован после культивирования с сукралозой in vitro [17,26,92,93].
Взаимосвязь между сукралозой, микробиотой кишечника и кишечным воспалением была непосредственно изучена в трех исследованиях и представлена в таблице 1. В одном из исследований у мышей SAMP1/YitFc, которым вводили Splenda, не было обострения колита, но повышался уровень миелопероксидазы (MPO) в тканях толстой кишки. Анализ фекальной микробиоты выявил повышение уровня Proteobacteria, но снижение уровней Lactobacilli и Clostridia [29]. Напротив, Splenda может повысить восприимчивость к колиту, вызванному 2, 4, 6-тринитробензолсульфоновой кислотой, с повышенным уровнем Bacteroidetes и Proteobacteria и снижением количества Firmicutes и Actinomycetes [8]. Недавнее исследование также показало, что сукралоза может повышать риск развития колоректального рака, связанного с колитом. Количество Actinomycetes и трех видов Peptostreptococcus stomatis, Clostridium symbiosum и Peptostreptococcus anaerobius было увеличено, а количество Proteobacteria - уменьшено [28].
Употребление сукралозы привело к изменению многих метаболитов (табл. 2). Уровень тирозина повысился, а p-гидроксифенилуксусной кислоты и коричной кислоты - снизился. Эти соединения могут сдерживать выработку реактивных видов кислорода (ROS), которые участвуют в метаболизме триптофана. Содержание желчных кислот было нарушено, при этом в содержимом печени наблюдалась большая концентрация CA и более высокое соотношение CA/хенодезоксихолевая кислота. Исследователи предположили, что эти изменения метаболитов могут привести к запуску и поддержанию воспаления печени [22,91]. Исходя из имеющихся данных, мы предположили, что сукралоза пагубно влияет на колит, способствуя увеличению численности провоспалительных бактерий. Тем не менее, реальные изменения в микробиоте кишечника и метаболитах, вызванные сукралозой, остаются неясными и указывают на необходимость дальнейших клинических исследований.
2.4. Сахарин (Е 954)
Большая часть сахарина абсорбируется и окончательно выводится с мочой, тогда как неабсорбированный сахарин выводится с калом. Хотя недавнее исследование показало, что высокие дозы добавок не вызывают изменений микробиоты кишечника или непереносимости глюкозы [94], потребление сахарина привело к обогащению воспалительных клеток слизистой оболочки и изменило проницаемость кишечника у мышей. Кроме того, у мышей, подвергшихся воздействию сахарина и предварительно обработанных антибиотиками, наблюдался более низкий уровень воспаления слизистой оболочки и дисфункции кишечного барьера [95]. Эти результаты показали, что дисбактериоз кишечника, как полагают, опосредует эти нарушения.
Высокий уровень сахарина в содержимом слепой кишки был связан с увеличением аэробной популяции [96]. Воздействие сахарина приводило к непереносимости глюкозы вследствие значительного дисбактериоза. Многие увеличенные таксоны принадлежали Bacteroides и Clostridiales, но количество Firmicutes и Cyanobacteria уменьшилось [30,66]. Точно так же метаболические изменения не могли быть вызваны у мышей, свободных от микробов, хотя они произошли после трансплантации кишечной микробиоты. Сахарин также может привести к воспалению печени, вызывая увеличение количества Akkermansia, Corynebacterium и Turicibacter и снижение количества Anaerostipes, Ruminococcus и Dorea [67]. Более того, совместное применение сахарина, глифосата и бензоата натрия вызывало увеличение численности родов E. coli и Pseudomonas [97]. После воздействия SUCRAM (сахарин + неогесперидин дигидрохалкон) наблюдалось увеличение популяции Lactobacillaceae и сокращение численности семейства Ruminococcaceae [98,99]. Аналогичные результаты были получены in vitro [65]. Кроме того, был также снижен рост Faecalibacterium prausnitzii и штаммов E. coli HB101 и K-12 [26,92].
Добавки сахарина могут значительно ингибировать рост кишечных бактерий и улучшить состояние колита, вызванного декстрансульфатом натрия (DSS) (таблица 1). Воздействие сахарина повлияло на β-разнообразие и состав микробиоты, что показало более высокий уровень Bacteroidetes и более низкий уровень Firmicutes. Наблюдалось увеличение противовоспалительных бактерий родов Bacteroides и Parasutterella. Исследование также выявило бактериостатический эффект сахарина на рост Staphylococcus aureus, Klebsiella pneumonia и Pseudomonas aeruginosa in vitro [30]; сахарин влияет на метаболомные профили в кале (табл. 2). Содержание дайдзеина, дигидродайдзеина и одесметиланголензина было повышено, а эквола - понижено в кале. Содержание соединений, которые могут опосредовать воспаление, таких как линолеоилэтаноламид, пальмитолеоилэтаноламид, N, N-диметилсфингозин и хинолиновая кислота, было значительно изменено [67]. Более того, уровни пропионата, ацетата, а также фенилмолочной кислоты были заметно выше, а муравьиной и бензойной кислот - ниже [65,66]. Анализ функционального обогащения показал, что биосинтез ЛПС, сборка жгутиков, фимбриальный синтез, бактериальный токсин и множественная лекарственная устойчивость, возможно, имеют отношение к делу [66]. Недавно было обнаружено, что NAS, включая сахарин, сукралозу, аспартам и Ace-K, способствуют эволюции бактерий и горизонтальному переносу толерантности к антибиотикам посредством естественной трансформации, что приводит к сверхэкспрессии генов, кодирующих механизмы поглощения и транслокации ДНК [100,101,102]. Это открытие дает некоторое представление о роли NAS в эволюции и распространении толерантности к антибиотикам среди бактерий. Более того, искусственные подсластители могут подавлять ощущение кворума кишечного бактериального сообщества, влияя на нормальное групповое поведение [103]. Согласно нашим предположениям, сахарин может взаимодействовать с кишечной микробиотой и их метаболитами, что приводит к воспалению кишечника.
2.5. Неотам (E 961)
Неотам на вкус в 7000–13 000 раз слаще сахара. Прием неотама уменьшал α-разнообразие и изменял β-разнообразие фекального микробиома. Наблюдалось резкое снижение количества Firmicutes. Увеличилась численность Bacteroidetes, особенно рода Bacteroides. Примечательно, что многие компоненты семейств Lachnospiraceae и Ruminococcaceae, включая роды Blautia, Dorea, Oscillospira и Ruminococcus, были значительно сокращены. Потребление неотама также изменило два пути ферментации бутирата в микробиоме кишечника. Один из путей включал снижение трех генов, кодирующих t4-гидроксибутирил-КоА-дегидратазу, бутирил-КоА-дегидрогеназу и ацетат-КоА-трансферазу. Эти гены участвовали в процессе ферментации сукцината до бутирата. С другой стороны, вышестоящие гены, связанные с бутиратом, ферментированным из пирувата, также были подавлены. Кроме того, обогащенные пути включали метаболизм аминокислот, биосинтез ЛПС и биосинтез антибиотиков, в то время как пути метаболизма жирных кислот и углеводов были сокращены [68]. Наблюдалось снижение содержания большинства липидов и жирных кислот, таких как 1,3-дипальмитат, 1-монопальмитин, линолевая кислота и стеариновая кислота (таблица 2). В фекалиях обнаружено пониженное содержание холестерина, кампестерола и стигмастанола [68].
По нашему мнению, обогащение путей синтеза фолата и биосинтеза ЛПС, вероятно, связано с увеличением количества Bacteroides и S24-7. Lachnospiraceae и Ruminococcaceae рассматривались как бактерии, разлагающие растения и продуцирующие SCFAs. Пониженная регуляция генов, участвующих в синтезе бутирата, и меньшее количество Lachnospiraceae и Ruminococcaceae, возможно, свидетельствуют о снижении выработки SCFAs, что приводит к снижению абсорбции липидов и жирных кислот. Однако метаболические последствия неотама все еще недостаточно изучены. Хотя изменения микробиоты кишечника аналогичны изменениям у пациентов с ВЗК, связь между неотамом и воспалением кишечника остается неясной. Будущие исследования необходимы для изучения последствий длительного воздействия на моделях колита или на людях.
2.6. Цикламат (E 952)
Цикламат - это натриевая соль цикламовой кислоты. Под воздействием кишечной микробиоты он может превращаться в циклогексиламин и выводиться с фекалиями. Эта пищевая добавка была исключена из списка общепризнанных безопасных (GRAS) с 1970 года, в то время как EFSA считала ее безопасной до сих пор. Предыдущее исследование показало, что прием цикламата не изменяет состав фекальных бактерий (например, Bacteroidaceae, Bifidobacteria, Lactobacilli) [104]. Однако в модели in vitro GIS1 наблюдалось увеличение числа представителей родов Bifidobacterium и Pediococcus. Также наблюдалось снижение общего содержания SCFAs, особенно соотношения между масляной и пропионовой кислотами (таблица 2) [65], в то время как цикламат ингибировал анаэробную ферментацию глюкозы [105]. Как мы знаем, SCFAs благотворно влияют на здоровье человека. Масляная кислота может быть эффективной против ожирения и резистентности к инсулину, а также может способствовать дислипидемии. Было показано, что пропионовая и масляная кислоты полезны при ВЗК в низких концентрациях [27]. В целом, выводы об общем влиянии цикламата на микробиоту кишечника и ВЗК сделать невозможно, и необходимы дополнительные исследования, чтобы выяснить его влияние на воспаление кишечника.
3. Сахарные спирты
Сахарные спирты, или полиолы, представляют собой низкокалорийные подсластители, которые содержат около половины калорий белого сахара и приводят лишь к небольшому изменению уровня сахара в крови. Большинство из них плохо всасываются и не метаболизируются в организме хозяина и обычно ферментируются микробиотой толстой кишки. Среди них в качестве пищевых добавок обычно используются эритрит, изомальт, ксилит и маннит.
3.1. Эритрит (Е 968)
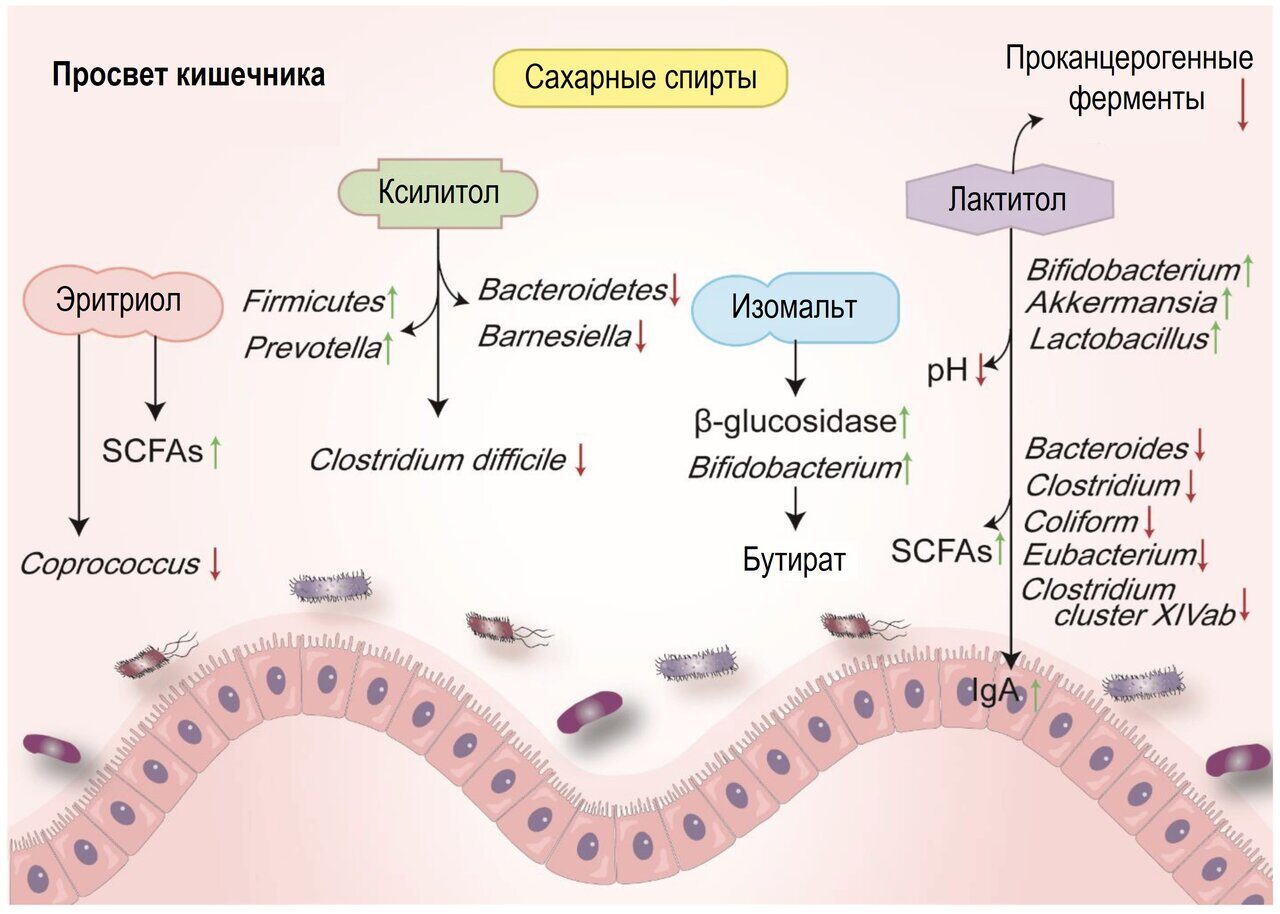
Эритрит (Эритритол) содержится во фруктах в естественном виде. После приема эритрита около 90 % всасывается в тонком кишечнике с очень низким уровнем метаболизма и выводится в неизменном виде с мочой. В толстой кишке кишечная флора может метаболизировать невсосавшуюся часть [106]. Микробиота кишечника человека, инкубированная с эритритолом, не изменяет общее газообразование, значения рН или продукцию SCFAs [107]. Karley et al. показали, что потребление эритритола вызывает повышение уровня масляной и пентановой кислот без существенных изменений в составе микробиоты кишечника [69]. Тем не менее, эритрит может ослаблять воспаление тонкого кишечника в моделях диеты с высоким содержанием жиров, вызывая снижение численности представителей рода Coprococcus [108,109]. Концентрация SCFAs в сыворотке крови, кале и белой жировой ткани была явно повышена (рис. 1) [109]. Учитывая ограниченное количество эритритола, попавшего в толстый кишечник, это соединение лишь незначительно влияет на состав микробиоты кишечника. Однако он может усилить микробиоту кишечника для производства SCFAs, что может облегчить воспаление кишечника. Несмотря на отсутствие прямых доказательств влияния эритрита на ВЗК, он считается дружественным бактериям полиолом, стабилизирующим микросреду кишечника, и может расщепляться до метаболитов, благоприятных для ВЗК.
Рисунок 1. Влияние сахарных спиртов на микробиом кишечника и метаболиты. "↑" означает повышенный уровень; "↓" означает пониженный уровень.
3.2. Изомальт (E 953)
Изомальт (изомальтит) давно используется в качестве подсластителя в пищевой и фармацевтической промышленности. Микроорганизмы легко разлагают невсосавшийся изомальт в толстой кишке [110]. В последних исследованиях он рассматривается как пребиотик [70]. У людей ферментированный в кишечнике изомальт способствовал увеличению численности бифидобактерий и снижению активности бактериальной β-глюкозидазы (рис. 1). Содержание SCFAs, лактата, желчных кислот, нейтральных стеринов, N, NH3, фенола и p-крезола в фекалиях также изменялось (табл. 2) [70]. Изомальт мог ферментироваться некоторыми штаммами бифидобактерий in vitro, что приводило к увеличению содержания бутирата. Однако экспрессия генов после воздействия изомальта не изменилась [70]. В другом исследовании кишечную микробиоту человека культивировали с гречишным медом, который является важнейшим натуральным подсластителем, состоящим из олигосахаридов и небольшой дозы изомальта и изомальтотриозы. Исследование показало, что гречишный мед может также повышать уровень бифидобактерий и сдерживать патогенные бактерии [111]. Несмотря на то, что влияние изомальта на течение ВЗК изучено в небольшом количестве клинических исследований, изомальт можно рассматривать как бифидогенный полиол и "близкий друг" для кишечного гомеостаза и микроокружения.
3.3. Ксилитол (E 967)
Ксилит (ксилитол) - это сахарный спирт с пятью углеродами, получаемый путем восстановления ксилозы. Микробная флора полости рта практически не получает энергии из ксилита, поэтому он считается некариогенным подсластителем и используется для изготовления жевательной резинки [112,113]. Сообщалось, что ксилит влияет на кишечную флору и оказывает ингибирующее действие на экспрессию воспалительных цитокинов, вызванную ЛПС. В исследовании, проведенном на человеке, употребление в пищу низкоусвояемых углеводов, включая ксилит, привело к значительному увеличению количества Anaerostipes spp. и бутирата в фекалиях [114]. Употребление ксилита может сдвинуть микробную популяцию кишечника грызунов с грамотрицательных на грамположительные бактерии [115]. Ксилит снижал уровень фекальных бактерий из типа Bacteroidetes и рода Barnesiella, в то время как увеличивал численность типа Firmicutes и рода Prevotella [114,116]. Более низкие концентрации ксилита могут также ингибировать вредные мутантные стрептококки (рис. 1) [117]. Следовательно, мы предполагаем, что ксилит может быть полезен для роста и метаболизма кишечной флоры, не оказывая при этом незначительной вредной стимуляции кишечника.
3.4. Лактитол (Е 966)
Считается, что лактитол (лактит) обладает умеренной сладостью и имеет более низкую сладость, чем лактулоза. Подобно ксилиту, он также считается некариогенным и не может метаболизироваться в верхних отделах пищеварительного тракта из-за дефицита β-галактозидазы; однако сахаролитические бактерии в толстой кишке способны расщеплять его для получения энергии.В нескольких исследованиях лактитол рассматривался как пребиотик, в то время как более высокое потребление лактиола может вызывать слабительный эффект [71,118].
У здорового человека прием лактитола уменьшал популяцию протеолитических бактерий, таких как Bacteroides, Clostridium, Coliforms, а также Eubacterium, и увеличивал рост Bifidobacterium, Lactobacillus и Streptococcus [72]. Небольшая доза лактитола может играть полезную роль для фекальных микроорганизмов [72,73]. Добавка лактита повышала уровень бифидобактерий (включая три вида: B. longum, B. pseudocatenu и B. latum) и лактобактерий (включая три вида: L. salivarius, L.fermentium и L. oris), но уменьшала численность Klebsiella pneumonia у больных циррозом печени [119]. Было отмечено увеличение численности Bifidobacterium и снижение численности B. Coccoides – группа E. rectale и кластер Clostridium XIVab после употребления лактитола с Lactobacillus acidophilus NCFM. Эти комбинированные пребиотические продукты могут также улучшить функции слизистой оболочки толстой кишки [120,121]. Пребиотик UG1601 (состоящий из инулина, лактита и геля алоэ вера) улучшал симптомы хронического запора, увеличивал относительную численность бактерий, продуцирующих бутират, включая Roseburia hominis, и уменьшал численность представителей типа Firmicutes и семейства Lachnospiraceae [122]. Другое исследование также показало его благотворное влияние на повышение уровня бифидобактерий. Это позволяет предположить, что лактитол может быть многообещающим кандидатом на пребиотик для пациентов с запорами [71]. Подобные изменения микробиоты кишечника после воздействия лактитола были также обнаружены у пациентов с хроническим вирусным гепатитом [123]. Подробности представлены на рисунке 1.
У животных употребление лактитола оказывало пребиотическое действие и снижало популяцию Enterobacteriaceae [74,75]. Примечательно, что употребление лактитола облегчало течение колита, изменяло α-разнообразие микробиоты кишечника и индуцировало повышение уровня Akkermansia (табл. 1) [31]. Это отличается от изменений кишечной флоры при ВЗК. Аккермансии могут разлагать муцин, производить SCFA и обеспечивать хозяина энергией. Они улучшают воспалительную реакцию и инсулинорезистентность, защищают кишечный эпителий и слизистый барьер у пациентов с ожирением и диабетом. Геном Akkermansia показал способность кодировать различные секреторные белки, такие как сульфаты, протеазы и гликоль-гидролизы. Следовательно, Akkermansia должна была метаболизировать лактитол и улучшать самораспространение.
Употребление лактитола также изменяет метаболиты кала (табл. 2). Он значительно снижает уровень pH в кале [72,73,75], что может быть результатом изменения SCFAs [71]. Он также увеличивал секрецию IgA без признаков воспаления слизистой оболочки [74]. Некоторые канцерогенные ферменты, такие как азоредуктаза, 7а-дегидроксилаза, β-глюкуронидаза, нитроредуктаза и уреаза, были снижены. Мы предположили, что это может быть связано с уменьшением количества анаэробных бактерий, продуцирующих эти ферменты, таких как Bacteroides и Clostridium, и заменой их Bifidobacterium или Lactobacillus [72].
Все эти результаты свидетельствуют о том, что лактитол применим в качестве пребиотика для улучшения дисбиоза кишечника и снятия кишечного воспаления, что позволяет предположить его приемлемость для пациентов с ВЗК.
4. Покрывающие и загущающие агенты
Мальтодекстрин (MDX), распространенный агент для покрытия и загущения в пищевой промышленности, способен модулировать микробную структуру и антибактериальную защиту хозяина через множество механизмов. Сообщалось, что он значительно изменяет разнообразие и численность микробиоты кишечника [124]. У здоровых людей потребление MDX значительно увеличивало численность Bifidobacterium longum и Bifidobacterium spp. [125]. В недавнем исследовании мышам с нокаутом по IL10 (IL10 KO) предварительно вводили фекальный материал мышей с дефицитом нуклеотид-связывающего домена олигомеризации 2 (NOD2 KO), чтобы вызвать воспаление кишечника. После введения 1%MDX анализ микробиома кала показал значительный сдвиг в α-разнообразии и β-разнообразии. В бокаловидных клетках кишечника мышей, которых кормили MDX, было снижено содержание муциновых гранул, что свидетельствовало о разрушении слизистого барьера [32]. У животных, получавших MDX, чаще возникал некротизирующий энтероколит с эрозиями и воспалением ворсинок слизистой оболочки; бактериальное разнообразие было снижено, при этом после приема MDX наблюдалось более высокое содержание Pseudomonas spp., Streptococcus spp. и Leuconostoc spp. и более низкий уровень Weissella app [33]. Более подробная информация представлена в таблице 3.
Таблица 3. Влияние мальтодекстрина на микробиоту кишечника.
|
Ref →
|
17
|
124
|
32
|
33
|
34
|
76
|
|
α-разнообразие
|
||||||
|
- богатство
|
-
|
↑
|
↓
|
-
|
-
|
-
|
|
- разнообразие
|
-
|
-
|
↓
|
-
|
-
|
-
|
|
β-разнообразие
|
-
|
S
|
S
|
-
|
-
|
-
|
|
Род
|
||||||
|
Bifidobacterium
|
↑
|
↑
|
||||
|
Bacteroides
|
↓
|
|||||
|
Mucispirillum
|
↑
|
|||||
|
Desulfovibrio
|
↓
|
|||||
|
Lactobacillus
|
↑
|
|||||
|
Enterococcus
|
↓
|
|||||
|
Faecalibacterium
|
↑
|
|||||
|
Akkermansia
|
↑
|
|||||
|
Roseburia
|
↑
|
|||||
|
Streptococcus
|
↑
|
↓
|
||||
|
Alistipes
|
↓
|
|||||
|
Leuconostoc
|
↑
|
|||||
|
Pseudomonas
|
↑
|
|||||
|
Weissella
|
↓
|
|||||
|
Oscillibacter
|
||||||
|
Вид
|
||||||
|
Escherichia coli
|
↑
|
|||||
|
Blautia coccoides
|
↑
|
Сокращения: “↑” — более высокое α-разнообразие или бактерии более многочисленны; “↓” — более низкое α-разнообразие или бактерии менее многочисленны; S — значительная разница, обнаруженная в β-разнообразии.
MDX также способен изменять пролиферацию и функции определенного вида бактерий. In vitro он может ускорять формирование биопленки ассоциированной с болезнью Крона (БК) адгезивной инвазивной E. coli (AIEC), которая уникально представлена в слизисто-ассоциированных бактериях пациентов с БК. Воздействие MDX индуцировало экспрессию пилей I типа и увеличивало адгезию бактерий к монослоям эпителиальных клеток кишечника человека по механизму, зависящему от пилей 1 типа. Исследование также продемонстрировало повышенную распространенность malX, гена, необходимого для метаболизма MDX, в штаммах AIEC. Это позволило предположить, что метаболизм MDX может способствовать колонизации E. coli в терминальной части подвздошной кишки [33]. Аналогичным образом MDX разрушал кишечный антимикробный барьер и усиливал колонизацию слизистой оболочки Salmonella у мышей с гастроэнтеритом, инфицированных Salmonella. Исследование также выявило ингибирование энергетического метаболизма в макрофагах костного мозга мышей после воздействия MDX с пониженной экспрессией NAPDH-оксидазы и ограниченным привлечением NADPH-оксидазы к везикулам, содержащим Salmonella. Это также может привести к персистенции сальмонелл в увеличенных поздних Rab7+эндосомальных везикулах, что может объяснить открытие in vivo [34]. Однако другое исследование показало, что MDX способствует истощению слизи, вызванному стрессом эндоплазматического ретикулума и усугубляет воспаление кишечника без значительных изменений в микробиоте, связанной со слизистой оболочкой (таблица 1) [126].
Различные образцы MDX также оказывают различное влияние на кишечную флору. Более длинные цепи MDX были более эффективны для образования биопленок AIEC, тогда как MDX с короткими кластерами ослаблял метаболическую дисрегуляцию, вызывая возможный пробиотический эффект [35]. Изомальтодекстрин, ферментативно получаемый из MDX с помощью ферментов α-глюкозидазы и α-амилазы, способствует росту бифидобактерий в слепой кишке и, как предполагалось, оказывает противовоспалительное действие [127]. MDX также изменил концентрацию SCFAs, хотя убедительных доказательств того, как MDX влияет на бактериальные метаболиты, недостаточно (таблица 2) [17,33,76,128]. В целом, MDX может вызвать воспаление кишечника с пролиферацией и колонизацией некоторых вредных видов, одновременно способствуя росту некоторой полезной микробиоты. Однако недавние данные в основном получены в результате экспериментов на животных, и необходимы дополнительные исследования для выяснения эффекта MDX на людях.
5. Эмульгаторы
Эмульгаторы широко применяются в повседневной жизни благодаря своей способности стабилизировать эмульсии и продлевать срок годности, предотвращая расслоение при хранении. Они могут действовать как желирующие агенты и поверхностно-активные вещества благодаря тому, что молекулы жира в продуктах питания адсорбируются на гидрофобном конце эмульгатора, а вода адсорбируется на гидрофильном конце. К распространенным эмульгаторам относятся карбоксиметилцеллюлоза (CMC), полисорбаты, каррагинан и т.д. [129,130,131].
5.1. Карбоксиметилцеллюлоза (E 466) и полисорбат 80 (E 433)
CMC и полисорбат 80 (P80) часто встречаются в пищевых маслах, мороженом, смесях для тортов, глазури и шоколадном сиропе. Тем не менее, эти добавки не заслуживают места в гомеостазе кишечника. Воздействие эмульгаторов CMC и P80 негативно влияет на кишечную микробиоту [131].
Эмульгаторы могут вызывать воспаление кишечника через микробиоту (табл. 1). Прием P80 вызвал изменения в микробиоме кишечника человека, аналогичные ВЗК, что привело к снижению численности полезного рода Bifidobacterium, важных продуцентов SCFA, таких как роды Faecalibacterium и Subdoligranulum, а также Clostridium leptum [17]. Naimi et al. обрабатывали образцы фекалий здоровых людей различными эмульгаторами в модели MiniBioReactor Array ex vivo и обнаружили изменение бактериального β-разнообразия после обработки P80, при этом наблюдался более низкий рост Streptococcus и Faecalibacterium [124]. У мышей прием P80 усугублял илеит, вызванный индометацином, снижая α-разнообразие кишечной микробиоты. При этом значительно усиливался рост продуцентов сульфидов, включая Enterobacteriacaeae, и роевое поведение связанного с ВЗК вида Proteus mirabilis [36]. Роение - это тип движения, опосредованного жгутиками, который является многоклеточным процессом и требует дифференциации вегетативных клеток в специализированный тип клеток, называемый клетками-рояльщиками [132]. Способность Proteus mirabilis к роению тесно связана с его патогенезом при ВЗК [133]. Интересно, что предварительная обработка антибиотиками отменяла этот вредный эффект, что указывает на важную роль дисбиоза подвздошной кишки [25]. Мета-транскриптом микробиоты человека после воздействия P80 показал, что биологические процессы, включая связывание нуклеиновых кислот (структурных компонентов рибосом), связывание ионов, связывание нуклеотидов, активность изомеразы и оксидоредуктазы, были усилены [124].
Недавнее клиническое исследование, изучавшее влияние CMC на микробиоту кишечника человека, показало, что это воздействие изменило бактериальное богатство и разнообразие, что привело к повышению уровня Roseburia spp. и Lachnospiraceae, а также снижению количества Faecalibacterium prausnitzii и Ruminococcus spp. [134]. В исследовании Naimi et al. β-разнообразие микробиоты кишечника человека значительно изменилось с уменьшением количества Streptococcus после обработки CMC [124]. Добавление CMC также вызвало тяжелый БК-подобный колит у мышей, нокаутированных по IL10. CMC изменил β-разнообразие микробиоты кишечника и увеличил концентрацию общих бактерий в подвздошной кишке. Кроме того, больше бактерий заполняли промежутки между ворсинками, усиливая их миграцию на дно крипт [11,38]. Chassaing et al. обнаружили, что длительный прием CMC или P80 вызывал низкосортное кишечное воспаление и способствовал развитию сильного колита у мышей, предрасположенных к этому заболеванию, что в конечном итоге приводило к усилению бактериального обсеменения. Эти эмульгаторы вызывали снижение микробного разнообразия, увеличивая богатство Akkermansia muciniphila и бактерий Proteobacteria, способствующих воспалению. После трансплантации фекалий от животных, обработанных эмульгатором, у мышей, не имеющих микробов, наблюдалось умеренное воспаление в толстой кишке с изменением кишечных микроорганизмов. Это еще раз иллюстрирует роль эмульгаторов в развитии патологий, вызванных дисбактериозом [11]. Авторы также применили имитатор слизистой оболочки модели микробной экосистемы кишечника человека (M-SHIME) для исследования изменений состава микробиоты человека и экспрессии генов ex vivo. Результаты показали, что Р80 резко повлиял на разнообразие и состав микробиоты, в то время как CMC продемонстрировал явное влияние на состав сложной микробиоты. Более того, суспензии M-SHIME, обработанные CMC и P80, были способны стимулировать слабое воспаление кишечника у безмикробных мышей, способствуя росту бактерий, связанных с воспалением, таких как Proteobacteria и Enterobacteriacae, и снижая уровни Bacteroidaceae (таблица 1) [39].
Многие исследования также изучали взаимодействие между эмульгаторами и кишечной палочкой. Одной адгезивно-инвазивной Escherichia coli (AIEC) достаточно, чтобы сделать мышей склонными к пагубному воздействию CMC и P80. После потребления CMC и P80 колонизация AIEC вызывала хроническое воспаление кишечника и кишечное бактериальное вторжение у стерильных (безмикробных) мышей [10]. Воздействие эмульгаторов также увеличивало адгезию AIEC к эпителиальным клеткам кишечника in vitro. Такие эффекты более выражены, когда существует дополнительная микробиота, такая как измененные представители флоры Шедлера (ASF) [10]. Более того, транскриптомный анализ выявил активацию генов, которые опосредуют вирулентность AIEC и ее способность способствовать воспалению. Оба эмульгатора способны индуцировать экспрессию гена diaA, который может кодировать белок, DnaA, активирующий инициацию репликации ДНК у бактерий. Гены, связанные со жгутиками, пилями 1-го типа и длинными полярными фимбриями, заметно активировались под действием CMC дозозависимым образом [10]. Более того, прием CMC уменьшал размер пор свиной слизи, что приводило к замедлению скорости диффузии частиц через слизь. Тем не менее, P80, по-видимому, минимально влияет на микроструктуру слизистой оболочки и дисперсию частиц [135]. P80 увеличивал подвижность E coli и ее способность перемещаться по микроскладчатым эпителиальным клеткам, посредством чего эпителий кишечника подвергался инвазии кишечной флорой [37]. В заключение можно сказать, что CMC и P80 взаимодействовали с патогенными бактериями, способствуя их вирулентности и проникновению. Потенциальный механизм продемонстрирован на рис. 2. Метаболиты в кале или содержимом просвета также изменились после приема CMC и P80. Было очевидно повышенное содержание большинства SCFAs, таких как масляная, пропионовая, валериановая и каприловая кислоты [11,17]. Состав фекальных желчных кислот резко изменился под воздействием CMC [11]. Уровни флагеллина и ЛПС повышались после обработки обоими эмульгаторами, что соответствовало результатам метагеномных анализов, показывающим обогащение генов, связанных со жгутиками и подвижностью бактерий в микробиоме кишечника (таблица 2) [10,32].
Рисунок 2. Механизм индуцированного эмульгаторами колита через микробиом кишечника. Эмульгаторы (1) изменяли рост и функции AIEC, что приводило к активации воспалительных путей в эпителии; (2) увеличивали численность бактерий, связанных с воспалением; (3) разрушали слизистый барьер. "↑" означает повышенный уровень.
Для пациентов с ВЗК употребление CMC и P80 должно вызывать серьезные опасения из-за их способности разрушать слизистый барьер и способствовать развитию сильного колита, изменяя состав и функции кишечных бактерий. Необходимо провести дополнительные исследования, чтобы оценить их влияние на здоровье кишечника человека.
5.2. Каррагинан (E 407)
Прим. ред.: каррагинан представляет собой высокосульфатированный гидрофильный коллоид, выделяемый из красных водорослей, и подразделяется на различные подтипы, такие как λ, κ, ι, ε и μ, которые определяются главным образом количеством и расположением сульфатных групп, а также содержанием 3,6-эндо-D-галактопиранозида.
Каррагинаны представляют собой группу сульфатированных полигалактанов, которые являются GRAS для повседневного использования [136]. Они обычно встречаются в ароматизированном молоке, кофе со льдом, молочном мороженом и замороженных десертах [137]. Переоценка каррагинана, проведенная EFSA, показала, что текущий ADI каррагинана следует считать временным, и это мнение необходимо улучшить в течение 5 лет. Метаболизм каррагинана в значительной степени осуществляется микробиотой кишечника хозяина [138]. Следовательно, микробы кишечника напрямую взаимодействуют с каррагинаном, влияя на гомеостаз кишечника. Интересно, что каррагинан разных видов и молекулярной массы оказывает разное воздействие на хозяина. Каррагинан можно разделить на низко- и высокомолекулярный, деградированный и недеградированный [139,140]. Было показано, что низкомолекулярный каррагинан увеличивает проницаемость кишечника и связан с возникновением колита [40]. Однако каррагинан с высокой молекулярной массой может обладать многообещающей противоопухолевой и антиоксидантной активностью. Сообщалось, что каррагинан вызывает и усугубляет воспаление кишечника, изменяя состав микробиоты кишечника (таблица 1). Onderdonk et al. показали, что каррагинан вызывал язвы кишечника у поросят, если они не находились в безмикробном состоянии [46,47]. Потребление каррагинана приводило к увеличению количества Proteobacteria и Deferribacteres, а также к снижению количества Firmicutes, Actinobacteria и Bacteroidetes [45]. Было высказано предположение, что различные изомеры каррагинана (κ-, ι- и λ-) вредно влияют на экологию кишечника.
Прим. ред.: В зависимости от степени полимеризации и этерификации препараты каррагинанов классифицируются на три группы: 1) Каппа (κ): сильные, твёрдые гели (одна сульфатная группа на две молекулы галактозы). Производятся из Kappaphycus cottonii; 2) Йота (ι): мягкие гели (две сульфатные группы на две молекулы галактозы). Производятся из Eucheuma spinosum; 3) Лямбда (λ): формируют гели в смеси с белками, а не водой; используются для загущения молочных продуктов (три сульфатные группы на две молекулы галактозы). Наиболее частый источник — водоросли Gigartina из Южной Америки.
В микробиоте кишечника человека каждый изомер вызывал изменения α-разнообразия и повышал провоспалительный потенциал микробиоты. Bacteroides был значительно обогащен κ- и λ-каррагинаном, тогда как Faecalibacterium был понижен ι-каррагинаном с более высоким содержанием флагеллина после обработки [124]. κ-каррагинан вызывал сильный колит в модели диеты с высоким содержанием жиров, значительно увеличивая количество Shigella и уменьшая количество Bifidobacterium [17]. Численность двух бактерий, связанных с воспалением, Alistipes Finegoldii и Bacteroides acidifaciens, также была заметно увеличена [42]. Аналогичным образом, у крыс, получавших ι-каррагинан, отмечалось значительное снижение общей численности бактерий и концентраций видов Enterobacteria, Staphylococci spp., Streptococci spp. и Lactobacillus spp. в фекалиях [141]. Shang et al. напрямую сравнили влияние различных изомеров на кишечную флору. Все они заметно вызывали снижение численности Akkermansia muciniphila. Однако богатство и разнообразие фекальных бактерий увеличилось после лечения ι-каррагинаном, но снижение обоих показателей наблюдалось после воздействия κ-каррагинана [41,43].
В некоторых исследованиях делается противоположный вывод. Добавление Sarconema filiforme, красной морской водоросли, содержащей в основном ι-каррагинан, ослабляло симптомы метаболического синдрома и слегка модулировало микробиоту кишечника у крыс [142]. У дрозофилы ι-каррагинан значительно увеличивал численность Commensalibacter, которые могли снижать регуляцию NF-kB-зависимых генов антимикробных пептидов и регулировать комменсальный кишечный мутуализм [143].
Более того, предыдущие исследования показали, что изменения в микробиоме кишечника наблюдались только при употреблении каррагинана в питьевой воде, но не в рационе с добавлением каррагинана, что говорит о том, что связывание с другими пищевыми ингредиентами, такими как белок, возможно, изменило его конформацию и лишило его биодоступности для некоторых бактерий [42].
После иммунизации животных Bacteroides vulgatus воздействие каррагинана приводило к более тяжелым поражениям кишечника, а в сыворотке крови обнаруживались антитела к этим бактериям [47]. Активность некоторых ферментов, таких как азоредуктаза, β-глюкозидаза и нитроредуктаза, была снижена в содержимом печени [141]. В другом исследовании два синергичных штамма, Bacteroides xylanisolvens 38F6A4 и E. coli 38F6C1, были получены из фекалий здорового человека и введены беззародышевым мышам, что усилило воспаление кишечника при употреблении каррагинана. Bacteroides xylanisolvens 38F6A4 могли вырабатывать β-каррагиназу для деградации каррагинана. Более того, E. coli 38F6C1 может косвенно контактировать с Bacteroides xylanisolvens 38F6A4. Она быстро потребляла кислород во время ферментации и создавала относительно гипоксическую среду, которая благоприятствовала росту Bacteroides xylanisolvens 38F6A4. Эти исследования позволили предположить, что некоторые микробы кишечника могут содержать каррагиназы, которые могут взаимодействовать друг с другом для деградации каррагинана и, таким образом, генерировать вредные метаболиты, изменяя адаптивные иммунные реакции хозяина [40]. Сообщалось, что гликопротеин, удаленный при злокачественных опухолях мозга 1 (DMBT1), взаимодействует с каррагинаном. DMBT1 - секретируемый гликопротеин с широким спектром связывания бактерий и помогает предотвратить их проникновение в организм. Воздействие каррагинана конкурировало с DMBT1-опосредованной агрегацией бактерий через связывание со специфическим пептидом, распознающим бактерии, и нарушало защиту слизистой оболочки, обеспечиваемую DMBT1. Это продемонстрировало новый механизм, согласно которому каррагинан способен нарушить врожденную иммунную функцию слизистой оболочки, обеспечиваемую DMBT1, что может привести к началу или продолжению воспалительной реакции на кишечные бактерии или бактериальные антигены [44].
У пациентов с ЯК в стадии ремиссии более высокая частота рецидивов наблюдалась после лечения каррагинансодержащей диетой [140]. Учитывая прямое вредное воздействие каррагинана на пациентов с ВЗК и микробиоту кишечника, мы предположили, что каррагинан может оказывать вредное воздействие на пациентов с ВЗК в результате нарушения микробиома кишечника и гомеостаза кишечника.
5.3. Глицерин-монолаурат (монолаурин)
Глицерин-монолаурат (GML) является натуральным моноэфиром глицерина лауриновой кислоты и одобрен FDA в качестве безопасного эмульгатора. In vitro GML подавляет рост и патогенность бактерий, грибков и оболочечных вирусов [144]. Следовательно, GML считается антимикробным эмульгатором, который широко используется широкой общественностью.
Jiang et al. провели серию исследований о том, как GML влияет на микробиоту кишечника и системное воспаление. Потребление GML повышает циркулирующие уровни провоспалительных цитокинов. Это значительно изменило β-разнообразие и состав кишечной микробиоты в результате увеличения численности Bacteroides acidifaciens и снижения уровня Akkermansia muciniphila и Lupinus luteus [145]. Однако GML модулировал местную микробиоту дозозависимым образом. Высокая доза GML (1600 мг/кг) повышала экспрессию противовоспалительного TGF-β1 и IL-22, увеличивая относительную численность здоровой основной микробиоты, такой как Clostridium XIVa, Oscillibacter и Parasutterella [48]. Дозы GML в 400 и 800 мг/кг также улучшили содержание противовоспалительной Barnesiella в контексте проблемы DSS-индуцированного колита. GML продемонстрировал благоприятный эффект при метаболическом синдроме и ожирении [48,49]. GML снижал вызванную диетой с высоким содержанием жиров нагрузку на циркулирующий ЛПС и снижал резистентность к инсулину при увеличении Bacteroides uniformis, Bifidobacterium pseudolongum, Akkermansia и Lactobacillus. Эти роды и виды чрезвычайно важны для улучшения метаболизма с помощью GML [50]. В таблице 1 показаны взаимодействия между GML, кишечной микробиотой и воспалением кишечника.
Также оценивался защитный эффект GML при колите и потенциальный механизм, связанный с дисбактериозом [48,51]. Предварительная обработка GML превосходит сопутствующую терапию GML при колите. Предварительная обработка GML увеличивала содержание лактобактерий и бифидобактерий в кале при более высоком уровне пропионовой и масляной кислот. Это привело к более быстрой и качественной ремиссии колита, в результате чего восстановились микробные сообщества с повышением уровня SCFAs в фекалиях (табл. 2) [31]. Таким образом, ремиссия колита, вызванная GML, связана с изменением состава микробиоты кишечника, что позволяет предположить, что этот препарат может быть дружественным спутником при ВЗК.
6. Пищевые красители
Рынок пищевых красителей оценивается в 5 млрд долларов США в 2020 году и, по оценкам, вырастет до 6,8 млрд долларов США к 2025 году при совокупном темпе роста (CAGR) в 5,4 % [146]. Пищевые красители, такие как азокрасители и наночастицы диоксида титана (TiO2 NPs), широко применяются в пищевой промышленности для придания пище более привлекательного вида и защиты от других загрязнителей.
6.1. Диоксид титана (E 171)
Наночастицы диоксида титана (TiO2 NPs) являются широко используемыми инженерными наноматериалами, которые часто встречаются в продуктах питания, чернилах и солнцезащитных средствах. Пищевые TiO2 NPs являются отбеливающими агентами, которые широко применяются в пищевых продуктах [147]. Более 40 % из них могут быть проглочены при жевании жевательных резинок [148]. Тем не менее, согласно обновленным данным Европейского управления по безопасности пищевых продуктов (ESFA), TiO2 NPs больше не считаются безопасными при использовании в качестве пищевой добавки из-за их генотоксичности [149]. Воздействие TiO2 NPs также может привести к дисфункции кишечного барьера [150], что приведет к умеренному воспалению кишечника и усилению иммунологического ответа [58]. Кроме того, они оказывают антибактериальное действие на пробиотические или симбиотические бактерии и негативно влияют на человека [151].
У людей добавление TiO2 NPs приводило к умеренному снижению плотности сообщества [78] и вызывало уменьшение доминирующих Bacteroides ovatus и Clostridium cocleatum [79]. Увеличение численности Firmicutes и уменьшение численности Bacteroidetes было отмечено в нескольких исследованиях на животных [52,53,54,59]. Также увеличилось количество Proteobacteria, Cyanobacteria и Actinobaceria [152]. На родовом уровне TiO2 NPs вызывали уменьшение количества полезных бактерий, включая Barnesiella, Akkermansia и Bacteroides, в дозозависимой манере [54]. Сообщалось, что Barnesiella удаляет патогенные бактерии, устраняет колонизацию энтерококков, устойчивых к ванкомицину, и сдерживает распространение бактерий, устойчивых к антибиотикам [153]. Она может улучшать действие противораковых соединений, таких как циклофосфамид [154]. Снижение количества Barnesiella, вероятно, связано с патогенезом ВЗК. Кроме того, TiO2 NPs вызывали воспалительную инфильтрацию и митохондриальные нарушения в толстой кишке, что приводило к увеличению количества представителей рода Turicibacter, а также Lactobacillus_gasseri и группы Lachnospiraceae bacterium NK4A136 в кале [56]. Примечательно, что Lactobacillus считается одним из основных производителей биопленок [57]. Таким образом, TiO2 NPs могут соединяться с бактериями, провоцируя образование биопленки [155]. У мышей с нокаутом по IL 10 Lactobacillus gasseri может оказывать очевидное противовоспалительное действие, возможно, благодаря своей способности продуцировать марганец-зависимую супероксиддисмутазу (SOD2) [156]. Таким образом, можно предположить, что усиление действия Lactobacillus gasseri является адаптивным ответом на воспалительный и окислительный стресс, вызванный TiO2 NPs [157]. Аналогичные результаты были также продемонстрированы на дрозофиле и зебрафише [151,158]. Подробности представлены в табл. 4.
Таблица 4. Влияние наночастиц диоксида титана на микробиоту кишечника.
|
Ref →
|
17
|
58
|
151
|
78
|
79
|
52
|
53
|
54
|
59
|
152
|
56
|
57
|
155
|
55
|
159
|
77
|
Всего
|
|
|
↑
|
↓
|
|||||||||||||||||
|
α-разнообразие
|
||||||||||||||||||
|
- богатство
|
-
|
N
|
-
|
↓
|
-
|
-
|
-
|
↓
|
-
|
↓
|
N
|
N
|
↓
|
-
|
N
|
-
|
0
|
4
|
|
- разнообразие
|
-
|
N
|
-
|
N
|
-
|
-
|
-
|
↓
|
-
|
↓
|
N
|
N
|
-
|
-
|
N
|
-
|
0
|
2
|
|
β-разнообразие
|
S
|
-
|
-
|
N
|
-
|
-
|
-
|
S
|
S
|
S
|
N
|
N
|
S
|
-
|
N
|
-
|
S = 5
|
|
|
Тип
|
||||||||||||||||||
|
Bacteroidetes
|
↑
|
↓
|
↓
|
↓
|
↑
|
↑
|
3
|
3
|
||||||||||
|
Verrucomicrobia
|
↓
|
↑
|
1
|
1
|
||||||||||||||
|
Firmicutes
|
↑
|
↑
|
↑
|
↑
|
↑
|
↑
|
6
|
0
|
||||||||||
|
Proteobacteria
|
↑
|
↓
|
1
|
1
|
||||||||||||||
|
Actinomycetes
|
↑
|
↑
|
2
|
0
|
||||||||||||||
|
Cyanobacteria
|
↑
|
1
|
||||||||||||||||
|
Deferribacteres
|
↑
|
1
|
||||||||||||||||
|
Род
|
||||||||||||||||||
|
Bifidobacterium
|
↓
|
↓
|
0
|
2
|
||||||||||||||
|
Bacteroides
|
↓
|
↑
|
1
|
1
|
||||||||||||||
|
Parabacteroides
|
↑
|
1
|
0
|
|||||||||||||||
|
Lactobacillu
|
↓
|
↑
|
↓
|
↑
|
2
|
2
|
||||||||||||
|
Prevotella
|
↓
|
0
|
1
|
|||||||||||||||
|
Turicibacter
|
↑
|
1
|
0
|
|||||||||||||||
|
Akkermansia
|
↓
|
0
|
1
|
|||||||||||||||
|
Adlercreutzia
|
↓
|
0
|
1
|
|||||||||||||||
|
Barnesiella
|
↓
|
0
|
1
|
|||||||||||||||
|
Rhodococcus
|
↑
|
1
|
0
|
|||||||||||||||
|
Lawsonia
|
↑
|
1
|
0
|
|||||||||||||||
|
Allobaculum
|
↑
|
1
|
0
|
|||||||||||||||
|
Enterobacteria
|
↑
|
1
|
0
|
|||||||||||||||
|
Acetobacteria
|
↑
|
1
|
0
|
|||||||||||||||
|
Вид
|
||||||||||||||||||
|
Clostridium leptum
|
↓
|
0
|
1
|
|||||||||||||||
|
Clostridium cocleatum
|
↑
|
1
|
0
|
|||||||||||||||
|
Bacteroides ovatus
|
↓
|
0
|
1
|
|||||||||||||||
Сокращения: “↑” — более высокое α-разнообразие или бактерии более многочисленны; “↓” — более низкое α-разнообразие или бактерии менее многочисленны; S — значительная разница, обнаруженная в β-разнообразии.
TiO2 NPs могут усугублять тяжесть колита и даже последующий канцерогенез толстой кишки через кишечные микроорганизмы. Обработка TiO2 усугубляла вызванное диетой с высоким содержанием жиров разрушение слизистого слоя, в то время как истощение кишечной флоры устраняло эти эффекты. Употребление TiO2 NPs также вызывало увеличение численности Firmicutes и уменьшение численности Lactobacillus и Bifidobacterium у мышей с ожирением [52,53]. TiO2 NPs могут ухудшать иммунные нарушения, снижая долю Treg-клеток и CD4+ T-клеток [58]. Аналогично, удаление микробиоты кишечника могло бы снять воспаление кишечника, вызванное TiO2 NPs. Таким образом, TiO2 NPs способны вызывать воспаление и изменять слизистый барьер через микробиом кишечника, что может быть связано с различными заболеваниями, включая ожирение и ВЗК (табл. 1).
Различные дозы или размеры TiO2 NPs оказывали различное влияние на микробиоту кишечника (табл. 4). При меньшей дозе воздействия TiO2 NPs были получены результаты, схожие с исследованиями CMC и P80. Наблюдалось значительное увеличение количества Lactobacillus и Allobacullum [56]. Некоторые исследования показали, что более высокая доза не вызывает значительных изменений [59], в то время как острое воздействие высокой дозы TiO2 NPs вызывает воспалительный ответ в подвздошной кишке и влияет на уровень слизисто-ассоциированных бактерий, включая Lactobacillus [55]. Кроме того, более крупный размер (50 или 100 нм) TiO2 NPs подавлял рост Lactobacilli более явно, чем более мелкий (10 нм) [151]. Меньший размер индуцирует более высокую концентрацию эндоцеллюлярных ROS, что соответствует лучшему антибактериальному эффекту [56]. Различные компоненты TiO2 NPs также оказывали различное влияние на микробиоту кишечника. Пищевые TiO2 NPs имели в большей степени рутиловую структуру, в то время как промышленные TiO2 NPs были в основном анатазными. Прием рутилового TiO2 NPs привел к неравномерному расположению клеток эпителия ворсинок и удлинению кишечных ворсинок. Они оказывали более сильное воздействие на кишечную микробиоту, чем анатазные TiO2 NPs. На уровне родов рутиловые TiO2 NPs повышали уровень Rhodococcu, а анатазные TiO2 NPs увеличивали численность Bacteroides [159]. Более того, воздействие TiO2 NPs пищевого качества оказывало большее ингибирующее влияние на переход от типа Proteobacteria к типу Firmicutes [77].
TiO2 NPs изменяют содержание метаболитов в фекалиях (Таблица 2). Хотя три исследования не выявили существенной разницы в уровне SCFAs [17,78,79], два исследования показали снижение концентрации SCFAs у мышей, подвергшихся воздействию более низкой дозы TiO2 NPs [19,57]. Однако высокая доза TiO2 NPs увеличивала уровень SCFAs в фекалиях [55]. Метаболомный анализ фекалий показал увеличение содержания капролактама, N-ацетилгистамина и глицерол-фосфохолина, а также уменьшение L-гистидина, 4-метил-5-тиазолэтанола и L-орнитина [56]. Путь биосинтеза аминоацил-тРНК был значительно обогащен в ходе биоинформационного анализа. Аминоацил-тРНК являются важнейшими субстратами для трансляции в микробиоте кишечника [66]. Более того, было показано, что сами по себе TiO2 NPs могут действовать как адъюванты, вызывая цитокиновые реакции через активацию NLRP3-инфламмасомы и генерацию ROS при взаимодействии с бактериальными антигенами, такими как ЛПС [160].
Таким образом, употребление TiO2 NPs нарушает целостность слизистой оболочки и изменяет функции и численность специфической флоры в кишечнике, что связано с риском и рецидивом ВЗК.
6.2. Азокрасители
Азокрасители состоят из диазотированного амина, который присоединен к фенолу или амину и включает по крайней мере одну азо-связь (-N = N-). В естественных условиях азосоединение азокрасителей может быть расщеплено азоредуктазой с образованием ароматических аминов [161]. К пищевым азокрасителям относятся Allura Red (Red 40, обозначается как E 129), Ponceau 4R (E124), Carmoisine (E 122), Quinoline Yellow (E 104), Тартразин (TZ, обозначается как E102) и Sunset Yellow (Yellow 6, обозначается как E110) [162]. Считалось, что Red 40 усиливает воспаление кишечника у мышей, склонных к колиту [60], в то время как состав фекальных бактерий существенно не изменяется (табл. 1). Однако колит у безмикробных мышей не наблюдался, пока последние не были колонизированы Bacteroides ovatus, что указывает на то, что провоспалительный эффект Red 40 зависит от бактерий кишечника. Кроме того, Red 40 и Yellow 6 могут быть метаболизированы комменсальными бактериями в натриевую соль 1-амино-2-нафтол-6-сульфоната (ANSA-Na). Обработка ANSA-NA также вызывала колит у мышей дикого типа, а не у безмикробных мышей. Это позволило предположить, что метаболит, вызывающий колит, требует участия бактерий (Таблица 2 и Рисунок 3) [60].
Рисунок 3. Влияние различных пищевых красителей на слизистый барьер и микроэкологию кишечника. "↑" означает повышенный уровень; "↓" означает пониженный уровень.
Употребление TZ (E102) может вызвать серьезные физиологические нарушения и гистопатологические изменения в организме карася. Он может вызывать окислительный стресс и повышать уровень провоспалительных цитокинов в дозозависимой манере, что указывает на тенденцию к воспалению кишечника. Более того, было обнаружено значительное сокращение некоторых пробиотических бактерий, включая Rhodococcus, Roseomonas и Bacillu, в то время как патогенные бактерии, такие как Bdellovibrio и Shewanella, были обогащены [61]. Уровень SCFAs, особенно бутирата, также снижался после поглощения TZ [80]. Таким образом, важно рассмотреть пагубное влияние TZ на кишечные барьеры и микробиоту, которые могут быть враждебными для пациентов с ВЗК (рис. 3).
Суданские азокрасители (Судан I, II, III, IV и Para Red) широко применяются в производстве печатных красок, пластмасс, кожи, воска и тканей [82]. Из-за их канцерогенности большинство стран запретили их использование в пищевой промышленности. В некоторых агентствах они все еще незаконно используются из-за дешевой цены и яркой окраски. Судан I и II сдерживали рост Lactobacillus rhamnosus и Clostridium perfringens. Судан II мог влиять на рост Enterococcus faecalis, однако после культивирования с Суданом III и IV содержание Bifidobacterium catenulatum, Clostridium perfringens, Enterococcus faecalis, Peptostreptococcus magnus и E. coli s значительно снизилось in vitro. Все они способны избирательно подавлять способность к выживанию двух видов Clostridium (Clostridium indolis и Clostridium ramosum). Как и TZ, один из метаболитов красителей, 1-амино-2-нафтол, был способен подавлять рост большинства бактерий [82]. Судан III и IV могут быть деградированы до некоторых канцерогенных ароматических аминов, таких как анилин и о-толуидин, некоторыми распространенными бактериями соответственно [81]. В итоге, Судан III и IV могут подавлять рост микробиоты кишечника человека сильнее, чем Судан I, II и Para Red. Современные данные показывают, что азокрасители Судана и их метаболиты играют опасную роль в гомеостазе кишечника. (Таблица 2 и Рисунок 3) [80,82].
7. Консерванты
Пищевые консерванты могут отсрочить разложение и продлить срок годности продуктов, ограничивая рост микроорганизмов и препятствуя окислению пищи. В настоящее время многие распространенные консерванты, такие как бензойная кислота, сорбат калия, нитрит и сульфит натрия, а также наночастицы Ag (Ag NPs), по некоторым данным, также вызывают изменение микробиоты кишечника. Однако Американская академия педиатрии предупреждает, что консерванты могут быть связаны с ухудшением гиперактивного поведения или риском канцерогенности, и предлагает избегать некоторых консервантов у детей. В последние годы этот факт привлек внимание FDA [163,164,165,166,167].
7.1. Бензойная кислота и бензоат натрия (E210, 211)
И бензойная кислота (BA), и бензоат натрия (SB) действуют как консерванты пищевых продуктов благодаря своей способности ограничивать рост патогенных микроорганизмов. Вся абсорбированная BA может полностью расщепляться до гиппуровой кислоты [168]. Недавние исследования изучали благотворное влияние BA и SB на барьерные функции кишечника и микробиоту кишечника путем регулирования окислительного статуса и иммунного состояния. Однако чрезмерное потребление может привести к разрушению кишечного барьера из-за окислительно-восстановительного статуса.
Применение BA повышало степень биоразнообразия микробиоты подвздошной кишки, снижая обилие общих аэробных бактерий дозозависимым образом [83]. Кроме того, BA уменьшала обилие грамотрицательных бактерий в двенадцатиперстной кишке [84]. У поросят обработка BA увеличивала высоту кишечных ворсинок, повышала уровень полезных микроорганизмов (например, Bifidobacterium и молочнокислых бактерий) и снижала популяцию вредных микроорганизмов [85,169]. Содержимое цекума поросят показало аналогичный эффект, при этом концентрация кишечной палочки была ниже, а уровень Lactobacillus и Bacillus - выше [86,170]. Однако смесь сорбата, бензоата и нитрита приводила к процветанию Proteobacteria и значительному снижению Clostridiales. Недавние исследования показали, что BA повышала восприимчивость к индуцированию дисбактериоза протеобактериями у мышей нокаутных по NOD2 (табл. 1). Примечательно, что размножение протеобактерий предполагается в качестве потенциального диагностического маркера дисбактериоза и связано с риском таких заболеваний, как ВЗК [62]. Кроме того, в моче было обнаружено снижение содержания гиппуровой кислоты, что связано с изменением микробиома кишечника у пациентов с болезнью Крона (табл. 2) [83].
Терапевтический потенциал SB был отмечен в модели язвенного колита, возможно, благодаря его антиоксидантной и противовоспалительной активности. SB может избирательно подавлять рост восприимчивых микробов кишечника. Добавление в рацион бензоата и глифосата может привести к чрезмерному росту общего микробиома кишечника, особенно представителей семейства Enterobacteriaceae [97]. Интересно, что Enterococcus faecalis, Lactobacillus paracasei и Bifidobacterium longum более восприимчивы к SB [62,171]. Мы предположили, что SB может быть дружественным игроком в микробиоте кишечника при ВЗК. Однако существующие исследования показали противоречивые мнения о SB, поэтому необходимы дополнительные исследования для уточнения влияния данного консерванта на кишечную флору и воспаление кишечника.
7.2. Сорбат калия (E 202)
Сорбат калия (PS) - это антисептический агент с низкой токсичностью, сильно подавляющий бактерии порчи и плесень при незначительном влиянии на органолептические свойства [172]. В предыдущих исследованиях сообщалось, что PS ограничивает жизнеспособность микробиоты кишечника через изменение иммунитета хозяина. Воздействие PS значительно снижало содержание IgG, IL-1β и TNF-α в кишечнике, что приводило к активации иммунной системы у зебрафиш. На уровне рода содержание полезных бактерий Faecalibacterium, а также патогенных бактерий Aeromonas и Methylobacterium продемонстрировало значительную тенденцию к снижению [172]. In vitro рост Faecalibacterium prausnitzi также значительно снизился после обработки PS [92]. Более того, большинство восприимчивых бактерий после воздействия PS являются грамотрицательными. Примечательно, что липофильность PS играет важную роль в модуляции различных типов микробиоты кишечника. В клеточных стенках грамотрицательных бактерий содержится большое количество липидов, что препятствует путям транскрипции и углеводного обмена. Однако грамположительные бактерии содержат большее количество пептидогликана, что, возможно, блокирует доставку PS [172]. Было показано, что E. coli устойчива к PS благодаря механизму эффлюксного насоса [171].
7.3. Сульфиты (... E 221 ...)
Сульфиты относятся к метабисульфитам, включая: сероводородные сульфиты, сернистый газ и сернокислые соли, содержащие калий, кальций или натрий [173]. Сульфит натрия (E 221) является одним из наиболее распространенных пищевых консервантов среди них. Он сильно ингибирует рост Faecalibacterium prausnitzii [92]. При этом Lactobacillus casei, Lactobacillus rhamnosus и Lactobacillus plantarum, которые считаются полезными кишечными бактериями благодаря своей способности вырабатывать молочную кислоту, также снижаются [173]. В другом исследовании сульфиты последовательно снижали жизнеспособность Proteus mirabilis, Escherichia fergusonii, Morganella morganii и Klebsiella pneumoniae, полученных от пациентов с болезнью Крона (табл. 1) [63]. Таким образом, сульфиты, особенно SS, могут обладать более сильной антимикробной способностью в отношении полезных бактерий в кишечнике, что может вызывать кишечные расстройства при ВЗК.
7.4. Наночастицы серебра (Ag NPs) (E 174)
С 1891 года наночастицы серебра (Ag NPs) используются в качестве раневого антисептика [174]. Механизм их антибактериальных свойств заключается в том, что ионы Ag взаимодействуют с тиоловой группой некоторых основных ферментов бактерий, подавляя их нормальную деятельность и физиологические функции [175]. In vitro Ag NPs оказывали негативное влияние на бактериальное сообщество человека, значительно снижая газообразование в культуре. Более того, численность Ruminococcus torques, Roseburia intestinalis, Eubacterium rectale, Roseburia faecalis и Bacteroides ovatus заметно снижались [176]. В другом исследовании было обнаружено снижение количества Enterococcus spp. и молочнокислых бактерий, а также увеличение количества Clostridium spp. после обработки твердыми Ag NPs, в то время как в динамической модели in vitro были обнаружены ограниченные изменения бактериального состава и метаболизма [87].
Более того, α-разнообразие и β-разнообразие нарушались дозозависимым образом, при этом увеличивалось соотношение между типами Firmicutes и Bacteroidetes. Семейства Lachnospiraceae и S24-7 в основном обусловили увеличение числа Firmicutes и уменьшение числа Bacteroidetes, соответственно [177]. В другом исследовании Ag NPs и ацетат серебра вызывали сокращение численности типа Firmicutes и рода Lactobacillus. Воздействие Ag NPs меньшего размера или в меньшей дозе может снижать регуляцию некоторых иммуномодулирующих генов [178]. Интересно, что различные формы Ag NPs, такие как кубические (AgNC) и сферические (AgNS), могут приводить к различным эффектам. После воздействия AgNC уменьшилось количество Bacteroides uniformis и Clostridium spp., в то время как Dehalobacterium spp., Peptococcaeceae и Oscillospira spp. изменились в группе, обработанной AgNS [179]. Однако доза с различным покрытием не оказала существенного влияния на микробиом кишечника [180]. Согласно предыдущему исследованию [181], бактериальные изменения могут быть гендерно-специфичными у рыбок данио.
Ag NPs ограничивали рост пробиотических Lactobacilli и некоторых распространенных условно-патогенных бактерий, таких как Staphylococcus aureus и E. coli. Лактобациллы более восприимчивы к Ag NPs, чем условно-патогенные бактерии. Лактобациллы могут создавать кислую среду, которая способствует растворению Ag NPs и может привести к чрезмерной выработке гидроксильного радикала (•OH), уничтожая внутриклеточный пул глутатиона и повышая уровень ROS. Повышенное содержание ROS повреждает ДНК и вызывает апоптоз. В этом исследовании обобщен возможный механизм бактерицидного пути pH-Ag+-•OH, что дает новое понимание влияния Ag NPs на здоровье человека [182]. Оказалось, что Ag NPS оказывают более ингибирующее влияние на некоторые полезные или распространенные бактерии и нарушают гомеостаз кишечника. Это вызывает большую озабоченность в отношении возникновения и обострения ВЗК, если потреблять Ag NPS в больших количествах.
7.5. Другие консерванты
ε-полилизин состоит из изопептида, связанного с 25-40 остатками L-лизина между ε-амино- и α-карбоксильными группами. Хотя в большинстве стран он не разрешен в качестве пищевой добавки, FDA присвоило этому продукту статус GRAS. Недавнее исследование выявило изменение состава кишечных микроорганизмов, с увеличением численности Bacteroides, Oscillospira и Coprococcus, а также снижением уровней Ruminococcus и Lactobacillu после потребления мышами ε-полилизина [183]. Триклозан (TCS) также применяется в качестве антимикробного ингредиента, используемого в зубной пасте, косметике, кухонной утвари и игрушках, но в 2013 году был запрещен FDA. Было установлено, что TCS связан с воспалением толстой кишки и опухолеобразованием через изменение микрофлоры кишечника и сигнального пути толл-подобных рецепторов 4 (TLR4). Триклозан значительно снижает α- и β-разнообразие (табл. 1). На уровне типов наблюдается сокращение численности Bacteroidetes, Actinomycetes и Cyanobacteria при увеличении численности Firmicutes. Кроме того, после обработки значительно уменьшилось количество Bifidobacterium и Bacteroides на уровне рода [64].
8. Антиоксиданты
Прим. ред.: Карнозиновая кислота - это природный абиетан, содержащийся в розмарине. Высушенные листья розмарина и шалфея содержат от 1,5 до 2,5% карнозиновой кислоты. Карнозиновая кислота и карнозол, производное этой кислоты, используются в качестве антиоксидантных консервантов в пищевых продуктах, где они маркируются как "экстракты розмарина" (E392).
Экстракт розмарина (RE), полученный из Rosmarinus officinalis Linn, обладает множеством биологических и фармакологических функций и может использоваться в качестве антиоксиданта в пищевых добавках и лекарствах.
RE продемонстрировал защитные эффекты против окисления, воспаления и дисбаланса микробиоты [184]. Диетические добавки с RE повышали усвояемость питательных веществ, улучшая антиоксидантный статус и морфологию кишечника у свиней. В слепой кишке показано увеличение количества Bifidobacterium и Bacteroidetes и снижение численности E. coli [185]. Как худые, так и тучные самки крыс демонстрировали одинаковые эффекты, с увеличением в группах Bacteroides/Prevotella и Blautia coccoides. Более того, у худых крыс были значительно изменены Clostridium leptum и Bifidobacterium. Содержание SCFAs в фекалиях увеличивалось у крыс с ожирением и снижалось у худых крыс [88]. RE также оказывает благотворное влияние на диабет и депрессию [186,187]. Розмариновая и карнозиновая кислоты - два компонента розмарина. Они оказывают антигликативное и антиоксидантное действие на крыс с диабетом. RE не только предотвращал воспаление и повреждение тканей, но и оказывал пребиотическое воздействие на микробиоту кишечника, что сопровождалось ростом устойчивых к диабету бактерий, таких как Actinobacteria, Bacteroides, Faecalibacterium, Lachnospiraceae и Prevotella, а также снижением количества чувствительных к диабету бактерий, таких как Firmicutes и Ruminococcaceae. Розмариновая кислота продемонстрировала большую эффективность в облегчении метаболических симптомов, чем карнозовая кислота [186]. Более того, RE увеличил долю последовательностей Lactobacillus и Firmicutes и уменьшил долю последовательностей Bacteroidetes и Proteobacteria в фекалиях мышей, подвергнутых хроническому сдерживающему стрессу (прим. ред.: речь идет о данных секвенирования 16S рРНК) [187]. В соответствии с приведенными выше данными, экстракт розмарина действительно играет роль в улучшении воспалительного статуса и модуляции кишечной микробиоты, что может быть полезно для пациентов с ВЗК.
9. Выводы
Все больше исследований изучают взаимодействие между микробиотой кишечника и пищевыми добавками, указывая на то, что эти взаимодействия могут быть вовлечены в патогенез ВЗК. После обобщения информации, собранной в ходе текущих исследований, наш обзор пришел к выводу, что пищевые добавки оказывают множественное воздействие на микробиоту кишечника и гомеостаз кишечника, что может быть связано с возникновением и прогрессированием ВЗК. Более того, пищевые добавки также в значительной степени способствуют изменению функций бактерий. В совокупности подсластители, такие как Ace-K, сукралоза и сахарин, могут вызывать или усугублять колит, повышая потенциал бактериального воспаления. Эмульгаторы, такие как CMC и P80, считаются вредными для здоровья кишечника, поскольку изменяют разнообразие кишечной микробиоты и увеличивают бактериальное проникновение. Безопасность пищевых красителей должна быть переоценена из-за их негативного влияния на развитие кишечных расстройств и дисбиоза; Однако полиолы и антиоксиданты, включенные в данное исследование, по-видимому, благотворно влияют на микробиоту кишечника, улучшая ее структуру и функции. Аспартам также может быть полезен для кишечника при ВЗК, поскольку повышает уровень пробиотических бактерий. Несмотря на то, что включенные исследования показали различное влияние пищевых добавок на микробиом кишечника и воспаление кишечника, не представляется возможным переносить те же результаты, полученные in vitro и/или на животных моделях, на человека. Поэтому будущие исследования должны воспроизводить физиологические условия человека на основе биологически релевантных моделей. Согласно современным данным и нормам, неблагоприятные пищевые добавки, такие как пищевые красители и эмульгаторы, включая CMC и P80, для пациентов с ВЗК должны рассматриваться с осторожностью, а полиолы, такие как лактитол, являются приемлемыми. Однако влияние подсластителей и антиоксидантов на микробиоту кишечника и развитие колита у человека остается неясным, и для его подтверждения срочно необходимы дальнейшие исследования. Кроме того, следует обратить внимание на влияние MDX и консервантов на здоровье и микрофлору кишечника, и рекомендуется провести дополнительные исследования, чтобы выяснить их определенное влияние на человека. Между тем, рекомендуется также существенно пересмотреть процесс GRAS в отношении особых групп (включая детей, беременных и кормящих женщин и т.д.). Кроме того, все агентства по безопасности пищевых продуктов должны взаимно использовать свои профессиональные знания и экспертные оценки для получения недостающей информации и признания пробелов в знаниях о пищевых добавках. В заключение необходимо отметить, что необходимы дополнительные исследования, чтобы выяснить взаимосвязь между пищевыми добавками, кишечной микробиотой и ВЗК, а также понять риски ВЗК, которым потенциально могут подвергнуться будущие поколения из-за потребительских привычек нынешних поколений.
Дополнительная информация
- Пищевые мутагены и антимутагены
- Пища для кишечного микробиома
- Микробные метаболиты при воспалительных заболеваниях кишечника
- Болезнь Крона, кишечная микробиота и лечебные диеты
- Иммунитет и диета при воспалительных заболеваниях кишечника
- Полифенолы и кишечный микробиом
- Антиоксидантные ферменты микроорганизмов
- Hodson, R. Inflammatory bowel disease. Nature 2016, 540, S97. [Google Scholar] [CrossRef] [PubMed]
- Chang, J.T. Pathophysiology of Inflammatory Bowel Diseases. N. Engl. J. Med. 2020, 383, 2652–2664. [Google Scholar] [CrossRef] [PubMed]
- Owczarek, D.; Rodacki, T.; Domagała-Rodacka, R.; Cibor, D.; Mach, T. Diet and nutritional factors in inflammatory bowel diseases. World J. Gastroenterol. 2016, 22, 895–905. [Google Scholar] [CrossRef]
- Campmans-Kuijpers, M.J.E.; Dijkstra, G. Food and Food Groups in Inflammatory Bowel Disease (IBD): The Design of the Groningen Anti-Inflammatory Diet (GrAID). Nutrients 2021, 13, 1067. [Google Scholar] [CrossRef] [PubMed]
- Hills, R.D., Jr.; Pontefract, B.A.; Mishcon, H.R.; Black, C.A.; Sutton, S.C.; Theberge, C.R. Gut Microbiome: Profound Implications for Diet and Disease. Nutrients 2019, 11, 1613. [Google Scholar] [CrossRef] [PubMed] [Green Version]
- Berglund, F. Food Additives. In Toxicological Aspects of Food Safety; Springer: Berlin/Heidelberg, Germany, 1978; Volume 1, pp. 33–46. [Google Scholar]
- Food Ingredients and Colors. Available online: https://www.fda.gov/food/food-ingredients-packaging/overview-food-ingredients-additives-colors (accessed on 26 February 2022).
- Wang, X.; Guo, J.; Liu, Y.; Yu, H.; Qin, X. Sucralose Increased Susceptibility to Colitis in Rats. Inflamm. Bowel Dis. 2019, 25, e3–e4. [Google Scholar] [CrossRef]
- Franzosa, E.A.; Sirota-Madi, A.; Avila-Pacheco, J.; Fornelos, N.; Haiser, H.J.; Reinker, S.; Vatanen, T.; Hall, A.B.; Mallick, H.; McIver, L.J.; et al. Gut microbiome structure and metabolic activity in inflammatory bowel disease. Nat. Microbiol. 2019, 4, 293–305. [Google Scholar] [CrossRef]
- Viennois, E.; Bretin, A.; Dubé, P.E.; Maue, A.C.; Dauriat, C.J.G.; Barnich, N.; Gewirtz, A.T.; Chassaing, B. Dietary Emulsifiers Directly Impact Adherent-Invasive E. coli Gene Expression to Drive Chronic Intestinal Inflammation. Cell Rep. 2020, 33, 108229. [Google Scholar] [CrossRef]
- Chassaing, B.; Koren, O.; Goodrich, J.K.; Poole, A.C.; Srinivasan, S.; Ley, R.E.; Gewirtz, A.T. Dietary emulsifiers impact the mouse gut microbiota promoting colitis and metabolic syndrome. Nature 2015, 519, 92–96. [Google Scholar] [CrossRef] [Green Version]
- The European Parliament and the Council of the European Union. Regulation (EC) No 1333/2008 of the European Parliament and of the Council. Off. J. Eur. Union 2008, 81, 16–33. [Google Scholar]
- EFSA Panel on Food Additives and Nutrient Sources added to Food (ANS); Mortensen, A.; Aguilar, F.; Crebelli, R.; Di Domenico, A.; Dusemund, B.; Frutos, M.J.; Galtier, P.; Gott, D.; Gundert-Remy, U.; et al. Re-evaluation of fatty acids (E 570) as a food additive. EFSA J. 2017, 15, e04785. [Google Scholar] [PubMed] [Green Version]
- EFSA Panel on Food Additives and Nutrient Sources added to Food (ANS). Scientific Opinion on the re-evaluation of aspartame (E 951) as a food additive. EFSA J. 2013, 11, 3496. [Google Scholar]
- Frankenfeld, C.L.; Sikaroodi, M.; Lamb, E.; Shoemaker, S.; Gillevet, P.M. High-intensity sweetener consumption and gut microbiome content and predicted gene function in a cross-sectional study of adults in the United States. Ann. Epidemiol. 2015, 25, 736–742.e4. [Google Scholar] [CrossRef] [PubMed]
- Ahmad, S.Y.; Friel, J.; Mackay, D. The Effects of Non-Nutritive Artificial Sweeteners, Aspartame and Sucralose, on the Gut Microbiome in Healthy Adults: Secondary Outcomes of a Randomized Double-Blinded Crossover Clinical Trial. Nutrients 2020, 12, 3408. [Google Scholar] [CrossRef] [PubMed]
- Gerasimidis, K.; Bryden, K.; Chen, X.; Papachristou, E.; Verney, A.; Roig, M.; Hansen, R.; Nichols, B.; Papadopoulou, R.; Parrett, A. The impact of food additives, artificial sweeteners and domestic hygiene products on the human gut microbiome and its fibre fermentation capacity. Eur. J. Nutr. 2020, 59, 3213–3230. [Google Scholar] [CrossRef] [Green Version]
- Palmnäs, M.S.; Cowan, T.E.; Bomhof, M.R.; Su, J.; Reimer, R.A.; Vogel, H.J.; Hittel, D.S.; Shearer, J. Low-dose aspartame consumption differentially affects gut microbiota-host metabolic interactions in the diet-induced obese rat. PLoS ONE 2014, 9, e109841. [Google Scholar] [CrossRef]
- Nettleton, J.E.; Cho, N.A.; Klancic, T.; Nicolucci, A.C.; Shearer, J.; Borgland, S.L.; Johnston, L.A.; Ramay, H.R.; Noye Tuplin, E.; Chleilat, F.; et al. Maternal low-dose aspartame and stevia consumption with an obesogenic diet alters metabolism, gut microbiota and mesolimbic reward system in rat dams and their offspring. Gut 2020, 69, 1807–1817. [Google Scholar] [CrossRef] [Green Version]
- Mahmud, R.; Shehreen, S.; Shahriar, S.; Rahman, M.S.; Akhteruzzaman, S.; Sajib, A.A. Non-Caloric Artificial Sweeteners Modulate the Expression of Key Metabolic Genes in the Omnipresent Gut Microbe Escherichia coli. J. Mol. Microbiol. Biotechnol. 2019, 29, 43–56. [Google Scholar] [CrossRef]
- EFSA Panel on Food Additives and Nutrient Sources added to Food (ANS). Safety of the proposed extension of use of acesulfame K (E 950) in foods for special medical purposes in young children. EFSA J. 2016, 14, 4437. [Google Scholar]
- Uebanso, T.; Ohnishi, A.; Kitayama, R.; Yoshimoto, A.; Nakahashi, M.; Shimohata, T.; Mawatari, K.; Takahashi, A. Effects of Low-Dose Non-Caloric Sweetener Consumption on Gut Microbiota in Mice. Nutrients 2017, 9, 560. [Google Scholar] [CrossRef] [Green Version]
- Bian, X.; Chi, L.; Gao, B.; Tu, P.; Ru, H.; Lu, K. The artificial sweetener acesulfame potassium affects the gut microbiome and body weight gain in CD-1 mice. PLoS ONE 2017, 12, e0178426. [Google Scholar] [CrossRef]
- Olivier-Van Stichelen, S.; Rother, K.I.; Hanover, J.A. Maternal Exposure to Non-nutritive Sweeteners Impacts Progeny’s Metabolism and Microbiome. Front. Microbiol. 2019, 10, 1360. [Google Scholar] [CrossRef] [Green Version]
- Hanawa, Y.; Higashiyama, M.; Sugihara, N.; Wada, A.; Inaba, K.; Horiuchi, K.; Furuhashi, H.; Kurihara, C.; Okada, Y.; Shibuya, N.; et al. Su1775—Artificial Sweetener Acesulfame Potassium Enhanced Lymphocyte Migration to Intestinal Microvessels by Enhancing Expression of Adhesion Molecules Through Dysbiosis. Gastroenterology 2019, 156, S-606. [Google Scholar] [CrossRef]
- Wang, Q.P.; Browman, D.; Herzog, H.; Neely, G.G. Non-nutritive sweeteners possess a bacteriostatic effect and alter gut microbiota in mice. PLoS ONE 2018, 13, e0199080. [Google Scholar] [CrossRef]
- Lavelle, A.; Sokol, H. Gut microbiota-derived metabolites as key actors in inflammatory bowel disease. Nat. Rev. Gastroenterol. Hepatol. 2020, 17, 223–237. [Google Scholar] [CrossRef]
- Li, X.; Liu, Y.; Wang, Y.; Li, X.; Liu, X.; Guo, M.; Tan, Y.; Qin, X.; Wang, X.; Jiang, M. Sucralose Promotes Colitis-Associated Colorectal Cancer Risk in a Murine Model along with Changes in Microbiota. Front. Oncol. 2020, 10, 710. [Google Scholar] [CrossRef]
- Rodriguez-Palacios, A.; Harding, A.; Menghini, P.; Himmelman, C.; Retuerto, M.; Nickerson, K.P.; Lam, M.; Croniger, C.M.; McLean, M.H.; Durum, S.K.; et al. The Artificial Sweetener Splenda Promotes Gut Proteobacteria, Dysbiosis, and Myeloperoxidase Reactivity in Crohn’s Disease-Like Ileitis. Inflamm. Bowel Dis. 2018, 24, 1005–1020. [Google Scholar] [CrossRef]
- Sünderhauf, A.; Pagel, R.; Künstner, A.; Wagner, A.E.; Rupp, J.; Ibrahim, S.M.; Derer, S.; Sina, C. Saccharin Supplementation Inhibits Bacterial Growth and Reduces Experimental Colitis in Mice. Nutrients 2020, 12, 1122. [Google Scholar] [CrossRef] [Green Version]
- Wang, Y.N.; Meng, X.C.; Dong, Y.F.; Zhao, X.H.; Qian, J.M.; Wang, H.Y.; Li, J.N. Effects of probiotics and prebiotics on intestinal microbiota in mice with acute colitis based on 16S rRNA gene sequencing. Chin. Med. J. 2019, 132, 1833–1842. [Google Scholar] [CrossRef]
- Zangara, M.; Sangwan, N.; Mcdonald, C.J.G. Common Food Additives Accelerate Onset of Inflammatory Bowel Disease in Mice by Altering Microbiome Composition and Host-Microbe Interaction. Gastroenterology 2021, 160, S53. [Google Scholar] [CrossRef]
- Thymann, T.; Møller, H.K.; Stoll, B.; Støy, A.C.; Buddington, R.K.; Bering, S.B.; Jensen, B.B.; Olutoye, O.O.; Siggers, R.H.; Mølbak, L.; et al. Carbohydrate maldigestion induces necrotizing enterocolitis in preterm pigs. Am. J. Physiol. Gastrointest. Liver Physiol. 2009, 297, G1115–G1125. [Google Scholar] [CrossRef]
- Nickerson, K.P.; Homer, C.R.; Kessler, S.P.; Dixon, L.J.; Kabi, A.; Gordon, I.O.; Johnson, E.E.; de la Motte, C.A.; McDonald, C. The dietary polysaccharide maltodextrin promotes Salmonella survival and mucosal colonization in mice. PLoS ONE 2014, 9, e101789. [Google Scholar] [CrossRef] [Green Version]
- Nickerson, K.P.; McDonald, C. Crohn’s disease-associated adherent-invasive Escherichia coli adhesion is enhanced by exposure to the ubiquitous dietary polysaccharide maltodextrin. PLoS ONE 2012, 7, e52132. [Google Scholar] [CrossRef] [Green Version]
- Furuhashi, H.; Higashiyama, M.; Okada, Y.; Kurihara, C.; Wada, A.; Horiuchi, K.; Hanawa, Y.; Mizoguchi, A.; Nishii, S.; Inaba, K.; et al. Dietary emulsifier polysorbate-80-induced small-intestinal vulnerability to indomethacin-induced lesions via dysbiosis. J. Gastroenterol. Hepatol. 2020, 35, 110–117. [Google Scholar] [CrossRef]
- Roberts, C.L.; Keita, A.V.; Duncan, S.H.; O’Kennedy, N.; Söderholm, J.D.; Rhodes, J.M.; Campbell, B.J. Translocation of Crohn’s disease Escherichia coli across M-cells: Contrasting effects of soluble plant fibres and emulsifiers. Gut 2010, 59, 1331–1339. [Google Scholar] [CrossRef] [Green Version]
- Swidsinski, A.; Ung, V.; Sydora, B.C.; Loening-Baucke, V.; Doerffel, Y.; Verstraelen, H.; Fedorak, R.N. Bacterial overgrowth and inflammation of small intestine after carboxymethylcellulose ingestion in genetically susceptible mice. Inflamm. Bowel Dis. 2009, 15, 359–364. [Google Scholar] [CrossRef]
- Chassaing, B.; Van de Wiele, T.; De Bodt, J.; Marzorati, M.; Gewirtz, A.T. Dietary emulsifiers directly alter human microbiota composition and gene expression ex vivo potentiating intestinal inflammation. Gut 2017, 66, 1414–1427. [Google Scholar] [CrossRef]
- Li, M. The Degradation and Utilization Study of Agarose, κ-Carrageenan and Their Oligosaccharides by Human Gut Microbiota. Ph.D. Thesis, Ocean University of China, Qingdao, China, 2014. [Google Scholar]
- Shang, Q.; Sun, W.; Shan, X.; Jiang, H.; Cai, C.; Hao, J.; Li, G.; Yu, G. Carrageenan-induced colitis is associated with decreased population of anti-inflammatory bacterium, Akkermansia muciniphila, in the gut microbiota of C57BL/6J mice. Toxicol. Lett. 2017, 279, 87–95. [Google Scholar] [CrossRef]
- Mi, Y.; Chin, Y.X.; Cao, W.X.; Chang, Y.G.; Lim, P.E.; Xue, C.H.; Tang, Q.J. Native κ-carrageenan induced-colitis is related to host intestinal microecology. Int. J. Biol. Macromol. 2020, 147, 284–294. [Google Scholar] [CrossRef]
- Wu, W.; Zhen, Z.; Niu, T.; Zhu, X.; Gao, Y.; Yan, J.; Chen, Y.; Yan, X.; Chen, H. κ-Carrageenan Enhances Lipopolysaccharide-Induced Interleukin-8 Secretion by Stimulating the Bcl10-NF-κB Pathway in HT-29 Cells and Aggravates C. freundii-Induced Inflammation in Mice. Mediat. Inflamm. 2017, 2017, 8634865. [Google Scholar] [CrossRef] [Green Version]
- End, C.; Bikker, F.; Renner, M.; Bergmann, G.; Lyer, S.; Blaich, S.; Hudler, M.; Helmke, B.; Gassler, N.; Autschbach, F.; et al. DMBT1 functions as pattern-recognition molecule for poly-sulfated and poly-phosphorylated ligands. Eur. J. Immunol. 2009, 39, 833–842. [Google Scholar] [CrossRef] [PubMed]
- Munyaka, P.M.; Sepehri, S.; Ghia, J.E.; Khafipour, E. Carrageenan Gum and Adherent Invasive Escherichia coli in a Piglet Model of Inflammatory Bowel Disease: Impact on Intestinal Mucosa-associated Microbiota. Front. Microbiol. 2016, 7, 462. [Google Scholar] [CrossRef] [PubMed]
- Onderdonk, A.B.; Hermos, J.A.; Dzink, J.L.; Bartlett, J.G. Protective effect of metronidazole in experimental ulcerative colitis. Gastroenterology 1978, 74, 521–526. [Google Scholar] [CrossRef]
- Onderdonk, A.B.; Cisneros, R.L.; Bronson, R.T. Enhancement of experimental ulcerative colitis by immunization with Bacteroides vulgatus. Infect. Immun. 1983, 42, 783–788. [Google Scholar] [CrossRef] [PubMed] [Green Version]
- Mo, Q.; Fu, A.; Deng, L.; Zhao, M.; Li, Y.; Zhang, H.; Feng, F. High-dose Glycerol Monolaurate Up-Regulated Beneficial Indigenous Microbiota without Inducing Metabolic Dysfunction and Systemic Inflammation: New Insights into Its Antimicrobial Potential. Nutrients 2019, 11, 1981. [Google Scholar] [CrossRef] [Green Version]
- Zhao, M.; Jiang, Z.; Cai, H.; Li, Y.; Mo, Q.; Deng, L.; Zhong, H.; Liu, T.; Zhang, H.; Kang, J.X.; et al. Modulation of the Gut Microbiota during High-Dose Glycerol Monolaurate-Mediated Amelioration of Obesity in Mice Fed a High-Fat Diet. mBio 2020, 11, e00190-20. [Google Scholar] [CrossRef] [PubMed] [Green Version]
- Zhao, M.; Cai, H.; Jiang, Z.; Li, Y.; Zhong, H.; Zhang, H.; Feng, F. Glycerol-Monolaurate-Mediated Attenuation of Metabolic Syndrome is Associated with the Modulation of Gut Microbiota in High-Fat-Diet-Fed Mice. Mol. Nutr. Food Res. 2019, 63, e1801417. [Google Scholar] [CrossRef]
- Mo, Q.; Liu, T.; Fu, A.; Ruan, S.; Zhong, H.; Tang, J.; Zhao, M.; Li, Y.; Zhu, S.; Cai, H.; et al. Novel Gut Microbiota Patterns Involved in the Attenuation of Dextran Sodium Sulfate-Induced Mouse Colitis Mediated by Glycerol Monolaurate via Inducing Anti-inflammatory Responses. mBio 2021, 12, e0214821. [Google Scholar] [CrossRef]
- Cao, X.; Han, Y.; Gu, M.; Du, H.; Song, M.; Zhu, X.; Ma, G.; Pan, C.; Wang, W.; Zhao, E.; et al. Foodborne Titanium Dioxide Nanoparticles Induce Stronger Adverse Effects in Obese Mice than Non-Obese Mice: Gut Microbiota Dysbiosis, Colonic Inflammation, and Proteome Alterations. Small 2020, 16, e2001858. [Google Scholar] [CrossRef]
- Zhu, X.; Zhao, L.; Liu, Z.; Zhou, Q.; Zhu, Y.; Zhao, Y.; Yang, X. Long-term exposure to titanium dioxide nanoparticles promotes diet-induced obesity through exacerbating intestinal mucus layer damage and microbiota dysbiosis. Nano Res. 2021, 14, 1512–1522. [Google Scholar] [CrossRef]
- Yan, J.; Wang, D.; Li, K.; Chen, Q.; Lai, W.; Tian, L.; Lin, B.; Tan, Y.; Liu, X.; Xi, Z. Toxic effects of the food additives titanium dioxide and silica on the murine intestinal tract: Mechanisms related to intestinal barrier dysfunction involved by gut microbiota. Environ. Toxicol. Pharmacol. 2020, 80, 103485. [Google Scholar] [CrossRef] [PubMed]
- Kurtz, C.C.; Mitchell, S.; Nielsen, K.; Crawford, K.D.; Mueller-Spitz, S.R. Acute high-dose titanium dioxide nanoparticle exposure alters gastrointestinal homeostasis in mice. J. Appl. Toxicol. JAT 2020, 40, 1384–1395. [Google Scholar] [CrossRef] [PubMed]
- Chen, Z.; Han, S.; Zhou, D.; Zhou, S.; Jia, G. Effects of oral exposure to titanium dioxide nanoparticles on gut microbiota and gut-associated metabolism in vivo. Nanoscale 2019, 11, 22398–22412. [Google Scholar] [CrossRef] [PubMed]
- Pinget, G.; Tan, J.; Janac, B.; Kaakoush, N.O.; Angelatos, A.S.; O’Sullivan, J.; Koay, Y.C.; Sierro, F.; Davis, J.; Divakarla, S.K.; et al. Impact of the Food Additive Titanium Dioxide (E171) on Gut Microbiota-Host Interaction. Front. Nutr. 2019, 6, 57. [Google Scholar] [CrossRef] [PubMed] [Green Version]
- Mu, W.; Wang, Y.; Huang, C.; Fu, Y.; Li, J.; Wang, H.; Jia, X.; Ba, Q. Effect of Long-Term Intake of Dietary Titanium Dioxide Nanoparticles on Intestine Inflammation in Mice. J. Agric. Food Chem. 2019, 67, 9382–9389. [Google Scholar] [CrossRef]
- Chen, H.; Zhao, R.; Wang, B.; Cai, C.; Zheng, L.; Wang, H.; Wang, M.; Yang, H.; Zhou, X.; Chai, Z.; et al. The effects of orally administered Ag, TiO2 and SiO2 nanoparticles on gut microbiota composition and colitis induction in mice. NanoImpact 2017, 8, 80–88. [Google Scholar] [CrossRef]
- He, Z.; Chen, L.; Catalan-Dibene, J.; Bongers, G.; Faith, J.J.; Suebsuwong, C.; DeVita, R.J.; Shen, Z.; Fox, J.G.; Lafaille, J.J.; et al. Food colorants metabolized by commensal bacteria promote colitis in mice with dysregulated expression of interleukin-23. Cell Metab. 2021, 33, 1358–1371.e5. [Google Scholar] [CrossRef]
- Wu, L.; Xu, Y.; Lv, X.; Chang, X.; Ma, X.; Tian, X.; Shi, X.; Li, X.; Kong, X. Impacts of an azo food dye tartrazine uptake on intestinal barrier, oxidative stress, inflammatory response and intestinal microbiome in crucian carp (Carassius auratus). Ecotoxicol. Environ. Saf. 2021, 223, 112551. [Google Scholar] [CrossRef]
- Hrncirova, L.; Machova, V.; Trckova, E.; Krejsek, J.; Hrncir, T. Food Preservatives Induce Proteobacteria Dysbiosis in Human-Microbiota Associated Nod2-Deficient Mice. Microorganisms 2019, 7, 383. [Google Scholar] [CrossRef] [Green Version]
- Schooth, L.F.; Loayza, J.J.J.; Teh, J.J.; Zhang, J.; Zhang, F.; Liu, Q.; Hamilton, A.L.; Wilson-O’Brien, A.; Trakman, G.L.; Lin, W.Y.; et al. 4 Crohn’s Disease Pathobiont Enterobacteriaceae Growth Is Modulated by Food Additives and Oxygen Availability: Factors in Pathophysiology and Recurrence. The Enigma Study. Gastroenterology 2020, 158, S-2. [Google Scholar] [CrossRef]
- Yang, H.; Wang, W.; Romano, K.A.; Gu, M.; Sanidad, K.Z.; Kim, D.; Yang, J.; Schmidt, B.; Panigrahy, D.; Pei, R.; et al. A common antimicrobial additive increases colonic inflammation and colitis-associated colon tumorigenesis in mice. Sci. Transl. Med. 2018, 10, eaan4116. [Google Scholar] [CrossRef] [PubMed] [Green Version]
- Vamanu, E.; Pelinescu, D.; Gatea, F.; Sârbu, I. Altered in Vitro Metabolomic Response of the Human Microbiota to Sweeteners. Genes 2019, 10, 535. [Google Scholar] [CrossRef] [PubMed] [Green Version]
- Suez, J.; Korem, T.; Zeevi, D.; Zilberman-Schapira, G.; Thaiss, C.A.; Maza, O.; Israeli, D.; Zmora, N.; Gilad, S.; Weinberger, A.; et al. Artificial sweeteners induce glucose intolerance by altering the gut microbiota. Nature 2014, 514, 181–186. [Google Scholar] [CrossRef]
- Bian, X.; Tu, P.; Chi, L.; Gao, B.; Ru, H.; Lu, K. Saccharin induced liver inflammation in mice by altering the gut microbiota and its metabolic functions. Food Chem. Toxicol. 2017, 107, 530–539. [Google Scholar] [CrossRef] [PubMed]
- Chi, L.; Bian, X.; Gao, B.; Tu, P.; Lai, Y.; Ru, H.; Lu, K. Effects of the Artificial Sweetener Neotame on the Gut Microbiome and Fecal Metabolites in Mice. Molecules 2018, 23, 367. [Google Scholar] [CrossRef] [PubMed] [Green Version]
- Mahalak, K.K.; Firrman, J.; Tomasula, P.M.; Nuñez, A.; Lee, J.J.; Bittinger, K.; Rinaldi, W.; Liu, L.S. Impact of Steviol Glycosides and Erythritol on the Human and Cebus apella Gut Microbiome. J. Agric. Food Chem. 2020, 68, 13093–13101. [Google Scholar] [CrossRef] [PubMed]
- Gostner, A.; Blaut, M.; Schäffer, V.; Kozianowski, G.; Theis, S.; Klingeberg, M.; Dombrowski, Y.; Martin, D.; Ehrhardt, S.; Taras, D.; et al. Effect of isomalt consumption on faecal microflora and colonic metabolism in healthy volunteers. Br. J. Nutr. 2006, 95, 40–50. [Google Scholar] [CrossRef]
- Chu, J.R.; Kang, S.Y.; Kim, S.E.; Lee, S.J.; Lee, Y.C.; Sung, M.K. Prebiotic UG1601 mitigates constipation-related events in association with gut microbiota: A randomized placebo-controlled intervention study. World J. Gastroenterol. 2019, 25, 6129–6144. [Google Scholar] [CrossRef]
- Ballongue, J.; Schumann, C.; Quignon, P. Effects of lactulose and lactitol on colonic microflora and enzymatic activity. Scand. J. Gastroenterol. Suppl. 1997, 222, 41–44. [Google Scholar] [CrossRef]
- Finney, M.; Smullen, J.; Foster, H.A.; Brokx, S.; Storey, D.M. Effects of low doses of lactitol on faecal microflora, pH, short chain fatty acids and gastrointestinal symptomology. Eur. J. Nutr. 2007, 46, 307–314. [Google Scholar] [CrossRef]
- Peuranen, S.; Tiihonen, K.; Apajalahti, J.; Kettunen, A.; Saarinen, M.; Rautonen, N. Combination of polydextrose and lactitol affects microbial ecosystem and immune responses in rat gastrointestinal tract. Br. J. Nutr. 2004, 91, 905–914. [Google Scholar] [CrossRef] [PubMed]
- Pinna, C.; Stefanelli, C.; Biagi, G. In vitro effect of dietary protein level and nondigestible oligosaccharides on feline fecal microbiota. J. Anim. Sci. 2014, 92, 5593–5602. [Google Scholar] [CrossRef] [PubMed] [Green Version]
- Kong, H.; Yu, L.; Gu, Z.; Li, C.; Ban, X.; Cheng, L.; Hong, Y.; Li, Z. Novel Short-Clustered Maltodextrin as a Dietary Starch Substitute Attenuates Metabolic Dysregulation and Restructures Gut Microbiota in db/db Mice. J. Agric. Food Chem. 2020, 68, 12400–12412. [Google Scholar] [CrossRef]
- Waller, T.; Chen, C.; Walker, S.L. Food and Industrial Grade Titanium Dioxide Impacts Gut Microbiota. Environ. Eng. Sci. 2017, 34, 537–550. [Google Scholar] [CrossRef]
- Agans, R.T.; Gordon, A.; Hussain, S.; Paliy, O. Titanium Dioxide Nanoparticles Elicit Lower Direct Inhibitory Effect on Human Gut Microbiota Than Silver Nanoparticles. Toxicol. Sci. 2019, 172, 411–416. [Google Scholar] [CrossRef] [PubMed]
- Dudefoi, W.; Moniz, K.; Allen-Vercoe, E.; Ropers, M.H.; Walker, V.K. Impact of food grade and nano-TiO2 particles on a human intestinal community. Food Chem. Toxicol. 2017, 106, 242–249. [Google Scholar] [CrossRef]
- Polic, I.I. Evaluation of the Impact of Azo Dyes on the Metabolism of Stabilized Fecal Communities and In Vitro Cell Culture. Master’s Thesis, The University of Guelph, Guelph, ON, Canada.
- Chen, H.; Xu, H.; Heinze, T.M.; Cerniglia, C.E. Decolorization of water and oil-soluble azo dyes by Lactobacillus acidophilus and Lactobacillus fermentum. J. Ind. Microbiol. Biotechnol. 2009, 36, 1459–1466. [Google Scholar] [CrossRef]
- Pan, H.; Feng, J.; He, G.X.; Cerniglia, C.E.; Chen, H. Evaluation of impact of exposure of Sudan azo dyes and their metabolites on human intestinal bacteria. Anaerobe 2012, 18, 445–453. [Google Scholar] [CrossRef] [Green Version]
- Torrallardona, D.; Badiola, I.; Broz, J. Effects of benzoic acid on performance and ecology of gastrointestinal microbiota in weanling piglets. Livest. Sci. 2007, 108, 210–213. [Google Scholar] [CrossRef]
- Kluge, H.; Broz, J.; Eder, K. Effect of benzoic acid on growth performance, nutrient digestibility, nitrogen balance, gastrointestinal microflora and parameters of microbial metabolism in piglets. J. Anim. Physiol. Anim. Nutr. 2006, 90, 316–324. [Google Scholar] [CrossRef]
- Diao, H.; Zheng, P.; Yu, B.; He, J.; Mao, X.B.; Yu, J.; Chen, D.W. Effects of dietary supplementation with benzoic acid on intestinal morphological structure and microflora in weaned piglets. Livest. Sci. 2014, 167, 249–256. [Google Scholar] [CrossRef]
- Diao, H.; Zheng, P.; Yu, B.; He, J.; Mao, X.; Yu, J.; Chen, D. Effects of benzoic Acid and thymol on growth performance and gut characteristics of weaned piglets. Asian-Australas. J. Anim. Sci. 2015, 28, 827–839. [Google Scholar] [CrossRef] [PubMed] [Green Version]
- Cc, A.; Gs, A.; At, A.; Bm, A.; Jc, B.; Bb, A.; Ma, A.J.F.; Toxicology, C. Gastrointestinal digestion of food-use silver nanoparticles in the dynamic SIMulator of the GastroIntestinal tract (simgi ®). Impact on human gut microbiota. Food Chem. Toxicol. 2019, 132, 110657. [Google Scholar]
- Romo-Vaquero, M.; Selma, M.V.; Larrosa, M.; Obiol, M.; García-Villalba, R.; González-Barrio, R.; Issaly, N.; Flanagan, J.; Roller, M.; Tomás-Barberán, F.A.; et al. A rosemary extract rich in carnosic acid selectively modulates caecum microbiota and inhibits β-glucosidase activity, altering fiber and short chain fatty acids fecal excretion in lean and obese female rats. PLoS ONE 2014, 9, e94687. [Google Scholar]
- Thomson, P.; Santibañez, R.; Aguirre, C.; Galgani, J.E.; Garrido, D. Short-term impact of sucralose consumption on the metabolic response and gut microbiome of healthy adults. Br. J. Nutr. 2019, 122, 856–862. [Google Scholar] [CrossRef] [Green Version]
- Méndez-García, L.A.; Bueno-Hernández, N.; Cid-Soto, M.A.; De León, K.L.; Mendoza-Martínez, V.M.; Espinosa-Flores, A.J.; Carrero-Aguirre, M.; Esquivel-Velázquez, M.; León-Hernández, M.; Viurcos-Sanabria, R.; et al. Ten-Week Sucralose Consumption Induces Gut Dysbiosis and Altered Glucose and Insulin Levels in Healthy Young Adults. Microorganisms 2022, 10, 434. [Google Scholar] [CrossRef]
- Bian, X.; Chi, L.; Gao, B.; Tu, P.; Ru, H.; Lu, K. Gut Microbiome Response to Sucralose and Its Potential Role in Inducing Liver Inflammation in Mice. Front. Physiol. 2017, 8, 487. [Google Scholar] [CrossRef] [Green Version]
- Loayza, J.; Berendsen, E.; Teh, J.-J.; Hoedt, E.C.; Zhang, J.; Liu, Q.; Hamilton, A.L.; Wilson-O’Brien, A.; Trakman, G.L.; Lin, W.Y.; et al. Su1994—The Common Food Additives Sodium Sulfite and Polysorbate 80 Have a Profound Inhibatory Effect on the Commensal, Anti-Inflammatory Bacterium Faecalibacterium prausnitzii. The Enigma Study. Gastroenterology 2019, 156, S-684–S-685. [Google Scholar] [CrossRef]
- Rettig, S.; Tenewitz, J.; Ahearn, G.; Coughlin, C.J.F.J. Sucralose causes a concentration dependent metabolic inhibition of the gut flora Bacteroides, B. fragilis and B. uniformis not observed in the Firmicutes, E. faecalis and C. sordellii (1118.1). FASEB J. 2014, 28, 1118.1. [Google Scholar] [CrossRef]
- Serrano, J.; Smith, K.R.; Crouch, A.L.; Sharma, V.; Yi, F.; Vargova, V.; LaMoia, T.E.; Dupont, L.M.; Serna, V.; Tang, F.; et al. High-dose saccharin supplementation does not induce gut microbiota changes or glucose intolerance in healthy humans and mice. Microbiome 2021, 9, 11. [Google Scholar] [CrossRef]
- Xu, D.; Wu, X.; Yu, T.; Xu, H.; Zhou, S.Y.; Li, J.Y.; Chung, O.J.G. 1099—Artificial Sweetener (Saccharin) Modulates Visceral Nociception by Lipopolysaccharide-Mediated Gut Barrier Dysfunction and Intestinal Inflammation. AGA J. 2018, 154, S-217. [Google Scholar] [CrossRef]
- Anderson, R.L.; Kirkland, J.J. The effect of sodium saccharin in the diet on caecal microflora. Food Cosmet. Toxicol. 1980, 18, 353–355. [Google Scholar] [CrossRef]
- Bilan, M.V.; Lieshchova, M.A.; Tishkina, N.M.; Brygadyrenko, V.V. Combined effect of glyphosate, saccharin and sodium benzoate on the gut microbiota of rats. Regul. Mech. Biosyst. 2019, 10, 228–232. [Google Scholar] [CrossRef]
- Daly, K.; Darby, A.C.; Hall, N.; Nau, A.; Bravo, D.; Shirazi-Beechey, S.P. Dietary supplementation with lactose or artificial sweetener enhances swine gut Lactobacillus population abundance. Br. J. Nutr. 2014, 111, S30-5. [Google Scholar] [CrossRef] [PubMed] [Green Version]
- Daly, K.; Darby, A.C.; Hall, N.; Wilkinson, M.C.; Pongchaikul, P.; Bravo, D.; Shirazi-Beechey, S.P. Bacterial sensing underlies artificial sweetener-induced growth of gut Lactobacillus. Environ. Microbiol. 2016, 18, 2159–2171. [Google Scholar] [CrossRef]
- Li, Z.; Gao, J.; Guo, Y.; Cui, Y.; Wang, Y.; Duan, W.; Wu, Z. Enhancement of antibiotic resistance dissemination by artificial sweetener acesulfame potassium: Insights from cell membrane, enzyme, energy supply and transcriptomics. J. Hazard. Mater. 2022, 422, 126942. [Google Scholar] [CrossRef]
- Yu, Z.; Wang, Y.; Henderson, I.R.; Guo, J. Artificial sweeteners stimulate horizontal transfer of extracellular antibiotic resistance genes through natural transformation. ISME J. 2022, 16, 543–554. [Google Scholar] [CrossRef]
- Yu, Z.; Guo, J. Non-caloric artificial sweeteners exhibit antimicrobial activity against bacteria and promote bacterial evolution of antibiotic tolerance. J. Hazard. Mater. 2022, 433, 128840. [Google Scholar] [CrossRef]
- Markus, V.; Share, O.; Shagan, M.; Halpern, B.; Bar, T.; Kramarsky-Winter, E.; Teralı, K.; Özer, N.; Marks, R.S.; Kushmaro, A.; et al. Inhibitory Effects of Artificial Sweeteners on Bacterial Quorum Sensing. Int. J. Mol. Sci. 2021, 22, 9863. [Google Scholar] [CrossRef]
- Lobach, A.R.; Roberts, A.; Rowland, I.R. Assessing the in vivo data on low/no-calorie sweeteners and the gut microbiota. Food Chem. Toxicol. 2019, 124, 385–399. [Google Scholar] [CrossRef]
- Pfeffer, M.; Ziesenitz, S.C.; Siebert, G. Acesulfame K, cyclamate and saccharin inhibit the anaerobic fermentation of glucose by intestinal bacteria. Z. Ernahr. 1985, 24, 231–235. [Google Scholar] [CrossRef]
- Bernt, W.O.; Borzelleca, J.F.; Flamm, G.; Munro, I.C. Erythritol: A review of biological and toxicological studies. Regul. Toxicol. Pharmacol. RTP 1996, 24, S191-7. [Google Scholar] [CrossRef] [PubMed] [Green Version]
- Arrigoni, E.; Brouns, F.; Amadò, R. Human gut microbiota does not ferment erythritol. Br. J. Nutr. 2005, 94, 643–646. [Google Scholar] [CrossRef] [Green Version]
- Han, Y.; Kwon, E.Y.; Choi, M.S. Anti-Diabetic Effects of Allulose in Diet-Induced Obese Mice via Regulation of mRNA Expression and Alteration of the Microbiome Composition. Nutrients 2020, 12, 2113. [Google Scholar] [CrossRef] [PubMed]
- Kawano, R.; Okamura, T.; Hashimoto, Y.; Majima, S.; Senmaru, T.; Ushigome, E.; Asano, M.; Yamazaki, M.; Takakuwa, H.; Sasano, R.; et al. Erythritol Ameliorates Small Intestinal Inflammation Induced by High-Fat Diets and Improves Glucose Tolerance. Int. J. Mol. Sci. 2021, 22, 5558. [Google Scholar] [CrossRef] [PubMed]
- Caballero, B.; Finglas, P.; Toldrá, F. (Eds.) Encyclopedia of Food and Health; Academic Press: Cambridge, MA, USA, 2015. [Google Scholar]
- Jiang, L.; Xie, M.; Chen, G.; Qiao, J.; Zhang, H.; Zeng, X. Phenolics and Carbohydrates in Buckwheat Honey Regulate the Human Intestinal Microbiota. Evid.-Based Complement. Altern. Med. 2020, 2020, 6432942. [Google Scholar] [CrossRef] [PubMed]
- Lynch, H.; Milgrom, P. Xylitol and dental caries: An overview for clinicians. J. Calif. Dent. Assoc. 2003, 31, 205–209. [Google Scholar]
- Campus, G.; Cagetti, M.G.; Sacco, G.; Solinas, G.; Mastroberardino, S.; Lingström, P. Six months of daily high-dose xylitol in high-risk schoolchildren: A randomized clinical trial on plaque pH and salivary mutans streptococci. Caries Res. 2009, 43, 455–461. [Google Scholar] [CrossRef]
- Uebanso, T.; Kano, S.; Yoshimoto, A.; Naito, C.; Shimohata, T.; Mawatari, K.; Takahashi, A. Effects of Consuming Xylitol on Gut Microbiota and Lipid Metabolism in Mice. Nutrients 2017, 9, 756. [Google Scholar] [CrossRef] [Green Version]
- Tamura, M.; Hoshi, C.; Hori, S. Xylitol affects the intestinal microbiota and metabolism of daidzein in adult male mice. Int. J. Mol. Sci. 2013, 14, 23993–24007. [Google Scholar] [CrossRef] [Green Version]
- Salminen, S.; Salminen, E.; Koivistoinen, P.; Bridges, J.; Marks, V. Gut microflora interactions with xylitol in the mouse, rat and man. Food Chem. Toxicol. 1985, 23, 985–990. [Google Scholar] [CrossRef]
- Söderling, E.M.; Ekman, T.C.; Taipale, T.J. Growth inhibition of Streptococcus mutans with low xylitol concentrations. Curr. Microbiol. 2008, 56, 382–385. [Google Scholar] [CrossRef]
- Schauber, J.; Weiler, F.; Gostner, A.; Melcher, R.; Kudlich, T.; Lührs, H.; Scheppach, W. Human rectal mucosal gene expression after consumption of digestible and non-digestible carbohydrates. Mol. Nutr. Food Res. 2006, 50, 1006–1012. [Google Scholar] [CrossRef] [PubMed]
- Lu, H.; Chen, L.; Pan, X.; Yao, Y.; Zhang, H.; Zhu, X.; Lou, X.; Zhu, C.; Wang, J.; Li, L.; et al. Lactitol Supplementation Modulates Intestinal Microbiome in Liver Cirrhotic Patients. Front. Med. 2021, 8, 762930. [Google Scholar] [CrossRef]
- Björklund, M.; Ouwehand, A.C.; Forssten, S.D.; Nikkilä, J.; Tiihonen, K.; Rautonen, N.; Lahtinen, S.J. Gut microbiota of healthy elderly NSAID users is selectively modified with the administration of Lactobacillus acidophilus NCFM and lactitol. Age 2012, 34, 987–999. [Google Scholar] [CrossRef] [PubMed] [Green Version]
- Ouwehand, A.C.; Tiihonen, K.; Saarinen, M.; Putaala, H.; Rautonen, N. Influence of a combination of Lactobacillus acidophilus NCFM and lactitol on healthy elderly: Intestinal and immune parameters. Br. J. Nutr. 2009, 101, 367–375. [Google Scholar] [CrossRef] [PubMed] [Green Version]
- Li, X.Q.; Zhang, X.M.; Wu, X.; Lan, Y.; Xu, L.; Meng, X.C.; Li, J.N. Beneficial effects of lactitol on the composition of gut microbiota in constipated patients. J. Dig. Dis. 2020, 21, 445–453. [Google Scholar] [CrossRef]
- Chen, C.; Li, L.; Wu, Z.; Chen, H.; Fu, S. Effects of lactitol on intestinal microflora and plasma endotoxin in patients with chronic viral hepatitis. J. Infect. 2007, 54, 98–102. [Google Scholar] [CrossRef]
- Naimi, S.; Viennois, E.; Gewirtz, A.T.; Chassaing, B. Direct impact of commonly used dietary emulsifiers on human gut microbiota. Microbiome 2021, 9, 66. [Google Scholar] [CrossRef]
- Calgaro, M.; Pandolfo, M.; Salvetti, E.; Marotta, A.; Larini, I.; Pane, M.; Amoruso, A.; Del Casale, A.; Vitulo, N.; Fiorio, M.; et al. Metabarcoding analysis of gut microbiota of healthy individuals reveals impact of probiotic and maltodextrin consumption. Benef. Microbes 2021, 12, 121–136. [Google Scholar] [CrossRef]
- Laudisi, F.; Di Fusco, D.; Dinallo, V.; Stolfi, C.; Di Grazia, A.; Marafini, I.; Colantoni, A.; Ortenzi, A.; Alteri, C.; Guerrieri, F.; et al. The Food Additive Maltodextrin Promotes Endoplasmic Reticulum Stress-Driven Mucus Depletion and Exacerbates Intestinal Inflammation. Cell. Mol. Gastroenterol. Hepatol. 2019, 7, 457–473. [Google Scholar] [CrossRef] [PubMed] [Green Version]
- Nishimura, N.; Tanabe, H.; Yamamoto, T. Isomaltodextrin, a highly branched α-glucan, increases rat colonic H2 production as well as indigestible dextrin. Biosci. Biotechnol. Biochem. 2016, 80, 554–563. [Google Scholar] [CrossRef] [PubMed] [Green Version]
- Beards, E.; Tuohy, K.; Gibson, G. A human volunteer study to assess the impact of confectionery sweeteners on the gut microbiota composition. Br. J. Nutr. 2010, 104, 701–708. [Google Scholar] [CrossRef] [PubMed] [Green Version]
- Cox, S.; Sandall, A.; Smith, L.; Rossi, M.; Whelan, K. Food additive emulsifiers: A review of their role in foods, legislation and classifications, presence in food supply, dietary exposure, and safety assessment. Nutr. Rev. 2021, 79, 726–741. [Google Scholar] [CrossRef]
- Garzón, R.; Hernando, I.; Llorca, E.; Rosell, C.M. Understanding the effect of emulsifiers on bread aeration during breadmaking. J. Sci. Food Agric. 2018, 98, 5494–5502. [Google Scholar] [CrossRef] [Green Version]
- Partridge, D.; Lloyd, K.A.; Rhodes, J.M.; Walker, A.W.; Johnstone, A.M.; Campbell, B.J. Food additives: Assessing the impact of exposure to permitted emulsifiers on bowel and metabolic health—Introducing the FADiets study. Nutr. Bull. 2019, 44, 329–349. [Google Scholar] [CrossRef] [Green Version]
- Rather, P.N. Swarmer cell differentiation in Proteus mirabilis. Environ. Microbiol. 2005, 7, 1065–1073. [Google Scholar] [CrossRef]
- Allison, C.; Lai, H.C.; Hughes, C. Co-ordinate expression of virulence genes during swarm-cell differentiation and population migration of Proteus mirabilis. Mol. Microbiol. 1992, 6, 1583–1591. [Google Scholar]
- Chassaing, B.; Compher, C.; Bonhomme, B.; Liu, Q.; Tian, Y.; Walters, W.; Nessel, L.; Delaroque, C.; Hao, F.; Gershuni, V.; et al. Randomized Controlled-Feeding Study of Dietary Emulsifier Carboxymethylcellulose Reveals Detrimental Impacts on the Gut Microbiota and Metabolome. Gastroenterology 2022, 162, 743–756. [Google Scholar] [CrossRef]
- Lock, J.Y.; Carlson, T.L.; Wang, C.M.; Chen, A.; Carrier, R.L. Acute Exposure to Commonly Ingested Emulsifiers Alters Intestinal Mucus Structure and Transport Properties. Sci. Rep. 2018, 8, 10008. [Google Scholar] [CrossRef]
- Martino, J.V.; Van Limbergen, J.; Cahill, L.E. The Role of Carrageenan and Carboxymethylcellulose in the Development of Intestinal Inflammation. Front. Pediatr. 2017, 5, 96. [Google Scholar] [CrossRef] [PubMed] [Green Version]
- Nicklin, S.; Miller, K. Intestinal uptake and immunological effects of carrageenan--current concepts. Food Addit. Contam. 1989, 6, 425–436. [Google Scholar] [CrossRef] [PubMed]
- Michel, C.; Macfarlane, G.T. Digestive fates of soluble polysaccharides from marine macroalgae: Involvement of the colonic microflora and physiological consequences for the host. J. Appl. Bacteriol. 1996, 80, 349–369. [Google Scholar] [CrossRef]
- Ariffin, S.H.; Yeen, W.W.; Abidin, I.Z.; Abdul Wahab, R.M.; Ariffin, Z.Z.; Senafi, S. Cytotoxicity effect of degraded and undegraded kappa and iota carrageenan in human intestine and liver cell lines. BMC Complement. Altern. Med. 2014, 14, 508. [Google Scholar]
- Bhattacharyya, S.; Shumard, T.; Xie, H.; Dodda, A.; Varady, K.A.; Feferman, L.; Halline, A.G.; Goldstein, J.L.; Hanauer, S.B.; Tobacman, J.K. A randomized trial of the effects of the no-carrageenan diet on ulcerative colitis disease activity. Nutr. Healthy Aging 2017, 4, 181–192. [Google Scholar] [CrossRef] [PubMed] [Green Version]
- Mallett, A.K.; Rowland, I.R.; Bearne, C.A.; Nicklin, S. Influence of dietary carrageenans on microbial biotransformation activities in the cecum of rodents and on gastrointestinal immune status in the rat. Toxicol. Appl. Pharmacol. 1985, 78, 377–385. [Google Scholar] [CrossRef]
- du Preez, R.; Paul, N.; Mouatt, P.; Majzoub, M.E.; Thomas, T.; Panchal, S.K.; Brown, L. Carrageenans from the Red Seaweed Sarconema filiforme Attenuate Symptoms of Diet-Induced Metabolic Syndrome in Rats. Mar. Drugs 2020, 18, 97. [Google Scholar] [CrossRef] [Green Version]
- Ma, C.; Li, Q.; Dai, X. Carrageenan Oligosaccharides Extend Life Span and Health Span in Male Drosophila melanogaster by Modulating Antioxidant Activity, Immunity, and Gut Microbiota. J. Med. Food 2021, 24, 101–109. [Google Scholar] [CrossRef]
- Zhang, M.S.; Sandouk, A.; Houtman, J.C. Glycerol Monolaurate (GML) inhibits human T cell signaling and function by disrupting lipid dynamics. Sci. Rep. 2016, 6, 30225. [Google Scholar] [CrossRef] [Green Version]
- Jiang, Z.; Zhao, M.; Zhang, H.; Li, Y.; Liu, M.; Feng, F. Antimicrobial Emulsifier-Glycerol Monolaurate Induces Metabolic Syndrome, Gut Microbiota Dysbiosis, and Systemic Low-Grade Inflammation in Low-Fat Diet Fed Mice. Mol. Nutr. Food Res. 2018, 62, 1700547. [Google Scholar] [CrossRef]
- Sakhr, K.; El Khatib, S. Physiochemical properties and medicinal, nutritional and industrial applications of Lebanese Sumac (Syrian Sumac—Rhus coriaria): A review. Heliyon 2020, 6, e03207. [Google Scholar] [CrossRef] [PubMed] [Green Version]
- Winkler, H.C.; Notter, T.; Meyer, U.; Naegeli, H. Critical review of the safety assessment of titanium dioxide additives in food. J. Nanobiotechnol. 2018, 16, 51. [Google Scholar] [CrossRef] [PubMed] [Green Version]
- Barreau, F.; Tisseyre, C.; Ménard, S.; Ferrand, A.; Carriere, M. Titanium dioxide particles from the diet: Involvement in the genesis of inflammatory bowel diseases and colorectal cancer. Part. Fibre Toxicol. 2021, 18, 26. [Google Scholar] [CrossRef] [PubMed]
- Younes, M.; Aquilina, G.; Castle, L.; Engel, K.-H.; Fowler, P.; Frutos Fernandez, M.J.; Fürst, P.; Gundert-Remy, U.; Gürtler, R.; Husøy, T.; et al. Safety assessment of titanium dioxide (E171) as a food additive. EFSA J. 2021, 19, e06585. [Google Scholar]
- Baranowska-Wójcik, E.; Gustaw, K.; Szwajgier, D.; Oleszczuk, P.; Pawlikowska-Pawlęga, B.; Pawelec, J.; Kapral-Piotrowska, J. Four Types of TiO2 Reduced the Growth of Selected Lactic Acid Bacteria Strains. Foods 2021, 10, 939. [Google Scholar] [CrossRef]
- Liu, L.Y.; Sun, L.; Zhong, Z.T.; Zhu, J.; Song, H.Y. Effects of titanium dioxide nanoparticles on intestinal commensal bacteria. Nucl. Sci. Tech. 2016, 27, 5. [Google Scholar] [CrossRef]
- Zhang, S.; Jiang, X.; Cheng, S.; Fan, J.; Qin, X.; Wang, T.; Zhang, Y.; Zhang, J.; Qiu, Y.; Qiu, J.; et al. Titanium dioxide nanoparticles via oral exposure leads to adverse disturbance of gut microecology and locomotor activity in adult mice. Arch. Toxicol. 2020, 94, 1173–1190. [Google Scholar] [CrossRef]
- Ubeda, C.; Bucci, V.; Caballero, S.; Djukovic, A.; Toussaint, N.C.; Equinda, M.; Lipuma, L.; Ling, L.; Gobourne, A.; No, D.; et al. Intestinal microbiota containing Barnesiella species cures vancomycin-resistant Enterococcus faecium colonization. Infect. Immun. 2013, 81, 965–973. [Google Scholar] [CrossRef] [Green Version]
- Kim, E.; Ahn, H.; Park, H. A review on the role of gut microbiota in immune checkpoint blockade therapy for cancer. Mamm. Genome 2021, 32, 223–231. [Google Scholar] [CrossRef]
- Butler, K.S.; Casey, B.J.; Garborcauskas, G.V.; Dair, B.J.; Elespuru, R.K. Assessment of titanium dioxide nanoparticle effects in bacteria: Association, uptake, mutagenicity, co-mutagenicity and DNA repair inhibition. Mutat. Res. Genet. Toxicol. Environ. Mutagenesis 2014, 768, 14–22. [Google Scholar] [CrossRef]
- Carroll, I.M.; Andrus, J.M.; Bruno-Bárcena, J.M.; Klaenhammer, T.R.; Hassan, H.M.; Threadgill, D.S. Anti-inflammatory properties of Lactobacillus gasseri expressing manganese superoxide dismutase using the interleukin 10-deficient mouse model of colitis. Am. J. Physiol. Gastrointest. Liver Physiol. 2007, 293, G729–G738. [Google Scholar] [CrossRef] [PubMed] [Green Version]
- Chen, Z.; Zhou, D.; Han, S.; Zhou, S.; Jia, G. Hepatotoxicity and the role of the gut-liver axis in rats after oral administration of titanium dioxide nanoparticles. Part. Fibre Toxicol. 2019, 16, 48. [Google Scholar] [CrossRef] [PubMed]
- Chen, L.; Guo, Y.; Hu, C.; Lam, P.K.S.; Lam, J.C.W.; Zhou, B. Dysbiosis of gut microbiota by chronic coexposure to titanium dioxide nanoparticles and bisphenol A: Implications for host health in zebrafish. Environ. Pollut. 2018, 234, 307–317. [Google Scholar] [CrossRef] [PubMed]
- Li, J.; Yang, S.; Lei, R.; Gu, W.; Qin, Y.; Ma, S.; Chen, K.; Chang, Y.; Bai, X.; Xia, S.; et al. Oral administration of rutile and anatase TiO2 nanoparticles shifts mouse gut microbiota structure. Nanoscale 2018, 10, 7736–7745. [Google Scholar] [CrossRef]
- Butler, M.; Boyle, J.J.; Powell, J.J.; Playford, R.J.; Ghosh, S. Dietary microparticles implicated in Crohn’s disease can impair macrophage phagocytic activity and act as adjuvants in the presence of bacterial stimuli. Inflamm. Res. 2007, 56, 353–361. [Google Scholar] [CrossRef]
- Ogugbue, C.J.; Morad, N.; Sawidis, T.; Oranusi, N.A. Decolorization and partial mineralization of a polyazo dye by Bacillus firmus immobilized within tubular polymeric gel. 3 Biotech 2012, 2, 67–78. [Google Scholar] [CrossRef] [Green Version]
- Sperandio, F.F.; Huang, Y.Y.; Hamblin, M.R. Antimicrobial photodynamic therapy to kill Gram-negative bacteria. Recent Pat. Anti-Infect. Drug Discov. 2013, 8, 108–120. [Google Scholar] [CrossRef] [Green Version]
- Bouvard, V.; Loomis, D.; Guyton, K.Z.; Grosse, Y.; Ghissassi, F.E.; Benbrahim-Tallaa, L.; Guha, N.; Mattock, H.; Straif, K. Carcinogenicity of consumption of red and processed meat. Lancet Oncol. 2015, 16, 1599–1600. [Google Scholar] [CrossRef] [Green Version]
- IARC Monographs on the Evaluation of Carcinogenic Risks to Humans. In Ingested Nitrate and Nitrite, and Cyanobacterial Peptide Toxins; International Agency for Research on Cance: Lyon, France, 2010.
- McCann, D.; Barrett, A.; Cooper, A.; Crumpler, D.; Dalen, L.; Grimshaw, K.; Kitchin, E.; Lok, K.; Porteous, L.; Prince, E.; et al. Food additives and hyperactive behaviour in 3-year-old and 8/9-year-old children in the community: A randomised, double-blinded, placebo-controlled trial. Lancet 2007, 370, 1560–1567. [Google Scholar] [CrossRef]
- Pogoda, J.M.; Preston-Martin, S.; Howe, G.; Lubin, F.; Mueller, B.A.; Holly, E.A.; Filippini, G.; Peris-Bonet, R.; McCredie, M.R.; Cordier, S.; et al. An international case-control study of maternal diet during pregnancy and childhood brain tumor risk: A histology-specific analysis by food group. Ann. Epidemiol. 2009, 19, 148–160. [Google Scholar] [CrossRef] [Green Version]
- Tonacchera, M.; Pinchera, A.; Dimida, A.; Ferrarini, E.; Agretti, P.; Vitti, P.; Santini, F.; Crump, K.; Gibbs, J. Relative potencies and additivity of perchlorate, thiocyanate, nitrate, and iodide on the inhibition of radioactive iodide uptake by the human sodium iodide symporter. Thyroid 2004, 14, 1012–1019. [Google Scholar] [CrossRef] [PubMed] [Green Version]
- Mao, X.; Yang, Q.; Chen, D.; Yu, B.; He, J. Benzoic Acid Used as Food and Feed Additives Can Regulate Gut Functions. BioMed Res. Int. 2019, 2019, 5721585. [Google Scholar] [CrossRef] [PubMed] [Green Version]
- Guggenbuhl, P.; Séon, A.; Quintana, A.P.; Nunes, C.S. Effects of dietary supplementation with benzoic acid (VevoVitall®) on the zootechnical performance, the gastrointestinal microflora and the ileal digestibility of the young pig. Livest. Sci. 2007, 108, 218–221. [Google Scholar] [CrossRef]
- Silva Júnior, C.D.; Martins, C.C.S.; Dias, F.T.F.; Sitanaka, N.Y.; Ferracioli, L.B.; Moraes, J.E.; Pizzolante, C.C.; Budiño, F.E.L.; Pereira, R.; Tizioto, P.; et al. The use of an alternative feed additive, containing benzoic acid, thymol, eugenol, and piperine, improved growth performance, nutrient and energy digestibility, and gut health in weaned piglets. J. Anim. Sci. 2020, 98, skaa119. [Google Scholar] [CrossRef]
- Hrncirova, L.; Hudcovic, T.; Sukova, E.; Machova, V.; Trckova, E.; Krejsek, J.; Hrncir, T. Human gut microbes are susceptible to antimicrobial food additives in vitro. Folia Microbiol. 2019, 64, 497–508. [Google Scholar] [CrossRef]
- Peng, Q.; Chang, H.; Wang, R.; You, Z.; Jiang, S.; Ma, C.; Huo, D.; Zhu, X.; Zhang, J. Potassium sorbate suppresses intestinal microbial activity and triggers immune regulation in zebrafish (Danio rerio). Food Funct. 2019, 10, 7164–7173. [Google Scholar] [CrossRef] [PubMed]
- Irwin, S.V.; Fisher, P.; Graham, E.; Malek, A.; Robidoux, A. Sulfites inhibit the growth of four species of beneficial gut bacteria at concentrations regarded as safe for food. PLoS ONE 2017, 12, e0186629. [Google Scholar] [CrossRef] [PubMed] [Green Version]
- Coll Ferrer, M.C.; Dastgheyb, S.; Hickok, N.J.; Eckmann, D.M.; Composto, R.J. Designing nanogel carriers for antibacterial applications. Acta Biomater. 2014, 10, 2105–2111. [Google Scholar] [CrossRef] [Green Version]
- Salem, H.M.; Ismael, E.; Shaalan, M. Evaluation of the Effects of Silver Nanoparticles Against Experimentally Induced Necrotic Enteritis in Broiler Chickens. Int. J. Nanomed. 2021, 16, 6783–6796. [Google Scholar] [CrossRef]
- Das, P.; McDonald, J.A.K.; Petrof, E.O.; Allen-Vercoe, E.; Walker, V.K. Nanosilver-Mediated Change in Human Intestinal Microbiota. J. Nanomed. Nanotechnol. 2014, 5, 235. [Google Scholar]
- van den Brule, S.; Ambroise, J.; Lecloux, H.; Levard, C.; Soulas, R.; De Temmerman, P.J.; Palmai-Pallag, M.; Marbaix, E.; Lison, D. Dietary silver nanoparticles can disturb the gut microbiota in mice. Part. Fibre Toxicol. 2016, 13, 38. [Google Scholar] [CrossRef] [PubMed] [Green Version]
- Williams, K.; Milner, J.; Boudreau, M.D.; Gokulan, K.; Cerniglia, C.E.; Khare, S. Effects of subchronic exposure of silver nanoparticles on intestinal microbiota and gut-associated immune responses in the ileum of Sprague-Dawley rats. Nanotoxicology 2015, 9, 279–289. [Google Scholar] [CrossRef] [PubMed]
- Javurek, A.B.; Suresh, D.; Spollen, W.G.; Hart, M.L.; Hansen, S.A.; Ellersieck, M.R.; Bivens, N.J.; Givan, S.A.; Upendran, A.; Kannan, R.; et al. Gut Dysbiosis and Neurobehavioral Alterations in Rats Exposed to Silver Nanoparticles. Sci. Rep. 2017, 7, 2822. [Google Scholar] [CrossRef] [PubMed]
- Wilding, L.A.; Bassis, C.M.; Walacavage, K.; Hashway, S.; Leroueil, P.R.; Morishita, M.; Maynard, A.D.; Philbert, M.A.; Bergin, I.L. Repeated dose (28-day) administration of silver nanoparticles of varied size and coating does not significantly alter the indigenous murine gut microbiome. Nanotoxicology 2016, 10, 513–520. [Google Scholar] [CrossRef] [PubMed] [Green Version]
- Ma, Y.; Song, L.; Lei, Y.; Jia, P.; Lu, C.; Wu, J.; Xi, C.; Strauss, P.R.; Pei, D.-S. Sex dependent effects of silver nanoparticles on the zebrafish gut microbiota. Environ. Sci. Nano 2018, 5, 740–751. [Google Scholar] [CrossRef]
- Tian, X.; Jiang, X.; Welch, C.; Croley, T.R.; Wong, T.Y.; Chen, C.; Fan, S.; Chong, Y.; Li, R.; Ge, C.; et al. Bactericidal Effects of Silver Nanoparticles on Lactobacilli and the Underlying Mechanism. ACS Appl. Mater. Interfaces 2018, 10, 8443–8450. [Google Scholar] [CrossRef]
- You, X.; Einson, J.E.; Lopez-Pena, C.L.; Song, M.; Xiao, H.; McClements, D.J.; Sela, D.A. Food-grade cationic antimicrobial ε-polylysine transiently alters the gut microbial community and predicted metagenome function in CD-1 mice. NPJ Sci. Food 2017, 1, 8. [Google Scholar] [CrossRef] [Green Version]
- Brindisi, M.; Bouzidi, C.; Frattaruolo, L.; Loizzo, M.R.; Tundis, R.; Dugay, A.; Deguin, B.; Cappello, A.R.; Cappello, M.S. Chemical Profile, Antioxidant, Anti-Inflammatory, and Anti-Cancer Effects of Italian Salvia rosmarinus Spenn. Methanol Leaves Extracts. Antioxidants 2020, 9, 826. [Google Scholar] [CrossRef]
- Yang, M.; Yin, Y.; Wang, F.; Bao, X.; Long, L.; Tan, B.; Yin, Y.; Chen, J. Effects of dietary rosemary extract supplementation on growth performance, nutrient digestibility, antioxidant capacity, intestinal morphology, and microbiota of weaning pigs. J. Anim. Sci. 2021, 99, skab237. [Google Scholar] [CrossRef]
- Ou, J.; Huang, J.; Zhao, D.; Du, B.; Wang, M. Protective effect of rosmarinic acid and carnosic acid against streptozotocin-induced oxidation, glycation, inflammation and microbiota imbalance in diabetic rats. Food Funct. 2018, 9, 851–860. [Google Scholar] [CrossRef]
- Guo, Y.; Xie, J.; Li, X.; Yuan, Y.; Zhang, L.; Hu, W.; Luo, H.; Yu, H.; Zhang, R. Antidepressant Effects of Rosemary Extracts Associate With Anti-inflammatory Effect and Rebalance of Gut Microbiota. Front. Pharmacol. 2018, 9, 1126. [Google Scholar] [CrossRef] [PubMed] [Green Version]
Комментарии
Комментариев пока нет