ООО "ПРОПИОНИКС"
| пн-пт с 09:00 до 18:00 | |
Влияние добавок железа на микробиоту кишечника и эффект приема пробиотиков при дефиците железа
« НазадПОИСК ЭФФЕКТИВНЫХ ДОБАВОК ЖЕЛЕЗА С УЧЕТОМ ВЗАИМОДЕЙСТВИЯ ПОСЛЕДНЕГО С КИШЕЧНОЙ МИКРОБИОТОЙ

Влияние добавок железа на микробиоту кишечника и эффект приема пробиотиков при дефиците железа
СОДЕРЖАНИЕ ОБЗОРА
- Предисловие
- 1. Введение
- 2. Метаболизм железа: значение для здоровья и болезней
- Рисунок 1. Обзор кишечного всасывания и метаболизма железа с участием энтероцитов, гепатоцитов, макрофагов и эритроидного костного мозга
- Рисунок 2. Классификация анемий
- 3. Микробиота кишечника и дефицит железа
- 4. Поглощение железа из добавок и из пищи
- 5. Применение пробиотиков, пребиотиков и синбиотиков в лечении дефицита железа
- 5.1. Пробиотики и лечение дефицита железа
- Таблица 1. Потребление пробиотиков при различных видах дефицита железа и их влияние на уровень железа в организме. ЖДА - железодефицитная анемия.
- Таблица 1S. Влияние пероральных добавок железа на состав кишечной микробиоты
- 5.2. Пребиотики и синбиотики в лечении дефицита железа
- Таблица 2. Потребление пребиотиков и синбиотиков при различных видах дефицита железа и их влияние на уровень железа в организме.
- 6. Выводы
- Дополнительная информация
- Литература
Предисловие. Дефицит железа в организме человека является глобальной проблемой, от которой страдают более двух миллиардов человек во всем мире. Важнейшие функции, обеспечиваемые достаточным количеством железа в организме, связаны с транспортом и хранением кислорода, переносом электронов, участием в окислительно-восстановительных реакциях, синтезом гормонов, репликацией ДНК, восстановлением и контролем клеточного цикла, фиксацией азота, антиоксидантным действием. При дефиците железа даже незначительная недостаточность может нарушить нормальное функционирование организма. С другой стороны, превышение концентрации железа оказывает существенное влияние на состав микробиоты кишечника. Существует несколько негенетических причин, приводящих к дефициту железа, и, соответственно, несколько подходов к их лечению. Наиболее распространенные методы связаны с обогащением продуктов питания и применением биологически активных добавок. В данном обзоре, после краткого описания метаболизма железа и его влияния на здоровье, мы проанализировали научную литературу на предмет влияния добавок железа на микробиом кишечника и влияние пробиотиков, пребиотиков и/или синбиотиков на усвоение и доступность железа для организма.
Дефицит железа - широко распространенная проблема, которой страдают более двух миллиардов человек во всем мире. Основными причинами этой недостаточности являются отсутствие в рационе продуктов, богатых железом, или неспособность организма усваивать поступающее с пищей железо в силу приобретенных или генетических причин. Дефицитом железа страдает около 40% населения развивающихся стран и около 10% жителей развитых стран [1]. Железо может поступать с продуктами питания, биологически активными добавками, а также в результате медицинских процедур, таких как переливание крови и/или эритроцитарных концентратов [2]. Наибольшее значение имеет не источник железа, а тип получаемого железа и пути его усвоения [3,4,5]. Доказано, что такие продукты, как овощи, мясо и мясные продукты, являются прекрасным источником железа, а ферментированный вариант этих продуктов улучшает усвоение железа из рациона. Молочная кислота, вырабатываемая лактобактериями, повышает пищевую биодоступность железа, что позволяет предположить, что использование пробиотических бактерий может служить клиническим инструментом для оптимизации биодоступности железа [6,7,8]. Окисленное железо в окружающей среде обладает низкой растворимостью, поэтому организмы должны выработать адекватные способы борьбы за доступные источники. Рост и благополучие человека прямо пропорциональны потреблению этого нутриента и в значительной степени зависят от состава микробиоты кишечника [9,10,11]. Все большее число исследований связывают биодоступность и всасывание железа с активностью микроорганизмов в кишечнике [12,13,14]. Более того, вирулентность многих патогенных микроорганизмов связана с уровнем железа [15]. В организме человека усваивается только 10% пищевого железа, остальные 90% выводятся с фекалиями, что влияет на баланс микробиоты [16].
В данном обзоре мы анализируем научную литературу, посвященную влиянию обогащения и добавок железа на микробиом кишечника и воздействию пробиотиков, пребиотиков и/или синбиотиков на абсорбцию и доступность железа для организма.
2. Метаболизм железа: значение для здоровья и болезней
Благодаря своему участию в метаболических процессах железо необходимо всем организмам. Наиболее изучены его функции, связанные с переносом и хранением кислорода, переносом электронов, синтезом гормонов, репликацией ДНК, контролем клеточного цикла, фиксацией азота и антиоксидантными свойствами [10,17]. Количество железа в организме взрослого мужчины составляет 3,5-4,0 г, причем большая его часть находится в гемоглобине (Hb) [3]. Транспорт железа в пищеварительной системе контролируется несколькими железосвязывающими белками (например, трансферрином, лактоферрином, бактериоферритином), а также другими функциональными агентами, присутствующими в нескольких ключевых участках. Как правило, муцины связываются с железом под воздействием кислой среды желудка, что способствует его сохранению в растворимом состоянии для последующего поглощения в щелочной среде двенадцатиперстной кишки. В дальнейшем железо, связанное с муцином, может проходить через клеточную мембрану слизистой оболочки. После попадания внутрь клетки мобилферрин, цитоплазматический железосвязывающий белок, транспортирует его на базолатеральную сторону, откуда оно экспортируется в плазму крови. Механизм всасывания гемового и негемового железа в клетках слизистой оболочки кишечника включает в себя различные транспортные процессы и регуляторные белки (рис. 1) [18]. Именно на этом этапе уровень ферритина рассматривается как наиболее надежный маркер дефицита железа [17].
Рисунок 1. Обзор кишечного всасывания и метаболизма железа с участием энтероцитов, гепатоцитов, макрофагов и эритроидного костного мозга - адаптировано из [19-27].
Что известно: Для синтеза гема и других металлопротеинов требуется >20 мг железа в сутки (из рациона и в основном за счет рециркуляции); из них только 1-2 мг железа поступает в кишечник (в основном в двенадцатиперстную кишку). Гемовое железо из рациона легко всасывается (через гемовый транспортер), а негемовое железо находится преимущественно в виде железа (Fe3+). Для облегчения транспорта нерастворимого железа через люминальную мембрану энтероцитов железо (Fe3+) восстанавливается ферментом ферритредуктазой дуоденального цитохрома В (DCYTB) до железа (Fe2+), которое затем транспортируется в энтероцит через транспортер двухвалентных металлов DMT 1. Для выделения железа в циркуляцию с базолатеральной мембраны энтероцитов и макрофагов используется ферропортин (FPN). В процесс экспорта также вовлечена ферроксидаза - гефестин, которая превращает Fe2+ обратно в Fe3+. Этот этап необходим для присоединения железа к апо-трансферрину, в результате чего в плазме образуется трансферрин. (прим. ред.: когда трансферрин не связан с железом, он представляет собой апопротеин). Именно в такой форме диферриновый (двухвалентный) трансферрин доставляет железо к местам утилизации железа, например, в эритроидный костный мозг, где образуются эритроциты (RBC). FPN контролируется гепсидином (из гепатоцитов). Связывание гепцидина с FPN приводит к интернализации и деградации последнего в энтероците. Гепсидин, содержащийся в больших количествах, ингибирует высвобождение железа ферропортином. Однако при низкой концентрации он способствует экспорту железа в циркуляцию. В некоторых типах клеток (энтероциты, макрофаги) железо может храниться в виде связанного ферритина. В циркуляции железо, которое в несвязанном состоянии является токсичным, присоединяется к апо-трансферрину (как уже говорилось выше), образуя трансферрин плазмы.
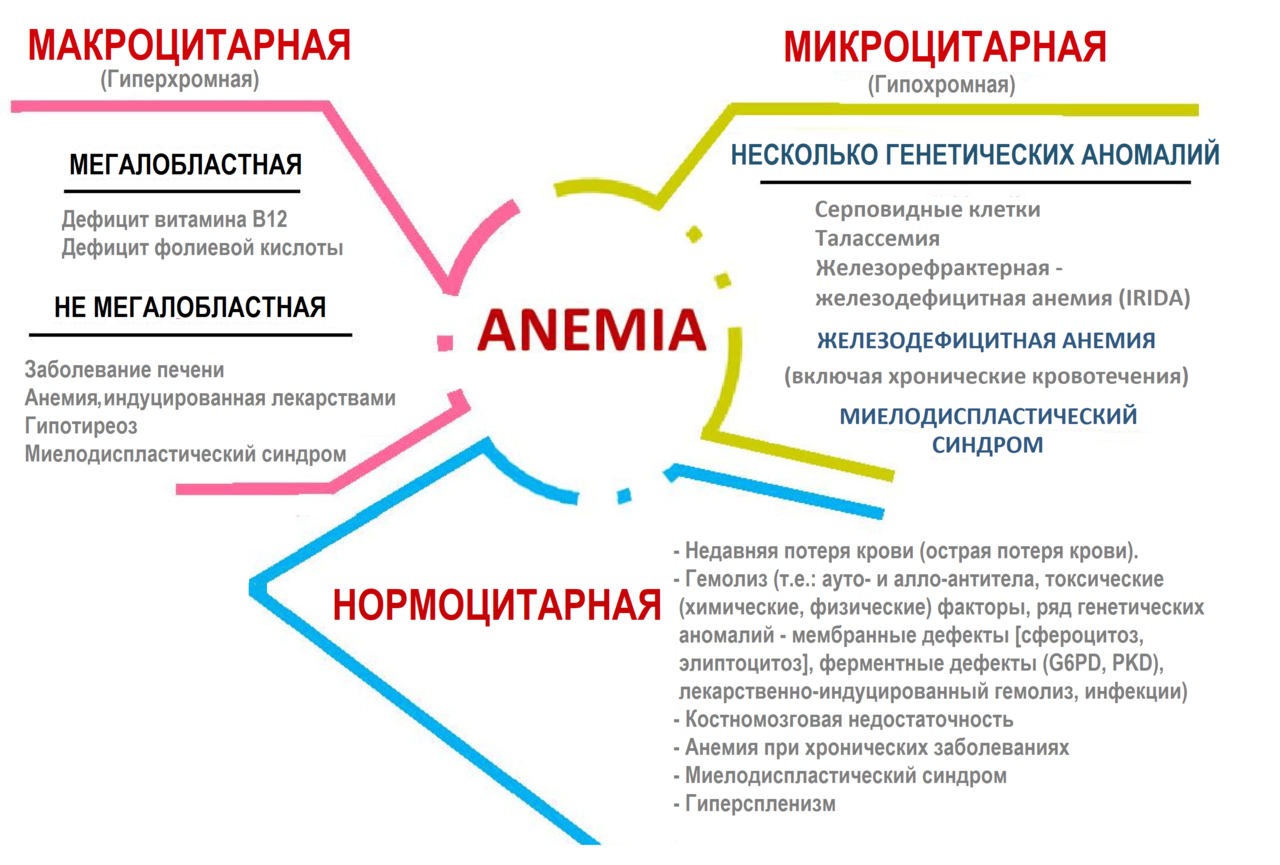
Анемия проявляется в результате неправильного питания или плохого усвоения железа. Дефицит железа может вызвать анемию, что приводит к невозможности поддержания нормальной оксигенации тканей и гомеостаза организма [28,29]. Примерно у 52% беременных женщин, в основном в развивающихся странах, может развиться этот дефицит. Потребность в железе во время беременности повышается, поскольку увеличиваются потребности, например, в норме наблюдается увеличение диаметра эритроцитов (богатых гемоглобином) [3,30]. Что касается распространенности железодефицитной анемии (ЖДА), то, по данным Всемирной организации здравоохранения (ВОЗ), около 50% всех случаев анемии обусловлены дефицитом железа [31]. Классификация анемий (основанная на морфологии эритроцитов) представлена на рис. 2.
Рисунок 2. Классификация анемий (адаптирована из [20,32]) (G6PD - глюкозо-6-фосфатдегидрогеназа; PKD - дефицит пируваткиназы).
Другие классификации основаны на таких критериях, как выработка эритроцитов, дефицит питания (железо, белки, фолаты, витамин В12, витамин В9), генетические нарушения синтеза цепей Hb, цитоскелет эритроцитов с аномальной формой, а также на вторичных патологиях, включая хронические кровотечения [18]. В некоторых случаях с анемией связаны также малоподвижный образ жизни, диабет и ожирение [18,33,34].
По данным ВОЗ [31], анемия, вызванная дефицитом железа, может быть классифицирована по трем стадиям - от первой (легкая форма) до третьей (тяжелая анемия) с низким уровнем Hb (<70 г/л у детей до 5 лет и беременных женщин и <80 г/л у детей старше 5 лет, подростков и взрослых). Последний тип влияет на когнитивные и физические функции человека, в результате чего у пациентов наблюдается хроническая усталость и снижение работоспособности [9,35]. Однако этот дефицит может быть скорректирован с помощью диеты или лечения препаратами железа. Наиболее частыми причинами дефицита железа являются низкая растворимость железа, низкая биодоступность и потеря крови в результате кровоизлияния [6]. Объяснением этих состояний является то, что большая часть железа, поступающего с пищей, имеет низкую растворимость и, соответственно, низкую биодоступность [1]. После всасывания железо попадает в системную циркуляцию и становится доступным либо для хранения, либо для физиологического функционирования организма [36].
3. Микробиота кишечника и дефицит железа
Микробиота желудочно-кишечного тракта человека играет важнейшую роль в метаболизме и функциях познания, влияя тем самым на жизненно важные функции организма. Сбалансированность рациона и питательных веществ влияет на здоровый рост микробиоты в первые годы жизни [37,38,39,40]. Для того чтобы модулировать баланс микробиоты кишечника и избежать дисбактериоза, пробиотики и пребиотики могут назначаться перорально, путем трансплантации микробиоты кала или другими методами [37]. Пробиотики - это живые микроорганизмы, которые, попадая в кишечник, улучшают его микробный состав. Пребиотики - это селективные неферментированные пищевые ингредиенты, которые вызывают изменения в жизнедеятельности микроорганизмов, подпитывая пробиотики, и тем самым обеспечивают множество преимуществ для хозяина [41].
Микробиота кишечника взрослых и детей различается в зависимости от возраста, этнической принадлежности, географического положения и образа жизни [38]. Здоровое питание, содержащее цельное зерно, свежие фрукты и овощи, орехи и лекарственные продукты, помогает нам бороться с различными заболеваниями и поддерживать баланс микробов в кишечнике [11,42]. Хотя физиологические и неврологические последствия дефицита железа изучены достаточно полно, необходимо продолжить исследования по оценке его влияния на развитие микробиоты кишечника [43,44]. Всасывание железа, которое может происходить как из рациона, так и из пероральных добавок, представляет собой сложный механизм, включающий множество реакций. Литература, посвященная всасыванию железа слизистыми оболочками, является противоречивой в дебатах о всасывании железа, представляя неясные объяснения того, всасывается ли оно в двухвалентной или трехвалентной форме. Однако было решено, что ключевую роль в всасывании железа играет растворимость перорального препарата в кишечнике [49]. По данным одного из исследований, в процессе отлучения от груди различных детей из Африки обогащение железом изменяло микрофлору кишечника, что приводило к уменьшению количества бифидобактерий и увеличению числа энтеробактерий и некоторых специфических энтеропатогенов (например, патогенной кишечной палочки). Кроме того, в том же исследовании было отмечено, что обогащение железом повышает уровень фекального кальпротектина, свидетельствующего о воспалении кишечника [34]. Установлено, что при снижении уровня железа могут возникать кишечные инфекции из-за влияния на состав микробиоты кишечника [50]. В исследовании, проведенном на молодых женщинах в Южной Индии, низкий уровень железа коррелировал с низким содержанием лактобацилл в кале [51].
Как дефицит, так и избыток железа имеют важное значение в плане дисбиоза микробиоты кишечника, возникновения и развития воспаления и колоректального рака [42,52,53]. Существуют специфические бактерии, опосредующие развитие кишечных патологий, такие как Streptococcus bovis, Enterococcus faecalis и Clostridia. Они выделяют сероводород и вторичные желчные соли, которые ускоряют воспаление и канцерогенез [54,55]. Некоторые бактерии, в том числе Bifidobacterium longum и Lactobacillus acidophilus, предотвращают воспаление в кишечнике [56]. По данным [57], на воспаление кишечника не влияло высокое количество дополнительного железа (50 мг Fe, 4 дня/неделю) в течение 266 дней, а концентрация основных микроорганизмов и короткоцепочечных жирных кислот (продуцируемых пробиотиками) в фекалиях оставалась неизменной. Предыдущее исследование, проведенное на крысах теми же авторами, показало, что у крыс с дефицитом железа концентрация бутирата и пропионата (продуцируемых специально группой Roseburia spp./E. rectale) в фекалиях была значительно ниже, а состав микробиоты кишечника сильно изменен [58]. Из этого следует, что недостаток железа оказывает заметное влияние на микробиоту кишечника, а избыток железа - нет.
Установлено, что изменение гомеостаза железа в организме хозяина может влиять "на содержание железа в просвете кишечника и, следовательно, на состав кишечных бактерий" [59]. Анализ фекалий мышей показал, что в регуляции железа в значительной степени участвуют железорегуляторный белок 2 (Irp2) и белок Hfe – белок мутировавших генов, который проявляется при таких заболеваниях, как наследственный гемохроматоз. Результаты исследования показали, что по сравнению с контролем на мышах дикого типа у мутантных мышей Irp2-/- или Hfe-/- (т.е. у мышей дефицитных по указанным белкам) состав микробиоты значительно изменился. Таким образом, метаболизм железа в организме хозяина в значительной степени зависит от типа микробиоты кишечника хозяина [59]. Кроме того, одним из факторов, определяющих всасывание железа, является рН содержимого толстой кишки. Например, микроорганизмы могут ферментировать галактоолигосахариды, что приводит к снижению рН в кишечнике и, следовательно, облегчает всасывание железа на этом уровне. Следовательно, продукты, содержащие уксусную кислоту, приготовленные с использованием пробиотиков, могут быть введены в рацион и могут улучшить усвоение железа [60].
Согласно проведенному исследованию, колебания концентрации железа могут иметь патологические последствия, негативно влияя на состав кишечной микробиоты. По сравнению с мышами, колонизированными кишечными бактериями, у безмикробных мышей наблюдается 8-10-кратное увеличение экспрессии белков-транспортеров металлов 1 (DMT 1) и DCYTB и двукратное снижение экспрессии ферропортина в двенадцатиперстной кишке. Энтероциты безмикробных мышей содержали мало железа, а после колонизации кишечными бактериями эпителиальные клетки благоприятствовали накоплению железа [61]. Механизм объясняется в исследовании, проведенном Gonzales et al. 2017 [62]. Они показали, что Lactobacillus fermentum, основной пробиотик, присутствующий в микробиоте человека, проявляет замечательную железовосстанавливающую активность. П-гидроксифенилуксусная кислота, метаболит, продуцируемый этим штаммом, увеличивает абсорбцию железа через транспортеры DMT 1 из энтероцитов за счет восстановления Fe3+ до Fe2+. Аналогичные результаты получены в исследовании (на кенийских младенцах), в котором показано, что порошок, обогащенный железом, может негативно влиять на состав микробиоты кишечника, увеличивая количество патогенных микроорганизмов, что приводит к воспалению кишечника [34].
С точки зрения генетики, различные типы наследственного гемохроматоза обусловлены мутациями в генах HFE, гепцидина (HAMP), гемоювелина (HJV), ферропортина (SLC40)A1 и рецептора трансферрина 2 (TfR2), что соответствует генетическим нарушениям перегрузки железом [63,64]. Ферропортин является экспортером гепсидина - гормона, регулирующего содержание железа в организме, на что влияют мутации в гене HAMP [65,66]. Отсутствие нормальной функции ферропортина оказывает непосредственное влияние на содержание металлов в кишечном эпителии и кале, поскольку этот белок участвует в экспорте железа в циркуляцию как из энтероцитов, так и из макрофагов [67]. Мутации в железорегулирующем гене SLC40A1, кодирующем ферропортин, приводят к фенотипу гемохроматоза с перегрузкой печени железом, что негативно сказывается на состоянии кишечной микробиоты [68,69].
Богатая железом среда в кишечнике благоприятствует развитию протеобактерий. Исследования на детях показали, что избыток железа вызывает воспаление и рост патогенных бактерий [34,70].
Воспалительные заболевания кишечника приводят к нарушению всасывания железа. Избыток железа в кишечной среде может приводить к образованию патобионтов (потенциально патологических клеток), которые являются результатом трансформации бактерий комменсальной микробиоты [71]. Эти патобионты могут индуцировать колоректальный рак, который также может вызывать воспалительные заболевания кишечника [72].
4. Поглощение железа из добавок и из пищи
Несмотря на то, что железо является одним из важнейших питательных веществ в нашем рационе, дефицит железа является наиболее частым нарушением питания во всем мире. Наличие железа в гемовой и негемовой форме в различных продуктах питания, таких как бобовые, молоко, мясо и соки, было показано много лет назад [73]. Всасывание железа в кишечнике происходит различными путями в зависимости от типа присутствующего в нем железа. Абсорбция гемового железа (Fe2+), преимущественно содержащегося в мясной пище, известна частично и, вероятно, опосредована поступлением гемового переносчика в энтероциты. В клетках железо высвобождается из гема гемоксигеназой-1 (HO-1). Негемовое железо (Fe3+), преимущественно присутствующее в вегетарианской диете, перед транспортировкой в абсорбционные клетки кишечника восстанавливается ферментом ферритредуктазой CYBRD1 (DCYTB) до Fe2+. После восстановления негемового железа до гемового в просвете кишечника последнее транспортируется в энтероцит кишечника с помощью белка - транспортера двухвалентных металлов (DMT 1). Внутри энтероцитов железо может либо накапливаться в виде ферритина, либо транспортироваться через базолатеральную мембрану в кровоток под действием ферропортина (FPN1), который также называют экспортером железа. Гепсидин регулирует экспрессию FPN1. Гефестин модулирует метаболизм и гомеостаз для поглощения железа, а именно: объединяет два Fe3+ в одну молекулу трансферрина (Tf) и связывает железо с апо-трансферрином.
Существует множество вариантов лечения недостаточности железа, в том числе пероральные производные железа, которые могут эффективно всасываться в кишечнике, в основном в двенадцатиперстной кишке, учитывая, что желудок и другие отделы кишечника в меньшей степени участвуют в процессах всасывания [49].
Было показано, что добавление мяса и сока к бобовым увеличивает доступность железа, поскольку овощи содержат белок и минеральные вещества, но ограничены в аскорбиновой кислоте. Наиболее низкий уровень усвоения железа отмечен в молоке из-за большого количества присутствующего в нем кальция. Для повышения усвоения железа беременным женщинам и детям следует употреблять продукты с максимальным содержанием аскорбиновой кислоты, но не одновременно с молоком [74]. В ходе одного исследования мышам давали воду, зеленый чай, черный чай или экстракт чая при соблюдении диеты на основе железа. Результаты показали, что как черный, так и зеленый чай не представляют риска в отношении доступности железа и не оказывают неблагоприятного влияния на рост или метаболизм крыс, но взаимодействие абсорбции железа у людей с этими соединениями чая следует изучить более внимательно (из-за действия фитатов) [75]. Железо накапливается в организме с первых дней жизни, и при отсутствии генетических дефектов его отсутствие в организме свидетельствует о наличии нездоровой пищи в первые месяцы жизни или в рационе матери. Имеются данные о том, что обогащенные железом молочные смеси способствуют профилактике этого дефицита. Существуют исследования новорожденных (в возрасте до 32 недель), в которых следили за двумя категориями питания: получавших обогащенные железом молочные смеси и питавшихся молоком матери. Еженедельно рассчитывалось содержание железа в организме (Hb). Статистические данные свидетельствуют о том, что баланс железа в организме в виде гемоглобина с рождения и гемоглобина с первых 3-6 месяцев существенно не менялся между детьми, которых кормили молочной смесью, и детьми, которых кормили грудным молоком [17].
Существует несколько микроэлементов и метаболитов, таких как аскорбиновая кислота (витамин С), фолиевая кислота, лимонная кислота, пептиды, богатые аминокислотой цистеином, и витамин А, которые усиливают всасывание железа в кишечнике [76,77,78,79]. Некоторые из этих молекул могут действовать опосредованно, устраняя ингибирующее действие фитатов, обнаруженных в кофе и чае [80]. Полифенолы (антоцианидины, флавоны, флаваноны, изофлавоны и изофлаваноны) ингибируют всасывание негемового железа из пищи. Алкоголь одновременно ингибирует всасывание двухвалентного железа и увеличивает всасывание трехвалентного железа [18]. Также показано, что введение пробиотиков и пребиотиков может увеличить абсорбцию железа [6,60,81,82].
Железодефицитная анемия поражает людей всех возрастов во всем мире. В связи с серьезностью и широкой распространенностью этой проблемы государственные организации ввели строгие правила, обеспечивающие надлежащее потребление железа в питании. В последние десятилетия широко практикуется обогащение продуктов питания железом. Однако наибольшую озабоченность вызывает физиологическая доступность железа, поступающего с обогащенными продуктами. Продукты питания, выступающие в качестве носителей железа, должны быть подобраны с учетом их синергического влияния с комплексами железа для усвоения и повышения доступности. Однако при таком подходе необходимо решить ряд проблем, связанных с масштабным применением, экономической эффективностью, безопасностью и приемлемостью для потребителей [18].
Фортификация железа - это процесс, включающий добавление витаминов и минералов, которые являются важнейшими микронутриентами, используемыми для улучшения качества продуктов питания с точки зрения их питательной ценности. Для преодоления железодефицитной анемии больные должны потреблять продукты, богатые микронутриентами. Микроорганизмы создали систему сидерофоров (высокоаффинных железохелатных соединений, секретируемых микроорганизмами) - механизм получения железа из окружающей среды. Однако избыток железа влияет на патогенность микроорганизмов, поэтому для минимизации негативного эффекта обогащения железом необходимо создать более совершенный подход. Кроме того, железо усваивается в присутствии ферментируемых углеводов, которые стимулируют «рост бактерий, продуцирующих короткоцепочечные жирные кислоты, такие как пропионовая кислота», что увеличивает потребление минералов [83]. Дефицит микроэлементов наблюдается в основном у малообеспеченных слоев населения. Возможным решением этой проблемы может стать добавление микронутриентов для повышения пищевого статуса. Примером такого дополнения могут служить пищевые добавки с несколькими микроэлементами [52], включающие такие витамины, как B1, B2, B6, B12 и A, а также кальций, железо и лизин. «Сульфат железа является наиболее биодоступной формой железа» [59], и его взаимодействие с микроэлементами может привести к увеличению абсорбции (усвоению).
Основными продуктами питания, используемыми для обогащения железом, являются зерновые и молочные продукты, в меньшей степени - соль, сахар и приправы. Использование злаков, муки из них и продуктов их переработки в качестве носителей железа невыгодно из-за высокого содержания в них фитиновой кислоты, которая может снижать всасывание железа [1]. Неабсорбированное железо разрушает микробиоту кишечника и приводит к изменению соотношения защитных и патогенных бактерий. Поэтому рекомендуется лечить этот дефицит внутривенно [56].
Употребление обогащенных железом продуктов питания с использованием пробиотиков может способствовать снижению анемии. Этот метод имеет ряд преимуществ, поскольку он менее затратный, более доступный и позволяет сократить использование лекарственных препаратов. Развивая этот новый подход к снижению дефицита микроэлементов, можно добиться прецизионного питания [74]. Прецизионное питание позволяет группировать людей по содержанию железа в их организме, что дает возможность рекомендовать целевые диеты, богатые железом, что приводит к снижению частоты анемии среди населения [13].
Для специалистов в области пищевой промышленности наиболее важной и актуальной задачей является обеспечение растущего населения продуктами питания с учетом содержания макро- и микроэлементов. Поэтому необходимо разработать ряд процедур, направленных на повышение содержания железа и снижение ингибиторов в пищевых культурах. Кроме того, необходимо изучить влияние некоторых пищевых добавок, таких как пребиотики, пробиотики и хелаторы металлов [36].
5. Применение пробиотиков, пребиотиков и синбиотиков в лечении дефицита железа
5.1. Пробиотики и лечение дефицита железа
Учитывая, что опасность дефицита железа для населения всего мира имеет большое значение, крайне важно реализовать соответствующие стратегии борьбы с этой проблемой. Наиболее распространенными стратегиями являются программы питания, добавление железа в продукты питания, лекарственные добавки железа, а также пробиотические, пребиотические и синбиотические подходы [30,33,60,73].
В систематическом обзоре было показано, что применение Lactobacillus plantarum 299v способствует профилактике железодефицитной анемии. Было установлено, что этот пробиотик улучшает усвоение негемового железа из рациона у активных европеоидов [6]. Rosen et al. [81] также использовали L. plantarum 299v для лечения дефицита железа у педиатрических пациентов, однако благоприятных результатов в отношении усвоения железа получено не было. Детям назначался сульфат железа в низких дозах (1-3 мг/кг/сут) как с пробиотиком, так и без него. Исследователи не обнаружили существенной разницы в уровне ферритина в сыворотке крови у детей, принимавших пробиотик L. plantarum 299v, по сравнению с контрольной группой. Не было выявлено связи между уровнем ферритина и приемом пробиотика.
В другом исследовании, проведенном на крысах, изучалось действие перорального многовидового пробиотика (Bifidobacterium bifidum W23, B. lactis W51, B. lactis W52, Lactobacillus acidophilus W37, L. brevis W63, L. casei W56, L. salivarius W24, Lactococcus lactis W19 и Lc. lactis W58 в равных пропорциях), вводимого в низкой 2,5 × 109 и высокой 1 × 1010 дозах. Результат показал, что увеличение дозировки на один порядок влияет на общее количество пробиотиков в кале. Что касается железосвязывающей способности, то она была выше в группе с высокой дозой пробиотика. В группах с высокой и низкой дозой пробиотика наблюдался низкий уровень сывороточного железа, в то время как в группах с высокой дозой пробиотика отмечался высокий уровень железа в печени, поджелудочной железе и двенадцатиперстной кишке [82].
Воспаление организма изменяет доступность питательных веществ, в том числе железа, что является механизмом ограничения роста микроорганизмов. Одной из ведущих причин острого гастроэнтерита является Salmonella enterica serovar typhimurium (S. typhimurium). Недавние исследования показали, что S. typhimurium процветает в воспаленной кишке, охотясь за сидерофорами железа. При введении пробиотического штамма Escherichia coli штамма Nissle 1917, который использует аналогичные механизмы для усвоения железа, колонизация S. typhimurium в моделях на мышах была снижена. Пробиотическая активность E. coli Nissle зависит от усвоения железа, учитывая, что мутанты с недостаточным усвоением железа колонизируют кишечник, но не снижают количество S. typhimurium в фекалиях. Доступность железа влияет на колонизацию S. typhimurium, а E. coli Nissle снижает рост кишечника S. typhimurium, конкурируя за это ограничивающее питательное вещество [84].
В таблице 1 представлены наиболее релевантные исследования, связанные с абсорбцией железа при введении одного или нескольких пробиотических штаммов.
Таблица 1. Потребление пробиотиков при различных видах дефицита железа и их влияние на уровень железа в организме. ЖДА - железодефицитная анемия.
|
Тип дефицита железа
|
Пробиотический штамм
|
Тип введения
|
Результаты
|
Ref
|
|
Низкая абсорбция железа
|
Lactobacillus. plantarum (FS2)
|
Перорально; безалкогольные напитки на основе сорго
|
↑ биодоступность железа в ферментированных напитках составляет 128-372%
|
[85]
|
|
Анемия (ЖДА)
|
L. plantarum 299v
|
Перорально; семена жемчужного проса
|
↑ всасывание железа
|
[86]
|
|
Анемия (ЖДА)
|
Streptococcus thermophilus
|
Перорально; кисломолочный напиток
|
↑ всасывание и утилизация железа (улучшение уровня гемоглобина в крови, сывороточного железа, общей железосвязывающей способности, ферритина)
|
[87]
|
|
Анемия (ЖДА)
|
L. fermentum
|
Перорально; наночастицы
|
пробиотики проникают в энтероциты, доставляя наночастицы и обеспечивая адекватный уровень железа
|
[88]
|
|
Анемия (ЖДА)
|
L. fermentum
|
In vitro
|
↑ всасывание железа
|
[62]
|
|
При менструации
|
L. plantarum 299v
|
Перорально; капсулы, с приемом пищи с высокой биодоступностью железа
|
↑ всасывание железа при совместном приеме
|
[89]
|
|
Анемия (ЖДА)
|
L. plantarum 299v
|
Перорально; фруктовый напиток
|
↑всасывание железа
|
[7]
|
|
Анемия (ЖДА)
|
L. acidophilus
|
Перорально; ферментированный хлеб
|
↑ значительное образование ферритина в клетках кишечника (in vitro) и сыворотке крови животных (in vivo)
↑ всасывание железа |
[90]
|
|
Анемия (ЖДА)
|
L. plantarum 299v
|
Перорально; капсулы вместе с железом и витамином С
|
↑ уровень железа в крови
|
[91]
|
|
Низкая биодоступность железа
|
Bifidobacterium bifidum и B. longum
|
Перорально; порошкообразные смеси для детского питания
|
↑ очевидная абсорбция или удержание железа (p < 0,05)
|
[60]
|
|
Дефицит железа
|
L. plantarum 299v
|
Перорально; капсулы
|
Лечение хорошо переносилось, с умеренными побочными эффектами
Существенной разницы в повышении сывороточного ферритина у детей не было |
[81]
|
|
Здоровый
|
L. plantarum
|
Перорально; смесь сырых овощей
|
↑ биодоступность железа
|
[92]
|
|
Нарушения метаболизма железа, связанные с ожирением
|
Пробиотическая смесь (
B. bifidum W23,
B. lactis W51,
B. lactis W52,
L. acidophilus W37,
L. brevis W63,
L. casei W56,
L. salivarius W24,
Lactococcus lactis W19, и
Lc. lactis W58)
|
Перорально; порошок
|
Многовидовые добавки пробиотиков могут влиять на метаболизм железа у пациенток с ожирением в постменопаузе; необходимы дальнейшие исследования
|
[93]
|
|
Анемия (ЖДА)
|
Lactobacillus plantarum Dad 13
|
Перорально; ферментированное молоко
|
Нет различий в статусе железа, росте, весе и профиле кишечной микробиоты
|
[33]
|
На заметку от редактора: Некоторые исследования, что было уже отмечено, показали снижение численности полезных микробов одновременно с увеличением численности вредных микробов после перорального приема добавок железа (таблица 1S) (источник).
|
Бактерии
|
Добавки железа
|
|
Тип: Firmicutes
|
↓
|
|
Род: Enterococcus
|
↑
|
|
Род: Lactobacillus
|
↓
|
|
Род: Roseburia
|
↑
|
|
Род: Clostridium
|
↑
|
|
Тип: Протеобактерии
|
↑
|
|
Семейство: Enterobacteriaceae
|
↑
|
|
Виды: E. coli
|
↑
|
|
Род: Salmonella
|
↑
|
|
Род: Shigella
|
↑
|
|
Род: Citrobacter
|
↑
|
|
Отряд: Bacteroidales
|
↑
|
|
Род: Bacteroides
|
↑
|
|
Род: Campylobacter
|
↑
|
|
Род: Bifidobacterium
|
↓
|
|
Род: Prevotella
|
↓
|
|
Род: Rothia
|
↓
|
5.2. Пребиотики и синбиотики в лечении дефицита железа
Пребиотики — это функциональные пищевые компоненты, которые стимулируют рост и колонизацию полезных бактерий в кишечнике и в конечном итоге улучшают здоровье организма. Заметную роль в физиологии кишечника играет колонизация кишечной микробиотой. Чтобы эффективно снизить риск некоторых заболеваний (рак, липидемия и т. д.), мы можем использовать пребиотики, такие как галактоолигосахариды, фруктоолигосахариды, инулин и пектин. Эти компоненты помогают осуществлять правильную колонизацию кишечной микробиоты и поддерживать ее баланс [41]. Потребление пре- и пробиотиков называется симбиозом.
Пребиотические фруктаны (селективные источники углерода) укрепляют здоровье хозяев. Они влияют на параметры крови, такие как снижение уровня мочевины, мочевой кислоты, аммиака и азотистый баланс в крови. В нескольких проведенных исследованиях утверждается, что фруктаны, такие как инулин, благотворно влияют на функции толстой кишки организма, даже улучшая усвоение минералов. Существует два типа физиологических эффектов: прямое воздействие на толстую кишку и кишечную микробиоту и косвенное системное воздействие, влияющее на метаболизм и снижающее риск заболевания [94].
В нескольких исследованиях потребление пребиотиков и/или синбиотиков коррелировало с увеличением доступности железа, в основном за счет превращения Fe3+ в Fe2+ из-за их железоредуцирующей активности и стимулирования поглощения железа энтероцитами. Большинство этих исследований обобщены в таблице 2.
Таблица 2. Потребление пребиотиков и синбиотиков при различных видах дефицита железа и их влияние на уровень железа в организме.
|
Тип дефицита железа
|
Пребиотики / Синбиотики
|
Тип введения
|
Результаты
|
Ref
|
|
Анемия (ЖДА)
|
галактоолигосахариды и инулин
|
Перорально; пшеничная мука
|
Улучшение иммунной функции женщин с дефицитом железа
|
[95]
|
|
Здоровый
|
Инулин
|
Перорально; добавка
|
Улучшилось содержание железа и антропометрический статус
|
[96]
|
|
Дефицит железа и ЖДА
|
Фрукто- и галактоолигосахариды
|
Молочные продукты
|
Улучшенная биодоступность железа
|
[97]
|
|
Анемия (ЖДА)
|
Инулин
|
Биойогурт с инулином и солями железа
|
↓ биодоступность
кальция ↓ биодоступность железа |
[98]
|
|
Анемия (ЖДА)
|
Bifidobacterium lactis HN019 и олигосахариды
|
Перорально; молоко
|
↓ риск анемии и дефицита железа (помог набрать вес)
|
[99]
|
|
Анемия при целиакии
|
Инулин, обогащенный олигофруктозой
|
Перорально; добавка
|
Снижение концентрации гепсидина в сыворотке крови. - ↑ всасывание железа
|
[100]
|
|
Vitro
|
Lactobacillus plantarum CIDCA * 83114 и пектин
|
Капсулы
|
↑ всасывание железа
|
[101]
|
|
Истощенный железом
|
галактоолигосахариды
|
Перорально
|
↑ всасывание железа
|
[102]
|
|
Анемия (ЖДА)
|
галактоолигосахариды
|
Инъекции
|
↑ всасывание железа
|
[103]
|
|
Анемия (ЖДА)
|
Инулин и олигофруктоза
|
Перорально; пищевые волокна
|
↑ экспрессия белка-переносчика двухвалентных металлов в слепой кишке и олигофруктоза снижали экспрессию белка ферропортина в двенадцатиперстной кишке.
Помогает регулировать всасывание железа в кишечнике |
[8]
|
|
Анемия (ЖДА)
|
галактоолигосахариды
|
Перорально; кукурузная каша, обогащенная порошкообразным микроэлементом (фумарат железа + натрий железа + галактоолигосахарид).
|
↑ фракционное усвоение железа (62%)
Улучшена относительная биодоступность железа
|
[104]
|
|
Здоровые (кенийские матери)
|
галактоолигосахариды
|
Перорально; порошок микроэлементов (фумарат железа + натрий железа ЭДТА ** + галактоолигосахариды)
|
Модулирует реакцию кишечной микробиоты младенцев на прием фортификантов железа
|
[105]
|
|
Анемия (ЖДА)
|
B. bifidum, B. Longum галактоолигосахариды
|
Перорально; порошковая детская смесь для последующего прикорма
|
↑ очевидное всасывание или удержание железа
|
[60]
|
|
Низкий уровень железа
|
Инулин
|
Перорально; вареный рис и протертый овощной соус
|
↑ всасывание железа
|
[106]
|
|
Анемия (ЖДА)
|
инулин, полидекстроза,
аравийская камедь и гуаровая камедь |
Перорально в йогурте, 2 г в день
|
↑ Биодоступность гемового железа
не влияет на биодоступность негемового железа
|
[107]
|
*CIDCA - Центр исследований и разработок в области криотехнологий пищевых продуктов (Аргентина)
**ЭДТА - этилендиаминтетрауксусная кислота.
В одном исследовании пектин был собран с наночастицами железа в качестве матрицы для доставки L. plantarum CIDCA 83114. Ученые исследовали биофизическую стабильность наночастиц железо-пектин и проанализировали их действие. Результаты показали, что железо не токсично для пробиотических клеток и не влияет на жизнеспособность бактерий, что означает, что оно эффективно как для доставки железа, так и для стабилизации бактерий. Это также можно использовать в качестве альтернативного решения для преодоления дефицита железа [101]. Эксперимент на крысах Sprague-Dawley показал, что прием неочищенных пребиотических галактоолигосахаридов в течение 3–4 недель может усиливать всасывание Ca, Mg и Fe [108].
Другое исследование было направлено на синтез производных органических соединений из полисахаридов, готовых связывать железо, чтобы помочь в лечении дефицита железа. Был получен комплекс инулин-янтарный ангидрид-цистеин-хлорид железа, обладающий хорошей биоразлагаемостью в присутствии инулиназы и высокими слизисто-адгезивными свойствами. Полученные результаты свидетельствуют о возможности использования таких комплексов для перорального лечения железодефицитной анемии или в качестве добавки к обогащенным железом продуктам питания [109].
Исследование показало, что лечение синбиотиками может улучшить усвоение железа организмом. Исследование проводилось на детях младшего школьного возраста (9-12 лет) в течение 3 месяцев. Они были разделены на две группы: те, кто употреблял добавку железа в виде сиропа (давали два раза в неделю), и те, кто употреблял синбиотическую смесь — Lactobacillus plantarum Dad 13 и фруктоолигосахарид в ферментированном молоке (шесть раз в неделю). В результате у детей не было существенных различий, поскольку они происходили из богатых семей и не страдали от нехватки продовольствия. Однако большее присутствие кишечной палочки наблюдались у тех, кто пил только сироп с добавкой железа, а большое количество бифидобактерий было обнаружено в кале тех, кто употреблял синбиотическую смесь с кисломолочным продуктом [33].
В другой статье рассматривалось влияние инулина in vitro на доступность железа в двух йогуртах с пробиотиками (йогуртах на основе молока и сои). Оценку проводили до и после инкубации йогуртов, отслеживая содержание диализируемой фракции железа, образование клеточного ферритина и связанного с клетками железа. Клеточная линия Caco-2 представляет собой линию клеток аденокарциномы человека, которая является полезной моделью для изучения поглощения железа, используемой в упомянутом исследовании. После инкубации обоих йогуртов с инулином и без него образование ферритина было выше. Это демонстрирует, что инулин сам по себе напрямую не влияет на усвоение железа, но оказывает положительное влияние при использовании клетками-пробиотиками [110].
Наночастицы, например наночастицы оксида железа, являются еще одной альтернативой пищевым добавкам. Они одновременно сохраняют органолептические свойства в продуктах питания. Инновационная рецептура состоит из наночастиц оксида железа, пектина и молочнокислых бактерий. Эти три компонента в комплексе могут обеспечить наилучшую форму защиты микроорганизмов и введения, а также гарантировать безопасное поступление растворимого железа в кишечник [101].
В другом исследовании изучалось влияние приема синбиотиков на пациентов с диабетом 2-го типа, поскольку многие метаболические осложнения связаны с изменениями минеральных веществ в сыворотке крови. Прием синбиотиков может оказывать положительное влияние на пациентов, не страдающих диабетом, и на пациентов с диабетом 2-го типа, демонстрируя значительные изменения в отношении усвоения железа в сыворотке крови [111]. Однако для подтверждения положительного эффекта пробиотиков, пребиотиков и синбиотиков в лечении железодефицита необходимы обширные исследования. Необходимо уточнить конкретные рекомендации по штаммам, дозировкам, составу синбиотических препаратов железа и метаболическим последствиям.
6. Выводы
Метаболизм железа включает в себя множество процессов, и, даже исключая генетические дефекты, существует несколько причин, вызывающих дефицит железа у человека. Поэтому существует множество подходов к повышению усвоения железа. Для достижения необходимой концентрации железа можно использовать пробиотики, пребиотики и синбиотики. В настоящее время исследования выявили множество механизмов, с помощью которых эти препараты могут помочь в регулировании дефицита железа. Важным в этом подходе является понимание способности пробиотиков выступать в качестве носителей железа, преобразовывать недоступное железо в его доступную форму или создавать метаболиты, косвенно повышающие абсорбцию железа в кишечнике. Такие препараты должны стать предметом дальнейших исследований, поскольку существующие работы, несмотря на их недостаточное количество, уже дают многообещающие результаты. Модуляция микробиоты кишечника путем приема про- и пребиотиков может влиять на абсорбцию железа, но при этом большое значение имеет тип принимаемого железа. Цитотоксичность неабсорбированного железа на клетки кишечника (энтероциты) требует всестороннего изучения, а адаптированные продукты питания могут стать отличным подходом в лечении дефицита железа.
Доп. информация:

К разделу о Гемопропиовите→
См. также:
- Железодефицит (общая информация)
- Добавки железа на стыке питания и микробиоты кишечника
- Кишечная микробиота и дефицит железа
- Железо и кишечный иммунитет
- Резолюция совета экспертов по железодефицитной анемии у женщин // Акушерство и гинекология: новости, мнения, обучение. 2020.Т.8,№4.С.28–36
- Распространенность железодефицитных состояний / Мед. совет, 2016
- Анемии: Метод. пособие для врачей / Екатеринбург., 2006.-91 с.
- Boccio, J.R.; Iyengar, V. Iron deficiency: Causes, consequences, and strategies to overcome this nutritional problem. Biol. Trace Elem. Res. 2003, 94, 1–32. [Google Scholar] [CrossRef]
- Goddard, A.F.; James, M.W.; McIntyre, A.S.; Scott, B.B. Guidelines for the management of iron deficiency anaemia. Gut 2011, 60, 1309–1316. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Miller, J.L. Iron deficiency anemia: A common and curable disease. Cold Spring Harb. Perspect Med. 2013, 3, a011866. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Chiplonkar, S.A.; Agte, V.V. Statistical model for predicting non-heme iron bioavailability from vegetarian meals. Int. J. Food Sci. Nutr. 2006, 57, 434–450. [Google Scholar] [CrossRef] [PubMed]
- Reddy, M.B. Algorithms to assess non-heme iron bioavailability. Int. J. Vitam. Nutr. Res. 2005, 75, 405–412. [Google Scholar] [CrossRef]
- Vonderheid, S.C.; Tussing-Humphreys, L.; Park, C.; Pauls, H.; Hemphill, N.O.; LaBomascus, B.; McLeod, A.; Koenig, M.D. A Systematic Review and Meta-Analysis on the Effects of Probiotic Species on Iron Absorption and Iron Status. Nutrients 2019, 11, 2938. [Google Scholar] [CrossRef][Green Version]
- Hoppe, M.; Önning, G.; Berggren, A.; Hulthén, L. Probiotic strain Lactobacillus plantarum 299v increases iron absorption from an iron-supplemented fruit drink: A double-isotope cross-over single-blind study in women of reproductive age. Brit. J. Nutr. 2015, 114, 1195–1202. [Google Scholar] [CrossRef][Green Version]
- Marciano, R.; Santamarina, A.B.; de Santana, A.A.; Silva, M.D.L.C.; Amancio, O.M.S.; do Nascimento, C.M.D.P.O.; Oyama, L.M.; de Morais, M.B. Effects of prebiotic supplementation on the expression of proteins regulating iron absorption in anaemic growing rats. Brit. J. Nutr. 2015, 113, 901–908. [Google Scholar] [CrossRef]
- Gupta, A. Iron Metabolism in Human Body. In Nutritional Anemia in Preschool Children; Springer: Singapore, 2017. [Google Scholar]
- Camaschella, C. Iron-deficiency anemia. N. Engl. J. Med. 2015, 372, 1832–1843. [Google Scholar] [CrossRef][Green Version]
- Wilson, A.S.; Koller, K.R.; Ramaboli, M.C.; Nesengani, L.T.; Ocvirk, S.; Chen, C.X.; Flanagan, C.A.; Sapp, F.R.; Merritt, Z.T.; Bhatti, F.; et al. Diet and the Human Gut Microbiome: An International Review. Dig. Dis. Sci. 2020, 65, 723–740. [Google Scholar] [CrossRef][Green Version]
- Andrews, S.C.; Robinson, A.K.; Rodríguez-Quiñones, F. Bacterial iron homeostasis. FEMS Microbiol. Rev. 2003, 27, 215–237. [Google Scholar] [CrossRef]
- Braun, V.; Hantke, K. Recent insights into iron import by bacteria. Curr. Opin. Chem. Biol. 2011, 15, 328–334. [Google Scholar] [CrossRef]
- Xi, R.; Wang, R.; Wang, Y.; Xiang, Z.; Su, Z.; Cao, Z.; Xu, X.; Zheng, X.; Li, J. Comparative analysis of the oral microbiota between iron-deficiency anaemia (IDA) patients and healthy individuals by high-throughput sequencing. BMC Oral Health 2019, 19, 255. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Beasley, F.C.; Marolda, C.L.; Cheung, J.; Buac, S.; Heinrichs, D.E. Staphylococcus aureus transporters Hts, Sir, and Sst capture iron liberated from human transferrin by Staphyloferrin A, Staphyloferrin B, and catecholamine stress hormones, respectively, and contribute to virulence. Infect. Immun. 2011, 79, 2345. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Cherayil, B.J.; Ellenbogen, S.; Shanmugam, N.N. Iron and intestinal immunity. Curr. Opin. Gastroenterol. 2011, 27, 523–528. [Google Scholar] [CrossRef] [PubMed]
- van de Lagemaat, M.; Amesz, E.M.; Schaafsma, A.; Lafeber, H.N. Iron deficiency and anemia in iron-fortified formula and human milk-fed preterm infants until 6 months post-term. Eur. J. Nutr. 2014, 53, 1263–1271. [Google Scholar] [CrossRef]
- Shubham, K.; Anukiruthika, T.; Dutta, S.; Kashyap, A.V.; Moses, J.A.; Anandharamakrishnan, C. Iron deficiency anemia: A comprehensive review on iron absorption, bioavailability and emerging food fortification approaches. Trends Food Sci. Technol. 2020, 99, 58–75. [Google Scholar] [CrossRef]
- Bierings, M.; Clayton, P.T.; Houwen, R.H. Disorders in the transport of copper, iron, magnesium, manganese, selenium and zinc. In Inborn Metabolic Diseases; Springer: Berlin, Germany, 2012; pp. 535–551. [Google Scholar]
- Jansen, V. Diagnosis of anemia—A synoptic overview and practical approach. Transfus. Apher. Sci. 2019, 58, 375–385. [Google Scholar] [CrossRef]
- Kowdley, K.V.; Brown, K.E.; Ahn, J.; Sundaram, V. ACG Clinical Guideline: Hereditary Hemochromatosis. Am. J. Gastroenterol. 2019, 114, 1202–1218. [Google Scholar] [CrossRef]
- Arredondo, M.; Núñez, M.T. Iron and copper metabolism. Mol. Asp. Med. 2005, 26, 313–327. [Google Scholar] [CrossRef]
- Fan, Y.; Dhaliwal, H.K.; Menon, A.V.; Chang, J.; Choi, J.E.; Amiji, M.M.; Kim, J. Site-specific intestinal DMT1 silencing to mitigate iron absorption using pH-sensitive multi-compartmental nanoparticulate oral delivery system. Nanomed. Nanotechnol. Biol. Med. 2019, 22, 102091. [Google Scholar] [CrossRef] [PubMed]
- Hentze, M.W.; Muckenthaler, M.U.; Galy, B.; Camaschella, C. Two to Tango: Regulation of Mammalian Iron Metabolism. Cell 2010, 142, 24–38. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Pandey, S.S.; Patnana, P.K.; Lomada, S.K.; Tomar, A.; Chatterjee, S. Co-regulation of Iron Metabolism and Virulence Associated Functions by Iron and XibR, a Novel Iron Binding Transcription Factor, in the Plant Pathogen Xanthomonas. PLoS Pathog. 2016, 12, e1006019. [Google Scholar] [CrossRef] [PubMed]
- Shen, J.; Sheng, X.; Chang, Z.; Wu, Q.; Wang, S.; Xuan, Z.; Li, D.; Wu, Y.; Shang, Y.; Kong, X.; et al. Iron Metabolism Regulates p53 Signaling through Direct Heme-p53 Interaction and Modulation of p53 Localization, Stability, and Function. Cell Rep. 2014, 7, 180–193. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Wang, Y.; Yu, L.; Ding, J.; Chen, Y. Iron Metabolism in Cancer. Int. J. Mol. Sci. 2019, 20, 95. [Google Scholar] [CrossRef][Green Version]
- Yaskolka Meir, A.; Tsaban, G.; Zelicha, H.; Rinott, E.; Kaplan, A.; Youngster, I.; Rudich, A.; Shelef, I.; Tirosh, A.; Brikner, D. A green-Mediterranean diet, supplemented with Mankai duckweed, preserves iron-homeostasis in humans and is efficient in reversal of anemia in rats. J. Nutr. 2019, 149, 1004–1011. [Google Scholar] [CrossRef] [PubMed]
- Das, N.K.; Schwartz, A.J.; Barthel, G.; Inohara, N.; Liu, Q.; Sankar, A.; Hill, D.R.; Ma, X.; Lamberg, O.; Schnizlein, M.K.; et al. Microbial Metabolite Signaling Is Required for Systemic Iron Homeostasis. Cell Metab. 2020, 31, 115–130.e6. [Google Scholar] [CrossRef]
- Jia, H.X.; Han, J.H.; Li, H.Z.; Liang, D.; Deng, T.T.; Chang, S.Y. Mineral Intake in Urban Pregnant Women from Base Diet, Fortified Foods, and Food Supplements: Focus on Calcium, Iron, and Zinc. Biomed. Environ. Sci. 2016, 29, 898–901. [Google Scholar]
- World Health Organization. Haemoglobin Concentrations for the Diagnosis of Anaemia and Assessment of Severity; World Health Organization: Geneva, Switzerland, 2015. [Google Scholar]
- Theml, H.; Diem, H.; Haferlach, T. Color Atlas of Hematology; Thieme: New York, NY, USA, 2004. [Google Scholar]
- Helmyati, S.; Rahayu, E.S.; Kandarina, B.J.I.; Juffrie, M. No Difference between Iron Supplementation Only and Iron Supplementation with Synbiotic Fermented Milk on Iron Status, Growth, and Gut Microbiota Profile in Elementary School Children with Iron Deficiency. Curr. Nutr. Food Sci. 2020, 16, 220–227. [Google Scholar] [CrossRef]
- Jaeggi, T.; Kortman, G.A.M.; Moretti, D.; Chassard, C.; Holding, P.; Dostal, A.; Boekhorst, J.; Timmerman, H.M.; Swinkels, D.W.; Tjalsma, H.; et al. Iron fortification adversely affects the gut microbiome, increases pathogen abundance and induces intestinal inflammation in Kenyan infants. Gut 2015, 64, 731. [Google Scholar] [CrossRef]
- Da Silva, W.R.; Silveira, L.; Fernandes, A.B. Diagnosing sickle cell disease and iron deficiency anemia in human blood by Raman spectroscopy. Lasers Med. Sci. 2019, 35, 1065–1074. [Google Scholar] [CrossRef] [PubMed]
- Saini, R.K.; Nile, S.H.; Keum, Y.-S. Food science and technology for management of iron deficiency in humans: A review. Trends Food Sci. Technol. 2016, 53, 13–22. [Google Scholar] [CrossRef]
- Cammarota, G.; Ianiro, G.; Bibbò, S.; Gasbarrini, A. Gut microbiota modulation: Probiotics, antibiotics or fecal microbiota transplantation? Intern. Emerg. Med. 2014, 9, 365–373. [Google Scholar] [CrossRef]
- Gabbianelli, R.; Damiani, E. Epigenetics and neurodegeneration: Role of early-life nutrition. J. Nutr. Biochem. 2018, 57, 1–13. [Google Scholar] [CrossRef]
- Kim, Y.S.; Unno, T.; Kim, B.-Y.; Park, M.-S. Sex Differences in Gut Microbiota. World J. Mens Health 2020, 38, 48–60. [Google Scholar] [CrossRef] [PubMed]
- Ursell, L.K.; Metcalf, J.L.; Parfrey, L.W.; Knight, R. Defining the human microbiome. Nutr. Rev. 2012, 70, S38–S44. [Google Scholar] [CrossRef][Green Version]
- Tungland, B. Chapter 9—Dysbiosis of the Microbiota: Therapeutic Strategies Utilizing Dietary Modification, Pro- and Prebiotics and Fecal Transplant Therapies in Promoting Normal Balance and Local GI Functions. In Human Microbiota in Health and Disease; Tungland, B., Ed.; Academic Press: Cambridge, MA, USA, 2018; pp. 381–419. [Google Scholar]
- Kim, S.R.; Kim, K.; Lee, S.A.; Kwon, S.O.; Lee, J.-K.; Keum, N.; Park, S.M. Effect of Red, Processed, and White Meat Consumption on the Risk of Gastric Cancer: An Overall and Dose–Response Meta-Analysis. Nutrients 2019, 11, 826. [Google Scholar] [CrossRef][Green Version]
- Boran, P.; Baris, H.E.; Kepenekli, E.; Erzik, C.; Soysal, A.; Dinh, D.M. The impact of vitamin B12 deficiency on infant gut microbiota. Eur. J. Pediatr. 2020, 179, 385–393. [Google Scholar] [CrossRef]
- Deschemin, J.C.; Noordine, M.L.; Remot, A.; Willemetz, A.; Afif, C.; Canonne-Hergaux, F.; Langella, P.; Karim, Z.; Vaulont, S.; Thomas, M.; et al. The microbiota shifts the iron sensing of intestinal cells. FASEB J. 2016, 30, 252–261. [Google Scholar] [CrossRef]
- Forth, W.; Rummel, W. Iron absorption. Physiol. Rev. 1973, 53, 724–792. [Google Scholar] [CrossRef]
- Wollenberg, P.; Rummel, W. Dependence of intestinal iron absorption on the valency state of iron. N-S Arch. Pharmacol. 1987, 336, 578–582. [Google Scholar] [CrossRef] [PubMed]
- Dietzfelbinger, H. Bioavailability of bi-and trivalent oral iron preparations. Investigations of iron absorption by postabsorption serum iron concentrations curves. Arzneimittel-Forschung 1987, 37, 107–112. [Google Scholar]
- Bezkorovainy, A. Biochemistry of nonheme iron in man. I. Iron proteins and cellular iron metabolism. Clin. Physiol. Biochem. 1989, 7, 1–17. [Google Scholar] [PubMed]
- Cremonesi, P.; Acebron, A.; Raja, K.B.; Simpson, R.J. Iron absorption: Biochemical and molecular insights into the importance of iron species for intestinal uptake. Pharmacol. Toxicol. 2002, 91, 97–102. [Google Scholar] [CrossRef] [PubMed]
- Simonyté Sjödin, K.; Domellöf, M.; Lagerqvist, C.; Hernell, O.; Lönnerdal, B.; Szymlek-Gay, E.A.; Sjödin, A.; West, C.E.; Lind, T. Administration of ferrous sulfate drops has significant effects on the gut microbiota of iron-sufficient infants: A randomised controlled study. Gut 2019, 68, 2095–2097. [Google Scholar] [CrossRef][Green Version]
- Balamurugan, R.; Mary, R.R.; Chittaranjan, S.; Jancy, H.; Shobana Devi, R.; Ramakrishna, B.S. Low levels of faecal lactobacilli in women with iron-deficiency anaemia in south India. Brit. J. Nutr. 2010, 104, 931–934. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Jahani-Sherafat, S.; Alebouyeh, M.; Moghim, S.; Ahmadi Amoli, H.; Ghasemian-Safaei, H. Role of gut microbiota in the pathogenesis of colorectal cancer; a review article. Gastroenterol. Hepatol. Bed. Bench. 2018, 11, 101–109. [Google Scholar]
- Louis, P.; Hold, G.L.; Flint, H.J. The gut microbiota, bacterial metabolites and colorectal cancer. Nat. Rev. Microbiol. 2014, 12, 661–672. [Google Scholar] [CrossRef]
- Gagniere, J.; Raisch, J.; Veziant, J.; Barnich, N.; Bonnet, R.; Buc, E.; Bringer, M.A.; Pezet, D.; Bonnet, M. Gut microbiota imbalance and colorectal cancer. World J. Gastroenterol. 2016, 22, 501–518. [Google Scholar] [CrossRef]
- Gao, Z.; Guo, B.; Gao, R.; Zhu, Q.; Qin, H. Microbiota disbiosis is associated with colorectal cancer. Front. Microbiol. 2015, 6, 20. [Google Scholar] [CrossRef] [PubMed]
- Ng, O. Iron, microbiota and colorectal cancer. Wien. Med. Wochenschr. 2016, 166, 431–436. [Google Scholar] [CrossRef] [PubMed]
- Dostal, A.; Baumgartner, J.; Riesen, N.; Chassard, C.; Smuts, C.M.; Zimmermann, M.B.; Lacroix, C. Effects of iron supplementation on dominant bacterial groups in the gut, faecal SCFA and gut inflammation: A randomised, placebo-controlled intervention trial in South African children. Brit. J. Nutr. 2014, 112, 547–556. [Google Scholar] [CrossRef] [PubMed]
- Dostal, A.; Chassard, C.; Hilty, F.M.; Zimmermann, M.B.; Jaeggi, T.; Rossi, S.; Lacroix, C. Iron depletion and repletion with ferrous sulfate or electrolytic iron modifies the composition and metabolic activity of the gut microbiota in rats. J. Nutr. 2012, 142, 271–277. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Buhnik-Rosenblau, K.; Moshe-Belizowski, S.; Danin-Poleg, Y.; Meyron-Holtz, E.G. Genetic modification of iron metabolism in mice affects the gut microbiota. BioMetals 2012, 25, 883–892. [Google Scholar] [CrossRef]
- Perez-Conesa, D.; Lopez, G.; Ros, G. Effect of probiotic, prebiotic and synbiotic follow-up infant formulas on iron bioavailability in rats. Food Sci. Technol. Int. 2007, 13, 69–77. [Google Scholar] [CrossRef]
- Collins, J.F.; Flores, S.R.; Wang, X.; Anderson, G.J. Mechanisms and Regulation of Intestinal Iron Transport. In Physiology of the Gastrointestinal Tract; Elsevier: Amsterdam, The Netherlands, 2018; pp. 1451–1483. [Google Scholar]
- González, A.; Gálvez, N.; Martín, J.; Reyes, F.; Pérez-Victoria, I.; Dominguez-Vera, J.M. Identification of the key excreted molecule by Lactobacillus fermentum related to host iron absorption. Food Chem. 2017, 228, 374–380. [Google Scholar] [CrossRef][Green Version]
- Gan, E.K.; Powell, L.W.; Olynyk, J.K. Natural History and Management of HFE-Hemochromatosis. Semin. Liver Dis. 2011, 31, 293–301. [Google Scholar] [CrossRef]
- Oh, C.-K.; Moon, Y. Dietary and Sentinel Factors Leading to Hemochromatosis. Nutrients 2019, 11, 1047. [Google Scholar] [CrossRef][Green Version]
- Camaschella, C.; Poggiali, E. Inherited disorders of iron metabolism. Curr. Opin. Pediatrics 2011, 23, 14–20. [Google Scholar] [CrossRef]
- Pantopoulos, K. Inherited Disorders of Iron Overload. Front. Nutr. 2018, 5, 5. [Google Scholar] [CrossRef][Green Version]
- Gulec, S.; Anderson, G.J.; Collins, J.F. Mechanistic and regulatory aspects of intestinal iron absorption. Am. J. Physiol. Gastrointest. Liver Physiol. 2014, 307, G397–G409. [Google Scholar] [CrossRef][Green Version]
- Aslam, M.F.; Frazer, D.M.; Faria, N.; Bruggraber, S.F.A.; Wilkins, S.J.; Mirciov, C.; Powell, J.J.; Anderson, G.J.; Pereira, D.I.A. Ferroportin mediates the intestinal absorption of iron from a nanoparticulate ferritin core mimetic in mice. FASEB J. 2014, 28, 3671–3678. [Google Scholar] [CrossRef] [PubMed]
- Carvalho, L.; Brait, D.; Vaz, M.; Lollo, P.; Morato, P.; Oesterreich, S.; Raposo, J.; Freitas, K. Partially Hydrolyzed Guar Gum Increases Ferroportin Expression in the Colon of Anemic Growing Rats. Nutrients 2017, 9, 228. [Google Scholar] [CrossRef][Green Version]
- Liu, B.D.; Pan, X.H.; Liu, Z.H.; Han, M.L.; Xu, G.H.; Dai, X.S.; Wang, W.; Zhang, H.B.; Xie, L.W. Fecal microbiota as a noninvasive biomarker to predict the tissue iron accumulation in intestine epithelial cells and liver. FASEB J. 2020, 34, 3006–3020. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Kalipatnapu, S.; Kuppuswamy, S.; Venugopal, G.; Kaliaperumal, V.; Ramadass, B. Fecal total iron concentration is inversely associated with fecal Lactobacillus in preschool children. J. Gastroenterol. Hepatol. 2017, 32, 1475–1479. [Google Scholar] [CrossRef]
- Buret, A.G.; Motta, J.-P.; Allain, T.; Ferraz, J.; Wallace, J.L. Pathobiont release from dysbiotic gut microbiota biofilms in intestinal inflammatory diseases: A role for iron? J. Biomed. Sci. 2019, 26, 1. [Google Scholar] [CrossRef] [PubMed]
- Martınez-Navarrete, N.; Camacho, M.M.; Martınez-Lahuerta, J.; Martınez-Monzó, J.; Fito, P. Iron deficiency and iron fortified foods—A review. Food Res. Int. 2002, 35, 225–231. [Google Scholar] [CrossRef]
- Brazaca, S.G.C.; da Silva, F.C. Enhancers and inhibitors of iron availability in legumes. Plant Foods Hum. Nutr. 2003, 58, 1–8. [Google Scholar] [CrossRef]
- Record, I.R.; McInerney, J.K.; Dreosti, I.E. Black tea, green tea, and tea polyphenols. Biol. Trace Elem. Res. 1996, 53, 27–43. [Google Scholar] [CrossRef]
- Milne, D.B.; Canfield, W.K.; Mahalko, J.R.; Sandstead, H.H. Effect of oral folic acid supplements on zinc, copper, and iron absorption and excretion. Am. J. Clin. Nutr. 1984, 39, 535–539. [Google Scholar] [CrossRef]
- Shu, E.; Ogbodo, S. Role of Ascorbic Acid in the Prevention of Iron-Deficiency Anaemia in Pregnancy. Biomed. Res. 2005, 16, 40–44. [Google Scholar]
- Martínez-Torres, C.; Romano, E.; Layrisse, M. Effect of cysteine on iron absorption in man. Am. J. Clin. Nutr. 1981, 34, 322–327. [Google Scholar] [CrossRef][Green Version]
- García-Casal, M.N.; Layrisse, M.; Solano, L.; Barón, M.A.; Arguello, F.; Llovera, D.; Ramírez, J.; Leets, I.; Tropper, E. Vitamin A and β-Carotene Can Improve Nonheme Iron Absorption from Rice, Wheat and Corn by Humans. J. Nutr. 1998, 128, 646–650. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Amos, A.; Alvan, A.; Florence, A. The Anti-nutritional Effect of Phytate on Zinc, Iron and Calcium Bioavailabilities of Some Cereals Staple Foods in Zaria, Nigeria. Eur. J. Nutr. Food Saf. 2020, 1–6. [Google Scholar] [CrossRef][Green Version]
- Rosen, G.M.; Morrissette, S.; Larson, A.; Stading, P.; Griffin, K.H.; Barnes, T.L. Use of a Probiotic to Enhance Iron Absorption in a Randomized Trial of Pediatric Patients Presenting with Iron Deficiency. J. Pediatr. 2019, 207, 192–197.e1. [Google Scholar] [CrossRef] [PubMed]
- Skrypnik, K.; Bogdanski, P.; Schmidt, M.; Suliburska, J. The Effect of Multispecies Probiotic Supplementation on Iron Status in Rats. Biol. Trace Elem. Res. 2019, 192, 234–243. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Helmyati, S.; Sudargo, T.; Kandarina, I.; Yuliati, E.; Wisnusanti, S.U.; Puspitaningrum, V.A.D.; Juffrie, M. Tempeh extract fortified with iron and synbiotic as a strategy against anemia. Int. Food Res. J. 2016, 23, 2296–2299. [Google Scholar]
- Deriu, E.; Liu, J.Z.; Pezeshki, M.; Edwards, R.A.; Ochoa, R.J.; Contreras, H.; Libby, S.J.; Fang, F.C.; Raffatellu, M. Probiotic bacteria reduce salmonella typhimurium intestinal colonization by competing for iron. Cell Host Microbe 2013, 14, 26–37. [Google Scholar] [CrossRef][Green Version]
- Adeyanju, A.A.; Kruger, J.; Taylor, J.R.; Duodu, K.G. Effects of different souring methods on the protein quality and iron and zinc bioaccessibilities of non-alcoholic beverages from sorghum and amaranth. Int. J. Food Sci. Technol. 2019, 54, 798–809. [Google Scholar] [CrossRef]
- Adiki, S.K.; Perla, C.K.; Saha, G.; Katakam, P.; Theendra, V. Enhancement in Iron Absorption on Intake of Chemometrically Optimized Ratio of Probiotic Strain Lactobacillus plantarum 299v with Iron Supplement Pearl Millet. Biol. Trace Elem. Res. 2019, 190, 150–156. [Google Scholar] [CrossRef]
- El-Azeem, A.S.A.; Hegazy, A.M.; Badawy, I.; Ibrahim, G.A.; El-Shafei, K.; El-Sayed, H.S.; Sharaf, O.M. Effectiveness of Functional Wheat-Fermented Milk Beverage against Tannic Acid Induced Anemia. Res. J. Pharm. Biol. Chem. Sci. 2016, 7, 2622. [Google Scholar]
- Garcés, V.; Rodríguez-Nogales, A.; González, A.; Gálvez, N.; Rodríguez-Cabezas, M.E.; García-Martin, M.L.; Gutiérrez, L.; Rondón, D.; Olivares, M.; Gálvez, J. Bacteria-carried iron oxide nanoparticles for treatment of anemia. Bioconj. Chem. 2018, 29, 1785–1791. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Hoppe, M.; Önning, G.; Hulthén, L. Freeze-dried Lactobacillus plantarum 299v increases iron absorption in young females—Double isotope sequential single-blind studies in menstruating women. PLoS ONE 2017, 12, e0189141. [Google Scholar] [CrossRef] [PubMed]
- Khodaii, Z.; Zadeh, M.N.; Kamali, J.; Natanzi, M.M. Enhanced iron absorption from lactic acid fermented bread (an in vivo/ex vivo study). Gene Rep. 2019, 15, 100389. [Google Scholar] [CrossRef]
- Korčok, D.J.; Tršić-Milanoviće, N.; Ivanović, N.; Đorđević, B. Development of Probiotic Formulation for the Treatment of Iron Deficiency Anemia. Chem. Pharm. Bull. 2018, 66, 347–352. [Google Scholar] [CrossRef][Green Version]
- Scheers, N.; Rossander-Hulthen, L.; Torsdottir, I.; Sandberg, A.-S. Increased iron bioavailability from lactic-fermented vegetables is likely an effect of promoting the formation of ferric iron (Fe 3+). Eur. J. Nutr. 2016, 55, 373–382. [Google Scholar] [CrossRef][Green Version]
- Skrypnik, K.; Bogdański, P.; Sobieska, M.; Suliburska, J. The effect of multistrain probiotic supplementation in two doses on iron metabolism in obese postmenopausal women: A randomized trial. Food Funct. 2019, 10, 5228–5238. [Google Scholar] [CrossRef]
- Tungland, B. Chapter 5—Direct Physiological Effects on Local Gi and Indirect Systemic Effects of Prebiotic Fructan Treatment, and its Role in Disease Prevention and Therapy. In Human Microbiota in Health and Disease; Tungland, B., Ed.; Academic Press: Cambridge, MA, USA, 2018; pp. 155–196. [Google Scholar]
- Rizwan Ahmad, A.M.; Ahmed, W.; Iqbal, S.; Mushtaq, M.H.; Anis, R.A. Iron and prebiotic fortified flour improves the immune function of iron deficient women of childbearing age. Pak. J. Pharm. Sci. 2020, 33, 253–261. [Google Scholar]
- Castro, L.C.V.; Costa, N.M.B.; Sant’Anna, H.M.P.; Ferreira, C.L.d.L.F.; Franceschini, S.d.C.d.C. Improvement the nutritional status of pre-school children following intervention with a supplement containing iron, zinc, copper, vitamin A, vitamin C and prebiotic. Ciên. Saú. Colet. 2017, 22, 359–368. [Google Scholar] [CrossRef]
- Christides, T.; Ganis, J.C.; Sharp, P.A. In vitro assessment of iron availability from commercial Young Child Formulae supplemented with prebiotics. Eur. J. Nutr. 2018, 57, 669–678. [Google Scholar] [CrossRef][Green Version]
- Dabour, N.; Dyab, N.; Kheadr, E. Iron fortification of reduced-fat bioyoghurt containing either short-or long-chain inulin. Int. J. Dairy Technol. 2019, 72, 229–239. [Google Scholar] [CrossRef]
- Sazawal, S.; Dhingra, U.; Hiremath, G.; Sarkar, A.; Dhingra, P.; Dutta, A.; Menon, V.P.; Black, R.E. Effects of Bifidobacterium lactis HN019 and prebiotic oligosaccharide added to milk on iron status, anemia, and growth among children 1 to 4 years old. J. Ped. Gastroenterol. Nutr. 2010, 51, 341–346. [Google Scholar] [CrossRef] [PubMed]
- Feruś, K.; Drabińska, N.; Krupa-Kozak, U.; Jarocka-Cyrta, E. A randomized, placebo-controlled, pilot clinical trial to evaluate the effect of supplementation with prebiotic Synergy 1 on iron homeostasis in children and adolescents with celiac disease treated with a gluten-free diet. Nutrients 2018, 10, 1818. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Ghibaudo, F.; Gerbino, E.; Copello, G.J.; Campo Dall’ Orto, V.; Gómez-Zavaglia, A. Pectin-decorated magnetite nanoparticles as both iron delivery systems and protective matrices for probiotic bacteria. Colloids Surf. B Biointerfaces 2019, 180, 193–201. [Google Scholar] [CrossRef] [PubMed]
- Jeroense, F.M.; Michel, L.; Zeder, C.; Herter-Aeberli, I.; Zimmermann, M.B. Consumption of galacto-oligosaccharides increases iron absorption from ferrous fumarate: A stable iron isotope study in iron-depleted young women. J. Nutr. 2019, 149, 738–746. [Google Scholar] [CrossRef] [PubMed]
- Laparra, J.M.; Díez-Municio, M.; Herrero, M.; Moreno, F.J. Structural differences of prebiotic oligosaccharides influence their capability to enhance iron absorption in deficient rats. Food Funct. 2014, 5, 2430–2437. [Google Scholar] [CrossRef][Green Version]
- Paganini, D.; Uyoga, M.A.; Cercamondi, C.I.; Moretti, D.; Mwasi, E.; Schwab, C.; Bechtler, S.; Mutuku, F.M.; Galetti, V.; Lacroix, C. Consumption of galacto-oligosaccharides increases iron absorption from a micronutrient powder containing ferrous fumarate and sodium iron EDTA: A stable-isotope study in Kenyan infants. Am. J. Clin. Nutr. 2017, 106, 1020–1031. [Google Scholar] [CrossRef][Green Version]
- Paganini, D.; Uyoga, M.A.; Kortman, G.A.; Boekhorst, J.; Schneeberger, S.; Karanja, S.; Hennet, T.; Zimmermann, M.B. Maternal Human Milk Oligosaccharide Profile Modulates the Impact of an Intervention with Iron and Galacto-Oligosaccharides in Kenyan Infants. Nutrients 2019, 11, 2596. [Google Scholar] [CrossRef][Green Version]
- Petry, N.; Egli, I.; Chassard, C.; Lacroix, C.; Hurrell, R. Inulin modifies the bifidobacteria population, fecal lactate concentration, and fecal pH but does not influence iron absorption in women with low iron status. Am. J. Clin. Nutr. 2012, 96, 325–331. [Google Scholar] [CrossRef][Green Version]
- Weinborn, V.; Valenzuela, C.; Olivares, M.; Arredondo, M.; Weill, R.; Pizarro, F. Prebiotics increase heme iron bioavailability and do not affect non-heme iron bioavailability in humans. Food Funct. 2017, 8, 1994–1999. [Google Scholar] [CrossRef]
- Maawia, K.; Iqbal, S.; Qamar, T.R.; Rafiq, P.; ullah, A.; Ahmad, M.-U.-D. Production of impure prebiotic galacto-oligosaccharides and their effect on calcium, magnesium, iron and zinc absorption in Sprague-Dawley rats. Pharma Nutr. 2016, 4, 154–160. [Google Scholar] [CrossRef]
- Pitarresi, G.; Tripodo, G.; Cavallaro, G.; Palumbo, F.S.; Giammona, G. Inulin–iron complexes: A potential treatment of iron deficiency anaemia. Eur. J. Pharm. Biopharm. 2008, 68, 267–276. [Google Scholar] [CrossRef] [PubMed]
- Laparra, J.M.; Tako, E.; Glahn, R.P.; Miller, D.D. Supplemental inulin does not enhance iron bioavailability to Caco-2 cells from milk- or soy-based, probiotic-containing, yogurts but incubation at 37 °C does. Food Chem. 2008, 109, 122–128. [Google Scholar] [CrossRef] [PubMed]
- Asemi, Z.; Aarabi, M.H.; Hajijafari, M.; Alizadeh, S.A.; Razzaghi, R.; Mazoochi, M.; Esmaillzadeh, A. Effects of synbiotic food consumption on serum minerals, liver enzymes, and blood pressure in patients with type 2 diabetes: A double-blind randomized cross-over controlled clinical trial. Int. J. Prev. Med. 2017, 8, 43. [Google Scholar] [CrossRef] [PubMed]
Комментарии
Комментариев пока нет