ООО "ПРОПИОНИКС"
| пн-пт с 09:00 до 18:00 | |
Микробиология + энзимология + генная инженерия + ...
БИОТЕХНОЛОГИЯ

Промышленная микробиология, энзимология и генная инженерия

Биологические технологии (биотехнологии) обеспечивают управляемое получение полезных продуктов для различных сфер человеческой деятельности. Эти технологии базируются на использовании каталитического потенциала различных биологических агентов и систем – микроорганизмов, вирусов, растительных и животных клеток и тканей, а также внеклеточных веществ и компонентов клеток. В настоящее время разработка и освоение биотехнологии занимают важное место в деятельности практически всех стран. Достижение превосходства в биотехнологии является одной их центральных задач в экономической политике развитых стран. Лидерами биотехнологии являются сегодня США и Япония, накопившие многолетний опыт биотехнологий для сельского хозяйства, фармацевтической, пищевой и химической промышленности. Прочное положение в производстве ферментных препаратов, аминокислот, белка, медикаментов занимают страны Западной Европы (ФРГ, Франция, Великобритания), а также Россия. Эти страны характеризуются мощным потенциалом новой техники и технологии, интенсивными фундаментальными и прикладными исследованиями в различных областях биотехнологии. Определить сегодня, что же такое биотехнология, весьма не просто. Вместе с тем, само появление этого термина в нашем словаре глубоко символично. Оно отражает мнение, что применение биотехнологических материалов и принципов в ближайшие годы радикально изменит многие отрасли промышленности и само человеческое общество. Интерес к этой науке и темпы ее развития в последние годы растут очень быстро.
Человек использовал биотехнологию многие тысячи лет: люди занимались пивоварением, пекли хлеб, получали кисломолочные продукты, применяли ферментации для получения лекарственных веществ и переработки отходов. Но только новейшие методы биотехнологии, включая методы генетической инженерии, основанные на работе с рекомбинантными ДНК, привели к «биотехнологическому буму», свидетелями которого являемся мы в настоящее время. Новейшие технологии генетической инженерии позволяют существенно усовершенствовать традиционные биотехнологические процессы, а также получать принципиально новыми, ранее недос- тупными способами разнообразные ценные продукты.
Развитие и преобразование биотехнологии обусловлено глубокими переменами, происшедшими в биологии в течение последних 25–30 лет. Основу этих событий составили новые представления в области наследственности и методические усовершенствования, которые приблизили человечество к познанию превращений ее материального субстрата и проложили дорогу новейшим промышленным процессам. Помимо этого, ряд важнейших открытий в других областях также повлиял на развитие биотехнологии (см. таблицу).
Области науки, новейшие результаты которых важны для развития биотехнологии
|
Генетическая инженерия
|
Технология рекомбинантных ДНК.
|
|
Биокатализ
|
Ферменты (выделение, иммобилизация).
Целые микробные клетки (иммобилизация, стабилизация).
|
|
Иммунология
|
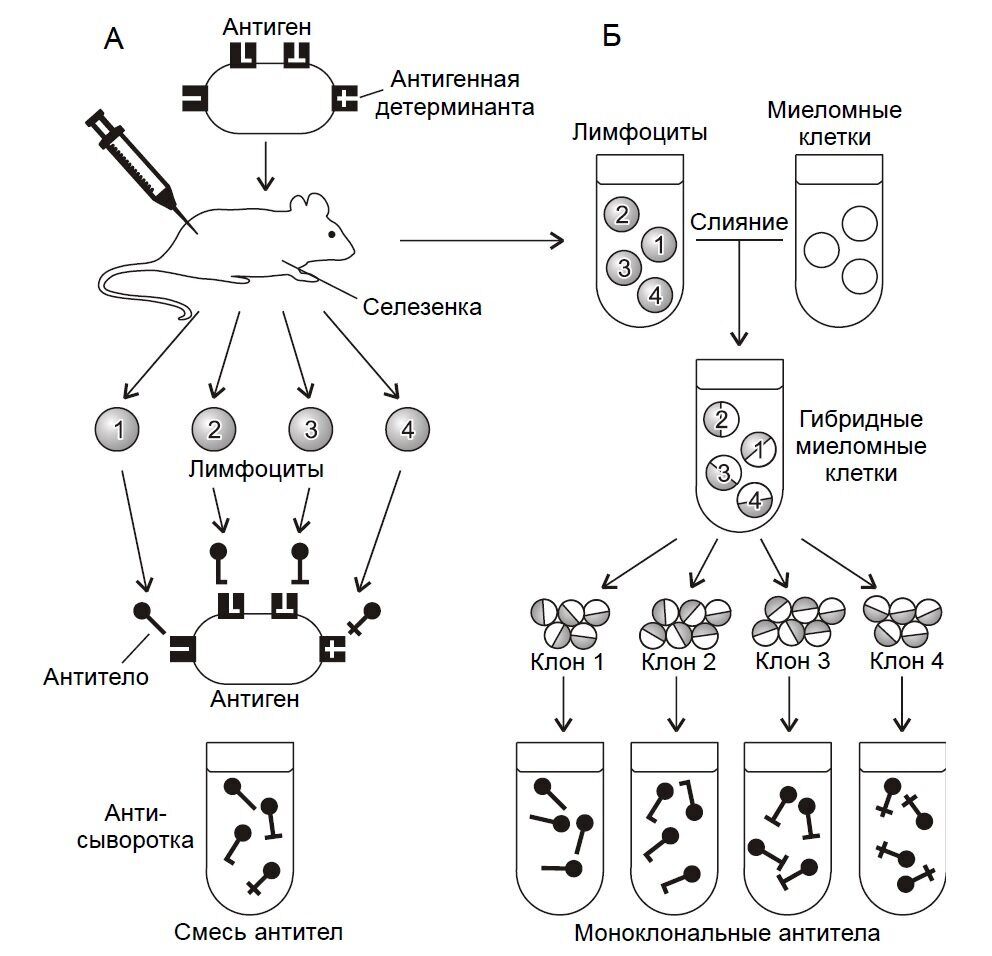
Моноклональные антитела.
|
|
Технология ферментации
|
Производство продуктов. Переработка отходов.
|
Генетическая инженерия существует немногим более 20 лет. Она блестяще раскрыла свои возможности в области прокариотических организмов. Однако новые технологии, применяемые к высшим растениям и животным, пока не столь значительны. Попытки применения приемов генетической инженерии к высшим растениям и животным сталкиваются с огромными трудностями, обусловленными как несовершенством наших знаний по генетике эукариот, так и сложностью организации высших организмов.
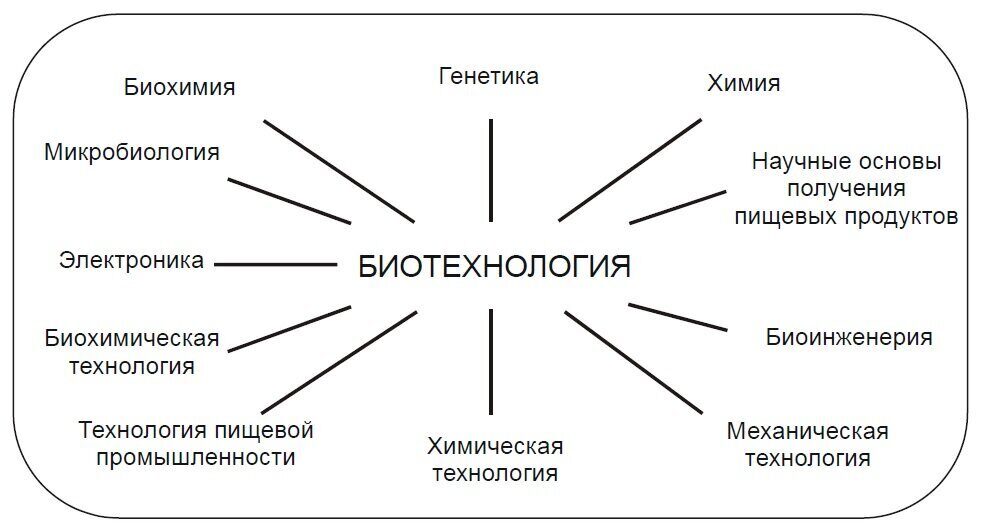
Использование научных достижений и практические успехи биотехнологии тесно связаны с фундаментальными исследованиями и реализуется на самом высоком уровне современной науки. В этом плане нельзя не отметить удивительную научную многоликость биотехнологии: ее развитие и достижения теснейшим образом связаны и зависят от комплекса знаний не только наук биологического профиля, но также и многих других (см. рисунок).
Сегодня биотехнология стремительно выдвинулась на передние позиции научно-технического прогресса. Фундаментальные исследования жизненных явлений на клеточном и молекулярном уровнях привели к появлению принципиально новых технологий и получению новых продуктов. Традиционные биотехнологические процессы, основанные на брожении, дополняются новыми эффективными процессами получения белков, аминокислот, антибиотиков, ферментов, витаминов, органических кислот и др. Наступила эра новейшей биотехнологии, связанная с получением вакцин, гормонов, интерферонов и др. Важнейшими задачами, стоящими перед биотехнологией сегодня, являются: повышение продуктивности сельскохозяйственных растительных культур и животных, создание новых пород культивируемых в сельском хозяйстве видов, защита окружающей среды и утилизация отходов, создание новых экологически чистых процессов преобразования энергии и получения минеральных ресурсов.
Характеризуя перспективы и роль биотехнологии в человеческом обществе, уместно прибегнуть к высказыванию на одном из Симпозиумов по биотехнологии японского профессора К. Сакагучи, который говорил следующее: «... ищите все, что пожелаете, у микроорганизмов, и они не подведут вас... Изучение и применение в промышленности культур клеток млекопитающих и растений, иммобилизация не только одноклеточных, но и клеток многоклеточных организмов, развитие энзимологии, генетической инженерии, вмешательство в сложный и недостаточно изученный наследственный аппарат растений и животных все больше расширят области применения существующих направлений биотехнологии и создадут принципиально новые направления».
Глава 1. НАУЧНЫЕ ОСНОВЫ БИОТЕХНОЛОГИИ
1.1. БИОТЕХНОЛОГИЯ – НОВАЯ КОМПЛЕКСНАЯ ОТРАСЛЬ
Современный этап научно-технического прогресса характеризуется революционными изменениями в биологии, которая становится лидером естествознания. Биология вышла на молекулярный и субклеточный уровень, в ней интенсивно применяются методы смежных наук (физики, химии, математики, кибернетики и др.), системные подходы. Бурное развитие комплекса наук биологического профиля с расширением практической сферы их применения обусловлено также социально-экономическими потребностями общества. Такие актуальные проблемы, стоящие перед человечеством второй половины ХХ века, как дефицит чистой воды и пищевых веществ (в особенности белковых), загрязнение окружающей среды, недостаток сырьевых и энергетических ресурсов, необходимость развития новых средств диагностики и лечения, не могут быть решены традиционными методами. Поэтому возникла острая необходимость в разработке и внедрение принципиально новых методов и технологий. Большая роль в решение комплекса этих проблем отводится биотехнологии, в рамках ко- торой осуществляется целевое применение биологических систем и процессов в различных сферах человеческой деятельности. В современной биотехнологии в соответствии со спецификой сфер ее применения целесообразно выделить в качестве самостоятельных ряд разделов следующие:
- Промышленная микробиология;
- Медицинская биотехнология;
- Технологическая биоэнергетика,
- Сельскохозяйственная биотехнология;
- Биогидрометаллургия;
- Инженерная энзимология;
- Клеточная и генетическая инженерия;
- Экологическая биотехнология.
Перспективность и эффективность применения биотехнологических процессов в различных сферах человеческой деятельности, от получения пищи и напитков до воспроизводства экологически чистых энергоносителей и новых материалов обусловлена их компактностью и одновременно крупномасштабностью, высоким уровнем механизации и производительности труда. Эти процессы поддаются контролю, регулированию и автоматизации. Биотехнологические процессы, в отличие от химических, реализуются в «мягких» условиях, при нормальном давлении, активной реакции и невысоких температурах среды; они в меньшей степени загрязняют окружающую среду отходами и побочными продуктами, мало зависят от климатических и погодных условий, не требуют больших земельных площадей, не нуждаются в применении пестицидов, гербицидов и других, чужеродных для окружающей среды агентов. Поэтому биотехнология в целом и ее отдельные разделы находится в ряду наиболее приоритетных направлений научно-технического прогресса и является ярким примером «высоких технологий», с которыми связывают перспективы развития многих производств. Биологические технологии находятся в настоящее время в фазе бурного развития, но уровень их развития во многом определяется научно-техническим потенциалом страны. Все высокоразвитые страны мира относят биотехнологию к одной из важнейших современных отраслей, считая ее ключевым методом реконструкции промышленности в соответствии с потребностями времени, и принимают меры по стимулированию ее развития.
Биотехнологические процессы многолики по своим историческим корням и по своей структуре, они объединяют элементы фундаментальных наук, а также ряда прикладных отраслей, таких как химическая технология, машиностроение, экономика. Научная многоликость биотехнологии в целом и ее раздела, имеющего целью решение природоохранных задач, удивительна: они использует достижения наук биологического цикла, изучающих надорганизменный уровень (экология), биологические организмы (микробиология, микология), суборганизменные структуры (молекулярная биология, генетика). Через биологию на биотехнологию влияют химия, физика, математика, кибернетика, механика. Современные биотехнологии также остро нуждаются в научно-обоснованной проработке технологии и аппаратурном оформлении. Поэтому необходима органическая связь с техническими науками – машиностроением, электроникой, автоматикой. Общественные и экономические науки также имеют большое значение в развитии экологической биотехнологии, так как решаемые ею практические задачи имеют большое социально-экономическое значение для развития любого общества. К биотехнологии, как ни к одной любой отрасли и области научных знаний, подходят знаменитые слова Луи Пастера: «Нет, и еще тысячу раз нет, я не знаю такой науки, которую можно было бы назвать прикладной. Есть наука и есть области ее применения, и они связаны друг с другом, как плод с взрастившим его деревом».
1.2. ИСТОРИЯ ВОЗНИКНОВЕНИЯ И ФОРМИРОВАНИЯ БИОТЕХНОЛОГИИ
Вопрос о формировании биотехнологии трактуется неоднозначно: по мнению одних (Овчинников, Баев, Скрябин), считается правомерным отнести к сфере биотехнологии древние процессы брожения, включая получение спирта, силосование; по мнению других (Аиба, Хемфри, Миллис), условной датой появления биотехнологии можно считать присуждение компании «Мерк Кемикал Компани» за достижения в области биохимической технологии в 1947 г. премии Мак-Гро – Хилла и, наконец, есть мнение, что начало биотехнологии следует отнести к 70-м годам ХХ столетия к моменту зарождения генетической инженерии. Видимо, правомерно отнести возникновение современной биотехнологии, начавшей свое формирование на базе существующих отраслей микробиологической промышленности, к началу 50-х годов нынешнего века, а весь предшествующий данному периоду этап называть предысторией формирования биотехнологии, ведущей корни из древнейших цивилизаций.
Предысторию формирования биотехнологии можно подразделить на ряд этапов:
- появление эмпирической технологии в 6-м тысячелетии до н.э.,
- зарождение естественных наук в XV–XVII веках;
- формирование микробиологических производств и начало взаимодействия науки и микробиологических производств в конце XIX – 10-х годах XX века, вызвавшее революционное преобразование микробиологических производств;
- создание научно-технических предпосылок для возникновения современной биотехнологии (10-е – конец 40-х годов XX века).
Человек с древнейших времен начал использовать в своей хозяйственной деятельности биологические организмы, в частности микроорганизмы, не зная об их существовании. Первым микробиологическим процессом, использованным на практике, было брожение – процесс обмена веществ, при котором в органическом субстрате происходят изменения под воздействием микробных ферментов. Возбудителями бродильных процессов являются грибы, бактерии, дрожжи. Данные организмы легко культивируются, быстро размножаются в сравнительно простых условиях и синтезируют ферменты, вызывающие разложение органических веществ. С древнейших времен брожение применяли при хлебопечении, пивоварении и виноделии. Так, при раскопках Вавилона обнаружены дощечки, насчитывающие 6000 лет, с описанием процесса приготовления пива, а в пирамидах Египта, построенных в этот же период, – караваи хлеба. Есть сведения об очистных сооружениях, которые функционировали в древнем Риме. С 3–4-го тысячелетий известны человеку процессы пектинового брожения, лежащие в основе мочки прядильных растений, льна, конопли и др. С древнейших времен человечество сталкивалось и с отрицательными последствиями деятельности микроорганизмов (порча продуктов, инфекционные болезни людей и домашнего скота). Следствием этого на первых этапах были неосознанные, эмпирические попытки разработки методов и средств борьбы с этими явлениями. Так стали возникать методы консервирования продуктов.
Во второй половине XV века начитается развитие современного естествознания. На становление и развитие биологии существенное влияние оказали успехи химии, которая из описательной в этот период превращается в аналитическую. Произошли сдвиги в изучении сущности процессов брожения; появился термин «ферментация», а процесс брожения стали связывать с наличием в среде дрожжей или ферментов. В XVI–XVII веках сначала во Франции, а затем повсеместно для разрыхления теста стали использовать пивные дрожжи; позднее с изменением и совершенствованием технологии пивоварения для этих целей стали применять дрожжи спиртовых производств. В Европе стали добывать медь в процессах бактериального выщелачивания.
Во второй половине XVIII века была доказана способность одного вещества разлагать другое. Это послужило началом экспериментального изучения уникальной способности ферментов к катализу специфических химических реакций. Таким образом, развитие описательной микробиологии и изучение химических превращений стали важной предпосылкой для становления микробиологии и биохимии.
В XIX веке с развитием химических наук были заложены основы органической химии. В этот период были открыты многие органические кислоты, глицерин, холестерин, глюкоза, первые аминокислоты, осуществлен синтез мочевины. Для зарождения энзимологии большое значение имело изучение процесса гидролиза полисахаридов. Огромное влияние на создание научных основ микробиологических производств имели работы Луи Пастера, который по просьбе правительства Франции исследовал причины нарушения технологических процессов в ряде производств. Работая в области прикладной микробиологии, Пастер сделал ряд крупнейших фундаментальных открытий, которые заложили основы современной технической микробиологии. Пастер неоспоримо доказал, что болезни, порча продуктов, брожение и гниение вызываются микроорганизмами, и создал теорию об экзогенности попадания этих организмов в среду. Этим была доказана несостоятельность бытующей в то время теории самозарождения микроорганизмов. Работы Пастера заложили научные основы виноделия, пивоварения, производства спирта и уксуса, борьбы с инфекционными болезнями. Современник Пастера Гексли, оценивая работы Пастера, говорил, что «... он своими открытиями возместил Франции большую часть контрибуции, уплаченной Германии». Крупным достижением данного периода была разработка метода чистых культур, а также усовершенствование сред для выделения и выращивания микроорганизмов. Чистые культуры стали применять в сложившихся микробиологических производствах. Большое значение имели работы по изучению микробного антагонизма и применению его в медицине. Мечниковым было создано учение об антагонизме микробов и научно обоснованы рекомендации для практических применений этого учения. В этот период активно изучалась азотфиксация. Немецкие исследователи Гельригель и Вильфарт установили биологическую природу процесса фиксации азота бобовыми растениями, а Бейеринк выделил чистую культуру клубеньковых бактерий и доказал их присутствие в ризосфере растений. Тогда же блестящими работами Виноградского, Омельянского, Надсона, Исаченко были заложены основы геологической микробиологии; начато изучение роли микроорганизмов в превращениях серы, железа, кальция, грязеобразовании. Стали закладываться научные основы биологической обработки и обезвреживания стоков. Очистные сооружения, известные со времен Древней Индии и Римской империи и пришедшие в упадок в средние века, с бурным развитием промышленности на рубеже XIX–XX веков вновь стали предметом пристальных исследований. В этот период начала складываться энзимология. Для изучения и применения ферментов потребовалась разработка и подбор специальных «мягких» методов выделения и очистки. Началось практическое применение ферментных препаратов для подслащивания ряда веществ, появились препараты для дубления кож и применения в аналитике.
В 70–80-е годы XIX столетия были заложены основы культивирования растительных клеток и животных тканей. После работ Шванна и Вирхова, назвавших клетку элементарным организмом, возник интерес к изучению живых клеток, и начались эксперименты по сохранению жизнеспособности клеток и кусочков тканей в специфических условиях и средах. В 1865 г. Мендель доложил Обществу испытателей природы свои наблюдения о закономерностях передачи наследственных признаков.
В начале XX века были введены термины «мутации», «ген», возникла гипотеза Сэттона-Бовери о том, что хромосомы являются материальными носителями наследственных признаков. Русский цитолог Навашин раскрыл особенности структуры хромосом и заложил основы хромосомной теории наследственности.
Таким образом, в данный период внедрение научных знаний дало возможность приступить к разработке научно-обоснованных биотехнологий многих производственных процессов.
Последний период эры предыстории современных биотехнологий (10-е – 40-е годы XX века) условно можно подразделить на два этапа. На первом этапе, в начале его, в основном, происходило усовершенствование технологии существующих производств, а затем, благодаря успехам микробиологии, биохимии и других наук того периода, в результате принципиальных усовершенствований аппаратуры и технологий возникла основа для организации новых производств. В этот период стали выпускать новые экологически чистые биоудобрения и биологические препараты для борьбы с вредителями и болезнями сельскохозяйственных растений, возникли производства ряда целевых продуктов (органических растворителей, спиртов), начались промышленные испытания биотехнологических процессов переработки и использования растительных отходов. Второй этап данного периода тесно связан с биотехнологическими методами получения ряда сложных веществ – антибиотиков, ферментов, витаминов. Революционным моментом данного периода была промышленная реализация технологии производства антибиотиков. Отправной точкой при этом послужило открытие Флемингом, Флори и Чейном химиотерапевтического действия пенициллина. Практически одновременно в СССР Ермольева, изучая действие лизоцима, показала, что он является фактором естественного иммунитета, а Гаузе и Бражникова получили новый активный препарат – антибиотик грамицидин.
После второй мировой войны в ходе интенсивного развития промышленных биотехнологий были организованы производства аминокислот, белка одноклеточных, превращение стероидов, освоено культивирование клеток животных и растений. Интактные клетки микроорганизмов широко стали использовать для получения лекарственных веществ стероидной природы, были организованы крупные производства вакцин.
Эра новейших биотехнологических процессов, возникшая в течение последних 25–30 лет, связана с использованием иммобилизованных ферментов и клеточных органелл, а также основана на методах рекомбинантных ДНК. Бурно развивающиеся в настоящее время генетическая и клеточная инженерия способствуют тому, что биотехнологии постепенно завоевывают все новые и новые области производства и решительно внедряются во многие сферы деятельности человека. В 50-е годы после успешного использования для получения вакцины вируса полиомиелита, выращиваемого в культуре клеток млекопитающих, линии культур клеток человека стали незаменимыми для выделения и культивирования ряда других вирусов, производства антител, интерферона, противоопухолевых химиопрепаратов. В конце 60-х годов иммобилизованные ферменты и клетки стали успешно применяться не только для производства полусинтетических препаратов, но и для проведения несложных биохимических анализов.
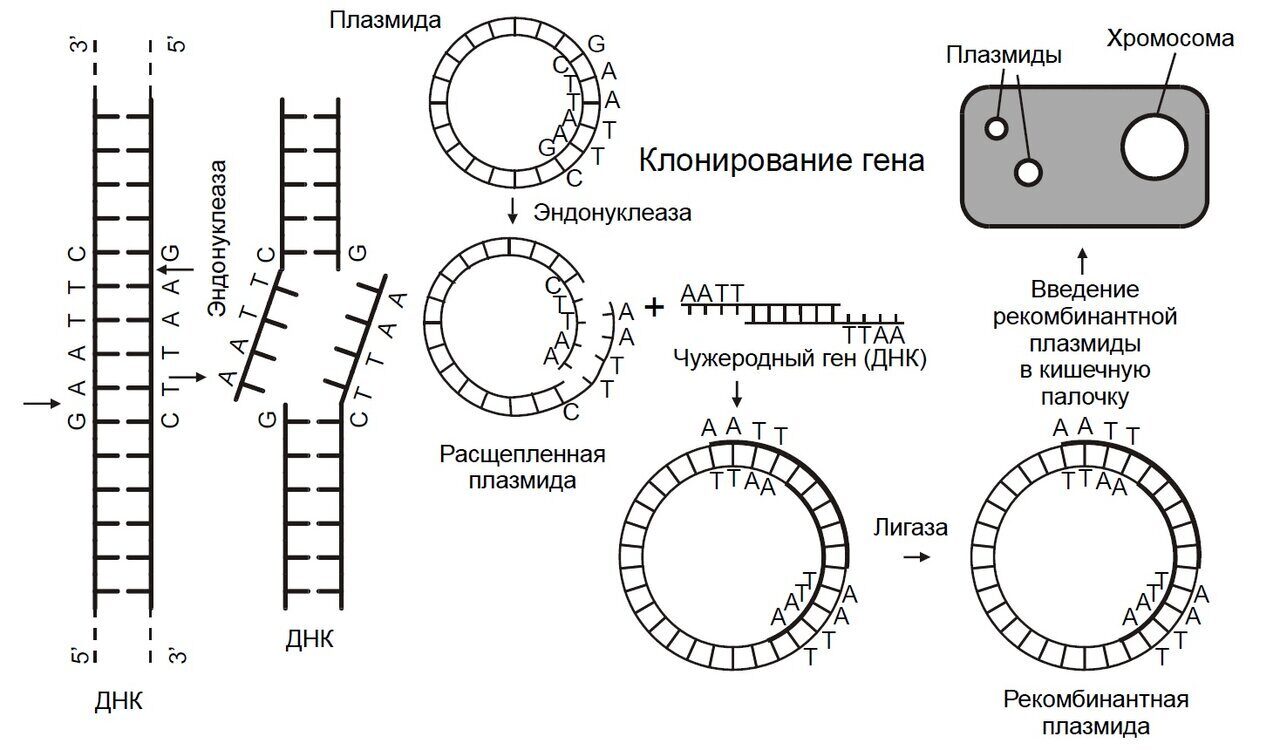
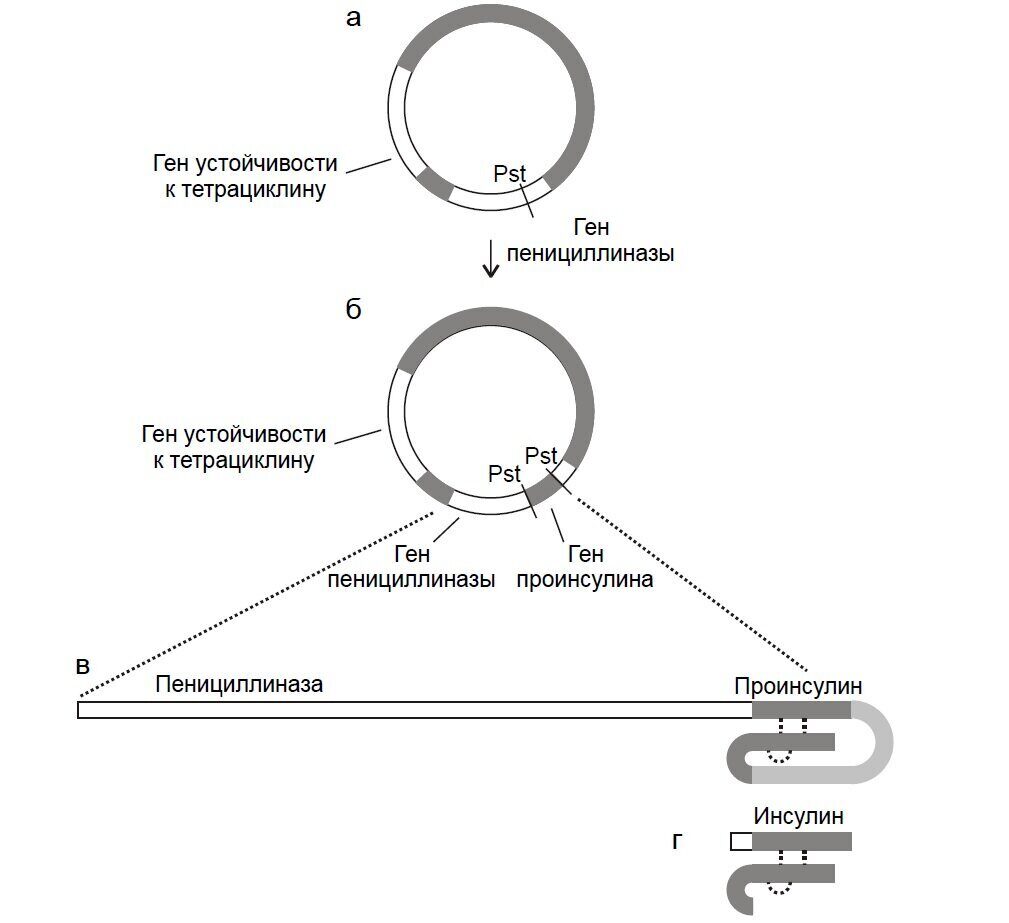
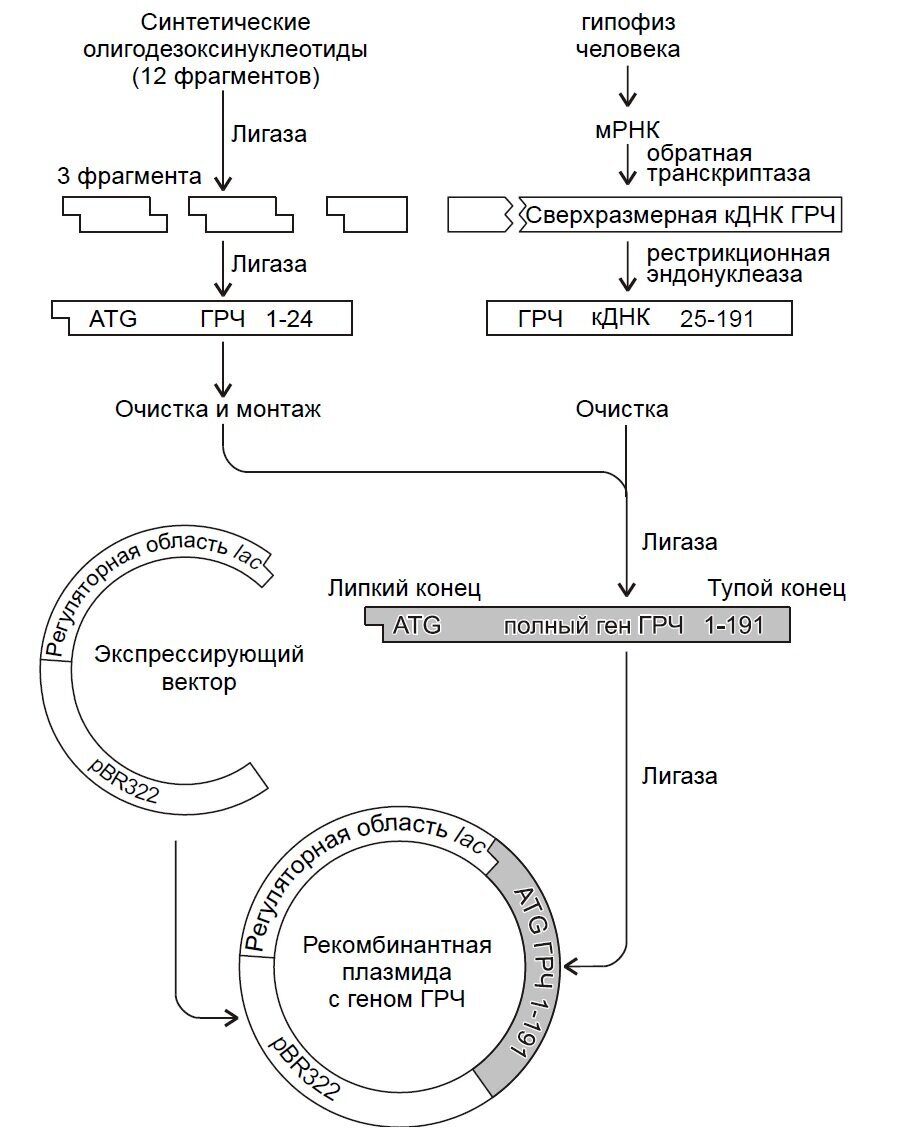
Возникновение генетической инженерии условно относят к 1972 году, когда в США Бергом была создана первая рекомбинантная молекула ДНК. С середины 70-х годов данной проблемой интенсивно занимаются тысячи научных коллективов и промышленных компаний во всех странах мира. Сочетание слов «генетика» и «инженерия» свидетельствуют о том, что наступило время, когда стало возможным конструирование рекомбинантных ДНК и целенаправленно создавать искусственные генетические программы. Это дало возможность организовать получение многих важных препаратов, а также начать работу по получению новых суперштаммов-деградаторов промышленных токсикантов. Внедрение новейших методов биотехнологии в настоящее время производит переворот в различных областях биотехнологии, включая биотехнологические процессы. Эти методы позволяют интенсифицировать экологически чистые биотехнологии воспроизводства пищи и кормовых препаратов, решать методами задачи обеспечения человечества материальными и энергетическими ресурсами и также природоохранные проблемы.
Таким образом, корни биотехнологических процессов уходят в далекое прошлое, а их будущее необычайно широко и перспективно. Современном биологическим технологиям под силу создать отрасли, основанные на функционировании биологических систем, метаболические системы которых обладают уникальными достоинствами и подчинены интересам человечества.
1.3. ТЕХНОЛОГИЧЕСКИЕ ОСНОВЫ БИОТЕХНОЛОГИЧЕСКИХ ПРОИЗВОДСТВ
Важнейшей задачей любого биотехнологического процесса является разработка и оптимизация научно-обоснованной технологии и аппаратуры для него. При организации биотехнологических производств частично был заимствован опыт развитой к тому времени химической технологии. Однако биотехнологические процессы имеют существенное отличие от химических в силу того, что в биотехнологии используют более сложную организацию материи – биологическую. Каждый биологический объект (клетка, фермент и т. д.) – это автономная саморегулирующаяся система. Природа биологических процессов сложна и далеко не выяснена окончательно. Для микробных популяций, например, характерна существенная гетерогенность по ряду признаков – возраст, физиологическая активность, устойчивость к воздействию неблагоприятных факторов среды. Они также подвержены случайным мутациям, частота которых составляет от 10-4 до 10-8. Гетерогенность также может быть обусловлена наличием поверхностей раздела фаз и неоднородностью условий среды.
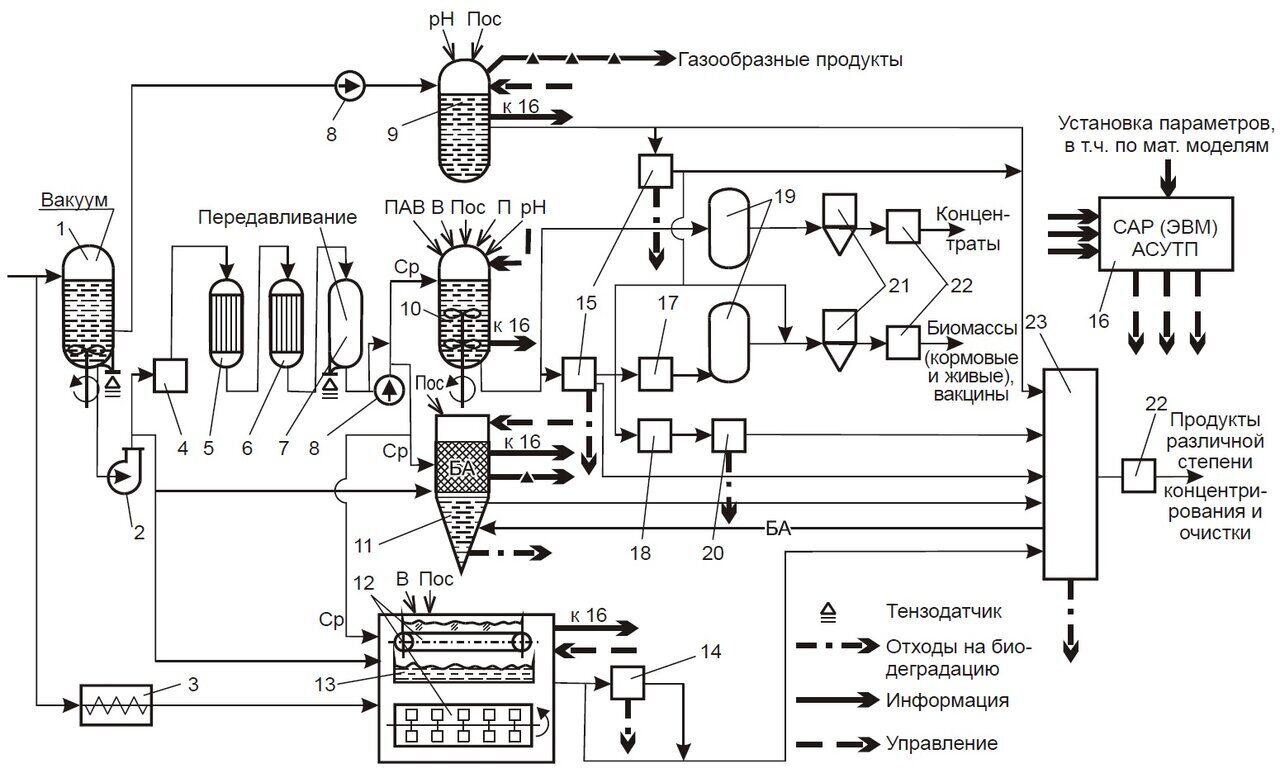
В общем виде любой биотехнологический процесс включает три основные стадии: предферментационную, ферментационную и постферментационную. Принципиальная схема реализации биотехнологических процессов в общем виде может быть представлена блок-схемой, в которой сделана попытка охватить все варианты ферментационных процессов (рис. 1.1).
************
Рис. 1.1. Принципиальная схема реализации биотехнологических процессов (по У. Э. Виестур и др., 1987): 1 – реактор для приготовления сред, 2 – вихревой насос, 3 – аппарат для приготовления твердых сред, 4 – паровая колонка для подогрева сред до температуры стерилизации, 5 – выдерживатель сред при температуре стерилизации, 6 – теплообменник для охлаждения сред, 7 – мерник – сборник питательной среды, 8 – дозатор, 9 – анаэробный ферментер, 10 – глубинный аэробный ферментер, 11 – биокаталитический реактор, 12 – ферментер для поверхностной твердофазной ферментации, 13 – то же для поверхностной жидкостной ферментации, 14 – экстрактор, 15 – сепаратор для отделения биомассы, 16 – система локальной автоматики, 17 – плазмолизатор биомассы, 18 – дезинтегратор биомассы, 19 – выпарная установка, 20 – фракционирование дезинтегратов, 21 – сушилка и другие аппараты для обезвоживания, 22 – аппаратура для расфасовки продукта, 23 – ионообменные колонны, аппараты для химических и мембранных методов выделения, центрифуги, фильтры, кристаллизаторы и др. устройства. Условные обозначения: рН – раствор для коррекции рН, П – компоненты и среды для подпитки, Пос – посевной материал, В – сжатый воздух, ПАВ – пеногаситель, Ср – стерильная питательная среда, БА – биологический агент.
На предферментационной стадии осуществляют хранение и подготовку культуры продуцента (инокулята), получение и подготовку питательных субстратов и сред, ферментационной аппаратуры, технологической и рециркулируемой воды и воздуха. Поддержание и подготовка чистой культуры является очень важным моментом предферментационной стадии, так как продуцент, его физиолого-биохимические характеристики и свойства определяют эффективность всего биотехнологического процесса. В отделении чистой культуры осуществляют хранение производствен- ных штаммов и обеспечивают их реактивацию и наработку инокулята в количествах, требуемых для начала процесса. При выращивании посевных доз инокулята применяют принцип масштабирования, то есть проводят последовательное наращивание биомассы продуцента в колбах, бутылях, далее в серии последовательных ферментеров. Каждый последующий этап данного процесса отличается по объему от предыдущего обычно на порядок. Полученный инокулят по стерильной посевной линии направляется далее в аппарат, в котором реализуется ферментационная стадия. Приготовление питательных сред осуществляется в специальных реакторах, оборудованных мешалками. В зависимости от растворимости и совместимости компонентов сред могут быть применены отдельные реакторы. Технология приготовления сред значительно усложняется, если в их состав входят нерастворимые компоненты. В различных биотехнологических процессах применяются различные по происхождению и количествам субстраты, поэтому процесс их приготовления варьирует. Поэтому дозирование питательных компонентов подбирается и осуществляется индивидуально на каждом производстве в соответствии с Технологическим регла- ментом конкретного процесса. В качестве дозирующего оборудования при этом применяются весовые и объемные устройства, используемые в пищевой и химической промышленности. Транспорт веществ осуществляется насосами, ленточными и шнековыми транспортерами. Сыпучие компоненты подают в ферментеры с помощью вакуумных насосов. Часто применяют принцип предварительных смесей, то есть соли предварительно растворяют и затем транспортируют по трубопроводам, дозируя их подачу по объему. В силу исключительного разнообразия биотехнологических процессов и применяемых для их реализации сред, методов и аппаратуры рассмотрение данных элементов далее будет связано с конкретными биотехнологическими производствами.
Стадия ферментации является основной стадией в биотехнологическом процессе, так как в ее ходе происходит взаимодействие продуцента с субстратом и образование целевых продуктов (биомасс, эндо- и экзопродуктов). Эта стадия осуществляется в биохимическом реакторе (ферментере) и может быть организована в зависимости от особенностей используемого продуцента и требований к типу и качеству конечного продукта различными способами. Ферментация может проходить в строго асептических условиях и без соблюдения правил стерильности (так называемая «незащищенная» ферментация); на жидких и на твердых средах; анаэробно и аэробно. Аэробная ферментация, в свою очередь, может протекать поверхностно или глубинно (во всей толще питательной среды).
Культивирование биологических объектов может осуществляться в периодическом и проточном режимах, полунепрерывно с подпиткой субстратом. При периодическом способе культивирования ферментер заполняется исходной питательной средой и инокулятом микроорганизмов (Х0 + S0 на рис. 1.2). В течение определенного периода времени в аппарате происходит взаимодействие микроорганизмов и субстрат сопровождающееся образованием в культуре продукта (Х + S → P).

Рис. 1.2. Схема биореактора периодического действия.
Биохимические превращения в этом аппарате продолжаются от десятков часов до нескольких суток. Регуляция условий внутри ферментера – важнейшая задача периодического культивирования микроорганизмов. В ходе периодической ферментации выращиваемая культура проходит ряд последовательных стадий: лаг-фазу, экспоненциальную, замедления роста, стационарную и отмирания. При этом происходят существенные изменения физиологического состояния биообъекта, а также ряда параметров среды. Целевые продукты образуются в экспоненциальной (первичные метаболиты – ферменты, аминокислоты, витамины) и стационарной (вторичные метаболиты – антибиотики) фазах, поэтому в зависимости от целей биотехнологического процесса в современных промышленных процессах применяют принцип дифференцированных режимов культивирования. В результате этого создаются условия для максимальной продукции того или иного целевого продукта. Периодически ферментер опорожняют, производят выделение и очистку продукта, и начинается новый цикл.
Непрерывный процесс культивирования микроорганизмов обладает существенными преимуществами перед периодическим. Непрерывная ферментация осуществляется в условиях установившегося режима, когда микробная популяция и ее продукты наиболее однородны. Применение непрерывных процессов ферментации создает условия для эффективного регулирования и управления процессами биосинтеза. Системы непрерывной ферментации могут быть организованы по принципу полного вытеснения или полного смешения. Первый пример – так называемая тубуляр- ная культура (рис. 1.3).
Рис. 1.3. Схема тубулярного биореактора полного вытеснения.
Процесс ферментации осуществляется в длинной трубе, в которую с одного конца непрерывно поступают питательные компоненты и инокулят, а с другой с той же скоростью вытекает культуральная жидкость. Данная система проточной ферментации является гетерогенной.
При непрерывной ферментации в ферментах полного смешения (гомогенно-проточный способ) во всей массе ферментационного аппарата создаются одинаковые условия. Применение таких систем ферментации позволяет эффективно управлять отдельными стадиями, а также всем биотехнологическим процессом и стабилизировать продуцент в практически любом, требуемом экспериментатору или биотехнологу состоянии. Управление подобными установками осуществляется двумя способами (рис. 1.4).
Рис. 1.4. Схемы биореакторов для проточного культивирования микроорганизмов. А – хемостат; Б – турбидостат с автоматической регуляцией оптической плотности. 1 – поступление среды, 2 – мешалка, 3 – сток культуры, 4 – насос, 5 – фотоэлемент, 6 – источник света.
Турбидостатный способ базируется на измерении мутности выходящего потока. Измерение мутности микробной суспензии, вызванное ростом клеток, является мерой скорости роста, с которой микроорганизмы выходят из биореактора. Это позволяет регулировать скорость поступления в ферментер свежей питательной среды. Второй метод контроля, – хемостатный, проще. Управление процессом в хемостате осуществляется измерением не выходящего, а входящего потока. При этом концентрацию одного из компонентов питательной среды (углерод, кислород, азот), поступающего в ферментер, устанавливают на таком уровне, при котором другие питательные компоненты находятся в избытке, то есть лимитирующая концентрация задающегося биогенного элемента ограничивает скорость размножения клеток в культуре.
Обеспечение процесса ферментации, с точки зрения инженерной реализации, сводится к дозированному поступлению в ферментер потоков (инокулята, воздуха (или газовых смесей), питательных биогенов, пеногасителей) и отвода из него тепла, отработанного воздуха, культуральной жидкости, а также измерению и стабилизации основных параметров процесса на уровне, требуемом для оптимального развития продуцента и образования целевого продукта. В ходе ферментации образуются сложные смеси, содержащие клетки, внеклеточные метаболиты, остаточные концентрации исходного субстрата. При этом целевые продукты, как правило, находятся в этой смеси в небольших концентрациях, а многие из них легко разрушаются. Все это накладывает существенные ограничения на методы выделения и сушки биологических препаратов.
Постферментационная стадия обеспечивает получение готовой товарной продукции и также, что не менее важно, обезвреживание отходов и побочных продуктов. В зависимости от локализации конечного продукта (клетка или культуральная жидкость) и его природы на постферментационной стадии применяют различную аппаратуру и методы выделения и очистки. Наиболее трудоемко выделение продукта, накапливающегося в клетках. Первым этапом постферментационной стадии является фракционирование культуральной жидкости и отделение взвешенной фазы – биомассы. Наиболее распространенный для этих целей метод – сепарация, осуществляемая в специальных аппаратах – сепараторах, которые работают по различным схемам в зависимости от свойств обрабатываемой культуральной жидкости. Основные проблемы, возникают при необходимости выделения мелковзвешенных частиц с размером 0.5–1.0 мкм и менее (бак- териальные клетки) и необходимостью переработки больших объемов жидкости (производство кормового белка, ряда аминокислот). Для повышения эффективности процесса сепарации применяют предварительную специальную обработку культуры – изменение рН, нагревание, добавление химических агентов. Для увеличения сроков годности биотехнологических продуктов производят их обезвоживание и стабилизацию. В зависимости от свойств продукта применяют различные методы высушивания.
Сушка термостабильных препаратов осуществляется на подносах, ленточном конвейере, а также в кипящем слое. Особо чувствительные к нагреванию препараты высушивают в вакуум-сушильных шкафах при пониженном давлении и температуре и в распылительных сушилках. К стабилизации свойств биотехнологических продуктов ведет добавление в качестве наполнителей различных веществ. Для стабилизации кормового белка применяют пшеничные отруби, кукурузную муку, обладающие дополнительной питательной ценностью. Для стабилизации ферментных препаратов используют глицерин и углеводы, которые препятствуют денатурации ферментов, а также неорганические ионы кобальта, магния, натрия, антибиотики и др.
1.4. ЭЛЕМЕНТЫ, СЛАГАЮЩИЕ БИОТЕХНОЛОГИЧЕСКИЕ ПРОЦЕССЫ
Основными элементами, слагающими биотехнологические процессы, являются: биологический агент, субстрат, аппаратура и продукт.
Биологический агент является активным началом в биотехнологических процессах и одним из наиболее важных ее элементов. Номенклатура биологических агентов бурно расширяется, но до настоящего времени важнейшее место занимает традиционный объект – микробная клетка (табл. 1.1, 1.2).
Микробные клетки с различными химико-технологическими свойствами могут быть выделены из природных источников и далее с помощью традиционных (селекция, отбор) и новейших методов (клеточная и генетическая инженерия) существенно модифицированы и улучшены. При выборе биологического агента и постановке его на производство прежде всего следует соблюдать принцип технологичности штаммов. Это значит, что микробная клетка, популяция или сообщество особей должны сохранять свои основные физиолого-биохимические свойства в процессе длительного ведения ферментации. Промышленные продуценты также должны обладать устойчивостью к мутационным воздействиям, фагам, заражению посторонней микрофлорой (контаминации); характеризоваться безвредностью для людей и окружающей среды, не иметь при выращивании побочных токсичных продуктов обмена и отходов, иметь высокие выходы продукта и приемлемые технико-экономические показатели.
В настоящее время многие промышленные микробные технологии базируются на использовании гетеротрофных организмов, а в будущем решающее место среди продуцентов займут автотрофные микроорганизмы, не нуждающиеся для роста в дефицитных органических средах, а также экстремофилы – организмы, развивающиеся в экстремальных условиях среды (термофильные, алкало- и ацидофильные).
Таблица 1.1. Микрооорганизмы, используемые в промышленности для получения целевых продуктов
|
Организм
|
Тип
|
Продукт
|
|
Saccharomyces cerevisiae
|
Дрожжи
|
Пекарские дрожжи, вино, эль, саке
|
|
Streptococcus thermophilus
|
Бактерии
|
Иогурт
|
|
Propionibacterium shermanii
|
Бактерии
|
Швейцарский сыр
|
|
Gluconobacterium suboxidans
|
Бактерии
|
Уксус
|
|
Penicillium roquefortii
|
Плесень
|
Сыры типа рокфора
|
|
Aspergillus oryzae
|
Плесень
|
Саке
|
|
Saccharomyces cerevisiae
|
Дрожжи
|
Этанол
|
|
Clostridium acetobutylicum
|
Бактерии
|
Ацетон
|
|
Xanthomonas campestris
|
Бактерии
|
Полисахариды
|
|
Corynebacterium glutamicum
|
Бактерии
|
L-Лизин
|
|
Candida utilis
|
Дрожжи
|
Микробный белок
|
|
Propionibacterium
|
Бактерии
|
Витамин В12
|
|
Aspergilus oryzae
|
Плесень
|
Амилаза
|
|
Kluyveromyces fragilis
|
Дрожжи
|
Лактаза
|
|
Saccharomycopsis lipolytica
|
Дрожжи
|
Липаза
|
|
Bacillus
|
Бактерии
|
Протеазы
|
|
Endothia parasitica
|
Плесень
|
Сычужный фермент
|
|
Leocanostoc mesenteroides
|
Бактерии
|
Декстран
|
|
Xanthomonas campestris
|
Бактерии
|
Ксантан
|
|
Penicillium chrysogenum
|
Плесень
|
Пенициллины
|
|
Chehalosporium acremonium
|
Плесень
|
Цефалоспирины
|
|
Rhizopus nigricans
|
Плесень
|
Трансформация стероидов
|
|
Гибридомы
|
–
|
Иммуноглобулины
и моноклональные антитела
|
|
Клеточные линии млекопитающих
|
–
|
Интерферон
|
|
E. coli (рекомбинантные штаммы)
|
Бактерии
|
Инсулин, гормон роста, интерферон
|
|
Blakeslea trispora
|
Плесень
|
b-Каратин
|
|
Phaffia rhodozyma
|
Дрожжи
|
Астаксантин
|
|
Bacillus thuringiensis
|
Бактерии
|
Биоинсектициды
|
|
Bacillus popilliae
|
Бактерии
|
Биоинсектициды
|
В последние годы расширяется применение смешанных микробных культур и их природных ассоциаций. По сравнению с монокультурами, микробные ассоциации способны ассимилировать сложные, неоднородные по составу субстраты, минерализуют сложные органические соединения, имея повышенную способность к биотрансформации, имеют повышенную устойчивость к воздействию неблагоприятных факторов среды и токсических веществ, а также повышенную продуктивность и возможность обмена генетической информацией между отдельными видами сообщества. Основные области применения смешанных культур – охрана окружающей среды, биодеградация и усвоение сложных субстратов.
Таблица 1.2. Важнейшие группы субстратов, биологических агентов и образуемых в биотехнологических процессах продуктов (по Виестур и др., 1987).
|
Субстраты
|
Биологические агенты
|
Продукты
|
|
Меласса, сок сахарного тростника, гидролизаты растительных полимеров.
|
Микроорганизмы, растительные и животные клетки, в том числе потической инженерии.
|
Биоудобрения и биоинсектициды, микробные биомассы, диагностикумы, вакцины.
|
|
Сахара, спирты, органические кислоты.
Парафины нефти.
Полупродукты, предшественники биотрансформации.
|
Вирусы.
Компоненты клеток: мембраны, протопласты, митохондрии, ферменты.
Внеклеточные продукты: ферменты, коферменты.
|
Биогаз.
Чистые продукты, медикаменты, диагностикумы.
Гормоны и др. продукты биотрансформации
Органические кислоты.
|
|
Природный газ, водород.
Отходы с/х и лесной промышленности.
|
Иммобилизованные клетки микроорганизмов, растений и животных, их компоненты и внеклеточные продукты.
|
Полисахариды.
белок одноклеточных. Пищевые продукты.
|
|
Отходы промышленности, в том числе переработки фруктов и овощей.
|
|
Экстракты, гидролизаты.
Спирты, органические растворители.
|
|
Бытовые отходы, сточные воды.
|
|
Антибиотики
Аминокислоты.
|
|
Молочная сыворотка.
|
|
Ферменты, витамины.
|
|
Картофель, зерно.
|
|
Металлы, неметаллы.
|
|
Зеленая биомасса растений.
|
|
Моноклональные антитела.
|
Особая группа биологических агентов в биотехнологии – ферменты, так называемые катализаторы биологического происхождения. Ферменты находят все большее применение в различных биотехнологических процессах и отраслях хозяйствования, но до 60-х годов это направление сдерживалось трудностями их получения, неустойчивостью, высокой стоимостью. Как отдельную отрасль в создании и использовании новых биологических агентов следует выделить иммобилизованные ферменты, которые представляют собой гармонично функционирующую систему, действие которой определяется правильным выбором фермента, носителя и способа иммобилизации. Преимущество мобилизованных ферментов в сравнении с растворимыми заключается в следующем: стабильность и повышенная активность, удержание в объеме реактора, возможность полного и быстрого отделения целевых продуктов и организации непрерывных процессов ферментации с многократным использованием биологического агента.
Иммобилизованные ферменты открывают новые возможности в создании биологических микроустройств для использования в аналитике, преобразовании энергии и биоэлектрокатализе.
К нетрадиционным биологическим агентам на данном этапе развития биотехнологии относят растительные и животные ткани, в том числе гибридомы, трансплантанты. Большое внимание в настоящее время уделяется получению новейших биологических агентов – трансгенных клеток микроорганизмов, растений, животных генноинженерными методами. Развиты также новые методы, позволяющие получать искусственные клетки с использованием различных синтетических и биологических материалов (мембраны с заданными свойствами, изотопы, магнитные материалы, антитела). Разрабатываются подходы к конструированию ферментов с заданными свойствами, имеющими повышенную реакционную активность и стабильность. В настоящее время реализован синтез полипептидов желаемой стереоконфигурации и пр.
Таким образом, в биотехнологических процессах возможно использование различных биологических агентов с различным уровнем организации, – от клеточной до молекулярной.
Субстраты и среды, используемые в биотехнологии, весьма разнообразны, и их спектр непрерывно расширяется (табл. 1.2). С развитием промышленных процессов происходит накопление новых видов отходов, которые могут быть обезврежены и конвертированы в полезные продукты методами биотехнологии. С одной стороны, развивающиеся бурными темпами биотехнологические промышленные направления сталкиваются с проблемой исчерпания традиционных видов сырья, поэтому возникает необходимость в расширении сырьевой базы, с другой, – увеличение объемов накапливающихся отходов делает необходимым разработку нетрадиционных, в том числе биотехнологических способов их переработки.
В настоящее время наблюдается рост интереса биотехнологов к природным возобновляемым ресурсам – продуктам фотосинтеза, биоресурсам мирового океана. В состав сред для биотехнологических процессов входят источники углерода и энергии, а также минеральные элементы и ростовые факторы. В качестве источников углерода и энергии в биотехнологических процессах используют главным образом природные комплексные среды неопределенного состава (отходы различных производств, продукты переработки растительного сырья, компоненты сточных вод и пр.), в которых помимо углеродных соединений содержатся также минеральные элементы и ростовые факторы. Довольно широко включены в разряд биотехнологических субстратов целлюлоза, гидролизаты полисахаридов и древесины. Последние около 30 лет используют для получения белка одноклеточных. Кислотный гидролиз древесины при 175–190°С обеспечивает выход в среду до 45–50 % редуцирующих веществ; при более жестких режимах гидролиза эта величина возрастает до 55–68 %. С большим успехом в последние годы стали применять гидролизаты торфа, это позволяет снизить стоимость, например, препаратов аминокислот в 4–5 раз. Минеральные элементы, необходимые для роста биологических агентов и входящие в состав питательных сред, подразделяются на макро- и микроэлементы. Среди макроэлементов на первом месте стоит азот, так как потребности в нем у биологических объектов на порядок превышают потребности в других элементах (фосфоре, сере, калии и магнии). Азот обычно используется микроорганизмами в восстановленной форме (мочевина, аммоний или их соли). Часто азот вводится в комплексе с другими макроэлементами – фосфором, серой. Для этого в качестве их источников используют соли (сульфаты или фосфаты аммония). Для ряда отдельных продуцентов, однако, лучшими являются нитраты или органические соединения азота. Существенное значение при обеспечении азотного питания продуцента имеет не только вид, но концентрация азота в среде, так как изменение соотношения C:N, воздействуя на скорость роста продуцента, метаболизм, вызывает сверхсинтез ряда целевых продуктов (аминокислот, полисахаридов и др.). Минеральные элементы необходимы для роста любого биологического агента, но их концентрация в среде в зависимости от биологии используемого биообъекта и задач биотехнологического процесса различна. Так, концентрация макроэлементов в среде (K, Mg, P, S) обычно составляет около 10–3–10–4 М. Потребности в микроэлементах невелики, и их концентрация в средах существенно ниже – 10–6–10–8 М. Поэтому микроэлементы часто специально не вносят в среде, так как их примеси в основных солях и воде обеспечивают потребности продуцентов. Отдельные продуценты в силу специфики метаболизма или питательных потребностей нуждаются для роста в наличие в среде ростовых факторов (отдельных аминокислот, витаминов и пр.). Помимо чистых индивидуальных веществ такой природы, на практике часто используют в качестве ростовых добавок кукурузный или дрожжевой экстракт, картофельный сок, экстракт проростков ячменя, зерновых отходов и отходов молочной промышленности. Стимулирующее действие данных ростовых факторов во многом зависит от индивидуальных свойств применяемого продуцента, состава основной среды, условий ферментации и др. Добавление ростовых факторов способно увеличить выход целевого продукта, например ферментов, в десятки раз.
Традиционно состав питательной среды, оптимальной для биотехнологического процесса, определяется методом длительного эмпирического подбора, в ходе которого на первых этапах определяется качественный и количественный состав среды. Было сделано много попыток обоснования состава сред с позиций физиологии и биохимии продуцента, но так как потребности в питательных веществах видо- и даже штаммоспецифичны, в каждом конкретном случае приходится подбирать оптимальный для конкретного продуцента состав среды. В последние 20–25 лет все шире используют математический метод планирования экспериментов, математическое моделирование биотехнологических процессов; это позволяет обоснованно подходить к конструированию питательных сред сделать их экономичными.
Аппаратура. Вопросами технического обеспечения биотехнологических процессов занимается биоинженерия. Для различных процессов существует огромное разнообразие аппаратуры: собственно для процесса ферментации, а также для выделения и получения готового продукта. Наиболее сложна и специфична аппаратура для ферментационной стадии. Технически наиболее сложным процессом ферментации является аэробный глубинный стерильный и непрерывный (или с подпиткой субстратом). Аппараты для поверхностной и анаэробной ферментации менее сложны и энергоемки. В современной литературе описаны сотни биореакторов, отличающихся по конструкции, принципу работы и размерам (от нескольких литров до нескольких тысяч кубометров). Многочисленность методов культивирование, чрезвычайное многообразие используемых биологических агентов привели к огромному разнообразию конструктивных решений, которые зависят от ряда факторов: типа продуцента и среды, технологии и масштабов производства, а также целевого продукта и пр. Техническое оснащение биотехнологии базируется на общих положениях технической биохимии и пищевой технологии, однако имеет свою специфику. Принципиальное отличие биотехнологических процессов от чисто химических заключается в следующем:
- чувствительность биологических агентов к физико-механическим воздействиям;
- наличие межфазового переноса веществ (по типу «жидкость – клетки», «газ – жидкость – клетки»);
- требования условий асептики;
- низкие скорости протекания многих процессов в целом;
- нестабильность целевых продуктов;
- пенообразование;
- сложность механизмов регуляции роста и биосинтеза.
Рассмотрим некоторые типы ферментационных аппаратов.
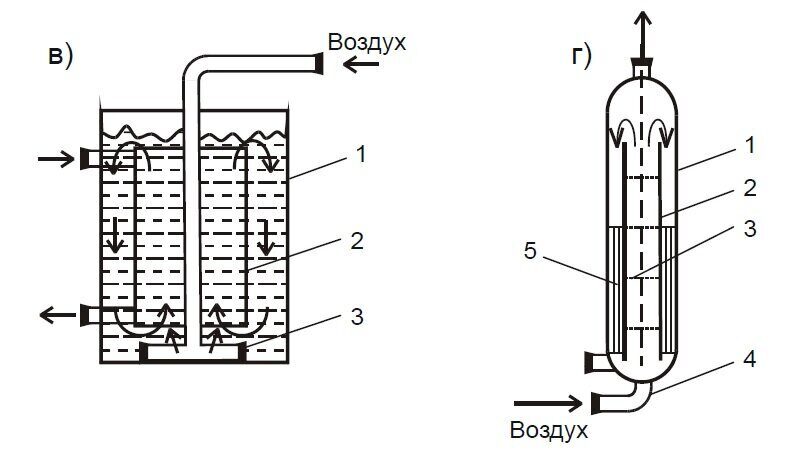
Аппараты для анаэробных процессов достаточно просты и применяются в процессах конверсии растительного сырья, в том числе растительных отходов, а также различных промышленных отходов. При метановом брожении для получения биогаза, а также в ряде других процессов (получение ацетона, шампанских вин) используют ферментационные аппараты (метанотенки). Эти аппараты имеют различную конструкцию (от простой выгребной ямы до сложных металлических конструкций или железобетонных сооружений) и объемы (от нескольких до сотен кубометров) (рис.1.5). Метановые установки оборудованы системой подачи сырья, системой теплообменах труб для стабилизации температуры, несложным перемешивающим устройством для гомогенного распределения сырья и биомассы продуцента, газовым колпаком и устройством переменного объема (газгольдер) для сбора образуемого биогаза.

Рис. 1.5. Схема метановой установки. 1 – дозирующее устройство, 2 – теплообменник, 3 – метанотенк; 4 – газгольдер.
Конструкция аппаратов для аэробной ферментации определяется типом ферментации и сырья. Аппараты для аэробной поверхностной ферментации, широко применяемые для производства органических кислот и ферментов, достаточно просты по конструкции и, соответственно, подразделяются на жидкофазные и твердофазные. Поверхностная жидкофазная ферментация протекает в так называемых бродильных вентилируемых камерах, в которых на стеллажах размещены плоские металлические кюветы. В кюветы наливают жидкую питательную среду, высота слоя составляет 80–150 мм, затем с потоком подаваемого воздуха среду инокулируют спорами продуцента. В камере стабилизируется влажность, температура и скорость подачи воздуха. После завершения процесса культуральная жидкость сливается из кювет через вмонтированные в днища штуцера и поступает на обработку. При твердофазной ферментации процесс также протекает в вентилируемых камерах, но вместо кювет на стеллажах размещают лотки, в которые насыпают сыпучую твердую среду слоем 10–15 мм. Для лучшей аэрации среды подаваемый в камеру воздух проходит через перфорированное днище лотков.
Аппараты для аэробной глубинной ферментации наиболее сложны как конструкционно, так и с точки зрения их эксплуатации. Главная задача, возникающая при их конструировании, – обеспечение высокой интенсивности массо- и энергообмена клеток со средой. Массообмен определяется транспортом (переносом) кислорода и других биогенных элементов из среды в микробную клетку и отводом из нее продуктов обмена. Главным показателем массообменных характеристик ферментера служит коэффициент массопередачи кислорода, так как кислород является основным лимитирующим фактором аэробных ферментационных процессов. Расход кислорода на образование 1 кг биомассы в зависимости от типа углерод- содержащего сырья и степени его восстановленности может составлять от 0.75 до 5.00 кг. Клетки способны утилизировать кислород только в растворенном виде, поэтому необходимо постоянно поддерживать его концентрацию в культуре на уровне, оптимальном для конкретного продуцента. При этом скорость поступления кислорода к клеткам должна превышать скорость его включения в клетки, и в околоклеточном пространстве не должно возникать так называемых «концентрационных ям». Кроме этого, концентрация клеток и растворенного субстрата должны быть равномерными по всему объему ферментера. Поэтому перемешивание является также одним из основных факторов, обеспечивающих требуемую гидродинамическую обстановку в аппарате. При интенсивном перемешивании пузырьки воздуха дробятся в аппарате и диспергируясь увеличивают площадь контакта фаз «среда-клетка». Однако чрезмерное перемешивание может вызвать механическое повреждение биологических объектов.
К настоящему времени разработано и применяется огромное количество разнообразнейших перемешивающих и аэрирующих устройств, и классифицировать их практически невозможно. Наиболее удачна, по нашему мнению, попытка классификации ферментационных аппаратов для аэробной глубинной ферментации по подводу энергии (Виестур и др., 1986; 1987). Согласно этой классификации, аппараты такого типа делятся на три группы по подводу энергии: 1) – к газовой фазе, 2) – к жидкой фазе, 3) – комбинированный подвод.
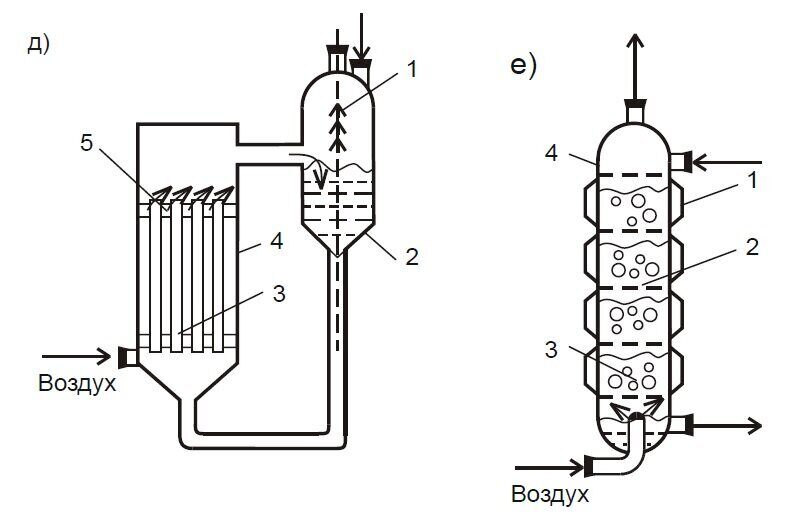
Ферментеры с подводом энергии к газовой фазе (группа ФГ). Их общий признак – подвод энергии в аппарат через газовую фазу, которая является ее носителем. Ферментеры характеризуются достаточно простой конструкцией (отсутствуют трущиеся, движущиеся узлы), высокой эксплуатационной надежностью, но имеют не очень высокие массообменные характеристики (коэффициент массопередачи кислорода менее 4 кг/м3) (рис. 1.6). Данные аппараты представляют собой вертикальную емкость, снабженную газораспределительным устройством одного из известных типов.
Барботажные газораспределительные устройства обычно устанавливаются в нижней части аппарата. Подаваемый сверху через распредели- тельную трубу воздух, пройдя через барботер, насыщает кислородом толщу среды. Коэффициент массопереноса кислорода невысок, 1–2 кг/м3 ч; барботажно-колонный – в нижней части корпуса такого аппарата устанавливается перфорированная пластина с диаметром отверстий 0.0005 м или сопловой эжектор с диаметром сопла 0.004 м; барботажно-эрлифтный аппарат характеризуется наличием внутри одного или нескольких диффузоров («стаканов») или нескольких перегородок для принудительного разделения восходящих и нисходящих потоков циркулирующей жидкости; эти элементы расположены равномерно по сечению аппарата или концентрично; газлифтный колонный ферментер состоит из двух колонн разного диаметра, соединенных между собой; одна представляет собой барботажную колонну с восходящим потоком воздуха, другая – циркуляционная, с нисходящим потоком. Воздух вводится в нижнюю зону аппарата в барботажную колонну; камера, соединяющая колонны в верхней части аппарата, образует большую поверхность контакта фаз; трубчатый аппарат сконструирован по типу теплообменных труб; взаимодействие газа в трубе при высоких скоростях продувки более интенсивное, чем в большом объеме, поэтому массообмен интенсивнее; аппарат с плавающей насадкой позво- ляет интенсифицировать массообмен за счет увеличения поверхности контакта фаз и турбулизации жидкости при работе с большими скоростями подачи газовой и жидкой фаз. В аппарат введены секционные элементы в виде решеток, оборудованных лопастной насадкой; в центре аппарата находится труба, через которую вводится воздух, а жидкая фаза поступает противотоком сверху. Газ, поступая на лопастную насадку, обычно из полиэтилена, вращает ее; это существенно увеличивает поверхность контакта газовой и жидкой фаз.
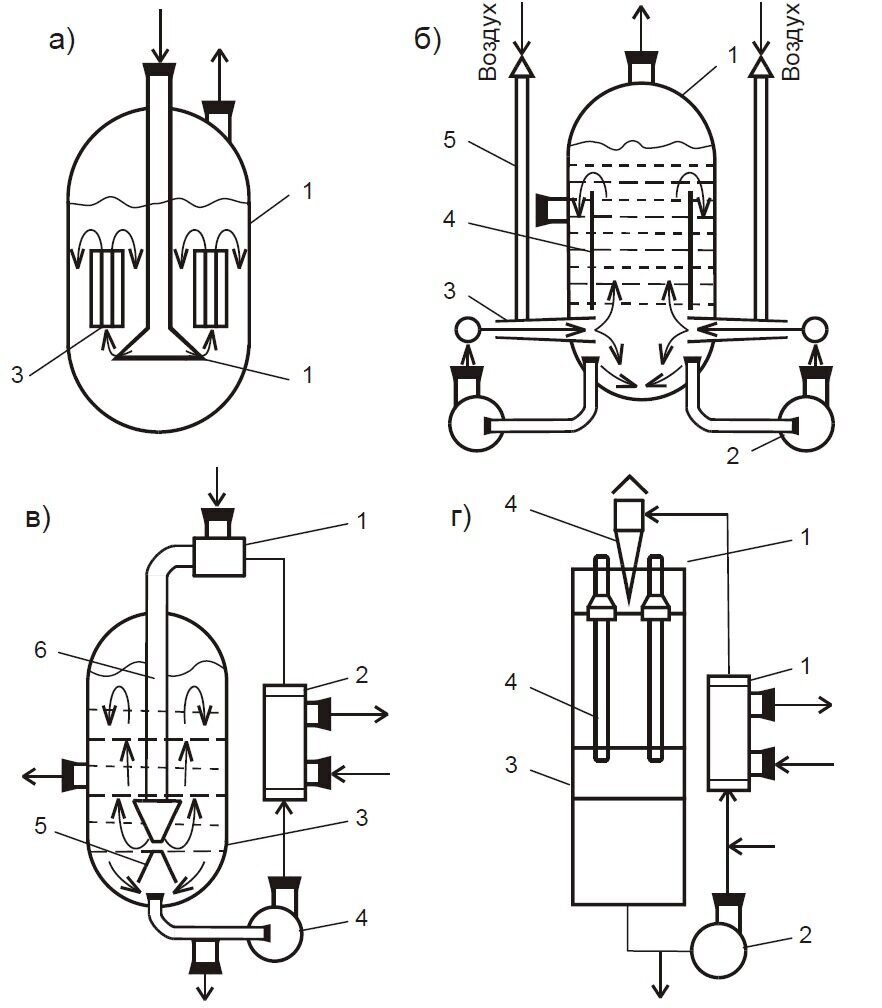
Ферментеры с вводом энергии жидкой фазой (группа ФЖ) наиболее сложны по конструкции и энергоемки, но обеспечивают наиболее высокие по сравнению с группой ферментеров ГФ значения коэффициента массопередачи кислорода, свыше 6 кг/м3 ч.
В данных аппаратах ввод энергии осуществляется жидкой фазой, обычно самовсасывающими мешалками или насосами; в последнем варианте жидкость вводится в аппарат через специальное устройство (сопло, эжектор, диспергатор). Данные аппараты также можно подразделит на ряд типов (рис. 1.7): ферментеры с самовсасывающими мешалками не требуют специальных воздуходувных машин, так как поступление в них воздуха происходит в результате разрежения в воздушной камере мешалки, соединенной с воздуховодом и с жидкостью, отбрасываемой лопатками мешалки; в эжекционных ферментерах возможна рециркуляция газовой фазы, что экономит субстрат, однако требуется наличие специальных насосов для перекачки газосодержащей культуральной среды. Применение эжекционного ввода газовых субстратов в ферментер может интенсифицировать массообмен на порядок; струйные ферментеры (с затопленной или падающей струей) оборудуются мощными насосами, которые забирают культуральную жидкость из нижней части аппарата и через напорный трубопровод подводят поток к аэрирующему устройству (по типу шахтного перепада или напорно-струйные). Струя жидкости под давлением свободно падает сверху и пронизывает аэрируемую жидкость до дна аппарата. Происходят интенсивные турбулизация и перемешивание жидкости. Внизу жидкость вновь засасывается насосом и снова подается вверх аппарата, то есть возникает замкнутый контур циркуляции. Недостатком данных аппаратов являются потери энергии при перекачке жидкости, трудности проектирования в связи с отсутствием надежных методик расчета конструкций и режимов работы струйных и эжекционных устройств.
Третья группа аппаратов – с подводом энергии газовой и жидкой фазами (группа ФЖГ). Основными их конструкционными элементами являются перемешивающие устройства всех известных типов, а также наличие в совокупности насосов и перемешивающих устройств. Это могут быть аппараты с группой самовсасывающих мешалок и насосом для перекачивания культуральной жидкости и другие сочетания перемешивающих и аэрирующих устройств. Коэффициент массопереноса кислорода в таких ферментерах может в принципе иметь любые из известных значения.
Перечисленные типы аппаратов возникли в основном в течение «эры» антибиотиков и белка одноклеточных и применяются, главным образом, в технической микробиологии.
Прогресс в области получения клеточных и рекомбинантных культур выдвигает специальные требования к биореакторам. При этом на первый план выдвигаются такие показатели, как стабильность биологических агентов, повышенные требования к асептике, лимитация срезовых условий при перемешивании и др. Однако, многие из таких конструкций пока еще носят экспериментальный характер.
Продукты. Ассортимент продуктов, получаемых в биотехнологических процессах, чрезвычайно широк. По разнообразию и объемам производства на первом месте стоят продукты, получаемые в процессах, основанных на жизнедеятельности микроорганизмов. Эти продукты подразделяются на три основные группы:
- 1 группа – биомасса, которая является целевым продуктом (белок одноклеточных) или используется в качестве биологического агента (биометаногенез, бактериальное выщелачивание металлов);
- 2 группа – первичные метаболиты – это низкомолекулярные соединения, необходимые для роста микроорганизмов в качестве строительных блоков макромолекул, коферментов (аминокислоты, витамины, органические кислоты);
- 3 группа – вторичные метаболиты (идиолиты) – это соединения, не требующиеся для роста микроорганизмов и не связанные с их ростом (антибиотики, алкалоиды, гормоны роста и токсины).
Среди продуктов микробиологического синтеза – огромное количество различных биологически активных соединений, в том числе белковых и лекарственных веществ, ферментов, а также энергоносители (биогаз, спирты) и минеральные ресурсы (металлы), средства для борьбы с вредителями сельскохозяйственных культур (биоинсектициды) и биоудобрения (табл. 1.1, 1.2). В связи с развитием новейших методов биотехнологии (инженерной энзимологии, клеточной и генной инженерии) спектр целевых продуктов непрерывно дополняется. Среди них все большее место занимают средства диагностики и лечения (гибридомы, моноклональные антитела, вакцины и сыворотки, гормоны, модифицированные антибиотики).
1.5. КРИТЕРИИ ОЦЕНКИ ЭФФЕКТИВНОСТИ ПРОЦЕССОВ
В биотехнологии при выборе метода получения конкретного целевого продукта обязательно должна производиться технико-экономическая оценка альтернативов получения подобных продуктов традиционными методами. По сравнению с известными биотехнологические процессы должны быть более технологичными, экономичными и экологичными либо вообще должны исключать альтернативы. Оценка альтернативности вариантов только через себестоимость продукта – односторонняя. Оценкой эффективности биотехнологии, помимо качества получаемого продукта, может служить сопоставление экспериментального и теоретического выхода продукта, рассчитанные по материально-энергетическому балансу процесса. При этом затраты и стоимость сырья в крупномасштабных биотехнологических процессах, как правило, являются определяющими, по- этому материально-энергетическая оценка в данном случае очень существенна. И, напротив, при использовании процессов на основе высокопро- дуктивных рекомбинантных штаммов-продуцентов основная доля затрат относится не к сырью, а к созданию продуцента и его поддержанию, а также разработке специальных условий его культивирования, то есть в данном случае экономика сырьевых и энергоресурсов играют второстепенную роль.
В любом биотехнологическом процессе ключевую роль играет биологический агент, его природа и физиолого-технологические свойства. Для роста любого биообъекта нужен исходный жизнеспособный посевной материал, источники энергии и углерода, питательные вещества для синтеза биомассы, отсутствие действия ингибиторов роста, соответствующие физико-химические условия ферментации (рН, температура, аэрация и др.).
Одним из основных показателей, характеризующих адекватность условий ферментации, служит скорость роста продуцента. Скорость роста (увеличение биомассы) организмов с бинарным делением в хорошо перемешиваемой среде в периодической культуре будет пропорционально концентрации микробной биомассы:
dX/dt = μX,
где dX/dt – скорость роста, Х – биомасса, μ – коэффициент пропорциональности, («удельная скорость роста»); параметр аналогичен сложным процентам (например, если удельная скорость роста равна 0.1 ч–1, – значит увеличение биомассы равно 10 % в час). Если величина μ постоянна, как это бывает в установившемся режиме культивирования, то интегрирование представленного уравнения дает:
lnX = lnX0 + μt,
где Х0 – биомасса в начальный период времени t.
График зависимости lnX от времени будет иметь вид прямой линии с наклоном μ. Удельная скорость роста является одним из основных параметров, характеризующих физиологическое состояние продуцента; ряд других параметров может быть выражен через этот показатель.
Продуктивность процесса характеризуется количеством продукта, получаемого на единицу объема биореактора в единицу времени. Продуктивность процесса зависит от многих факторов: активности продуцента, значений коэффициента выхода продукта из потребленного субстрата, количества активной биомассы в ферментере:
П = qs Yp/s X [г/л ч.],
где qs – скорость потребления субстрата (метаболический коэффициент), Yp/s- выход продукта (экономический коэффициент), X – концентрация биомассы, P – продукт, S – субстрат.
Влиять на величину продуктивности можно путем изменения различных ее составляющих, но в каждом конкретном случае это приходится рассматривать отдельно. Так, при повышении величины Х могут возникнуть ограничения по массообменным характеристикам аппарата и лимитирующие состояния; влиять на величину метаболического коэффициента культуры возможно только при условии глубокого знания взаимосвязей между физиолого-биохимическими характеристиками продуцента и условиями среды.
Выход продукта (Y) (экономический коэффициент) определяется как количество продукта, получаемого из данного количества субстрата:
Y = X/Sо – S,
где S и So – конечная и исходная концентрация субстрата.
Данный коэффициент выражает эффективность использования субстрата для получения целевого продукта и является очень важной характеристикой, так как непосредственно связан с продуктивностью и позволяет непосредственно влиять на себестоимость конечного продукта. Экономический коэффициент имеет четкий физический смысл, характеризующей степень перехода энергии, заключенной в субстрате, в продукт. Данная величина необходима для расчетов и прогнозирования процесса в целом и используется в качестве параметра для контроля и управления ходом различных процессов и сопоставления их эффективности.
Конечная концентрация продукта должна планироваться с учетом продолжительности процесса и величины выхода продукта. Достижение конечной высокой концентрации продукта оправдано, когда выделение, концентрирование его трудоемки и дорогостоящи.
Удельные энергозатраты существенно варьируют в зависимости от направленности и схемы процесса ферментации, а также условий подготовки сырья на предферментационной стадии и постферментационных процедур. Удельные энергозатраты также очень существенно зависят от типа ферментационного оборудования.
Непродуктивные затраты субстрата (h) – это затраты энергии субстрата, которые не проявляются в приросте продукта. В общем виде они выражаются через экономический коэффициент:
h = Yэкспериментальный/Yтеоретический < 1.
Непродуктивные затраты существенно влияют на эффективность и экономику биотехнологического процесса, поэтому выявление причин и мест этих дополнительных трат энергического субстрата очень важно. Непродуктивные затраты субстрата могут быть связаны с ошибками при считывании генетической информации в ходе быстрого роста продуцента и затратами на поддержание при разобщенном росте в результате снижения эффективности образования энергии в цепи переноса электронов из-за разобщения окисления и фосфорилирования, инактивации мест сопряжения, возникновения альтернативных, менее эффективных ветвей, с диссипацией энергии, а также из-за возрастания трат энергии на поддержание жизни без размножения (транспорт субстратов и мономеров в клетке, ресинтез молекул, защитные реакции, процессы репарации).
Первичная оценка эффективности биотехнологических процессов по перечисленным параметрам проводится на стадии лабораторных разработок и испытаний процесса и далее уточняется при масштабировании на опытных и опытно-промышленных стадиях.
1.6. КОНТРОЛЬ И УПРАВЛЕНИЕ БИОТЕХНОЛОГИЧЕСКИМИ ПРОЦЕССАМИ; МОДЕЛИРОВАНИЕ И ОПТИМИЗАЦИЯ
Эффективное проведение биотехнологических процессов тесно связано с совершенствованием способов контроля и управления. В период предыстории биотехнологии делались отдельные попытки регулировать развитие продуцента с помощью изменений параметров внешней среды. До середины ХХ века регулирование в основном сводилось к эмпирике, так как без знания сущности происходящего невозможно эффективно контролировать и управлять процессом. В основном, объектом управления того периода была экстенсивная периодическая культура микроорганизмов со всеми ее недостатками: динамикой состояния продуцента и среды, отсутствием средств контроля. В последние 25 лет с внедрением управляемых культур биотехнологи переходят от простой задачи поддержания определенных параметров среды к управлению процессом в целом. Для реализации управляемого культивирования необходимо построение алгоритмов управления, основанных на моделях биотехнологического процесса. В современных биотехнологических процессах необходимо регистрировать и анализировать множество быстроизменяющихся факторов (концентрацию субстрата, биомассы и продукта в культуре, рН, температуру, парциальное давление кислорода и др.) (табл. 1.3). Это вызывает необходимость в применении электронной техники.
Таблица 1.3. Величины и расчетные параметры, применяемые для управления биотехнологическими процесами
|
Измеряемые параметры
|
Расчеты на базе измерений
|
|
|
|
|
Первые разработки по применению ЭВМ в биотехнологии относятся к концу 60-х гг. ХХ века. На первых этапах ЭВМ привлекали в качестве советчика оператора, управляющего исполнительными механизмами для поддержания оптимального течения биотехнологического процесса. Прежде всего, для сбора и обработки информации по показаниям датчиков и для представления этой информации в легковоспринимаемой форме. Разрабатывали также системы автоматического регулирования отдельных параметров (дозировка среды или отдельных компонентов, стабилизация температуры и рН среды, скорости протока) по принципу контроля с обратной связью. Позднее ЭВМ стали использовать для управления технологическим процессом в целом в составе автоматизированных систем АСУ. Задача создания АСУ стала особенно актуальной при реализации крупнотоннажных биотехнологических процессов. В настоящее время АСУ осуществляется на основе системного подхода, и управление имеет многоуровневую иерархическую систему.
Внедрение АСУ позволяет осуществить рациональное управление процессом биосинтеза. В результате этого экономятся исходное сырье, электроэнергия, вода, повышается продуктивность процесса и производительность труда обслуживающего персонала. Затраты на создание и внедрение АСУ в биотехнологии окупаются сравнительно быстро, в течение 3–4 лет.
Обычная схема контроля и управления ферментацией включает ферментер, датчики, регулирующую систему, которая реализует расчетные зависимости на основе измерения параметров процесса. Исходные данные от датчиков поступают на ЭВМ, в которой они оперативно анализируются, и в результате выдаются данные для исполнительных устройств и механизмов. В настоящее время разработка и внедрение АСУ для биотехнологических процессов, прежде всего, определяется уровнем технической оснащенности данных процессов и зависит от уровня электронного оборудования, средств контроля и автоматизации. Возникают также проблемы вследствие большой информационной емкости биотехнологических процессов. Эффективность АСУ зависит от быстродействия и объема памяти ЭВМ. Поэтому прогресс в области биотехнологии зависит от прогресса в области электроники. Большое будущее имеет, в частности, микропроцессорная техника. Внедрение АСУ сдерживается отставанием в создании надежной и быстродействующей контрольно-измерительной аппаратуры, выдерживающей стерилизацию и удовлетворяющей современные требования к чувствительности и точности измерения, быстродействию, надежности, миниатюризации.
Моделирование является одним из наиболее значимых направлений при разработке биотехнологических процессов, так как с помощью моделирования, экспериментального и математического, исследуются и разрабатываются новые процессы, совершенствуются аппараты и технологические схемы производств. При экспериментальном моделировании в лабораторных и промышленных условиях применяются, как правило, модели объектов и процессов, отличающиеся масштабами. Экспериментальное моделирование позволяет исследовать и оптимизировать процессы, сущность которых мало изучена. Данный подход часто служит единственным средством для исследования биотехнологического процесса. Первым этапом экспериментального моделирования служит лабораторный уровень, в ходе которого при сравнительно небольших затратах проводится изучение новых продуцентов и разработка новых процессов. Далее полученные результаты переносят в опытные, полупромышленные и промышленные масштабы. На опытных установках отрабатываются все технологические детали будущего процесса, обучается персонал, создается оборудование, уточняются технико-экономические показатели. Затем проводятся крупномасштабные дорогостоящие промышленные эксперименты и испытания. Экспериментальное моделирование имеет ряд особенностей: трудоемкость, сложность реализации новой модели процесса. Наиболее трудны при этом вопросы масштабирования технологии и оборудования. Развитие биологических агентов связано не только с поведением жидкости и реагентов в ферментере, но и с их собственным метаболизмом. Поэтому масштабирование в биологии требует специальных решений, при этом до настоящего времени нет единого подхода к решению данной задачи. Для оптимизации и управления биотехнологическими процессами, помимо экспериментального, необходимо также привлечение математического моделирования. Эти два подхода, дополняя друг друга, позволяют более эффективно решать поставленные задачи. Экспериментальное моделирование часто предшествует математическому, являясь для него источником информации. Математические модели – удобное средство обобщения экспериментальных данных. Наличие математических моделей позволяет более обоснованно подходить к планированию экспериментов и обрабатывать данные, существенно сокращать объем экспериментальных работ. Для моделирования и расчета биотехнологических процессов в силу их сложности применяют системный подход. Математическая модель сложной биосистемы должна включать описание различных по своей природе объектов и явлений. Поэтому, анализируя биологическую системы в целом, применяют метод декомпозиции, расчленяя исходную систему на ряд подсистем: строятся модели массообмена, кинетики роста биообъекта и биохимических процессов. К настоящему времени разработано много моделей массообмена, кинетики потребления субстрата и образования различных продуктов. Наиболее сложная задача – моделирование собственно биологических объектов, так как они значительно сложнее химических, физических и технических. Объекты биотехнологии способны к саморегулированию, их сложность усугубляется неоднородностью. Процессы, протекающие в биореакторе, зависят не только от сложных внутриклеточных факторов, но и от условий внешней среды; в свою очередь, внешние процессы в биологии связаны с внутренними, поэтому их разделить нельзя. Кроме этого, на данном этапе уровня развития математической биологии отсутствует теория, адекватная сущности биологических процессов. Пока не создан математический аппарат, способный описать природу биологических превращений во всем многообразии, то есть необходимо развитие и совершенствование самого математического аппарата. Математическое описание биологических объектов дополнительно осложняется их недостаточной изученностью. Поэтому на данном этапе возможно достаточно упрощенное и приближенное математическое описание биологических объектов, это направление нуждается в существенном совершенствовании. Оптимизация биотехнологических процессов осуществляется на основе сочетания экспериментального и математического моделирования и применения современных методов оптимизации (динамического и нелинейного программирования, вариационного исчисления). Однако в настоящее время для оценки оптимальности биотехнологических процессов трудно даже подобрать критерии. При оптимизации в биотехнологии необходимо учитывать ограничения, связанные с экономическими и конструктивными условиями, возможностями контрольно-измерительной аппаратуры и средств управления, экологическими требованиями и др. Моделирование и оптимизация биотехнологических процессов – задача сложная и во многом еще не решенная. Однако именно разработка адекватных моделей различных биотехнологических процессов и на их основе создание совершенных методов оптимизации и управления – важнейшее направление биотехнологии, без которого невозможен прогресс.
Глава 2. ПРОМЫШЛЕННАЯ МИКРОБИОЛОГИЯ: ПРОЦЕССЫ ПРОИЗВОДСТВА ПОЛЕЗНЫХ ВЕЩЕСТВ
Промышленная микробиология – это наука о получении различных целевых продуктов на основе жизнедеятельности микроорганизмов. Промышленная микробиология (или техническая микробиология) в настоящее время представляет собой также самостоятельную и наиболее крупнотоннажную отрасль современной промышленной биотехнологии. Огромное разнообразие микроорганизмов, утилизирующих в качестве ростовых субстратов различные соединения, в том числе отходы, позволяет получать широкий спектр биологически активных соединений, а также осуществлять полезные для человека реакции, включая обезвреживание отходов, трансформацию и получение энергии, и многое другое.
В настоящее время в различных процессах промышленной микробиологии получают около 200 соединений, обладающих коммерческой ценностью. Важнейшими среди них являются: алкалоиды, аминокислоты, антибиотики, антиметаболиты, антиоксиданты, белки, витамины, гербициды, инсектициды, коферменты, липиды, нуклеиновые кислоты, органические кислоты, пигменты, ПАВ, полисахариды, полиоксиалканоаты, противоопухолевые агенты, растворители, сахара, стерины, ферменты, нуклеотиды, нуклеозиды, эмульгаторы.
2.1. БЕЛОК ОДНОКЛЕТОЧНЫХ
Наиболее дефицитным компонентом пищи является белок, в особенности, – высокой биологической ценности, то есть животного происхождения. Мировая потребность в белка в настоящее время удовлетворяется примерно на 40 %. Предполагается, что к 2000 году с ростом населения потребность в белке увеличится, при этом дефицит кормового белка возрастет до 147 %. Поэтому изыскание эффективных способов увеличения ресурсов белка для прямого или непрямого (через организм сельскохозяйственных животных) увеличения пищевых ресурсов является одной из основных задач научно-технического прогресса.
Нетрадиционным и принципиально новым способом получения белковых веществ является микробиологический синтез. По скорости роста микроорганизмы превосходят сельскохозяйственные культуры в сотни, а животных – в тысячи раз. Поэтому микробиологический синтез с большей эффективностью использует материальные и энергетические ресурсы, не требует больших земельных площадей и не зависит от погодных и климатических условий и не загрязняет окружающую среду ядохимикатами, так как не использует пестициды. Качество микробных белков близко белкам животного происхождения. Применение микробных белков в кормопроизводстве улучшает качество и усвояемость традиционных растительных кормов. Например, 1 т кормовых дрожжей обеспечивает экономию 5 т зерна и увеличивает продуктивность в животноводстве на 15–30 %. Современный средний завод по производству микробного белка мощностью 50 т/год и занимающий 0.2 га может обеспечить потребность в белке до 10 млн. человек. Сельскохозяйственные технологии для таких масштабов производства требуют до 16 тыс. га, засеянных пшеницей, либо содержание фермы с производительностью 400 поросят/день. В 60-е годы появился новый термин – «белок одноклеточных» (single cell protein, «SCP»), означающий целые неживые высушенные микробные клетки (водорослей, дрожжей, бактерий, грибов), предназначенные в качестве белкового продукта для кормовых и пищевых целей. Термин несколько условен, так как в микробных биомассах помимо белков существенную долю занимают другие компоненты – сахара, липиды, нуклеиновые кислоты. Белок одноклеточных должен удовлетворять ряду специальных требований. Главными являются: питательность, переваримость, экономическая эффективность. Питательность микробного белка, определяемая по химическому составу, близка традиционным белковым продуктам (табл. 2.1).
Таблица 2.1. Химический состав микробных биомасс и традиционных белковых продуктов (по Waterworth, 1982)
|
Состав, %
|
Водоросли
|
Нитчатые грибы
|
Дрожжи
|
Бактерии
|
Соя
|
Рыбная мука
|
|
Белок
|
47–63
|
31–50
|
47–56
|
72–83
|
45
|
64
|
|
Жиры
|
7–20
|
2–8
|
2–6
|
1–3
|
1
|
9
|
|
Зола
|
7
|
2
|
6
|
8
|
6
|
18
|
|
Лизин
|
2.4
|
1.5
|
4.2
|
4.1
|
2.8
|
4.0
|
|
Метионин- Цистеин
|
1.7
|
0.8
|
1.7
|
2.3
|
1.3
|
2.8
|
|
Нуклеиновые кислоты
|
3–8
|
9
|
6–12
|
8–16
|
нет
|
нет
|
Микробная биомасса питательна, если ее компоненты перевариваются ферментами пищеварительного тракта высших животных или человека. Препятствием этому могут быть клеточные стенки отдельных продуцентов, которые предварительно приходится разрушать, а также высокий уровень нуклеиновых кислот. Последние метаболизируются в организме животных и выводятся из организма с урини, следовательно, не представляют для высших животных опасности. Для человека такой уровень нуклеиновых кислот неприемлем, так как в ходе их усвоения возможно нарушение обмена веществ и возникновение патологических состояний. Поэтому для пищевых целей микробную биомассу предварительно обрабатывают, используя различные методы разрушения и денуклеотизации.
В технико-экономических показателях микробиологического синтеза белка определяющее значение имеют удельные затраты и стоимость сырья (до 50 % в структуре всех затрат) и энергозатраты (до 15–30 %). Поэтому важнейшим вопросом при разработке новых технологий получения белка одноклеточных вопрос доступности сырьевой базы. Доступность сырья подразумевает наличие различных резервных вариантов, позволяющих оперативно заменять и использовать различные источники сырья без существенного изменения качества получаемого продукта. В современных промышленных процессах используют как «чистое» сырье постоянного химического состава, так и комплексные соединения, включая отходы различных производств. Последнее наиболее выгодно экономически и имеет огромное значение для охраны окружающей среды.
Микроорганизмы способны усваивать различные углеродсодержащие субстраты, которые принято подразделять на несколько поколений:
Независимо от вида используемого сырья, типовая схема микробиологического производства белка включает получение и подготовку сырья, получение посевного материала, ферментацию, выделение, инактивацию, сгущение микробной биомассы, последующее высушивание и стандартизацию готового продукта. Большое значение имеет качество исходного посевного материала (инокулята). Инокулят получают из музейной культуры в несколько стадий с применением принципа масштабирования. Подготовленные инокулят, основной ростовой субстрат и все необходимые питательные компоненты вместе с воздухом подают в ферментер, в котором происходит основная стадия биотехнологического процесса – ферментационная. Стадия ферментации проводится в соответствии с Технологическим регламентом, разработанным для конкретного процесса, включая субстрат и тип продуцента, и сводится к дозированному поступлению в ферментер потоков питательных веществ и воздуха (или газовой смеси), стабилизации основных параметров процесса на заданных уровнях и своевременному отводу из аппарата отработанного воздуха, образующихся продуктов, а также тепла. Максимальные скорости синтеза белковых веществ микробными клетками реализуются при оптимальных условиях среды, когда удельная скорость роста близка к максимальной. Поэтому для получения белка одноклеточных биотехнологические процессы реализуют в проточном режиме, который позволяет стабилизировать практически все параметры стадии ферментации на уровнях, оптимальных для размножения клеток со скоростями роста, близкими к μmax, то есть в режиме белковой направленности биосинтеза. При производстве биомассы в качестве кормового белкового продукта, как правило, осуществляется режим незащищенной ферментации, то есть без соблюдения правил стерильности. Последнее оправдано как условиями ферментации (проточное культивирование), так и спецификой применяемых субстратов и штаммов-продуцентов, а также сферой применения конечного продукта. Получаемая на стадии ферментации суспензия с 1–2.5 % содержанием микробной биомассы по сухому веществу (АСВ), то есть 10–25 кг/м3, на постферментационной стадии подвергается сгущению в несколько этапов до 12–16 % АСВ и термообработке, в ходе которой в течение 10–40 минут при 75–90°C практически все клетки штамма-продуцента и сопутствующая микрофлора погибают. После стадии термообработки суспензию в вакуум-выпарных установках сгущают до концентрации 20–25 % АСВ и далее высушивают до остаточной влажности конечного продукта около 10 %. Далее мелкодисперсный порошок высушенных клеток гранулируют. Порошок или гранулят фасуют по 25–30 кг и затаривают в многослойные бумажные мешки.
Обязательным условием технологического процесса получения микробной биомассы является очистка газо-воздушных выбросов, которые образуются на стадии ферментации и постферментационной стадии и представляют собой большие объемы воздуха, загрязненного живыми микробными клетками, белковой пылью и другими продуктами микробного синтеза. Очистке подвергаются также большие объемы культуральной жидкости, образуемой после отделения клеточной биомассы. Очищенная жидкость используется в цикле оборотного водоснабжения технологической схемы производства.
Технология получения микробного белка является в настоящее время самой крупнотоннажной отраслью биотехнологии, производящей важнейшие кормовые препараты и белковые добавки для животноводства, звероводства, птицеводства, рыбоводства, а также белок пищевого назначения с использованием разнообразного сырья и субстратов.
Субстраты I-го поколения – углеводы
Идею использования биомассы микроорганизмов в качестве белковых компонентов питания с 1890 г. начал пропагандировать Дельбрюк, который вместе с коллегами разработал первый технологический процесс выращивания пивных дрожжей Saccharomyces cerevisiae на мелассе. Полученную дрожжевую биомассу рекомендовали использовать в качестве белковой добавки в пищевые продукты. Во время первой мировой войны мощность действующих в Германии установок по производству дрожжевого белка достигала 10 тыс. тонн/г. Получаемый продукт использовали главным образом, добавляя в мясные фарши. К середине 30-х годов производства дрожжей на гидролизатах отходов сельского хозяйства и деревообрабатывающей промышленности, сульфитном щелоке, барде гидролизных заводов стали появляться в разных странах. В России первый завод по производству кормовых дрожжей из отходов сельского хозяйства был пущен в 1935 г. Во время второй мировой войны биомасса пищевых дрожжей (Candida arborea и C. utilis) также была важным белковым компонентом питания в Германии. После второй мировой войны серия заводов по производству пищевых дрожжей на углеводном сырье производительностью 10–12 тонн в сутки была построена в разных странах.
В настоящее время в микробиологических производствах белка применяется различное сахаросодержащее сырье. Это отходы пищевой, молочной, спиртовой, сахарной и целлюлозной промышленности и продукты переработки растительного сырья (древесины, соломы, торфа, несъедобных частей растений – стебли, лузга, кочерыжки). Питательные среды, приготовленные на основе перечисленных субстратов, содержат наборы моно- и дисахаров, органические кислоты, спирты и другие органические соединения, а также минеральные элементы, то есть являются сложными многокомпонентыми субстратами. Поэтому при их применении используют штаммы-продуценты, способные, во-первых, усваивать как пентозы, так и гексозы, и, во-вторых, – устойчивые к присутствию спиртов, фурфурола и других продуктов гидролиза растительных биомасс. Наибольшее распространение получили виды дрожжей рода Candida: C. utilis, C. scottii, C. tropicalis, способные утилизировать наряду с гексозами пентозы и толерантные к наличию фурфурола в среде. Дрожжи утилизируют углеродсодержащие компоненты гидролизатов, сульфитного щелока, последовательно: глюкоза, уксусная кислота, манноза, ксилоза, галактоза, арабиноза. В зависимости от выбранной схемы культивирования дрожжей полнота использования перечисленных углеродсодержащих компонентов различна; максимальная – при использовании смешанных культур. Применяются две, наиболее эффективные, схемы соединения ферментационных аппаратов при совместном выращивании C. scottii и C. tropicalis: двухступенчатая последовательная и параллельно-последовательная. В первом варианте в качестве исходной питательной среды используют неразбавленный гидролизат (сусло) с концентрацией редуцирующих веществ (РВ) 30–35 г/л (по массе). В первом ферментере утилизируется около 70 % РВ, главным образом за счет легкоусвояемых гексоз, до остаточной концентрации РВ около 10–15 г/л, в основном, пентоз. Полученные в первом аппарате дрожжи выделяются из дрожжевой суспензии и подвергаются обработке до получения готового продукта; а отделенная культуральная жидкость поступает во второй аппарат, в котором оставшиеся пентозы утилизируются более приспособленными к ним другими штаммами дрожжей. По второму варианту используют два последовательно соединенных фермента: в первый поступает разбавленное сусло с концентрацией РВ около 15–18 г/л; в нем в ходе ферментации дрожжей утилизируются в основном гексозы. Далее дрожжевая суспензия поступает во второй аппарат, в котором без добавления субстрата происходит доутилизация оставшихся сахаров. Общий выход дрожжей достигает при этом 70–80 % по отношению к РВ.
Выращивание дрожжей на данных субстратах осуществляют в аппара- тах эрлифтного типа объемом от 300 до 600 м3 с вводом воздуха в нижнюю зону аппарата при избыточном давлении 40–60 КПа. В процессе насыщения питательной среды воздухом образуется газожидкостная эмульсия, циркулирующая по всему объему аппарата, обеспечивающая эффективное перемешивание среды. Для борьбы с образующейся при аэрации пеной используют механическое пеногашение. Рабочий объем аппарата составляет около 70 % от общего объема. На отдельных предприятиях применяют также барботажно-эрлифтные ферментеры большего объема, до 1300 м3 с воздухораспределением по нескольким, обычно 4–5 зонам.
Процесс выращивания дрожжей осуществляется в непрерывном режиме при скорости протока среды, равной 0.20–0.25 ч-1, рН 4.2–4.6; температура среды составляет в зависимости от используемых штаммов от 30–35 до 38–40°С. Сдвиг рН в кислую сторону в ходе ферментации дрожжей автоматически корректируется подтитровкой среды аммиачной водой. Для отвода образующегося в ходе ферментации тепла в составе аппаратов применяют теплообменные устройства в виде змеевиков, через которые циркулирует охлажденная вода. Суспензия, сливаемая из аппарата, с содержанием дрожжей от 20 до 40 г/л и влажностью 75 %, поступает на стадию обработки и концентрирования, в ходе которой подвергается флотации, трехступенчатой сепарации, термообработке и высушиванию. Для обогащения дрожжевой биомассы витамином D2 дрожжи облучают ультрафиолетом, под воздействием которого содержащийся в липидной фракции клеток эргостерин превращается в витамин. Для этого сгущенную суспензию дрожжей прокачивают по кварцевым трубкам. Содержание витамина D2 достигает 5000 МЕ/1 г АСВ. В составе биомассы дрожжей (%): белок – 43–58, липиды – 2–3, углеводы – 11–23, зола – 11, остаточная влажность – не более 10. Выход товарных дрожжей на продуктах переработки отходов древесины составляет 46–48 %. Это соответствует выходу 240 кг АСБ дрожжей с 1 т отходов, при том экономический коэффициент использования субстрата составляет 0.4–0.6, затраты углеводов на получение биомассы – около 2 т, кислорода – 0.7–1.0 т/т. Удельная производительность аппаратов – 15–20 кг/м3 в сутки при расходе электроэнергии 600–800 кВт ч.
Наращивание объемов производства кормовых дрожжей на гидролизатах древесины сдерживается существующим уровнем технологий химического гидролиза растительного сырья. Некоторые преимущества имеют процессы получения кормовых дрожжей на предприятиях целлюлознобумажной промышленности, так как отходы данного производства (сульфитный щелок, предгидролизат) имеют сравнительно низкую себестоимость. Выход дрожжей из 1 т целлюлозы достигает 37 кг при комплексном получении дрожжей и спирта и 96 кг – при получении только дрожжей. Производительность процесса составляет 2.4 кг/м3 ч, содержание сырого протеина в биомассе – 48 %.
Представляется перспективным привлечение в качестве субстрата для получения кормовых дрожжей продуктов совместного гидролиза растительного сырья и ила очистных сооружений. При этом питательная среда дополнительно обогащается аминокислотами растительного и животного происхождения. Это увеличивает выход дрожжей и содержание в них белка. Сырьевая база производства микробного кормового белка расширяется также за счет использования гидролизатов торфа, которые содержат в больших количествах легкоусвояемые моносахара, а также органические кислоты. Выход дрожжей достигает 65–68 % от РВ гидролизатов, при этом качество дрожжевой биомассы превосходит дрожжи, выращенные на гидролизатах отходов растительного сырья.
Среди новых источников сырья большой интерес представляют так называемые возобновляемые ресурсы углеводов, получаемые из лигнин-целлюлозных материалов. Данные материалы с целью осахаривания подвергают обработке с использованием традиционных физических и химических, а также биотехнологических методов, например, на основе целлюлолитических ферментов или микробных клеток. Микробные клетки (дрожжи, бактерии, грибы белой гнили) в процессе роста разлагают целлюлозу и обогащают получаемый белковый продукт аминокислотами. Круг таких продуцентов расширяется за счет быстрорастущих представителей не только дрожжей, но и грибов и бактерий, например родов Trichoderma, Cellulomonas, Aspergillus и Alcaligenes, обладающих по сравнению с дрожжами более высокими скоростями роста и лучшим набором аминокислот.
Субстраты II-го поколения – жидкие углеводороды
Способность микроорганизмов использовать в качестве основного ростового субстрата углеводороды была доказана Таусоном в 1935 г. Интенсивные научные исследования углеводородов в качестве потенциального субстрата для получения белка одноклеточных были развернуты в 50–60-е годы ХХ столетия. Было установлено, что микроорганизмами могут усваиваться практически все классы углеводородов, включая прямогонные дизельные фракции, очищенные жидкие парафины, масляные дистилляты и другие нефтепродукты, содержащие n-парафины, но с наибольшими скоростями утилизируются углеводороды нормального строения с длиной углеродной цепи С11–С18, вскипающие при 200–320°.
В качестве штаммов-продуцентов белка одноклеточных на углеводородах наибольшее распространение получили дрожжи рода Candida: C. guilliermondii, C. maltosa, C. scottii. Полученные в результате селекционно-генетической работы быстрорастущие штаммы устойчивы к вытеснению другими микробными видами в условиях нестерильной промышленной культуры.
Углеводороды проникают в микробные клетки через липидную фракцию клеточной стенки, имеющей гидрофобную структуру, до цитоплазматической мембраны по градиенту концентрации. Микробиологическое окисление n-парафинов включает несколько этапов. В результате первичного окисления углеводородов образуются спирты:
R → (CH2)n → CH3 + O2 + НАД →-2H+→
R → (CH2)n → CH2ОН +O2 + НАД H2.
Спирты далее с участием алкогольдегидрогеназы окисляются до альдегидов, которые альдегиддегидрогеназой окисляются до кислот. Далее в реакциях β-окисления при участии ацетил-КоА образуются соответствующие производные кислот, которые при участии ацетилгидрогеназы окисляются с образованием соединений с двойной углеродной связью:
R – CH2 – CH2 – СO – S – KoA →-2H+→ RH = CH – CO – S – KoA.
Далее ненасыщенное соединение гидратируется, превращаясь в β-кислоту:
RH = CH – CO – S – KoA →H2O→ R – СНОН – СН2 – СО – S – КоА,
которая восстанавливается до кетокислоты:
R – СНОН – СН2 – СО – S – КоА → R – СО – СН2 – СО – S – КоА.
Реакции β-окисления завершаются при участии α-кетоацетилтиолазы с образованием ацетил-КоА и жирной кислоты с укороченной на 2 атома углерода цепью по сравнению с исходной кислотой:
R – СО – СН2 – СО – S – КоА + НS – КоА →
→ R – СО – S – КоА – СН3 – СО – S – КоА.
Ацетил-КоА-эфир жирной кислоты снова вступает в реакции β-окисления.
При получении белковой биомассы на углеводородах имеются существенные ограничения, так как в исходных парафинах могут присутствовать циклические углеводороды. Поэтому в качестве сырья могут быть использованы только высокоочищенные парафины с содержанием ароматических углеводородов не более 0.01 %. Парафины не растворяются в воде, поэтому культивирование на данном субстрате осуществляется в эмульсии, представляющей собой мелко диспергированные в среде капли углеводородов диаметром не более 5 мкм. В данном случае культура является четырехфазной системой («газ – жидкость – жидкие углеводороды – микробные клетки»). Кроме перемешивания на эффективность диспергирования углеводородов оказывает влияние также поверхностное натяжение, поэтому очень важен состав и реологические свойства питательной среды.
Парафины служат только источником энергии и углерода для микроорганизмов, поэтому все необходимые для роста дрожжей макро- и микроэлементы дозируют в питательную среду в соответствии с потребностями в них культуры. В питательную среду вводятся сульфат аммония, суперфосфат, хлорид калия и раствор микроэлементов, а также ПАВ для снижения поверхностного натяжения и повышения скорости роста дрожжей. Используемая для коррекции рH среды аммиачная вода является также дополнительным источником азота. Содержание парафинов в исходной питательной среде на стадии ферментации составляет 3–5 %. С увеличением концентрации углерода потребности культуры в кислороде возрастают, так как утилизация углеводородов клетками осуществляется в режиме интенсивной аэрации. Потребности углеводород-ассимилирующих дрожжей в кислороде в 2.6–2.8 раза выше по сравнению с процессом на углеводах. Расход воздуха составляет от 20 до 50 м3 на 1 кг АСВ дрожжей.
Эффективный процесс получения белка одноклеточных на жидких углеводородах реализуется в ферментах типа Б-50, представляющих собой 12-секционный аппарат в виде тора общим объемом 800 м3 при рабочем объеме 320 м3. Каждая секция аппарата снабжена перемешивающим устройством в виде самовсасывающей мешалки турбинного типа и эжекционным устройством. Суспензия в ходе ферментации последовательно проходит все секции. При этом в 1–9 секциях реализуется активный рост клеток при непрерывном поступлении углеродного субстрата; в последних трех – так называемая стадия «дозревания», в ходе которой подача субстрата прекращается и происходит окисление и доутилизация дрожжами остаточных углеводородов. Такой режим позволяет практически полно утилизировать субстрат и получить продукт с допустимым уровнем остаточных углеводородов (не более 0.01 %). Окисление углеводородов с большими затратами кислорода сопровождается большим тепловыделением (2.5–3.5 ккал/кг). Поэтому система отвода тепла представляет собой встроенные теплообменники с поверхностью до 3000 м3 на каждую секцию. Время пребывания культуры в аппарате составляет около 8 ч, скорость протока среды – до 0.22 ч–1 при стабилизации рН на уровне 4.0–4.5, температуры – 32–34°С. Производительность процесса достигает 27 т в сутки, экономический коэффициент по углеводородам – 1.0–1.2, затраты углеводородов – 0.9–1.0 т, кислорода – 2.4–2.8 т/т АСВ. Готовый продукт, БВК, полученный на углеводородах, содержит (%): сырой протеин – до 60, жиры – 5, углеводы – 10–20, зола, влага – до 10; витамин D2 – до 4000 м.е. и витамины группы B.
К середине 70-х гг. технологии получения белка одноклеточных на углеводородах были разработаны всеми развитыми странами. Крупнотоннажные производства БВК были созданы в СССР, Италии, Румынии, Франции. В 1980 г. объемы производства составили: СССР около 1.0 млн. т/г; 20 000 т/г во Франции; 300 000 т/г в Италии; 1500 т/г в Румынии, 5000 т/г в Великобритании. Однако это направление производства белка одноклеточных не получило развития, за исключением России, так как стоимость БВК из углеводородов пока не удалось снизить до уровня традиционных кормовых продуктов (соевой и рыбной муки).
Субстраты III-го поколения – оксидады углеводородов, газообразные углеводороды, углекислота, водород
Перспективными видами сырья для крупнотоннажного получения микробного белка принято считать спирты, природный газ, водород.
Масштабы производства, технологичность низших спиртов и качество получаемого микробного белка выдвинули метанол и этанол в разряд наи- более перспективных субстратов. Исследование процессов микробного синтеза на спиртах с середины 70-х годов были развернуты всеми развитыми странами. Было показано, что способность усваивать метанол присуща как дрожжам (рода Hansenula, Candida), так и бактериям (Pseudomonas, Methylomonas).
Усвоение метанола микроорганизмами происходит в результате 3-х последовательных стадий через формальдегид и формиат до углекислоты:
СН3ОН → НСОН → НСООН → О2.
Преимущества метанола по сравнению с жидкими углеводородами состоят в прекрасной растворимости в воде, высокой чистоте и отсутствии канцерогенных примесей, высокой летучести. Это позволяет легко удалять его остатки из готового продукта на стадии термообработки и высушивания. Тепловыделение в ходе ферментации на метаноле также существенно ниже вследствие химического строения спиртов и наличия в их составе кислорода. Биологическая активность спиртов, проявляющаяся по отношению к посторонней микрофлоре, является дополнительным фактором, обеспечивающим доминирование в культуре производственных штаммов-продуцентов. Однако горючесть спиртов и возможность образования с воздухом взрывоопасных смесей (диапазон концентраций 6–35 % объемных), а также токсичность требуют специальных мер, обеспечивающих безопасный режим работы.
Питательная среда, помимо спирта (8–10 г/л), содержит все необходимые для нелимитированного роста клеток, элементы питания. Помимо традиционных макро- и микроэлементов в среду в качестве дополнительного источника азотного питания и витаминов вводят дрожжевой экстракт (50 мг/л).
Типы используемых режимов ферментации и аппаратуры определяются физиологической спецификой штамма-продуцента. При выращивании дрожжей (C. boidinii, H. polymorpha) в условиях асептической или частично неасептической ферментации применяются аппараты с вводом энергии жидкой фазой с эжекционными устройствами. Температура культивирования составляет 34–37°C, рН – 4.2–4.6, скорость протока среды – 0.12-0.16 ч-1, экономический коэффициент по метанолу – 0.4. Производительность аппаратов достигает 75 т АСВ в сутки при концентрации клеток в суспензии до 30 г/л. Затраты метанола на синтез биомассы составляют около 2.5 т/т. Получаемые на метаноле дрожжи имеют следующий состав (%): сырой протеин – 56–62, липиды – 5–6, нуклеиновые кислоты – 5–6, зола – 7–11, влажность – не выше 10.
При использовании в качестве продуцента белка одноклеточных бактериальных форм (Methylomonas clara, Ps. rosea) для ферментации используют струйные аппараты производительностью 100–300 т АСВ в сутки. Процесс проводят при 32–34°С, рН 6.0–6.4, скорости протока среды 0.5 ч-1. Экономический коэффициент по метанолу достигает 0.45, то есть его затраты на получения конечного продукта снижаются до 2.2 т/т. Бактериальная биомасса по сравнению с дрожжевой содержит больше азотсодержащих компонентов (%): сырого протеина – до 74, нуклеиновых кислот – 10–13.
Высокоочищенным субстратом для получения микробного белка пищевого назначения является этанол. Наиболее продуктивные производственные штаммы дрожжей (C. utilis, Hancenula anomala) обеспечивают получение белкового продукта пищевого назначения с содержанием белка до 60 % при скорости протока среды 0.14 ч-1 и экономическим коэффициентом по этанолу 0.40–0.45. До недавнего времени вопрос о реализации процесса получения микробного белка на спиртах в промышленных масштабах не казался злободневным из-за достаточно высокой отпускной цены на данный субстрат. Однако в связи с разработкой в последние годы более эффективных технологий получения спиртов и повышением спроса на белковые продукты данная технология становится перспективной.
В 70-е годы с поиском новых доступных источников сырья стали рассматривать возможности привлечения для получения микробного белка газообразных углеводородов, главным образом, – метана, источником которого служит широко распространенный природный газ. Природный газ, помимо сравнительно низкой стоимости и доступности, характеризуется отсутствием ингибирующих рост микроорганизмов примесей, позволяет получать сравнительно большие выходы биомассы и не требует специальной очистки ни исходного сырья, ни получаемой биомассы. Продуцентами микробного белка на метане являются бактерии родов Methylococcus, Pseudomonas, Mycobacterium, Methanomonas, которые утилизируют метан в качестве источника углерода и энергии, окисляя его через ряд последовательных стадий через спирт и альдегид до углекислоты:
СН4 → СН3ОН → НСОН→ НСООН → СО2.
При использовании метана возникает ряд существенных технологических проблем в связи с особенностями метана как субстрата роста. Метан поступает из газовой фазы и имеет низкую растворимость (до 0.02 г/л при нормальном давлении), поэтому скорость его растворения в культуре яв- ляется лимитирующим фактором, определяющим скорость роста продуцента. Синтез биомассы сопровождается выделением в околоклеточную среду промежуточных продуктов окисления метана (до 0.2–0.6 г углерода на 1 г синтезированной биомассы), ингибирующих развитие основного производственного штамма. Поэтому используют микробную ассоциацию, в составе которой, помимо метанотрофов, развиваются 5–6 гетеротрофных видов, утилизирующих продукты неполного окисления метана. В связи с высокой восстановленностью метана для его микробного окисления требуется большое количество кислорода (в 5 раз больше, чем на углеводах и в 2–3 раза больше, чем при окислении жидких углеводородов). Поэтому процесс требует сложного аппаратурного оформления стадии ферментации. Выращивание метанотрофных бактерий осуществляется в проточной культуре при 34–38°С и нейтральных значениях рН среды. Питательная среда содержит обычный набор минеральных элементов; источником азота служит как восстановленая, так и окисленные формы. При использовании олигонитрофильных микроорганизмов концентрация азота в среде низка (20–30 мг/л). Потребности в кислороде у микробных клеток в 2–3 раза превышает их потребности в метане. Однако из-за взрывоопасности субстрата стехиометрическое соотношение данных газов принимается не оптимальным для развития бактерий, и процесс реализуют при лимите по кислороду и избытке метана.
Для выращивания метанотрофных бактерий используют аппараты со струйным диспергированием газовой среды, имеющие высокие массообменные характеристики. Для более полного усвоения метана применяют рециркуляцию газовой смеси, повышение рабочего давления в аппарате, а также использование вместо воздуха кислорода. Это позволяет повысить степень утилизации газового субстрата до 95 %. Скорость протока среды в ходе ферментации составляет 0.25–0.30 ч–1; концентрация клеток в культуре на выходе из ферментера не превышает 10 г/л. Затраты субстрата на 1 т биомассы составляют для метана и кислорода 1.8–2.2 и 4.5–5.0 т соответственно. Биомасса содержит (%): сырой протеин – до 75, нуклеиновые кислоты – 10, липиды – 5, зола – до 10, влажность – не выше 10. Получаемый белок по содержанию и соотношению аминокислот близок к рыбной муке и соевым шротам.
Крупнотоннажное производство белка одноклеточных на природном газе реализовано в России. Технологию и данный субстрат прогнозно считают перспективными. Однако рентабельность и развитие этого направления во многом будут зависеть от возможности совершенствования аппаратурного оформления и интенсификации процесса.
Принципиально новым направлением в изыскании перспективных продуцентов белка является привлечение фотоавтотрофных организмов, использующих в качестве углеродного источника углекислоту, а энергии – свет. Исследования водорослей в качестве возможных продуцентов белка проводят несколько десятилетий. Внимание к водорослям определяется способом их питания, химическим составом биомассы, технологичностью.
Процесс прироста биомассы водорослей происходит за счет фотосинтеза, поэтому главным фактором, определяющим эффективность, является освещенность. С середины 60-х в качестве перспективных биосинтетиков белка активно рассматривали водоросли (Chlorella, Scenedesmus). Однако эти надежды не оправдались из-за малой доступности данных биомасс (неперевариваемые клеточные стенки, необходимость дезинтеграции клеток и очистки белков от токсичного хлорофилла и др.), а также низкой энергетической эффективности фотосинтеза.
Эффективным белковым продуктом оказались цианобактерии рода Spirulina, растущие в природных условиях и способные фиксировать атмосферный азот. Биомасса Spirulina содержит (%): до 70 белков, полноценного аминокислотного состава, 19 углеводов, 4 нуклеиновых кислот и 4 липидов, 6 пигментов и по 3 золы и волокон. Клеточная стенка имеет отличный от микроводорослей состав и легко переваривается. Низкий уровень нуклеиновых кислот в биомассе, нетоксичность пигментов фикоцианинов, высокий уровень переваримого белка, – все это сделали данную биомассу полноценным белковым продуктом пищевого назначения. При метаболизме белков спирулины в организме человека не образуется холестерина, поэтому данный белок стали рассматривать в качестве компонента диетического питания.
Первые упоминания о спирулине относятся к началу XVI, когда на базарах в окрестностях Мехико продавали в виде галет высушенную Spirulina maxima, растущую в естественных условиях в щелочном озере Текскоко. В середине XIX века бельгийская экспедиция через Сахару на деревенских базарах в районе озера Чад также обнаружила сине-зеленые галеты, представляющие собой высушенную биомассу другой популяции – Spirulina platensis, растущей в шелочных прудах, окружающих озеро. Спирулина растет практически как монокультура, так как рН озерной воды в местах ее естественного обитания достигает 10.5–11.0. Благодаря наличию в клетках наполненных газом вакуолей и спиральной форме филаментов, клубки водорослей всплывают на поверхность, и ветер выносит их на берег. Время удвоения биомассы спирулины составляет около 3–4 дней, и собирать урожай можно круглосуточно. В оптимальных условиях выход биомассы составляет до 20 г АСВ/м2 в сутки. Это на порядок превышает урожаи пшеницы, при этом качество получаемого белка существенно выше растительного (табл. 2.2).
Таблица 2.2. Сопоставление продуктивности высших растений и Spirulina (по А. Сассону, 1987)
|
Продуцент
|
Выход, т/га/год
|
|
|
Вес (АСБ)
|
Неочищенный белок
|
|
|
Пшеница
|
4
|
0.5
|
|
Кукуруза
|
7
|
1.0
|
|
Соевые бобы
|
6
|
2.4
|
|
Spirulina
|
50
|
35.0
|
Эксперименты по исследованию биологической ценности спирулины, выполненные Французским институтом нефти совместно с компанией «Соса Текскоко», завершились в 1973 г. созданием первой опытной фабрики. К 1982 г. производство достигло 1000 т/г. Главными импортерами продукта (мука, таблетки) являются Япония, США, европейские страны. Аналогичные производства по выращиванию спирулины в искусственных условиях планируют Франция, Италия. В Израиле близ г. Хайфа на болотах площадью 12 000 м2 выращивают водоросль Spirulina platensis для кормовых и пищевых целей. Генетическое усовершенствование имеющихся штаммов Spirulina может существенно повысить их урожайность. Получены мутанты, у которых при сохранении скорости роста пул аминокислот может быть существенно выше, чем у исходного. Показана возможность выращивания спирулины в искусственных щелочных прудах, а также в отходящих теплых водах теплостанций.
В середине 70-х годов активизировались исследования, направленные на разработку технологий получения микробного белка с использованием хемолитоавтотрофных микроорганизмов. Хемолитоавтотрофные водородокисляющие бактерии, использующие в качестве источника углерода углекислоту, а энергии – реакцию окисления водорода, в середине 70-х годов привлекли внимание биотехнологов. Окисление водорода с образованием биомассы (символ биомасссы - СН2О) реализуется по схеме:
6Н2 + 2О2 + СО2 = (СН2О) + 5Н2О,
Перспективность водородокисляющих бактерий определяется их автотрофией и независимостью от дефицитных источников органического сырья, быстрым ростом, высоким содержанием полноценного по аминокислотному составу белка, отсутствием внеклеточных промежуточных продуктов обмена органической природы (единственным побочным продуктом процесса окисления водорода является вода), высокой экологической чистотой процесса производства и получаемого продукта. В качестве источника водорода, помимо электролизного, могут быть использованы различные водородсодержащие газы, включая синтез-газ и отходы ряда химических и нефтехимических производств, а углекислоты – топочные газы и экспанзерная углекислота биохимических производств. Таким образом, производство белка одноклеточных на основе водородокисляющих бактерий может выполнять функции очистного сооружения. Вместе с тем данная технология по ряду показателей (труднорастворимый и взрывоопасный газовый субстрат) имеет ограничения аналогично способу получения белка одноклеточных на метане. Технология получения микробного белка на основе водородных бактерий, реализованная на уровне опытного производства и имеет следующие характеристики при незащищенной проточной ферментации в аппаратах с вводом энергии жидкой фазой, оснащенных эжекторами или самовсасывающими турбинными мешалками (1500 об./мин.): скорость протока среды 0.4 ч–1, концентрация клеток в культуре – 10–20 г/л; затраты водорода – 0.7, углекислоты – 2.0, кислорода – 3.0 т на 1 т АСВ биомассы.
В настоящее время по сравнению с легкодоступным и сравнительно дешевым природным газом биотехнология на основе водорода считается менее доступной для организации крупнотоннажного производства белка одноклеточных. Однако в связи с прогнозами развития водородной энергетики и высокой экологической чистотой данный процесс, несомненно, представляется перспективным.
Таким образом, для эффективного восполнения имеющегося дефицита белка могут быть реализованы различные нетрадиционные биотехнологии с привлечением разнообразных субстратов и штаммов-продуцентов. История микробного белка только начинается, и если сегодня белки одноклеточных принципиально не могут решить проблему существующего белкового дефицита, в последующие годы они будут играть все большую роль в жизни человека.
2.2. АМИНОКИСЛОТЫ
Аминокислоты с каждым годом находят все большее применение в качестве кормовых и пищевых добавок и приправ, сырья фармацевтической и парфюмерной промышленности. Все аминокислоты, из которых состоят белки, являются L-формами. Из 20 аминокислот – 8 (изолейцин, лейцин, лизин, метионин, треонин, триптофан, валин, фенилаланин) незаменимы для человека. Для сельскохозяйственных животных этот список дополняют гистидин и аргинин, а для молодняка птицы – еще и пролин. Поэтому в больших количествах аминокислоты употребляют для балансировки кормов. Введение в состав комбикормов аминокислот сокращает расход де- фицитных белков животного происхождения. За последние 10 лет количе- ство аминокислот, используемых в кормопроизводстве, возросло в 15 раз. Это составляет около 70 % от объема их производства. Около 30 % произ- водимых аминокислот используется в пищевой промышленности. Так, цистеин предотвращает пригорание пищи в процессе приготовления, улучшает качество хлеба при выпечке, усиливает запах пищи. Глицин, обладающий освежающим, сладковатым вкусом, используется при производстве напитков. Глутаминовая кислота – для усиления вкуса и консервирования пищи. Ряд аминокислот (аргинин, аспартат, цистеин, фенилаланин и др.) используют в медицине. Аминокислоты широко используются в химической и фармацевтической промышленности в качестве предшественников для производства детергентов, полиаминокислот, полиуретана и препаратов для сельского хозяйства.
Получение аминокислот возможно несколькими путями: химическим синтезом, гидролизом природного белкового сырья и в биотехнологических процессах. Химический синтез дает рацемат – продукт, содержащий как L-, так и D-формы аминокислот. За исключением глицина, который не имеет оптически активных изомеров, и метионина, усваяемого организмами в обеих формах, D-изомеры обладают токсичностью. Получение оптически активных L-изомеров аминокислот из гидролизатов природных материалов растительного и животного происхождения связано с многоступенчатой и дорогостоящей очисткой. Биотехнологическое получение аминокислот включает в себя прямую микробную ферментацию, а также микробиологический или ферментативный синтез из предшественников.
Микробиологический метод получения аминокислот, наиболее распространенный в настоящее время, основан на способности микроорганизмов синтезировать все L-аминокислоты, а в определенных условиях – обеспечивать их сверхсинтез. Биосинтез аминокислот в микробных клетках протекает в виде так называемых свободных аминокислот или «пула аминокислот», из которого в процессах конструктивного метаболизма синтезируются клеточные макромолекулы. Для синтеза всех белков требуется 20 аминокислот. Пути синтеза большинства аминокислот взаимосвязаны. При этом одни аминокислоты являются предшественниками для биосинтеза других. Пируват является предшественником аланина, валина, лейцина; 3-фосфоглицерат – серина, глицина, цистеина; щавелево-уксусная кислота – аспартата, аспарагина, метионина, лизина, треонина, изолейцина; α-кетоглутаровая кислота – глутамата, глутамина, аргинина, пролина; фосфоэнолпируват+эритрозо-4-фосфат – фенилаланина, тирозина, триптофана; 5-фосфорибозил-1-пирофосфат + АТФ – гистидина. Синтез каждой аминокислоты в микробных клетках реализуется в строго определенных количествах, обеспечивающих образование последующих аминокислот, и находится под строгим генетическим контролем. Контроль осуществляется по принципу обратной связи на уровне генов, ответственных за синтез соответствующих ферментов (репрессия), и на уровне самих ферментов, которые в результате избытка образующихся аминокислот могут изменять свою активность (ретроингибирование). Данный механизм контроля исключает перепроизводство аминокислот и также препятствует их выделению из клеток в окружающую среду. Чтобы добиться сверхсинтеза отдельных аминокислот, нужно обойти или изменить данный контрольный механизм их синтеза. Для первого пути возможно использование природных «диких» штаммов; очень существенны при этом условия ферментации, так как добиться дисбаланса в системе синтеза аминокислот можно путем изменения ряда основных факторов среды (концентрация основного субстрата, рН, соотношение макро- и микроэлементов в среде и др.). Изменение контрольного механизма синтеза аминокислот осуществляется генетическими методами. При этом получают мутантные организмы: ауксотрофные и регуляторные мутанты. Ауксотрофные мутанты – это организмы, утратившие способность к синтезу одной или нескольких аминокислот.
Среди продуцентов аминокислот – различные микроорганизмы, представители родов Corynebacterium, Brevibacterium, Bacillus, Aerobacter, Microbacterium, Eschirichia. Используемые в промышленности микроорганизмы можно подразделить на несколько классов: дикие штаммы, ауксотрофные мутанты, регуляторные мутанты и ауксотрофные регуляторные мутанты. Промышленные штаммы, как правило, несут несколько мутаций, затрагивающих механизмы регуляции целевой аминокислоты и ее предшественников.
Для получения таких аминокислот, как L-глутамата, L-валина, L-аланина, L-глутамина и L-пролина возможно применение природных штаммов и усиление у них продукции аминокислот условиями ферментации. Например, высокий, до 30 г/л, выход глутамата возможен при полном или частичном подавлении активности a-кетоглутаратдегидрогеназы, добавках в среду ПАВ и антибиотиков (пенициллина, цефалоспорина) для увеличения проницаемости клеточных мембран для глутамата. Синтез L-глутамата можно переключить на образование L-глутамина или L- пролина, изменяя условия ферментации. При повышении концентрации ионов аммония и биотина в среде стимулируется образование L-пролина; слабо кислая среда и ионы цинка при избытке аммония усиливают синтез L-глутамина.
Ауксотрофные мутанты используют в тех случаях, когда необходимо синтезировать аминокислоты, являющиеся конечными продуктами разветвленных цепей метаболических реакций аминокислот. Например, для получения L-лизина, L-треонина, L-метионина или L-изолейцина, для которых общим предшественником является L-аспартат, применяют мутанты, ауксотрофные по гомосерину или треонину и гомосерину. Ауксотрофные мутанты не способны образовывать ингибиторы соответствующего метаболического пути, работающие по принципу отрицательной обратной связи из-за отсутствия определенной ключевой ферментативной реакции. Поэтому при выращивании такого штамма в среде с минимальной концентрацией необходимого ингредиента (аминокислоты) они способны на суперпродукцию аминокислоты-предшественника. Ауксотрофные мутанты, способные накапливать конечные продукты неразветвленных цепей биосинтеза, например L-аргинина, невозможны. В данной ситуации приходится получать мутанты с частично нарушенной регуляцией биосинтеза, так как это позволяет повысить выход целевого продукта. Такие организмы являются регуляторными мутантами.
Регуляторные мутанты отбирают по устойчивости к аналогам аминокислот либо среди ревертантов ауксотрофов. Аналоги аминокислот выступают в роли искусственных ингибиторов ферментов, работающих по принципу обратной связи, одновременно обеспечивая биосинтез требуемых аминокислот и подавляя процесс их включения в белки. Так, серусодержащий аналог лизина S-(2-аминоэтил)-L-цистеин является у Brevibacterium flavum ложным и действует ингибитором аспартаткиназы по принципу обратной связи. Поэтому устойчивые к его действию мутанты, у которых выход лизина достигает 33 г/л, синтезируют фермент, в 100 раз менее чувствительный к ингибированию по механизму обратной связи, по сравнению с исходным штаммом. Регуляторные мутанты получают путем трансдукции, проводя при этом отбор сначала отдельных мутаций, вызывающих полное рассогласование механизмов регуляции, а затем объединяя данные признаки путем котрансдукции. В результате этого, у одного штамма можно последовательно закрепить устойчивость к нескольким аналогам.
В последние годы для получения новых эффективных штаммов- продуцентов аминокислот стали применять новейшие методы биотехнологии. Методы генетической инженерии позволяют повышать количество генов биосинтеза путем их клонирования на плазмидах. Это приводит к увеличению количества ферментов, ответственных за синтез аминокислот, следовательно, повышает выход целевого продукта. Клонирование генов системы синтеза аминокислот в клетки микроорганизмов с иным, по сравнению с донорским организмом, типом питания позволяет расширять сырьевую базу и заменять дорогостоящие сахаросодержащие субстраты более дешевыми.
Производственные биотехнологические процессы получения аминокислот реализуются в условиях глубинной аэробной периодической ферментации. Скорость синтеза аминокислот не совпадает во времени со скоростью роста производственной культуры (рис. 2.1).

Рис. 2.1. Основные показатели культуры Corynebacterium glutamaticum при синтезе глутаминовой кислоты (по А. М. Безбородову, 1989). 1 – глюкоза, 2 – кетоглутаровая кислота, 3 – биомасса, 4 – глутаминовая кислота.
Максимальная продукция аминокислоты наступает, как правило, когда прирост биомассы практически прекращается. Поэтому питательная среда на первом этапе ферментации должна обеспечивать сбалансированный рост клеток; а на втором – условия для сверхсинтеза целевой аминокислоты. В качестве источника углерода и энергии используют богатые сахаросодержащие субстраты, главным образом, мелассу. Возможно также привлечение более доступных субстратов (ацетат, сульфитный щелок, углеводороды). В зависимости от таксономического положения и физиологических потребностей микроорганизмов в качестве источника азота используют соли аммония, нитраты, а также аминокислоты и молекулярный азот. В состав среды вносят необходимые количества углерода и азота, фосфатов и других солей, а также стимуляторы роста (витамины, дрожжевой экстракт), ПАВ, антибиотики. Периодический режим ферментации и богатая по составу среда требуют соблюдения строгой стерильности в ходе получения инокулята и на ферментационной стадии. Стерилизации подвергаются питательная среда, воздух и все технологическое оборудование. После стадии ферментации в процессе обработки культуральной жидкости клетки отделяют от раствора, который далее подвергают очистке от окрашенных примесей и взвешенных частиц с помощью сорбционных методов. Далее процесс проводится с использованием различных методов выделения и очистки в зависимости от сферы применения конечного продукта. Для фармакологии и пищевой промышленности аминокислоты выпускают в виде высушенных чистых кристаллических препаратов; для кормовых и технических целей – используют стабилизированную и сконцентрированную культуральную жидкость.
Технология получения глутаминовой кислоты
L-глутаминовая кислота (α-аминоглутаровая) – первая аминокислота, полученная на основе промышленного микробиологического синтеза:
НООС – СН2 – СН2 – NH2СН – СООН
Глутаминовая кислота является важнейшей аминокислотой растительных и животных белков, не будучи незаменимой. Синтез глутаминовой кислоты происходит в цикле трикарбоновых кислот (рис. 2.2) в результате ферментативного восстановительного аминирования 2-кетоглутаровой кислоты НАДФ-зависимой глутаматдегидрогеназой:
НООС – СН2 – СН2 – СО – СООН + НАД(Ф)Н2 + NН3 →
→ НООС – СН2 – СН2 – NН2СН – СООН + НАД(Ф).
2-кетоглутаровая кислота образуется в свою очередь из изолимонной кислоты под воздействием изоцитратдегидрогеназы. Необходимый для синтеза глутаминовой кислоты НАД(Ф)Н постоянно регенерируется в процессе окисления изолимонной кислоты в 2-кетоглутаровую.
Рис. 2.2. Схема синтеза глутаминовой кислоты С. glutamaticum.
Возможность получения глутаминовой кислоты из углеводов на основе микроорганизмов впервые была продемонстрирована в 1957 г. японскими исследователями Киносита, Асаи и др. Продуцировать глутаминовую кислоту способны дрожжи, микроскопические грибы, бактерии. Бактерии обеспечивают наибольший выход по отношению к использованному углеродному субстрату (не менее 40–50 %). Промышленное значение имеют бактериальные культуры (Micrococcus, Brevibacterium, Microbacterium, Corynebacterium). Сверхсинтез кислоты у диких штаммов возможен в специальных физиологических условиях при торможении скорости роста и увеличении проницаемости клеточной мембраны для глутаминовой кислоты. Такие условия обеспечивает определенная концентрация биотина в среде (1–5 мкг/л), а также присутствие некоторых антибиотиков. Внутриклеточная концентрация глутаминовой кислоты снижается в результате экскреции продукта в околоклеточную среду, поэтому регуляция синтеза конечным продуктом ослабевает. Сверхпродукция глутаминовой кислоты связана также с высокой концентрацией аммония в среде, высокой активностью НАД(Ф)Н-зависимой глутаматдегидрогеназы и отсутствием или дефектом α-кетоглутаратдегидрогеназы, катализирующей превращение 2-кетоглутарата в янтарную кислоту.
Глутаминовая кислота в основном используется в фармакологии и пи- щевой промышленности, поэтому задача постферментационной стадии – получение высокоочищенных препаратов. Для этого на первом этапе обработки культуральной жидкости в нее добавляют негашеную известь или известковое молоко. После этого избыток ионов осаждают кислотой, осадок удаляют центрифугированием. Фильтрат после осветления активированным углем и сорбции на ионообменных смолах концентрируют вакуум-выпариванием при 40–60°С. Осаждение кристаллов глутаминовой кислоты проводят в изоэлектрической точке (рН 3.2 при 4–15°С). В результате перекристаллизации чистота продукта достигает 99.6 %. Кристаллы кислоты отделяют от маточника центрифугированием, промывают и высушивают. Если нужно получить глутамат натрия, кристаллы глутаминовой кислоты обрабатывают гидроокисью натрия. Для этого влажные кристаллы растворяют в воде, нейтрализуют 50 % раствором едкого натра. Полученный раствор фильтруют, упаривают под вакуумом до содержания сухих веществ 60 % и направляют на перекристаллизацию. Полученные кристаллы глутамата натрия выделяют из маточного раствора центрифугированием и высушивают током горячего воздуха.
Глутамат натрия усиливает вкус многих пищевых продуктов, способствует длительному сохранению вкусовых качеств консервированных продуктов (овощей, рыбы, мясных продуктов). За рубежом глутамат натрия добавляют во все продукты не только при консервировании, но и при замораживании и просто хранении. В Японии, США и других странах глутамат натрия является обязательной принадлежностью стола аналогично соли, перцу, горчице. Глутаминовая кислота не только повышает вкусовую ценность пищи, но также стимулирует пищеварение. Важное свойства глутаминовой кислоты – служить защитным фактором при отравлениях внутренних органов (печени, почек), ослаблять действие токсинов и усиливать ряд фармакологических препаратов. В настоящее время производство глутаминовой кислоты является крупнотоннажным биотехнологическим производством (около 400 000 т/г), объемы ее производства возрастают с каждым годом. Ведущими странами – производителями глутаминовой кислоты и глутамата натрия являются Япония и США.
Технология получения лизина
L-Лизин (α, ε-аминокапроновая кислота): СН2NH2 – (СН2)3 – NH2СН – СООН
в организме высших животных и человека определяет биологическую ценность переваримого белка. Данная аминокислота выполняет также много других важнейших биохимических функций – способствует секреции пищеварительных ферментов и транспорту кальция в клетки, улучшает общий азотный баланс в организме. Добавление лизина в состав комбикормов увеличивает усвояемость белка животными и снижает расход кормов на производство животноводческой продукции.
Синтез L-лизина у микроорганизмов осуществляется различными путями. Дрожжи, грибы и микроводоросли синтезируют лизин из α-кетоглутаровой кислоты через a-аминоадипиновую кислоту. Вследствие малой изученности этого биосинтетического пути получение мутантов – суперпродуцентов лизина через аминоадипиновый путь представляется проблематичным. Высшие растения и бактерии синтезируют лизин по другой схеме – через α-диаминопемелиновую кислоту. По этой разветвленной схеме биосинтеза L-лизина (диаминопимелиновый путь) синтез начинается с аспарагиновой кислоты и проходит через диаминопимелиновую кислоту. Помимо L-лизина, аспарагиновая кислота является также предшественником для L-метионина, L-треонина и L-изолейцина (рис. 2.3). Ключевым местом в синтезе лизина является аспартаткиназа; она ингибируется треонином. Присутствие лизина этот эффект усиливает. Треонин ингибирует дегидрогеназу полуальдегида аспарагиновой кислоты, а также гомосериндегидрогеназу. Метионин является репрессором по отношению к гомосериндегидрогеназе, а изолейцин ингибирует треонин-дегидрогеназу. Продукты обмена, угнетающие различные ферменты и участвующие в синтезе лизина, следует вывести из реакции. Именно поэтому для производства L-лизина используют различные ауксотрофные мутанты. Производственные штаммы-продуценты лизина – это ауксотрофные штаммы глутаматпродуцирующих коринебактерий (Corynebacterium glutamaticum, Brevibacterium flavum). Применяют три типа ауксотрофных мутантов: ауксотрофы по гомосерину или треонину с подавленной гомосеринкиназой; метионин- и треонинчувствительные штаммы с существенно сниженной активностью гомосериндегидрогеназы; аналогорезистетные прототрофные продуценты лизина, устойчивые к треонину и аминоэтицилцистеину, с аспартаткиназой, нечувствительной к согласованному ингибированию лизином и треонином. Получены штаммы, обеспечивающие 40 % конверсию углеродного субстрата в аминокислоту и выходы лизина на сахарах до 40, уксусной кислоте – до 70 г/л.
Рис. 2.3. Диаминопимелиновый путь синтеза лизина
Микробиологический процесс производства лизина аналогичен схеме получения глутаминовой кислоты, однако использование ауксотрофных микроорганизмов требует специального состава питательных сред, которые подбираются индивидуально для каждого штамма. Очень важно также осуществлять на стадии ферментации стабилизацию основных параметров культуры в строгом соответствие с технологическим регламентом данного производства, так как выход лизина зависит от температуры среды, концентрации кислорода, длительности ферментации, дозы и возраста посевного материала. Помимо сахаров (7–12 % по объему), сульфата аммония и фосфатов калия, в среду вносят кукурузный экстракт в качестве источника биологически активных веществ (1.2–1.5 % по содержанию сухих веществ), а также мел и синтетический пеногаситель. Среда должна содержать (в л): 200 мг метионина, 800 мг треонина, 15–20 мкг биотина (при меньших концентрациях биотина синтезируется глутаминовая кислота, при 2.5 мг – молочная кислота, как механизм обратного действия). Соотношение углерода и азота в среде оптимально как 11:1 (при его увеличе- нии выход лизина падает, при уменьшении – накапливается аланин).
Культивирование осуществляется в строго стерильной глубинной аэробной периодической культуре в аппаратах объемом 50 и 100 м3 при коэффициенте заполнения 0.75. Процесс длится 48–72 ч при 29–30°С, контролируемом рН 7.0–7.5, непрерывном перемешивании и избыточном давлении 20–30 кПа. Уровень аэрации составляет 1м3 воздуха/м3 среды в минуту. При ухудшении условий аэрации происходит образование молочной кислоты. Для пеногашения используют кашалотовый жир или синтетические масла (0.5 % от объема среды). В первые сутки потребляется около 25 % сахаров и почти все аминокислоты, при этом образуется практически вся биомасса. Далее на фоне резкого снижения скорости роста клеток наблюдается самая высокая скорость синтеза лизина (до 1.0 г/л ч). Для стабилизации рН периодически проводят поддтитровку культуры 25 % раствором аммиака. При дополнительном дробном введении в аппарат углеводов и азота выход лизина можно повысить. Конечная концентрация кислоты достигает 40 г/л при остаточной концентрации сахаров около 0.5–1.0 г/л.
Эффективный процесс получения лизина реализован на более доступном субстрате – уксусной кислоте. Токсичность данного субстрата делает необходимой дробную подачу ацетата; его концентрация в среде не должна превышать 2 %. Небольшие добавки сахара в среду (около 1 %) повышают выход лизина на 30–50 %. Экономический коэффициент по потребляемому ацетату при этом составляет 27 %. Конечная концентрация лизина в среде достигает 40–50 г/л. В последние годы получены мутантные штаммы B. flavum, обеспечивающие на ацетатной среде выход лизина до 73 г/л. Практически весь производимый микробиологическим способом L-лизин используется в кормопроизводстве для повышения усвояемости и питательности кормов. Поэтому выпускается лизин, главным образом, в виде кормовых препаратов – жидкого концентрата лизина (ЖКЛ) и кормового концентрата лизина (ККЛ).
При производстве ЖКЛ культуральную жидкость, предварительно стабилизированную 25 % раствором гидросульфита натрия, подкисляют соляной кислотой до рН 4.5–5.0. Образующийся при этом термостабильный монохлорид лизина упаривают в вакуумно-выпарных аппаратах до 40 % содержания сухих веществ. Готовый препарат ЖКЛ не замерзает при температуре до –18°C и сохраняет свои свойства в течение 3 месяцев.
ККЛ получают на основе ЖКЛ, высушивая жидкий концентрат в распылительных сушилках при температуре не более 90°С до остаточной влажности 4–8 %. Сухой препарат лизина гигроскопичен и в процессе хранения подвержен порче. Для устранения данного нежелательного явления в концентрат перед высушиванием вводят наполнители в виде костной муки, бентоита, негашеной извести, пшеничных отрубей. Высушивание полученной пасты проводят конвективным способом на вальцево-ленточных сушилках. Препарат по составу близок к жидкому концентрату лизина и содержит (в %): 7–10 лизина, 15–17 белка, до 14 других аминокислот, 10–13 бетаина и 20–25 зольных веществ. Препарат сыпуч и негиг- роскопичен. Срок его хранения возрастает до 1 года.
Технология получения триптофана
L-Триптофан (α-амино-β-индолилпропионовая кислота) относится к незаменимым аминокислотам: СН2 – NН2СН – СООН
Триптофан, наряду с другими ароматическими аминокислотами, фелиаланином и тирозином, в последние годы находит все большее применение. Отсутствие или дефицит триптофана в организме приводит к ряду тяжелых заболеваний (диабет, туберкулез, пеллагра). Используется триптофан в биохимических исследованиях, в небольших количествах – в животноводстве.
В общем виде последовательность биосинтетических реакций образования триптофана следущая:
эритрозо-4-фосфат + фосфоеноилпировиноградная кислота →
→ 7-фосфо-3-дезокси-D-арабиногептулозовая кислота →
→ 5-дегидрошикимовая кислота→ шикимовая кислота→
→ хоризмовая кислота → антраниловая кислота → триптофан.
Шикимовая кислота является основным промежуточным продуктом, из которого через 5-фосфо-3-енолпирувилшикимовую кислоту образуется хоризмовая кислота. Данная стадия является ключевой для синтеза ароматических аминокислот.
Микробиологический синтез L-триптофана осуществляют на основе мутантных штаммов дрожжей (Candida) и бактерий (E. coli, Bacillus subtilis), дефицитных по тирозину и фенилаланину. Промышленный синтез L-триптофана осуществляется на основе сахаров. Исходная питательная среда для стерильного периодического выращивания дрожжей содержит (в %): сахароза 10, мочевина 0.5, кукурузный экстракт 2.0, а также хлорид кальция, калий фосфорнокислый и сульфат магния. Продолжительность периодической ферментации при 37°С не превышает 48 ч. В ходе пост-фертментационной стадии триптофан выделяют из культуры по обычным схемам. Для получения очищенного кристаллического препарата работают с культуральной жидкостью. Для получения кормового концентрата используют и биомассу клеток.
Двухступенчатое получение аминокислот из биосинтетических предшественников выбирают в тех случаях, когда предшественник недорог, а прямая микробная ферментация недостаточно экономична или разработана. При микробиологическом синтезе аминокислот из предшественников удается значительно понизить репрессию или ретроингибирование, так как в результате внесения в среду готового интермедиата снимаются проблемы, связанные с наличием генетического контроля в системе синтеза аминокислот.
При двухступенчатом способе получения глутаминовой кислоты из α-кетоглутаровой, играющей роль предшественника, необходим источник данного предшественника и ферментная система, катализирующая превращение кетоглутарата в целевую аминокислоту. Кетоглутарат получают микробиологическим синтезом на основе бактерий (Pseudomonas, Escherichia) или дрожжей (Candida) – I ступень. На II ступени можно получить L-глутаминовую кислоту в реакции восстановительного аминирования с помощью культуры Pseudomonas, имеющей сильную глутаматдегидрогеназу:
α-кетоглутаровая кислота + NН4+ НАДН →
→ L-глутаминовая кислота + Н2О + НАД+.
L-глутаминговая кислота также может быть получена из кетоглутарата через переаминирование последней с участием трансамидазы:
α-кетоглутаровая кислота + аминокислота →
→ L-глутаминовая кислота + α-кетокислота;
II ступень по данной схеме может быть реализована культурой E. coli, в качестве донора аминогрупп могут выступать аланин или аспарагиновая кислота.
Комбинированный, принципиально новый способ получения L-лизина в 1973 г. был предложен японской фирмой «Тойо Рейон» («Торей»). Конечный продукт, получаемый по данной технологии, отличается высокой концентрацией и чистотой. На первой стадии циклогексан в результате химических реакций превращается в циклический ангидрид лизина (D, L-α-амино-e-капролактам). На второй стадии осуществляют разделение оптических изомеров с помощью ферментов; происходящий при этом асимметрический гидролиз с участием гидролазы аминокапролактама приводит к образованию L-лизина. Гидролазу L-α-амино-e-капролактама синтезируют дрожжи (Candida, Trichospora, Cryptococcus), фермент стимулируется ионами марганца, магния и цинка. Источником рацемазы аминокапролактама могут служить бактерии (Flavobacterium, Achromobacter). Оба эти фермента, обладающие рацемазной и гидролазной активностями, в виде определенного количества биомассы вводят на II ступени в водный раствор предшественника – DL-аминокапролактама. В ходе ферментативных реакций из предшественника образуется L-лизин, чистота препарата – выше 99 %. Помимо микробной биомассы, источником превращений DL-аминокапролактама в лизин могут служить изолированные иммобилизованные ферменты. Раствор предшественника пропускают через колонку, содержащую оба иммобилизованных фермента: один из них (гидролаза) гидролизует амидную связь в L-аминокапролактаме, не затрагивая D-формы предшественника; второй (рацемаза) – превращает D-изомер в ра- цемат с высокой скоростью. Выход L-лизина может составлять до 95 %.
L-триптафан также можно получать из предшественника – антраниловой кислоты. На первом этапе по традиционной микробиологической схеме с использованием дрожжей Candida utilis в течение 20–24 ч проводят процесс ферментации в условиях интенсивной (около 7 г О2/л·ч) аэрации. Среда содержит мелассу (10.4 %), мочевину, сульфат магния, фосфаты калия. Для пеногашения используют кашалотовый жир и синтетические кремнеорганические соединения. Далее интенсивность аэрации снижают вдвое, в культуру периодически вносят растворы мочевины, мелассы и антраниловой кислоты. В течение 22–24 ч наращивают биомассу – источник ферментов; затем, в течение последующих 120 ч происходит собственно трансформация антраниловой кислоты в аминокислоту. Общее время процесса составляет около 140 ч, выход триптофана – 60 г/л.
Большие успехи в биотехнологии аминокислот были достигнуты с формированием методов инженерной энзимологии, в частности, с развитием техники иммобилизации ферментов.
Первым процессом промышленного использования иммобилизованных ферментов был процесс для разделения химически синтезированных рацемических смесей D- и L-форм аминокислот, разработанный в Японии в 1969 г. (предыдущие 15 лет процесс проводился компанией «Танабе Сейяку» с применением растворимых ферментов – аминоацилаз). В качестве исходного материала используют раствор ацилпроизводных синтезированных химическим путем LD-форм аминокислот, который пропускают через колонку с иммобилизированной L-аминоацилазой. Последняя гидролизует только ацил-L-изомеры, отщепляя от них объемную ацильную группу и тем самым резко увеличивает растворимость образующейся L-аминокислоты по сравнению с присутствующими в реакционной смеси ацил-D-изомерами. Далее смесь легко разделяется обычными физико-химическим методами. Компанией на промышленном уровне по данной технологии реализован синтез нескольких L-аминокислот, в том числе метионина, валина, фенилаланина, триптофана. Представляет интерес процесс получения аспарагиновой кислоты из химических предшественников (фумаровой кислоты и аммиака) на основе фермента аспартазы, разработанный японской фирмой «Танабе Сейяку». Фермент в одну стадию присоединяет молекулу аммиака к двойной связи фумаровой кислоты с образованием оптически активной L-аспарагиновой кислоты. Выход продукта составляет 99 %, процесс реализуется непрерывно в колонке объемом 1 м3. Производительность достигает 1700 кг чистой L-аспарагиновой кислоты в день на один реактор.
Дегидрогеназы аминокислот (лейцин- и аланиндегидрогеназы), катализирующие обратимые реакции дезаминирования, применяют в непрерывных процессах синтеза аминокислот из соответствующих кето-аналогов.
Глутаматсинтетаза, катализирующая АТФ-зависимую реакцию аминирования глутамата, используется для получения глутамина с 92 % выходом. L-тирозин-фенол-лиаза, катализирующая реакцию элиминации, в которой тирозин распадается с образованием фенола, аммиака и пирувата, используется для энзиматического получения последнего. L-триптофан-индол-лиаза может быть использована для получения L-триптофана из индола, пирувата и аммиака.
Высокая потребность в аминокислотах непрерывно стимулирует разработку принципиально новых и более эффективных биотехнологических способов их получения при наращивании темпов и объемов промышленного производства.
2.3. ОРГАНИЧЕСКИЕ КИСЛОТЫ
Органические кислоты широко используют в пищевой и фармацевтической промышленности, в технике и в качестве химического сырья. Отдельные органические кислоты (лимонную, яблочную) можно получать экстракцией из природного растительного сырья; другие (уксусную, молочную) – в процессах органического синтеза. Более 50 органических кислот могут быть получены на основе микробиологического синтеза. Биотехнологические методы их получения к настоящему времени детально разработаны. Более того, принято считать, что органические кислоты, полученные в результате микробиологического синтеза, для использования человеком предпочтительнее в сравнение с синтетическими кислотами. Для технических нужд органические кислоты получают химическим путем; применяемые в пищевой и фармацевтической промышленности – в различных биотехнологических процессах. Это производства лимонной, молочной, уксусуной, итаконовой, пропионовой и глюконовой органических кислот; (молочная и уксусные кислоты производятся также и химическим путем).
Органические кислоты в системе микробного метаболизма являются продуктами деградации источника энергии и углерода. Так, лимонная, изолимонная, кетоглутаровая, янтарная, фумаровая и яблочная кислоты – интермедиаты цикла трикарбоновых кислот у большинства аэробных микроорганизмов. Глюконовая, кетоглюконовая и винная кислоты – промежуточные продукты прямого окисления глюкозы (без фосфорилирования) некоторых аэробных бактерий и грибов. Молочная, масляная и пропионовая кислоты являются конечными продуктами метаболизма углеводов у анаэробных бактерий. Уксусная кислота – продукт окисления этанола; а алифатические моно- и дикарбоновые кислоты – промежуточные продукты окисления нормальных алканов. Таким образом, возможности микроорганизмов для полу- чения на основе их метаболизма органических кислот велики.
Для сверхсинтеза отдельных кислот нужны селективные, строго определенные условия. При сбалансированном росте микроорганизмов на полноценной среде накопления органических кислот не происходит, так как являясь промежуточными продуктами в системе микробного метаболизма, органические кислоты – исходный материал для синтеза других макромолекул. Время максимальной скорости образования в клетке органических кислот, как и многих других метаболитов, не совпадает во времени со скоростью размножения клеток и накоплением биомассы. Сверхсинтез органических кислот наблюдается при торможении скорости роста продуцента и блокировании процессов биосинтеза, требующих участия кислот в качестве субстрата, то есть при нарушении процессов диссимиляции имеющегося эндогенного субстрата и процессов синтеза основных (азотсодержащих) компонентов клетки. Такими условиями, как правило, является полное или избыточное содержание в среде источника углерода и энергии и дефицит биогенных элементов, ограничивающих рост клеток. Большинство органических кислот получают, лимитируя рост клеток-продуцентов дефицитом азота или фосфора при избытке углеродсодержащего субстрата. Поэтому микробиологические процессы получения органических кислот – двухфазные (рис. 2.4): на первом этапе происходит так называемый сбалансированный рост при максимальном накоплении биомассы и потреблении углеродного и энергетического субстрата, а также лимитирующего биогена; на втором – происходит замедление скорости роста клеток. В результате этого прирост биомассы прекращается и начинается интен- сивное кислотообразование. Длительность фазы интенсивного кислотообразования определяется наличием углеродсодержащего субстрата в среде. Важным условием кислотообразование большинства органических кислот (за исключением молочной) является хороший режим аэрации, а также величина рН среды.
Способность продуцировать ту или иную кислоту – широко распространенное среди микроорганизмов свойство. В качестве производственных культур используют специально подобранные штаммы, продуцирующие целевую кислоту в виде монопродукта с высокими выходами и эффективным усвоением углеродного субстрата. При многих производствах органических кислот экономический коэффициент по углероду достигает 90 % и выше. В качестве продуцентов используют бактериальные, дрожжевые и грибные культуры (Lactobacillus, Arthrobacter, Alcaligenes, Candida, Aspergillus, Penicillium, Trichoderma). Способы ферментации в микробиологических процессах производства органических кислот – разнообразны. Среди них – поверхностные жидко- и твердофазные процессы, а также глубинные, включая проточные культуры. В последние годы разработаны принципиально новые и эффективные биотехнологии с использованием иммобилизованных целых клеток и ферментов. Также разнообразны и субстраты, используемые в производстве органических кислот. Применяемые в начале века глюкоза и сахароза со временем стали заменять более доступными комплексными средами (мелассой, гидролизным крахмалом); в 60-е годы были разработаны новые процессы получения органических кислот на жидких парафинах нефти.
Рис. 2.4. Рост Aspergillus niger и образование лимонной кислоты (по Прескот и Дэн, 1952). 1 – титруемая кислотность среды (в пересчете на лимонную кислоту), 2 – лимонная кислота, 3 – сахар в среде, 4 – масса мицелия, 5 – рН среды.
Получение лимонной кислоты
Лимонная кислота (СН2 – СООН – СОНСООН – СН2СООН) – трехосновная оксикислота, широко распространенная в плодах и ягодах. Она широко применяется в пищевой промышленности при производстве кондитерских изделий и напитков, в фармацевтической, химической и текстильной промышленности. Лимонная кислота была идентифицирована в качестве продукта метаболизма плесневых грибов в 1893 г. Вемером. В настоящее время это кислота по объемам производства (свыше 350 тыс. т/г) занимает первое место среди всех органических кислот.
У микроорганизмов синтез лимонной кислоты реализуется в цикле дикарбоновых кислот и осуществляется в результате конденсации кислоты с четырьмя атомами углерода и двумя карбоксильными группами и кислоты с одной карбоксильной группой. Образуемая в результате гликолиза пировиноградная кислота связывается с углекислотой; синтезируемая при этом щавелевоуксусная кислота реагирует с уксусной кислотой с образованием лимонной кислоты, то есть образование лимонной кислоты включает реакции гликолиза и ряд реакций цикла Кребса. При каждом обороте цикла молекула щавелевоуксусной кислоты взаимодействует с уксусной, образуя лимонную кислоту:
Производство лимонной кислоты методом ферментации плесневых грибов принадлежит к числу давних биотехнологических процессов. Первое производство было реализовано в конце XIX века. Совершенствование процесса получения лимонной кислоты тесно связано с разработкой многих фундаментальных аспектов микробиологии (борьбой с микробным загрязнением производственной культуры, оптимизацией состава питательных сред, селекцией высокопродуктивных штаммов и др.).
В промышленном производстве лимонной кислоты в качестве продуцента в основном используют Aspergillus niger, но также применяют и A. wentii. Процесс ферментации достаточно сложен, так как лимонная кислота, является продуктом первичного метаболизма грибов, и даже незначительное выделение данного продукта в окружающую среду свидетельствует о выраженном дисбалансе клеточного метаболизма. Рост продуцента и синтез кислоты обычно регулируют составом среды (сахара, P, Mn, Fe, Zn). Сверхсинтез лимонной кислоты реализуется при больших концентрациях сахаров в среде (14–24 %) и является ответной реакцией продуцента на дефицит фосфора, а также других металлов, хотя их роль до конца не ясна. Это, видимо, и подавление анаболизма, и влияние на свойства поверхности и морфологию гиф. Оптимум рН на стадии кислотообразования составляет 1.7–2.0. В более щелочной среде процесс сдвигается в сторону накопления щавелевой и глюконовой кислот. В качестве основы среды обычно используют глюкозный сироп, гидролизаты крахмала или мелассу. Последнюю предварительно разбавляют до требуемого уровня сахаров и обрабатывают с целью снижения содержания металлов. Источником азота служат соли аммония (0.2 %); концентрация фосфатов (0.01–0.02 %). В качестве пеногасителей используют природные масла с высоким содержанием жирных кислот. Очень существенное значение имеет уровень аэрации культуры.
В производстве лимонной кислоты применяют несколько вариантов процесса. Поверхностный способ реализуется на твердой сыпучей среде и в жидкой фазе. При жидкофазной поверхностной ферментации питательную среду разливают в кюветы слоем от 8 до 18 см. Кюветы размещают на стеллажах в предварительно простерилизованной парами формалина бро- дильной камере. Через специальные воздуховоды с током стерильного воздуха поверхность среды засевают исходной музейной культурой. В качестве посевного материала используют предварительно полученные также в условиях поверхностной культуры и высушенные споры (конидии) из расчета 50–75 мг конидий на 1 м2 площади кювет. Известно несколько вариантов процесса: бессменный, бессменный с доливами и метод пленок. При бессменном режиме процесс осуществляется на одной среде от момента засева спор до завершения стадии кислотообразования. При использовании метода пленок через 7 суток после завершения кислотообразования сброженный раствор мелассы сливают из кювет, мицелий промывают стерильной водой; и в кюветы заливают новую среду. Бессменный способ с доливом характеризуется дробными добавками мелассы под пленку гриба на стадии кислотообразования (30–35 % от исходного объема), так называемый режим с подпиткой субстратом. Это позволяет повысить выход лимонной кислоты на 15–20 % с единицы поверхности при сокращении затрат сахаров на 10–15 % по сравнению с другими методами. В ходе стадии ферментации на первом этапе (первые 24–36 ч) происходит интенсивный рост мицелия. Температура среды в этот период стабилизируется на уровне 32–34°C, интенсивность аэрации составляет 3–4 м3 воздуха в ч/м мицелия. В период активного кислотообразования подачу воздуха увеличивают в 5–6 раз. В результате более интенсивного термогенеза температуру снижают до 30–32°. По мере снижения процесса кислотообразования режим аэрации становится менее интенсивным. Контроль процесса ведут по показателям титруемой кислотности среды. Процесс считают завершенным при остаточной концентрации сахаров около 1–2 % и уровне титруемой кислотности 12–20 %. Содержание лимонной кислоты от уровня всех кислот достигает 94–98 %. Сброженный раствор сливают в сборник и направляют на обработку; промытый мицелий используют в кормопроизводстве.
Твердофазная ферментация имеет много общего с поверхностно-жидкофазным процессом. Разработанный в Японии процесс Коджи предусматривает использование в качестве среды пористого материла (багасса, картофель, пульпа сахарной свеклы, пшеничные отруби). Материал предварительно стерилизуют, после охлаждения инокулируют суспензией спор. Ферментация происходит в лотках при 25–30°C в течение 6–7 дней. Образованную лимонную кислоту экстрагируют водой. В Японии 20 % общего объема производства лимонной кислоты получают методом Коджи.
Начиная с 1950 г., промышленные процессы получения лимонной кислоты стали переводить в условия глубинной культуры. Стабильный процесс возможен при его организации в две стадии: рост мицелия на полной среде в ходе первой стадии и на второй (при отсутствии фосфора в среде) – образование лимонной кислоты. Глубинная ферментация проводится в аппаратах емкостью 50 м3 с заполнением на 70–75 %. В качестве посевного материала используют мицелий, подрощенный также в условиях глубинной культуры. В производственном аппарате, куда подрощенный мицелий передается по стерильной посевной линии, питательная среда содержит 12–15 % сахаров. Ферментацию проводят при 31–32° при непрерывном перемешивании. В ходе процесса кислотообразования (5–7 суток) реализуют интенсивный режим аэрации (до 800–1000 м3/ч) с дробным добавлением сахаров, 2–3 подкормки. Выход лимонной кислоты составляет от 5 до 12 %, остаточная концентрация сахаров – 0.2–1.5 %, доля цитрата – 80–98 % от суммы всех органических кислот.
В 60-е годы начали разрабатывать процессы получения лимонной кислоты на основе жидких углеводородов (С9–С30) с использованием в качестве продуцентов дрожжей (Candida) и бактерий (Brevibacterium, Corynebacterium, Arthrobacter), а также с применением метода проточных культур. Эти технологии, пока не реализованные в промышленных масштабах, обещают в будущем определенные технологические перспективы. Готовый продукт – высокоочищенную кристаллическую лимонную кислоту получают в ходе постферментационной стадии. В сброженных растворах содержатся, помимо целевой кислоты, также глюконовая и щавелевая кислоты, остатки несброженных сахаров и минеральные соли. Для выделения лимонной кислоты из данного раствора ее связывают гидроокисью кальция с образованием труднорастворимого цитрата кальция:
2 С6Н8О7 + 3 Са(ОН)2 = Са3(С6Н5О7)2 + 6 Н2О.
Одновременно образуются кальциевые соли глюконовой и щавелевой кислот, глюконат кальция Са(С6Н11О7)2 и оксалат кальция СаС2О4. Кальциевые соли лимонной и щавелевой кислот выпадают в осадок, а глюконат кальция и основная часть органических и минеральных компонентов мелассы остаются в растворе. Осадок отделяется на вакуум-фильтре, промывается и высушивается. Далее для перевода лимонной кислоты в свободное состояние и освобождения от оксалата кальция осадок обрабатывают серной кислотой с последующей фильтрацией. Раствор лимонной кислоты фильтруют, концентрируют вакуум-выпаркой и затем подвергают кристаллизации при медленном охлаждении до 8–10°. Полученные кристаллы отделяют в центрифуге от маточника и высушивают в пневматических сушилках при 30–35°. Готовый продукт содержит не менее 99.5 % лимонной кислоты (в пересчете на моногидрат), зольность – не выше 0.1– 0.35 %.
Получение молочной кислоты
Молочная кислота (СН3СНОНСООН) – органическая одноосновная кислота, образуемая в результате анаэробного превращения углеводов молочнокислыми бактериями. В 1847 г. С. Блодно доказал, что данная кислота является продуктом брожения, а Л. Пастер установил, что этот процесс вызывают бактерии. Образование молочной кислоты из глюкозы возможно несколькими путями. При сбраживании гомоферментными молочнокислыми бактериями:
С6Н12О6 → 2 СН2ОН2СНОНСНО (глицеральдегид) →
→ 2 СН3СОСНО (метилглиоксаль) + 2 Н2О,
СН3СОСНО (метилглиоксаль) + Н2О →
→ СН3СНОНСООН (молочная кислота).
Второй путь, гетероферментный, включает распад глюкозы до пировиноградной кислоты и восстановление последней до молочной кислоты:
С6Н12О6 → СН3СОСООН + Н2 → СН3СНОНСООН.
Для промышленного получения молочной кислоты используют гомоферментные молочнокислые бактерии. У гомоферментных молочнокислых бактерий только 3 % субстрата превращается в клеточный материал: а остальной – трансформируется в молочную кислоту, выход которой достигает до 1.5 %. Теоретически из 1 моля глюкозы должно образоваться 2 моля лактата. На практике эта величина несколько ниже, 1.8 моля, то есть выход продукта от субстрата достигает 90 %.
Применяют молочную кислоту в пищевой промышленности для получения напитков, мармеладов, в процессах консервирования, а также в кормопроизводстве. Соли молочной кислоты используют в фармацевтике.
Промышленное производство молочной кислоты начато в конце ХIХ века с участием молочнокислых бактерий Lactobacillus delbrueckii, L. leichmannii, L.bulgaricus. Молочнокислое брожение протекает в анаэробных условиях, однако лактобациллы относятся к факультативным анаэробам, поэтому при ферментации воздух полностью не удаляют из ферментеров. В качестве сырья используют сахарную и тростниковую мелассу и гидролизаты крахмала, при этом концентрация сахаров в исходной среде в зависимости от характера брожения составляет примерно от 5 до 20 %.
Используют восстановленные формы азота, сульфаты или фосфаты аммония, а также солод и кукурузный экстракт в качестве источника факторов роста. Возможно использование сульфитного щелока с участием бактерий L. delbrueckii. Ферментацию проводят в глубинной культуре при рН 6.3–6.5 и строго постоянной температуре 50°С. Длительность процесса составляет до 7–11 суток. В ходе процесса брожения для коррекции изменяющегося рН в культуру вносят мел, 3–4 раза в течение суток. Конечная концентрация образующегося лактата кальция составляет 10–15 %, остаточная концентрация сахаров – 0.5–0.7 %.
На стадии получения готового продукта культуральную среду нагревают до 80–90°, затем нейтрализуют гашеной известью до слабощелочной реакции. После отстаивания в течение 3–5 ч взвешенные частицы декантируют. После этого раствор лактата кальция подают на фильтр-пресс. Фильтрат упаривают до концентрации 27–30 %, охлаждают до 25–30° и подвергают кристаллизации. Промытый лактат кальция отделяют центрифугированием и подвергают расщеплению серной кислотой при 60–70°. Сырую молочную кислоту 18–20 % концентрации упаривают в несколько этапов в вакуум-выпарных аппаратах до 70 % концентрации. Отфильтрованную кислоту после фильтр-пресса подают на розлив с внесением небольших количеств мела, при этом около 10 % кислоты превращается в кристаллический лактат, который связывает молочную кислоту.
Получение уксусной кислоты
Уксусная кислота (СН3СООН) – широко используется в пищевой, химической, микробиологической промышленности, в медицине. Получение уксусной кислоты из спиртосодержащих жидкостей было известно более 10 тыс. лет назад. В те времена древние греки и римляне использовали уксус в качестве освежающего напитка и получали, главным образом, оставляя вино открытым. В больших масштабах уксус долго получали в плоских открытых бочках, в которых пленка бактерий плавала на поверхности. В XIX веке поверхностные процессы стали заменять более эффективными. Так, был разработан процесс в струйном генераторе. В середине ХХ века появились глубинные процессы ферментации. Усовершенствованный генератор Фрингса используется в настоящее время.
Уксуснокислое брожение основано на способности уксуснокислых бактерий окислять спирт кислородом воздуха с участием алкогольдегидрогеназы в уксусную кислоту:
СН3СН2ОН + О2 → СН3СООН + Н2О,
при этом из 1 моля этанола образуется моль уксусной кислоты, а из 1 л 12 об. % спирта получается 12.4 весовых % уксусной кислоты.
Данный процесс могут реализовать многие бактерии, но в промышленных технологиях для получения уксуса используют уксуснокислые бактерии рода Acetobacter, интерес представляют также бактерии Gluconobacter.
Большую часть уксуса получают, используя разведенный спирт. В настоящее время процесс реализуют как поверхностным, так и глубинным способом. Поверхностный режим протекает в струйных генераторах, наполненных древесной стружкой, объемом до 60 м3. Исходный питательный раствор с бактериями распыляют по поверхности стружек, и он стекает, собираясь в нижней части аппарата. После этого жидкость собирают и вновь закачивают в верхнюю часть аппарата. Процедуру повторяют 3–4 раза, в результате в течение 3-х дней до 90 % спирта трансформируется в ацетат. Этот старый способ протекает более эффективно и равномерно в генераторах Фрингса с автоматическим поддержанием температуры и принудительной подачей воздуха. По такой технологии производят до 400 млн л уксусной кислоты в год.
Современные промышленные процессы получения уксуса реализуют в глубинной культуре в специальных аэрационных аппаратах с термостабилизацией и механической системой пеногашения. Скорость аэрации составляет 3.4 м3/м3·ч., вращение ротора – 1500 об./мин., температура 30°С. Исходная инокулируемая смесь содержит этанол и уксусную кислоту, соответственно, около 5 и 7 %; конечная концентрация уксуса через 1.5 суток составляет 12–13 %. Процесс – полупроточный, отливно-доливный. Каждые 30–35 часов до 60 % культуры заменяют на свежее сусло. При глубинной ферментации выход продукта на 1 м3 в 10 раз выше по сравнению с поверхностной ферментацией. К началу 90-х гг. таким способом производили до 715 млн. литров 10 % уксусной кислоты в год.
Разработан и реализован эффективный непрерывный способ получения уксусной кислоты в батарее последовательно работающих ферментеров (обычно 5 аппаратов). Температура культивирования составляет 28° для Acetobacter и 35° при использовании в качестве продуцента культуры Bact. schutzenbachii. Наилучшим сырьем для процесса является этиловый спирт, полученный из зерно-картофельного сырья, при его концентрации около 10 %. Оптимум рН для развития бактерий – около 3. При увеличении содержания уксусной кислоты в культуре свыше 8 % рост бактерий замедляется, при 12–14 % прекращается. Поэтому процесс проводят в батарее последовательно соединенных аппаратов. Первый выполняет роль инокулятора, поэтому в него непрерывно подают свежую среду и поддерживают условия, оптимальные для быстрого образования биомассы бактерий. Культура из первого аппарата поступает во второй аппарат и далее – в последующие, при этом транспортировка культуральной жидкости осуществляется воздухом. В каждом аппарате условия ферментации стабилизируются в соответствии с требованиями течения хода ферментации, при постепенном понижении температура среды от 28° в первом аппарате до 25° – в последнем. Режим аэрации также изменяется, от 0.4 до 0.15 м3/м3 мин. Концентрация спирта со второго по четвертый аппарат стабилизируется на требуемом уровне подачей в них среды с 40 % этанолом. Из последнего аппарата выводится культуральная жидкость с содержанием ацетата не ниже 9.0 и не выше 9.3 %. Выход кислоты составляет до 90 кг из 100 л безводного спирта.
На постферментационной стадии после отделения бактериальной биомассы раствор уксуса фильтруют, освобождая от окрашенных и взвешенных частиц, и далее подвергают пастеризации. Для повышения концентрации исходные растворы вымораживают до 20–30 %. Дальнейшее концентрирование до получения ледяной уксусной кислоты (98.0–99.8 %), проводят методом перегонки.
Получение пропионовой кислоты
Пропионовая кислота (СН3СН2СООН) синтезируется грамположительными пропионовокислыми бактериями (Propionibacterium), используется в химико-фармацевтической промышленности, при получении косметических средств, в качестве фунгицида для сохранения зерна.
Химизм образования пропионовой кислоты заключается в следующем: пировиноградная кислота при участии биотина и углекислоты карбоксилируется в щавелевоуксусную, которая через яблочную и фумаровую кислоты восстанавливается до янтарной кислоты. Янтарная кислота при участии АТФ и КоА превращается в сукцинил-КоА, последний под воздействием метилмалонил-КоА-изомеразы и при участии кофермента В12 превращается в метилмалонил-КоА. В результате карбоксилирования метилмалонил-КоА расщепляется с образованием свободного КоА и пропионовой кислоты.
Среди промышленных штаммов-продуцентов – бактерии Pr. Arabinosum, Pr. shermanii, Pr. rubrum и др. В качестве субстрата брожения бактерии используют различные сахара (лактозу, глюкозу, мальтозу, сахарозу, органические кислоты – яблочную и молочную). Получают пропионовую кислоту в глубиной аэробной культуре на средах, содержащих (%): сахара 2, органический азот 0.4 (источник – дрожжевой экстракт), соли молочной кислоты. Процесс реализуется за 12 суток при 30° и рН 6.8–7.2; при этом свыше 70 % сахаров трансформируется в органические кислоты, на образование углекислоты расходуется менее 20 % углеродного субстрата.
Получение итаконовой кислоты
Итаконовая кислота (С5Н6О4) – ненасыщенная двухосновная кислота; ее образование плесневыми грибами открыл в 1931 г. Киношита. Данная кислота – важный промежуточный продукт для получения полимеров. Итаконовая кислота образует сополимеры с эфирами и другими мономерами, поэтому используется при производстве синтетических волокон и смол, ряда адгезивных средств, ПАВ, красителей и других сложных органических соединений.
Синтез итаконовой кислоты связан с реакциями цикла Кребса; ее исходным продуктом является цис-аконитовая кислота, которая при декарбоксилировании в результате перемещения электронов и перехода двойной связи из положения 2.3 в положение 3.4 превращается в итакановую кислоту:

Получение итаконовой кислоты осуществляют поверхностным и глубинным методами ферментации. В качестве продуцентов используют отселектированные грибные штаммы (Aspergillus itaconicus, Asp. terreus). Процесс аналогичен процессам получения лимонной кислоты. Среды содержат высокие концентрации сахаров, обычно используют мелассу, при дефиците фосфора и железа. Особенностью процесса получения данной кислоты является высокая потребность продуцента в солях цинка, магния и меди. При поверхностной ферментации в течение 10–12 суток образуется около 60 % продукта в пересчете на сахар, доля целевой кислоты в смеси (синтезируются также янтарная, щавелевая и фумаровая кислоты) – свыше 90 %. Содержание итаконовой кислоты достигает 15–20 %, остаточная концентрация сахаров не превышает 0.6 %. В отличие от лимонной, итаконовая кислота – токсичный продукт, при ее концентрации около 7 % рост продуцента угнетается, и скорость продукции кислоты снижается. Токсичность итаконовой кислоты нейтрализуют дробными добавками гидроксиаммония, рН среды при этом стабилизируется на уровне 3.5–3.8. При глубинной ферментации конечная концентрация итаконовой кислоты ниже, 4–6 %. Товарный продукт – кристаллическая итаконовая кислота 92 % содержания, остальное – влага (3–6 %) и другие кислоты (1–3 %).
Получение глюконовой кислоты
Глюконовая кислота – одноосновная пентокислота, получаемая при ферментативном окислении глюкозы с участием глюкозооксидазы. Глюконовая кислота имеет много областей применения. Комплексообразователь с металлами – глюконат натрия, применяют при производстве моющих средств; кальций-, железо- и калийные соли глюконовой кислоты широко используют в медицине и пищевой промышленности.
Продуценты глюконовой кислоты – грибы (Penicillium, Aspergillus). Ферментацию в промышленных масштабах осуществляют поверхностым и глубинным способами; используют среды с высоким (до 30–35 %) содержанием глюкозы, в составе сред – сульфат магния, фосфат калия, источник азота, а также углекислый кальций. Процесс завершается при остаточной концентрации сахара около 1 %. Готовый продукт – кристаллические соли – глюконаты.
Получение фумаровой кислоты
Фумаровая кислота – транс-изомер этилен-дикарбоновой кислоты:

используется при производстве синтетических смол, красок, лаков. Смолы фумаровой кислоты применяют для производства печатных красок. Магниевые и натриевые соли фумаровой кислоты используют в медицине.
Фумаровая кислота – метаболит цикла трикарбоновых кислот и присутствует во всех живых клетках, однако редко экскретируется в среду. Продуцентом данной кислоты являются различные грибы (Penicillium, Aspergillus, Rhizopus), последние наиболее активны. Среды для получения фумаровой кислоты содержат глюкозу в концентрации 5–10 %, лимитирующий фактор – азот, цинк. Ферментация реализуется в условиях интенсивной аэрации поверхностным или глубинным способом. При этом в ходе ферментации проводят нейтрализацию среды углекислым кальцием или раствором щелочи. Максимальный выход кислоты – 58 % от потребленной глюкозы.
Биотехнологические методы получения органических кислот совершенствуются. Недавно в Японии разработан способ получения 2-кетоглюконовой кислоты на основе биосинтеза бактерий Pseudomonas, выход кислоты достигает 90 % от использованного сахара. Разработана технология получения щавелевой кислоты на средах с сахарами на основе грибов A. ozyzae. На основе селектированных штаммов дрожжей (Candida lipolytica) созданы технологии получения лимонной и изолимонной кислот. Специально отселектированные штаммы дрожжей рода Candida синтезируют на средах с нормальными парафинами фумаровую, яблочную, янтарную кислоты. Процесс на данном сырье постоянного состава более стабилен, чем на комплексных природных средах на основе мелассы; также упрощается стадия выделения и очистки готового продукта.
2.4. ВИТАМИНЫ
Витамины – это низкомолекулярные органические вещества, способные в очень низких концентрациях оказывать сильное и разнообразное действие. Природным источником многих витаминов являются растения и микроорганизмы. В настоящее время в производстве многих витаминов ведущие позиции принадлежат химическому синтезу, однако при производстве отдельных витаминов микробный синтез имеет огромное значение, например при производстве кормовых препаратов витаминов. Отдельные витамины, кобаламины, менахиноны продуцируются только микробными клетками. Витамины принимают активное участие во многих процессах метаболизма человека и высших животных (процессы цикла трикарбоновых кислот, распад и синтез жирных кислот, синтез аминокислот и др.), оказывая влияние на разнообразные физиологические процессы. Микробиологическим путем получают некоторые витамины группы B, а также эргостерин и каротин, являющиеся, соответственно, предшественниками витаминов D2 и провитамина A.
Получение витамина В12
Витамин В12 – (α-5,6-диметилбензимидазол)-цианкобаламин – полимер сложного строения, являющийся гематопоэтическим и ростовым фактором для многих животных и микроорганизмов. Микробиологический синтез является единственным способом получения данного витамина. Способность к синтезу данного витамина широко распространена среди прокариотических микроорганизмов. Активно продуцируют витамин В12 Propionibacterium, а также Pseudomonas и смешанные культуры матанообразующих бактерий. Получение витамина на основе пропионовокислых бактерий, способных к самостоятельному синтезу аденозилкобаламина 5,6 ДМБ (коэнзима В12), осуществляется в две стадии в двух последовательных аппаратах объемом 500 л при коэффициенте заполнения 0.65–0.70. Первую стадию культивирования проводят в течение 80 ч и слабом перемешивании в анаэробных условиях до полной утилизации сахара; полученную биомассу центрифугируют. Сгущенную суспензию инкубируют во втором аппарате еще в течение 88 ч, аэрируя культуру воздухом (2 м3/ч). Среда содержит сахара (обычно глюкозу 1–10 %), добавки солей железа, марганца, магния и кобальта (10–100 мг/л), кукурузный экстракт (3–7 %). В качестве источника азота принят (NH4)2SO4. Ферментацию проводят при 30°С, рН стабилизируют на уровне 6.5–7.0 подтитровкой культуры раствором (NH)4OH. На второй стадии происходит образование ДМБ. После завершения ферментации витамин экстрагируют из клеток, нагреванием в течение 10–30 минут при 80–120°С. При последующей обработке горячей клеточной суспензии цианидом происходит образование CN-кобаламина; продукт сорбируют, пропуская раствор через активированный уголь и окислы алюминия; затем элюируют водным спиртом или хлороформом. После выпаривания растворителя получают кристаллический витамин. Выход В12 составляет до 40 мг/л.
Активными продуцентами В12 являются бактерии рода Pseudomonas. Разработаны эффективные технологии на основе термофильных бацилл Bacillus circulans, в течение 18 ч при 65–75°С в нестерильных условиях. Выход витамина составляет от 2.0 до 6.0 мг/л. Бактерии выращивают на богатых средах, приготовленных на основе соевой и рыбной муки, мясного и кукурузного экстракта. Продукция В12 для медицины составляет около 12 т/г; форма выпуска – стерильный раствор CN-В12 на основе 0.95-го раствора NaCl и таблетки витамина в смеси с фолиевой кислотой или другими витаминами. Для нужд животноводства витамин В12 получают на основе смешанной ассоциации термофильных метаногенных бактерий. Ассоциация состоит из 4-х культур, взаимосвязанно расщепляющих органический субстрат до СО2 и СН4: углевод-сбраживающих, аммонифицирующих, сульфат-восстанавливающих и собственно метанообразующих бактерий. В качестве субстрата используют декантированную ацетонобутиловую барду, содержащую 2.0–2.5 % сухих веществ. Брожение проходит при 55–57°С в нестерильной культуре в две фазы: на первой образуются жирные кислоты и метан, на второй – метан, углекислота и витамин В12. Длительность процесса в одном аппарате составляет 2.5–3.5 суток, в двух последовательных – 2–2.5 суток. Концентрация витамина в бражке достигает 850 мкг/л. Параллельно в значительных количествах, до 20 м3/м3 образуется газ (65 % метана и 30 % углекислоты). Бражка имеет слабощелочную реакцию. Для стабилизации витамина ее подкисляют соляной или фосфорной кислотой, затем в выпарном аппарате сгущают до 20 % содержания сухих веществ и высушивают в распылительной сушилке. Содержание В12 в сухом препарате – до 100 мкг/г.
Получение витамина В2
Витамин В2 (рибофлавин) получил свое название от сахара рибозы, входящего в состав молекулы витамина в виде многоатомного спирта D-рибита. Широко распространен в природе и в значительных количествах синтезируется растениями, дрожжами, грибами, бактериями. Животные, не синтезирующие этот витамин, должны получать его в составе комбикормов. При дефиците рибофлавина в организме нарушаются процессы белкового обмена, замедляется рост. Препараты рибофлавина используют в медицине для лечения ряда заболеваний, а в животноводстве – в качестве добавки в корма. Микроорганизмы синтезируют рибофлавин и две его коферментные формы – ФАД и ФМН. Продуцентами витамина являются бактерии (Brevibacterium ammoniagenes, Micrococcus glutamaticus), дрожжи (Candida guilliermondii, C. flaveri), микроскопические (Ashbya gossypii, Eremothecium ashbyii) и плесневые грибы (Aspergillus niger).
Промышленное получение рибофлавина осуществляется химическим синтезом, микробиологическим и комбинированным: при этом синтезированная микроорганизмами рибоза химически трансформируется в В2.
Для медицинских целей микробиологический рибофлавин получают на основе гриба Aspergillus. Для высоких выходов витамина (до 7 г/л) используют усовершенствованные штаммы и оптимизированные среды, содержащие (в %): кукурузный экстракт – 2.25, пептон – 3.5, соевое масло – 4.5 и стимуляторы (пептоны, глицин). Используют активный инокулят, которым засевают стерильную среду. Ферментацию проводят в течении 7 суток при 28°С и хорошей аэрации (0,3 м3/м3×мин.). Исходный рН составляет около 7.0, в ходе ферментации в связи с выделением кислот среда подкисляется до рН 4.0–4.5. После утилизации углеродного субстрата продуцент начинает утилизировать кислоты; рН повышается и после этого начинается образование витамина В2. При этом кристаллы рибофлавина накапливаются в гифах и вне мицелия. На постферметационной стадии для выделения витамина мицелий нагревают в течение 1 ч при 120°С.
В ряде стран для получения кормовых препаратов витамина В2 используют достаточно простой способ на основе микроскопического гриба Eremothecium ashbyii, который выращивают в глубинной культуре в течение 80–84 ч при 28–30°С на среде с глюкозой или мальтозой (2.5 %), источником азота в виде NH4NO3 и карбоксидом кальция (0.5 %). Выход ри- бофлавина составляет 1250 мкг/мл. Культуральная жидкость концентрируется в вакуумной выпарке до содержания сухих веществ 30–40 % и высушивается в распылительной сушилке. Товарная форма продукта – порошок с содержанием рибофлавина не менее 10 мг/г и 20 % сырого протеина, в препарате присутствуют никотиновая кислота и витамины В1, В3, В6 и В12. Полученный генноинженерным методом штамм Bacillus subtilis образует за 35 суток ферментации до 4 г/л рибофлавина.
Получение эргостерина
Эргостерин – (эргоста-5,7,22-триен-3β-ол) – исходный продукт производства витамина D2 и кормовых препаратов дрожжей, обогащенных этим витамином. Витамин D2 (эргокальциферол) образуется при облучении ультрафиолетом эргостерина, который в значительных количествах синтезируют бурые водоросли, дрожжи, плесневые грибы. Наиболее активные продуценты эргостерина – Saccharomyces, Rhodotoryla, Candida.
В промышленных масштабах эргостерин получают при культивировании дрожжей и мицелиальных грибов на средах с избытком сахаров при дефиците азота, высокой температуре и хорошей аэрации. Более интенсивно эргостерин образуют дрожжи рода Candida на средах с углеводородами. При получении кристаллического препарата витамина D2 культивируют плесневые грибы (Penicillium, Aspergillus). Для получения кормовых препаратов облучают суспензию или сухие дрожжи (Candida). Облучают тонкий слой 5 % суспензии дрожжей ультрафиолетовыми лампами с длиной волны 280–300 нм. Кормовые препараты дрожжей содержат в 1 г АСВ 5000 Е витамина D2 и не менее 46 % сырого белка. Для получения кристаллического препарата витамина дрожжи или грибной мицелий подвергают кислотному гидролизу при 110°С. Витамин экстрагируют спиртом, фильтруют, далее фильтрат упаривают, несколько раз промывают спиртом. Спиртовый экстракт сгущают до 50 % концентрации сухих веществ, омыляют щелочью. Полученные кристаллы витамина очищают перекристаллизацией и сушат в эфире, отгоняя последний. Кристаллический осадок растворяют в масле. Данный препарат используют в медицинских целях. Эргостерин является также исходным продуктом для получения ряда стероидных гормонов, пищевых и лекарственных препаратов.
2.5. БИОПОЛИМЕРЫ
Термин «биополимеры» относится ко многим высокомолекулярным соединениям (полисахаридам, липидам, полиоксиалканоатам), которые являются для клеток резервными веществами и синтезируются в специфических условиях несбалансированного роста. Такими условиями, как правило, являются избыток углеродного и энергетического субстратов в среде и дефицит отдельных минеральных элементов (азота, фосфора, серы, магния и т.д.), лимитирующих синтез азотсодержащих компонентов и скорость роста клеток. Многие микробные биополимеры являются эндогенным источником углерода и энергии, поэтому способствуют сохранению выживаемости клеток в неблагоприятных условиях среды.
Полисахариды
Полисахариды (гликаны) – полимеры, построенные не менее чем из 11 моносахаридных единиц. Полисахариды являются обязательным компонентом всех организмов, присутствуют как изолированно, так и в комплексах с белками, липидами, нуклеиновыми кислотами. Полисахариды преобладают в растительных биомассах и составляют, следовательно, большую часть органического материала на планете. Полисахариды разнообразны по строению, локализации в клетках и, естественно, по своим физико-химическим свойствам. Особенно разнообразны полисахариды, синтезируемые микроорганизмами. Микробные полисахариды делятся на внутриклеточные, локализованные в цитоплазме, и внеклеточные – полисахариды слизей, капсул, чехлов. Многие полисахариды биологически активны и повышают устойчивость макроорганизмов к вирусной и бактериальной инфекциям, обладают противоопухолевым действием, а также антигенной специфичностью. Поэтому они находят все более широкое применение в медицине и фармацевтической промышленности в качестве диагностикумов, заменителей плазмы крови и пр. Чрезвычайно широки перспективы применения полисахаридов в связи с их гелеообразующими и реологическими свойствами в качестве загустителей сиропов и косметических средств, для упаковки продуктов и протравливания семян. Водные растворы отдельных полисахаридов чрезвычайно стабильны в широких интервалах рН и температуры, поэтому находят применения при добыче нефти и газа; флоккулирующие свойства гликанов используют в процессах очистки, концентрирования и разделения металлов. Возможности полисахаридов раскрыты далеко не полностью, поэтому их изучение ведет к расширению сферы применения.
Большинство микроорганизмов синтезируют полисахариды из разнообразных источников углерода, обеспечивающих их рост, – углеводов, спиртов, карбоновых кислот, С1-соединений. Природа и концентрация углеродного источника в среде существенно влияет на образование полисахаридов, которое сводится к созданию гликозидной связи между моносахаридными единицами (рис. 2.5); при этом гликозильный донор передает гликозил на акцептор-затравку, высвобождаясь при этом. Акцепторами служат олигосахара и недостроенные полисахариды. Часто первичным акцептором служат олигосахара, в ряде случаев – недостроенный полисахарид – «затравка». Полимеризация идет до образования готового полисахарида с участием специфических гликозилтрасфераз, которые отщепляют фрагменты линейной цепи недостроенного гликана и переносят их на ту же или аналогичную цепь в определенном положении.
Рис. 2.5. Схема образования гликозидной связи.
Синтез полисахаридов определяется условиями культивирования продуцента и составом питательной среды, которые определяют возможность и интенсивность их образования, а также состав, структуру и, следовательно, свойства. Существенное значение имеют не только качественный состав используемого углеродного сырья, но также и концентрация, так как эффективный синтез полисахаридов осуществляется на средах с высоким содержанием углеродного субстрата. Количество и форма источника азота, не влияя на состав полисахаридов, оказывает влияние на скорость роста микроорганизмов и количественных выход полисахаридов. Существенна также роль фосфатов и ионов марганца, магния, кальция, являющихся кофакторами синтеза полисахаридов. Разнообразно и специфично влияние рН и температуры среды на накопления гликанов. Существенен хороший уровень аэрации культуры. Производство полисахарив специфично для каждого и определяется природой, локализацией, свойствами, а также областью применения гликанов и, безусловно, физиологическими особенностями продуцента. Получение экзополисахаридов эффективнее внутриклеточных, так как их концентрация выше, меньше проблем на стадии выделения и очистки, однако в ходе ферментации возникают трудности с транспортом кислорода из газовой фазы в жидкую (при повышении экскреции гликанов в среду ее вязкость возрастает). Следствием этого становятся снижение роста клеток и торможение продукции полисахаридов.
Поэтому среду приходится разбавлять в десятки раз и после удаления клеток продуцента – концентрировать.
Спектр промышленных продуцентов и выпускаемых полисахаридов весьма разнообразен (табл. 2.3). Ведущими странами – производителями полисахаридов являются: США, Франция (ксантан, курдлан), Россия (декстран), Япония (пуллан, курдлан).
Таблица 2.3. Промышленные микробные полисахариды (по Gruger, Gruger, 1984)
|
Полисахарид
|
Продуцент
|
|
Ксантан
|
Xanthomonas campesrtis
|
|
Альгинат
|
Pseudomonas aeruginosa, Azotobacter vinelandii
|
|
Курдлан
|
Alcaligenes
|
|
Склероглюкан
|
Sclerotium glucanicum, S. delphinii, S. rolfsii
|
|
Пуллан
|
Pullularia pullulans
|
|
Декстран
|
Acetobacter sp., Leuconostac mesenteroides, L.dextranicum, Streptococcus mutans
|
Технология получения декстранов
Продуцентами декстранов являются штаммы Leuconostac mesenteroides, растущие на средах с высоким содержанием сахарозы (10–30 %), дестраном-«затравкой», дрожжевым экстрактом и минеральными солями. В зависимости от состава минеральных солей и той или иной природы «затравки» синтезируются высокомолекулярные (60–80 тыс.) линейные или имеющие низкую молекулярную массу (20–30 тыс.) разветвленные декстраны. Последние обладают наибольшей биологической активностью. Из декстранов выпускают плазмозаменители (клинический декстран, полиглюкин, плазмодекс, хемодекс и др.).
Типичный пример ферментации – глубинная периодическая культура, реализуемая на первом этапе с целью образования биомассы продуцента при избытке сахаров и рН 6.5–8.0. Синтез декстрансахаразы, ведущий к образованию гликанов, наиболее интенсивен при рН около 7.0. Помимо ионов магния синтез декстранов стимулируется при замене сахарозы мелассой. Бактерии расщепляют сахарозу с образованием глюкозы и фруктозы. Последняя сбраживается по гетероферментному пути с образованием молочной и уксусной кислот, маннита и углекислоты. Глюкоза быстро полимеризуется в декстран. Процесс завершается через 24 ч. Выделение декстрана из культуры проводят метанолом, для последующей очистки – многократно растворяют в воде, переосаждают метанолом и фракционируют. Декстрансахараза является экзоферментом, и ее концентрация в культуральной среде значительна. Поэтому возможен процесс получения полисахарида на основе растворимого фермента. Культуральная жидкость с декстрансахаразой при рН около 5.0 и 15°С способна около месяца проявлять высокую ферментативную активность. Реализован процесс на основе культуральной среды с ферментом, содержащей сахарозу и декстран-«затравку», – процесс полимеризации завершается в течении 8 ч. Этот способ значительно упрощает процедуру ферментации и стадию выделения и очистки декстрана и позволяет в контролируемых условиях получать продукт заданной молекулярной массы. Перспективы имеет также процесс на основе иммобилизованной декстрансахаразы. В середине 90-х гг. начат выпуск коньюгатов модифицированного декстрана с ферментом стрептокиназой. Препарат представляет собой пролонгированную декстраном форму стрептокиназы.
Ксантан
Ксантан, продуцируемый бактериями Xanthomonas campesrtis, обладает уникальными реологическими свойствами. В низких концентрациях он образует очень вязкие растворы и обладает псевдопластичностью; его растворы не изменяют свои реологические свойства при изменении температуры, рН, солености в широких пределах.
Ксантан применяют в пищевой промышленности, при изготовлении гелевых дезодорантов, зубной пасты, при суспендировании сельскохозяйственных химикатов, используют при добыче нефти. Объемы производства ксантана – наиболее крупнотоннажны из всех других гликанов. Товарное название выпускаемого продукта (ксантан, келцан, келтрол).
Получают ксантаны в условиях периодической глубинной культуры на средах, содержащих 1–5 % углеводов (кукурузный крахмал, сахар-сырец или меласса), а также органические соединения азота, двузамещенный фосфорнокислый калий, микроэлементы. Ферментация длится в течение 3 суток при 28°С и рН 6.5–7.2 в две фазы: на первой реализуется рост клеток и накопление биомассы, на второй при дефиците азота в среде происходит образование полисахарида. Осаждают полисахарид из культуральной жидкости метанолом, полученный осадок высушивают.
Альгинат
Данный полисахарид ранее выделяли из морской водоросли Laminaria. Альгинат обладает в определенных условиях прекрасными гелеобразующими, а также псевдопластическими свойствами в широком диапазоне рН и температур, и используется в кондитерской и фармацевтической промышленности. Установлено, что альгинат является лучшим носителем для иммобилизации ферментов и, особенно, целых клеток. Сравнительно недавно среди бактерий идентифицированы продуценты полисахарида, близкого альгинату (Pseudomonas aeruginosa, Azotobacter vinelandii). Процесс реализован в промышленности на средах с избытком углерода. Варьируя концентрацию фосфата в среде, можно влиять на молекулярную массу синтезируемого полимера, а при изменении концентрации кальция изменяется соотношение моносахаридов, входящих в состав данного гликана, следовательно, и его свойства.
Курдлан
Бактерии Alcaligenes faecalis штамм 10С3 синтезируют курдлан, представляющий собой полимер глюкозы. Важное свойства данного полисахарида – образование термически необратимых гелей. При нагревании свыше 64°С происходит гелеобразование курдлана; прочность геля не изменяется в диапазоне температур 60–80° и существенно возрастает при увеличении температуры свыше 120°, при этом одиночная спираль переходит в тройную. Курдлан нерастворим в холодной воде.
Курдлан обладает противоопухолевой активностью, поэтому находит применение в медицине. Ацетильные производные курдлана применяют в качестве основы ультрафильтрационных полупроницаемых мембран для разделения веществ с молекулярной массой 200–2000. Ферментация протекает в глубинной периодической культуре в речение 80 ч на средах, содержащих 8 % глюкозы; выход полисахарида составляет около 40 г/л. В связи с привлекательностью свойств данного продукта технология его получения интенсивно совершенствуется.
Пуллан
Полисахарид продуцируется дрожжеподобным грибом Aerobasidium pullulans на средах, содержащих 50 % глюкозы в течение 80–100 ч. Вязкость пуллана зависит от рН среды: она минимальна при рН 4.0, молекулярная масса при этом составляет около 200 тыс., при увеличении рН молекулярная масса возрастает. Пуллан используют в качестве биоразрушаемого упаковочного материала для пищевых продуктов; он обладает также антиокислительными свойствами.
Склероглюкан
Склероглюкан (товарное название – политран) синтезируют грибы рода Sclerotium. Синтез данного полисахарида в отличие от большинства других максимален в ранней лог-фазе 48-ч культуры. Процесс разработан на средах с глюкозой, в том числе в проточном режиме, выход полисахарида от ассимилированной глюкозы составляет 50 %. В низких концентрациях (1.5 % растворы) образует в воде прочные гели, которые не изменяют свои свойства в широком интервале температур. Используют в качестве покрытия семян, пестицидов, а также при производстве латексов и красителей.
Задачей биотехнологии является совершенствование микробиологических процессов получения полисахаридов на основе улучшенных штаммов-продуцентов при расширении сырьевой базы за счет замены дорогостоящих сахаров более доступными субстратами, а также модификация физико-химических свойств самих гликанов.
Микробные полиоксиалканоаты
Полиоксиалканоаты (ПОА) – биополимеры оксипроизводных жирных кислот, синтезируются многими прокариотическими микроорганизмами в специфических условиях несбалансированного роста при избытке углеродного и энергетического субстрата в среде и дефиците минеральных элементов (азота, серы, фосфатов и др.), а также кислорода. Среди наиболее перспективных продуцентов ПОА – Azotobacter, Bacillus, Methylomonas, Pseudomonas, Alcaligenes.
Наиболее изученным в настоящее время является полиоксибутират – полимер β-оксимасляной кислоты (С4Н8О2). Молекулярная масса полимера определяется условиями синтеза полимера, спецификой продуцента, а также процедурой экстракции полимера из биомассы. Помимо полиоксибутирата, микроорганизмы способны синтезировать гетерополимерные ПОА – сополимеры оксибутирата и оксивалерата, оксибутирата и оксигек- саноата, полиоксибутирата и полиоксигептаноата и др. а также трех-, четырех- и более компонентные полимеры. Таким образом, химический состав и, как установлено в последние два-три года, отдельные физико-химические свойства (молекулярный вес, кристалличность, температурные характеристики, скорости биодеградации, механическая прочность) могут существенно варьировать. Это открывает пути для получения в будущем полимерных материалов с заданными свойствами.
Практический интерес и значимость данных исследований определяются свойствами полиоксиалканоатов, которые по своим базовым показателям близки к полипропилену (табл. 2.4), но обладают также рядом уникальных свойств, включая совместимостью с животными тканями, оптическую активность, пьезоэлектрические и антиоксидантные свойства и, самое главное, биодеградабельность.
Свойства ПОА делают их перспективными для применения в различных сферах: медицине и хирургии (прочный рассасываемый хирургический материал, элементы для остеосинтеза, сосудистой пластики, пленочные покрытия ран и ожоговых поверхностей, одноразовые изделия, в т.ч. нетканые материалы), фармакологии (пролонгация действия лекарственных веществ), пищевой промышленности (предупреждение окислительной порчи напитков и продуктов, упаковочные материалы), сельском хозяйстве (обволакивание семян, покрытие удобрений и пестицидов), радиоэлектронике, коммунальном хозяйстве (различные разрушаемые тара и упаковочные материалы) и пр.
Таблица 2.4. Сравнение свойств полиоксибутирата (ПОБ) и полипропилена (ПП) (по D. King, 1982)
|
Свойства
|
ПОБ
|
ПП
|
|
Температура плавления (°С)
|
175
|
176
|
|
Прозрачность (%)
|
80
|
70
|
|
Молекулярный вес (D)
|
5.105
|
2.105
|
|
Температура стеклования (°С)
|
15
|
-10
|
|
Удельный вес (г/см3)
|
1.250
|
0.905
|
|
Модуль изгиба (ГПа)
|
4.0
|
1.7
|
|
Прочность на разрыв (МПа)
|
40
|
38
|
|
Растяжение на разрыв (%)
|
6
|
400
|
|
Устойчивость к ультрафиолету
|
хорошая
|
плохая
|
|
Устойчивость к растворителям
|
плохая
|
хорошая
|
Синтез полиоксибутирата и других ПОА в принципе возможен с использованием различного сырья: сахаров, спиртов, ацетата, а также водорода и углекислоты (табл. 2.5).
Таблица 2.5. Затраты сырья и выход полиоксибутирата на различных субстратах (по Collins, 1987)
|
Субстрат
|
Цена, долл/т
|
Выход ПОБ, т/т субстрата
|
Затраты, долл/т ПОБ
|
|
Метанол
|
110
|
0.18
|
610
|
|
Этанол
|
440
|
0.50
|
880
|
|
Ацетат
|
370
|
0.33
|
1220
|
|
Декстроза
|
360
|
0.33
|
1180
|
|
Тростниковый сахар
|
200
|
0.33
|
500
|
|
Водород
|
500
|
1.0
|
500
|
Углерод, ассимилированный клетками тем или иным путем, превращается в пируват, который декарбоксилируется с образованием ацетил-КоА. Последний включается в реакции цикла трикарбоновых кислот, и при нарушениях в системах амфиболизма, вызванных дефицитом структурных элементов для синтеза белка, не становится предшественником аминокислот, а подвергается поликонденсации, далее восстанавливается с участием НАДН в реакциях β-окисления в оксимасляную кислоту, которая подвергается полимеризации с образованием полиоксибутирата:
Процесс накопления полиоксибутирата осуществляют микробные клетки при несбалансированном росте, например, голодающие по азоту или кислороду, то есть медленно растущие. При этом возникает проблема, как получить большие урожаи биомассы с одновременным большим содержанием полимеров. Высокопродуктивные проточные системы ферментации не приемлемы для больших выходов ПОА. Процесс проводят в периодическом режиме, обычно в две стадии, на первой клетки, получая все необходимые питательные вещества, растут с достаточно высокими скоростями роста и образуют практически всю биомассу; на втором этапе процесс продолжается при избытке источников углерода и энергии, но при лимитировании роста одним их биогенов. В результате происходит включение ассимилированных клетками углерода, главным образом, в полимер, выходы которого могут достигать свыше 70 % к весу сухого вещества клетки.
В промышленных масштабах процесс реализован фирмой «Ай-Си-Ай» в Великобритании. В качестве продуцента используют мутантный штамм водородных бактерий Alcaligenes eutrophys, способный усваивать глюкозу. Процесс реализуется в периодическом двустадийном режиме при лимите азота в среде с затратами сахаров до 3 т/т полимера в течение 110–120 часов. Объемы применяемых для получения полимера ферментационных аппаратов достигают от 3.5 до 200 м3. Помимо глюкозы, возможно использование тростникового сахара, фруктозных сиропов, мелассы. Товарное название продукта «Биопол». Помимо гомогенного полиоксибутирата фирма выпускает гетерополимер – продукт сополимеризации оксибутирата и оксивалерата на средах, содержащих глюкозу и пропанол либо только валериановую кислоту в концентрации до 20 г/л. Получение клеток с высоким содержанием полимера – только одна часть проблемы. Существенной технологической задачей является также процедура экстракции поли- мера из биомассы и последующая очистка. Важная проблема, возникающая при этом, снижение молекулярной массы продукта в ходе постферментационной стадии. В общем виде процедура включает несколько стадий: отделение клеток от культуральной среды, разрушение клеток, экстракцию полимера из клеток с помощью неполярных растворителей (хлороформ, гексан), осаждение спиртом и высушивание.
На экономику производства микробных полиоксиалканоатов существенным образом влияет стоимость исходного сырья, а также выходы полимера и его исходные физико-химические свойства.
В настоящее время полиоксибутират планируется применять в достаточно узких сферах (медицина, фармакология), однако экологичность данного материала по сравнению с неразрушаемыми и получаемыми в экологически тяжелых процессах нефтесинтеза полиолефинов позволяют считать, что микробные ПОА в недалеком будущем смогут стать базовым термопластичным полимером для различных сфер применения. Поэтому процессы получения полиоксибутирата и других гетерополимерных ПОА являются объектом пристального внимания и научных поисков всех развитых стран.
2.6. АНТИБИОТИКИ
Антибиотики (антибиотические вещества) – это продукты обмена микроорганизмов, избирательно подавляющие рост и развитие бактерий, микроскопических грибов, опухолевых клеток. Образование антибиотиков – одна из форм проявления антагонизма. В научную литературу термин веден в 1942 г. Ваксманом, – «антибиотик – против жизни». По Н. С. Егорову: «Антибиотики – специфические продукты жизнедеятельности организмов, их модификации, обладающие высокой физиологической активностью по отношению к определенным группам микроорганизмов (бактериям, грибам, водорослям, протозоа), вирусам или к злокачественным опухолям, задерживая их рост или полностью подавляя развитие».
Специфичность антибиотиков по сравнению с другими продуктами обмена (спиртами, органическими кислотами), также подавляющими рост отдельных микробных видов, заключается в чрезвычайно высокой биологической активности. Например, минимальная концентрация эритромицина (0.01–0.25 мкг/мл) полностью подавляет многие грамположительные формы. Механизмы повреждающих воздействий антибиотиков на клетки различны. Отдельные антибиотики (пенициллины, новобиоцин, цефалоспорины) подавляют процессы образования клеточных стенок; другие (стрептомицин, полимиксины) изменяют проницаемость мембран; третьи (грамицидины) подавляют окислительное фосфорилирование; хлорамфеникол подавляет отдельные этапы синтеза белка на рибосомах; азасерин и сарколизин – вызывают нарушения в процессах синтеза нуклеиновых кислот и т.д.
Существует несколько подходов в классификации антибиотиков: по типу продуцента, строению, характеру действия. По химическому строению различают антибиотики ациклического, алициклического строения, хиноны, полипептиды и др. По спектру биологического действия антибиотики можно подразделить на несколько групп:
- антибактериальные, обладающие сравнительно узким спектром действия (пенициллин, эритромицин, грамицидин, бацитрацин), подавляют развитие грамположительных микроорганизмов (стафилококки, стрептококки, пневмококки), и широкого спектра действия (стрептомицин, тетрациклины, неомицин, хлоромицетин), подавляющие как грамположительных, так и грамотрицительных микроорганизмов (кишечную палочку, дифтерии, брюшного тифа);
- противогрибковые, группа полиеновых антибиотиков (нистатин, гризеофульвин и др.), действующие на микроскопические грибы;
- противоопухолевые (актиномицины, митомицин и др.), действующие на опухолевые клетки человека и животных, а также на микроорганизмы.
В настоящее время описано свыше 6000 антибиотиков, но на практике применяется только около 150, так как многие обладают высокой токсичностью для человека, другие – инактивируются в организме и пр.
Антибиотики широко применяются в различных сферах человеческой деятельности: медицине, пищевой и консервной промышленности, сельском хозяйстве. Открытие антибиотиков вызвало переворот в медицине. Широко известно применение антибиотиков с бактерицидным и бактериостатическим действием; благодаря антибиотикам стали излечимыми многие инфекционные заболевания (чума, туберкулез, пневмония, брюшной тиф, холера и т.д.). В течение многих лет антибиотики применяют в сельском хозяйстве в качестве стимуляторов роста сельскохозяйственных животных, средств борьбы с болезнями животных и растений. Антибиотические вещества также широко применяют для борьбы с посторонней микрофлорой в ряде бродильных производств и в консервной промышленности. Однако нельзя не отметить, что длительное и неконтролируемое применение антибиотиков приводит к возникновению и широкому распространению в микробных популяциях R-фактора устойчивости к антибиотикам, передающегося от одной бактериальной клетки к другой при помощи плазмид в процессе коньюгации. Средствами борьбы с проявлением лекарственной устойчивости к антибиотикам является обоснованное и строго контролируемое их применение и получение новых, модифицированных антибиотических препаратов, обладающих биологической активностью к резистентным формам.
Способность синтезировать антибиотики широко распространена среди различных представителей микробного мира. Связи между таксономическим положением микроорганизмов и способностью синтезировать тот или иной антибиотик нет. Так, микроорганизмы, принадлежащие к одной группе, способны синтезировать самые разнообразные по химическому строению и действию антибиотики, и один и тот же антибиотик может продуцироваться различными микроорганизмами. Продуцентами антибиотиков являются бактерии, актиномицеты, мицелиальные грибы.
Описано около 600 антибиотиков, которые синтезируются бактериями. Эти антибиотики по химическому строению принадлежат к полипептидам и низкомолекулярным белкам. Однако в промышленных масштабах выпускается незначительное число антибиотиков бактериального происхождения. Важнейшими их них являются: грамицидин (Bacillus brevis), полимиксины (Bac. polymyxa, Bac. circulans), бацитрацины (Bacillus licheniformis), низины (Streptococcus lactis).
Самое большое количество (свыше 70 %) антибиотиков, выпускаемых промышленностью и широко применяемых, синтезируется актиномицетами. Среди них – антибиотики различного химического строения, которые относят к нескольким группам: а) аминогликозиды – стрептомицин (Streptomyces griseus), неомицины (Streptomyces fradiae, Str. albogriseolus), канамицины (Str. kanamyceticus), гентамицины (Micromonospora purpurea) и др.; б) тетрациклины – хлортетрациклин (Str. aureofaciens), окситетрациклин (Str. rimosus); в) актиномицины – большая группа близких по строению препаратов, синтезируемых различными микроорганизмами, в том числе (Streptomyces antibioticus, Str. chrysomallus, Str. flavus); г) макролиды – эритромицин (Streptomyces erythreus), олеандоимицин (Str. antibioticus), магнамицин (Str. halstedii), филипин (Str. filipensis); д) анзамицины – стрептоварицины (Str. spectabilis), рифамицины (Nocardia mediterranea), галамицины (Micromonospora halophytica), нафтамицин (Str. collinus) и др.
Мицелиальные грибы также синтезируют достаточно большое количество антибиотиков (около 1200). Наиболее известны среди них следующие: пенициллины (Penicillium chrysogenum, P. brevicompactum, Aspergillus flavus, Asp. nidulans), цефалоспорины (Cephalosporium acremonium), фумалгин (Aspergillus fumigatus), гризеофульвин (Penicillium nigricans, P. griseofulvum), трихоцетин (Trichthecium roseum).
Синтез антибиотиков микробными клетками – это специфический процесс обмена веществ, возникший и закрепленный в процессе эволюции организма. Каждый микробный вид способен образовывать один или несколько вполне определенных антибиотических веществ. Выделенные из природных источников, так называемые «дикие» штаммы обладают низкой антибиотической активностью. В промышленности применяют в качестве продуцентов штаммы, которые по сравнению с исходными штаммами обладают повышенной на 2–3 порядка антибиотической активностью. Это достигается, как и во многих других биотехнологических процессах, двумя способами: генетическими усовершенствованиями организмов и оптимизацией условий ферментации.
Антибиотики – это вторичные продукты обмена микроорганизмов, (идиолиты). Характерной особенностью развития продуцентов антибиотических веществ является ярко выраженная двухфазность: в первой фазе развития микроорганизмов происходит накопление биомассы, во второй – синтез антибиотика. При этом очень важно создать условия ферментации, адекватные этой двухфазности с учетом ингибирующего действия антибиотика как продукта обмена на продуцент.
Нельзя не отметить, что создание промышленности антибиотиков является крупнейшим достижением биологии нашего столетия. Организация этого производства потребовала коренных преобразований существующей микробиологической промышленности: при этом были решены вопросы обеспечения строжайших условий стерильности в ходе всех стадий биотехнологического процесса, разработаны и созданы эффективная аппаратура с высокими газо-динамическими характеристиками, средства борьбы с сильным пенообразованием, методывполучения стерильных препаратов антибиотиков высокой степени чистоты. Распространение этих достижений и применение их в других, сложившихся биотехнологических процессах, основанных на жизнедеятельности микроорганизмов, сыграло решающую роль в становлении современной биотехнологии в целом.
В процессах производства антибиотиков очень большое значение имеет правильный выбор состава питательной среды. В зависимости от природы используемого микроорганизма в качестве источника углерода возможно применение различных субстратов. Например, для получения пенициллина лучшим источником углерода и энергии является глюкоза и лактоза; грамицидина – глицерин и соли янтарной кислоты; стрептомицина и неомицина – глюкоза. При разработке состава среды для каждого отдельного продуцента индивидуально подбирают не только тип углеродного субстрата, но и его концентрацию. В качестве источника азота многие продуценты антибиотиков используют восстановленные формы (аммоний и аминокислоты), однако некоторые предпочитают нитраты. Когда источник азота должен присутствовать в виде готовых аминокислот, полипептидов или белков, используют пшеничную и кукурузную муку, экстракты дрожжевой биомассы. Большое значение имеет также концентрация в среде фосфора, а также других минеральных элементов (серы, марганца, железа, кобальта и др.). В ряде случаев существенного увеличения выхода антибиотического вещества достигают в результате внесения в среду предшественников синтеза конкретного антибиотика. В связи c интенсивным пенообразованием, сопровождающим процесс синтеза антибиотиков, в состав среды вводят пеногасители (растительные и животные жиры, минеральные масла).
Помимо состава среды, большое влияние на выход антибиотиков оказывают другие физико-химические факторы среды: рН, температура, обеспечение кислородом, которые подбираются и задаются индивидуально для каждого продуцента.
На предферментационной стадии получают инокулят из музейной культуры и готовят питательную среду. После стерилизации технологического оборудования и среды в ферментер вносят требуемое количество инокулята и начинают процесс ферментации. В промышленности используют аппараты различной емкости, от 500 л до 100 м3 и более. В ходе ферментации культура непрерывно аэрируется стерильным подогретым воздухом. Температура среды, рН и ряд других параметров автоматически регулируются в соответствии с регламентом производства конкретного антибиотика.
Процесс ферментации осуществляется в строго стерильной, глубинной, аэробной и периодической культуре и носит выраженный двухфазный характер (рис. 2.6).
Рис. 2.6. Процесс развития Streptomyces fradiae 3535 и образования неомицина (по Ваксману, 1953). 1 – глюкоза, 2 – мицелий, 3 – неомицин.
Первая фаза сбалансированного роста (тропо-фаза) характеризуется быстрым накоплением биомассы продуцента на фоне исчерпания углеродного субстрата, а также азота, фосфатов и др. При этом может наблюдаться некоторое изменение величины рН; синтез антибиотиков не наблюдается или имеет место в незначительных количествах. На второй фазе (идиофаза) прирост биомассы прекращается, и может иметь место некоторое падение концентрации клеток в культуре в результате гибели и лизиса некоторой части популяции. При этом среда обогащается продуктами обмена и продуктами автолиза погибших клеток, и начинается активный процесс синтеза антибиотиков. Исключительно важным на этом этапе становится правильно организованный режим пеногашения. Наряду с пеногасителями химической природы, дополнительно применяют механическое пеногашение с использованием специальных устройств. В большинстве случаев антибиотики выделяются в культуральную среду, хотя возможно и сохранение их внутри клеток. Локализация антибиотика, а также сфера применения последнего определяют специфику приемов постферментационной стадии. Если антибиотик находится в клетках, на первом этапе обработки биомассу выделяют из культуральной жидкости (фильтрацией или центрифугированием); далее после разрушения клеток антибиотик экстрагируют и переводят в растворимую фазу. Затем данный раствор, а также культуральные среды, (если антибиотик в процессе идиофазы выделяется из клеток в среду) подвергают различным методам экстракции, разделения, очистки и концентрирования для получения готового продукта. Особенность процедуры выделения и очистки антибиотиков – разбавленные исходные растворы (около 1 %) и возможность инактивации антибиотика в ходе постферментационной стадии. Цель всех процедур постферментационной стадии – получение стерильных препаратов высокой степени чистоты. Особенно высокие требования предъявляют к антибиотикам медицинского назначения. Поэтому выделение, очистка, концентрирование, высушивание, а также расфасовка и упаковка медицинских антибиотиков осуществляются в асептических условиях. Готовый продукт подвергается тщательному биологическому и фармакологическому контролю. Биологический контроль определяет степень стерильности препарата. В ходе фармакологического контроля проводят всесторонние испытания препарата на токсичность, пирогенность, токсикогенность и пр., устанавливают максимально переносимую дозу антибиотика, дозы, вызывающие полную и 50 % гибель экспериментальных животных. Готовая форма лекарственного препарата антибиотического вещества поступает к потребителю с указанием биологической активности и даты выпуска.
Антибиотики немедицинского назначения, применяемые в сельском хозяйстве, получают также в условиях строго стерильной регламентированной культуры, однако готовый продукт представляет собой высушенную биомассу продуцента или культуральную среду. В таком препарате, помимо антибиотика, содержатся также другие биологически активные вещества (витамины группы В, ферменты, витамины, аминокислоты). Наиболее известны среди применяемых в качестве кормовых антибиотических препаратов – биовит и биомицин, являющиеся препаратами хлортетрациклина, а также гризин, бацитрацин, гигромицин и др. Подавляя развитие болезнетворных микроорганизмов, тем самым снижая заболеваемость и смертность, антибиотики ускоряют рост и развитие животных и птицы. Так, применение антибиотиков в свиноводстве обеспечивает дополнительный привес от каждой тысячи животных до 120 ц при сокращении расхода кормов на 5–10 %. При добавлении антибиотиков в корм кур-несушек можно дополнительно получить до 15 тыс. яиц в год от 1000 кур. В течение последних 25 лет антибиотики применяют также для борьбы с фитопатогенами, возбудителями которых являются микроорганизмы. Антибиотические вещества наносят на вегетативные части растения, а также на семена или вносят в почву. В результате селективного действия на фитопатогенные микроорганизмы антибиотики задерживают рост или убивают микроорганизмы-возбудители, не нанося вреда растению. Наиболее эффективными фитопатогенными препаратами являются трихотецин, полимицин, фитобактериомицин, гризеофульвин.
Поиск продуцентов новых антибиотиков непрерывно продолжается. Огромные перспективы для получения высокопродуктивных штаммов открываются в связи с развитием новейших методов клеточной и генетической инженерии. Помимо усовершенствования природы микроорганизмов-продуцентов антибиотических веществ, оптимизации аппаратуры и технологий, большое значения для получения нового спектра препаратов, обладающих более ценными свойствами по сравнению с исходными, имеет так называемая модификация антибиотиков и получение полусинтетических препаратов. Полученные микробиологическим путем антибиотики подвергают химической модификации, в результате которой возможно получение препаратов с более выраженным физиологическим действием.
Глава 3. ИНЖЕНЕРНАЯ ЭНЗИМОЛОГИЯ
В конце 60-х – начале 70-х гг. на базе технической биохимии, химической технологии, химической энзимологии и ряда инженерных дисциплин возникло новое научно-техническое направление биотехнологии – инженерная энзимология, к которой относят систему методов получения, очистки, стабилизации и применения ферментов. Основной задачей инженерной энзимологии является конструирование биоорганических катализато- ров с заданными свойствами на основе ферментов или ферментных комплексов и разработка на их базе различных эффективных и экологически чистых биотехнологических процессов. Высокая субстратная специфичность ферментативного катализа и уникальная способность ускорять реакции в десятки и сотни раз в условиях нормального давления и физиологических температур позволяют получать высокие выходы продуктов и создавать практически безотходные биотехнологические процессы, не загрязняющие окружающую среду.
Эффективные биотехнологические процессы на основе ферментативного катализа используются все шире в различных сферах человеческой деятельности: пищевой промышленности, энергетике, медицине, биоэлектрокатализе и микроэлектронике.
3.1. ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ ФЕРМЕНТОВ
Ферменты – это специфические катализаторы белковой природы, вырабатываемые клетками и тканями организмов. Они способны во много раз ускорять течение химических и биохимических реакций, не входя в состав конечных продуктов. Практические применения ферментов основаны на их высокой каталитической активности и более высокой по сравнению с небиологическими каталитическими системами субстратной специфичностью. Источником ферментов служат растительные и животные ткани, микроорганизмы. Химический синтез ферментов в промышленных масштабах очень сложен, дорог и экономически не целесообразен. Микробиологический метод получения ферментов – наиболее перспективен. Его преимущества заключаются в следующем: 1) богатство ассортимента ферментов, синтезируемых микроорганизмами, 2) возможность управления ферментативными системами и составом производимых препаратов, 3) высокие скорости размножения микроорганизмов и возможность использования различных, в том числе доступных и недорогих субстратов. Ферменты в микробных клетках могут иметь как внутриклеточную локализацию, так и выделяться в окружающую среду. Последние более доступны для препаративного получения, поэтому в промышленных масштабах получают главным образом внеклеточные ферменты. Из описанных к настоящему времени более 2000 ферментов практическое значение имеют около 50.
Согласно современной классификации, все ферменты подразделяются на 6 классов: оксидоредуктазы, трансферазы, гидролазы, лиазы, изомеразы и линазы (синтетазы).
Негидролитические ферменты – оксидоредуктазы, лиазы, изомеразы и лигазы применяются сравнительно редко. Наиболее широкое применение получили микробные гидролазы, взаимодействующие с пептидами, гликозидами и другими соединениями с участием воды. Среди гидролаз – гликозидазы, протеиназы, липазы.
Гликозидазы катализируют гидролиз гликозидных соединений. Так, крахмал гидролизуют амилазы, продуцентами которых являются различные микроорганизмы (Bacillus, Aspergillus); декстраназа, взаимодействующая с гликозидными связями декстрана, синтезируется Penicillium purpurogenium; пуллоназа, гидролизующая пуллан, гликоген, декстрины, продуцируется бактериями Klebsiella; инвертаза синтезируется многими представителями рода Aspergillus; целлюлолитические ферменты, являющиеся сложным комплексом активных белков, воздействуют на различные участки молекулы целлюлозы. Фитопатогенные грибы Fusarium oxysporum, Erwinia образуют пектинолитические ферменты; анаэробные бактерии Clostridium felsineum продуцируют полигалактуроназу, пектинэстеразу. Очень разнообразны протеиназы, катализирующие разрыв пептидных связей белков с образованием пептидов и свободных аминокислот. Протеиназы различных микроорганизмов существенно различаются своими свойствами; среди продуцентов протеиназ – Aspergillus, Actinomyces, Clostridium, E.coli. Продуцентами липаз, осуществляющих гидролиз триацилглицеролов с образованием жирных кислот и глицерина, являются различные микроорганизмы (Aspergillus, Mucor, Rhizopus, Geotrichum, Candida). Фосфокиназы, синтезируемые бактериями Clostridium, Bacillus, расщепляют сложные связи между жирными кислотами, глицерином и фосфатидной кислотой.
История применения ферментов уходит корнями в далекое прошлое. Некоторые ферменты, содержащиеся в природных растительных материалах, издавна использовались человеком для получения пива, спиртных напитков, производства хлеба и кисломолочных продуктов. Практика, основанная на коллективном опыте людей, намного опередила получение знаний и разработку научных основ для создания данных технологических процессов. Промышленная отрасль получения ферментных препаратов из природного растительного сырья стала зарождаться только в конце XIX столетия, а эра современной инженерной энзимологии насчитывает около 30 лет. Тем не менее, ферменты настолько широко вошли в нашу жизнь и настолько широко применяются в различных промышленных отраслях, что представить без них наше существование сегодня не представляется возможным. Промышленное получение и применение ферментов в различных технологических процессах составляет в настоящее время один из важнейших разделов новейшей биотехнологии.
Огромное значение ферменты имеют в различных отраслях пищевой промышленности. В хлебопечении амилазы ускоряют процесс созревания и улучшают качество теста; их используют также для получения растворимого крахмала, патоки, декстрина. Грибные амилазы заменяют солод, лактазу используют для удаления молочного сахара из молока; инвертазы сахаров, предупреждающие кристаллизацию сахарозы, применяют в кондитерской промышленности. Комплекс ферментов – цитаз, используют для более полной экстракции соков из плодов и овощей, а также получения эфирных масел. Грибные глюкозидазы, освобождая продукты от остаточных сахаров, удлиняют сроки их хранения. С помощью каталазы из продуктов удаляют перекиси водорода, целлюлазы применяют для осахаривания крахмала из картофеля и зерна, а также увеличения выхода агар-агара из водорослей. Протеолитические ферменты микробного происхождения заменяют реннин в сыроделии. Липазы находят применение в производстве сухого молока и для ускорения созревания сыров.
Пектинолитические ферменты издавна применяются для обработки льносоломы и получения из нее волокна. Амилолитические ферменты используют для удаления клея из тканей (расшлифовка); некоторые протеиназы применяют для удаления серицина и высвобождения шелковых волокон из шелка-сырца; для обезжиривания волокон используют липазы. В кожевенной промышленности при помощи протеолитических ферментов производят обезволашивание шкур и мягчение голья, ускоряют также процессы получения высококачественной шерсти. Ферментные препараты применяют в сельском хозяйстве при производстве кормов. Пектиназы и гемицеллюлазы повышают доступность и усвояемость кормов, ускоряют процессы силосования трудно- и несилосующихся зеленых кормов.
Все большее применение ферменты находят в тонком органическом синтезе в процессах получения различных сложных соединений (аминокислот, пептидов, нуклеотидов, полусинтетических антибиотиков), а также в медицине. Ряд ферментов применяют в так называемой «заместительной терапии» для восполнения имеющегося ферментативного дефицита. Так, препараты протеиназ используют для удаления некротических тканей в ходе лечения гнойных ран и ожогов. Бактериальную аспарагиназу, расщепляющую аспарагин, необходимый лейкозным клеткам, применяют при ряде злокачественных заболеваний. Препараты протеиназ (террилин и стрептокиназа) обладают тромболитическим действием и применяются для борьбы с тромбозами. Холестеринэстераза гидролизует холестерин, локализованный на внутренних стенках кровеносных сосудов. Особое место занимают высокоочищенные ферменты, используемые в аналитике, микроанализе, биоэлектрокатализе.
Таким образом, объемы и спектр выпускаемых ферментов, а также области их применения расширяются с каждым годом.
Микроорганизмы, являющиеся источником для получения разнообразных ферментов, существенно различаются между собой по способности синтезировать данные биологически активные соединения. Эти различия проявляются как в ассортименте синтезируемых ферментов тем или иным микробным видом, так и в их активности и исходных свойствах. Ферменты – вещества белковой природы, поэтому в смеси с другими белками определить их не представляется возможным. Наличие фермента устанавливают по протеканию той реакции, которую катализирует фермент; количественное определение фермента проводят по величине образовавшегося продукта реакции либо по расходу исходного субстрата. Принята так называемая стандартная единица активности (E или U) – это количество фермента, которое катализирует превращение 1 микромоля субстрата в минуту при заданных стандартных условиях.
Выбор продуцента необходимого фермента сопряжен с проверкой активности огромного количества культур, приводящей к отбору наиболее активного продуцента. Природные штаммы обычно не синтезируют ферменты в избыточных количествах, так как процесс их синтеза находится под строгим генетическим контролем. Исключение составляют конститутивные ферменты, например ферменты гексозомонофосфатного пути, которые синтезируются в больших количествах в любых условиях роста. Наряду с отбором наиболее активных штаммов-продуцентов ферментов из микробных коллекций или выделенных из природных источников, продуцирующих конститутивные ферменты, широко используют индуцибельные и репрессибельные ферменты, которые синтезируются клетками в результате изменения условий ферментации или генетического аппарата клетки. К индуцибельным относятся многие ферменты, имеющие коммерческую ценность.
Индукция – это универсальный контроль для катаболических путей. Процесс ферментации с целью получения индуцибельных ферментов ведут в присутствии субстрата-индуктора. Так, для получения амилаз в среду вносят крахмал, рибонуклеазы – РНК, липаз – жиры, инвертазы – сахарозу и т.д. В результате способности синтезироваться индуцированно в ответ на заданный субстрат, возможно использование одной культуры для получения различных ферментов (табл. 3.1). Это свойство широко используется в промышленности для получения различных ферментов.
Таблица 3.1. Синтез протеолитических ферментов в глубинной культуре Actinomyces fradiae на средах с различными индукторами (по Р. В. Фениксовой, 1973)
|
Состав среды
|
Рост,
ч
|
Белок, мг/мл
|
Активность, ед./мл
|
||
|
Казеиназа
|
Эластаза
|
Кератиназа
|
|||
|
Соли, шерсть
|
72
|
0.5
|
0.1
|
0.2
|
0.2
|
|
Соли, крахмал, шерсть, янтарная кислота
|
72
|
0.9
|
1.5
|
2.9
|
3.4
|
|
Соли, крахмал, рог, янтарная кислота
|
72
|
1.1
|
2.3
|
5.3
|
6.0
|
|
Соли, крахмал, соевая мука
|
96
|
1.7
|
4.8
|
9.9
|
8.9
|
Таблица 3.2. Дерепрессия биосинтетических ферментов при ограниченном питании ауксотрофов факторами роста (по Wang e.a., 1983)
|
Фактор роста
|
Дерепрессированный фермент
|
Увеличение активности
|
|
Лейцин
Тиамин
Биотин
|
Синтетаза гидроксиуксусной кислоты
4 фермента тиаминового синтеза
7-окси-8-амино-пеларгонат аминотрансфераза
|
в 40 раз
до 1500 раз
в 400 раз
|
Репрессии синтеза фермента конечным продуктом можно избежать, не допуская накопления последнего. При выращивании ауксотрофных штаммов на средах с дефицитом факторов роста накопления конечного продукта не происходит, и фермент дерепрессируется. В результате этого активность целевого фермента удается повысить многократно (табл. 3.2). Дерепрессии синтеза ферментов можно добиться, выращивая частичный ауксотрофный организм, который медленно растет на минимальной среде. Но стимулируется ростовым фактором. Возможно получение конститутивных мутантов, которые не репрессируются конечным продуктом. Такие мутанты получают, адаптируя организмы к токсическому аналогу конечного продукта с последующей селекцией на устойчивость.
Многие ферменты, в основном катаболического индуцибельного типа, репрессируются при быстром росте клеток на легко утилизируемом субстрате. Для того чтобы избежать катаболитной репрессии, в среду не вносят репрессирующий субстрат, и применяют мутанты, устойчивые к катаболитной репрессии.
Выход ферментов можно увеличить также с помощью новейших методов биотехнологии. С помощью плазмид или трансдуцирующих фагов можно увеличить копийность генов, кодирующих синтез целевых ферментов. Усиление экспрессии генов возможно также в результате включения сильных промоторов в ДНК.
Помимо генетического фактора, огромное влияние на продукцию ферментов оказывают состав среды и условия культивирования микроорганизмов. При этом не только наличие индуктора в среде способно увеличить выход фермента. Чрезвычайно важным является качественный и количественный состав питательных сред. Например, большинство видов плесневых грибов рода Aspergillus хорошо растут на достаточно простой синтетической среде Чапека с сахарозой и нитратом. Для синтеза амилазы, однако, сахарозу следует заменить крахмалом и увеличить концентрацию углерода и азота в среде. После этого активность фермента возрастает в 3 раза. Добавление аминокислот в виде экстракта солодовых ростков выход фермента повышает дополнительно в 4–5 раз. Оптимизируя состав питательной среды, можно повысить активность амилазы более чем в 500 раз (табл. 3.3).
При подборе состава среды учитывают все факторы: вид и концентрацию источника углерода и энергии, факторы роста, минеральные элементы, индуцирующие субстраты. В качестве источников углерода и азота чаще всего применяют различное природное органическое сырье: крахмал, кукурузный экстракт, соевую муку, гидролизаты дрожжевых биомасс. Помимо источника углерода, азота и факторов роста, большое влияние на синтез ферментов оказывают минеральные соли магния, марганца, кальция, железа, цинка, меди и др., многие из которых входят в состав ферментов.
Биотехнологическое производство ферментов реализуется двумя способами – поверхностным и глубинным. Твердофазная поверхностная ферментация заключается в выращивании продуцента на поверхности тонкого слоя твердой сыпучей среды. Глубинная ферментация в жидкой среде может быть реализована как в условиях периодического процесса, так и с применением проточных систем.
При поверхностной ферментации для получения инокулята споровый материал размножают поверхностным способом или выращивают музейную культуру в условиях глубинной жидкой культуры. Далее посевной материал направляют на стадию ферментации, которая осуществляется на поверхности сыпучей среды в металлических лотках или вертикальных перфорированных с обеих сторон кюветах. Культура развивается на поверхности твердой рыхлой среды, основу которой составляют пшеничные отруби, зерновая шелуха, являющиеся источником ростовых веществ. Для разрыхления среды в отруби добавляют древесные опилки (5–10 %), овсяную шелуху. Смесь перед автоклавированием увлажняют до 20–40 % влажности и подкисляют для улучшения условий стерилизации. Прогрев сыпучей среды осуществляют острым паром в специальных стерилизаторах при непрерывном перемешивании среды; длительность процесса – 60–90 минут при 105–140°С. В охлажденную до 30°С среду вносят стерильные термолабильные компоненты, инокулят (0.02–0.1 % от массы среды), быстро перемешивают ручным способом и раскладывают в лотки слоем 2–3 см, которые устанавливают в герметичные аэрируемые камеры, предварительно простерилизованные. Исходная влажность среды – 58–60 %, температура культивирования 28–32°, длительность ферментации около 36–48 ч.
Таблица 3.3. Влияние состава среды на синтез α-амилазы в глубинной культуре Aspergillus oryzae (по Р. В. Фениксовой, 1973)
|
Состав среды
|
Активность, ед./100 мл
|
|
Среда Чапека с 3 % сахарозы и 0.05 % азота
|
20
|
|
Среда Чапека с 6 % крахмала и 0.15 % азота
|
60
|
|
То же + 10 мл экстракта солодовых ростков
|
250–300
|
|
То же + 40 мл экстракта солодовых ростков
|
500–550
|
|
Концентрация компонентов (C, N, S, P) в 1.5 раза при оптимальной аэрации
|
1000–1100
|
В течение первых 10–12 ч происходит прорастание конидий при 28°. В последующие 14–18 ч реализуется быстрый рост мицелия, в этот период потребляется основное количество питательных веществ из среды при максимальном термогенезе. Аэрация становится максимальной (до 60 объемов стерильного воздуха на объем камеры/ч). Для предотвращения высыхания конидий в результате повышения температуры влажность воздуха повышают практически до 100 %. Вследствие больших расходов воздуха принята его рециркуляция. Циркулирующий воздух проходит через систему охлаждения и используется повторно; отработанная часть после очистки на волокнистых фильтрах выбрасывается в атмосферу. В этот период скорость образования фермента достигает максимальных значений. В последующие 12–18 ч процессы метаболизма ослабевают, но синтез ферментов еще продолжается. Мицелий обволакивает и прочно скрепляет твердые частицы среды, поэтому для нормального транспорта и окисления веществ среда должна быть достаточно рыхлой и влажной. Эффективный транспорт кислорода из газовой фазы и растворение в среде происходит при условии хорошей аэрируемости довольно тонкого слоя твердой сыпучей среды. Это приводит к необходимости использования больших объемов производственных площадей. Поверхностный метод ферментации является экстенсивным методом с большой долей ручного труда. При этом, однако, он не энергоемок и обеспечивает более высокий выход продукта на единицу массы среды по сравнению с глубинной ферментацией.
Поверхностная ферментация с использованием вместо лотков кювет более совершенна. Конструкция обеспечивает более эффективную аэрацию и позволяет частично механизировать процесс. Применяемые в промышленности колонные аппараты объемной аэрации еще более улучшают процесс твердофазной ферментации. Такой аппарат разделен на секции перфорированными пластинами, закрепленными на поворотных осях. Среда в ходе ферментации разрыхляется с помощью вращающихся перемешиваюших устройств. Это позволяет увеличить высоту слоя до 30 см. Режим перегрузки среды на тарелках задается автоматически. Производительность аппарата достигает 1 т культуры в сутки.
После завершения стадии ферментации выросшая культура представляет собой корж (пек) из набухших частиц среды, плотно связанных разросшимся мицелием. Данную массу измельчают с помощью дробилок различного типа (барабанно-зубчатых, шнековых, молотковых) до частиц размером 5–6 мм. Для предотвращения инактивации ферментов массу подсушивают до остаточной влажности около 10–12 %. Технические препараты ферментов, используемые к текстильной, кожевенной промышленности, упаковывают в бумажные многослойные крафт-мешки и отправляют потребителю. Процедура получения очищенных активных препаратов ферментов сложна и многоэтапна.
Важнейшим нормируемым показателем выпускаемых ферментных препаратов является активность, которая выражается в микромолях субстрата, прореагировавшего под действием 1 мл ферментного раствора или 1 г препарата в оптимальных для протекания ферментативной реакции условиях за 1 минуту. Существует также понятие активности условного ферментного препарата. Данная единица рассчитывается по активности основного фермента в стандартном условном препарате. За активность условного стандартного препарата принимают его среднюю устойчивую активность, достигаемую в производственных условиях.
Глубинный способ микробиологического получения ферментов имеет преимущества по сравнению с поверхностным, так как проходит в контролируемых условиях ферментации, исключает ручной труд, позволяет автоматизировать процесс. Питательная среда для ферментации готовится, исходя из физиологических потребностей используемой микробной культуры, а также из типа целевого фермента. Основным углеродным сырьем служат различные сорта крахмала (кукурузный, пшеничный, картофельный), кукурузный экстракт, свекловичный жом, а также глюкоза, мальтоза, декстрины. В качестве источника азота применяют органические соединения (гидролизаты казеина или микробных биомасс), а также минеральные соли (NaNO3, NH4NO3, NH4HPO4, (NH4)2SO4). Для биосинтеза целлюлолитических ферментов источником углерода служит хлопок, солома, целлюлоза; липолитических – липиды.
На предферментационной стадии технологическое оборудование и питательная среда подвергаются стерилизации. После охлаждения среды до 30° в нее вносят выращенный инокулят (2–5 % от объема производственной культуры). Процесс проводят в цилиндрических аппаратах объемом до 100 м3. Синтез фермента в глубинной культуре протекает в течение 3–4 суток при непрерывной подаче стерильного воздуха, стабилизации рН и температуры среды на строго определенных уровнях. Незначительные изменения значений данных параметров могут вызвать многократное снижение ферментативной активности.
Динамика образования биомассы и выхода фермента α-амилазы на основе культуры Aspergillus показаны на рис. 3.1. В течение первого периода (24–30 ч) мицелий бурно развивается и идет быстрое потребление легкоусвояемого субстрата. Далее в среду вносят индуктор. После этого начинается интенсивный синтез целевого фермента. Периодически в среду вносят стерильный пеногаситель, добавку углеродного субстрата, раствор для коррекции и стабилизации рН.
Рис. 3.1. Рост мицелия, образование α-амилазы и потребление субстрата в глубинной культуре A. oryzae (по Р. В. Фениксовой, 1973). 1 – a-амилаза, 2 – мицелий, 3 – сухие вещества среды.
Процесс образования биомассы продуцента не совпадает во времени с максимумом продукции фермента, при этом условия для образования фермента могут существенно отличаться от условий для оптимального режима синтеза биомассы. Поэтому условия среды в ходе протекания процесса ферментации контролируются и изменяются. Известны стадийные процессы в двух последовательных аппаратах. В первом создают условия для развития мицелия; во втором – для синтеза и накопления фермента. На промышленном уровне реализованы также проточные режимы, например, для получения глюкозоизомеразы с использованием бактериальной культуры Bacillus coagulans. Ферментацию проводят при дефиците глюкозы и кислорода в среде (глюкозоизомераза ингибируется кислородом); максимальная продуктивность сохраняется длительное время, до 200 ч.
После завершения ферментации для предотвращения инактивации ферментов культуральную жидкость охлаждают до 3–5°С и направляют на обработку. После отделения мицелия культуральную среду освобождают от грубых взвешенных частиц и концентрируют под вакуумом или подвергают ультрафильтрации. В связи с термолабильностью многих ферментов процессы обработки ведут при контролируемых, часто пониженных температурах. Глубокая очистка ферментов приводит к существенной потере активности препаратов и также очень дорогостояща. Более того, высокоочищенные белки менее стабильны по сравнению с неочищенными. Поэтому при использовании растворимых ферментов редко пользуются полной очисткой. Тем более что в зависимости от сферы применения требования к чистоте ферментных препаратов различны. Так, ряд ферментных препаратов, получаемых при поверхностной ферментации, выпускают в виде высушенных отрубей с остатками мицелия, а также высушенных осадков белков или высушенных растворов. Товарные формы таких препаратов известны в виде сухих препаратов или растворов ферментов. Последние хранят при отрицательных температурах, с применением стабилизаторов (соли кальция или магния, а также хлорид натрия, сорбит, бензоат и др.). Для получения очищенных препаратов ферментов применяют различные методы (осаждение солями или органическими растворителями, высаливание, сорбционную и хроматографическую очистку с использованием высокоселективных ионитов). Процесс завершается стадией высушивания на распылительных или вакуумных аппаратах в щадящем температурном режиме, не допускающем больших потерь активности ферментов. После стандартизации продукт направляется потребителю.
На заметку от редактора:
СПОСОБЫ ПОЛУЧЕНИЯ НОВЫХ ФЕРМЕНТОВ
Ввиду стремительного развития науки, в частности, молекулярной биологии, сегодня становятся также актуальными следующие направления в поиске и получении новых ферментов: 1) рациональная белковая инженерия; 2) направленная эволюция; 3) новые методы скрининга для изучения огромного разнообразия природных ферментов.
Новые источники ферментов. Живые организмы обитают в самых разнообразных условиях и вырабатывают ферменты, приспособленные для функционирования в специфических средах. Механизмы приспособления к условиям существования особенно разнообразны у микроорганизмов: в процессе эволюции некоторые из них сумели приспособиться к самым экстремальным условиям – рН, температура, жесткий осмос и др. При систематическом скрининге необычных сред обитания (щелочные или кислые природные среды, глубоководные впадины, горячие источники и др.) регулярно обнаруживают новые микроорганизмы, из которых выделяют ферменты с необычными свойствами. Так, ДНК-полимераза I (Taq-полимераза), широко применяемая для проведения ПЦР, выделена из термофильной бактерии Thermus aquaticus, обитающей в гейзере (90 °С) на территории Йеллоустонского заповедника. В гидротермальных источниках (110 °С, 150 бар) Средиземного моря на глубине 1500 м были обнаружены неизученные ранее микроорганизмы, относящиеся к группе архей. Оказалось, что ДНК-полимераза этих организмов делает меньше ошибок, чем Taq-полимераза в аналогичных условиях. Некоторые из этих ферментов уже поступили в продажу, в частности Pfu- и Tma-полимеразы.
Новые методы скрининга. Современные методы молекулярной биологии, в частности белковая инженерия или направленная эволюция, открывают новые возможности для скрининга и оптимизации ферментов для промышленного применения. Наиболее наглядны успехи направленной эволюции для получения ферментов, обладающих высокой стабильностью в экстремальных температурных и кислотно-щелочных условиях. Методами биоинформатики можно проводить ускоренный поиск новых ферментов на основе данных, полученных при секвенировании геномов. К настоящему времени полностью секвенированы геномы нескольких сотен микроорганизмов: при сравнении их последовательностей с консенсусными последовательностями известных ферментов удалось обнаружить несколько сотен ферментов с неясной субстратной специфичностью. С помощью ПЦР были получены кДНК этих ферментов, однако поиск природных субстратов – чрезвычайно сложная задача. Анализ консенсусных областей 16S-рРНК различных бактерий позволил предположить, что к настоящему времени лишь 1% всех существующих бактерий классифицированы и могут быть культивированы. В связи с этим осуществляются попытки обнаружения новых ферментов из некультивируемых микроорганизмов путем выделения и экспрессии ДНК («Метагеном») из естественных природных источников. Для этого выделяют ДНК, при помощи ферментов расщепляют ее на фрагменты небольшого размера, чтобы их можно было встроить в вектор, затем экспрессируют их в клетках-хозяевах и проводят функциональный анализ полученных продуктов.
3.2. ИММОБИЛИЗОВАННЫЕ ФЕРМЕНТЫ
Широкие перспективы открылись перед инженерной энзимологией в результате создания нового типа биоорганических катализаторов, так называемых иммобилизованных ферментов. Термин «иммобилизованные ферменты» узаконен сравнительно недавно, в 1974 г. Сандэремом и Реем, хотя еще в 1916 г. Нельсон и Гриффи показали, что инвертаза, адсорбированная на угле или алюмогеле, сохраняет свою каталитическую активность. Однако начало целенаправленных исследований, ориентированных на создание такого рода стабилизированных ферментных катализаторов, относится к середине XX века, при этом широкий фронт работ и ощутимые успехи достигнуты в последние 20–25 лет. Иммобилизация – это процесс прикрепления ферментов к поверхности природных или синтетических материалов, включение их в полимерные материалы, полые волокна и мембранные капсулы, поперечная химическая сшивка. Иммобилизацию также можно характеризовать как физическое разделение катализатора и растворителя, в ходе которого молекулы субстрата и продукта легко обмениваются между фазами. Разделение может быть достигнуто адсорбционным или ковалентным связыванием фермента с нерастворимыми носителями, либо связыванием отдельных молекул фермента с образованием агрегатов. При иммобилизации ферментов происходит стабилизация каталитической активности, так как этот процесс препятствует денатурации белков. Иммобилизованный фермент, имеющий ограниченную возможность для конформационных перестроек, быстрее растворимого находит кратчайший путь к функционально активной конформации. Иммобилизованные ферменты приобретают, помимо стабильности, отдельные свойства, не характерные для их свободного состояния, например, возможность функционировать в неводной среде, более ши- рокие зоны оптимума по температуре и рН. По образному выражению А. М. Егорова (1987) «Иммобилизованные ферменты как гребцыневольники на галерах, прикованные каждый к своей скамье, пространственно разобщены на носителе. Это означает резкое затруднение межмолекулярных взаимодействий типа агрегации, которые могут вызвать инактивацию фермента». При этом фермент из разряда гомогенных катализаторов переходит в разряд гетерогенных, то есть находится в фазе, не связанной ни с исходным субстратом, ни с образуемым продуктом. Это позволяет организовывать на базе иммобилизованных ферментов различные более эффективные биотехнологические процессы многократного периодического, а также непрерывного действия с использованием принципа взаимодействия подвижной и неподвижной фаз.
Длительность сохранения каталитической активности и ряд свойств ферментов определяются правильностью выбора носителя, метода и условий проведения иммобилизации. Существует несколько принципиально различных подходов, позволяющих связать фермент с носителем: адсорбционные методы и методы химического связывания на поверхности, методы механического включения или захвата, методы химического присоединения (рис. 3.2).
Рис. 3.2. Основные методы иммобилизации ферментов. А – абсорбция на крупнопористом носителе; Б – ковалентное связывание; В – адсорбция; Г – поперечная сшивка; Д – включение в гель.
Методы иммобилизации путем адсорбции основаны на фиксировании фермента на поверхности различных материалов – неорганических (силикагель, пористое стекло, керамика, песок, обожженная глина, гидроокиси титана, циркония, железа) и органических (хитин, целлюлоза, полиэтилен, ионообменные смолы, вспененная резина, полиуретан с ячеистой структурой). Насколько разнообразны материалы, применяемые для адсорбции ферментов, настолько различны механизмы и прочность связывания фермента с носителем. Характеризуя эти связи, можно говорить о широком их спектре, от простого обрастания носителя до образования полярных, ионных и ковалентных связей. Адсорбция – это самый простой метод иммобилизации ферментов на поверхности нерастворимых носителей.
Процедура иммобилизации состоит в смешивании в определенных условиях фермента с носителем и инкубации смеси. Затем при помощи фильтрования и центрифугирования проводят отделение нерастворимого компонента смеси от растворимого. В процессе адсорбции фермента на носителе при их взаимодействии возникают солевые связи, а также другие слабые взаимодействия (водородные, ван-дер-ваальсовы). Адсорбция – мягкий метод иммобилизации, при котором влияние носителя на активность фермента минимально, поэтому, как правило, ферменты хорошо сохраняют активность. Недостаток данного метода – непрочность связей. Поэтому при незначительном изменении условий среды (рН, температуры, ионной силы, концентрации продукта) возможна десорбция фермента с поверхности носителя. Более прочными являются связи, основанные на ионном взаимодействии, когда адсорбция поддерживается при определенных значениях рН и ионной силе омывающего фермент раствора.
Методы химического связывания имеют долгую историю и реализуются в различных модификациях. Практически все функциональные группы белков могут быть использованы для связывания катализатора с носителем. Широкое применение нашли реакции, ведущие в присутствии водоотнимающего агента к образованию пептидных связей между аминогруппами фермента и карбоксильными группами носителя или, наоборот, – между карбоксильными группами фермента и аминогруппами носителя. В качестве водоотнимающего агента используют дициклогексилкарбодиимид, сшивающим агентом может служить бромциан. Возможно проведение сшивки без участия сшивающих агентов. Перспективным подходом в развитии данного метода является использование в качестве носителя привитых полимеров. Прививая к поверхности полимерного материала боковые ветви, можно регулировать его свойства и влиять на реакционную способность за счет создания на поверхности носителя микросооружений, оптимальных для стабильного функционирования биокатализатора. Пример такого подхода – применение полиэтилена с привитыми поливиниловым спиртом или полиакриловой кислотой. С целью снижения диффузионных затруднений между субстратом и ферментом, а также для облегчения оттока образующихся продуктов, при иммобилизации можно выводить фермент из микросооружения молекулы носителя. Фермент присоединяют к поверхности носителя через некоторую, определенной длины, химическую последовательность, так называемый спейсер («поясок»).
Иммобилизация путем химической сшивки фермента с носителем характеризуется высокой эффективностью и прочностью связи. Для предот- вращения снижения каталитической активности фермента место сшивки удаляют от активного центра катализатора и присоединение проводят не по белковой части молекулы, а по углеводной.
Одним из наиболее эффективных методов иммобилизации с образованием химических связей считают образование ковалентных связей между молекулой носителя и катализатором. Как правило, для ковалентного присоединения носитель нужно предварительно активировать (активацию аффинных носителей проводят, например, бромцианом). Более простым, не требующим предварительной модификации носителя и быстрым методом иммобилизации в простых условиях является металлохелатный метод. Он заключается в иммобилизации ферментов на носителях из полимеров гидроксидов металлов (титана, циркония, олова, железа). Гидроксильные группы вытесняются из координационной сферы того или иного металла функциональными группами фермента, в результате между носителем и ферментом возникает координационная или ковалентная связь. Успех метода определяется рядом условий: в молекуле фермента должны присутствовать группы, играющие роль лигандов и способные стерически контактировать с атомами титана; данные группы должны быть удалены от активного центра. Метод применяют в различных вариантах, с использованием органических и неорганических носителей, включая ионообменные носители. Природа комплекса может существенно влиять на активность и операционную стабильность иммобилизованного фермента (табл. 3.4–3.5).
Сравнительно новой разновидностью металлохелатного метода является иммобилизация ферментов на основе гидроксидов переходных металлов, в основном титана и циркония. Молекулы фермента закрепляются на поверхности носителя путем образования хелатов. Для реализации данного метода, помимо фермента, необходимо наличие только одного реагента, собственно гидроксида металла.
Таблица 3.4. Влияние метода иммобилизации с использованием комплекса TiCl4 на активность глюкозоамилазы (по Дж. Вудворду, 1988)
|
Комплекс, использованный для активации
|
Активность фермента, ед./г
|
|
TiCl4 – акриламид
|
1.03
|
|
TiCl4 – мочевина
|
0.36
|
|
TiCl4 – лимонная кислота
|
0.41
|
|
NiCl4 – лактоза
|
0.48
|
Таблица 3.5. Операционная стабильность ферментов, иммобилизованных на носителях, активированных титаном (IV) (по Дж. Вудворду, 1988)
|
Фермент
|
Носитель
|
Температура, °С
|
Время полуинактивации
|
|
Глюкоамилаза
|
Роговая обманка
|
50
|
10 ч.
|
|
|
пористое стекло
|
45
|
1 ч.
|
|
Инвертаза
|
Роговая обманка
|
25
|
54 сут.
|
|
|
пористое стекло
|
18
|
8 сут.
|
Недостатком методов иммобилизации на основе физической адсорбции или ковалентного присоединения является необходимость использования достаточно больших количеств катализатора. Более того, химическая модификация, которой подвергаются ферменты в процессе иммобилизации. Может существенно снижать их каталитическую активность. Избежать этого можно при использовании методов иммобилизации ферментов путем включения в полимерную структуру.
В качестве полимерных носителей применяют природные и синтетические материалы (альгинат, желатину, каррагинан, коллаген, хитин, целлюлозу, полиакриламид, фоточувствительные полимеры). Раствор фермента смешивают с раствором мономеров носителя. Далее создают условия для процесса полимеризации, в ходе которого происходит механическое включение фермента в структуру носителя. Важным моментом является равномерность распределения молекул фермента в объеме носителя и однородность получаемых агрегатов. Техника включения зависит от природы и свойств используемого материала, образуемые при этом биосистемы имеют вид гранул, волокон, полимерных сеток, пленок и т.п.
Иммобилизация в полиакриламидный гель (ПААГ), который наиболее часто используется для этих целей, заключается во внесении раствора фермента в раствор мономера (N, N1-метилендиакриламида). Далее в подобранных условиях быстро формируется гель в виде блока. Монолитный гель измельчают, придавая частицам форму кубиков желаемого размера. При использовании желатины или агар-агара вначале подогревают их растворы, затем охлаждают и вносят фермент. В процессе последующего охлаждения происходит формирование геля. Полимеризация альгината происходит в присутствии некоторых катионов. Поэтому на первом этапе смешивают растворы фермента и мономеров этих полисахаридов, далее смесь с помощью дозирующего устройства вносят в раствор, содержащий ионы Ca2+ или Ba2+ (для альгината) или Al3+, Fe3+, K+ или Mo2+ (для каррагинана), при этом образуются сферические полимерные частицы в виде гранул. Гели в зависимости от природы используемого полимерного материала отличаются по ряду показателей. Например, гели ПААГ недостаточно прочные, но этого можно избежать при использовании ПААГ, содержащего жесткую арматуру из керамики. При увеличении степени сшивки с целью придания большей прочности гелю возникают проблемы диффузионных затруднений. Альгинатные гели отличаются высокой прочностью и хорошими гидродинамическими свойствами, что не создает препятствий для притока к активным центрам молекул ферментов субстрата и оттоку образуемого продукта. При работе с альгинатом кальция важно отсутствие в иммобилизационной системе хелатирующих агентов (фосфатов, цитратов), которые, связывая кальций, разрушают структуру геля.
Привлекательной для использования является иммобилизация ферментов методом инкапсулирования. В этом методе главным является не создание физических или химических сил, необходимых для связывания катализатора с носителем, а удержание раствора, окружающего фермент. В процессе инкапсулирования иммобилизуются не отдельные молекулы фермента, а исходный раствор, содержащий фермент. При использовании метода иммобилизации применительно к ферментам чаще всего применяют коацервацию и межфазовую полимеризацию. Первый прием реализуется без химических реакций и включает фазовое разделение коллоидных частиц полимера, которые ассоциируют вокруг маленьких водных капель и образуют затем непрерывную мембрану. В качестве полимерных материалов при этом используют нитрат или ацетат целлюлозы, бутадиеновый каучук. При межфазовой полимеризации для образования полупроницаемой мембраны один из реагентов находится в водной, другой – в органической фазе; на границе раздела фаз происходит реакция полимеризации и вокруг диспергированных в органической фазе капель образуется слой полимера. С помощью этого метода могут быть получены мембраны из полиуретана или эпоксидных смол. Полупроницаемые мембраны, покрывающие раствор с ферментом, могут быть изготовлены из различных материалов (полистирола, полиакрилата, полиуретана, полиэфиров, липидов, поликарбонатов и т. д.). Варьируя материалы для получения полупроницаемой мембраны, можно осуществлять контроль размеров молекул. Например, большие по размерам молекулы ферментов удерживаются внутри капсулы, а более мелкие молекулы исходных субстратов и синтезируемых продуктов могут свободно диффундировать через мембрану. Диаметр микросфер может составлять от нескольких микрон до нескольких тысяч микрон при толщине мембран от сотен ангстрем до нескольких микрон. Безусловным преимуществом микрокапсулирования является большая площадь поверхности, приходящаяся на единицу активности иммобилизованного фермента, что позволяет использовать высокие концентрации ферментов в исходном растворе и достигать высокой эффективности их действия. При этом возможно также придать ферменту способность функционирования в неводной среде и получать высокие выходы целевого продукта высокой степени чистоты.
К методу инкапсулирования близок метод обращенных мицелл. Фермент включают в замкнутую структуру из поверхностно-активного вещества (липид, детергент), содержащую микроскопическую каплю воды. Фермент функционирует на границе раздела двух фаз: органической, находящейся в биореакторе, и водной, заключенной в обращенную мицеллу.
Существенный интерес представляет способ включения ферментов в полые волокна. Применяют волокна, изготовленные из природных либо синтетических полимерных материалов. Раствор фермента вводят во внутренний объем полых волокон и затем «запечатывают» волокно с обоих концов. Фермент в полости волокон не претерпевает каких-либо химических модификаций, поэтому сохраняет свою активность и свойства.
Иммобилизация методом поперечных сшивок (или химического присоединения) заключается в химическом связывании молекул ферментов между собой путем образования поперечных сшивок. Для образования сшивок применяют различные агенты, несущие две и более реакционно способные группы, которые осуществляют поперечную сшивку ферментов за счет эпокси- и иминогрупп, например, эпоксиполиимины:

В качестве сшивающих агентов широко применяют также глутаровый альдегид, гексаметилендиизоцианат, хлорпроизводные триазина. Метод отличается простотой реализации и позволяет производить сшивку различных по структуре ферментов, а также ферментов с целыми клетками. Однако часто при сшивке может происходить изменение существенное снижение активности катализатора.
Таким образом, методы иммобилизации достаточно разнообразны, причем имеется возможность использования их в сочетании. Например, адсорбцию на носителе с инкапсулированием, включение в гелевую структуру и адсорбцию и т.д. Рассмотренные методы применяются не только для иммобилизации ферментов, но также и для других биокатализаторов – целых клеток, клеточных органелл, антител, антигенов и др. Ни один из описанных методов не является универсальным, и для каждого типа катализаторов существуют свои предпочтительные методы. Ферменты иммобилизуют различными адсорбционными методами или методом поперечных сшивок, лучшим методом для иммобилизации целых клеток является включение в полимерные структуры.
Помимо создания устойчивых биокаталитических ферментных систем, важнейшей задачей инженерной энзимологии является изучение физико-химических свойств данных систем и разработка научных основ их функционирования и применения.
3.3. ПРОЦЕССЫ НА ОСНОВЕ ИММОБИЛИЗОВАННЫХ ФЕРМЕНТОВ
Сферы применения иммобилизованных ферментов разнообразны – это тонкий органический синтез и преобразование энергии, ферментная аналитика и получение целевых продуктов, конверсия растительного сырья и создание лекарственных препаратов.
Применение иммобилизованных ферментов является сегодня одним из важнейших и динамично развивающихся разделов современной биотехнологии. Объемы выпуска ферментов, применяемых в промышленных процессах непрерывно возрастают, при этом ведущие западные страны, лидирующие в этой области, ежегодно выпускают ферментов на сотни млн. долларов. Производство протеаз, глюкозоизомераз, ацилтрасфераз достигает сотен и тысяч кг/г (табл. 3.6).
Таблица 3.6. Иммобилизованные ферменты, используемые в промышленности (по Poulsen, 1984)
|
Иммобилизованный
фермент
|
Объемы выпуска, т/г
|
Получаемый продукт
|
Страна
|
|
Аминоацилаза
|
менее 5
|
L-аминокислоты
|
Япония
|
|
Аминоглюкозидаза
|
1
|
Глюкоза
|
Англия
|
|
Глюкозоизомераза
|
1500–1750
|
Глюкозо-фруктозные сиропы
|
Дания, Нидерланды, Япония
|
|
Гидантоиназа
|
менее 1
|
D-фенилглицин-
|
Япония
|
|
Лактаза
|
5
|
Лактозные гидролизаты
|
Япония
|
|
Нитрилаза
|
0.1
|
Акриламид
|
Япония
|
|
Пенициллин G-ацилаза
|
3–4
|
6 АПК
|
Япония, Нидерланды
|
|
Пенициллин V-ацилаза
|
1
|
6 АПК
|
Англия, Австрия
|
Внедрение иммобилизованных ферментов в промышленные отрасли и организация на их основе принципиально новых, экологически чистых и компактных биотехнологических процессов дает ощутимый экономический эффект. Для таких процессов разрабатывают специальные биореакторы, имеющие аналогию с реакторами для химических процессов с гетерогенным катализом. Иммобилизованный фермент в таком биореакторе представляет собой неподвижную фазу, через которую протекает субстрат, подлежащий биопревращению. Реакторы бывают периодического и непрерывного действия. Чаще всего фермент, включенный в полимерную структуру, представляет собой малые сферические частицы одинакового размера. Это обеспечивает большую площадь реакционной поверхности и, следовательно, улучшение диффузии. Сферические частицы или гранулы с ферментом максимально плотно упаковывают в аппарате. В результате этого концентрация каталитического агента, участвующего в биотехнологическом процессе, значительно выше по сравнению с ферментационными системами на основе микробных клеток. Повышение концентрации биокатализатора обеспечивает большую производительность аппарата и более высокий выход продукта. Одностадийные превращения субстрата с использованием иммобилизованных ферментов осуществляются обычно в проточных реакторах с перемешиванием, псевдоожиженным слоем, а также в реакторах с полыми волокнами (рис. 3.3).
Рис. 3.3. Типы реакторов с иммобилизованными катализаторами (по Дж. Вудворду, 1988). А – реактор колоночного типа, Б – Реактор с перемешиванием, В – модифицированный реактор колоночного типа.
Все представленные системы имеют определенные ограничения в части неравномерного распределения катализатора, а также перепадов давления. Применяют реакторы колоночного типа, реакторы с перемешиванием на базе магнитной или подвесной мешалки. В реакторах с перемешиванием возможно разрушение довольно мягких частиц геля. Оригинальна конструкция биореактора «корзиночного» типа, в котором для предотвращения разрушения гранул перемешивание осуществляется за счет вращающейся проволочной «корзины», в ячейках которой иммобилизованы гранулы с включенным ферментом. В данном варианте реализованы два типа иммобилизации: полимерные гранулы с включенными молекулами фермента сами иммобилизованы в ячейках проволочной сетки. Применяются также биореакторы периодического действия, без протока, в которых фермент, включенный в гель в виде монолитного блока, заполняет весь объем аппарата. В толще геля в процессе иммобилизации и формирования монолита или после завершения этого процесса для осуществления газо- и массообмена формируют вертикальные каналы.
Эра биореакторов для иммобилизованных биокатализаторов только начинается; их конструкции непрерывно совершенствуются применительно к различным биотехнологическим процессам, реализуемым на их базе. Эти процессы относятся к сфере органического синтеза и медицины, конверсии растительного сырья и преобразования энергии, производства пищевых веществ и напитков.
Иммобилизованные ферменты в пищевой промышленности
В истории пищевой технологии, насчитывающей тысячелетия, иммобилизованные биокаталитические системы (ферменты, клетки) за последние 20–25 лет вписали совершенно новые страницы, обозначив принципиальные сдвиги в области самих технологий и в улучшении качества пищевых продуктов. Все большее применение в развитых странах находят биотехнологических процессы получения глюкозо-фруктозных сиропов, оптически активных L-аминокислот из рацемических смесей, диетического безлактозного молока, сахаров из молочной сыворотки, синтеза L-аспарагиновой и L-яблочной кислот из фумаровой кислоты.
Получение глюкозо-фруктозных сиропов, важный с точки зрения диетологии процесс, впервые был реализован в промышленности в 1973 г. американской компанией «Клинтон Корн». В настоящее время это самый крупный промышленный процесс на основе иммобилизованных ферментов.
Фруктоза по сравнению с глюкозой, обладая более приятным вкусом, на 60–70 % слаще, то есть ее потребляется меньше обычного сахара, кроме того, метаболизм фруктозы в организме человека не связан с превращением инсулина, она менее вредна для зубов и т.д. Технологии получения глюкозо-фруктозных сиропов за короткий срок были разработаны и освоены в промышленных масштабах многими западными странами. В 1980 г. их выпуск составил 3.7 млн. тонн. Продукт с товарным названием «изоглюкоза» поступает на рынок в виде сиропов, содержащих глюкозу и фруктозу в соотношении, близком к 1:1; с использованием разделительных процессов типа жидкой хроматографии содержание фруктозы может быть повышено до 90 %.
Биохимическая сущность процесса сводится к превращению (изоме- ризации) глюкозы, предварительно полученной в результате гидролиза кукурузного или картофельного крахмала, во фруктозу под воздействием иммобилизованной глюкозоизомеразы. Реакция протекает в одну стадию до тех пор, пока в реакционной смеси соотношение глюкозы и фруктозы практически не уравняется. Конечным продуктом может быть данный раствор; фруктоза может быть отделена из раствора, а глюкоза – подвергнута дальнейшей изомеризации. Процесс протекает непрерывно в реакционных колоннах высотой 5 м, заполненных слоем катализатора – иммобилизованного фермента в виде полимерных гранул, полых волокон, кусочков геля и т.д. Технические детали процесса и способы иммобилизации фермента подробно в литературе не описаны, так как являются секретом производства. Время полуинактивации фермента составляет от 20 до 50 суток, то есть заменять или обновлять катализатор приходится раз в 2–3 месяца. Производительность биореакторов варьирует от 1 до 9 т глюкозо-фруктозного сиропа на 1 кг иммобилизованного фермента. По экономическим оценкам, выполненным в Венгрии на основе анализа производства глюкозо-фруктозных сиропов мощностью 120 тыс. т кукурузного зерна в год, произ- водство такого типа экономичнее в 1.5 раза по сравнению с традиционным получением сахара из сахарной свеклы. Датская компания «Ново» рекомендует в качестве лучших следующие параметры процесса: активность катали- затора – 200 межд. ед./г, высота слоя катализатора – 5 м, линейная скорость потока – 3.6 м/ч., производительность реактора – 400 т в сутки.
Корпорацией «Цетус» (США) разработан новый процесс получения 100 % фруктозы из глюкозных сиропов. На первом этапе глюкоза под действием иммобилизованной пиранозо-2-оксидазы окисляется в D-глюкозон, который на втором, химическом, этапе на палладиевом катализаторе прак- тически со 100 % выходом восстанавливается до фруктозы. США планируют к 2000 г. заменить на 30–40 % потребление сахара такими фруктозными сиропами, Япония – резко сократить экспорт сахара за счет биотехнологического процесса изомеризации глюкозы во фруктозу.
Получение L-аминокислот ферментативным разделением химических рацемических смесей D,L-аминокислот реализовано на промышленном уровне фирмой «Танабе Суйяку» в 1969 г. В качестве исходного сырья используют полученные химическим синтезом ацилированные D,L-аминокислоты (метионин, валин, фенилаланин, триптофан), раствор которых пропускают через колонку объемом 1 м3, заполненную иммобилизо- ванной аминоацилазой. Фермент гидролизует L-ацил-изомеры, после отщепления объемной ацил-группы более мелкие и растворимые молекулы L-аминокислот выводятся из биореактора через мембрану. В конце концов в реакционной смеси остаются только ацил-D-аминокислоты, которые при нагревании вновь рацемируются на D- и L-изомеры. Период полуинактивации фермента, иммобилизованного на полимерной смоле, составляет 65 дней. Периодически в колонку доливают свежую порцию раствора фермента, который вновь адсорбируется смолой. Время работы колонки без смены носителя составило более 8 лет.
В Италии фирмой «Сентрале дель Латте» в середине 80-х годов реализован первый коммерческий процесс получения безлактозного молока. Лактоза, присутствующая в достаточно больших количествах в молоке и плохо растворимая, вызывает кристаллизацию ряда молочных продуктов и кондитерских изделий, снижая их качество. Кроме этого, некоторая часть населения не может употреблять нативное молоко вследствие недостаточности лактазы, фермента, гидролизующего молочный сахар с образованием глюкозы и галактозы. Молоко после такой обработки приобретает качества диетического продукта. Масштабы производства безлактозного молока возрастают во многих европейских странах.
Получение сахаров из молочной сыворотки в процессе ферментативного гидролиза позволяет получать дополнительные количества сахаристых веществ из отходов молочной промышленности. Первые промышленные процессы гидролиза лактозы молочной сыворотки с использованием иммобилизованной лактазы осуществлены в 1980 г. в Англии и Франции. Предварительно деминерализованную сыворотку пастеризуют и затем пропускают через ферментационную колонку с иммобилизованной лактазой. Период полуинактивации фермента удается увеличить до 60 суток, мощность установок – 1000 л/ч при 80 % конверсии лактозы. Получаемые при этом глюкоза и галактоза превосходят по степени сладости обычные сахара в 1.5 раза при равных экономических показателях.
Получение L-яблочной кислоты ферментативным способом из L-аспарагиновой кислоты основано на использовании иммобилизованной в геле фумаразы. Яблочная кислота достаточно широко используется в пищевой и фармацевтической промышленности в качестве заменителя лимонной кислоты. Компанией «Танабе Суйяку» в результате иммобилизации фумаразы в карраген удалось повысить ее операционную стабильность при времени полуинактивации свыше 100 суток, при этом продуктивность процесса превращения фумаровой кислоты в яблочную возросла более чем в 5 раз.
Получение L-аспарагиновой кислоты с помощью фермента аспартазы, иммобилизованной в геле, со временем полуинактивации препарата до 30 суток возможно из фумаровой кислоты. Фермент, присоединяя аммиак к двойной связи фумаровой кислоты, в одну стадию образует оптически активную форму L-аспарагиновой кислоты. Процесс реализован также на основе иммобилизованных в гель микробных клеток с дополнительным химическим связыванием, время полуинактивации аспартазы, находящейся в клетках, возросло до 120 суток; технологический процесс практически полностью автоматизирован и реализуется в непрерывном режиме. Производительность установок – до 1.7 т/1м3 в день.
Помимо представленных и реализованных в промышленных масштабах процессов, иммобилизованные ферменты в настоящее время широко используются в научных исследованиях при разработке новых биотехнологических процессов получения ценных продуктов. Это процесс получения глюкозы из крахмала с участием амилазы и глюкозоамилазы; получение инвертного сахара (аналог глюкозо-фруктозных сиропов) из сахарозы с использованием инвертазы. В рамках диетологии разрабатываются процессы получения белковых гидролизатов заданного состава с участием иммобилизованных протеаз. Осваиваются установки для непрерывного ферментативного получения глюкозы из различных целллюлозосодержащих отходов.
Использование иммобилизованных ферментов в тонком органическом синтезе
Высокие скорости протекания реакций в «мягких» условиях, уникальная специфичность и стереоспецифичность действия ферментов позволяет создавать на их основе эффективные и перспективные технологические процессы. В настоящее время успехи в тонком органическом синтезе на основе иммобилизованных ферментов особенно наглядны в сфере получения лекарственных препаратов (антибиотиков, стероидов, простагландинов).
С использованием иммобилизованных ферментов созданы процессы получения более эффективных аналогов существующих антибиотиков пенициллинового ряда и цефалоспоринов, модификация которых химическим путем является чрезвычайно сложной задачей. Так, на основе иммобилизованной пенициллинамидазы реализован процесс эффективного деацилирования бензилпенициллина, являющегося сырьем для получения 6-амино-пеницилановой кислоты (6-АПК). Это достаточно простой технологический процесс, протекающий в одну стадию при обычных условиях в диапазоне температур 10–40°С. Промышленная реализация процесса получения 6-АПК привела к существенному увеличению выпуска полусинтетических пенициллинов и удешевлению их. На основе этого же фермента разработан процесс получения 7-аминодезацетокси-цефалоспоровой кислоты, представляющей собой ключевой субстрат для синтеза новых цефалоспоринов.
Перспективно применения ферментативного катализа для получения ряда лекарственных веществ (простагландинов, тромбоксанов, простациклина и др.) из арахидоновой кислоты с использованием сложных полиферментных систем. Ключевым ферментом здесь является простагландин-эндопероксидсинтетаза, катализирующая трехсубстратную реакцию. В ходе реакции происходит сопряженное окисление арахидоновой кислоты кислородом и донором электронов в виде НАДН, триптофана, ферроцианида. Следует отметить, что исходный субстрат для этих реакций, арахидоновая кислота, может быть получена из масел с использованием специфических фосфолипаз.
Интересным направлением являются разрабатываемые процессы превращения достаточно доступных субстратов (фумарата аммония, фенола, индола, пирувата аммония) в редкие аминокислоты (тирозин, фенилаланин, триптофан, 5-окситриптофан) с участием лиаз, процессы получения органических кислот из фумаровой, ферментативная модификация нук- леиновых кислот, синтез олиго- и полипетидов. Ферментативный органический синтез, находящийся в настоящее время на стадии становления и развития, имеет огромные перспективы для существенного расширения сферы применения в ближайшем будущем.
3.4. ФЕРМЕНТЫ В МИКРОАНАЛИЗЕ
Высокая каталитическая активность и уникальная специфичность действия ферментов являются основой применения их для аналитических целей. Ферментные методы анализа характеризуются высокой чувствительностью, специфичностью, точностью, быстродействием, а также возможностью применения в сложных многокомпонентных средах. В аналитической энзимологии применяется широкий спектр ферментов, относящихся ко всем классам (оксидоредуктазы, трансферазы, гидролазы, лиазы, изомеразы, лигазы). При этом наряду с моноферментными системами, широко используются полиферментные системы. В настоящее время созданы, наряду с классическими фотометрическими методами регистрации, принципиально новые методы – электрохимические, био- и хемолюминесцентные.
Ферментный анализ относится к кинетическим методам анализа, при котором искомое вещество определяют по скорости реакции, пропорциональной концентрации определяемого вещества. Например, при превращении вещества А в продукт Р: А → P, концентрация последнего будет нарастать во времени, при этом начальная скорость реакции vо пропорциональна концентрации А: vо = k [А], где k – константа скорости реакции. Чем выше исходная концентрация определяемого вещества, тем больше начальная скорость реакции. Предварительно построенный калибровочный график зависимости vо от [А] позволяет определять неизвестные концентрации веществ в анализируемой смеси.
Ферментный электрод – это комбинация датчика, основой которого является ионоселективный электрод с иммобилизованным ферментом. Понятие ферментного электрода ввели Кларк и Лайон в 1962 г.; в то время использовали растворимые ферменты. В 1969 г. Гильбо и Монталво впервые описали потенциометрический ферментный электрод для определения мочевины, позволявший измерять разность потенциалов, возникающую в системе при отсутствии внешнего напряжения. Иммобилизованный фермент в конструкции электрода первыми применили Апдайк и Хикс в 1971 г., укрепив иммобилизованную в геле глюкозооксидазу на поверхности полярографического кислородного датчика (датчик вольтометрического или амперметрического типа позволяет измерять ток при наложении постоянного напряжения). С тех пор разработано свыше 100 различных конструкций ферментных электродов, некоторые из них представлены в табл. 3.7.
Таблица 3.7. Типичные ферментные электроды и их параметры (по Дж. Вудворду, 1988)
|
Определяемое вещество
|
Фермент
|
Датчик
|
Стабиль- ность
|
Время реакции
|
Чувствитель- ность, М/л
|
|
Мочевина
|
Уреаза
|
Катионный
|
3 недели
|
30–60 с
|
10–2 – 5×10–5
|
|
Газовый (NH3)
|
1 мес.
|
2–4 мин.
|
до 5×10–4
|
||
|
Глюкоза
|
Глюкозо-оксидаза
|
рН-электрод
|
1 неделя
|
5–10 мин.
|
10–1 – 10–3
|
|
Газовый (О2)
|
3 недели
|
2–5 мин.
|
2×10–4
|
||
|
L-аминокислоты
|
Оксидаза L-аминокислот
|
Pt(H2O2)
|
4–6 мес.
|
12 с
|
10–3 – 10–5
|
|
Спирты
|
Алкоголь-оксидаза
|
Pt(H2O2)
|
1 неделя
|
12 с
|
0.5 – 100 мг/ %
|
|
Пенициллин
|
Пенициллиназа
|
рН-электрод
|
2 недели
|
0.5–2 мин.
|
10–2 – 10–4
|
|
Мочевая кислота
|
Уратоксидаза
|
Pt(H2O2)
|
4 мес.
|
30 с
|
10–2 – 10–4
|
|
Нитрат
|
Нитрат-редуктаза
|
NH4+
|
2–3 мин.
|
|
10–2 – 10–4
|
|
Нитрит
|
Нитрит-редуктаза
|
Газовый (NH3)
|
3–4 мес.
|
2–3 мин.
|
5×10–2 – 5×10–4
|
|
Сульфат
|
Акрил-сульфатаза
|
Pt
|
1 мес.
|
1 мин.
|
10–1 – 10–4
|
В ферментном электроде фермент используют обычно в иммобилизованном виде. Для этого применяют два метода: химическую модификацию молекул фермента путем введения групп, обеспечивающих нерастворимость, и физическое включение фермента в инертный носитель (крахмал, ПААГ) (рис. 3.4). Ферментный электрод используют как обычный ионоселективный электрод. Потенциометрические датчики (электроды для определения мочевины, пенициллина, аминокислот) непосредственно подключают к цифровому вольтметру; строят график зависимости потенциала (мВ) от концентрации определяемого вещества в полулогарифмических координатах.
При использовании амперметрических электродов (платинового или кислородного) для определения глюкозы, спирта применяют полярограф. При этом строят график зависимости силы тока (мкА) от концентрации вещества в линейных координатах. Вместо полярографа можно использовать устройство (адаптор), которое подает потенциал на амперометрический датчик (в случае определения глюкозы или спирта), преобразуя ток в разность потенциалов, регистрируемую вольтметром. Вместе с ферментным электродом используют электрод сравнения (например, каломельный). Последний может быть частью комбинированного ферментного электрода, – датчика NH3, СО2, О2, на основе которых делают ферментные электроды для детекции мочевины, аминокислот, спирта и т.д. На рис. 3.5 показаны конструкции ферментных электродов.
Рис. 3.4. Изготовление ферментных электродов (по Дж. Вудворду, 1988). А – с использованием физически включенных ферментов, Б – химически связанных ферментов.
Стабильность работы электродов главным образом зависит от способа иммобилизации фермента: правильного подбора фермента и носителя, концентрации фермента в носителе, стабильности применяемого датчика, на основе которого сделан электрод, а также от условий проведения анализа и условий хранения электрода.
Эра широкого внедрения ферментных электродов в различные сферы аналитики только начинается. Биосенсоры, помимо высокой чувствительности и быстродействия, существенно уменьшают объем анализируемых проб, автоматизируют и упрощают схему анализа. Особенно эффективно применение ферментных методов анализа для контроля состояния окружающей среды, в пищевой и биотехнологической промышленности, в клинической аналитике, а также в научных исследованиях. Широкие перспективы открывают возможности применения мультиферментных систем, в которых один из ферментов обеспечивает специфичность реакции, а другой – детекцию продуктов этой реакции (например, перекисей). Полиферментная аналитика существенно, до 10–11 – 10–14 М, увеличивает чувствительность анализа.
Рис. 3.5. Ферментные электроды (по Н. Н. Угаровой, 1987). А – ферментный электрод на основе стеклянного электрода для измерения рН: 1- металлический электрод, 2 – резиновое кольцо, 3 – полупроницаемая мембрана, 4 – слой фермента, 5 – стеклянная мембрана, проницаемая для ионов водорода, 6 – приэлектродный буферный раствор; Б – схема электрода для определения глюкозы: 1 – катод, 2 – электрод сравнения, 3 – полупроводниковая полимерная мембрана, 4 – слой иммобилизованной глюкозооксидазы.
Перспективным методом анализа считают также биолюминесцентный микроанализ на основе светлячковой и бактериальной люцифераз. Эти методы анализа позволяют определять, например, АТФ и НАД с чувствительностью до 10–14 М. Сопряжение люцифераз с другими ферментами, катализирующими протекание реакции с образованием АТФ и НАДН, открывают широкие возможности для создания высокоспецифичных, экспрессных и высокочувствительных методов анализа.
Глава 4. ГЕНЕТИЧЕСКАЯ И КЛЕТОЧНАЯ ИНЖЕНЕРИЯ
При оптимизации любого биотехнологического процесса, протекающего с участием живых организмов, основные усилия обычно направлены на улучшение их генетических свойств. Традиционно для этих целей использовали мутагенез с последующим скринингом и отбором подходящих вариантов. Сегодня в этой области произошли громадные перемены. В настоящее время разрабатываются и применяются принципиально новые методы, основанные на технологии рекомбинантных ДНК. Модификация генетического материала осуществляется разными методами: в живом организме (in vivo) и вне его (in vitro), соответственно, это два направления – клеточная инженерия и генетическая инженерия.
С помощью этих методов возможно получение новых высокопродуктивных продуцентов белков и пептидов человека, антигенов, вирусов и др. Развитие генетической и клеточной инженерии приводит к тому, что биотехнологическая промышленность все шире и шире завоевывает новые области производства. Фундаментом для возникновения новейших методов биотехнологии послужили открытия в генетике, молекулярной биологии, генетической энзимологии, вирусологии, микробиологии и других дисциплинах.
4.1. МЕТОДЫ И ВОЗМОЖНОСТИ ГЕНЕТИЧЕСКОЙ ИНЖЕНЕРИИ
Быстрое внедрение новейших фундаментальных достижений в практику и существенное влияние последних на уровень теоретических исследований, свойственные биотехнологии, наиболее наглядно проявляются на примере развития генетической инженерии.
Важнейшим этапом для развития биотехнологии было выделение в середине текущего столетия молекулярной биологии в самостоятельную дисциплину. Возникновение молекулярной биологии стало возможным благодаря взаимодействию генетики, физики, химии, биологии, математики и др. Э. Чаргофф и З. Д. Хочкис, исследуя молекулярные соотношения нуклеотидных оснований в ДНК (аденин, гуанин, цитозин, тимин) показали, что у различных организмов они одинаковы. Это открытие сыграло ключевую роль в установлении структуры ДНК. Большую роль в расшифровке структуры ДНК сыграл прогресс в области генетики бактерий и бактериофагов. Было установлено (А. Херши, М. Чейз, Дж. Ледерберг, Н. Циндер), что трансдукция (перенос генетического материала) может осуществляться с помощью бактериофага, а фаговой ДНК может принадлежать роль носителя наследственности. Б. Хейсом были выяснены также закономерности полового процесса у бактерий (конъюгация), при котором из донорских клеток, имеющих F-фактор (фертильность) генетический материал переносится в реципиентные клетки. Дж. Уотсон и Ф. Крик предложили комплиментарную модель строения ДНК и механизм ее репликации; было раскрыто уникальное свойство ДНК – способность самовоспроизведения (репликация).
На базе молекулярной биологии и генетики микроорганизмов к началу 60-х гг. сформировалась молекулярная генетика. Г. Гамов в 1954 г. выдвинул гипотезу о том, что каждый кодон (последовательность нуклеотидов, кодирующая одну аминокислоту) должен состоять из трех нуклеотидов. В 1961 г. было подтверждено экспериментально, что первичная структура белка закодирована в ДНК в виде последовательности нуклеотидных триплетов (кодонов), каждая из которых соответствует одной из 20 аминокислот. К 1966 г. удалось получить данные о строении генетического кода.
Следующим был вопрос о том, как переносится информация с ДНК, находящейся в ядре, в цитоплазму, где реализуется синтез белка на рибосомах. Было установлено, что последовательность триплетных кодонов, хранящаяся в ДНК, транскрибируется (переписывается) в недолговечные молекулы информационной РНК (иРНК). Данный этап ДНК → иРНК был назван транскрипцией, а этап иРНК → белок – трансляцией. Перенос аминокислоты и определение ее местонахождения в синтезирующейся белковой молекуле осуществляет транспортная РНК (тРНК). На ДНК, как на матрице, синтезируется РНК, а на РНК – белок. У некоторых вирусов отсутствует первое звено, и РНК служит для них материалом наследственности.
Механизм контроля генной активности долгое время оставался неизвестным. Большое значение имели работы Ф. Жакоба и Ж. Моно, показавшие, что у бактерий есть структурные гены, дающие информацию о синтезе определенных белков и регуляторные гены, которые осуществляют включение или выключение отдельных генов или их блоков. Далее выяснилось, что регуляция генов по этому принципу имеет место и у других организмов. Существуют также иные механизмы регуляции.
Следующим важным шагом было проведение работ по расшифровке нуклеотидных последовательностей (секвенирование), которое дает информацию о первичной структуре участка генома, выполняющего определенные функции. Структура и функции приобрели общее молекулярно-биологическое выражение, его суть заключается в том, что функциональные состояния выражают структурные изменения макромолекул и ассоциаций.
От изучения закономерностей функционирования генетического материала в клетке вскоре исследователи перешли к генетическим манипуляциям. Возникла новая экспериментальная технология, заключающаяся в введении в клетки чужеродных генов. Названия «генетическая (или генная) инженерия» или «работа с рекомбинантными ДНК» эквивалентны. Суть этой технологии заключается в воссоединении фрагментов ДНК in vitro с последующим введением новых («рекомбинантных») генетических структур в живую клетку.
В 1972 г. Берг с сотрудниками создали первую рекомбинантную молекулу ДНК, состоящую из фрагмента ДНК вируса ОВ40 и бактериофага λ dvgal с галактозным опероном E. coli. Инструментом для генетического конструирования стали две группы ферментов – рестриктирующие эндонуклеазы (рестриктазы) и лигазы. Первые необходимы для получения однородных фрагментов ДНК, вторые – для их соединения. Рестриктазы и лигазы в совокупности с другими ферментами (нуклеазами, обратной транскриптазой, ДНК-полимеразой и др.) обеспечивают проведение всех генноинженерных манипуляций.
Техника генетического конструирования in vitro включает несколько последовательных процедур (рис. 4.1):
- получение нужного гена;
- встраивание его в генетический элемент, способный к репликации (вектор);
- введение гена, входящего в состав вектора, в организм-реципиент;
- идентификацию (скрининг) и отбор клеток, которые приобрели желаемый ген или гены.
Получение генов
Получение генов возможно несколькими путями: выделением из ДНК, химико-ферментным синтезом и ферментным синтезом.
Выделение генов из ДНК проводят с помощью рестриктаз, катализирующих расщепление ДНК на участках, имеющих определенные нуклеотидные последовательности (4–7 нуклеотидных пар). Расщепление можно проводить по середине узнаваемого участка нуклеотидных пар; при этом обе нити ДНК «разрезаются» на одном уровне. Образующиеся фрагменты ДНК имеют так называемые «тупые» концы. Возможно расщепление ДНК со сдвигом, при этом одна из нитей выступает на несколько нуклеотидов. Образуемые при этом «липкие» концы в силу своей комплементарности вступают во взаимодействие.
Нуклеотидную последовательность с липкими концами можно присоединить к вектору (предварительно обработанному той же рестриктазой), превратить в кольцевую в результате сшивания лигазами взаимно компли- ментарных концов. Метод имеет существенные недостатки, так как достаточно трудно подобрать действие ферментов для строгого вычленения нужного гена. Вместе с геном захватываются «лишние» нуклеотиды или, наоборот, ферменты отрезают часть гена, превращая его в функционально неполноценный.
Химико-ферментный синтез применяют в том случае, если известна первичная структура белка или пептида, синтез которого кодирует ген. Необходимо полное знание нуклеотидной последовательности гена. Этот метод позволяет точно воссоздать нужную последовательность нуклеотидов, а также вводить в гены участки узнавания рестриктаз, регуляторных последовательностей и пр. Метод состоит из химического синтеза одноцепочечных фрагментов ДНК (олигонуклеотидов) за счет поэтапного образования эфирных связей между нуклеотидами, обычно 8–16-звенных. В настоящее время существуют «генные машины», которые под контролем микропроцессора очень быстро синтезируют специфические короткие последовательности одноцепочечной ДНК. На рис. 4.2 показана схема такой машины, сконструированной канадской фирмой «Био лоджикэлс». Нужная последовательность оснований вводится на клавишный пульт управления. Микропроцессор открывает клапаны, через которые с помощью насоса в синтезирующую колонку последовательно поступают нуклеотиды, а также необходимые реагенты и растворители. Колонка наполнена бусинками кремния, на которых собираются молекулы ДНК. В данном устройстве возможен синтез цепей длиной до 40 нуклеотидов со скоростью 1 нуклеотид за 30 минут. Полученные олигонуклеотиды с помощью ДНК-лигазы сшиваются между собой с образованием двуцепочечного нуклеотида. С помощью данного метода были получены гены А- и В-цепей инсулина, проинсулина, соматостатина и др.
Рис. 4.2. Схема «генной машины» (по Д. Хопвуду, 1984).
Ферментный синтез гена на основе выделенной матричной РНК (мРНК) является в настоящее время наиболее распространенным методом. Сначала из клеток выделяют матричные РНК, среди которых присутствует мРНК, кодируемая геном, который требуется выделить. Затем в подобранных условиях на выделенной из клетки мРНК, как на матрице, с помощью обратной транскриптазы (ревертазы) синтезируется нить ДНК, комплиментарная мРНК (кДНК). Полученная комплиментарная ДНК (кДНК) служит матрицей для синтеза второй нити ДНК с использованием ДНК-полимеразы или ревертазы. Затравкой при этом служит олигонуклеотид, комплиментарный 3’-концу мРНК; новая цепь ДНК образуется из дезоксинуклеозидтрифосфатов в присутствии ионов магния. Метод с большим успехом применен для получения в 1979 г. гена гормона роста человека (соматотропина).
Полученный тем или иным способом ген содержит информацию о структуре белка, но сам не может ее реализовать. Поэтому нужны дополнительные механизмы для управления действием гена.
Перенос генетической информации в клетку реципиента осуществляется в составе вектора. Вектор – это, как правило, кольцевая молекула ДНК, способная к самостоятельной репликации. Ген вместе с вектором образует рекомбинантную ДНК.
Конструирование рекомбинантных ДНК
При обычном введении в бактериальную клетку ДНК подвергается ферментативной атаке, в результате которой разрушается. Чтобы этого не происходило, используют векторные молекулы ДНК, способные при введении в клетку существовать автономно, а при делениях клетки – реплицироваться. Вектор также несет в своем составе генетический признак, необходимый для последующего распознавания и отбора трансгенных организмов. Обычно в качестве маркерных генов используют гены устойчивости к антибиотикам.
Конструирование рекомбинантных ДНК осуществляется in vitro с изолированными ДНК при помощи эндонуклеаз рестрикции, которые расщепляют вектор в одном участке, превращая его из кольцевой формы в линейную с образованием липких концов, комплиментарных концам вводимой ДНК. Комплиментарные концы вектора и вводимого гена сшиваются лигазой. Полученную рекомбинантную ДНК с помощью той же ДНК-лигазы замыкают с образованием кольцевой молекулы.
В качестве векторов используют плазмиды и вирусы. Вирусы быстро транспортируются из клетки в клетку, за короткое время способны быстро заразить весь организм. Важной проблемой при их использовании является аттеньюация – ослабление патогенности для хозяина; таким образом, не очевидно, что зараженные вирусом клетки выживут и смогут передавать потомству измененную генетическую программу. Наиболее распространенными векторами являются многокопийные плазмиды с молекулярной массой 3–10 кб. Первые плазмиды были выделены из бактерий, впоследствии их стали конструировать методами генной инженерии.
Использование векторов общего назначения методически – несложная задача, не требующая специального оборудования. Наиболее используемыми плазмидными векторами для клонирования являются плазмиды E. coli (pBR322, pBR325, pACYC117, pACYC 184), а также сконструированные на основе плазмиды CoIEI. Современные плазмидные векторы в присутствии хлорамфеникола способны к репликации, независимо от деления хромосомы, количество копий плазмид при этом может возрастать до 2000 копий на клетку.
При получении библиотеки генов растений и высших животных, у которых общая длина генома составляет до 3×109 и более, емкость вектора часто играет решающую роль. В данном случае в качестве вектора используют ДНК фага λ. При помощи специальных методов рекомбинантные ДНК вводят прямо в фаговые головки. Еще большей емкостью обладают плазмиды – космиды (до 40 кб), у которых cos-фрагмент генома фага λ, участвует в упаковке ДНК в фаговую частицу на конечной стадии развития. Для упаковки ДНК необходимо, чтобы ДНК содержала COS-участок и ее размер был примерно равным размеру генома фага λ. Достигнутые методы упаковки ДНК в фаговую головку при помощи космид позволяют получать библиотеки генов практически любых организмов.
Перенос генов в клетки организма-реципиента
Перенос рекомбинантных ДНК осуществляется путем трансформации или конъюгации. Трансформация – это процесс изменения генетических свойств клетки в результате проникновения в нее чужеродной ДНК. Впервые она была обнаружена у пневмококков Ф. Гиффитом, который показал, что некоторые клетки невирулентных штаммов бактерий при заражении ими мышей совместно с вирулентными штаммами приобретают патогенные свойства. В дальнейшем трансформация была продемонстрирована и изучена у различных видов бактерий.
Установлено, что к трансформации способны лишь некоторые, так называемые «компетентные», клетки (способные включать чужеродную ДНК и синтезирующие особый трансформирующий белок). Компетентность клетки определяется также факторами внешней среды. Этому может способствовать обработка клеток полиэтиленгликолем или хлоридом кальция. После проникновения в клетку одна из нитей рекомбинантной ДНК деградирует, а другая за счет рекомбинации с гомологичным участком реципиентной ДНК может включиться в хромосому или внехромосомную единицу. Трансформация является наиболее универсальным способом передачи генетической информации и имеет наибольшее значение для генетических технологий.
Конъюгация – один из способов обмена генетического материала, при котором происходит однонаправленный перенос генетической информации от донора к реципиенту. Этот перенос находится под контролем особых конъюгативных плазмид (фактор фертильности). Перенос информации от донорской клетки в реципиентную осуществляется через специальные половые ворсинки (пили). Возможна передача информации и с помощью неконъюгативных плазмид при участии плазмид-помощниц.
Передача всего набора генов вируса или фага, приводящая к развитию в клетке фаговых частиц, называется трансфекцией. Методика применительно к бактериальным клеткам включает получение сферопластов, очистку инкубационной среды от нуклеаз и добавление очищенной фаговой ДНК (присутствие протаминсульфата повышает эффективность трансфекции). Методика применима к животным и растительным клеткам с участием специальных челночных вирусных векторов.
Скрининг и отбор рекомбинантных клеток
После переноса сконструированных ДНК, как правило, лишь небольшая часть реципиентных клеток приобретает необходимый ген. Поэтому очень важным этапом является идентификация клеток, несущих ген-мишень.
На первой стадии идентифицируют и отбирают клетки, несущие вектор, на основе которого осуществлен перенос ДНК. Отбор проводят по генетическим маркерам, которыми помечен вектор. Главным образом маркерами являются гены устойчивости к антибиотикам. Поэтому отбор проводят высевом клеток на среды, содержащие конкретный антибиотик. После высева на этих средах вырастают только клетки, в составе которых находится вектор с генами антибиотиковой устойчивости.
На второй стадии отбирают клетки, несущие вектор и ген-мишень. Для этого используют две группы методов: 1) основанные на непосредственном анализе ДНК клеток-реципиентов и 2) основанные на идентификации признака, кодируемого геном-мишенью. При использовании первой группы методов из клеток, предположительно содержащих нужный ген, выделяют векторную ДНК, и в ней проводится поиск участков, несущих данный ген. Далее проводят секвенирование части нуклеотидной последовательности гена. Возможен другой метод – гибридизация выделенной из клеток ДНК с зондом (искомый ген или соответствующая ему мРНК); выделенную ДНК переводят в одноцепочечное состояние и вводят ее во взаимодействие с зондом. Далее определяют наличие двуцепочечных гибридных молекул ДНК. Во втором варианте возможен непосредственный отбор клеток, синтезирующих белок – продукт транскрипции и трансляции гена-мишени. Применяются также селективные среды, поддерживающие рост только клеток, приобретших ген-мишень.
С помощью методов генетической инженерии возможно конструирование новых форм микроорганизмов по заданному плану, способных синтезировать разнообразные продукты, в том числе эукариотических организмов. Рекомбинантные микробные клетки быстро размножаются в контролируемых условиях и способны утилизировать при этом разнообразные, в том числе, недорогие субстраты.
Основные проблемы, возникающие при генетических манипуляциях, заключаются в следующем: 1) гены при трансформации, попадая в чужеродную среду, подвергаются воздействию протеаз, поэтому их надо защищать; 2) как правило, продукт трансплантированного гена аккумулируется в клетках и не выделяется в среду; 3) большинство желаемых признаков кодируется не одним, а группой генов. Все это существенно затрудняет перенос и требует разработки технологии последовательной трансплантации каждого гена.
К настоящему времени генетическая инженерия освоила все царства живого. Фенотипическое выражение «чужих» генов (экспрессия) получены у бактерий, дрожжей, грибов, растений и животных. Блестящие успехи достигнуты на клетках наиболее и всесторонне изученных микроорганизмов. Эра рекомбинантных ДНК применительно к растениям и высшим животным только начинается. В области генетической инженерии животных клонированы гены β-глобина мышей, фага λ. Помимо почечных клеток зеленой африканской мартышки, испытываются все новые виды культуры животных клеток, в том числе клетки человека. Например, в клетках непарного шелкопряда с применением вирусного вектора удалось добиться экспрессии гена β-интерферона человека. Этот ген также клонирован в клетках млекопитающих. В генетической инженерии человека, как и в генетическом конструировании растений, пока не достигнуто тканеспецифического выражения генов. Решения данной проблемы ищут на путях введения определенных промоторов регуляторных участков в конструируемые векторы. Пока остается достаточно отдаленной задачей возможность улучшения сельскохозяйственных пород животных. К настоящему времени практически нет сведений по генетике таких признаков, как плодовитость, выход и жирность молока, повышение устойчивости к болезням и др. Это препятствует попыткам генетических манипуляций в данной области.
Генетическая инженерия дает в руки биотехнологов не только новые продуценты ценных соединений, но и улучшает и повышает эффективность ценных свойств уже традиционно используемых организмов. Распространенным методом повышения выхода полезного продукта является амплификация – увеличение числа копий генов. Образование многих целевых продуктов (аминокислот, витаминов, антибиотиков и др.) характеризуется длинным биохимическим путем синтеза, который управляется не одним, а десятками генов. Выделение этих генов и клонирование с помощью амплификации представляет довольно трудную, но в ряде случаев возможную задачу. Повышение выхода полезного продукта достигается также с помощью локализованного (сайт-специфического) мутагенеза in vitro: с использованием химического мутагенеза обрабатывается не весь геном клетки, а его фрагмент, полученный с помощью рестрикции.
4.2. ГЕННАЯ ИНЖЕНЕРИЯ ПРОМЫШЛЕННО ВАЖНЫХ ПРОДУЦЕНТОВ
Развитие техники рекомбинантных ДНК позволяет проводить выделе- ние генов эукариот и экспрессировать их в гетерологических системах. В настоящее время методы генетической инженерии позволяют конструировать генетические системы, способные функционировать в клетках прокариот и эукариот. Эти возможности позволяют создавать организмы, обладающие новыми ценными свойствами, например, бактериальные штаммы, способные синтезировать эукариотические белки.
Среди белковых продуктов, представляющих большой интерес, выделяются такие биологически активные вещества, как гормоны. Важное место среди них занимают белковые и пептидные гормоны. Эти гормоны, многие из которых остро необходимы в медицине, до недавнего времени получали экстракцией из тканей животных при условии, что гормон не обладает выраженной видовой специфичностью. Сравнительно короткие пептидные гормоны пытались получать химическим синтезом. Но такой путь получения оказался нерентабельным уже для молекул, состоящих из нескольких десятков звеньев. Единственным источником гормонов с крайне выраженной видовой специфичностью (гормон роста соматотропин) были органы умерших людей.
Успехи генетической инженерии вселили надежды на возможность клонирования генов синтеза ряда гормонов в микробных клетках. Эти надежды в значительной мере оправдались, в первую очередь, на примере микробиологического синтеза пептидных гормонов.
Первые успешные результаты по экспрессии химически синтезированной последовательности нуклеотидов ДНК, кодирующей 14-звенный пептидный гормон соматостатин (антагонист соматотропина), получены в 1977 г. в США компанией «Генетек». Для предотвращения процесса разрушения гормона в бактериальных клетках под воздействием пептидазы авторы применили подход, который потом был успешно использован для получения других пептидных гормонов. Был сконструирован гибридный ген, часть которого была взята из гена фермента β-галактозидазы кишечной палочки, а остаток представлял собой фрагмент, кодирующий собственно соматостатин (фрагмент синтезировали химически). Введенный в бактериальные клетки гибридный ген направлял синтез белка-химеры, состоящего более чем на 90 % из аминокислотной последовательности β-галактозидазы. Остальная часть представляла собой соматостатин. На стыке участка двух исходных генов находился кодон аминокислоты метионина. Последнее позволило обработать гибридный белок бромцианом, разрывающим пептидную связь, образованную метионином; среди продуктов расщепления был обнаружен соматостатин. Данный подход был использован для получения многих пептидных гормонов (А- и В-цепей инсулина, нейропептида лейэнкефалина, брадикинина, ангиотензина и др.).
Генноинженерными методами за короткий срок были созданы микроорганизмы-суперпродуценты, позволяющие получать с высокими выходами ряд белков вирусов и животных. Созданы штаммы, у которых до 20 % клеточного белка составляют генноинженерные продукты, например, коровий антиген вируса гепатита В, главный капсидный антиген вируса ящура, реннин теленка, поверхностный антиген вируса гепатита В и др.
Получение рекомбинантного инсулина
Гормон инсулин построен из двух полипептидных цепей, А и Б, длиной 20 и 30 аминокислот соответственно. Последовательность цепей была установлена в 1955 г. Сэнгером. Синтез обеих цепей, включающий 170 химических реакций, в 1963 г. был реализован в США, ФРГ и Китае. Но перенести такой сложный процесс в промышленность оказалось невозможным. Получали инсулин до 1980 г. за счет выделения его из поджелудочной железы (поджелудочная железа коровы весит 200–250 г., а для получения 100 г кристаллического инсулина требуется до 1 кг исходного сырья). Поэтому потребности в нем удовлетворяли не полностью. Так, в 1979 г. из 6 млн. зарегистрированных больных сахарным диабетом инсулин получали только 4 млн. человек. В 1980 г. датская компания «Ново индастри» разработала метод превращения инсулина свиньи в инсулин человека ферментативным замещением остатка аланина, который является 30-й аминокислотой в цепи В, на остаток треонина. В результате был получен однокомпонентный инсулин человека 99 % чистоты. В организме животного две полипептидные цепи исходно являются частями одной белковой молекулы длиной 109 аминокислот – это препроинсулин. При синтезе в клетках поджелудочной железы первые 23 аминокислоты служат сигналом для транспорта молекулы сквозь мембрану клетки. Эти аминокислоты отщепляются, и образуется проинсулин длиной 86 аминокислот.
В 1980 г. Гилберт с коллегами выделили мРНК инсулина из опухоли β-клеток поджелудочной железы крысы (в то время не разрешали манипулировать генами человека) (рис. 4.3). Полученную ДНК-копию мРНК встроили в плазмиду pBR 322, в среднюю часть гена пенициллиназы (фермент в норме выделяется из клетки), которую транспортировали в бактерию. Сконструированная плазмида, как оказалось, содержала информацию о структуре проинсулина, а не препроинсулина. При трансляции мРНК в клетках E. coli синтезировался гибридный белок, содержащий последовательности пенициллиназы и проинсулина. Гормон из этого белка выщепляли трипсином. Было доказано, что полученный таким образом белок влияет на сахарный обмен аналогично гормону поджелудочной железы. В 1979 г. в США в течение трех месяцев синтезировали гены, кодирующие А- и В-цепи инсулина; гены были собраны из 18 и 11 олигонуклеотидов соответственно. Далее гены были встроены, как и при получении соматостатина, в плазмиду в конце гена β-галактозидазы кишечной палочки. В клетках E. coli также осуществлен синтез проинсулина, а не только его отдельных цепей. На выделенной матричной мРНК синтезировали ДНК-копию. Синтез проинсулина имеет определенные преимущества, так как процедуры экстракции и очистки гормона минимальны.
Совершенствование техники получения генноинженерных штаммов-продуцентов с помощью различных приемов (амплификацией плазмид, инкапсулированием вводимых рекомбинантных ДНК, подавлением протеолитической активности реципиентных клеток) позволило получить высокие выходы гормона, до 200 мг/л культуры. Медико-биологические и клинические испытания генноинженерного белка показали пригодность препарата, и в 1982 г. он был допущен к производству во многих странах.
Рис. 4.3. Биосинтез инсулина крысы в сконструированных клетках E. coli (по Gilbert e.a., 1980). а) карта плазмиды pBR322 c двумя генами – пенициллиназы и устойчивости к тетрациклину; б) карта, полученная при определении последовательности кДНК рекомбинантной плазмиды в продуцирующем инсулин клоне E. coli; в) гибридный белок; г) биологически активный инсулин после удаления пенициллиназы и сегмента проинсулина.
Биосинтез соматотропина
Соматотропин (гипофизарный гормон роста) впервые был выделен в 1963 г. из трупного материала. Выход гормона из одного гипофиза составлял около 4–6 мг в пересчете на готовый фармацевтический препарат. Для лечения карликовости необходимая доза составляет 6 мг в неделю в течение года. Кроме недостатка по массе, получаемый экстракцией препарат был гетерогенным, против него вырабатывались антитела, которые сводили на нет действие гормона. Более того, существовала опасность, что при получении препарата могло произойти заражение организма медленно развивающими вирусами. Поэтому дети, получавшие данный препарат, нуждались в многолетнем медицинском наблюдении.
Генноинженерный препарат имеет несомненные преимущества: доступен в больших количествах, гомогенен, не содержит вирусов. Синтез соматотропина, состоящего из 191 аминокислотного остатка, был осуществлен в США Гедделем с сотрудниками в 1979 г. (компания «Генентек») (рис. 4.4).
Рис. 4.4. Схема конструирования гена соматотропина комбинацией химического синтеза и выделения природной мРНК (по P. Newmark, 1979).
При химико-ферментном синтезе ДНК получается ген, кодирующий предшественник соматотропина, поэтому был выбран специальный путь клонирования. На первом этапе клонировали двунитевую ДНК-копию мРНК и расщеплением рестиктазами получали последовательность, кодирующую всю аминокислотную последовательность гормона, кроме первых 23 аминокислот. Далее клонировали синтетический полинуклеотид, соответствующий этим 23 аминокислотам со стартовым ANG кодоном в начале. Два полученных фрагмента соединяли и подстраивали к паре lac-промоторов и участку связывания рибосом. Сконструированный ген трансплантировали в E. coli. Синтезированный в бактериях гормон обладал требуемой молекулярной массой, не был связан с каким-либо белком; его выход составлял около 100 000 молекул на клетку. Гормон, однако, содержал на N-конце полипептидной цепи дополнительный остаток метионина; при удалении последнего выход гормона был низким.
В 1980 г. были получены доказательства того, что генноинженерный соматотропин обладает биологической активностью нативного гормона. Клинические испытания препарата также прошли успешно. В 1982 г. гормон был получен также на основе сконструированной кишечной палочки в Институте Пастера в Париже. Стоимость гормона к 1990 г. снизилась до 5 долларов/ед. В настоящее время его начинают применять в животноводстве для стимулирования роста домашнего скота, удоев и др.
Получение интерферонов
Интерфероны – группа белков, способных продуцироваться в ядерных клетках позвоночных. Это мощные индуцибельные белки, являю- щиеся фактором неспецифической резистентности, поддерживающего гомеостаз организма. Система интерферонов обладает регуляторной функцией в организме, так как способна модифицировать различные биохимические процессы. Интерфероны позвоночных, в том числе человека, разделяют на три группы: α, β, γ, соответственно, лейкоцитарные, фибробластные и иммунные.
В конце 70-х гг. стала очевидной потенциальная значимость интерферонов для медицины, в том числе профилактики онкологических заболеваний. Клинические испытания сдерживались отсутствием достаточных количеств интерферонов и высокой стоимостью препаратов, полученных традиционным способом (выделение из крови). Так, в 1978 г. для получения 0.1 г чистого интерферона в Центральной лаборатории здравоохранения Хельсинки (лаборатория – мировой лидер по производству интерферона из лейкоцитов здоровых людей) получали при переработке 50 000 л крови. Полученное количество препарата оценочно могло обеспечить лечение против вирусной инфекции 10 000 случаев. Перспективы получения интерферонов связывали с генной инженерией.
В 1980 г. Гилберту и Вейссману в США удалось получить интерферон в генетически сконструированной E. coli. Исходная трудность, с которой они столкнулись, – низкий уровень мРНК в лейкоцитах, даже стимулированных заражением вирусом. При переработке 17 л крови удалось выделить мРНК и получить ДНК-копию. Последнюю встроили в плазмиду и клонировали в E. coli. Было испытано свыше 20 000 клонов. Отдельные клоны были способны к синтезу интерферона, но с низким выходом, 1–2 молекулы на клетку. Аналогичные исследования проводили в Японии, Англии, Франции, России.
В 1980 г. были установлены нуклеотидные последовательности α- и β- интерферонов: мРНК фибробластного интерферона состоит из 836 нуклеотидов; из них 72 и 203 нуклеотида приходятся на 5’- и 3’- нетранслируемые области, 63 кодируют пептид, ответственный за секрецию интерферона из клеток и 498 нуклеотидов кодируют 166 аминокислотных остатков собственно интерферона. После этого химическим синтезом были получены гены α- и β-интерферонов, которые клонировали в E. coli. В 1981 г. была расшифрована нуклеотидная последовательность иммунного интерферона, существенно отличающегося от первых двух, но сравнимого по величине молекулы. Существенным моментом был полный синтез гена лейкоцитарного интерферона человека, осуществленный в Великобритании сотрудниками фирмы «Империал кемикал индастри» и Школы биологических наук Лестерского университета. В течение полутора лет была синтезирована полная последовательность ДНК-копии интерферона, способная кодировать α1-интерферон. Синтез олигонуклеотидов был осуществлен новым методом, существенно ускорившим синтез гена. Вначале к полиакриламидной смоле был присоединен нуклеотид; далее проводили присоединение пар нуклеотидов, используя конденсирующий агент в безводном пиридине. Каждый цикл длился полтора часа, поэтому в течение года можно было синтезировать последовательность длиной в 5000 нуклеотидов. Было синтезировано 67 олигонуклеотидов, которые с помощью лигазы соединили в двунитевую ДНК, состоящую из 514 пар нуклеотидов. Полученный ген встраивали в клетки двух бактерий: E. coli, Methylophilus methylotrophus, и была получена экспрессия.
Усилия, направленные на получение генноинженерных интерферонов, по сравнению с методом культуры клеток позволили снизить затраты более чем в 100 раз. Были получены различные типы интерферонов на основе генноинженерных клеток бактерий и дрожжей. Это позволило развернуть медико-биологические и клинические испытания препаратов. Получаемые в течение 1980–1981 гг. препараты интерферонов были очищены на 80 % и обладали удельной активностью более 107 международных единиц на 1 мг белка. Расширение клинических испытаний интерферонов, начатых в этот период, зависит от повышения степени его очистки. Прогресс в этом направлении был достигнут применением моноклональных антител, которые можно использовать для аффинной хроматографии (при этом нужные белки задерживаются на колонке с антителами).
4.3. КЛЕТОЧНАЯ ИНЖЕНЕРИЯ
Традиционно для получения более активных биологических агентов применяли селекцию и мутагенез. Селекция – это направленный отбор мутантов – организмов, наследственность которых приобрела скачкообразное изменение в результате структурной модификации в нуклеотидной последовательности ДНК. Генеральный путь селекции – это путь от слепого отбора нужных продуцентов к сознательному конструированию их генома. Традиционные методы отбора в свое время сыграли важную роль в развитии различных технологий с использованием микроорганизмов. Были отобраны штаммы пивных, винных, пекарских, уксуснокислых и др. микроорганизмов. Ограничения метода селекции связано с низкой частотой спонтанных мутаций, приводящих к изменению в геноме. Ген должен удвоиться в среднем 106–108, чтобы возникала мутация.
К существенному ускорению процесса селекции ведет индуцированный мутагенез (резкое увеличение частоты мутаций биологического объекта при искусственном повреждении генома). Мутагенным действием обладают ультрафиолетовое и рентгеновское излучение, ряд химических соединений (азотистая кислота, бромурацил, антибиотики и пр.). После обработки популяции мутагеном проводят тотальный скрининг (проверку) полученных клонов и отбирают наиболее продуктивные. Проводят повторную обработку отобранных клонов, и вновь отбирают продуктивные клоны, то есть проводят ступенчатый отбор по интересующему признаку.
Работа эта требует больших трудозатрат и времени. Недостатки ступенчатого отбора могут быть в значительной степени преодолены при сочетании его с методами генетического обмена.
Генетическое конструирование in vivo (клеточная инженерия) включает получение и выделение мутантов и использование различных способов обмена наследственной информацией живых клеток.
Основой клеточной инженерии является слияние неполовых клеток (гибридизация соматических клеток) с образованием единого целого. Слияние клеток может быть полным, или клетка-реципиент может приобрести отдельные части донорской клетки (митохондрии, цитоплазму, ядерный геном, хлоропласты и др.). К рекомбинации ведут различные процессы обмена генетической информацией живых клеток (половой и парасексуальный процесс эукариотических клеток; конъюгация, трансформация и трансдукция у прокариот, а также универсальный метод – слияние протопластов).
При гибридизации берут генетически маркированные штаммы микроорганизмов (чаще ауксотрофные мутанты или мутанты, устойчивые к ингибиторам роста). В результате слияния клеток (копуляции) происходит образование гибридов у дрожжей, грибов, водорослей. Если исходные клетки были гаплоидными, в результате слияния ядер появляется диплоидная клетка (зигота), несущая в ядре двойной набор хромосом. У отдельных представителей ядро сразу подвергается мейозу, в ходе которого каждая из хромосом расщепляется. Гомологичные хромосомы образуют пары и обмениваются частями своих хроматид в результате кроссинговера. Далее формируются гаплоидные половые споры, каждая из которых содержит набор генов, которыми различались родительские клетки, в результате рекомбинации генов одной и той же хромосомы, а также разных хромосом при распределении хромосомных пар. Если после слияния ядра не сливаются, образуются формы со смешенной цитоплазмой и ядрами разного происхождения (гетерокарионы). Такие формы свойственны грибам, особенно продуцентам пенициллинов. При размножении полученных гетерозиготных диплоидов или гетерокарионов происходит расщепление – проявление в потомстве, обнаруживающих не только доминантные, но и рецессивные признаки родителей. Половой и парасексуальный процесс широко используют в генетической практике промышленно важных микроорганизмов-продуцентов.
У бактерий обмен генетической информацией происходит в результате взаимодействия конъюгативных плазмид (конъюгации). Впервые конъюгацию наблюдали у E. coli K-12. Для конъюгационного скрещивания культуру донора и реципиента смешивают и совместно инкубируют в питательном бульоне или на поверхности агаризованных сред. Клетки при помощи образующегося конъюгационного мостика соединяются между собой; через мостик осуществляется передача определенного сайта плазмидной хромосомы к реципиенту. Так, при 37°С для переноса всей хромосомы требуется около 90 минут. Конъюгация открыла и открывает широкие перспективы для генетического анализа и конструирования штаммов.
Трансдукция – процесс переноса генетической информации от клетки реципиента к клетке-донору с помощью фага. Впервые этот процесс был описан в 1952 г. Циндером и Лидербергом. Трансдукция основана на том, что в процессе размножения фагов в бактериях возможно образование частиц, которые содержат фаговую ДНК и фрагменты бактериальной ДНК. Для осуществления трансдукции нужно размножить фаг в клетках штамма-донора, а затем заразить им клетки-реципиента. Отбор рекомбинантных форм проводят на селективных средах, не поддерживающих роста исходных форм.
В последние годы очень широко применяют метод слияния протопластов. Этот метод, видимо, является универсальным способом введения генетической информации в клетки различного происхождения. Простота метода делает его доступным для селекции промышленно важных продуцентов. Метод открывает новые возможности для получения межвидовых и межродовых гибридов и скрещивания филогенетически отдаленных форм живого. Получены положительные результаты слияния бактериальных, дрожжевых и растительных клеток. Получены межвидовые и межродовые гибриды дрожжей. Имеются данные о слиянии клеток различных видов бактерий и грибов. Удалось получить гибридные клетки в результате слияния клеток организмов, относящихся к различным царствам: животного и растительного. Ядерные клетки лягушки были слиты с протопластами моркови; гибридная растительно-животная клетка росла на средах для растительных клеток, однако, достаточно быстро утрачивала ядро и покрывалась клеточной стенкой.
Достаточно успешно в последние годы проводятся работы по созданию ассоциаций клеток различных организмов, то есть получают смешанные культуры клеток двух или более организмов с целью создания искусственных симбиозов. Успешно проведены опыты по введению азотфиксирующего организма Anabaena variabilis в растения табака. Попытки введения A. variabilis непосредственно в черенки зрелых растений табака не дали положительных результатов. Но при совместном культивировании мезофильной ткани табака и цианобактерий удалось получить растения-регенеранты, содержащие цианобактерии. Получены ассоциации клеток женьшеня и паслена с цианобактерией Chlorogleae fritschii.
Перспективно клональное размножение животных клеток для генетических манипуляций. Большие перспективы имеет техника клеточных культур животных клеток для получения биологически активных соединений, хотя делает пока только первые шаги. Культуры опухолевых клеток или нормальные клетки, трансформированные in vitro, сохраняют в ряде случаев способность синтезировать специфические продукты. Несмотря на много, пока не преодоленных трудностей, показана возможность получения ряда веществ в культуре животных клеток:
|
Продукт
|
Клетки или их источник
|
|
Гормон роста
|
Опухоль гипофиза
|
|
Коллаген
|
Фибробласты
|
|
Кортикостероиды
|
Опухоль надпочечника
|
|
Гистамин
|
Опухоль из тучных клеток
|
|
Меланин
|
Меланома радужной оболочки сетчатки
|
|
Мукополисахариды
|
Фибробласты
|
|
Фактор роста нервной ткани
|
Нейробластома
|
Важное направление клеточной инженерии связано с ранними эмбриональными стадиями. Так, оплодотворение яйцеклеток в пробирке позволяет преодолеть бесплодие. С помощью инъекции гормонов можно получить от одного животного десятки яйцеклеток, искусственно их оплодотворить in vitro и имплантировать в матку других животных. Эта технология применяется в животноводстве для получения монозиготных близнецов. Разработан новый метод, основанный на способности индивидуальных клеток раннего эмбриона развиваться в нормальный плод. Клетки эмбриона разделяют на несколько равных частей и трансплантируют реципиентам. Это позволяет размножать различных животных ускоренным путем. Манипуляции на эмбрионах используют для создания эмбрионов различных животных. Подход позволяет преодолеть межвидовой барьер и создавать химерных животных. Таким образом получены, например, овце-козлиные химеры.
Наиболее перспективным направлением клеточной инженерии является гибридомная технология. Гибридные клетки (гибридомы) образуются в результате слияния клеток с различными генетическими программами, например, нормальных дифференцированных и трансформированных клеток. Блестящим примером достижения данной технологии являются гибридомы, полученные в результате слияния нормальных лимфоцитов и миеломных клеток. Эти гибридные клетки обладают способностью к синтезу специфических антител, а также к неограниченному росту в процессе культивирования.
В отличие от традиционной техники получения антител, гибридомная техника впервые позволила получить моноклональные антитела (антитела, продуцируемые потомками одной-единственной клетки). Моноклональные антитела высокоспецифичны, они направлены против одной антигенной детерминанты. Возможно получение нескольких моноклональных антител на разные антигенные детерминанты, в том числе сложные макромолекулы.
Моноклональные антитела в промышленных масштабах получены сравнительно недавно. Как известно, нормальная иммунная система способна в ответ на чужеродные агенты (антигены) вырабатывать до миллиона различных видов антител, а злокачественная клетка синтезирует только антитела одного типа. Миеломные клетки быстро размножаются. Поэтому культуру, полученную от единственной миеломной клетки, можно поддерживать очень долго. Однако невозможно заставить миеломные клетки вырабатывать антитела к определенному антигену. Эту проблему удалось решить в 1975 г. Цезарю Мильштейну. У сотрудников Медицинской научно-исследовательской лаборатории молекулярной биологии в Кембридже возникла идея слияния клеток мышиной миеломы с В-лимфоцитами из селезенки мыши, иммунизированной каким-либо специфическим антигеном. Образующиеся в результате слияния гибридные клетки приобретают свойства обеих родительских клеток: бессмертие и способность секретировать огромное количество какого-либо одного антитела определенного типа (рис. 4.5). Эти работы имели огромное значение и открыли новую эру в экспериментальной иммунологии.
Рис. 4.5. Схема продукции моноклональных антител гибридомой, образованной лимфоцитами и миеломными клетками (по Г. Фаффу, 1984). А – антиген с 4 антигенными детерминантами на поверхности; после инъекции антигена лимфоциты мыши продуцируют 4 типа антител; антисыворотка из крови мыши содержит смесь антител; Б – лимфоциты сливаются с миеломными клетками; гибридные клетки (источник чистых антител) клонируют.
В 1980 г. Карло М. Кроче с сотрудниками (США) удалось создать стабильную, продуцирующую антигены, внутривидовую человеческую гибридому путем слияния В-лимфоцитов миеломного больного с периферическими лимфоцитами от больного с подострым панэнцефалитом.
Основные этапы получения гибридомной техники следующие. Мышей иммунизируют антигеном, после этого из селезенки выделяют спленоциты, которые в присутствии полиэтиленгликоля сливают с дефектными опухолевыми клетками (обычно дефектными по ферментам запасного пути биосинтеза нуклеотидов – гипоксантина или тиамина). Далее на селективной среде, позволяющей размножаться только гибридным клеткам, проводят их отбор. Питательную среду с растущими гибридомами тестируют на присутствие антител. Положительные культуры отбирают и клонируют. Клоны инъецируют животным с целью образования опухоли, продуцирующей антитела, либо наращивают их в культуре. Асцитная жидкость мыши может содержать до 10–30 мг/мл моноклональных антител.
Гибридомы можно хранить в замороженном состоянии, и в любое время вводить дозу такого клона в животное той линии, от которой получены клетки для слияния. В настоящее время созданы банки моноклональных антител. Антитела применяют в разнообразных диагностических и терапевтических целях, включая противораковое лечение (таблица 4.1).
Таблица 4.1. Возможные области и способы применения антител (по И. Хиггинсу, 1988)
|
Область медицины
|
Способ применения
|
|
Анализ
|
Структурные зонды для идентификации поверхностных особенностей клеток
|
|
Диагностика
|
Наборы реактивов для диагностики беременности
|
|
Выявление эстрогенных рецепторов для диагностики рака молочной железы
|
|
|
Иммунодиагностика
|
Точное определение количества специфических антигенов
|
|
Иммуноочистка
|
Очистка антигенов (например, интерферона)
|
|
Терапия
|
Направленный перенос токсинов в раковые клетки, инактивация ядов, пассивная иммунизация, лечение аутоиммунных болезней
|
Эффективным способом применения моноклональных антител в терапии является связывание их с цитоксическими ядами. Антитела, конъюгированные с ядами, отслеживают и уничтожают в макроорганизме раковые клетки определенной специфичности.
Таким образом, клеточная инженерия является эффективным способом модификации биологических объектов и позволяет получать новые ценные продуценты на органном и также клеточном и тканевом уровнях.
Источник: Использован материал первых 4-х глав из учебного пособия: Биотехнология / Т. Г. Волова. – Новосибирск: Изд-во Сибирского отделения Российской Академии наук, 1999. – 252 с. (всего 7 глав)
Литература: см. по ссылке→
Доп. информация:
Микробная биотехнология (начальная страница)