ООО "ПРОПИОНИКС"
| пн-пт с 09:00 до 18:00 | |
Микробная технология аминокислот
Описание промышленного биосинтеза аминокислот на примере лизина, глутаминовой кислоты и триптофана
В состав природных белков (в том числе микробных) входят 20 аминокислот, из которых десять не синтезируются в организме животных и человека и должны поступать с кормами и продуктами питания. К незаменимым аминокислотам относятся лейцин, изолейцин, фенилаланин, валин, метионин, триптофан, треонин, лизин, аргинин, гистидин.
В животноводстве сбалансированность кормов по аминокислотам определяет полноту использования их животными и, следовательно, затраты кормов на единицу продукции.
Добавка к рациону животных незначительных количеств (десятые доли процента) недостающих незаменимых аминокислот приводит к снижению расхода кормов более чем в 2 раза.
Помимо сельского хозяйства, крупным потребителем аминокислот является пищевая промышленность. Незаменимые аминокислоты применяют для обогащения пищевых продуктов. Суточная потребность человека в незаменимых аминокислотах составляет 0,5-2,2 г в зависимости от вида аминокислоты. Многие аминокислоты обладают оригинальным вкусом и являются компонентами сложных композиций, определяющих вкусовые особенности ряда пищевых продуктов. Цистеин и цистин в сочетании с глутаматом натрия используют для имитации запаха и вкуса мяса при создании новых видов пищи. Некоторые аминокислоты и их производные важны для диабетического питания. Например, производные аспарагиновой кислоты в 130 раз слаще сахарозы. Глутамат натрия широко используется как консервант и усилитель вкусовых качеств пищевых продуктов. Аминокислоты находят применение при производстве дезодорантов, антиокислителей жиров, пищевых красителей.
Все большее внимание уделяется использованию аминокислот и их производных в фармакологии в качестве лекарственных препаратов для профилактики и лечения различных заболеваний. В последние годы перечень аминокислот, применяемых в фармацевтических целях, значительно расширился (триптофан, глутаминовая кислота, треонин, аргинин, гистидин и др.). Большие перспективы связывают с производством полиаминокислот, на основе которых получают искусственные материалы, аналогичные по внешнему виду коже, шелку, шерсти. Специальная искусственная кожа из аминокислот легко и без вреда рассасывается в живом организме и используется при лечении ожогов, в хирургии. Для получения полимеров чаще всего применяют глутаминовую кислоту.
Масштабы производства аминокислот в мире оцениваются величиной около 600 тыс. т в год, в том числе глутаминовая кислота - 300 тыс. т, лизин - 100 тыс. т, метионин - более 150 тыс. т. Существуют следующие способы промышленного производства аминокислот:
- кислотный, щелочной или ферментативный гидролиз природных белков (белки микробной биомассы, белоксодержащие отходы переработки растений (например, соевый шрот), отходы мясной промышленности (кератиновое сырье), казеин молока и др.);
- химический синтез;
- микробиологический синтез;
- получение аминокислот методом биотрансформации предшественника (химико-энзиматический синтез).
Первый способ пригоден для получения кормовой смеси аминокислот из белоксодержащих отходов. Выделение индивидуальных аминокислот из белковых гидролизатов − весьма сложная и дорогостоящая операция. При щелочном и кислотном гидролизе белков некоторые из аминокислот в значительной степени разрушаются, а протеолитические ферменты не обеспечивают полный гидролиз пептидных связей.
Разработан и реализован в промышленных масштабах химический синтез ряда аминокислот: метионина, глутаминовой кислоты, лизина, триптофана, треонина, глицина и др. Метионин получают из акролеина (СН2=СН–СНО), глутамат натрия - из акрилонитрила (NС-СН=СН2), триптофан - из индола и нитроуксусного эфира, лизин - из циклогексанона.
В результате химического синтеза всегда образуются рацематы - равновесные смеси D- и L-форм аминокислоты. Биологически активны L-аминокислоты. Разделение D- и L-форм аминокислот - сложный и (или) дорогостоящий процесс. D-форма в готовом продукте представляет собой балласт, поскольку не усваивается организмом человека и животного, а у некоторых аминокислот она обладает токсичными свойствами. Исключение составляют глицин и метионин. Для первого не существует оптически активных изомеров, а D- и L-формы метионина усваиваются организмом человека и животных в равной степени.
В мировой практике около 60% всего объема производимых аминокислот получают микробиологическим синтезом. Главным преимуществом этого способа является то, что микроорганизмы образуют аминокислоты в биологически активной L-форме. Образование аминокислот в D-форме является редким исключением. Это обстоятельство в значительной степени упрощает выделение и очистку аминокислот и позволяет получать кормовые препараты с низкой себестоимостью.
В ближайшем будущем прямому микробиологическому синтезу составит конкуренцию метод биотрансформации, который обладает рядом преимуществ:
- незначительное количество побочных продуктов в ферментационной среде, что упрощает стадию выделения и очистки целевого продукта;
- высокая концентрация аминокислот в ферментационной среде;
- отсутствие жестких требований по стерильности процесса и возможность осуществления его в непрерывном режиме.
Эти факторы обусловливают значительную экономию энергетических ресурсов, снижение себестоимости продукта при производстве чистых аминокислот и более высокий уровень экологической чистоты производства. В качестве примера промышленной реализации биотрансформационного метода можно привести производство L-аспарагиновой кислоты биотрансформацией фумарата аммония с применением аспартазы иммобилизованных клеток E. coli (фирма «Танабэ», Япония) или производство L-лизина из циклогексана (фирма «Торэй», Япония).
В отечественной практике наибольшее распространение получил метод прямого микробиологического синтеза аминокислот с использованием ауксотрофных мутантов, способных к сверхсинтезу целевой аминокислоты. Ауксотрофные мутанты получают путем воздействия различных мутагенов (рентгеновское излучение, химические агенты) на исходную культуру микроорганизма с последующей селекцией штамма по заданным признакам. У мутантов появляется дефектный ген, детерминирующий фермент, без которого не может осуществляться биосинтез определенной аминокислоты.
Получение ауксотрофных мутантов, способных к сверхсинтезу аминокислот, возможно только для микроорганизмов, которые имеют разветвленный путь биосинтеза по крайней мере двух аминокислот, образующихся из одного предшественника. Их биосинтез контролируется на уровне первого фермента общего участка ингибированием конечными продуктами. У таких ауксотрофных мутантов избыток одной аминокислоты при дефиците другой не приводит к подавлению активности первого фермента. Аминокислота, биосинтез которой блокирован в результате мутагенного воздействия, должна присутствовать в исходной ферментационной среде в ограниченном количестве.
Технология микробиологического синтеза различных аминокислот имеет много общего. Среди кормовых препаратов аминокислот наибольшее распространение получили препараты на основе лизина.
1. Производство препаратов лизина

Лизин (α, ε-диаминокапроновая кислота) имеет структурную формулу

В организме животных и человека лизин увеличивает коэффициент использования белка, способствует секреции пищеварительных ферментов, транспорту кальция в клетки.
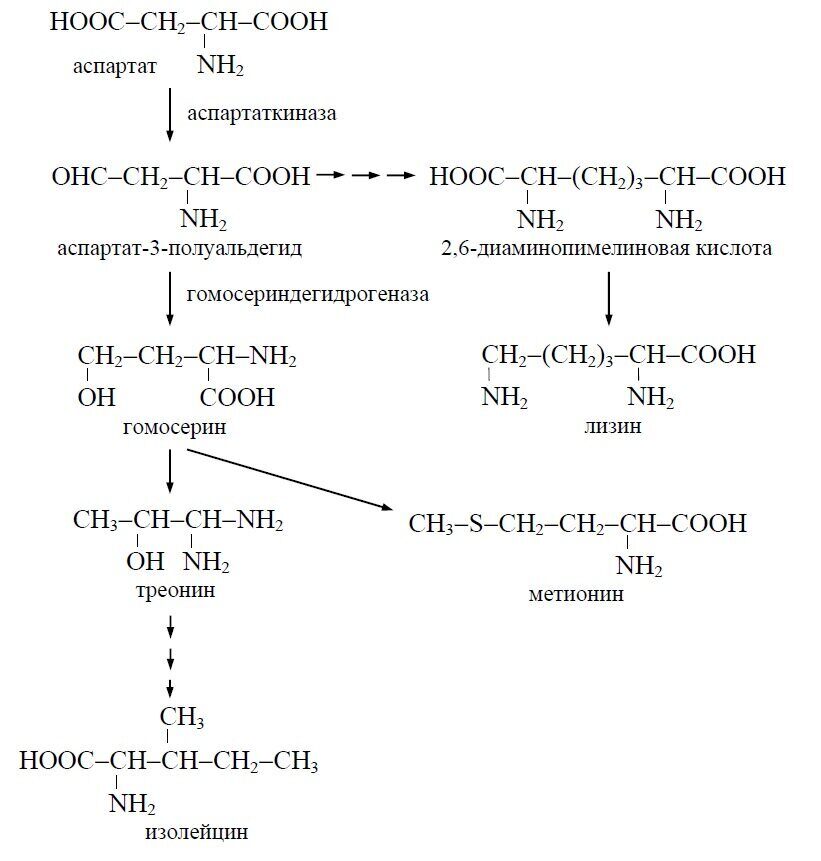
Существует два принципиально различных пути биосинтеза лизина у микроорганизмов. Грибы, микроводоросли, дрожжи и актиномицеты осуществляют синтез лизина по аминоадипиновому пути из α-кетоглутаровой кислоты через аминоадипиновую кислоту. Регуляция активности ферментов этого пути исследована недостаточно, и среди указанных групп микроорганизмов еще не получены мутанты, способные к сверхпродукции лизина. В клетках бактерий (и в высших растениях) биосинтез лизина начинается с аспарагиновой кислоты и протекает через диаминопимелиновую кислоту (диаминопимелиновый путь).
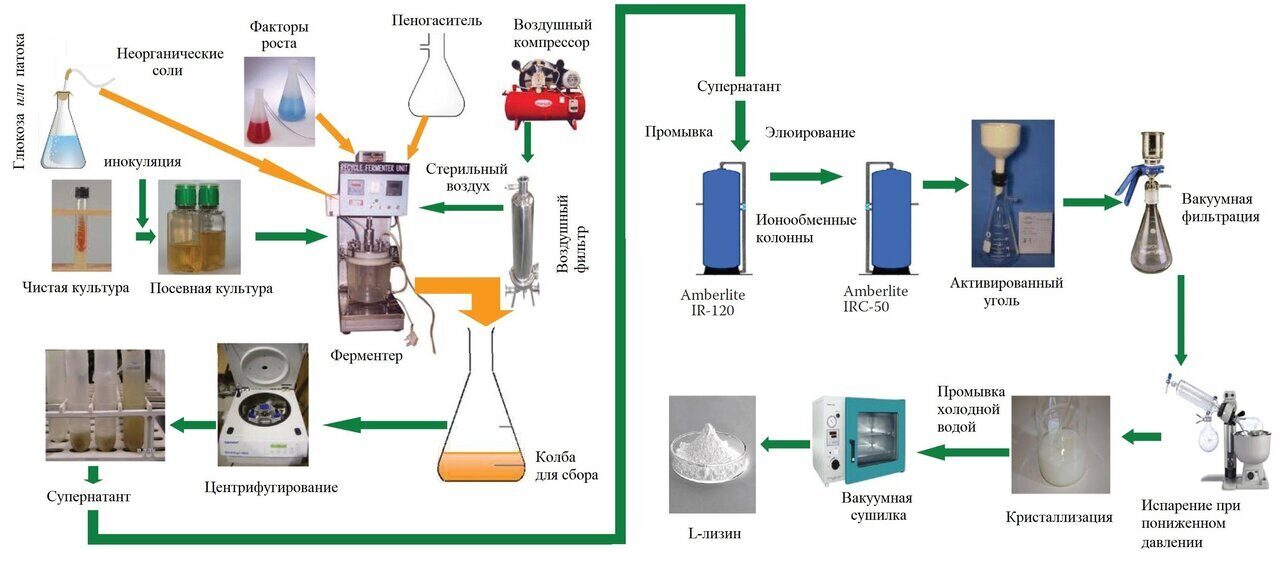
На заметку от редактора: на рис. выше показано лабораторное производство L-лизина (по материалам Zafar A. Mahmood Microbial amino acids production, 2014 г).
Аспарагиновая кислота под действием фермента аспартаткиназы превращается в аспартат-3-полуальдегид. От этого важнейшего промежуточного соединения один путь биосинтетических превращений ведет к синтезу лизина, другой - к синтезу гомосерина. Гомосерин является промежуточным продуктом для синтеза треонина и изолейцина, с одной стороны, и метионина - с другой.
При нарушении биосинтеза гомосерина ход реакций превращения аспарагиновой кислоты сдвигается в сторону образования лизина (например, облучение γ-лучами (60Со) приводит к потере способности синтезировать фермент гомосерин-дегидрогеназу). Регуляция биосинтеза L-лизина у промышленных продуцентов этой аминокислоты осуществляется по первому ферменту - аспартаткиназе. Этот фермент ингибируется только при совместном действии двух метаболитов: лизина и треонина. Указанное обстоятельство обеспечивает получение ауксотрофных мутантов, у которых нет факторов, предотвращающих сверхсинтез L-лизина.
Таким образом, продуцентами L-лизина для его промышленного получения являются ауксотрофные мутанты с нарушенным синтезом гомосериндегидрогеназы, относящиеся к группе коринебактерий и способные образовывать в оптимальных условиях до 70 г/л лизина.
Электронная микрофотография C. glutamicum ATCC 13032
В производственных условиях используют штаммы Corynebacterium glutamicum 95, T-3; Brevibacterium flavum 22L, 531E.
Ауксотрофные мутанты, продуцирующие лизин, дефицитны по гомосерину. Для обеспечения нормального развития микроорганизмов требуется введение в состав ферментационной среды гомосерина. Результаты исследований показали, что гомосерин может быть заменен совместным присутствием в среде двух аминокислот: треонина и метионина. При этом концентрация треонина в среде должна быть строго регламентирована в связи с тем, что, как указывалось выше, треонин совместно с лизином при их определенном соотношении ингибируют аспартаткиназу.
Таким образом, недостаточное количество треонина тормозит рост микроорганизмов, а его избыток снижает продуктивность культуры по лизину. Экспериментальным путем установлено, что концентрация L-треонина в питательной среде для различных мутантов должна находиться в пределах 0,2-0,8 г/л. Метионин также влияет на рост микроорганизмов, но не участвует в процессе регуляции биосинтеза лизина. Оптимальная концентрация его в среде составляет 0,15-0,25 г/л.
На рост и развитие продуцентов лизина оказывают воздействие также и другие аминокислоты, не принимающие прямого участия в процессах, которые протекают при биосинтезе лизина. Для каждого продуцента лизина аминокислотный состав среды уточняется экспериментальным путем. В промышленные среды не добавляются чистые аминокислоты. Их содержание в питательной среде регулируется путем введения богатых аминокислотами отходов различных произ- водств или гидролизатов белоксодержащего сырья: кукурузного экстракта, гидролизатов кормовых дрожжей.
Продуценты лизина являются биотинзависимыми микроорганизмами. Оптимальная концентрация биотина в среде составляет 10-20 мкг/л, что значительно выше концентрации, необходимой для нормального роста и развития микробной клетки (4-5 мкг/л). При низкой концентрации биотина (1-2 мкг/л) уровень продукции лизина снижается в 20-30 раз, и процесс смещается в сторону накопления глутаминовой кислоты (до 30 г/л).
При высокой концентрации в среде биотин обусловливает образование цитоплазматической мембраны, легко проницаемой для основных аминокислот (в частности, лизина) и трудно проницаемой для кислых и нейтральных аминокислот. Это создает благоприятные условия для накопления внеклеточного лизина. Продуценты лизина рода Brevibacterium требуют обязательного присутствия в питательной среде витамина В1 (тиамина). При отсутствии тиамина бактерии плохо развиваются и синтезируют вместо лизина преимущественно α-аланин. В промышленных питательных средах источником биотина и тиамина являются кукурузный экстракт и свекловичная меласса.
Необходимым компонентом питательной среды является источник углерода. Для продуцентов лизина в качестве источников углерода могут быть использованы моно- и дисахариды: глюкоза, сахароза, мальтоза, фруктоза. Практически не усваиваются продуцентами лизина пентозы и лактоза. Максимальный биосинтез лизина достигается на средах с сахарозой. Важное значение имеет концентрация источника углерода в ферментационной среде. С увеличением его концентрации содержание лизина в среде возрастает, но степень потребления источника углерода снижается. Экономически целесообразно проводить ферментацию при концентрации углевода 6-12%. Предпочтительно осуществлять подачу углевода в ферментатор дробно, по мере его потребления микроорганизмами.
В промышленных условиях в качестве источников углеводов используют чаще всего свекловичную мелассу. Выход лизина составляет 25-33% от углеводов мелассы.
Перспективными источниками углерода являются нормальные углеводороды, уксусная кислота, этанол и метанол, этиленгликоль, на которых культивируются специальные виды микроорганизмов. Наибольшее промышленное значение имеет уксусная кислота, которая хорошо ассимилируется применяемыми продуцентами и обеспечивает образование лизина в количестве до 90 г/л. Особенность ацетатных сред состоит в том, что ацетат угнетает биосинтез ферментов ЦТК, и его высокая концентрация в среде снижает лизинобразующую способность микроорганизмов. Максимально допустимая концентрация ацетата в среде не должна превышать 2%. При этом выход лизина составляет 25-27% от потребленного ацетата. При культивировании микроорганизмов-продуцентов лизина осуществляют дробную подачу ацетата в ферментатор. Ацетатная среда требует меньшего количества биотина (до 1 мкг/л).
Для обеспечения нормальной жизнедеятельности продуцентов лизина в составе среды должны присутствовать соединения азота и фосфора. Источником азота могут быть соли аммония или мочевина. Выбор источника азота осуществляется экспериментально для каждого промышленного штамма. Например, для Brevibacterium flavum 22L максимальный выход лизина наблюдается при использовании NH4Cl или (NH4)2SO4 в количестве 1,5-2,0%. Высокий уровень биосинтеза лизина обеспечивает применение полностью ассимилируемого источника азота – мочевины. Для каждой культуры выдерживается определенное соотношение углерод : азот (для Corynebacterium glutamicum 95 С : N = 11 : 1). Недостаток азота приводит к снижению выхода лизина, а избыток его изменяет направление биосинтеза в сторону накопления аланина.
Источником фосфора являются калиевые соли фосфорной кислоты (дигидрофосфат в большей степени, чем гидрофосфат калия). Содержание соединений фосфора в среде строго регламентируется (0,08-0,20%), в связи с чем нельзя использовать фосфорнокислый аммоний в качестве источника азота.
Потребность продуцентов лизина в макро- и микроэлементах (Mg, Fe, Cu, Mn и др.) удовлетворяется за счет таковых, которые содержатся в достаточном количестве в кукурузном экстракте и мелассе. При необходимости (для ацетатных сред) эти элементы вводят в питательную среду, как правило, в виде сульфатов.
Существенное влияние на биосинтез лизина оказывают условия культивирования продуцентов: рН среды, длительность и температура ферментации, степень аэрации среды, возраст и доза посевного материала.
Продуценты лизина относятся к мезофильным микроорганизмам, имеющим оптимальную температуру роста и биосинтеза 28–33°С. Понижение температуры резко увеличивает продолжительность биосинтеза (при практически неизменном выходе), повышение температуры снижает выход лизина и приводит к автолизу культуры.
Оптимальное значение рН среды различается по отдельным стадиям культивирования: 6,8-7,2 для накопления биомассы, 7,6-8,2 для биосинтеза лизина, а также при использовании различных источников углерода и азота. Применяемые в отечественной промышленности продуценты обеспечивают наилучшие результаты по биосинтезу лизина при рН среды 7,0-7,6.
Биосинтез лизина связан с высокой активностью дегидрогеназных ферментов цикла трикарбоновых кислот и глиоксилатного цикла и по этой причине требует интенсивной аэрации среды. Недостаточная аэрация приводит к снижению выхода лизина и усилению образования аланина. Чрезмерно интенсивная аэрация приводит к росту культуры в ущерб выходу лизина. Аэрирующие устройства в ферментаторах должны быть рассчитаны на подачу такого количества воздуха, чтобы величина парциального давления кислорода в период максимального роста культуры (примерно через 16-20 ч) не падала ниже 20-30% от полного насыщения.
Посевной материал обычно используется в возрасте 16-24 ч и имеет титр (2-4) · 109 клеток на 1 мл. Доза посевного материала, как правило, составляет 5-8% от объема засеваемой среды.
Очень важное значение имеет устойчивость культуры к поражению фагами. В производственных условиях целесообразно использовать фагоустойчивые культуры. На территории заводов, производящих лизин, выделено более 50 различных фагов, способных подвергнуть лизису клетки продуцентов лизина. Все выделенные фаги поражают клетки бактерий рода Brevibacterium. Продуценты лизина рода Corynebacterium отличаются фагоустойчивостью, но менее продуктивны по лизину.
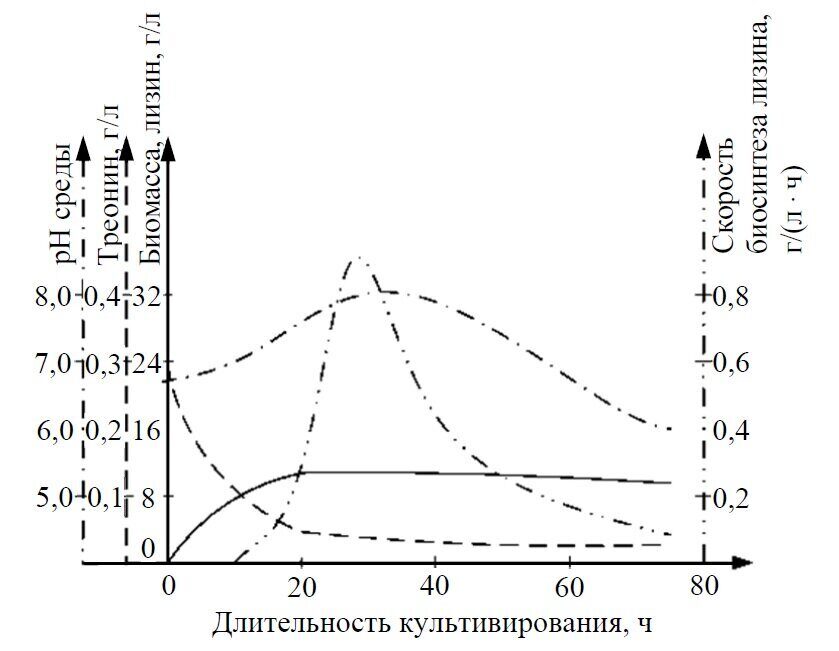
При культивировании продуцентов лизина накопление биомассы и синтез лизина не совпадают по времени (рис. 1.1). Первая стадия - наращивание биомассы продуцента - длится 12-20 ч. В этот период клетки интенсивно потребляют из среды треонин и метионин. Когда содержание треонина в среде становится незначительным, синтез биомассы прекращается и клетки начинают синтезировать лизин. Характерным признаком начала биосинтеза лизина является почти полное потребление из среды треонина.
Рис. 1.1. Динамика развития продуцента и изменения состава питательной среды при культивировании Corynebacterium glutamicum 95
Синтез лизина осуществляется с 12-20 ч от начала процесса культивирования до 60-72 ч. В период накопления биомассы клетки продуцента имеют крупный размер. Со времени начала образования лизина клетки сильно уменьшаются в размерах. Наибольшая скорость биосинтеза лизина наблюдается на 20-30-м часу роста и достигает 0,8-1,0 г/(л · ч).
Вторая стадия ферментации характеризуется уменьшением количества биомассы продуцента за счет частичного автолиза клеток.
При периодическом культивировании продуцента концентрация лизина в культуральной жидкости составляет 40-48 г/л при содержании биомассы 10-15 г/л по сухому веществу. Содержание лизина в культуральной жидкости можно значительно повысить, если по мере истощения среды вводить в ферментатор небольшие порции свежей питательной среды (дробная подпитка). Подпитка активизирует биосинтетическую деятельность продуцентов лизина, и концентрация его в культуральной жидкости может достигать 60 г/л.
На основе культуральной жидкости получают кормовые препараты лизина с различным содержанием целевого компонента: жидкий концентрат лизина - ЖКЛ (7-8% лизина); сухой кормовой концентрат лизина - ККЛ (7-10%); кормовой кристаллический лизин (70-72%); высококонцентрированный кормовой кристаллический лизин (92-95%). Для кормовых целей целесообразнее получать технические препараты ЖКЛ и ККЛ, так как они содержат помимо лизина значительное количество других очень важных для животного организма соединений, в частности витамины: рибофлавин, пантотеновую кислоту, фолиевую кислоту, никотинамид и др.
Технические препараты лизина получают на основе всей суммы веществ, присутствующих в культуральной жидкости, включая био- массу продуцента и твердые нерастворимые частицы среды. Поскольку культуральная жидкость имеет сравнительно низкое содержание сухих веществ (10–14%) и не обладает стабильностью при хранении, необходимо увеличить концентрацию сухих веществ.
Технология производства ЖКЛ основана на упаривании культуральной жидкости в 3–4-корпусной вакуум-выпарной установке со стекающей пленкой до содержания сухих веществ 40-45%. При длительном нагревании имеют место существенные потери лизина, связанные с окислением и конденсацией аминогрупп лизина с редуцирующими веществами (углеводами). Эти процессы приводят к образованию окрашенных продуктов - меланоидинов.
Поэтому исходную культуральную жидкость предварительно стабилизируют 25%-ным раствором бисульфита натрия (0,4% от объема культуральной жидкости), который блокирует альдегидные группы углеводов, и подкисляют соляной кислотой до рН 4,5-5,0. Образующийся при этом монохлоргидрат лизина более устойчив к термическому воздействию. ЖКЛ сохраняет свое качество без изменения в течение 3 мес. Считается, что он обладает большей биологической ценностью, чем сухой ККЛ.
Сухой препарат ККЛ получают высушиванием ЖКЛ (рис. 1.2). Распылительная сушка для этих целей непригодна из-за больших отложений продукта на внутренней поверхности сушилки, его высокой гигроскопичности и слеживаемости. Эти недостатки устраняются введением в упаренную культуральную жидкость наполнителя - пшеничных отрубей в соотношении 1 : 1 по массе. Смесь имеет влажность 30-35% и легко гранулируется. Гранулы высушивают в сушилках кипящего слоя при низких потерях лизина (0,8-1,5%). Продукт негигроскопичен, имеет срок годности 6 мес.
Жидкий концентрат лизина подается в шнек-смеситель с температурой 70–85°С для лучшего насыщения наполнителя. Отруби поступают в смеситель из бункера через дозатор. Продолжительность перемешивания около 2 мин. Из гранулятора смесь продавливается через фильеры в камеру сушилки кипящего слоя. Образующиеся гранулы отрываются от гранулятора потоком горячего воздуха и подсушиваются, что предотвращает их слипание. В кипящем слое гранулы быстро высыхают и пневмотранспортом направляются в бункер. Отработанный воздух очищается в циклоне. Производительность сушилки – 2 т/ч по сухим гранулам.
Сушилки с кипящим слоем обеспечивают удельный влагосъем в 2–3 раза выше, чем распылительные и в 4–5 раз выше в сравнении с ленточными.
Гранулы, содержащие 8–10% влаги, измельчают в дробилке до порошкообразного состояния и затем упаковывают в полиэтиленовые мешки, которые герметизируют и дополнительно упаковывают в крафт-мешки. Полученный таким методом препарат (порошок коричневого цвета) негигроскопичен.
Сухой ККЛ может отправляться потребителю россыпью крытым железнодорожным или автомобильным транспортом.
Данный препарат должен содержать монохлоргидрат лизина в пересчете на сухое вещество не менее 7% при влажности не более 10%.
Рис. 1.2. Схема получения кормового концентрата лизина: 1 – сборник ЖКЛ; 2 – подогреватель; 3 – гранулятор; 4 – сушилка кипящего слоя; 5 – сетки; 6 – основной калорифер; 7 – дополнительный калорифер; 8 – циклон; 9 – бункер-охладитель
Ионообменное выделение лизина (рис. 1.3) осуществляют без предварительного удаления биомассы продуцента из культуральной жидкости с последующей промывкой катионита теплой водой и использованием промывной воды, содержащей клеточную массу, для производства побочного продукта - аминобактерина. Элюируют лизин 3-5%-ным раствором аммиака, элюат упаривают под вакуумом до 40-45% сухих веществ, подкисляют соляной кислотой до рН 4,5-5,0 для перевода лизина в форму монохлоргидрата. Концентрат сушат в распылительной сушилке в мягких условиях. Кормовой кристаллический лизин содержит не менее 70% основного вещества.
Цикл (процесс) ионообменного выделения лизина из культуральной жидкости (КЖ) складывается из следующих операций:
- сорбция лизина на катионите КУ 2-8;
- вытеснение КЖ и промывка катионита;
- десорбция лизина со смолы КУ 2-8 элюентом;
- промывка смолы после десорбции.
С целью сокращения расхода воды и количества стоков предусматривается повторное использование промывных растворов.
Подготовка катионита к работе. Катионит КУ 2-8 – сильнокислотный сульфополистирольный катионит. Термостойкость 120–140°С. Представляет собой сферические зерна от желтого до коричневого цвета размером 0,315–1,250 мм. Эффективный размер зерен – 0,4–0,6 мм.
Исходную смолу выдерживают в 20–25%-ном растворе NaCl в течение суток и в виде водной суспензии подают в ионообменную колонну. После заполнения колонны смолой ее отмывают от мелких фракций подачей водопроводной воды снизу вверх. Для полного удаления пузырьков воздуха из смолы скорость подачи воды изменяют (чередуют) от наименьшей (1 об./об. смолы в час) до предельной (2 об./об. смолы в час). Процесс ведут до полной отмывки мелкой фракции (контролируют унос смолы в пробах промывных вод).
Рис. 1.3. Схема получения кормового кристаллического лизина
После окончания фракционирования смолу обрабатывают 5%-ным раствором HCl с целью удаления мономеров, ионов железа и других примесей. Для этого из колонны сливают воду, снизу подают 5%-ный раствор HCl до верхнего уровня смолы и выдерживают на протяжении 5 ч. После выдержки смолу отмывают от ионов Cl– водопроводной водой. Отмывку заканчивают при рН 4–5. Для перевода смолы в рабочую NH4+-форму в колонну подают сверху вниз 1%-ный раствор аммиака со скоростью 0,5 об./об. смолы в час. Обработку ведут до равенства концентрации аммиака на входе и выходе из колонны. Затем смолу промывают водопроводной водой до рН 8,5 в направлении снизу вверх. Аналогично проводится регенерация смолы, которую выполняют после каждых 120–180 циклов работы. Смолу до замены регенерируют 1–3 раза.
Подкисление КЖ перед ионным обменом. Культуральную жидкость подкисляют в стальном гуммированном аппарате концентрированной серной кислотой до величины рН 1,6–2,0. Серная кислота подается в количестве 20–30 л на 1 м3 КЖ со скоростью не более 15 л/мин. При сильном вспенивании добавление кислоты замедляют.
При рН 1,6–2,0 лизин находится главным образом в виде двухвалентного катиона, что способствует более полной его сорбции на катионите КУ 2-8 в NH+-форме (рис. 1.4).При рН < 9,7 молекула лизина заряжена положительно. В интервале 4 < pH < 7 суммарный заряд молекулы равен +1. При дальнейшем уменьшении рН величина заряда возрастает, достигая +2 при рН ≤ 1.
С увеличением рН раствора выше определенного значения лизин десорбируется с ионообменной смолы (комплекс «ионит-лизин» обратимо диссоциирует вследствие ионизации карбоксильной группы лизина и конкурентной сорбции других катионов).
Сорбция лизина на катионите. В начале процесса сорбции производится извлечение лизина из обедненной КЖ (КЖ с «проскоком» лизина), полученной при извлечении лизина из КЖ в предыдущем цикле. Применяют ионообменные колонны объемом 25 м3, вмещающие 20 м3 смолы с емкостью по лизину 100 кг/м3. Обедненная КЖ (20 м3) подается на колонну снизу вверх со скоростью 1 об./об. смолы в час. Вытесняемый из межгранулярного пространства катионита раствор (0,5 объема смолы, ~10 м3) направляют в сборник промывного раствора. Последующий сток отработанной КЖ поступает в нейтрализатор.
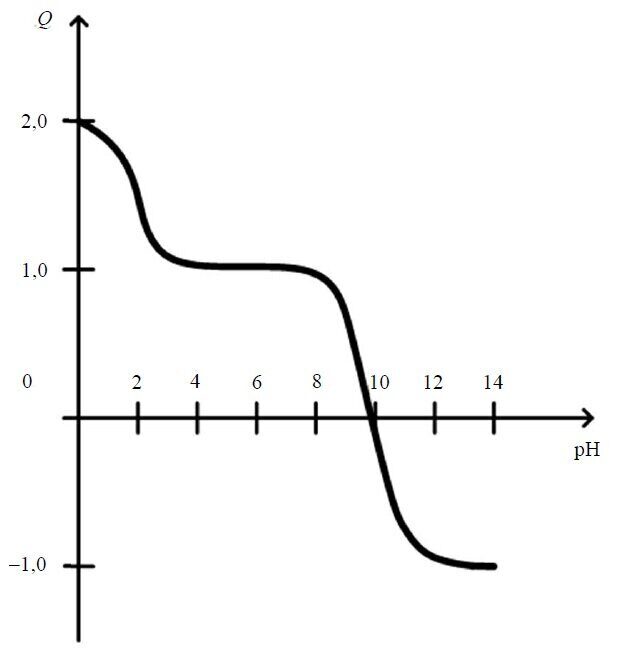
Рис. 1.4. Зависимость величины заряда от значения рН
По окончании подачи КЖ с «проскоком» лизина в колонну подают культуральную жидкость в направлении снизу вверх со скоростью 1 об./об. смолы в час. Выходящая из колонны жидкость с содержанием лизина не более 0,5 г/л направляется на нейтрализацию. При насыщении катионита лизином начинается «проскок» лизина – резкое повышение его концентрации в выходящем из колонны потоке. Жидкость с «проскоком» лизина (10 м3) собирается в сборник обедненной КЖ, откуда подается для исчерпывающей сорбции лизина до концентрации менее 0,5 г/л.
Вытеснение КЖ и промывка катионита. По окончании процесса сорбции КЖ вытесняется из колонны со скоростью 1 об./об. смолы в час промывным раствором (30 м3 на операцию). Начальный сток колонны – вытесненная из межгранулярного пространства КЖ с «проскоком» лизина в количестве 0,5 объема смолы (10 м3) – направляется в сборник с обедненной КЖ. Последующий сток поступает в нейтрализатор.
При сорбции лизина из КЖ, содержащей биомассу, катионит отмывают от биомассы дополнительно конденсатом вакуум-выпарных установок (ВВУ) или горячей (50–55°С) водой в количестве 10 м3 на операцию со скоростью 1 об./об. смолы в час. Сток направляют в нейтрализатор.
Десорбция лизина элюентом. Десорбция производится 3–5%-ным раствором аммиака. Элюент подают в направлении снизу вверх со скоростью 0,4 об./об. смолы в час (8 м3/ч). Общее количество элюента, необходимое для полного извлечения лизина в одном цикле, составляет 2 объема смолы (40 м3).
Первую порцию выходящей из колонны жидкости в количестве 10 м3 направляют в сборник промывного раствора. После этого собирают богатую фракцию элюата (1 объем смолы, 20 м3) с концентрацией лизина 90–100 г/л, которая поступает на упаривание. Последующий сток – бедную фракцию элюата (0,5 объема смолы, 10 м3) – направляют в сборник для приготовления элюента. Последующий сток (10 м3) поступает в сборник промывного раствора.
Упаривание элюата. Перед упариванием из элюата отгоняют аммиак на роторно-пленочном испарителе в следующем режиме: подача элюата – 15–25 м3/ч, температура кипения в аппарате – 45–60°С, давление – 0,08–0,09 МПа.
Пары конденсируются в конденсаторе. Содержащий аммиак конденсат направляется в емкость для приготовления элюента. Элюат после отгонки основного количества аммиака (остаточное содержание аммиака не более 0,5%) поступает на упаривание в ВВУ с ниспадающей пленкой до содержания сухих веществ 45–50%. Конденсат вторичного пара используется для приготовления элюента.
Подкисление упаренного элюата. Упаренный элюат подкисляют до рН 4,0–4,2 концентрированной соляной кислотой (300–400 л 27,5%-ной HCl на 1 м3 упаренного элюата) при перемешивании. Подкисленный упаренный элюат передается на сушку. Аппарат для подкисления элюата покрыт кислотостойкой эмалью.
Сушка упаренного элюата. Подкисленный упаренный элюат сушат в распылительной сушилке при температуре теплоносителя на входе в сушилку 105–110°С, на выходе из сушилки – 80–85°С (температура в топке – 700–720°С).
Перед расфасовкой крупные фракции кристаллического лизина отсеивают на сите и измельчают на дробилке тонкого помола до размера частиц 100–150 мкм.
Нейтрализация стока. Сток ионообменных колонн в смеси с другими технологическими стоками нейтрализуют в нейтрализаторе аммиачной водой до рН 4,0–4,5 и направляют на упаривание с целью получения аминобактерина. При одновременном получении ККЛ и кристаллического лизина возможно упаривание нейтрализованного стока в смеси с КЖ при условии получения ККЛ с содержанием лизина не менее 7%.
Разработана технология ионообменно-экстракционного выделения лизина из культуральной жидкости, предусматривающая использование жидкого катионита – сульфэкса, который представляет собой раствор смеси полинонилнафталин-сульфокислот в алифатических углеводородах (например, в октане). Доминирующим компонентом смеси является динонилнафталин-сульфокислота

Для извлечения аминокислоты культуральную жидкость, освобожденную от биомассы продуцента, смешивают с экстрагентом и выдерживают в смесителе в течение 3–4 мин, затем эмульсию разделяют на органическую и водную фазы в экстракторе-сепараторе. Реэкстракцию аминокислоты из органической фазы осуществляют 15–17%-ным раствором NH4OH с последующим разделением фаз в экстракторе-сепараторе. Применение жидких катионитов для извлечения аминокислот из культуральной жидкости имеет ряд преимуществ:
- малое количество катионита (в 10–20 раз меньше, чем твердого);
- высокая скорость процессов экстракции и реэкстракции (время контакта с жидким катионитом до 10 мин, с твердым – около 12 ч);
- жидкие катиониты менее подвержены «отравлению» и не теряют своей активности на протяжении 200 рабочих циклов.
Высококонцентрированные кристаллические препараты лизина (рис. 1.5) также получают на основе элюата, который после упаривания и подкисления соляной кислотой подвергают кристаллизации при температуре 10–12°С и рН 4,5-5,0. Высушенные кристаллы содержат 92-95% лизина монохлоргидрата.
Для получения высокоочищенного препарата кристаллы растворяют в воде, раствор обрабатывают активированным углем для удаления красящих веществ, упаривают под вакуумом и кристаллизуют лизин из водно-спиртового раствора. Этиловый спирт добавляют к концентрату в соотношении 3 : 1 по объему.
Кристаллы промывают деионизированной водой и сушат под вакуумом при температуре до 60°С. Продукт содержит 97-98% монохлоргидрата лизина. Выход лизина на стадии выделения его из культуральной жидкости составляет 75%.
2. Производство глутаминовой кислоты

Глутаминовая кислота (α-аминоглутаровая кислота) имеет следующую структурную формулу:
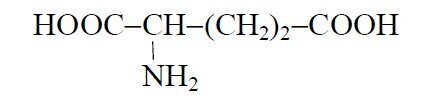
Глутаминовая кислота не является незаменимой, однако она находит широкое применение в различных областях промышленности. В наибольших масштабах глутаминовую кислоту в виде глутамата натрия используют в пищевой промышленности как усилитель вкусовых качеств пищевых продуктов и консервант. Приоритет в производстве этой аминокислоты, бесспорно, принадлежит Японии. Крупнейшим производителем глутамата натрия является фирма «Адзиномото».
Для биосинтеза глутаминовой кислоты используют культуры Corynebacterium glutamicum ВНИИгенетика-490, Corynebacterium glutamicum 541Р, Brevibacterium species 22.
Глутаминовая кислота может образовываться микроорганизмами двумя путями:
– восстановительным аминированием α-кетоглутаровой кислоты с образованием глутаминовой кислоты:
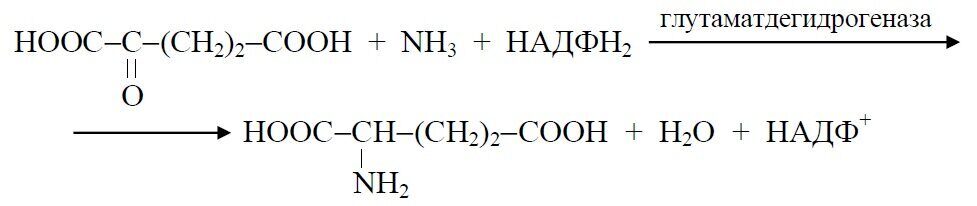
– переаминированием α-кетоглутаровой кислоты с участием свободных аминокислот микробной клетки в присутствии фермента аминотрансаминазы:
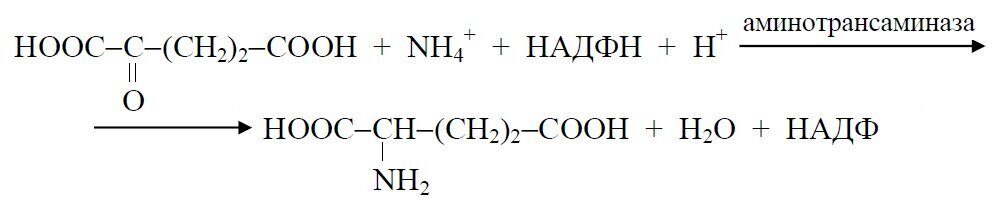
В том и другом случае предшественником глутаминовой кислоты является α-кетоглутаровая кислота, содержание которой пополняется за счет реакций, протекающих в цикле трикарбоновых кислот. Для интенсивного синтеза глутаминовой кислоты необходимо иметь мутантный штамм микроорганизма с нарушенной ферментативной системой превращения α-кетоглутаровой кислоты в янтарную кислоту (нарушено образование α-кетоглутаратдегидрогеназы).
В отличие от биосинтеза лизина концентрация биотина в среде в процессе биосинтеза глутаминовой кислоты не должна превышать 2–5 мкг/л. В противном случае интенсивно накапливаются другие аминокислоты (аланин, аспарагин, лизин, а также янтарная кислота). С увеличением концентрации биотина возрастает синтез биомассы и снижается уровень накопления глутаминовой кислоты. Максимум образования биомассы не совпадает с максимумом биосинтеза глутаминовой кислоты, так как потребность этих процессов в биотине различна. Некоторые антибиотики (пенициллин, тетрациклин) снимают тормозящее действие избытка биотина.
Например, биосинтетическая способность штамма Brevibacterium species 22, применяемого в производстве лизина, может быть переключена с лизина на глутаминовую кислоту путем добавления в обычную кукурузно-мелассную среду небольших количеств пенициллина (2–4 ед./мл среды), который изменяет проницаемость плазмалеммы клетки. Штамм Corynebacterium glutamicum ВНИИгенетика-3144 способен синтезировать глутаминовую кислоту на средах, содержащих до 40 мкг/л биотина, что в 8–10 раз превышает концентрацию биотина для известных продуцентов (1–5 мкг/л).
Основным источником углерода для получения глутаминовой кислоты является сахароза, глюкоза, свекловичная меласса, гидролизат крахмала. В качестве источника азота чаще всего используют мочевину в количестве 1,5–2,0%. В питательную среду также вносят биостимуляторы, например кукурузный экстракт, дрожжевой экстракт. Недостаток азота в среде приводит к снижению концентрации глутаминовой кислоты и накоплению в среде повышенных количеств α-кетоглутаровой кислоты.
При культивировании штамма Corynebacterium glutamicum 541Р используется среда, состав которой приведен в таблице.
Состав питательной среды для культивирования штамма Corynebacterium glutamicum 541Р
|
Компоненты среды
|
Среда для получения посевного материала, %
|
Среда
для ферментации, %
|
|
Сахароза
|
5,0
|
8,5–10,0
|
|
Меласса
|
1,5
|
1,2
|
|
Мочевина
|
1,0
|
0,5
|
|
K2НРО4
|
0,1
|
0,1
|
|
KН2РО4
|
0,1
|
0,1
|
|
ZnSO4
|
–
|
0,1
|
|
MgSO4
|
0,1
|
0,1
|
Температура культивирования продуцентов 28–30°С, величина рН среды 6,8–7,5. Производственное культивирование длится 48 ч при интенсивной аэрации среды (50–60 м3/(м3 · ч)). Уровень накопления глутаминовой кислоты в культуральной жидкости составляет 50–55 г/л.
Получение технической глутаминовой кислоты или глутамата натрия осуществляют по следующей схеме (рис. 1.6).
Для осаждения биомассы продуцента КЖ нагревают глухим паром до температуры 35–40°С, добавляют известковое молоко (15–20% СаО) в количестве 0,75–1,0% от массы КЖ (в пересчете на СаО) и перемешивают 10–12 мин. Вводят концентрированную ортофосфорную кислоту (75%) до величины рН 6,5–7,0 (~1 л на 100 л суспензии). Реакция сопровождается выделением тепла и разогревом жидкости. Жидкость нагревают до 60–65°С, перемешивают и подают на фильтрование. Гидроокись кальция вызывает коагуляцию микробных клеток и белковых веществ, содержащихся в КЖ. Ортофосфорная кислота нейтрализует Са(ОН)2 с образованием малорастворимых фосфатов кальция в виде поверхностно-активного геля, который адсорбирует высокомолекулярные органические соединения, пигменты и одновременно увлекает в осадок микробные клетки. Осадок отделяют фильтрованием и используют как кормовой препарат. Количество влажного осадка – 200–300 кг/м3 КЖ.
Фильтрат подкисляют до величины рН 4,5–5,0 для эффективного удаления окрашенных соединений сорбцией на ионите ИА-1. На 1 объем сорбента подают не более 5 объемов осветляемого раствора. Регенерацию ионита проводят щелочью, затем промывают водой. Осветленный раствор упаривают в вакуум-выпарных аппаратах при температуре 60–70°С до содержания сухих веществ 45–50%. Упаренный раствор охлаждают до 50°С, подкисляют соляной кислотой до рН 4,0–4,5 с одновременным внесением затравки в виде кристаллов глутаминовой кислоты в количестве 0,5–1,0% от массы аминокислоты в растворе.
Затем раствор подкисляют до рН 3,2–3,5 (изоэлектрическая точка), охлаждают до температуры 5–10°С и кристаллизуют в течение 30–48 ч при периодическом перемешивании.
Рис. 1.6. Схема переработки культуральной жидкости с получением технической глутаминовой кислоты и глутамата натрияКристаллизацию заканчивают при снижении концентрации глутаминовой кислоты в маточном растворе до 20 г/л. На этой стадии можно отделить кристаллы центрифугированием, высушить и получить техническую глутаминовую кислоту.
Для получения глутамата натрия производят перекристаллизацию глутаминовой кислоты с обработкой активированным углем (1% от массы фильтруемого раствора), затем нейтрализуют аминокислоту 30%-ным раствором NаОН до величины рН 5,8–6,0, поскольку последующая очистка раствора активированным углем наиболее эффективно протекает при данном значении рН. После очистки раствор окончательно нейтрализуют до величины рН 6,8–7,0. Кристаллизацию глутамата натрия проводят при температуре 5–10°С и в течение 40–48 ч, кристаллы отделяют центрифугированием и высушивают в барабанной сушилке.
Конечный продукт представляет собой моногидрат глутамата натрия в виде белого порошка без запаха. Вкус аналогичен вкусу куриного бульона. Содержание основного вещества – не менее 99%, содержание влаги – не более 0,5%.
3. Технология триптофана

Триптофан является незаменимой аминокислотой. Среди других аминокислот триптофан отличается многообразием производных, широко используемых для производства фармакологических средств (лекарственные препараты для лечения ожирения, заболеваний печени, восстановления функций мозга, регулирования кровяного давления, лечения алкоголизма и др.). Эффективно применение триптофана для обогащения низкокалорийной пищи и создания специализированного питания для космонавтов. В небольших количествах триптофан используется в животноводстве. Повышению уровня применения триптофана в качестве пищевых и кормовых добавок препятствует его высокая цена. В то же время потребность в триптофане непрерывно возрастает.
В мировой производственной практике триптофан получают микробиологическим и химическим способами. Химический метод производства позволяет получать рацемическую форму аминокислоты из акрилонитрила (в Японии производится около 80 т триптофана в год этим способом). Однако разделение оптических изомеров дорогостоящая и трудоемкая операция. Микробиологический синтез позволяет получать L-форму аминокислоты, легкоусвояемую организмом человека и животных.
Путем микробного синтеза триптофан можно получить двумя способами. По первому методу осуществляют синтез триптофана с помощью мутантных штаммов бактерий, дефицитных по фенилаланину и тирозину. Для синтеза используются бактериальные штаммы, относящиеся к виду Bacillus subtilis, имеющие нарушения в цепи синтеза фенилаланина и тирозина.
Второй путь микробного синтеза триптофана – трансформация предшественника аминокислоты с помощью ферментных систем микроорганизмов до триптофана. В качестве предшественника используется антраниловая кислота. Особые штаммы дрожжей Candida utilis трансформируют антраниловую кислоту в индол-3-глицерофосфат, а затем с участием серина в присутствии фермента триптофансинтазы образуется триптофан:
В отечественной практике отработана технология биотрансфор- мации антраниловой кислоты в L-триптофан с помощью ферментных систем дрожжей Candida utilis 295-t.
Для получения посевного материала дрожжи Candida utilis выращивают на питательной среде следующего состава (г/л): меласса – 100; мочевина – 5; K2HPO4 – 0,1; MgSO4 – 0,05; CaCl2 – 0,1. Величина рН среды 7,0–7,5, температура культивирования 28–30°С.
Производственная питательная среда отличается от посевной тем, что содержание мелассы составляет 60 г/л. Ферментацию осуществляют в асептических условиях.
Процесс производственной ферментации можно разделить на два периода: накопление биомассы дрожжей и трансформация предшественника ферментными системами дрожжей в триптофан. Продолжительность периода накопления биомассы дрожжей составляет 24 ч при интенсивной аэрации (не менее 7 г О2/(л · ч)). Во втором периоде ферментации в КЖ небольшими порциями добавляют 5%-ный спиртовой раствор антраниловой кислоты и 50%-ный раствор мочевины. Антраниловую кислоту и мочевину вносят через каждые 6 ч. Через 3–4 ч после добавления антраниловой кислоты и мочевины с периодичностью в 12 ч дополнительно вводят мелассу в виде 25%-ного стерильного раствора. Дробное внесение антраниловой кислоты связано с тем, что она токсична и содержание ее в среде не должно превышать уровня 0,5–0,7 г/л. В качестве предшественника можно использовать и другие соединения (например, индол), однако наибольший выход триптофана наблюдается при применении антраниловой кислоты (до 98,8%).
Во втором периоде ферментации уровень аэрации снижается по сравнению с первым вдвое – до 3–4 г О2/(л · ч). Длительность второго периода около 120 ч. Общая продолжительность процесса около 144 ч. Культуральная жидкость в конце ферментации содержит 7–12% сухих веществ, в том числе 0,3–0,6% триптофана (обычно 6 г/л).
Триптофан на 85–88% находится в жидкой фазе (КЖ). Для получения очищенного препарата триптофана используют фильтрат КЖ, для кормовых целей получают кормовой концентрат, в который входит и биомасса продуцента.
С целью получения кормового концентрата триптофана культуральную жидкость упаривают под вакуумом в 3 раза и полученный концентрат высушивают в распылительной сушилке при температуре входящего теплоносителя 110–120°С. Готовый продукт представляет собой порошок светло-коричневого цвета, имеющий следующий состав (%): сухое вещество – 90; белковые вещества – 48–54; триптофан – 1–3; аминокислоты – 6 (в том числе лизин 3,22% от общей суммы аминокислот), витамины группы В.
Очищенные препараты триптофана получают непосредственно из КЖ или из фильтрата КЖ ионообменным выделением.
Для этой цели используют двухколонный ионообменный аппарат: первая колонна заполнена анионитом ИА-1, а вторая – катионитом КУ 2-8. Цикл ионообменного выделения триптофана из КЖ включает следующие операции: сорбция триптофана на смоле ИА-1; промывка смолы водой; элюирование триптофана с анионита ИА-1 с одновременной сорбцией его на катионите КУ 2-8; элюирование триптофана с катионита; регенерация катионита КУ 2-8; регенерация анионита ИА-1.
КЖ в смеси со стоком от промывки ферментатора (5% от КЖ) подают на колонну со смолой ИА-1 снизу вверх со скоростью 1 об./об. смолы в час. Первая порция стоков (0,5 объема смолы) поступает в сборник промывной воды. Остальные стоки (отработанная КЖ) направляются на получение кормового белоксодержащего пре- парата (содержание триптофана менее 0,2 г/л). По окончании подачи КЖ на колонну поступает (при тех же условиях) упаренный маточный раствор. На этой стадии отделяется биомасса продуцента, компоненты среды, кислые продукты метаболизма (окрашенные соединения сорбируются на смоле). Для вытеснения остатков КЖ из смолы производят кратковременную промывку анионита водой в количестве 0,5 объема смолы со скоростью 1 об./об. смолы в час в направлении снизу вверх.
Элюирование триптофана с анионита ИА-1 осуществляют водой. Для этого к выходу колонны со смолой ИА-1 подсоединяют колонну с катионитом КУ 2-8 и через двухколонный аппарат пропускают воду в количестве 5 объемов смолы со скоростью 2 об./об. смолы в час. При этом триптофан, элюированный со смолы ИА-1, сорбируется на катионите КУ 2-8. Сток сливается в канализацию. Для полного элюирования триптофана производят циркуляцию воды, находящейся в системе, в течение суток. Затем колонны разъединяют и осуществляют элюирование триптофана со смолы КУ 2-8 и регенерацию анионита ИА-1. Элюентом является 1,6%-ный раствор NH4OH в 50%-ном растворе этанола. Количество элюента – 3 объема катионита. Для приготовления элюента используют бедную фракцию элюата с предыдущего цикла и водно-спиртовой конденсат со стадии упаривания маточного раствора. Элюент подают в колонну сверху вниз со скоростью 1,5 об./об. смолы в час. Первый сток (1 объем смолы) – бедная фракция элюата. Богатая фракция (1,5 объема смолы) содержит 5–60 г/л триптофана. Последний сток (0,5 объема смолы) – бедная фракция, которая используется для приготовления элюента.
По окончании элюирования катионит регенерируют 0,5 н. раство- ром НСl (4 объема смолы), подаваемым в колонну снизу вверх со скоростью 1 об./об. смолы в час. Катионит переводится в Н+-форму, сток направляется в канализацию.
Для регенерации анионита ИА-1 в колонну снизу вверх подают 3%-ный раствор NH4OH (3 объема смолы со скоростью 1 об./об. смолы в час) и затем промывают водой (до 10 объемов смолы). Анионит переводится в ОНˉ-форму. Замену катионита и анионита в колоннах производят через 180–200 циклов работы колонн.
Богатую фракцию элюата нейтрализуют уксусной кислотой до рН 6,5–7,0, охлаждают до температуры 0–5°С и выдерживают в течение 24 ч. Триптофан кристаллизуется в количестве до 80% от содержания в элюате. Кристаллы отделяют центрифугированием (влажность кристаллов до 70%) и затем высушивают в барабанной сушилке очищенным на фильтрах грубой и тонкой очистки воздухом, имеющим температуру 90–95°С (температура отработанного воздуха 60–65°С). Высушиваемый материал не должен прогреваться до температуры более 40°С. Сухой продукт упаковывают в двойные полиэтиленовые пакеты (1–2 кг), которые помещают затем в бумажные или картонные мешки. Влажность продукта не более 5%. Содержание триптофана в конечном продукте не менее 90%.
Потери триптофана составляют: при сорбции на анионите ИА-1 – 3%; на стадии элюирования с анионита ИА-1 – 12%; при сорбции на катионите КУ 2-8 – 4%; на стадии элюирования с катионита КУ 2-8 – 3,5%; потери при сушке – 4%. Общий выход продукта 70%.
Сорбционная емкость по триптофану анионита ИА-1 и катионита КУ 2-8 составляет соответственно 64 и 60 кг/м3 влажной смолы.
Доп. информация:
Микробная биотехнология (начальная страница)
Промышленный биосинтез аминокислот (раннее).
- Ссылки от редактора →
- Технология микробного синтеза
- Основы Биотехнологии + (промышленная микробиология, энзимология, генная и клеточная инженерия)
- Методы выделения и очистки продуктов биотехнологических производств.
- Базовые представления о биотехнологии пробиотических добавок
Источник: Промышленная биотехнология : электронный курс лекций для студентов специальности 1-48 02 01 «Биотехнология» / Н. С. Ручай, О. В. Остроух. – Минск : БГТУ, 2013. – 109 с.