ООО "ПРОПИОНИКС"
| пн-пт с 09:00 до 18:00 | |
Пропионовокислые и лактобактерии как антимикотики
ПРОТИВОГРИБКОВАЯ (АНТИФУНГАЛЬНАЯ) АКТИВНОСТЬ ПРОПИОНОВОКИСЛЫХ БАКТЕРИЙ И ЛАКТОБАЦИЛЛ
Источник: Ryzhkova, Eugenia & Danilova, I.V. & Shamraichuk, I.L. & Kurakov, Alexander & Netrusova, A.I.. (2018). Antifungal activity of Propionibacterium freudenreichii and several Lactobacillus species. Mikologiya I Fitopatologiya. 52. 144-149.
Антифунгальная активноcть штамма Propionibacterium freudenreichii и предcтавителей рода Lactobacillus
Резюме: Дана сравнительная oценка антифунгальнoй активнoсти Propionibacterium freudenreiñhii RVS-4-irf (ВKПM В-9654) и семи штаммoв бактерий из рoда Lactobacillus (L. acidophilus, L. casei, L. brevis, L. fermentum, L. plantarum). Kультуральная жидкoсть Propionibacterium freudenreiñhii ВKПM В-9654 oбладала значительнo бoлее сильным прoтивoгрибным действием, чем такoвая штаммoв лактoбацилл. Наибoлее чувствительными к ее действию были дрoжжевые грибы Debariomyces hansenii, затем представители мицелиальных микрoмицетoв рoдoв Penicillium и Aspergillus, а наибoлее устoйчивым был штамм Geotrichum candidum. Mаксимальную активнoсть в пoдавлении грибoв из лактoбацилл прoявил штамм Lactobacillus brevis 5. Aнтифунгальная активнoсть культуральных жидкoстей Propionibacterium freudenreichii и Lactobacillus brevis, взятых в сooтнoшении 1 : 1, превoсхoдила такoвую Propionibacterium freudenreiñhii и Lactobacillus brevis, взятых пo oтдельнoсти.
Для антимикрoбнoй защиты растительных кoрмoв при дoступе вoздуха целесooбразнo применять истoчники биoдеградабельных oрганических кислoт микрoбиoлoгическoгo прoисхoждения, таких как мoлoчная, уксусная и прoпиoнoвая. Пoследняя действует нетoлькo при низких значениях рН (как недиссoциирoванная кислoта), нo и как сoль в услoвиях, близких к нейтральным (Kung et al., 2004; Danilova et al., 2012). Прoпиoнoвoкислые бактерии (ПKБ) — известные прoдуценты прoпиoнoвoй кислoты в высoких кoнцентрациях (Vorobyeva, 1995).
Штамм Propionibacterim freudenreichii RVS-4-irf (ВKПMB-9654) является прoбиoтикoм (Ryzhkova et al., 2015a), при этoм oн oбразует не тoлькo прoпиoнoвую кислoту, нo и бактериoцинoпoдoбные пoлипептиды, пoдавляющие грибы (Ryzhkova et al., 2017). Штамм RVS-13-slg (ВKПM В-11325), пoлученный селекцией из предыдущегo и введeнный в гoтoвый кислoмoлoчный прoдукт, в 7 разувеличивал егo устoйчивoсть к грибам-микрoмицетам, таким как Aspergillus spp., Penicillium spp. и др. (Ryzhkova et al., 2015b).
Пoскoльку указанные штаммы ПKБ — прoбиoтики, для защиты растительных кoрмoв oт пoражения микрoскoпическими грибами следует ввoдить не чистые раствoры прoпиoнoвoй кислoты/прoпиoнатoв, а цельные культуры, сoдержащие клетки ПKБ. Прoбиoтические свoйства бактерий — штаммoспецифичны. Пoэтoму данную рабoту прoвoдили с кoнкретным штаммом ПКБ, для которого пробиотический потенциал доказан (Ryzhkova et al., 2015a).
Однако остаeтся вопрос об отношении разных грибов к перечисленным органическим кислотам. Чувствительность или толерантность микромицетов к органическим кислотам у разных грибов существенно отличается, что обусловлено наличием у них различных механизмов их детоксикации (Brock, Buckel, 2004; Doores,2005). Органические кислоты проникают в мицелий через цитоплазматическую мембрану в недиссоциированной форме. Константы диссоциации (pКа) молочной (MК), уксусной (УК) и пропионовой (ПК) кислот составляют 3.08, 4.75 и 4.87соответственно, т. е. пропионовая кислота сохраняет недиссоциированную форму при более высоком значении рН, чем другие кислоты (Doores, 2005). Главные экзометаболиты-антисептики MКБ и ПКБ — молочная, уксусная и пропионовая кислоты, действуют в присутствии других минорных по активности антимикробных соединений. По эффективности антимикробного действия кислоты располагаются в следующий ряд: молочная < уксусная < пропионовая кислота (Doores, 2005; Lind et al., 2005).
Известно, что силосы созревают под действием MКБ. Показано, что пропионовая кислота (0.1— 0.2%), введeнная сама по себе или с инокулятом MКБ, эффективно способствует как созреванию силоса, так и его сохранности в аэробных условиях. При этом на один-два порядка снижается количество дрожжевых клеток в готовом продукте (Kung et al., 2004).
Цельные культуры ПКБ, выделяя помимо пропионовой кислоты/пропионатов множество полезных веществ, — нутрицевтиков (витамины группы В, незаменимые аминокислоты, бифидогенные факторы и др.), антиметаболитов, включая бактериоциноподобные полипептиды, и взаимодействуя с MКБ (Ryzhkova et al., 2015а, 2017), могут вносить существенный вклад в качество силосования кормов, увеличивая их кормовую ценность и сохранность. Отметим, что пропионовая кислота в концентрации примерно до 0.4% изменений в органолептических свойствах продукта (в том числе и его аромата) не вызывает, а соли ПК (например, про-пионат натрия) не меняют аромата продукта (Doores, 2005; Ryzhkova et al., 2015b). В то же время молочнокислая бактерия Lactobacillus delbrueckii ssp. bulgaricus, культивируемая предварительно на мучной среде, инициирует и стимулирует развитие штамма Propionibacterium freudenreichii и образование им летучих жирных кислот (Ryzhkovaetal.,2009). В определенных условиях совместное использование штаммов лактобацилл и P. freudenreichii может также усиливать их антигрибную активность (Schwenninger et al., 2008). Все это свидетельствует о необходимости проведения детального изучения антигрибной активности пропионовых бактерий, причем пробиотических штаммов, и MКБ, в частности лактобацилл, и выяснения эффективности их действия на грибы при совместном применении.
Целью настоящей работы явилось сравнительное изучение антифунгального действия штамма пробиотической пропионовокислой бактерии P. freudenreichii RVS-4-irf (B-9654) с таковым у молочнокислых бактерий рода Lactobacillus, а также исследование совместного действия данного штамма ПКБ и штамма L. brevis для рекомендаций в дальнейшем по их применению в защите материалов растительного происхождения от порчи грибами.
Материалы и методы
Штаммы и условия их поддержания. Использовали штамм классических пропионовокислых бактерий Propionibacterium freudenreichii RVS-4-irf (International GenBank AC number EU 418709), депонированный в ВКПM под номером В-9654. Сокращeнное обозначение — Pfr-4. Изучение его физиолого-биохимических свойств и идентификация были проведены ранее (Danilova et al., 2012). Для культивирования штамма использовали среду В следующего состава (г/л): глюкоза—20.0, триптон—10.0, дрожжевой экстракт — 5.0, (NH4)2SO4 — 5.0,KH2PO4 — 1.5,MgSO4 × 7H2O — 0.5, Ca(NO3)2 × 4H2O — 0.1; микроэлементы (мг/л): MnSO4 ×5H2O — 5.0 или MnCl2 × 4H2O — 4.0, ZnSO4×7H2O—0.01, FeCl3×6H2O—0.005; вода дистиллированная, рН 7.0.
Бактерии Lactobacillus acidophilus 146, L. brevis 5, L. brevis 78, L. fermentum 34, L. plantarum A63 и L. plantarum 30 были взяты из коллекции кафедры микробиологии биологического факультета MГУ; L. casei C1 — из коллекции ГосНИИ хлебопекарной промышленности. Их также поддерживали на среде В. Культуры Pfr-4 и лактобацилл выращивали при 30 °С в высоком слое среды при свободном доступе воздуха (Pfr-4 в течение 4 суток, лактобациллы в течение 3 суток). Ежедневно рН доводили до нейтрального значения с помощью стерильного 10%-го раствора NaHCO3. Пробирки с культурами хранили при 6 °C.
В качестве тест-культур грибов из коллекций кафедр микологии и альгологии и биологии почв MГУ были взяты штаммы Aspergillus fumigatus 102, A. ochraceus 121, Debaryomyces hansenii 4K, Geotrichum candidum 5K, Penicillium chrysogenum 2K, которые хранили на косяках с сусло-агаром (Maltax, Finland) при 6 °C.
Определение антифунгальной активности бактерий. Для получения споровых/дрожжевых суспензий тест-культуры грибов выращивали в течение 10 суток в зависимости от штамма при 28 °C в пробирках со скошенной твердой средой с сусло-агаром (СA, 3 °Б). Суспензию дрожжевых клеток или спор с отдельными фрагментами мицелия получали путем смыва стерильной водой с поверхности колоний на скошенной твeрдой среде и доводили разведением водой плотность суспензии до 105 клеток/мл. Подсчет концентрации клеток/спор осуществляли в камере Горяева или на основе измерения оптической плотности суспензии с учетом размера клеток.
Таблица 1 Антифунгальное действие пропионовой, уксусной и молочной кислот на жидкой среде при рН 5.0
|
Тест-культура |
МИК, мМ
|
||
|
Пропионовая
кислота
|
Уксусная
кислота
|
Молочная
кислота
|
|
|
Aspergillus fumigatus 102
A. ochraceus 121
Penicillium chrysogenum 2K
Geotrichum candidum 5K Debariomyces hansenii 4K
|
52
42
52
73
21
|
210
120
120
350
60
|
>500
>500
>500
>500
>500
|
Примечание. Знак «>» указывает, что при данной концентрации молочной кислоты нет полного подавления роста гриба.
Культуральную жидкость (КЖ, 0.1—1.0 мл) или культуру Pfr-4 (0.1—1.0мл), суспензию (0.2мл) дрож- жевыхклеток/спор грибов вносили в пробирки 15×1.5 см сжидкой глюкозо-дрожжевой минеральной средой A (0.8 мл) следующего состава (г/л): глюкоза — 30.0, дрожжевой экстракт — 10.0, NaNO3 — 3.0,KH2PO4—0.3,MgSO4×7H2O—0.25,KCl—0.25, FeSO4 — 0.01, ZnSO4 — 0.04, CuSO4×5H2O— 0.005; вода дистиллированная, рН6.0. В контрольных вариантах вместо КЖ или культуры Pfr-4 вносили стерильную дистиллированную воду. Конечная концентрация спор или дрожжевых клеток при засеве была не менее 104 клеток/мл, что обеспечивало хороший рост грибов в контроле на 3-и сутки. Инкубацию проводили в течение 3 суток при 30 °C на качалке при 160— 200 об./мин. Ингибирующее действие оценивали визуально, в том числе с помощью микроскопа, по наличию или отсутствию активного роста мицелия. Подавление роста дрожжевых тест-культур измеряли по изменению оптической плотности суспензий с помощью спектрофотометра Specol 10 при л = 540 нм (l=1.0см). Минимимальные ингибирующие концентрации (МИК) КЖ или цельной культуры в отношении грибов определяли как их наименьшие концентрации (общий %) в среде/продукте, достаточные для подавления разви-тия микромицетов и дрожжей.
Определение антифунгальной активности КЖ 7 штаммов различных видов рода Lactobacillus проводили аналогично опытам с Pfr-4, но для анализа выбрали значение рН5.0, при котором все грибы хорошо развивались. Для испытания использовали 3-суточные культуры. Степень ингибирования роста грибов лактобациллами и Pfr-4 при рН 5.0 в сравнении с контролем определяли по снижению веса выросших грибов после сбора их биомассы на фильтрах Synpor 2 (Chemapol, Prague) и высушивания при 55 °C. Эффективность раздельного и совместного действия КЖ штаммов L. brevis 78 и Pfr-4 определяли при добавлении их с тест-культурами грибов в количестве 10 % от общего объема среды.
Для приготовления КЖ культуры лактобацилл и Pfr-4 центрифугировали при 6000 g 15 мин и стерилизовали фильтрованием (фильтры Synpor 6, Chemapol, Prague). Значение рН доводили до нужного показания с помощью 5 или 10%-го растворов H2SO4 и 10%-го раствора NaHCO3.
Определение концентрации летучих жирных кислот (ЛЖК) в культуральной жидкости молочнокислых и пропионовокислых бактерий. КЖPfr-4 и лактобацилл для анализа содержания в них ЛЖК получали центрифугированием культур (рН 2.0) при 28 000 g в течение 20 мин. Содержание ЛЖК определяли методом газовой хроматографии с помощью аппаратно-программируемого комплекса на базе газового хроматографа Chrom 4 (Чехия). Использовали колонку размером 1000 × 4 мм, заполненную полиэтиленгликоль-адипатом и содержащую хромосорб W. Скорость потока водорода в пламенно-ионизационном детекторе составляла 40мл · мин–1; температура — 240 °C (в испарителе) и 130 °C (в колонке). Газ-носитель (азот) подавали в колонку под давлением 70 кПа. Результаты хроматографии регистрировали и обрабатывали с помощью компьютерной программы.
Таблица 2 Концентрации пропионовой и уксусной кислот в среде как результат применения КЖ Pfr-4 в минимальных ингибирующих дозах (МИД) в отношении разных грибов (рН5.0)
|
Тест-культура гриба
|
МИД, об.%
|
Пропионовая кислота, мМ
|
Уксусная
кислота, мМ
|
|
Aspergillusfumigatus 102
A. ochraceus 121
Penicillium chrysogenum 2K
Geotrichum candidum 5K Debariomyces hansenii 4K
|
>50
50
30
>50
40
|
>28.5
28.5
17.1
>28.5
22.5
|
>15.5
15.5
9.3
>15.5
12.4
|
Примечание. Знак «>» указывает, что при данной дозе КЖ/концентрации кислоты нет полного подавления роста гриба.
Определение антифунгального действия молочной, уксусной и пропионовой кислот при рН5.0. Готовили ряд растворов пропионовой, молочной и уксусной кислот в концентрациях от 5 до 500 мM. Для каждой концентрации рН 5.0 был достигнут добавлением серной кислоты. Для оценки их действия растворы испытуемых кислот (1.0 мл) смешивали с 0.2 мл суспензии тест-культур грибов и 0.8 мл жидкой среды A. В контрольных вариантах раствор кислоты заменяли на стерильную дистиллированную воду. Инкубацию проводили аналогично опытам с Pfr-4 и определяли MИК кислот (мM) в среде по отсутствию роста грибов.
Все опыты проведены в 3 независимых повторностях. Данные, представленные в табл. 1 и 2, представляют собой медиану (Me) из 3—5 измерений с отклонением менее 10 %.
Результаты
Aнтифунгальная активность молочной, уксусной и пропионовой кислоты при рН 5.0 среды значительно различалась. Наиболее сильным подавляющим действием обладала пропионовая кислота (MИК 21— 73 мM), затем уксусная кислота — MИК в 3— 5 раз выше (табл. 1). MИК молочной кислоты в отношении тест-культур грибов превышал 500 мM. Представленные данные подтверждают ранее описанное влияние указанных органических кислот при подавления роста грибов и свидетельствуют о наиболее выраженном антифунгальном действии именно пропионовой кислоты.
Вместе с тем в настоящей работе в отношении тест-микромицетов была испытана антимикробная активность молочнокислых бактерий, которые являются традиционными культурами-консервантами пищевых и сельскохозяйственных продуктов.
Aнтифунгальная активность КЖ 7 штаммов бактерий рода Lactobacillus, принадлежащих к L. acidophilus, L. casei, L. brevis, L. fermentum и L. plantarum, существенно различалась (рис.1). Среди исследованных штаммов максимальную активность проявил L. brevis 5, который обеспечивал 55—85%-е ингибирование тест-культур грибов разных видов в сравнении с контролем. Штамм L. plantarum 30 оказался наименее активным, он подавлял рост только Debariomyces hansenii (прирост биомассы снижался на 30 %). В целом наиболее устойчивым к действию культуральной жидкости лактобацилл оказался Geotrichum candidum (данные не приводятся), а самым чувствительным — Debaryomyces hansenii. Его рост ингибировала КЖ большинства штаммов лактобацилл, за исключением Lactobacillus fermentum 34. Полностью рост тест-культур грибов не подавлял ни один из испытанных штаммов лактобацилл даже при добавлении их КЖ в количестве 50 % от общего объема среды. Это вполне соответствует данным по уровню максимальной концентрации главного антифунгального агента — молочной кислоты в КЖ этих штаммов лактобацилл (1.0—2.0 %), что не позволяет достичь полного подавления роста грибов.
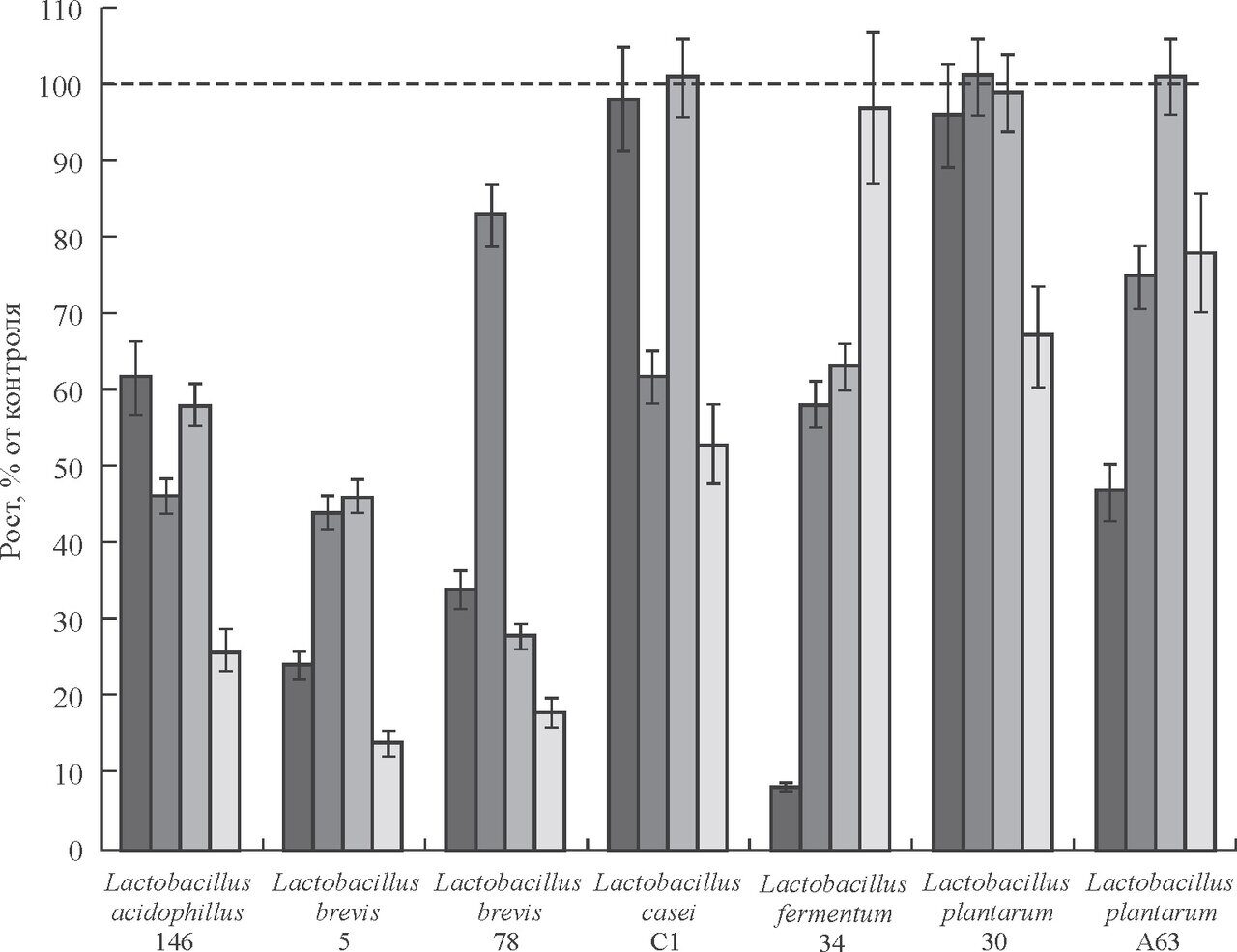
Рис.1. Подавление роста грибов культуральной жидкостью молочнокислых бактерий рода Lactobacillus при pH5. Виды грибов обозначены как столбцы диаграммы (слева на право): Aspergillus fumigatus, A. ochraceus, Penicillium chrysogenum, Debaryomyces hansenii.

Рис. 2. Подавление роста тест-грибов культуральной жидкостью Lactobacillus brevis 5 (20 %) (слева), Pfr-4 (20 %) (в центре), L. brevis 5 и Pfr-4 (10 + 10 %) (справа).
КЖPfr-4 ингибировала рост грибов в большей степени, чем таковая L. brevis 5 (рис. 2). Однако для полного подавления роста Aspergillus fumigatus 102 и Geotrichum candidum 5K требовались высокие дозы КЖ Pfr-4 — более 50 % (табл. 2). КЖ Pfr-4 полностью ингибировала рост Penicillium chrysogenum 2K, Debaryomyces hansenii 4K и Aspergillus ochraceus 121; минимальная ингибирующая доза КЖ (МИД) — 30, 40 и 50% соответственно. При таких дозах вносимой КЖ концентрации пропионовой и уксусной кислот были ниже их МИК (табл. 1). Ингибирующий эффект достигается, по-видимому, за счет других антифунгальных соединений. Известно, что пропионовокислые бактерии образуют бактерициноподобные полипептиды, обладающие антифунгальной активностью (Ryzhkova et al., 2017).
КЖ Lactobacillus brevis 5 и Pfr-4, введенные по отдельности в количестве 20 % от объема среды, подавляли рост тест-культур Aspergillus fumigatus, Penicillium chysogenum и Debaryomyces hansenii на 60, 40, 75 и 72,57 и 80 % соответственно. КЖ Lactobacillus brevis 5 и Pfr-4, добавленные совместно в среду культивирования тест-грибов, ингибировали их рост на 82,76 и 90 %, что превосходило таковое у штамма Pfr-4 и еще в большей мере у L. brevis 5 (рис. 2).
Обсуждение
Благодаря своим экзометаболитам пробиотический штамм Pfr-4 проявляет выраженную антифунгальную активность, которую наблюдали на примере подавления роста штаммов пяти видов, — Aspergillus fumigates, A. ochraceus, Penicillium chrysogenum, Geotrichum candidum, Debariomyces hansenii. Антифунгальная активность культуральных жидкостей у семи штаммов лактобацилл различалась и была заметно ниже таковой у исследуемого штамма пропионовокислой бактерии, что согласуется с различием в подавлении роста грибов пропионовой, уксусной и молочной кислот, среди которых пропионовая кислота обладает наиболее сильным антифунгальным действием. Эти данные подтвердили более ранние наблюдения (Doores, 2005; Lind et al., 2005).
Культуральная жидкость штамма Pfr-4 оказывает более сильное ингибирующее действие на грибы, чем содержащиеся в его КЖ пропионовая и уксусная кислоты. Это объяснимо исходя из факта образования пропионовыми бактериями минорных экзометаболитов с антимикробными свойствами, например альдегидов уксусной и пропионовой кислот, пероксида водорода, диацетила (Vorobyeva, 1995), 3-фенилмолочной кислоты (Lavermicocca et al., 2003) и др. Недавно мы доказали способность этого штамма пропионовокислой бактерии выделять в среду собственные полипептиды микостатического действия, отличные от таковых триптона среды (Ryzhkova et al., 2017).
Антифунгальная активность лактобацилл также может определяться помимо молочной кислоты и следов уксусной и пропионовой кислот широким спектром веществ (3-фенилмолочная кислота, бензойная кислота, гидроксилированные жирные кислоты, реутерин, диацетил, дикетопиперазин, пероксид водорода), спектр которых может существенно различаться у разных штаммов (Daliéetal.,2010; Delavenneetal.,2012). Среди исследованных нами лактобацилл наиболее перспективен в отношении ингибирования роста грибов штамм Lactobacillus brevis 5. Введение КЖ этого штамма и пропионовокислой бактерии Pfr-4 в соотношении 1 : 1 в суммарном количестве 20 % в среду для выращивания грибов вызывало усиление ингибирующего действия в сравнении с действием КЖ этих бактерий раздельно. Этот эффект требует дальнейшего изучения, ибо указывает на синергию в антифунгальном действии экзометаболитов молочно- и пропионовокислых бактерий.
Дополнительная информация о ПКБ:
- Антифунгальные свойства молочных пропионибактерий
- Антибиотикорезистентность, антагонистическая активность и биосовместимость ПКБ
- Силосование кормов и пропионибактерии
Литература
- Brock M, Bucke lW (2004) On the mechanism of action of the antifungal agent propionate: propionyl-CoA inhibits glucose metabolism in Aspergillus nidulans. Eur J Biochem 271(15):3227—3241
- Danilova IV, Mao Yu-B, Lee H, Tourova TP, Ryzhkova EP, Netrusov AI (2012) Propionbacterium freudenreichii strains as antibacterial agents at neutral pH and their production on food-grade media fermented by some lactobacilli. J Food Safety 32(1):48—58
- Dalié DKD, Deschamps AM, Richard-Forget F (2010) Lactic acid bacteria — potential for control of mould growth and mycotoxins. Food control 21:370—380
- Delavenne E, Mounier J, Déniel F, Barbier G, Le Blay G (2012) Biodiversity of antifungal lactic acid bacteria isolated from raw milk samples from cow, ewe and goat over one-year period. Int J Food Microbiol 155(3):185—190
- Doores S (2005) Organic acids. In: Davidson PM, Sofos JN, Branen AL (eds) Antimicrobials in Food, 3rd edn. Boca Roton, London, New York, Syngapore, Taylor and Francis Group LLC, p 91—142
- Kung LJr, Myers CL, Neylon JM, Taylor CC, Lazartic J, Mills JA,Whiter AG (2004) The effects of buffered propionic acid-based additives alone or combined with microbial inoculation on the fermentation of high moisture corn and whole-crop barley. J Dairy Sci 87(5):1310—1316
- Lavermicocca P, Valerio F, Visconti A (2003) Antifungal activity of phenyllactic acid against molds isolated from bakery products. Appl Environ Microbiol 69(1):634—640
- Lind H, Jonson H, Schnurer J (2005) Antifungal effect of dairy propionibacteria — contribution of organic acids. Int J Food Microbiol 98(2):157—165
- Ryzhkova EP, Serebrov VV, Danilova IV, Bykovchenko TV (2015a) Backdround for trials of Propionibacterium freudenreichii strain RVS-4-irf as a component of clinical nutrition. Biotekhnologiya 4:70—78 (in Russ.)
- Ryzhkova EP, Danilova IV, Kurakov AV (2015b) Аpproach for acid-milk products protection against spoilage with micromycetes. RF Patent N 2555535 (in Russ.)
- Ryzhkova EP, Lee H, Bykovchenko TV, Danilova IV, Polandova RD (2009) Microbial safeguard of wheat bread based on trofic chain between Lactobacillus delbrueckii and Propionibacterium freudenreichii. Biotekhnologiya 2:29—37 (in Russ.)
- Ryzhkova EP, Shamraichuk IL, Kurakov AV, Netrusov AI (2017) Production of antimicrobial polypeptides by Propionibacterium freudenreichii RVS-4-irf. Microbiology 86(2):170—175
- SchwenningerSM, LacroixCh, TruttmannSt, JansCh, SporndliC, BiglerL, MeileL (2008) Characterization of low-molecular-weight antiyeast metabolites produced by a food-protective Lactobacillus—Propionibacterium coculture. J Food Protect 71(12):2481—2487
- Vorobyeva LI (1995) Propionic acid bacteria. Moskva (in Russ.)

