ООО "ПРОПИОНИКС"
| пн-пт с 09:00 до 18:00 | |
Часть I. «Курса лекций по общей микробиологии и основам вирусологии»
КУРС ЛЕКЦИИ ПО ОБЩЕЙ МИКРОБИОЛОГИИ И ОСНОВАМ ВИРУСОЛОГИИ
В двух частях (часть 1)

По материалам Курса лекций по общей микробиологии и основам вирусологии. В 2 ч. Ч. 1 /О.В. Прунтова, О. Н. Сахно, М. А. Мазиров; Владим. гос. ун-т. - Владимир: Изд-во Владим. гос. ун-та, 2006. - 192 с.

ВВЕДЕНИЕ
Для чего нужно будущему биологу, экологу или специалисту любой другой биологической специальности изучать микробиологию и основы вирусологии?
Во-первых, микроорганизмы, присутствуя повсеместно, активно участвуют в круговороте веществ в природе, являются неотъемлемой частью любой экологической системы, поэтому знание их морфологии, физиологии, генетики необходимо для формирования целостного представления о биосфере.
Во-вторых, широкое использование микроорганизмов в народном хозяйстве (в сельском хозяйстве, пищевой, медицинской, перерабатывающей и других отраслях) требует глубоких теоретических знаний в этой области.
В-третьих, способность существовать в микроэкологических условиях позволила микроорганизмам сохранить свойства, соответствующие далекому прошлому нашей планеты. Для биолога это является чрезвычайно важным, потому что в суждениях о жизни как биологическом явлении он должен учитывать те особенности, которые характерны для микроорганизмов.
Таким образом, чтобы понимать, реально оценивать и решать общебиологические или частные (медицинские, экологические, сельскохозяйственные и др.) проблемы, необходимо знать морфологию, физиологию, генетику и экологию микроорганизмов.
Цели и задачи микробиологии. Микробиология (от греч. micros - малый, bios - жизнь, logos - учение) - наука, изучающая строение, жизнедеятельность и экологию микроорганизмов - мельчайших форм жизни растительного или животного происхождения, невидимых невооруженным глазом. Она изучает всех представителей микромира (бактерии, грибы, простейшие, вирусы). По своей сути микробиология является фундаментальной биологической наукой. Для изучения микроорганизмов она использует методы других наук, прежде всего физики, биологии, биоорганической химии, молекулярной биологии, генетики, цитологии, иммунологии. Как и всякая наука, микробиология подразделяется на общую и частную. Общая микробиология изучает закономерности строения и жизнедеятельности микроорганизмов на всех уровнях: молекулярном, клеточном, популяционном; генетику и взаимоотношения их с окружающей средой. Предметом изучения частной микробиологии являются отдельные представители микромира в зависимости от их проявления и влияния на окружающую среду, живую природу, в том числе человека. К частным разделам микробиологии относятся медицинская, ветеринарная, сельскохозяйственная, техническая (раздел биотехнологии), морская, космическая микробиология.
Медицинская микробиология изучает патогенные для человека микроорганизмы: бактерии, вирусы, грибы, простейшие. В зависимости от природы изучаемых патогенных микроорганизмов медицинская микробиология делится на бактериологию, вирусологию, микологию, протозоологию. Каждая из этих дисциплин рассматривает морфологию и физиологию патогенных микроорганизмов, то есть осуществляет микроскопические и другие виды исследований, изучает обмен веществ, питание, дыхание, условия роста и размножения, генетические особенности; роль микроорганизмов в этиологии и патогенезе инфекционных болезней; основные клинические проявления и распространенность вызываемых заболеваний; специфическую диагностику, профилактику и лечение инфекционных заболеваний; экологию патогенных микроорганизмов.
К медицинской относят также санитарную, клиническую и фармацевтическую микробиологию.
Санитарная микробиология изучает микрофлору окружающей среды, взаимоотношения микрофлоры с организмом, влияние ее и продуктов ее жизнедеятельности на состояние здоровья человека, разрабатывает мероприятия, предупреждающие неблагоприятное воздействие микроорганизмов на человека.
Фармацевтическая микробиология исследует инфекционные болезни лекарственных растений, порчу лекарственных растений и сырья под действием микроорганизмов, обсемененность лекарственных средств в процессе приготовления, а также готовых лекарственных форм.
Ветеринарная микробиология изучает те же вопросы, что и медицинская микробиология, но применительно к микроорганизмам, вызывающим болезни животных.
Почвенная микробиология изучает влияние микроорганизмов на процессы почвообразования, на плодородие, состав почвы, инфекционные заболевания растений и т.д., то есть вопросы, которые находятся в центре внимания сельскохозяйственной микробиологии.
Морская и космическая микробиология изучают соответственно микрофлору морей и водоемов, космического пространства и других планет.
Техническая микробиология, являющаяся частью биотехнологии, разрабатывает технологию получения из микроорганизмов разнообразных продуктов для народного хозяйства и медицины (антибиотики, вакцины, ферменты, белки, витамины). Основа современной биотехнологии - генетическая инженерия.
Многочисленные открытия в области микробиологии, изучение взаимоотношений между макро- и микроорганизмами во второй половине XIX в. способствовали началу бурного развития иммунологии. Вначале иммунология рассматривалась как наука о невосприимчивости организма к инфекционным заболеваниям. В настоящее время она стала общемедицинской и общебиологической наукой. Доказано, что иммунная система служит для защиты организма не только от микробных агентов, но и от любых генетически чужеродных организму веществ с целью сохранения постоянства внутренней среды организма, то есть гомеостаза.
Глава 1. МИКРОБИОЛОГИЯ И ИСТОРИЯ ЕЕ РАЗВИТИЯ
Тысячелетия люди жили в окружении микроорганизмов, не подозревая о том, что пользуются продуктами их жизнедеятельности, страдают и гибнут от болезней, вызываемых ими. Уже в VI - V вв. до н.э. человек пользовался плодами деятельности микроорганизмов. Виноделие, хлебопечение, сыроделие, выделка кож - процессы, проходящие с участием микроорганизмов. Тогда же, в древности, ученые и мыслители предполагали, что многие болезни вызываются какими-то посторонними невидимыми причинами, имеющими живую природу.
Минимальные размеры предмета, который может видеть человек (в виде точки), 0,07 - 0,08 мм. Размеры же микроорганизмов значительно меньше, они исчисляются микрометрами (мкм) и нанометрами (нм). Поэтому открытие и изучение микромира стало возможным только после возникновения и последующего совершенствования оптической техники.
§ 1.1. Открытие микроорганизмов
Самые простые двояковыпуклые линзы были обнаружены при археологических раскопках в Древнем Вавилоне, они были изготовлены из отшлифованного горного хрусталя.
В XVI - XVII вв. в связи с бурным развитием астрономии были созданы первые подзорные трубы и телескопы. Один из первых микроскопов был изобретен в 1610 г. Г. Галилеем посредством того, что он расположил линзы телескопа иным образом и получил увеличение мелких предметов. Позже английский физик Р. Гук создал микроскоп, дающий увеличение в 30 раз, и, рассматривая в этом микроскопе срезы пробки, обнаружил ячеистое строение древесной ткани. Впоследствии он ввел термин «клетка» для структурных единиц, из которых построены живые организмы.
 Но приоритет в открытии микроорганизмов принадлежит голландскому натуралисту-любителю Антони ван Левенгуку (1632 - 1723 гг.). А. Левенгук торговал полотном и увлекался шлифованием стекол. Он довел это искусство до совершенства и сконструировал микроскоп, который увеличивал предметы в 300 раз. Рассматривая под микроскопом различные объекты (дождевую воду, различные настои, зубной налет, кровь, испражнения, сперму), он обнаружил мельчайших «животных», которых назвал «анималькулями», и был убежден, что они устроены так же, как и крупные организмы, то есть имеют такие же органы, но только очень маленькие. Свои наблюдения А. Левенгук регулярно сообщал в Лондонское королевское общество (более 170 писем), а в 1695 г. обобщил в книге «Тайны природы, открытые А. Левенгуком».
Но приоритет в открытии микроорганизмов принадлежит голландскому натуралисту-любителю Антони ван Левенгуку (1632 - 1723 гг.). А. Левенгук торговал полотном и увлекался шлифованием стекол. Он довел это искусство до совершенства и сконструировал микроскоп, который увеличивал предметы в 300 раз. Рассматривая под микроскопом различные объекты (дождевую воду, различные настои, зубной налет, кровь, испражнения, сперму), он обнаружил мельчайших «животных», которых назвал «анималькулями», и был убежден, что они устроены так же, как и крупные организмы, то есть имеют такие же органы, но только очень маленькие. Свои наблюдения А. Левенгук регулярно сообщал в Лондонское королевское общество (более 170 писем), а в 1695 г. обобщил в книге «Тайны природы, открытые А. Левенгуком».
В Россию первый микроскоп привез из Голландии Петр I, где он встречался с А. Левенгуком и беседовал с ним. Позднее в императорских мастерских были изготовлены первые российские микроскопы.
§ 1.2. Основные этапы развития микробиологии
Этапы развития микробиологии связаны между собой не столько хронологически, сколько обусловлены основными достижениями и открытиями, поэтому многие исследователи выделяют различные периоды, но чаще всего следующие: эвристический, морфологический, физиологический, иммунологический и молекулярно-генетический.
ЭВРИСТИЧЕСКИЙ ПЕРИОД (IV - III вв. до н.э. - XVI в.)
Связан скорее с логическими и методическими приемами нахождения истины, то есть эвристикой, чем с какими-либо экспериментами и доказательствами. Мыслители этого периода (Гиппократ, римский писатель Варрон, Авиценна и др.) высказывали предположения о природе заразных болезней, миазмах, мелких невидимых животных. Эти представления были сформулированы в стройную гипотезу спустя многие столетия в сочинениях итальянского врача Д. Фракасторо (1478 - 1553 гг.), высказавшего идею о живом контагии (contagium vivum), который вызывает болезни. При этом каждая болезнь вызывается своим контагием. Для предохранения от болезней им были рекомендованы изоляция больного, карантин, ношение масок, обработка предметов уксусом.
МОРФОЛОГИЧЕСКИЙ ПЕРИОД (XVII - ПЕРВАЯ ПОЛОВИНА XIX вв.)
Начинается с открытия микроорганизмов А. Левенгуком. На этом этапе было подтверждено повсеместное распространение микроорганизмов, описаны формы клеток, характер движения, места обитания многих представителей микромира. Окончание этого периода знаменательно тем, что накопленные к этому времени знания о микроорганизмах и научно-методический уровень (в частности, наличие микроскопической техники) позволили ученым разрешить три очень важные (основные) для всех естественных наук проблемы: изучение природы процессов брожения и гниения, причины возникновения инфекционных заболеваний, проблему самозарождения микроорганизмов.
Изучение природы процессов брожения и гниения. Термин «брожение» (fermentatio) для обозначения всех процессов, идущих с выделением газа, впервые употребил голландский алхимик Я.Б. Гельмонт (1579 - 1644 гг.). Многие ученые пытались дать определение этому процессу и объяснить его. Но ближе всех к пониманию роли дрожжей в процессе брожения подошел французский химик А.Л. Лавуазье (1743 - 1794 гг.) при изучении количественных химических превращений сахара при спиртовом брожении, но он не успел завершить свою работу, так как стал жертвой террора французской буржуазной революции. Многие ученые изучали процесс брожения, но к заключению о связи процессов брожения с жизнедеятельностью микроскопических живых существ одновременно, независимо друг от друга пришли французский ботаник Ш. Каньяр де Латур (исследовал осадок при спиртовом брожении и обнаружил живых существ), немецкие естествоиспытатели Ф. Кютцинг (при образовании уксуса обратил внимание на слизистую пленку на поверхности, которая также состояла из живых организмов) и Т. Шванн. Но их исследования были подвергнуты суровой критике сторонниками теории физико-химической природы брожения. Их обвинили в «легкомыслии в выводах» и отсутствии доказательств.
Вторая основная проблема о микробной природе инфекционных заболеваний также была решена в морфологический период развития микробиологии. Первыми высказали предположения о том, что заболевания вызывают невидимые существа, древнегреческий врач Гиппократ (ок. 460 - 377 гг. до н.э.), Авиценна (ок. 980 - 1037 гг.) и др. Несмотря на то, что появление болезней теперь уже связывалось с открытыми микроорганизмами, необходимы были прямые доказательства. И они были получены русским врачом-эпидемиологом Д.С. Самойловичем (1744 - 1805 гг.). Микроскопы того времени имели увеличение примерно в 300 раз и не позволяли обнаружить возбудителя чумы, для выявления которого, как сейчас известно, необходимо увеличение в 800 - 1000 раз. Чтобы доказать, что чума вызывается особым возбудителем, он заразил себя отделяемым бубона больного чумой человека и заболел чумой. К счастью, Д.С. Самойлович остался жив. Впоследствии героические опыты по самозаражению для доказательства заразности того или иного микроорганизма провели русские врачи Г.Н. Минх и О.О. Мочутковский, И.И. Мечников и др. Но приоритет в решении вопроса о микробной природе инфекционных заболеваний принадлежит итальянскому естествоиспытателю А. Баси (1773 - 1856 гг.), который впервые экспериментально установил микробную природу заболевания шелковичных червей, он обнаружил передачу болезни при переносе микроскопического грибка от больной особи к здоровой. Но большинство исследователей были убеждены в том, что причинами всех заболеваний являются нарушения течения химических процессов в организме.
Третья проблема о способе появления и размножения микроорганизмов была решена в споре с господствовавшей тогда теорией самозарождения. Несмотря на то, что итальянский ученый Л. Спалланцани в середине XVIII в. наблюдал под микроскопом деление бактерий, мнение о том, что они самозарождаются (возникают из гнили, грязи и т.д.), не было опровергнуто. Это было сделано выдающимся французским ученым Луи Пастером (1822 - 1895 гг.), который своими работами положил начало современной микробиологии.
В этот же период начиналось развитие микробиологии в России. Основоположником русской микробиологии является Л.Н. Ценковский (1822 - 1887 гг.). Объекты его исследований - простейшие, водоросли, грибы. Он открыл и описал большое число простейших, изучил их морфологию и циклы развития, показал, что нет резкой границы между миром растений и животных. Им была организована одна из первых пастеровских станций в России и предложена вакцина против сибирской язвы (живая вакцина Ценковского).
ФИЗИОЛОГИЧЕСКИЙ ПЕРИОД (ВТОРАЯ ПОЛОВИНА XIX в.)
Бурное развитие микробиологии в XIX в. привело к открытию многих микроорганизмов: клубеньковых бактерий, нитрифицирующих бактерий, возбудителей многих инфекционных болезней (сибирская язва, чума, столбняк, дифтерия, холера, туберкулез и др.), вируса табачной мозаики, вируса ящура и др. Открытие новых микроорганизмов сопровождалось изучением не только их строения, но и их жизнедеятельности, то есть на смену морфолого-систематическому изучению первой половины XIX в. пришло физиологическое изучение микроорганизмов, основанное на точном эксперименте. Поэтому вторую половину XIX в. принято называть физиологическим периодом в развитии микробиологии.
Этот период характеризуется выдающимися открытиями в области микробиологии, и его без преувеличения можно было бы назвать в честь гениального французского ученого Л. Пастера Пастеровским, потому что научная деятельность этого ученого охватывала все основные проблемы, связанные с жизнедеятельностью микроорганизмов. Подробнее об основных научных открытиях Л. Пастера и их значении для охраны здоровья людей и хозяйственной деятельности человека будет сказано в § 1.3.
Первым из современников Л. Пастера, кто оценил значение его открытий, был английский хирург Дж. Листер (1827 - 1912 гг.), который, основываясь на достижениях Л. Пастера, впервые ввел в медицинскую практику обработку всех хирургических инструментов карболовой кислотой, обеззараживание операционных и добился снижения числа смертельных исходов после операций.
 Одним из основоположников медицинской микробиологии является Роберт Кох (1843 - 1910 гг.), которому принадлежит разработка методов получения чистых культур бактерий, окраска бактерий при микроскопии, микрофотографии. Известна также сформулированная Р. Кохом триада Коха, которой до сих пор пользуются при установлении возбудителя болезни. В 1877 г. Р. Кох выделил возбудителя сибирской язвы, в 1882 г. - возбудителя туберкулеза, а в 1905 г. ему была присуждена Нобелевская премия за открытие возбудителя холеры.
Одним из основоположников медицинской микробиологии является Роберт Кох (1843 - 1910 гг.), которому принадлежит разработка методов получения чистых культур бактерий, окраска бактерий при микроскопии, микрофотографии. Известна также сформулированная Р. Кохом триада Коха, которой до сих пор пользуются при установлении возбудителя болезни. В 1877 г. Р. Кох выделил возбудителя сибирской язвы, в 1882 г. - возбудителя туберкулеза, а в 1905 г. ему была присуждена Нобелевская премия за открытие возбудителя холеры.
В физиологический период, а именно в 1867 г., М.С. Воронин описал клубеньковые бактерии, а почти через 20 лет Г. Гельригель и Г. Вильфарт показали их способность к азотфиксации. Французские химики Т. Шлезинг, А. Мюнц обосновали микробиологическую природу нитрификации (1877 г.), а в 1882 г. П. Дегерен установил природу денитрификации, природу анаэробного разложения растительных остатков. Российский ученый П.А. Костычев создал теорию микробиологической природы процессов почвообразования.
 Наконец, в 1892 г. русский ботаник Д. И. Ивановский (1864 - 1920 гг.) открыл вирус табачной мозаики. В 1898 г. независимо от Д.И. Ивановского этот же вирус был описан М. Бейеринком. Затем был открыт вирус ящура (Ф. Леффлер, П. Фрош, 1897 г.), желтой лихорадки (У. Рид, 1901 г.) и многие другие вирусы. Однако увидеть вирусные частицы стало возможным только после изобретения электронного микроскопа, так как в световые микроскопы они не видны. К настоящему времени царство вирусов насчитывает до 1000 болезнетворных видов. Только за последнее время открыт ряд новых вирусов, в том числе вирус, вызывающий СПИД. Несомненно, что период открытия новых вирусов и бактерий и изучения их морфологии и физиологии продолжается до настоящего времени.
Наконец, в 1892 г. русский ботаник Д. И. Ивановский (1864 - 1920 гг.) открыл вирус табачной мозаики. В 1898 г. независимо от Д.И. Ивановского этот же вирус был описан М. Бейеринком. Затем был открыт вирус ящура (Ф. Леффлер, П. Фрош, 1897 г.), желтой лихорадки (У. Рид, 1901 г.) и многие другие вирусы. Однако увидеть вирусные частицы стало возможным только после изобретения электронного микроскопа, так как в световые микроскопы они не видны. К настоящему времени царство вирусов насчитывает до 1000 болезнетворных видов. Только за последнее время открыт ряд новых вирусов, в том числе вирус, вызывающий СПИД. Несомненно, что период открытия новых вирусов и бактерий и изучения их морфологии и физиологии продолжается до настоящего времени.
С.Н. Виноградский (1856 - 1953 гг.) и голландский микробиолог М. Бейеринк (1851 - 1931 гг.) ввели микроэкологический принцип исследования микроорганизмов. С.Н. Виноградский предложил создавать специфические (элективные) условия, дающие возможность преимущественного развития одной группы микроорганизмов, открыл в 1893 г. анаэробный азотфиксатор, названный им в честь Пастера Clostridium pasterianum, выделил из почвы микроорганизмы, представляющие совершенно новый тип жизни и получившие название хемолитоавтотрофных.
Микроэкологический принцип был развит и М. Бейеринком и применен при выделении различных групп микроорганизмов. Через 8 лет после открытия С.Н. Виноградским азотфиксатора М. Бейеринк выделил в аэробных условиях Azotobacter chroococcum, исследовал физиологию клубеньковых бактерий, процессы денитрификации и сульфатредукции и т.д. Оба этих исследователя являются основоположниками экологического направления микробиологии, связанного с изучением роли микроорганизмов в круговороте веществ в природе.
К концу XIX в. намечается дифференциация микробиологии на ряд частных направлений: общая, медицинская, почвенная.
ИММУНОЛОГИЧЕСКИЙ ПЕРИОД (НАЧАЛО ХХ в.)
С наступлением ХХ в. начинается новый период в микробиологии, к которому привели открытия XIX в.
Работы Л. Пастера по вакцинации, И.И. Мечникова по фагоцитозу, П.Эрлиха по теории гуморального иммунитета составили основное содержание этого этапа в развитии микробиологии, по праву получившего на- звание иммунологического.
Пауль Эрлих (1854 - 1915 гг.) - немецкий врач, бактериолог и биохимик, один из основоположников иммунологии и химиотерапии, выдвинувший гуморальную (от лат. humor - жидкость) теорию иммунитета. Он считал, что иммунитет возникает в результате образования в крови антител, которые нейтрализуют яд. Подтверждением этому было открытие антитоксинов - антител, нейтрализующих токсины у животных, которым вводили дифтерийный или столбнячный токсин (Э. Беринг, С. Китазато).
 И.И. Мечникова (1845 - 1916 гг.) тоже по праву считают основоположником русской микробиологии и иммунологии. Его основные научные интересы были сосредоточены на проблеме изучения взаимоотношений организма-хозяина и микроорганизма-паразита. Его главные научные I открытия касаются изучения иммунитета. В 1883 г. он сформулировал фагоцитарную теорию иммунитета. Невосприимчивость человека к повторному заражению была известна давно, но природа этого явления была непонятна даже после того, как стала широко применяться вакцинация против многих заболеваний.
И.И. Мечникова (1845 - 1916 гг.) тоже по праву считают основоположником русской микробиологии и иммунологии. Его основные научные интересы были сосредоточены на проблеме изучения взаимоотношений организма-хозяина и микроорганизма-паразита. Его главные научные I открытия касаются изучения иммунитета. В 1883 г. он сформулировал фагоцитарную теорию иммунитета. Невосприимчивость человека к повторному заражению была известна давно, но природа этого явления была непонятна даже после того, как стала широко применяться вакцинация против многих заболеваний.
И.И. Мечников показал, что защита организма от болезнетворных бактерий - это сложная биологическая реакция, в основе которой лежит способность фагоцитов (макро- и микрофаги) захватывать и разрушать посторонние тела, попавшие в организм, в том числе бактерии. Исследования И.И. Мечникова по фагоцитозу убедительно доказали, что, помимо гуморального, существует клеточный иммунитет.
И.И. Мечников и П. Эрлих были научными противниками на протяжении многих лет, каждый экспериментально доказывал справедливость своей теории. Впоследствии оказалось, что противоречия между гуморальным и фагоцитарным иммунитетами нет, так как эти механизмы осуществляют защиту организма совместно. И в 1908 г. И.И. Мечникову совместно с П. Эрлихом была присуждена Нобелевская премия за разработку теории иммунитета.
Иммунологический период характеризуется открытием основных реакций иммунной системы на генетически чужеродные вещества (антигены): антителообразование и фагоцитоз, гиперчувствительность замедленного типа (ГЗТ), гиперчувствительность немедленного типа (ГНТ), толерантность, иммунологическая память.
Особенно бурное развитие получили микробиология и иммунология в 50 - 60 гг. двадцатого столетия. Этому способствовали важнейшие открытия в области молекулярной биологии, генетики, биоорганической химии; появление новых наук: генетической инженерии, молекулярной биологии, биотехнологии, информатики; создание новых методов и использование научной аппаратуры.
Иммунология является основой для разработки лабораторных методов диагностики, профилактики и лечения инфекционных и многих неинфекционных болезней, а также разработки иммунобиологических препаратов (вакцин, иммуноглобулинов, иммуномодуляторов, аллергенов, диагностических препаратов). Разработкой и производством иммунобиологических препаратов занимается иммунобиотехнология - самостоятельный раздел иммунологии. Современная медицинская микробиология и иммунология достигли больших успехов и играют огромную роль в диагностике, профилактике и лечении инфекционных и многих неинфекционных болезней, связанных с нарушением иммунной системы (онкологические, аутоиммунные болезни, трансплантация органов и тканей и др.).
МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЙ ПЕРИОД (С 50-х гг. ХХ в.)
Он характеризуется рядом принципиально важных научных достижений и открытий:
- Расшифровка молекулярной структуры и молекулярно-биологической организации многих вирусов и бактерий; открытие простейших форм жизни - «инфекционного» белка приона.
- Расшифровка химического строения и химический синтез некоторых антигенов. Например, химический синтез лизоцима (Д. Села, 1971 г.), пептидов вируса СПИДа (Р.В. Петров, В.Т. Иванов и др.).
- Расшифровка строения антител-иммуноглобулинов (Д. Эдельман, Р. Портер, 1959 г.).
- Разработка метода культур животных и растительных клеток и их выращивание в промышленных масштабах с целью получения вирусных антигенов.
- Получение рекомбинантных бактерий и рекомбинантных вирусов.
- Создание гибридом путем слияния иммунных В-лимфоцитов - продуцентов антител и раковых клеток - с целью получения моноклональных антител (Д. Келлер, Ц. Мильштейн, 1975 г.).
- Открытие иммуномодуляторов - иммуноцитокининов (интерлейкины, интерфероны, миелопептиды и др.) - эндогенных природных регуляторов иммунной системы и их использование для профилактики и лечения различных болезней.
- Получение вакцин с помощью методов биотехнологии и приемов генетической инженерии (гепатита В, малярии, антигенов ВИЧ и других антигенов) и биологически активных пептидов (интерфероны, интерлейкины, ростовые факторы и др.).
- Разработка синтетических вакцин на основе природных или синтетических антигенов и их фрагментов.
- Открытие вирусов, вызывающих иммунодефициты.
- Разработка принципиально новых способов диагностики инфекционных и неинфекционных болезней (иммуноферментный, радиоиммунный анализы, иммуноблотинг, гибридизация нуклеиновых кислот). Создание на основе этих способов тест-систем для индикации, идентификации микроорганизмов, диагностики инфекционных и неинфекционных болезней.
Во второй половине ХХ в. продолжается формирование новых направлений в микробиологии, от нее отпочковываются новые дисциплины со своими объектами исследований (вирусология, микология), выделяются направления, различающиеся задачами исследования (общая микробиология, техническая, сельскохозяйственная, медицинская микробиология, генетика микроорганизмов и т.д.). Было изучено много форм микроорганизмов и примерно к середине 50-х гг. прошлого века А. Клюйвером (1888 - 1956 гг.) и К. Нилем (1897 - 1985 гг.) была сформулирована теория биохимического единства жизни.
§ 1.3. Значение научной деятельности Луи Пастера в развитии микробиологии
 К дому, где помещалась лаборатория Л. Пастера, прибита доска с надписью
К дому, где помещалась лаборатория Л. Пастера, прибита доска с надписью
Переоценить значение научных открытий Л. Пастера невозможно. Изучая молочнокислое, спиртовое, масляно-кислое брожения, он выяснил, что эти процессы вызывают определенные микроорганизмы. Исследуя «болезни» вина, болезни животных и человека, он экспериментально установил, что их вызывают также микроорганизмы. То есть Л. Пастер впервые показал, что микроорганизмы - это живые организмы, полезные или вредные, активно воздействующие на окружающую природу, в том числе и на человека, животных, растения. Принципиально новым было открытие Л. Пастером анаэробного способа существования организмов, «жизни без кислорода» (на примере спиртового брожения).
Теоретическим открытием Л. Пастера были его работы о невозможности самозарождения. К середине XIX в. спор по этому вопросу приобрел большую остроту и вышел за рамки научных дискуссий. В остроумном, гениальном по своей простоте опыте Л. Пастер показал, что самозарождения не существует. Он поместил стерильный бульон в колбу, сообщавшуюся с атмосферным воздухом через изогнутую S-образную трубку. В такой, по существу, открытой колбе бульон при длительном стоянии оставался прозрачным, потому что изогнутость трубки не давала возможности микроорганизмам проникнуть с пылью из воздуха в колбу. Вывод из этого опыта Л. Пастер сформулировал так: «Нет, сегодня не имеется ни одного известного факта, с помощью которого можно было бы утверждать, что микроскопические существа появились на свет без зародышей, без родителей, которые их напоминают. Те, кто настаивает на противоположном, являются жертвой заблуждения или плохо проделанных опытов, содержащих ошибки, которые они не сумели заметить или которых они не сумели избегнуть».
И наконец, работы Л. Пастера в области изучения инфекционных болезней животных и человека (болезнь шелковичных червей, сибирская язва, куриная холера, бешенство) позволили ему не только выявить природу этих заболеваний, но и найти способ борьбы с ними. Поэтому его считают по праву основоположником медицинской микробиологии. Работы Л. Пастера были оценены по достоинству не только соотечественниками, но и получили международное признание. В 1888 г. для ученого на средства, собранные по международной подписке, был построен в Париже научно-исследовательский институт, носящий в настоящее время его имя. Пастер был первым директором этого института. В настоящее время филиалы института Л. Пастера находятся во многих странах мира. Именно ученым Пастеровского института Л. Монтанье был открыт вирус иммунодефицита человека (ВИЧ) параллельно с американским ученым Р. Галло.
§ 1.4. Общая характеристика основных групп микроорганизмов.
Со времени открытия микроорганизмов А. Левенгуком и до ХIХ в. их рассматривали как мельчайшие существа животного происхождения. Только во второй половине ХIХ в. немецкий биолог Э. Геккель (1834 - 1919 гг.) пришел к выводу, что микроорганизмы существенно отличаются от всех известных ранее представителей царств животных и растений, и предложил их выделить в отдельное царство Protista (протисты, первосущества). В настоящее время нет общепринятой теории или представления об общей системе живого мира. Согласно одной точке зрения выделяют только два царства - Plantae (растения) и Animalia (животные), микроорганизмы рассматриваются как примитивные растения или животные и соответственно входят в состав одного из этих двух царств. Согласно второй точке зрения, по Э. Геккелю, микроорганизмы выделяют в самостоятельную группу по признаку малых (видимых только с помощью соответствующих приборов) размеров и связанных с этим специфических методов изучения.
С конца ХIХ в. уже были данные о неоднородности микроорганизмов, в частности о различии в строении их клеток, поэтому их разделили на высшие и низшие протисты. Простейшие (одноклеточные животные), микроскопические водоросли (кроме сине-зеленых) и микроскопические грибы (плесени, дрожжи) были отнесены к высшим, а все бактерии и сине-зеленые водоросли (или цианобактерии) - к низшим протистам. Это деление было проведено в соответствии с типом клеточной организации - прокариотной или эукариотной. Низшие протисты имеют прокариотное строение клеток, а высшие - эукариотное.
Чем отличаются прокариотный и эукариотный типы клеточной организации?
Прокариоты (от греч. karyon - ядро) - доядерные простейшие, одноклеточные формы жизни, не имеющие ядерной мембраны и высокоорганизованных органелл.
Прокариотная клетка имеет, как правило, цитоплазматическую мембрану, образующую одну внутреннюю полость, в которой располагается нуклеоид (ДНК), он не отделен от цитоплазмы мембраной. В цитоплазме могут быть функционально специализированные структуры, но они не отделены от нее мембранами, то есть не образуют замкнутых полостей. Рибосомы прокариотной клетки 70S-типа.
Эукариотная клетка имеет в отличие от прокариотной вторичные полости. Ядро, митохондрии, хлоропласты и другие клеточные органеллы присутствуют только в эукариотной клетке. Наружные мембраны этих органелл (ядерная, мембрана митохондрий и др.) образуют вторичные полости. Рибосомы эукариотной клетки 80S-типа. Основные черты прокариотной и эукариотной клеточных организаций представлены в табл. 1
Таблица 1 Некоторые морфологические и физиологические свойства эукариотических, прокариотических организмов и вирусов
|
Свойство
|
Биологический домен
|
|||
|
Эукариоты
|
Бактерии
|
Археи
|
Вирусы
|
|
|
Строение клетки
|
Эукариотическое
|
Прокариотическое
|
Прокариотическое
|
-
|
|
Ядерная мембрана
|
+
|
-
|
-
|
-
|
|
Число хромосом
|
>1
|
1
|
1
|
1
|
|
Строение хромосом
|
Линейное
|
Циклическое
|
Циклическое
|
Линейное или циклическое
|
|
Муреин (пептидогликан) в клеточной стенке
|
-
|
+
|
-
|
-
|
|
Липиды клеточной мембраны
|
Эфир-связанные глицериды, неразветвленные, полиненасыщенные
|
Эфир-связанные глицериды, неразветвленные, насыщенные или мононенасыщенные
|
Эфир-связанные глицериды, разветвленные, насыщенные
|
-
|
|
Стеролы клеточной мембраны
|
+
|
-
|
-
|
-
|
|
Органеллы (митохондрии и хлоропласты)
|
+
|
-
|
-
|
-
|
|
Размер рибосом
|
80S (цито- плазменные)
|
70S
|
70S
|
-
|
|
Движение цитоплазмы
|
+
|
-
|
-
|
-
|
|
Мейоз и митоз
|
+
|
-
|
-
|
-
|
|
Транскрипция и трансляция одновременная
|
-
|
+
|
+
|
+
|
|
Аминокислотная инициация синтеза белка
|
Метионин
|
N-формил-
метионин
|
Метионин
|
Метионин
|
|
Ингибиция синтеза белка стрептомицином и хлорамфениколом
|
-
|
+
|
+
|
-
|
|
Состав и строение жгутиков
|
Жгутик содержит набор микротрубочек (из белка тубулина), собранных в группы
9 + 2
|
Жгутик построен из белковых (флагеллин) субъединиц, образующих спираль
|
Жгутик построен из белковых (флагеллин) субъединиц, образующих спираль
|
-
|
Прокариоты и эукариоты имеют определенное строение, формы жизнедеятельности и находятся в биоценотических отношениях с другими живыми существами, а также неживой природой. Как прокариоты, так и эукариоты состоят из структур, обеспечивающих их жизненные процессы, направленные на выживание и размножение.
Из всего вышесказанного можно сделать заключение, что единая общепринятая точка зрения на систему живого мира до настоящего времени еще не выработана. Систематика микроорганизмов всѐ ещѐ находится в развитии. На сегодняшний день, основываясь на современных достижениях молекулярной биологии, генетической инженерии, в соответствии с такими признаками, как уровень организации генома, наличие и состав белок-синтезирующих систем и клеточной стенки, все известные живые существа делят на следующие биологические домены: эукариоты, бактерии, археи, вирусы и плазмиды.
К прокариотам относят бактерии, сине-зеленые водоросли, или цианобактерии, и археи. Простейшие, дрожжи и нитчатые грибы - эукариоты. Вирусы и плазмиды тоже являются микроорганизмами, но представителями неклеточных форм жизни.
При таком разнообразии очень трудно дать определение понятия «микроорганизм». Главное отличие живого от неживого - наличие собственной генетической системы, которая обеспечивает наследственную непрерывность и эволюцию данного организма, то есть его жизнь. Все структуры, которые имеют свою генетическую систему, рассматриваются как живые организмы. Исходя из этого понятие «микроорганизм» можно определить так: микроорганизмы - это невидимые невооруженным глазом представители всех царств жизни: эукариоты, бактерии, археи, вирусы и плазмиды, имеющие собственную генетическую систему и играющие важную и разнообразную роль в круговороте веществ и энергии в природе, в патологии человека, животных и растений.
Эукариоты (простейшие, дрожжи и нитчатые грибы) имеют дифференцированное ядро, отграниченное от цитоплазмы ядерной мембраной, аппарат митоза, ядрышко. Ядерная ДНК эукариот находится в комплексе с гистонами в соотношении 1:1; хромосомы эукариот построены в виде регулярных компактных структурных единиц - нуклеосом, которые состоят из белковой глобулы и обвивающего ее фрагмента ДНК размером в 200 пар нуклеотидов. Хромосомы бактерий не имеют гистонов и стабильных регулярных структурных единиц. Однако у бактерий обнаружены гистоноподобные белки, но их содержится значительно меньше в расчете на хромосому, и они легко диссоциируют при выделении. Эукариоты имеют рибосомы 80S, митохондрии или хлоропласты (в этих структурах содержатся рибосомы 70S), не содержат пептидогликана, все они аэробы. Дисциплина, изучающая простейших, называется протозоологией, а изучающая грибы - микологией.
Прокариоты (бактерии и археи) - это организмы, у которых еще нет оформленного ядра, а есть лишь его предшественник - нуклеоид. Он представлен одной или несколькими хромосомами, которые состоят из ДНК и свободно располагаются в цитоплазме, не отграниченные от нее никакой мембраной. Прокариоты не имеют дифференцированного аппарата митоза, у них нет ядрышка, нет митохондрий и хлоропластов, рибосомы 70S, большинство имеют клеточную стенку, содержащую пептидогликан, которой нет у эукариот. Размеры варьируют от 1 до 20 мкм. Они аэробы и анаэробы.
В 70-х гг. ХХ в. обнаружены микроорганизмы, структурно относящиеся к прокариотному типу, но значительно отличающиеся химическим строением важных клеточных макромолекул и способностью осуществлять уникальные биохимические процессы. Эти необычные прокариоты были названы вначале архебактериями, а в настоящее время переименованы в «археи». Типичные прокариоты, или бактерии, получили название бактерий (ранее эубактерии). Дисциплина, которая изучает эубактерии и архебактерии, называется бактериологией.
Число известных архей по сравнению с бактериями чрезвычайно мало. Основные отличия архей от бактерий: в химическом составе клеточной жесткой стенки нет пептидогликана; у архей особая структура липидов, иной компонентный состав РНК-полимераз; повторяющиеся последовательности в составе хромосомной ДНК; наличие интронов в генах тРНК и рРНК; иной химический состав и строение рибосом. Сходство архей с эукариотами: наличие интронов в генах тРНК и рРНК; наличие в хромосомных ДНК повторяющихся последовательностей и остальные вышеперечисленные признаки, а также рибосомы архей имеют сходство с рибосомами 70S и 80S.
Подвижность микроорганизмов (прокариот и эукариот) обеспечивается жгутиками, которые различаются по химической структуре. Жгутики у прокариот состоят из белка флагеллина и не содержат систем микротрубочек. Жгутики у эукариот построены из белка тубулина и представляют собой систему микротрубочек, располагающихся по типу 9+2 и связанных базальным телом.
Вирусы и плазмиды. Особое место среди микроорганизмов занимают вирусы (от лат. virus - яд) - мельчайшие простейшие формы жизни, стоящие на грани между живым и неживым, не способные жить и размножаться вне животной, растительной или иной клетки. Их геном представлен либо ДНК, либо РНК; у них отсутствуют собственные системы биосинтеза белка и мобилизации энергии, поэтому они являются абсолютными внутриклеточными паразитами. В состав вирусов, кроме нуклеиновых кислот, входят белки, ферменты. Еще более просто устроены прионы - «инфекционные» белковые частицы, лишенные генетического материала, то есть нуклеиновой кислоты. Вирусы и прионы являются облигатными (обязательными) внутриклеточными паразитами.
Прокариоты, как правило, размножаются вне клетки, однако могут являться факультативными внутриклеточными паразитами; только некоторые из бактерий (риккетсии, хламидии) являются облигатными внутриклеточными паразитами. Эукариоты устроены значительно сложнее, чем прокариоты. Об этом можно судить по объему генома, то есть числу генов, составляющих генетический аппарат клетки. У эукариотов его объем в десятки и сотни раз больше, чем у прокариотов. Так, если у вирусов объем генома состоит примерно из 10 - 100, у бактерий - из 1000 - 5000, то у простейших - из 10 000 и более генов. Размеры отдельных представителей микромира колеблются от 0,01 - 0,4 мкм, или 10 - 400 нм (вирусы), до 10 и более мкм (бактерии, грибы, простейшие).
Микроорганизмы играют огромную роль в природе и жизни человека. Они обеспечивают круговорот веществ и энергии в природе, плодородие почв, поддержание газового состава атмосферы и других природных процессов. Подавляющее большинство микроорганизмов безвредно для человека, а многие из них полезны. В частности, микроорганизмы, населяющие кожу и слизистые оболочки, желудочно-кишечный и урогенитальный тракты, составляют экологическое единство с организмом человека и поддерживают постоянство некоторых процессов его жизнедеятельности (эндоэкология). Многие микроорганизмы используются человеком при получении жизненно необходимых продуктов и материалов.
Микроорганизмы, которые не оказывают неблагоприятных влияний на организм человека и не вызывают у него заболеваний, называют непатогенными, или сапрофитами. Однако имеется группа микроорганизмов, вызывающих у человека различные заболевания, патологические процессы. Эти микроорганизмы называются патогенными (от греч. pathos - болезнь); они живут и питаются за счет органических субстратов. Количество патогенных микроорганизмов огромно - более 3000 видов (бактерии, вирусы, грибы), из них более 1000 видов составляют вирусы. При соответствующих условиях, главным образом снижении сопротивляемости организма, сапрофиты могут вызывать болезни, то есть вести себя как патогенные микроорганизмы. Такие микроорганизмы называют условно-патогенными.
Приблизительно 3000 видов бактерий и архей и более 1000 вирусов известны сегодня, но это число, вероятно, меньше одного процента от всех видов, существующих в природе.
Глава 2 МОРФОЛОГИЯ МИКРООРГАНИЗМОВ
§ 2.1. Размеры и форма микроорганизмов
Размеры микроорганизмов. Все живые объекты, размеры которых менее 70 - 80 мкм, невидимы невооруженным глазом и могут быть отнесены к микроорганизмам. Размеры микроорганизмов варьируют в широких пределах (табл. 2): величина самых крупных представителей приблизительно 100 мкм (некоторые диатомовые водоросли и высшие протисты), размеры одноклеточных зеленых водорослей и клеток дрожжей на порядок меньше - приблизительно 10 мкм, еще меньше размеры, характерные для большинства бактерий. Типичная бактериальная клетка - приблизительно 1 мкм в диаметре, в то время как большинство эукариотических клеток - от 10 до 100 мкм в диаметре. В среднем линейные размеры бактерий лежат в пределах 0,5 - 3,0 мкм. Но некоторые бактерии могут иметь гигантские размеры, например: клетки нитчатой серобактерии Beggiatoa alba имеют диаметр до 50 мкм; Achromatium oxaliferum имеет в длину 15 - 100 мкм при поперечнике примерно 5 - 33 мкм, а длина клетки спирохеты может быть до 250 мкм. Самые мелкие из известных прокариотных клеток - микоплазмы диаметром клеток 0,1 - 0,15 мкм. Минимальное число ферментов, нуклеиновых кислот и других макромолекулярных компонентов, необходимых для самовоспроизведения теоретической «минимальной клетки», составляет по проведенной оценке около 50. В клетке диаметром 0,15 мкм может содержаться порядка 1200 молекул белка и осуществляться около 1200 ферментативных реакций, то есть у микоплазм достигнут размер клеток, близкий к теоретическому пределу клеточного уровня организации жизни.
Размеры вирусов находятся в диапазоне 16 - 300 нм и лежат за пределами разрешающей способности светового микроскопа. Вирусы занимают место между самыми мелкими бактериальными клетками и самыми крупными органическими молекулами.
Таблица 2 Размеры микроорганизмов
|
Объект
|
Линейный размер, мкм
|
|
Одноклеточные эукариоты
|
|
|
Некоторые диатомовые водоросли
|
100
|
|
Зеленая водоросль Chlorella
|
2 - 10
|
|
Дрожжи Saccharomyces
|
6 - 10
|
|
Прокариотные организмы
|
|
|
Achromatium oxaliferum
|
5 - 33 х 15-100
|
|
Beggiatoa alba
|
2 - 10 х 1 - 50
|
|
Cristispira pectinis
|
1,5 х 36-72
|
|
Spirochaeta plicatilis
|
0,2-0,7 х 80-250
|
|
Bacillus subtilis
|
0,7-0,8 х 2 - 3
|
|
Escherichia coli
|
0,3 - 1 х 1 - 6
|
|
Staphilococcus aureus
|
0,5-1,0
|
|
Thiobacillus thioparus
|
0,5 х 1 - 3
|
|
Rickettsia prowazeki
|
0,3-0,6 х 0,8 - 2
|
|
Mycoplasma mycoides
|
0,1 х 0,25
|
|
Вирусы
|
|
|
Вирус табачной мозаики
|
0,02 х 0,3
|
|
Вирус коровьей оспы
|
0,26
|
|
Вирус гриппа
|
0,1
|
|
ФагТ2
|
0,06 х 0,2
|
|
ФХ174
|
0,025
|
|
Вирус желтой лихорадки
|
0,022
|
|
Вирус ящура
|
0,030
|
|
Толщина ЦПМ бактериальной клетки
|
0,01
|
|
Рибосома
|
0,018
|
|
Молекула глобулярного белка:
крупная
мелкая
|
0,013
0,004
|
Размеры бактерий выражают в микрометрах (мкм). Один микрометр равен 1000 нм (нанометров). Для сравнения: 1 мм = 103 мкм = 106 нм = 10 Å = 109 пм (пикометров). В нанометрах измеряют отдельные компоненты бактерий. Структуру микроорганизмов изучают с помощью электронной микроскопии целых клеток и их ультратонких срезов.
Форма прокариот. Клетки прокариот достаточно разнообразны и имеют форму сферы, цилиндра или спирали. Они бывают одиночными, в иных случаях образуют нити или колонии.
Прокариоты сферической формы (шаровидные клетки) называют кокками, после деления они могут не расходиться и образуют пары клеток - диплококки, или парные кокки (пневмококк, гонококк, менингококк). Пневмококк (возбудитель пневмонии) имеет с противоположных сторон ланцетовидную форму, а гонококк (возбудитель гонореи) и менингококк (возбудитель эпидемического менингита) - форму кофейных зерен, обращенных вогнутой поверхностью друг к другу.
Стрептококки (от греч. streptos - цепочка) - клетки округлой или вытянутой формы, составляющие цепочку вследствие деления клеток в одной плоскости и сохранения связи между ними в месте деления. Сарцины (от лат. sarcina — связка, тюк) располагаются в виде пакетов из 8 и более кокков, так как они образуются при делении клетки в трех взаимно перпендикулярных плоскостях. В этом случае колонии бактерий имеют правильную сферическую форму. Если деление происходит в нескольких плоскостях неравномерно, образуются клеточные скопления неправильной формы. Стафилококки (от греч. staphyle - виноградная гроздь) представляют собой кокки, расположенные группами (гроздьями) в результате деления в разных плоскостях.
Прокариоты, имеющие форму цилиндра, - палочковидные бактерии, различаются по размерам, по отношению длины клетки к ее поперечнику, форме концов клетки и взаимному расположению клеток. Длина клеток варьирует от 1 до 8 мкм, толщина - от 0,5 до 2 мкм. Палочки могут быть правильной (кишечная палочка и др.) и неправильной (коринебактерии и др.) формы, в том числе ветвящиеся, например актиномицеты. Наиболее мелкие палочковидные бактерии - риккетсии. Концы палочек могут быть как бы обрезанными (сибиреязвенная бацилла), закругленными (кишечная палочка), заостренными (фузобактерии) или в виде утолщения, и тогда палочка похожа на булаву (коринебактерии дифтерии).
Слегка изогнутые палочки называют вибрионами (холерный вибрион). Большинство палочковидных бактерий располагается беспорядочно, так как после деления клетки расходятся. Если после деления клетки остаются связанными общими фрагментами клеточной стенки и не расходятся, они располагаются под углом друг к другу (коринебактерии дифтерии), образуют цепочку (сибиреязвенная бацилла).
Спириллы - извитые формы бактерий, имеют вид штопорообразно извитых клеток. К патогенным спириллам относится возбудитель содоку (болезни укуса крыс).
Спирохеты - тонкие, длинные, извитые (спиралевидной формы) бактерии, отличающиеся от спирилл подвижностью, обусловленной «сгибательными» изменениями клеток.
Актиномицеты — ветвящиеся грамположительные бактерии. Свое название (от греч. actis - луч, mykes - гриб) они получили в связи с возникновением в пораженных тканях друз-гранул из плотно переплетенных нитей в виде лучей, отходящих от центра и заканчивающихся колбовидными утолщениями. Актиномицеты, как и грибы, образуют мицелий - нитевидные переплетающиеся клетки (гифы). Они формируют субстратный мицелий, появляющийся в результате врастания мицелия в питательную среду, и воздушный, растущий на поверхности среды. Актиномицеты могут делиться путем фрагментации мицелия на палочковидные или сферические клетки, похожие на палочковидные и кокковидные бактерии. На воздушных гифах актиномицетов могут образовываться споры, необходимые для размножения. Споры актиномицетов обычно нетермостойки.
Описаны прокариоты, обладающие морфологической изменчивостью, в зависимости от условий имеющие вид палочек, кокков или обнаруживающие слабое ветвление. Форма многоклеточных прокариот также разнообразна: это скопления различной конфигурации, чаще, нити. Своеобразие бактериальным клеткам придают жгутики, имеющие различное расположение на клеточной поверхности, а также выделения клеточных веществ разной химической природы.
За последнее время среди прокариот обнаружены организмы, отличающиеся от описанных выше основных форм. Некоторые бактерии имеют вид кольца, замкнутого или разомкнутого в зависимости от стадии роста. У прокариот, размножающихся в основном почкованием, описано образование клеточных выростов (простек), число которых может колебаться от 1 до 8 и более. Из природных субстратов выделены бактерии червеобразной формы и напоминающие шестиугольную звезду. Для некоторых видов характерно слабое или довольно хорошо выраженное ветвление.
§ 2.2. Морфология прокариотной клетки
Прокариотные клетки имеют три структурные области, которые на рис. 1 обозначены буквами А, Б и В. Область А включает поверхностные клеточные структуры и внеклеточные образования: жгутики, клеточную стенку, капсулу, слизистые выделения, чехол, фимбрии; область Б - плазматическую мембрану и цитоплазматическую область, которая содержит геном клетки (ДНК) и рибосомы; область В - запасные питательные вещества и различные виды включений.

Рис. 1. Комбинированное изображение прокариотной клетки (по Schlegel, 1972 г.) [8]:
А: 1 - клеточная стенка; 2 - капсула; 3 - слизистые выделения; 4 - чехол; 5 - жгутики; 6 - ворсинки; Б: 7 - цитоплазматическая мембрана; 8 - нуклеоид; 9 - рибосомы; 10 цитоплазма; 11 хроматофоры; 12 - хлоросомы; 13 - пластинчатые тилакоиды; 14 - фикобилисомы; 15 - трубчатые тилакоиды; 16 - мезосома; 17 - аэросомы (газовые вакуоли); 18 - ламеллярные структуры; В: 19 - полисахаридные гранулы; 20 - гранулы поли-β-оксимасляной кислоты; 21 - гранулы полифосфата; 22 - цианофициновые гранулы; 23 - карбоксисомы (полиэдральные тела); 24 - включения серы; 25 - жировые капли; 26 -углеводные гранулы
Основные структуры бактериальной клетки: клеточная стенка, цитоплазматическая мембрана, цитоплазма с включениями и ядро, называемое нуклеоидом. Бактерии могут иметь и дополнительные структуры: капсулу, микрокапсулу, слизь, жгутики, фимбрии, пили; некоторые бактерии способны образовывать споры.
Область А - поверхностные структуры клетки
ЖГУТИКИ
Жгутики (от англ. flagella - жгутик) бактерий представляют собой тонкие нити, берущие начало от цитоплазматической мембраны; длина их больше, чем длина клетки. Они определяют подвижность бактерий, позволяют им плавать в жидких средах. Толщина жгутиков 12-20 нм, длина 3 - 12 мкм. Число жгутиков и их расположение у бактерий различных видов варьирует от одного полярного (монотрих) у холерного вибриона (рис. 2) до десятка и сотен жгутиков, отходящих по периметру бактерии (перитрих), у кишечной палочки, протея и др. Лофотрихи имеют пучок жгутиков на одном из концов клетки, амфитрихи - по одному жгутику или пучку жгутиков на противоположных концах клетки.

Рис. 2. Vibrio cholerae (холерный вибрион)
Жгутики прикреплены к цитоплазматической мембране и клеточной стенке специальными дисками. По химическому составу жгутики состоят из белка флагеллина, обладающего антигенной специфичностью. Его субъединицы закручены в виде спирали. Флагеллин обладает сократительной способностью.
Жгутики выявляют с помощью электронной микроскопии препаратов, напылѐнных тяжелыми металлами, или в световом микроскопе после обработки препаратов специальными методами (например, после серебрения). Они состоят из однотипных спирально или продольно уложенных вокруг полой сердцевины белковых субъединиц, образующих цилиндрическую структуру, которая особым образом прикреплена к бактериальной клетке; включают три компонента: спиральную жгутиковую нить постоянной толщины, крючок и базальное тельце. Крючок, к которому присоединена жгутиковая нить, имеет длину 30 - 45 нм и состоит из отличающегося от флагеллина белка. Он соединен с базальным тельцем, которое располагается целиком в оболочке (в клеточной стенке и цитоплазматической мембране).
Базальное тельце состоит из центрального стержня, заключенного в систему особых колец. У грамотрицательных бактерий их две пары: внешняя (кольца L и P) и внутренняя (S и M). Кольца L и P (рис. 3) расположены внутри клеточной стенки (кольцо L - в липополисахариде (ЛПС), а кольцо P - в слое пептидогликана). Они исполняют роль втулки стержня. Внутренняя пара (S и M) фиксирована на цитоплазматической мембране, причем кольцо S располагается в периплазматическом пространстве, а M - на цитоплазматической мембране или в ней.

Рис. 3. Строение жгутика грамотрицательных бактерий: 1 - нить; 2 - крючок; 3 - базальное тельце; 4 - стержень; 5 - L-кольцо; 6 - P-кольцо; 7 - S-кольцо; 8 - M-кольцо; 9 - цитоплазматическая мембрана; 10 периплазматическое пространство; 11 пептидогликановый слой; 12 - наружная мембрана (по De Pamphilis, Adler, 1971 г.) [8]
Жгутики у грамположительных бактерий, имеющих более толстую и гомогенную клеточную стенку, содержат только одну пару колец - S и M. Эти кольца обеспечивают вращательное движение жгутиков. Благодаря этому вращению происходит направленное движение бактерий. Жгутиковый аппарат обладает особым бинарным переключателем, который позволяет менять направление движения жгутиков против часовой стрелки на движение по часовой стрелке. Со жгутиковым аппаратом связана также и хемотаксическая активность бактерий. Генетический контроль синтеза жгутиковых белков, их сборки и активности осуществляется особым опероном. Установлено, что мутации в области mot-генов (от англ. motility - подвижность) приводят к потере только подвижности, однако все структуры жгутиков сохраняются; мутации в che-генах (от греч. chemotaxis - хемоподвижность) - к потере хемотаксической активности при сохранении структуры жгутиков и их подвижности.
Бактериальные жгутики движутся за счет протонной силы (хеми-осмотического потенциала) бактериальной мембраны, а не гидролиза ATФ. Прокариоты обладают разными типами движения (поведения), то есть способностью двигаться в ответ на воздействия окружающей среды. Например, в процессе хемотаксиса бактерия может ощущать качество и количество некоторых химических веществ в окружающей среде и двигаться к ним (если это полезные питательные вещества) или удаляться от них (если это вредные вещества).
Фимбрии или реснички (от лат. fimbria - бахрома) - нитевидные образования, более тонкие и короткие (3 - 20 нм х 0,3 - 10 мкм), чем жгутики. Фимбрии отходят от поверхности клетки и состоят из белка, называемого пилином. Биологическое значение фимбрий состоит в том, что с их помощью бактерии прикрепляются только к определенным поверхностям.
Среди фимбрий разного типа выделяют фимбрии, ответственные за адгезию, то есть прикрепление бактерии к поражаемой клетке (например, пили общего типа - common pili); фимбрии, ответственные за питание, водно-солевой обмен; половые (F-пили), или конъюгационные, пили. Пили общего типа многочисленны и достигают количества нескольких сотен в одной клетке. Они являются основными факторами патогенности у болезнетворных бактерий, потому что бактерии ими прикрепляются к чувствительным клеткам и заселяют их, то есть факторами адгезии и колонизации. Кроме того, они препятствуют фагоцитозу.
Термин «пили» применяется чаще в отношении особых фимбрий - половых пилей, образуемых так называемыми мужскими клетками-донорами, содержащими трансмиссивные плазмиды (F, R, Col); их количество 1 - 2 на клетку.
Пили (донорные ворсинки) - длинные (0,5 - 10 мкм) нитевидные структуры белковой природы. Они присущи бактериям, имеющим конъюгативные плазмиды (F- и R-плазмиды). Они, как и жгутики, имеют внутреннюю полость и построены из особого белка, отличающегося от флагеллина и пилина. Их синтез находится под контролем плазмидных генов. Они служат аппаратом конъюгации: с их помощью устанавливается непосредственный контакт между донорной и реципиентной клетками. Донорные пили обнаруживают с помощью донорспецифических фагов, которые на них адсорбируются и далее вызывают лизис клетки-хозяина. Донорные пили встречаются в количестве 1 - 2 на клетку.
КАПСУЛЫ, СЛИЗИСТЫЕ СЛОИ И ЧЕХЛЫ
Некоторые бактерии (пневмококки, клебсиеллы и др.) образуют капсулу - слизистое образование, прочно связанное с клеточной стенкой, имеющее четко очерченные внешние границы. Капсула различима в мазках-отпечатках из патологического материала, еѐ толщина 0,2 мкм. В чистых культурах бактерий капсула образуется реже. В ее образовании участвует цитоплазматическая мембрана. По химическому составу различают капсулы, состоящие из полисахаридов, содержащих аминосахара, и капсулы полипептидной природы, например у сибиреязвенной бациллы.
Выявление капсул осуществляется методом негативного контрастирования. Капсула гидрофильна, она препятствует фагоцитозу бактерий.
Многие бактерии образуют микрокапсулу - слизистое образование, выявляемое при электронной микроскопии. От капсулы следует отличать слизь — мукоидные экзополисахариды, не имеющие четких внешних границ. Бактериальные экзополисахариды участвуют в адгезии (прилипании к субстратам), их еще называют гликокаликсом.
Кроме того, что бактериальные экзополисахариды синтезируются бактериями путем секреции их компонентов, существует и другой механизм их образования - при действии внеклеточных ферментов на дисахариды. В результате этого образуются декстраны и леваны.
Капсула и слизь предохраняют бактерии от повреждений, высыхания, так как они гидрофильны и хорошо связывают воду, препятствуют действию защитных факторов макроорганизма и бактериофагов и могут являться запасом питательных веществ.
Чехлы - это более сложные структуры. Обычно они имеют и более сложный химический состав, например, у Sphaerotilus natans чехол содержит: сахаров - 36, гексозамина -11, белка - 27, липида - 5,2, фосфора - 0,5 %.
Капсулы, слизистые слои и гликокаликс, как известно, определяют специфические свойства поверхности бактериальных клеток, и некоторые компоненты этих структур являются специфическими антигенами.
Капсулы также защищают бактерии от хищных простейших и от действия антибактериальных агентов животного (фагоциты, антитела) или растительного (микроцины) происхождения. Капсулы некоторых почвенных бактерий защищают их от постоянной угрозы высушивания.
КЛЕТОЧНАЯ СТЕНКА
Это важный и обязательный структурный элемент большинства прокариотных клеток, который располагается под капсулой или слизистым чехлом или непосредственно контактирует с окружающей средой. На долю клеточной стенки приходится от 5 до 50 % сухого вещества клетки. Это прочная, упругая структура, служащая механическим барьером между протопластом и внешней средой, придающая клеткам определенную, при- сущую им форму и поддерживающая высокое осмотическое давление в клетке.
Концентрация солей в клетке, как правило, намного выше, чем в окружающей среде, и поэтому между ними существует большое различие в осмотическом давлении. Клеточная стенка механически защищает клетку от проникновения в нее избытка воды, то есть сдерживает высокое осмотическое давление в клетке. Она участвует в процессе деления клетки и транспорте метаболитов.
Клеточная стенка прокариот резко отличается от таковой у эукариот как по строению, так и по химическому составу. Она содержит специфические полимерные комплексы, которые остутствуют в других структурах клетки. Химический состав и строение клеточной стенки постоянны для определенного вида и являются важным признаком при идентификации.
В зависимости от строения клеточной стенки прокариоты, относящиеся к бактериям, делятся на две большие группы. В 1884 г. датский ученый Х. Грам предложил метод окраски (впоследствии этот метод стали называть «окраска по Граму»), в результате которого бактерии делятся на грамположительные (сине-фиолетовый) и грамотрицательные (красный цвет).
Если фиксированные бактерии окрасить сначала кристаллическим фиолетовым, а затем йодом, то образуется окрашенный комплекс (генциановый фиолетовый в комплексе с йодом). В зависимости от строения клеточной стенки при последующей обработке спиртом этот комплекс либо удерживается, либо вымывается. Если бактерии остаются с сине-фиолетовой окраской, то это свидетельствует о том, что обработка окрашенного по Граму мазка бактерий спиртом вызывает сужение пор в пептидогликане и тем самым задерживает краску в клеточной стенке. То есть бактерии окрашиваются грамположительно.
Наоборот, грамотрицательные бактерии после воздействия спиртом утрачивают краситель, обесцвечиваются и при обработке фуксином окрашиваются в красный цвет вследствие меньшего содержания пептидогликана (1 - 10 % массы клеточной стенки). В состав клеточной стенки бактерий входят семь различных групп химических веществ (табл. 3).
Таблица 3 Химический состав клеточных стенок грамположительных и грамотрицательных бактерий (Rose, 1971 г.; Freer, Salton, 1971 г.)
|
Компоненты клеточной стенки
|
Грамположительные эубактерии
|
Грамотрицательные эубактерии
|
|
|
Внутренний
слой (пептидо-гликановый)
|
Внешний слой
(наружная клеточная мембрана)
|
||
|
Пептидогликан
|
+
|
+
|
-
|
|
Тейхоевые кислоты
|
+
|
-
|
-
|
|
Полисахариды
|
+
|
-
|
+
|
|
Белки
|
±
|
-
|
+
|
|
Липиды
|
±
|
-
|
+
|
|
Липополисахариды
|
-
|
-
|
+
|
|
Липопротеины
|
-
|
±
|
+
|
Примечание. (+) - присутствуют; (-) - отсутствуют; (±) - не у всех.
Клеточные стенки грамположительных и грамотрицательных бактерий резко различаются по химическому составу и по ультраструктуре.
У грамположительных бактерий клеточная стенка толще (от 20 до 80 нм), чем у грамотрицательных, и пептидогликан (синонимы муреин, мукопептид) составляет основную массу ее вещества (от 40 до 90 %). Под электронным микроскопом она выглядит как гомогенный электронно-плотный слой.
Пептидогликан представлен параллельно расположенными молекулами гликана, состоящего из остатков N-ацетилглюкозамина и N-ацетилмурамовой кислоты, соединенных гликозидной связью.
Гликановые молекулы связаны поперечной пептидной связью. Отсюда название этого полимера - пептидогликан. Основу пептидной связи составляют тетрапептиды, состоящие из чередующихся L- и D- аминокислот, например L-аланин - D-глутаминовая кислота - мезодиаминопимелиновая кислота - D-аланин. В пептидогликане грамположительных бактерий вместо мезодиаминопимелиновой кислоты часто содержится L-диаминопимелиновая кислота или лизин. Элементы гликана (ацетилглюкозамин и ацетилмурамовая кислота) и аминокислоты тетрапептида (мезодиаминопимелиновая и D-глутаминовая кислоты, D-аланин) являются отличительной особенностью бактерии, поскольку отсутствуют у животных и человека.
Пептидогликан ковалентно связан с тейхоевыми кислотами (от греч. teichos - стенка). Это уникальный класс химических соединений, представляющих собой полимеры, построенные на основе рибита (пятиатомного спирта), остатки которого соединены между собой фосфодиэфирными связями. Поскольку это длинные линейные молекулы, они пронизывают весь слой пептидогликана, достигая поверхности клеточной стенки, и являются основными антигенами грамположительных бактерий. Остающиеся свободные гидроксилы фосфорной кислоты придают тейхоевой кислоте свойства полианиона, таким образом, они определяют поверхностный заряд клетки. Сахарные компоненты тейхоевых кислот входят в состав рецепторов для некоторых бактериофагов и определяют возможность адсорбции фага на клеточной поверхности.
В клеточной стенке грамположительных бактерий содержится небольшое количество полисахаридов, липидов и белков.
Входящие в состав клеточной стенки полисахариды, липиды могут ковалентно связываться с ее макромолекулами в отличие от белков, которые формируют на ее внешней поверхности отдельный слой.
Таким образом, основными компонентами клеточной стенки грамположительных бактерий являются три типа макромолекул: пептидогликаны, тейхоевые кислоты и полисахариды, которые, ковалентно связываясь, образуют сложную структуру с весьма упорядоченной пространственной организацией.
Строение клеточной стенки у грамотрицательных бактерий намного сложнее. У них обнаружена многослойная клеточная стенка. В ее состав входит гораздо большее число макромолекул разного химического типа (рис. 4). Пептидогликан образует только внутренний слой клеточной стенки, неплотно прилегая к цитоплазматической мембране. Для разных видов грамотрицательных бактерий его содержание колеблется в широких пределах и существенно меньше (5 - 10 %), чем у грамположительных
бактерий. Химическая структура пептидогликана грамотрицательных бактерий в основном сходна со структурой пептидогликана грамположительных бактерий. Снаружи от пептидогликана располагается дополнительный слой клеточной стенки - наружная мембрана. Она состоит из фосфолипидов, типичных для элементарных мембран, белков, липопротеина и липосахарида.
Рис. 4. Схема строения клеточной стенки и цитоплазматической мембраны
Специфическим компонентом наружной мембраны является липополисахарид сложного молекулярного строения, занимающий около 30 - 40 % поверхности и локализованный во внешнем слое. Он состоит из трех компонентов: липида А, базисной части, или ядра, и О-специфической цепи полисахарида, образованной повторяющимися идентичными олигосахаридными последовательностями. Липополисахарид закреплен в наружной мембране липидом А, придающим токсичность липополисахариду, отождествляемому поэтому с эндотоксином. От липида А отходит базисная часть липополисахарида. Наиболее постоянной частью ядра липополисахарида является кетодезоксиоктоновая кислота. О-специфическая цепь, отходящая от ядра липополисахарида, определяет серогруппу, серовар (разновидность бактерий, выявляемая с помощью иммунной сыворотки) выделенного штамма бактерий. Таким образом, с понятием липополисахарида связаны представления об О-антигене, по которому можно дифференцировать бактерии.
Помимо типичной клеточной стенки грамотрицательных бактерий, у некоторых представителей этой группы обнаружены дополнительные слои разной электронной плотности, располагающиеся с внешней стороны от наружной мембраны. Но до настоящего времени не ясно, относятся ли они к клеточной стенке, являясь результатом ее последующего усложнения, или же представляют собой структурные элементы многослойного чехла.
Атипичные клеточные стенки прокариот. У некоторых скользящих бактерий (миксобактерии, флексибактерии), способных в процессе перемещения по твердому субстрату периодически менять форму клеток, например, путем изгибания, была обнаружена нетипичная для грамотрицательных бактерий эластичная клеточная стенка. Объяснением такой гибкости клеточной стенки этих бактерий может быть особенность строения пептидогликанового компонента (низкая сшитость этого компонента клеточной стенки).
У метанобразующих архей клеточные стенки содержат пептидогликан особого химического строения. У других представителей этой группы клеточная стенка состоит исключительно из кислого гетерополисахарида; у некоторых экстремально галофильных, метанобразующих и ацидотермофильных архей - только из белка. Археи с клеточной стенкой белковой природы не окрашиваются по Граму, остальные типы архей дают грамположительную реакцию.
Прокариоты, не имеющие клеточной стенки. Впервые бактерии, не имеющие клеточной стенки, были обнаружены при воздействии на них лизоцимом - ферментом из группы гликозидаз, содержащимся в яичном белке, слюнной жидкости и выделяемом некоторыми бактериями.
Бактерии с частично (сферопласты) или полностью (протопласты) утраченной клеточной стенкой можно получать при воздействии определенными химическими веществами в лабораторных условиях. При нарушении синтеза клеточной стенки бактерий под влиянием фермента лизоцима или пенициллина, а также защитных факторов организма образуются клетки с измененной, часто шаровидной, формой (протопласты).
После удаления ингибитора синтеза клеточной стенки такие измененные бактерии могут реверсировать, то есть приобретать полноценную клеточную стенку и восстанавливать исходную форму.
Бактерии сферопластного или протопластного типа, утратившие способность к синтезу пептидогликана под влиянием антибиотиков или других факторов, но сохранившие способность к размножению, называются L- формами. L-формы могут возникать и в результате мутаций. Они представляют собой осмотически чувствительные шаровидные, колбовидные клетки различной величины, в том числе и проходящие через бактериальные фильтры. L-формы могут образовывать многие бактерии - возбудители инфекционных болезней.
Функции клеточной стенки прокариот многочисленны, разнообразны и очень важны для клетки:
- механическая защита клетки от воздействия окружающей среды;
- поддержание ее внешней формы;
- обеспечение возможности существования в гипотонических растворах;
- транспорт веществ;
- образование периплазматического пространства у грамотрицательных бактерий, заполненного раствором со специфическими транспортными белками и гидролитическими ферментами. У грамположительных бактерий эти ферменты выделяются в окружающую среду, чтобы не происходило самопереваривание собственных молекул.
ЗНАЧЕНИЕ ПОВЕРХНОСТНЫХ КОМПОНЕНТОВ КЛЕТКИ
Все поверхностные компоненты прокариотной клетки имеют большое значение, так как они осуществляют контакт клетки с окружающей средой и позволяют реагировать на внешние воздействия так, чтобы поддерживать собственное существование и выживание в окружающей среде.
Их свойства определяются молекулярным составом цитоплазматической мембраны и клеточной стенки, включая липополисахарид.
Наиболее важные функции, которые осуществляют прокариоты, используя свои поверхностные компоненты:
- образуют барьеры проходимости, которые позволяют осуществлять избирательный проход питательных веществ и исключение вредных веществ;
- вырабатывают "адгезины", которым свойственно прикрепляться к определенным поверхностям или тканям;
- выделяют ферменты, чтобы добиться определенных реакций на поверхности клетки, важной для выживания прокариот;
- выделяют белки, которые могут быть ответом на температуру, осмотическое давление, соленость, свет, кислород, питательные вещества и т.д., или являться сигналом для генома клетки, который даст правильный ответ на новые воздействия окружающей среды.
Область Б - плазматическая мембрана и цитоплазматическая область, которая содержит геном клетки (ДНК) и рибосомы
МЕМБРАНЫ
Химический состав мембран. Мембраны бактерий структурно подобны мембранам клетки эукариот, за исключением того, что бактериальные мембраны состоят из насыщенных и мононенасыщенных жирных кислот (редко полиненасыщенных жирных кислот) с 16 - 18 углеродными атомами и обычно не содержат стерины.
Содержимое клетки отделяется от клеточной стенки цитоплазматической мембраной - обязательным структурным элементом любой клетки, нарушение целостности которого приводит к потере клеткой жизнеспособности. На долю цитоплазматической мембраны приходится 8 - 15 % сухого вещества клетки. У большинства прокариот цитоплазматическая мембрана является единственной мембраной. В клетках фототрофных и ряда хемотрофных прокариот содержатся также мембранные структуры, располагающиеся в цитоплазме и получившие название внутриплазматических мембран. Их происхождение и функции будут рассмотрены ниже.
Цитоплазматическая мембрана - белково-липидный комплекс, который составляют 50 - 75 % белков, от 15 до 45 % липидов и небольшое количество углеводов. Липиды и белки составляют 95 % и более вещества мембран. Главным липидным компонентом бактериальных мембран являются фосфолипиды - производные 3-фосфоглицерина. Хотя у прокариот найдено множество различных фосфолипидов, набор их в значительной степени родо- и даже видоспецифичен. Широко представлены в бактериальных мембранах различные гликолипиды. Стерины отсутствуют у большинства прокариот, за исключением представителей группы микоплазм и некоторых бактерий. Так, в ЦПМ Acholeplasma содержится 10 - 30 % холестерина, поглощаемого из внешней среды, от общего содержания мембранных липидов. Из других групп липидов в мембранах обнаружены каротиноиды, хиноны, углеводы.
Все липиды бактерий - производные глицерина - содержат один или несколько остатков жирных кислот, состав которых своеобразен. Полиненасыщенные жирные кислоты у бактерий отсутствуют. Исключение составляют цианобактерии, у разных видов которых найдены полиненасыщенные жирные кислоты типа С16:2, С18:2, С18:3, С18:4. Помимо обычных жирных кислот, то есть обнаруживаемых и в клетках эукариот, в составе мембранных липидов бактерий находят и кислоты, не встречающиеся, как правило, в мембранах эукариот.
Набор жирных кислот в мембранных липидах также чрезвычайно видоспецифичен. У некоторых грамположительных бактерий С15-жирная кислота с разветвленной цепью может составлять до 90 % всех жирных кислот липидов. Главная функция липидов - поддержание механической стабильности мембраны и придание ей гидрофобных свойств.
Особый состав липидов обнаружен в мембранах архей. У них не найдены типичные для бактерий эфиры глицерина и жирных кислот, но присутствуют эфиры глицерина и высокомолекулярных С20-, С40-спиртов, а также нейтральные изопреноидные С20-, С30-углеводороды.
На долю белков приходится больше половины сухой массы мембран. К мембранам с наиболее высоким содержанием белка относятся бактериальные цитоплазматические мембраны. Цитоплазматическая мембрана E.coli содержит 27 основных белков и множество минорных белков, но ни один из основных белков не присутствует в преобладающих количествах. Поскольку цитоплазматическая мембрана прокариот многофункциональна и участвует в осуществлении разнообразных ферментативных процессов, был сделан вывод, что мембранные белки - это, как правило, ферменты. По аминокислотному составу мембранные белки не отличаются от других клеточных белков, за исключением того, что в них содержится мало цистеина. Некоторые из них являются пермеазами, участвующими в транспорте веществ.
В некоторых бактериальных мембранах в значительных количествах обнаружены углеводы. По-видимому, они содержатся не в свободном состоянии, а входят в состав гликолипидов и гликопротеинов.
Структура мембран. Мембранные липиды всех эукариот и части архей образуют бислои, в которых гидрофильные «головы» молекул обращены наружу, а гидрофобные «хвосты» погружены в толщу мембраны. Углеродные цепочки, прилегающие к гидрофильным «головам», довольно жестко фиксированы, а более удаленные части «хвостов» обладают достаточной гибкостью. У некоторых архей (ряд метаногенов, термоацидофилов) мембранные липиды, в состав которых входит С40-спирт, формируют монослойную мембрану, по толщине равную бислойной. Монослойная липидная мембрана обладает большей жесткостью по сравнению с бислойной. При «биологических» температурах мембранные липиды находятся в жидкостно-кристаллическом состоянии, характеризующемся частичной упорядоченностью структуры. При понижении температуры они переходят в квазикристаллическое состояние. Чем более ненасыщены и разветвлены остатки жирных кислот или чем большее число циклических группировок они содержат, тем ниже температура перехода из жидкостно-кристаллического состояния в квазикристаллическое.
«Жидкая» структура мембран обеспечивает определенную свободу молекул белков, что необходимо для осуществления процессов транспорта электронов и веществ через мембрану. Это же свойство обусловливает высокую эластичность мембран: они легко сливаются друг с другом, растягиваются и сжимаются.
В отличие от липидов у мембранных белков нет единого способа структурной организации. 30 - 50 % белка имеет конфигурацию α-спирали, остальная часть находится преимущественно в виде беспорядочного клубка. В зависимости от расположения в мембране и характера связи с липидным слоем мембранные белки условно можно разделить на три группы: интегральные, периферические и поверхностные. Интегральные белки полностью погружены в мембрану, а иногда пронизывают ее насквозь. Связь интегральных белков с мембранными липидами очень прочна и определяется главным образом гидрофобными взаимодействиями. Периферические белки частично погружены в гидрофобную область, а поверхностные находятся вне еѐ. В первом случае связь с липидами в основном определяется, а во втором - исключительно определяется электростатическими взаимодействиями. Помимо этого некоторые белки и липиды в мембране могут быть связаны ковалентно.
Одна из функций основных белков - формирование в мембране гидрофильных диффузионных пор диаметром примерно 1 нм, через которые осуществляется неспецифическая диффузия молекул массой до 600 - 900 Да. То есть через такие поры могут проходить сахара, аминокислоты, небольшие олигосахариды и пептиды. Белки, пронизывающие наружную мембрану насквозь и образующие гидрофильные поры, называют поринами. Минорные белки выполняют специфические функции: участвуют в облегченной диффузии, активном транспорте веществ и являются специфическими рецепторами для фагов. Примером минорных белков могут служить белки, ответственные за специфический транспорт в клетку железосодержащих соединений.
Существует несколько моделей строения мембраны. Наибольшее признание получила модель, учитывающая основные данные, известные о мембранах, согласно которой в липидную основу включены асимметрично расположенные белковые молекулы (см. рис. 4). Некоторые из них образуют скопления на поверхностях липидного би- или монослоя, другие частично или полностью погружены в него, третьи пронизывают его насквозь. В модели подчеркнута асимметрия строения мембраны, основанная на различиях в химическом строении и расположении молекул белка.
При избыточном росте по сравнению с ростом клеточной стенки цитоплазматическая мембрана образует инвагинаты, то есть впячивания в виде сложно закрученных мембранных структур, называемых мезосомами. Менее сложно закрученные структуры называются внутриплазматическими мембранами (ВПМ). Среди ВПМ выделяют несколько видов (табл. 4).
Таблица 4 Мембраны прокариот
|
Прокариоты
|
Физио-логические группы
|
Мембраны
|
||||
|
Наружная клеточная
|
Цитоплазма- тическая
|
Внутриплазматические
|
||||
|
Фото-синтетические
|
Мезо-сомальные
|
прочие
|
||||
|
Грамположительные
|
Хемотрофы
|
-
|
+
|
-
|
±
|
±
|
|
Грамотрицательные
|
Фототрофы
|
±
|
+
|
±
|
±
|
-
|
|
Хемотрофы
|
±
|
+
|
-
|
±
|
±
|
|
Примечание. (+) - присутствуют; (-) - отсутствуют; (±) - не у всех.
Роль мезосом и внутриплазматических мембран до конца не выяснена. Полагают, что они участвуют в делении клетки, обеспечивая энергией синтез клеточной стенки, а также в секреции веществ, спорообразовании, то есть в процессах, сопровождающихся большой затратой энергии.
Функции цитоплазматической мембраны прокариот разнообразны и жизненно важны для клетки:
- содержит ферменты, катализирующие конечные этапы синтеза мембранных липидов, компонентов клеточной стенки и некоторых других веществ, участвует в синтезе компонентов клеточной стенки;
- играет важную роль в превращениях клеточной энергии. У бактерий, источником энергии для которых служат процессы дыхания или фотосинтеза, в цитоплазматической мембране расположены переносчики цепи электронного транспорта, функционирование которых приводит к генерированию энергии, используемой затем в клетке по разным каналам, в том числе и для образования энергии в форме АТФ. Содержит значительное количество ферментов, системы переноса электронов и является местом генерации энергии у бактерий;
- обеспечивает избирательное поступление в клетку и выход из нее разнообразных веществ и ионов. Осуществляется это с использованием разных механизмов мембранного транспорта. Выделяют 4 типа транспортных систем, с участием которых происходит проникновение молекул в бактериальную клетку: пассивную диффузию, облегченную диффузию, активный транспорт и перенос химически модифицированных молекул (транслокация групп);
- участвует в регуляции роста и клеточного деления;
- участвует в регуляции процессов репликации и сегрегации хромосом и плазмид (они связаны с ее рецепторами);
- с ней связаны жгутики и аппарат регуляции их движения;
- участвует в компартментализации и стабилизации рибосом;
- участвует в образовании мезосом (участки инвагинации в цитоплазму, они открыты в периплазматическое пространство).
ПЕРИПЛАЗМАТИЧЕСКОЕ ПРОСТРАНСТВО
Периплазматическое пространство, или периплазма, находится между цитоплазматической мембраной и внутренним слоем пептидогликана, ширина его у грамположительных бактерий 10 нм. Поры, содержащиеся в клеточной стенке, открываются в периплазматическое пространство. В него открыты мезосомы. Оно играет роль во взаимодействии цитоплазматической мембраны и клеточной стенки, в нем содержатся различные ферменты (например, фосфатазы), олигосахариды и др.
ЦИТОПЛАЗМА
Это сложная коллоидная система, в ней нет эндоплазматического ретикулума и других органелл, свойственных эукариотам, она неподвижна. Цитоплазма бактерий занимает основной объем клетки и состоит из растворимых белков. У некоторых видов есть микротрубочки - рапидосомы, сходные с микротрубочками простейших, и три типа органелл, окруженных белковыми мембранами: газовые пузырьки (у водных прокариот - цианобактерий); хлоробиум-везикулы (аппарат фотосинтеза у фотосинтезирующих); карбоксисомы, которые содержат фермент карбоксидисмутазу, необходимый для фиксации СО2 в процессе фотосинтеза.
В цитоплазме располагается ядерный аппарат - генофор (нуклеоплазма), который не отделен мембраной. Кроме хромосомы имеются плазмиды, иногда целый комплекс. Хромосома и плазмиды связаны со специфическими рецепторами цитоплазматической мембраны. В ней располагаются рибосомы и все компоненты белоксинтезирующей системы.
В цитоплазме содержатся различные макромолекулы (тРНК, аминокислоты, нуклеотиды и др.), могут быть мезосомы, которые участвуют в энергетическом обмене, формировании межклеточной перегородки при делении, спорообразовании и др., включения: капельки нейтральных липидов, воска, серы, полисахариды, поли-β-масляная кислота и полифосфаты (волютин). Они накапливаются при избытке питательных веществ в окружающей среде и выполняют роль запасных веществ для питания и энергетических потребностей. Зерна волютина выявляются у дифтерийной палочки в виде интенсивно окрашивающихся полюсов клетки.
Цитоплазматические элементы бактерий неизменно включают прокариотическую хромосому и рибосомы. Хромосома - обычно одна большая молекула ДНК, замкнутая в кольцо, более или менее свободно лежащая в цитоплазме. Прокариоты иногда обладают небольшими внехромосомными циклическими ДНК, названными плазмидами.
В цитоплазме прокариот рибосомы отчетливо видны в форме гранул. Рибосомы бактерий имеют коэффициент седиментации 70S (состоят из 50S и 30S субъединиц) в отличие от рибосом, характерных для эукариотических клеток, у которых коэффициент седиментации 80S (60S и 40S). Поэтому некоторые антибиотики, действие которых основано на подавлении синтеза белка путем связывания их с рибосомами бактерий, не оказывают влияния на синтез белка эукариотических клеток.
Функция рибосом состоит в участии в процессе трансляции генетической информации с мРНК при синтезе белка. Синтез белка с помощью 70S-рибосомы происходит в митохондриях эукариотических клеток и хлоропластах, что является главным аргументом в поддержку точки зрения о том, что эти органеллы произошли от прокариот.
ГЕНЕТИЧЕСКИЙ АППАРАТ
Генетический аппарат, или нуклеоид, является эквивалентом ядра у бактерий. У прокариот это более компактное образование (диаметром около 2 нм), занимающее центральную область в цитоплазме и не отделенное от нее мембраной.
ДНК прокариот имеет существенные отличия в структурной организации от эукариотной ДНК: нуклеоид бактерий не имеет ядерной оболочки, ядрышка и основных белков (гистонов).
Вся ДНК клетки (и хромосомная, и плазмидная) образует геном клетки. В течение роста клетки и еѐ деления прокариотная хромосома копируется обычным полуконсервативным способом прежде, чем произойдет еѐ распределение по дочерним клеткам. Однако процессы мейоза и митоза у прокариот отсутствуют. Репликация и сегрегация (разделение) прокариотной ДНК координируются мембраной, возможно мезосомами. Обычно в бактериальной клетке содержится одна хромосома, но часто в экспоненциально растущей культуре количество ДНК может достигать массы 3, 4, 8 и более хромосом. Нередко в клетках при действии на них определенных факторов (температуры, рН среды, ионизирующего излучения, солей тяжелых металлов, некоторых антибиотиков и др.) происходит образование множества копий хромосомы. При устранении воздействия этих факторов, а также после перехода в стационарную фазу в клетках, как правило, обнаруживается по одной копии хромосомы.
Нуклеоид выявляется в световом микроскопе после окраски специфическими для ДНК методами по Фельгену или Гимзе.
На электронных микроскопических фотографиях ультратонких срезов бактерий нуклеоид имеет вид светлых зон с фибриллярными, нитевидными структурами ДНК. Несмотря на отсутствие ядерной мембраны, нуклеоид довольно четко отграничен от цитоплазмы.
Длина молекулы в развернутом виде может достигать более 1 мм, то есть почти в 1000 раз превышать длину бактериальной клетки. Длительное время считали, что в распределении нитей хромосомы бактериальной ДНК не прослеживается никакой закономерности. Однако, если исходить из того, что молекула ДНК образует беспорядочный клубок, трудно объяснить процесс репликации и последующее распределение образовавшихся хромосом по дочерним клеткам. Было установлено, что хромосомы прокариот представляют собой высокоупорядоченную структуру, имеющую константу седиментации 1300 - 2000S для свободной и 3200 - 7000S для связанной с мембраной формы. В том и другом случае часть ДНК в этой структуре представлена системой из 20 - 100 независимо суперспирализованных петель. В обеспечении суперспирализованной организации хромосом участвуют молекулы РНК. Хромосомы большинства прокариот имеют молекулярную массу в пределах 1-10 - 3-10 Да. В группе микоплазм генетический материал представлен молекулами, имеющими наименьшее для клеточных организмов количество ДНК 0,4-109 - 0,8-109 Да, а наибольшее со- держание ДНК обнаружено у нитчатых цианобактерий 8-109 Да.
Молекула ДНК несет множество отрицательных зарядов, поскольку каждый фосфатный остаток содержит ионизированную гидроксильную группу. У эукариот отрицательные заряды нейтрализуются образованием комплекса ДНК с основными белками - гистонами. В клетках подавляющего большинства прокариот не обнаружено гистонов, поэтому нейтрализация зарядов осуществляется взаимодействием ДНК с полиаминами (спермином и спермидином), а также с ионами Mg2+ . В последнее время у некоторых архебактерий и цианобактерий обнаружены гистоны и гистоноподобные белки, связанные с ДНК. Содержание пар оснований А+Т и Г+Ц в молекуле ДНК является постоянным для данного вида организма и слу- жит важным диагностическим признаком. У прокариот молярная доля ГЦ в ДНК колеблется в очень широких пределах: от 23 до 75 %.
ПОКОЯЩИЕСЯ КЛЕТКИ
Некоторые прокариоты наряду с вегетативными формами образуют и покоящиеся формы - цисты и споры
ЦИСТЫ
Цисты образуют бактерии рода Azotobacter, группы Спирохеты, рода Myxococcus, рода Rickettsia и др. У большинства миксобактерий образование цист, называемых также миксоспорами, - закономерная стадия их жизненного цикла (рис. 5, а). После окончания стадии активного размножения клетки миксобактерий собираются вместе и образуют структуры наподобие плодовых тел, представляющие собой массу слизи, в которую погружены клетки, или дифференцированные структуры, поднимающиеся над поверхностью субстрата на простых или разветвленных стебельках (рис. 5, б).
Рис. 5. Цикл развития и плодовые тела некоторых миксобактерий: а - цикл развития Myxococcus: 1 - активно размножающиеся вегетативные клетки; 2 - скопление клеток, предшествующее образованию плодового тела; 3 - плодовое тело; 4 - миксоспоры; б - плодовые тела: 1 - Myxococcus; 2 - Choпdromyces (по Schlegel, 1972 г.) [8]
Внутри плодовых тел клетки переходят в покоящееся состояние. У одних видов цисты могут морфологически не отличаться от вегетативных клеток, у других их образование сопровождается заметными морфологическими и структурными изменениями: происходит утолщение стенки вегетативной клетки, в результате чего формируются оптически плотные, более сильно преломляющие свет, окруженные капсулой укороченные палочки или сферические формы (рис. 6, а). Образование миксоспор сопровождается синтезом белка, так что сформированная миксоспора содержит около 1/3 заново синтезированного белка. ДНК не синтезируется, а переходит из исходных вегетативных клеток. Генетический аппарат миксоспор может быть представлен тремя или четырьмя копиями хромосомы вегетативной клетки.
Цисты миксобактерий более устойчивы к нагреванию, высушиванию, различным физическим воздействиям, чем вегетативные клетки.
У азотобактера образование цист сопровождается изменением морфологии клетки, потерей жгутиков и накоплением в цитоплазме в больших количествах гранул поли-β-оксимасляной кислоты; одновременно происходит синтез дополнительных клеточных покровов: внешних (экзина) и внутренних (интина) по отношению к клеточной стенке (рис. 6, б), различающихся структурно и химическим составом.
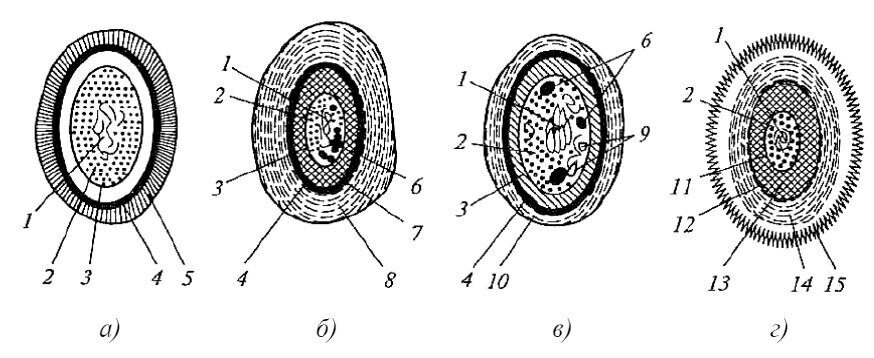
Рис. 6. Строение покоящихся форм прокариот: а - миксоспоры миксобактерий; б - цисты азотобактера; в - акинеты цианобактерий; г - эндоспоры; 1 - нуклеоид; 2 - цитоплазма; 3 - цитоплазматическая мембрана; 4 - клеточная стенка; 5 - капсула; 6 - гранулы запасных веществ; 7 - внутренние покровы (интина); 8 - внешние покровы (экзина); 9 - тилакоиды; 10 чехол; 11 внутренняя мембрана споры; 12 - наружная мембрана споры; 13 - кортекс; 14 - покровы споры, состоящие из нескольких слоев; 15 - экзоспориум (по Дуде, Пронину, 1981 г.) [8]
АКИНЕТЫ
Покоящимися клетками некоторых цианобактерий, обладающими повышенной устойчивостью к ряду неблагоприятных факторов (высушиванию, пониженным температурам), являются акинеты. Они, как правило, заметно крупнее вегетативных клеток, имеют продолговатую или сферическую форму, гранулированное содержимое и толстую оболочку. Образование акинет происходит в период замедления роста и начинается с увеличения клеточных размеров, при этом в цитоплазме накапливаются гранулы запасных веществ (гликогеновых, полифосфатных и особенно крупных цианофициновых), а также карбоксисом. Одновременно происходит утолщение пептидогликанового слоя клеточной стенки и уплотнение слизистого чехла за счет отложения в нем электронно-плотного фибриллярного материала полисахаридной природы (рис. 6, в). Оболочки акинет содержат больше липидов и полисахаридов, а цитоплазма - меньше воды, чем вегетативные клетки. В цитоплазме при формировании акинет отмечается увеличение содержания ДНК, рибосом, но уменьшение количества хлорофилла и фикобилиновых пигментов. Тилакоиды образуют сложную сетчатую структуру. Скорость фотосинтеза в акинетах ниже, а дыхание выше, чем в вегетативных клетках. Прорастание акинет происходит иногда вскоре после их образования или только после перенесения в свежую питательную среду и может осуществляться двумя путями: иногда в акинете на одном из полюсов формируется пора, через которую выходит проросток, или же прорастание происходит в результате разрыва оболочки акинеты.
ЭНДОСПОРЫ
Образование эндоспор - процесс, имеющий место только в мире прокариот. Бактериальные эндоспоры - это особый тип покоящихся клеток грамположительных эубактерий, формирующихся эндогенно, то есть внутри цитоплазмы «материнской» клетки (спорангия). Эндоспоры обладают специфическими структурами (многослойными белковыми покровами, наружной и внутренней мембранами, кортексом) и устойчивостью к высоким температурам и дозам радиации, летальным в норме для вегетативных клеток (рис. 6, г). Эндоспорам свойственно также и особое физическое состояние протопласта.
К спорообразующим относится большое число бактерий приблизительно из 15 родов, характеризующихся морфологическим и физиологическим разнообразием (табл. 5).
Спорообразование, форма и расположение спор в клетке (вегетативной) являются видовым свойством бактерий, что позволяет отличать их друг от друга. Форма спор может быть овальной, шаровидной; расположение в клетке: терминальное - на конце палочки (возбудитель столбняка), субтерминальное - ближе к концу палочки (возбудитель ботулизма, газовой гангрены) и центральное (сибиреязвенная бацилла).
Таблица 5 Бактерии, образующие споры (по Дуде, 1982 г.) [8]
|
Род бактерий
|
Форма вегетативных клеток
|
Окраска
по Граму
|
Отношение
к
кислороду
|
|
Bacillus
|
Палочковидная
|
±
|
Аэробы
|
|
Clostridium
|
»
|
±
|
Анаэробы
|
|
Desulfotomaculum
|
»
|
-
|
»
|
|
Sporolactobacillus
|
»
|
+
|
Аэробы
|
|
Sulfobacillus
|
»
|
-
|
»
|
|
Sporosarciпa
|
Сферическая
|
+
|
»
|
|
Thermoactiпomyces
|
Ветвящиеся нити
|
+
|
»
|
|
Actiпobifida
|
»
|
+
|
»
|
|
Sporospirillum
|
Спириллы
|
-
|
Анаэробы
|
|
Ostillospira
|
Дисковидные клетки
в трихомах
|
-
|
»
|
|
Fusosporus
|
Спириллы
|
-
|
»
|
Примечание: (+) - присутствуют; (-) - отсутствуют; (±) - не у всех.
Споры образуются при неблагоприятных условиях существования бактерий, сопровождающихся высушиванием, дефицитом питательных веществ и т.д., при этом внутри одной бактерии образуется одна спора. Поэтому образование спор способствует сохранению вида и не является способом размножения, как у грибов. Спорообразующие аэробные бактерии, у которых размер споры не превышает диаметра клетки, называются бациллами, а спорообразующие анаэробные бактерии, у которых размер споры превышает диаметр клетки, и они поэтому принимают форму веретена, называются клостридиями (от лат. clostridium - веретено).
Процесс спорообразования проходит ряд стадий (рис. 7), в течение которых часть цитоплазмы и хромосома отделяются, окружаясь цитоплазматической мембраной; образуется проспора. На следующей стадии между двумя мембранами, покрывающими проспору, формируется толстый слой кортекса (коры). Спорообразование сопровождается интенсивным потреблением проспорой, а затем формирующейся оболочкой споры дипиколиновой кислоты и ионов кальция. Сформировавшаяся эндоспора состоит из протопласта с нуклеоидом, стенки споры, кортекса, оболочки и экзоспория.
Протопласт споры (ядро) содержит цитоплазматическую мембрану, цитоплазму, хромосому, все компоненты белоксинтезирующей и анаэробной энергообразующей систем.
Стенка споры непосредственно окружает ее внутреннюю мембрану и представлена пептидогликаном, из которого формируется клеточная стенка прорастающей клетки.

Рис. 7. Формирование эндоспоры: I - вегетативная клетка; II - инвагинация цитоплазматической мембраны; III - образование споровой перегородки (септы); IV - формирование двойной мембранной системы образующейся проспоры; V - сформированная проспора; VI- формирование кортекса; VII - формирование покровов споры; VIII - лизис материнской клетки; IX- свободная зрелая спора; X - прорастание споры; 1 - нуклеоид; 2 - цитоплазма; 3 - цитоплазматическая мембрана; 4 - клеточная стенка; 5 - споровая перегородка; 6 - наружная мембрана споры; 7 - внутренняя мембрана споры; 8 - кортекс; 9 - покровы споры (по Дуде, 1974 г.) [8]
Кортекс - самый толстый слой оболочки споры. Он состоит из пептидогликана, содержащего мало поперечных сшивок и поэтому очень чувствительного к лизоциму. Разрушение кортекса лизоцимом играет пусковую роль в процессе прорастания споры.
Оболочка споры построена из кератиноподобного белка. Ее плохая проницаемость определяет высокую устойчивость спор к действию различных химических веществ.
Экзоспорий - липопротеиновая оболочка, содержащая немного углеводов. После завершения спорообразования вегетативная часть клетки отмирает, спора высвобождается и длительное время сохраняется в окружающей среде до тех пор, пока не возникнут условия, благоприятные для ее прорастания.
Специфические элементы споры, включая многослойную оболочку и дипиколинат кальция, обусловливают ее свойства: она долго может сохраняться в почве, например возбудители сибирской язвы и столбняка - десятки лет. В благоприятных условиях они прорастают, проходя три стадии: активацию, инициацию, вырастание. При этом из одной споры образуется одна бактерия. Активация - готовность к прорастанию. Она ускоряется при прогревании при температуре 60 - 80 °С. Инициация прорастания длится несколько минут. Вырастание характеризуется быстрым ростом, сопровождающимся разрушением оболочки споры и выходом проростка.
Споры сильно преломляют свет, поэтому хорошо заметны в неокрашенных препаратах.
Генетический контроль спорообразования обеспечивается более чем 40 оперонами, которые представляют дополнительный геном у спорообразующих бактерий. В его составе - до 60 генов. Инициация споруляции связана с геном spoO, мутации в котором делают невозможным образование споры с самых начальных стадий. Транскрипция этого гена запускает последовательную транскрипцию всех оперонов спорового генома. Споро- образующие бактерии обладают механизмами, с помощью которых они распознают определенные изменения в окружающей среде, например уменьшение содержания источников энергии, некоторых аминокислот и др. В ответ в клетке происходят метаболические изменения, которые и запускают споруляцию. Одна из особенностей споруляции состоит в том, что на определенном этапе (приблизительно на 3-м часу) происходит синтез небольших кислоторастворимых белков. На их долю приходится около 10 - 12 % всех белков споры. В спорах они связываются с ДНК, обеспечивая устойчивость к УФ-облучению. В момент прорастания споры эти белки гидролизуются и тем самым снабжают прорастающую спору необходимыми аминокислотами.
Прорастание споры происходит тогда, когда она получает химический сигнал. Различные виды спорообразующих бактерий располагают рецепторами, распознающими наличие в среде источников энергии, L-аланина, аденозина и др. Связывание с такими эффекторами активирует автолизин (лизоцим), содержащийся в споре, который быстро разрушает пептидогликан кортекса.
Прорастание спор включает три стадии:
Активация является обязательным условием прорастания. Она осуществляется различными воздействиями - кислой средой, веществами, содержащими свободные сульфгидрильные группы, повышением температуры, механическим повреждением спор.
Начальная стадия. Под влиянием внешних эффекторов происходит активация автолизина, который разрушает пептидогликан кортекса, в спору поступает вода, спора высвобождается от дипиколината кальция, под воздействием гидролитических ферментов разрушаются другие ее компоненты.
Стадия роста. После разрушения кортекса и наружных слоев споры из нее появляется («выклевывается») растущая новая вегетативная клетка. Она состоит из протопласта споры и ее клеточной стенки. В ней активизируются биосинтетические процессы; в результате новая вегетативная клетка при наличии необходимых питательных веществ удваивает свою биомассу и делится на две дочерние клетки, которые далее активно размножаются, пока этому способствуют условия среды. Процесс прорастания споры контролируется генами как спорового, так и вегетативного генома.
Область В - запасные питательные вещества и внутрицитоплазматические включения
ВНУТРИЦИТОПЛАЗМАТИЧЕСКИЕ ВКЛЮЧЕНИЯ
В цитоплазме прокариот обнаруживаются различные включения. Одни из них следует рассматривать как активно функционирующие структуры, другие - как продукты клеточного метаболизма, не выделяющиеся наружу, но откладывающиеся внутри клетки. Некоторые цитоплазматические включения имеют явно приспособительное значение. И наконец, многие из них являются запасными веществами, отложение которых клеткой происходит в условиях избытка питательных веществ в окружающей среде, а потребление наблюдается, когда организм попадает в условия голодания.
К числу внутрицитоплазматических включений, выполняющих определенную функцию в фотосинтезе, относят хлоросомы зеленых бактерий и фикобилисомы цианобактерий. В этих структурах локализованы пигменты, поглощающие кванты света и передающие их в реакционные центры, то есть выполняющие роль антенны. Хлоросомы имеют форму продолговатых пузырьков длиной 90 - 150 и шириной 25 - 70 нм, окруженных однослойной электронно-плотной мембраной толщиной 2 - 3 нм, построенной только из белка. Они располагаются в непосредственной близости от ЦПМ, плотно к ней примыкая. В хлоросомах локализованы бактериохлорофиллы с, d или е. Водорастворимые пигменты белковой природы (фикобилипротеины) цианобактерий содержатся в особых структурах - фикобилисомах, расположенных правильными рядами на внешних поверхностях фотосинтетических мембран и под электронным микроскопом имеющих вид гранул диаметром 28 - 55 нм.
Карбоксисомы состоят из частиц рибулозодифосфаткарбоксилазы - фермента, катализирующего фиксацию СО2 на рибулозодифосфате в восстановительном пентозофосфатном цикле. До настоящего времени окончательно не выяснено, в какой форме находится фермент в карбоксисомах: в инертном или функционирующем состоянии. Имеются данные, что в активно растущей культуре больше фермента находится в растворимой форме. При переходе в стационарную фазу увеличивается доля рибулозодифосфаткарбоксилазы в составе карбоксисом. Эти данные указывают на возможную роль карбоксисом как структур, обеспечивающих защиту фермента от воздействия внутриклеточными протеазами и его консервирование.
К внутриплазматическим включениям, имеющим приспособительное значение, относятся магнитосомы, газовые вакуоли, или аэросомы, обнаруженные у водных прокариот. Газовые вакуоли найдены у представителей 15 таксономических групп. Это сложноорганизованные структуры, напоминающие пчелиные соты. Состоят из множества газовых пузырьков, каждый из которых окружен однослойной белковой мембраной и заполнен газом, идентичным газу окружающей среды. Мембраны газовых пузырьков проницаемы для газов, но не проницаемы для воды.
§ 2.3. Морфология вирусов
Вирусы относятся к царству Vira. Это мельчайшие микроорганизмы, не имеющие клеточного строения, белоксинтезирующей системы, содержащие только один тип нуклеиновой кислоты (ДНК или РНК). Они отличаются особым разобщенным (дисъюнктивным) способом размножения (репродукции): в клетке отдельно синтезируются нуклеиновые кислоты вирусов и их белки и затем происходит их сборка в вирусные частицы. Вирусы, являясь облигатными внутриклеточными паразитами, размножаются в цитоплазме или ядре клетки. Сформированная вирусная частица называется вирионом.
Морфологию и структуру вирусов изучают с помощью электронного мик- роскопа, так как их размеры малы и сравнимы с толщиной оболочки бактерий.
Форма вирионов может быть различной: палочковидной (вирус табачной мозаики), пулевидной (вирус бешенства), сферической (вирусы полиомиелита, ВИЧ), в виде сперматозоида (многие бактериофаги) (рис. 8).

Рис. 8. Формы вирионов: 1 - вирус оспы; 2 - вирус герпеса; 3 - аденовирус; 4 - паповавирус; 5 - гепаднавирус; 6 - парамиксовирус; 7 - вирус гриппа; 8 - коронавирус; 9 - аренавирус; 10 - ретровирус; 11 - реовирус; 12 - пикорнави-рус; 13 - вирус бешенства; 14 - тогавирус, флавовирус; 15 - буньявирус
Размеры вирусов определяют с помощью электронной микроскопии, методом ультрафильтрации через фильтры с известным диаметром пор, методом ультрацентрифугирования. Одними из самых мелких вирусов являются вирусы полиомиелита и ящура (около 20 нм), цирковирусы (16 нм), наиболее крупным - вирус натуральной оспы (около 350 нм). Вирусы имеют уникальный геном, так как содержат либо ДНК, либо РНК. Поэтому различают ДНК-содержащие и РНК-содержащие вирусы. Они обычно гаплоидны, то есть имеют один набор генов. Геном вирусов представлен раз- личными видами нуклеиновых кислот: двунитчатыми, однонитчатыми, линейными, кольцевыми, фрагментированными.
Среди РНК-содержащих вирусов различают вирусы с положительным (плюс-нить РНК) геномом. Плюс-нить РНК этих вирусов выполняет наследственную функцию и функцию информационной РНК (иРНК). Имеются также РНК-содержащие вирусы с отрицательным (минус-нить РНК) геномом. Минус-нить РНК этих вирусов выполняет только наследственную функцию. Геном вирусов способен включаться в состав генетического аппарата клетки в виде провируса, проявляя себя генетическим паразитом клетки. Нуклеиновые кислоты некоторых вирусов (вирусы герпеса и др.) могут находиться в цитоплазме инфицированных клеток, напоминая плазмиды.
Различают просто устроенные (например, вирус полиомиелита) и сложно устроенные (например, вирусы гриппа, кори) вирусы. У просто устроенных вирусов нуклеиновая кислота связана с белковой оболочкой, называемой капсидом (от лат. capsa - футляр). Капсид состоит из повторяющихся морфологических субъединиц - капсомеров. Нуклеиновая кислота и капсид, взаимодействуя друг с другом, образуют нуклеокапсид. У сложно устроенных вирусов капсид окружен дополнительной липопротеидной оболочкой - суперкапсидом (производное мембранных структур клетки-хозяина), имеющим «шипы». Капсид и суперкапсид защищают вирионы от влияния окружающей среды, обусловливают избирательное взаимодействие (адсорбцию) с клетками, определяют антигенные и иммуногенные свойства вирионов. Внутренние структуры вирусов называют сердцевиной.
Для вирионов характерен спиральный, кубический и сложный типы симметрии капсида. Спиральный тип симметрии обусловлен винтообразной структурой нуклеокапсида, кубический - образованием изометрического полого тела из капсида, содержащего вирусную нуклеиновую кислоту.
Кроме обычных вирусов, известны и так называемые неканонические вирусы - прионы - белковые инфекционные частицы, имеющие вид фибрилл размером 10-20 х 100 - 200 нм. Прионы, по-видимому, являются одновременно индукторами и продуктами автономного гена человека или животного и вызывают у них энцефалопатии в условиях медленной вирусной инфекции (болезни Крейтцфельдта - Якоба, куру и др.). Другими необычными агентами, близкими к вирусам, являются вироиды - небольшие молекулы кольцевой, суперспирализованной РНК, не содержащие белка, вызывающие заболевания у растений.
Глава 3. ФИЗИОЛОГИЯ МИКРООРГАНИЗМОВ
Физиология микроорганизмов изучает жизнедеятельность микробных клеток, процессы их питания, дыхания, роста, размножения, закономерности взаимодействия с окружающей средой.
§ 3.1. Химический состав прокариотной клетки
Клетки прокариот содержат воду, белки, нуклеиновые кислоты, углеводы, липиды, минеральные вещества (табл. 6).
Вода — основной компонент бактериальной клетки, составляющий около 70 - 90 % ее массы. Она находится в свободном или связанном состоянии со структурными элементами клетки. В спорах количество воды уменьшается до 18 - 20 %. Вода является растворителем для многих веществ, а также выполняет механическую роль в обеспечении тургора. При плазмолизе - потере клеткой воды в гипертоническом растворе - происходит отслоение протоплазмы от клеточной оболочки. Удаление воды из клетки, высушивание приостанавливают процессы метаболизма. Большинство микроорганизмов хорошо переносят высушивание. При недостатке воды они не размножаются. Высушивание в вакууме из замороженного состояния (лиофилизация) прекращает размножение и способствует длительному сохранению микробных особей. Остальные компоненты составляют 10 - 30 % сухой массы клетки.
Белки определяют важнейшие биологические свойства бактерий и состоят обычно из сочетаний 20 аминокислот. В состав бактерий входит диаминопимелиновая кислота (ДАП), отсутствующая в клетках человека и животных. Бактерии содержат более 2000 различных белков, находящихся в структурных компонентах и участвующих в процессах метаболизма. Большая часть белков обладает ферментативной активностью. Белки бактериальной клетки обусловливают антигенность и иммуногенность, вирулентность, видовую принадлежность бактерий.
Нуклеиновые кислоты бактерий выполняют функции, аналогичные функциям нуклеиновых кислот эукариотических клеток: молекула ДНК в виде хромосомы отвечает за наследственность, рибонуклеиновые кислоты (информационная, или матричная, транспортная и рибосомная) участвуют в биосинтезе белка. Бактерии можно характеризовать (таксономически) по содержанию суммы гуанина и цитозина (ГЦ) в молярных процентах (мол. %) от общего количества оснований ДНК. Более точной характеристикой микроорганизмов является гибридизация их ДНК. Основа метода гибридизации ДНК - способность денатурированной (однонитчатой) ДНК ренатурироваться, то есть соединяться с комплементарной нитью ДНК и образовывать двухцепочечную молекулу ДНК.
Таблица 6 Химический состав E.coli (по Neidhardt, 1987 г.)
|
Химический компонент
|
Общее коли- чество, в % от сухого вещества
|
Молекулярная масса, Да
|
Количество молекул в клетке
|
Число разных видов молекул в клетке
|
|
Белок
|
55,0
|
4,7-104
|
2 350 000
|
1850
|
|
РНК:
|
20,5
|
-
|
-
|
-
|
|
23 S
|
-
|
1,0-106
|
18 700
|
1
|
|
16S
|
-
|
5,0-105
|
18 700
|
1
|
|
5S
|
-
|
3,9-104
|
18 700
|
1
|
|
тРНК
|
-
|
2,5-104
|
198 000
|
60
|
|
иРНК
|
-
|
1,0-106
|
1 380
|
600
|
|
ДНК
|
ЗД
|
2,5-109
|
2
|
1
|
|
Липиды
|
9,
|
705
|
22 000 000
|
|
|
Липополисахариды
|
3,4
|
4070
|
1 430 000
|
1
|
|
Пептидогликан
|
2,5
|
(904)n
|
1
|
1
|
|
Гликоген
|
2,5
|
1,0-106
|
4 300
|
1
|
|
Полиамины:
|
0,4
|
-
|
-
|
-
|
|
Путресцин
|
-
|
88
|
5 600 000
|
1
|
|
Спермидин
|
-
|
145
|
1 100 000
|
1
|
|
Метаболиты, кофакторы, ионы
|
3,5
|
—
|
—
|
800
|
Углеводы бактерий представлены простыми веществами (моно- и дисахариды) и комплексными соединениями. Полисахариды часто входят в состав капсул. Некоторые внутриклеточные полисахариды (крахмал, гликоген и др.) являются запасными питательными веществами.
Липиды в основном входят в состав цитоплазматической мембраны и ее производных, а также клеточной стенки бактерий, например наружной мембраны, где, кроме бимолекулярного слоя липидов, имеется ЛПС. Липиды могут выполнять в цитоплазме роль запасных питательных веществ. Липиды бактерий представлены фосфолипидами, жирными кислотами и глицеридами. Наибольшее количество липидов (до 40 %) содержат микобактерии туберкулеза.
Минеральные вещества бактерий обнаруживают в золе после сжигания клеток. В большом количестве выявляются фосфор, калий, натрий, сера, железо, кальций, магний, а также микроэлементы (цинк, медь, кобальт, барий, марганец и др.). Они участвуют в регуляции осмотического давления, рН среды, окислительно-восстановительного потенциала, активируют ферменты, входят в состав ферментов, витаминов и структурных компонентов микробной клетки.
§ 3.2. Питание бактерий (конструктивный метаболизм прокариот)
Образ жизни прокариот состоит в постоянном воспроизведении своей биомассы. Совокупность протекающих в клетке процессов, обеспечивающих воспроизводство биомассы, называется обменом веществ, или метаболизмом.
Клеточный метаболизм складывается из двух потоков реакций, имеющих разную направленность: энергетического и конструктивного метаболизмов.
КОНСТРУКТИВНЫЙ МЕТАБОЛИЗМ
Конструктивный метаболизм (биосинтез, анаболизм) - цепь последовательных реакций, в результате которых за счет поступающих извне веществ строится вещество клеток; это процесс, связанный с потреблением свободной энергии, запасенной в химической форме в молекулах АТФ или других богатых энергией соединениях.
Метаболические пути конструктивной и энергетической направленности состоят из множества последовательных ферментативных реакций и могут быть разделены на три этапа:
- На начальном этапе воздействию подвергаются молекулы, служащие исходными субстратами. Иногда эту часть метаболического пути называют периферическим метаболизмом, а ферменты, катализирующие первые этапы превращения субстрата, - периферическими;
- Последующие превращения включают ряд ферментативных реакций и приводят к образованию промежуточных продуктов, или метаболитов, а сама цепь превращений объединяется под названием промежуточно го метаболизма;
- На последних этапах образуются конечные продукты конструктивных путей, которые используются для построения вещества клеток, а конечные продукты энергетических путей выделяются в окружающую среду.
Конструктивные и энергетические процессы протекают в клетке одновременно. У большинства прокариот они тесно связаны между собой. Однако у некоторых прокариотных организмов можно выделить последовательности реакций, служащих только для получения энергии или только для биосинтеза. Связь между конструктивными и энергетическими процессами прокариот осуществляется по нескольким каналам. Основной из них - энергетический. Определенные реакции поставляют энергию, необходимую для биосинтезов и других клеточных энергозависимых функций.
Биосинтетические реакции, кроме энергии, нуждаются часто в поступлении извне восстановителя в виде водорода (электронов), источником которого служат также реакции энергетического метаболизма. И наконец, тесная связь между энергетическими и конструктивными процессами проявляется в том, что определенные промежуточные этапы и метаболиты обоих путей могут быть одинаковыми (хотя направленность потоков реакций, относящихся к каждому из путей, различна). Это создаѐт возможности для использования общих промежуточных продуктов в каждом из метаболических путей. Промежуточные соединения такой природы предложено называть амфиболитами, а промежуточные реакции, одинаковые для обоих потоков, - амфиболическими.
Метаболизм прокариот отличается чрезвычайным разнообразием, которое есть результат способности этих форм жизни использовать в качестве источников энергии и исходных субстратов для построения веществ тела самый широкий набор органических и неорганических соединений. Такая способность обусловлена различиями в наборе клеточных периферических ферментов, воздействующих на исходные субстраты и видоизменяющих их молекулы в направлении, позволяющем им далее метаболизироваться по каналам промежуточного метаболизма. Промежуточный метаболизм прокариот не отличается существенным разнообразием от периферического метаболизма эукариот, хотя по сравнению с ним состоит из большего числа вариантов.
Мономеры, необходимые для построения основных клеточных компонентов, могут быть синтезированы клеткой или поступать в готовом виде из среды. Чем больше готовых соединений должен получать организм извне, тем ниже уровень его биосинтетических способностей, так как химическая организация всех свободноживущих форм одинакова.
ПИТАНИЕ БАКТЕРИЙ
Особенности питания бактериальной клетки состоят в поступлении питательных субстратов внутрь через всю ее поверхность, а также в высокой скорости процессов метаболизма и адаптации к меняющимся условиям окружающей среды.
Широкому распространению бактерий способствует разнообразие типов питания. Микроорганизмы нуждаются в углероде, азоте, сере, фосфоре, калии и других элементах.
Источники углерода. В конструктивном метаболизме основная роль принадлежит углероду, поскольку все соединения, из которых построены живые организмы, - это соединения углерода. Их известно около миллиона. Прокариоты способны воздействовать на любое известное углеродное соединение, то есть использовать его в своем метаболизме. В зависимости от источника углерода для конструктивного метаболизма все прокариоты делятся на две группы: автотрофы, к которым принадлежат организмы, способные синтезировать все компоненты клетки из углекислоты (аутотрофными бактериями являются нитрифицирующие бактерии, находящиеся в почве; серобактерии, обитающие в воде с сероводородом; железобактерии, живущие в воде с закисным железом, и др.) и гетеротрофы, для которых источником углерода служат органические соединения.
Понятия «авто-» и «гетеротрофия» характеризуют, таким образом, тип конструктивного метаболизма. Если автотрофия - довольно четкое и узкое понятие, то гетеротрофия - понятие весьма широкое и объединяет организмы, резко различающиеся своими потребностями в питательных веществах.
Наибольшая степень гетеротрофности присуща прокариотам, относящимся к облигатным внутриклеточным паразитам (от греч. parasitos нахлебник), то есть организмам, которые могут жить только внутри других живых клеток, например, риккетсии, вирусы и некоторые простейшие.
Они являются патогенными для растений, животных и человека. Паразитический образ жизни привел к редукции некоторых метаболических путей у этих прокариот, что и обусловило полную их зависимость от метаболизма клетки хозяина.
Факультативными паразитами (или условно-патогенными) называют формы прокариот, способные расти при создании подходящих условий вне клетки хозяина.
Следующую крупную группу прокариот составляют гетеротрофы, утилизирующие органические остатки отмерших организмов в окружающей среде, их называют сапрофитами. Термин «сапрофиты» происходит от греческих слов sapros - гнилой и phyton - растение.
Сапрофиты используют продукты жизнедеятельности других организмов или разлагающиеся растительные и животные ткани. К сапрофитам относится большая часть бактерий. Степень требовательности к субстрату у сапрофитов весьма различна. В эту группу входят организмы, которые могут расти только на достаточно сложных субстратах (молоко, трупы животных, гниющие растительные остатки), то есть им нужны в качестве обязательных элементов питания углеводы, органические формы азота в виде набора аминокислот, пептидов, белков, все или часть витаминов, нуклеотиды или готовые компоненты, необходимые для синтеза последних (азотистые основания, пятиуглеродные сахара). Чтобы удовлетворить потребность этих гетеротрофов в элементах питания, их обычно культивируют на средах, содержащих мясные гидролизаты, автолизаты дрожжей, растительные экстракты, молочную сыворотку.
Есть прокариоты, требующие для роста весьма ограниченное число готовых органических соединений в основном из числа витаминов и аминокислот, которые они не в состоянии синтезировать сами, и, наконец, гетеротрофы, нуждающиеся только в одном органическом источнике углерода. Им может быть какой-либо сахар, спирт, кислота или другое углеродсодержащее соединение. Так, бактерии из рода Pseudomonas способны использовать в качестве единственного источника углерода и энергии любое из 200 различных органических соединений, и есть бактерии, для которых таким источником может служить узкий круг довольно экзотических органических веществ. Например, Bacillus fastidiosus может использовать только мочевую кислоту и продукты ее деградации, а некоторые представители рода Clostridium растут только в среде, содержащей пурины. Использовать другие органические субстраты для роста они не могут. Биосинтетические способности этих организмов развиты в такой степени, что они сами могут синтезировать все необходимые им углеродные соединения.
Особую группу гетеротрофных прокариот, обитающих в водоемах, составляют олиготрофные бактерии, способные расти при низких концентрациях в среде органических веществ. Организмы, предпочитающие высокие концентрации питательных веществ, относят к копиотрофам. Термины происходят от греческих слов oligos - малый, сорiosus - изобилие и trорhе - пища
Если у типичных копиотрофов оптимальные условия для роста создаются при содержании в среде питательных веществ в количестве примерно 10 г/л, то для олиготрофных организмов - в пределах 1 - 15 мг углерода/л. В средах с более высоким содержанием органических веществ такие бактерии, как правило, расти не могут и погибают. Различия между гетеротрофными прокариотами с высокими потребностями в готовых органических соединениях и теми, потребности которых минимальны и сводятся, как правило, к одному какому-нибудь органическому источнику углерода, заключаются, таким образом, в степени развития их биосинтетических способностей. Крайняя степень развития биосинтетических способностей - возможность строить все клеточные компоненты из углекислоты - присуща группе автотрофных прокариот.
Как можно видеть из изложенного выше, в мире прокариот не существует резкой границы между авто- и гетеротрофными организмами, так же как нет ее в ряду одноуглеродных соединений (СО2, СО, НСООН, НСНО, СН3ОН, СН4), каждое из которых может служить источником угле- рода для определенной группы прокариот. Однако использование термина «автотрофия» удобно для обозначения конкретного типа конструктивного метаболизма, поскольку в процессе эволюции он оказался специфически связанным с определенными видами энергетических процессов, что привело к появлению у прокариот таких типов жизни, которые отсутствуют у более высокоорганизованных форм.
В зависимости от окисляемого субстрата, называемого донором электронов или водорода, микроорганизмы делятся на две группы: литотрофы (от греч. lithos - камень), использующие в качестве доноров водорода неорганические соединения, и органотрофы, использующие органические соединения.
Учитывая источник энергии, среди бактерий различают фототрофы, то есть фотосинтезирующие (например, сине-зеленые водоросли, использующие энергию света), и хемотрофы, нуждающиеся в химических источниках энергии.
Источники азота. Азот (наряду с углеродом, водородом и кислородом) является одним из четырех основных элементов, участвующих в по- строении клетки. В расчете на сухие вещества его содержится приблизительно 10 %. Природный азот бывает в окисленной, восстановленной и молекулярной формах. Подавляющее большинство прокариот усваивают азот в восстановленной форме. Это соли аммония, мочевины, органические соединения (аминокислоты или пептиды). Окисленные формы азота, главным образом нитраты, также могут потребляться многими прокариотами. Так как азот в конструктивном клеточном метаболизме используется в форме аммиака, нитраты перед включением в органические соединения должны быть восстановлены.
Восстановление нитратов до аммиака осуществляется посредством последовательного действия двух ферментов - нитрат- и нитритредуктазы. Нитратредуктаза катализирует НАД • Н2-зависимое восстановление нитрата до нитрита:
NO3- + НАД . Н2 → NO2- + НАД+ + Н2О,
в результате которого осуществляется перенос на NO3- двух электронов. Нитритредуктаза катализирует шестиэлектронное восстановление NO2- до NН3:
NO2- + 3НАД . Н2 + Н+2 → NН3 + 3НАД+ + 2Н2О.
До момента появления NН3 никаких свободных промежуточных продуктов не обнаружено. Молекулы мочевины и органических соединений также должны быть подвергнуты соответствующим ферментативным воздействиям, сопровождающимся высвобождением аммиака.
Давно была обнаружена способность отдельных представителей прокариотного мира использовать молекулярный азот атмосферы. В последнее время установлено, что этим свойством обладают многие прокариоты, принадлежащие к разным группам: бактерии и археи, аэробы и анаэробы, фототрофы и хемотрофы, свободноживущие и симбиотические формы. Фиксация молекулярного азота также приводит к восстановлению его до аммиака.
Потребности в источниках серы и фосфора. Сера входит в состав аминокислот (цистеин, метионин), витаминов и кофакторов (биотин, липоевая кислота, кофермент А и др.), а фосфор - необходимый компонент нуклеиновых кислот, фосфолипидов, коферментов. В природе сера находится в форме неорганических солей, главным образом сульфатов, в виде молекулярной (элементной) серы или входит в состав органических соединений. Большинство прокариот для биосинтетических целей потребляют серу в форме сульфата, который при этом восстанавливается до уровня сульфида. Однако некоторые группы прокариот не способны к восстановлению сульфата и нуждаются в восстановленных соединениях серы. Основной формой фосфора в природе являются фосфаты, которые и удовлетворяют потребности прокариот в этом элементе.
Необходимость в ионах металлов. Всем прокариотным организмам необходимы металлы, которые могут использоваться в форме катионов неорганических солей. Некоторые из них (магний, кальций, калий, железо) нужны в достаточно высоких концентрациях, потребность в других (цинк, марганец, натрий, молибден, медь, ванадий, никель, кобальт) невелика. Роль перечисленных выше металлов определяется тем, что они входят в состав основных клеточных метаболитов и, таким образом, участвуют в осуществлении жизненно важных функций организма.
Потребность в факторах роста. Некоторые прокариоты обнаруживают потребность в одном каком-либо органическом соединении из группы витаминов, аминокислот или азотистых оснований, которое они по каким-то причинам не могут синтезировать из используемого источника углерода. Такие органические соединения, необходимые в очень небольших количествах, получили название факторов роста.
Факторы роста - это необходимые для микроорганизмов соединения, которые они сами синтезировать не могут, поэтому их необходимо добавлять в питательные среды.
Организмы, которым в дополнение к основному источнику углерода необходим один или больше факторов роста, которые они не могут сами синтезировать, называют ауксотрофами (цв. вклейка, рис. IV, V, VI).
Прототрофы способны сами синтезировать необходимые для роста соединения, например из глюкозы и солей аммония.
СИНТЕЗ ПРОКАРИОТАМИ ОСНОВНЫХ КЛЕТОЧНЫХ КОМПОНЕНТОВ
Как уже отмечалось выше, основная масса органических веществ клетки состоит из полисахаридов, липидов, белков и нуклеиновых кислот,
являющихся (за исключением липидов) полимерами. Образованию полимеров предшествует синтез составляющих их мономеров. В случае полисахаридов - это различные моносахара, нуклеиновых кислот - рибо- и дезоксирибонуклеотиды, белков - аминокислоты.
Биосинтез углеводов. Если прокариоты выращивать на средах, где источник углерода - одно-, двух- или трехуглеродные соединения, то необходимые сахара (в первую очередь С6) они должны синтезировать из имеющихся в среде источников углерода. У подавляющего большинства автотрофов на среде с СО2 в качестве единственного источника углерода сахара синтезируются в реакциях восстановительного пентозофосфатного цикла. У гетеротрофов на среде с С2- и С3-соединениями для синтеза необходимых сахаров используются в значительной степени реакции, функционирующие в катаболическом потоке, например в гликолитическом пути. Однако поскольку некоторые ферментативные реакции этого пути необратимы, в клетках гетеротрофных прокариот, способных использовать двух- и трехуглеродные соединения, сформировались специальные ферментативные реакции, позволяющие обходить необратимые реакции катаболического пути.
Процесс, обеспечивающий синтез С6-углеводов из неуглеводных предшественников, например аминокислот, глицерина, молочной кислоты, получил название глюконеогенеза. Таким путем, сочетающим использование имеющегося в клетке катаболического аппарата и специальных реакций, служащих только для биосинтетических целей, решается прокариотами проблема биосинтеза необходимых моносахаров.
Биосинтез липидов. У прокариот липиды входят в состав клеточных мембран и клеточной стенки, служат запасными веществами, являются компонентами пигментных систем и цепей электронного транспорта. Ниже мы рассмотрим синтез жирных кислот и фосфолипидов, являющихся у большинства прокариот, относящихся к эубактериям, универсальным компонентом клеточных мембран.
С14 - С18-жирные кислоты синтезируются путем последовательного присоединения двухуглеродных фрагментов к активированной С2-группе, выполняющей функцию затравки, и последующего восстановления окисленных углеродных атомов.
В клетках бактерий компонентами липидов являются в основном насыщенные жирные кислоты или содержащие одну двойную связь (мононенасыщенные). Полиненасыщенные жирные кислоты, содержащие две и более двойные связи, найдены до сих пор только у цианобактерий. Образование двойных связей в молекуле кислоты может происходить двумя путями. Один из них, обнаруженный у аэробных бактерий, требует участия молекулярного кислорода. У облигатно анаэробных и некоторых аэробных бактерий двойные связи вводятся в молекулу кислоты на ранней стадии ее синтеза в результате реакции дегидратации.
Пути, ведущие к синтезу фосфолипидов, состоят из нескольких этапов. Исходным субстратом служит фосфодиоксиацетон (промежуточное соединение гликолитического пути), восстановление которого приводит к образованию 3-фосфоглицерина. К последнему затем присоединяются два остатка жирных кислот. Продуктом реакции является фосфатидная кислота. Активирование ее с помощью ЦТФ и последующее присоединение к фосфатной группе серина, инозита, глицерина или другого соединения приводят к синтезу фосфатидилсерина, фосфатидилинозита и фосфатидилглицерина соответственно.
Биосинтез аминокислот. Большинство прокариот способны синтезировать все аминокислоты, входящие в состав клеточных белков. В качестве исходных углеводородов для биосинтеза аминокислот служит небольшое число промежуточных соединений различных метаболических путей (табл. 7). Введение в молекулу некоторых из них (щавелевоуксусной, α-кетоглутаровой, пировиноградной кислот) аминного азота приводит к образованию аспарагиновой, глутаминовой кислот и аланина. Однако в большинстве случаев исходные соединения должны подвергнуться значительным перестройкам, чтобы сформировать углеродный остов молекулы будущей аминокислоты.
Особенностью биосинтеза аминокислот является использование общих биосинтетических путей. Так, 19 из 20 аминокислот, входящих в состав белков, можно по способу их происхождения разделить на 5 групп. Только одна аминокислота (гистидин) образуется по отдельному биосинтетическому пути. Азот вводится в молекулу аминокислоты посредством реакций аминирования, амидирования и переаминирования. Реакции аминирования приводят к образованию из пировиноградной кислоты аланина, а из α-кетоглутаровой - глутаминовой кислоты, например:
Две реакции амидирования ведут к образованию глутамина и аспара-гина из глутаминовой и аспарагиновой кислот в реакциях типа:
где ФH - неорганический фосфат. Глутаминовая кислота и глутамин прямо или косвенно служат донорами амино- и амидогрупп при синтезе практически всех аминокислот и других азотсодержащих органических соединений.
Таблица 7 Некоторые особенности биосинтеза аминокислот [8]
|
Предшественник
|
Метаболический путь,
приводящий к образованию
предшественника
|
Аминокислоты с общими биосинтетическими
путями
|
|
Щавелевоуксусная
кислота
|
Цикл трикарбоновых
кислот
Реакции карбоксилирования
|
Аспарагиновая кислота
Аспарагин
Лизин
Метионин
Треонин
Изолейцин
|
|
α-Кетоглутаровая
кислота
|
Цикл трикарбоновых
кислот
|
Глутаминовая кислота
Глутамин
Аргинин
Пролин
|
|
3-Фосфоглицери-
новая кислота
|
Гликолиз
Цикл Кальвина
|
Серин
Глицин
Цистеин
|
|
Пировиноградная
кислота
|
Гликолиз
Путь Энтнера - Дудорова
|
Аланин
Валин
Лейцин
|
|
Фосфоенолпиро-
виноградная кислота +
Эритрозо-4-фосфат
|
Гликолиз
Окислительный
пентозофосфатный путь
|
Триптофан
Тирозин
Фенилаланин
|
|
5-Фосфорибозил-1-
пирофосфат + АТФ
|
Окислительный
пентозофосфатный путь
|
Гистидин
|
Аспарагин используется только для синтеза белковых молекул. Во все остальные аминокислоты азот вводится посредством реакций переаминирования, катализируемых соответствующими аминотрансферазами, при этом во всех реакциях одним из участников является глутаминовая кислота:
глутаминовая кислота + щавелевоуксусная кислота →
→ аспарагиновая кислота + α-кетоглутаровая кислота
Еще одним путем включения азота аммиака в состав органических соединений является реакция, приводящая к образованию карбамоилфосфата:
NН3 + СО2 + 2АТФ → Н2N — СО — О — РО3Н2 + 2АДФ + ФH
Карбамоилфосфат
Дальнейшее использование азота карбамоилфосфата происходит по двум направлениям: для синтеза пиримидинов и аргинина.
Биосинтез мононуклеотидов. Из мононуклеотидов построены нуклеиновые кислоты (РНК, ДНК) клеток. Кроме того, мононуклеотиды входят в состав многих коферментов и участвуют, таким образом, в осуществлении различных каталитических функций. Центральное место в биосинтезе мононуклеотидов занимает синтез пуриновых и пиримидиновых азотистых оснований. Большинство прокариот способно к синтезу этих соединений из низкомолекулярных предшественников.
Синтез пуриновых и пиримидиновых мононуклеотидов осуществляется независимыми путями.
В результате последовательных ферментативных реакций при синтезе пуриновых нуклеотидов образуется инозиновая кислота, из которой путем химических модификаций пуринового кольца синтезируются адениловая (АМФ) и гуаниловая (ГМФ) кислоты.
Первым синтезируемым пиримидиновым нуклеотидом является оротидиловая кислота, декарбоксилирование которой приводит к образованию уридиловой кислоты (УМФ). Последняя служит предшественником цитидиловых нуклеотидов, но соответствующее превращение происходит только на уровне трифосфатов, поэтому сначала из УМФ образуется УТФ, аминирование которого приводит к возникновению ЦТФ. Дезоксирибо- нуклеотиды образуются в результате восстановления соответствующих рибонуклеотидов на уровне дифосфатов (для некоторых прокариот описано подобное превращение на уровне трифосфатов). Синтез специфического для ДНК нуклеотида - тимидиловой кислоты - происходит путем ферментативного метилирования дезоксиуридиловой кислоты.
Многие прокариоты способны использовать содержащиеся в пита- тельной среде готовые пуриновые и пиримидиновые основания, их нук- леозиды и нуклеотиды, имея ферменты, катализирующие следующие эта- пы взаимопревращений экзогенных пуриновых и пиримидиновых произ- водных:
азотистое основание ↔ нуклеозид ↔ нуклеотид (моно ↔ ди ↔ трифосфат).
МЕХАНИЗМЫ ПИТАНИЯ
Поступление различных веществ в бактериальную клетку зависит от величины и растворимости их молекул в липидах или воде, рН среды, концентрации веществ, различных факторов проницаемости мембран и др. Клеточная стенка пропускает небольшие молекулы и ионы, задерживая макромолекулы массой более 600 Да. Основным регулятором поступления веществ в клетку является цитоплазматическая мембрана.
Условно можно выделить четыре механизма проникновения питательных веществ в бактериальную клетку: простая диффузия, облегченная диффузия, активный транспорт, транслокация групп.
Наиболее простой механизм поступления веществ в клетку - простая диффузия, при которой перемещение веществ происходит вследствие разницы их концентрации по обе стороны цитоплазматической мембраны. Вещества проходят через липидную часть цитоплазматической мембраны (органические молекулы, лекарственные препараты) и реже по заполненным водой каналам в цитоплазматической мембране. Пассивная диффузия осуществляется без затраты энергии.
Облегченная диффузия происходит также в результате разницы концентрации веществ по обе стороны цитоплазматической мембраны. Однако этот процесс осуществляется с помощью молекул-переносчиков, локализующихся в цитоплазматической мембране и обладающих специфичностью. Каждый переносчик транспортирует через мембрану соответствующее вещество или передает другому компоненту цитоплазматической мембраны - собственно переносчику. Белками-переносчиками могут быть пермеазы, место синтеза которых - цитоплазматическая мембрана. Облегченная диффузия протекает без затраты энергии, вещества перемещаются из области с более высокой концентрацией в область с более низкой.
Активный транспорт происходит с помощью пермеаз и направлен на перенос веществ меньшей концентрации в сторону большей, то есть как бы против течения, поэтому данный процесс сопровождается затратой метаболической энергии (АТФ), образующейся в результате окислительно-восстановительных реакций в клетке.
Перенос (транслокация) групп сходен с активным транспортом, но отличается тем, что переносимая молекула видоизменяется в процессе переноса, например фосфорилируется.
Выход веществ из клетки осуществляется за счет диффузии и при участии транспортных систем.
ФЕРМЕНТЫ БАКТЕРИЙ
Ферменты распознают соответствующие метаболиты (субстраты), вступают с ними во взаимодействие и ускоряют химические реакции. Являются белками, участвуют в процессах анаболизма (синтеза) и катаболизма (распада), то есть метаболизма. Многие ферменты взаимосвязаны со структурами микробной клетки. Например, в цитоплазматической мембране имеются окислительно-восстановительные ферменты, участвующие в дыхании и делении клетки. Окислительно-восстановительные ферменты цитоплазматической мембраны и ее производных обеспечивают энергией интенсивные процессы биосинтеза различных структур, в том числе клеточной стенки. Ферменты, связанные с делением и аутолизом клетки, обнаруживаются в клеточной стенке. Так называемые эндоферменты катализируют метаболизм, проходящий внутри клетки. Экзоферменты выделяются клеткой в окружающую среду, расщепляя макромолекулы питательных субстратов до простых соединений, усваиваемых клеткой в качестве источников энергии, углерода и др. Некоторые экзоферменты (пенициллиназа и др.) инактивируют антибиотики, выполняя защитную функцию.
Различают конститутивные и индуцибельные ферменты. Конститутивные ферменты синтезируются клеткой непрерывно, вне зависимости от наличия субстратов в питательной среде. Индуцибельные (адаптивные) ферменты синтезируются только при наличии в среде субстрата данного фермента. Например, кишечная палочка на среде с глюкозой практически не образует β-галактозидазу, но резко увеличивает ее синтез при выращивании на среде с лактозой или другим β-галактозидом.
Некоторые ферменты (так называемые ферменты агрессии) разрушают ткань и клетки, обусловливая широкое распространение в инфицированной ткани микроорганизмов и их токсинов. К таким ферментам относят гиалуронидазу, коллагеназу, дезоксирибонуклеазу, нейраминидазу, лецитовителлазу и др. Так, гиалуронидаза стрептококков, расщепляя гиалуроновую кислоту соединительной ткани, способствует распространению стрептококков и их токсинов.
Известно более 2000 ферментов. Они объединены в шесть классов: оксидоредуктазы - окислительно-восстановительные ферменты (к ним относятся дегидрогеназы, оксидазы и др.); трансферазы, переносящие отдельные радикалы и атомы от одних соединений к другим; гидролазы, ускоряющие реакции гидролиза, то есть расщепления веществ на более простые с присоединением молекул воды (эстеразы, фосфатазы, глюкозидазы и др.); лиазы, отщепляющие от субстратов химические группы негидролитическим путем (карбоксилазы и др.); изомеразы, превращающие органические соединения в их изомеры (фосфогексоизомераза и др.); лигазы, или синтетазы, ускоряющие синтез сложных соединений из более простых (аспарагинсинтетаза, глютаминсинтетаза и др.).
Различия в ферментном составе используются для идентификации микроорганизмов, так как они определяют их различные биохимические свойства: сахаролитические (расщепление сахаров), протеолитические (разложение белков) и другие, выявляемые по конечным продуктам расщепления (образование щелочей, кислот, сероводорода, аммиака и др.).
Ферменты микроорганизмов используют в генетической инженерии (рестриктазы, лигазы и др.) для получения биологически активных соединений, уксусной, молочной, лимонной и других кислот, молочнокислых продуктов, в виноделии и других отраслях. Ферменты применяют в качестве биодобавок в стиральные порошки для уничтожения загрязнений белковой природы.
§ 3.3. Дыхание прокариот (энергетический метаболизм)
Энергетический метаболизм (катаболизм) - это поток реакций, сопровождающихся мобилизацией энергии и преобразованием ее в электрохимическую (Δ(μн+) или химическую (АТФ) форму, которая затем может быть использована во всех энергозависимых процессах.
Существуют группы прокариот, энергетический метаболизм которых не связан с превращениями органических соединений (прокариоты с фото- лито- и хемолитотрофным типом энергетического обмена). По отношению к такого рода энергетическим процессам термин «катаболизм» неприменим. У них функционирует только один поток превращений органических соединений углерода - анаболический.
Энергетические процессы прокариот по своему объему (масштабности) значительно превосходят процессы биосинтетические, а их протекание приводит к существенным изменениям в окружающей среде. Разнообразны и необычны в этом отношении возможности прокариот, способы их энергетического существования. Все это вместе взятое сосредоточило внимание исследователей в первую очередь на изучении энергетического метаболизма прокариот.
Энергетические ресурсы. Организмы могут использовать не все виды энергии, существующей в природе. Недоступными для них являются ядерная, механическая, тепловая виды энергии. Чтобы теплота могла служить источником энергии, необходим большой перепад температур, который в живых организмах невозможен. Доступными для живых систем внешними источниками энергии (энергетическими ресурсами) являются электромагнитная (физическая) энергия (свет определенной длины волны) и химическая (восстановленные химические соединения). Способностью использовать энергию света обладает большая группа фотосинтезирующих организмов, в том числе и прокариот, имеющих фоторецепторные молекулы нескольких типов (хлорофиллы, каротиноиды, фикобилипротеины). Для всех остальных организмов источниками энергии служат процессы окисления химических соединений. Часто энергетическими ресурсами служат биополимеры, находящиеся в окружающей среде (полисахариды, белки, нуклеиновые кислоты), а также липиды. Прежде чем быть использованными, биополимеры должны быть гидролизованы до составляющих их мономерных единиц. Этот этап весьма важен по следующим причинам. Белки и нуклеиновые кислоты отличаются исключительным разнообразием. Количество видов белков исчисляется тысячами, после гидролиза же образуется только 20 аминокислот. Все разнообразие нуклеиновых кислот (ДНК и РНК) после гидролиза сводится к 5 видам нуклеотидов. Таким образом, расщепление полимеров до мономерных единиц резко сокращает набор химических молекул, которые могут быть использованы организмом.
Полимерные молекулы расщепляются до мономеров с помощью ферментов, синтезируемых и выделяемых прокариотами в окружающую среду (экзоферментов). Крахмал и гликоген гидролизуются амилазами, гликозидные связи целлюлозы расщепляются целлюлазой. Многие бактерии образуют пектиназу, хитиназу, агаразу и другие ферменты, гидролизующие соответствующие полисахариды и их производные. Белки расщепляются внеклеточными протеазами, воздействующими на пептидные связи. Нуклеиновые кислоты гидролизуются рибо- и дезоксирибонуклеазами. Образующиеся небольшие молекулы легко транспортируются в клетку через мембрану. Процесс распада жирных кислот локализован в клетке и включает несколько этапов. На первом из них жирная кислота с помощью соответствующего фермента превращается в КоА-производное, которое окисляется в β-положении с последующим отщеплением ацетил-КоА. Другим продуктом реакции является КоА-производное жирной кислоты, укороченное на два углеродных атома. Ацетил-КоА по катаболическим каналам используется для получения клеткой энергии.
Процесс расщепления биополимеров не связан с образованием свободной, то есть доступной клетке, энергии. Происходящее при этом рассеивание энергии также невелико. Образовавшиеся мономеры подвергаются в клетке дальнейшим ферментативным превращениям, в результате которых путем перестройки химической структуры возникают молекулы, включающиеся на каком-либо этапе в качестве метаболитов в функционирующие клеточные катаболические системы. Основные из них: путь Эмбдена - Мейергофа - Парнаса (гликолиз), окислительный пентозофосфатный путь, путь Энтнера - Дудорова и цикл трикарбоновых кислот (ЦТК). Общее для всех катаболических путей - многоступенчатость процесса окисления исходного субстрата. На некоторых этапах окисление субстрата сопряжено с образованием энергии в определенной форме, в которой эта энергия может использоваться в самых разнообразных энергозависимых процессах.
Таким образом, внешние доступные организмам источники энергии (свет, химические соединения) должны быть трансформированы в клетке в определенную форму, чтобы обеспечить внутриклеточные потребности в энергии.
Дыхание бактерий. Дыхание, или биологическое окисление, основано на окислительно-восстановительных реакциях, идущих с образованием АТФ-универсального аккумулятора химической энергии. Энергия необходима микробной клетке для ее жизнедеятельности. При дыхании происходят процессы окисления и восстановления: окисление - отдача донорами (молекулами или атомами) водорода или электронов; восстановление - присоединение водорода или электронов к акцептору. Акцептором водорода или электронов может быть молекулярный кислород (такое дыхание называется аэробным) или нитрат, сульфат, фумарат (такое дыхание называется анаэробным - нитратным, сульфатным, фумаратным). Анаэробиоз (от греч. aer - воздух, bios - жизнь) - жизнедеятельность, протекающая при отсутствии свободного кислорода. Если донорами и акцепторами водорода являются органические соединения, то такой процесс называется брожением. При брожении происходит ферментативное расщепление органических соединений, преимущественно углеводов, в анаэробных условиях. С учетом конечного продукта расщепления углеводов различают спиртовое, молочнокислое, уксусное и другие виды брожения.
По отношению к молекулярному кислороду бактерии можно разделить на три основные группы: облигатные, то есть обязательные, аэробы, облигатные анаэробы и факультативные анаэробы.
Облигатные аэробы - это прокариоты, для роста которых кислород необходим. К ним относится большинство прокариотных организмов.
Облигатные анаэробы (клостридии ботулизма, газовой гангрены, столбняка, бактероиды и др.) растут только на среде без кислорода, который для них токсичен. При наличии кислорода бактерии образуют перекисные радикалы кислорода, в том числе перекись водорода и супероксид-анион кислорода, токсичные для облигатных анаэробных бактерий, поскольку они не образуют соответствующие инактивирующие ферменты. Аэробные бактерии инактивируют перекись водорода и супероксид-анион кислорода соответствующими ферментами (каталазой, пероксидазой и супероксиддисмутазой).
Факультативные анаэробы могут расти как при наличии, так и при отсутствии кислорода, поскольку они способны переключаться с дыхания в присутствии молекулярного кислорода на брожение в его отсутствие. Они способны осуществлять анаэробное дыхание, называемое нитратным: нитрат, являющийся акцептором водорода, восстанавливается до молекулярного азота и аммиака.
Среди облигатных анаэробов различают аэротолерантные бактерии, которые сохраняются при наличии молекулярного кислорода, но не используют его.
Для выращивания анаэробов в бактериологических лабораториях применяют анаэростаты - специальные емкости, в которых воздух заменяется смесью газов, не содержащих кислорода. Воздух можно удалять из питательных сред путем кипячения, с помощью химических адсорбентов кислорода, помещаемых в анаэростаты или другие емкости с посевами.
§ 3.4. Закономерности роста и размножения бактерий
РОСТ И РАЗМНОЖЕНИЕ БАКТЕРИЙ
Жизнедеятельность бактерий характеризуется ростом - формированием структурно-функциональных компонентов клетки и увеличением самой бактериальной клетки, а также размножением - самовоспроизведением, приводящим к увеличению количества бактериальных клеток в популяции. Различают рост клеток и рост популяции. Каждый из них характеризуется своими особенностями и закономерностями. Под ростом индивидуальной клетки понимают увеличение ее биомассы, наступающее в результате синтеза клеточного материала. Объем клетки можно вычислить, если известны ее продольные и поперечные размеры. Для шаровидных клеток он определяется по формуле
V=4/3 πr3
а для цилиндрических - по формуле
V= πаr2,
где r - радиус клетки, а - длина клетки.
Бактерии размножаются путем бинарного деления пополам, реже путем почкования. Актиномицеты, как и грибы, могут размножаться спорами, так как являются ветвящимися бактериями, а также путем фрагментации нитевидных клеток. Грамположительные бактерии делятся путем врастания синтезирующихся перегородок деления внутрь клетки, а грамотрицательные - путем перетяжки, в результате чего образуются две одинаковые клетки (рис. 9).

Рис. 9. Процесс роста и размножения бактериальной клетки. Время генерации g представляет собой время между моментом образования бактерии и моментом, когда она расщепляется на две дочерние клетки
Делению клеток предшествует репликация бактериальной хромосомы по полуконсервативному типу (двуспиральная цепь ДНК раскрывается и каждая нить достраивается комплементарной нитью), приводящая к удвоению молекул ДНК бактериального ядра - нуклеоида.
Образовавшиеся в результате репликации две хромосомы расходятся, чему способствует увеличение размеров растущей клетки: прикрепленные к цитоплазматической мембране или ее производным (например, мезосомам) хромосомы по мере увеличения объема клетки удаляются друг от друга. Окончательное их обособление завершается образованием перетяжки или перегородки деления (рис. 10).
Клетки с перегородкой деления расходятся в результате действия аутолитических ферментов, разрушающих сердцевину перегородки деления. Аутолиз при этом может происходить неравномерно: делящиеся клетки в одном участке остаются связанными частью клеточной стенки в области перегородки деления. Такие клетки располагаются под углом друг к другу, что характерно для дифтерийных коринебактерий.
Рис. 10. Механизм распределения бактериальных хромосом
КУЛЬТИВИРОВАНИЕ МИКРООРГАНИЗМОВ
Питательные среды. Для выращивания микроорганизмов (например, бактерий) в условиях лаборатории или производства используют жидкие, плотные и полужидкие питательные среды, которые должны обязательно отвечать трем основным требованиям:
- содержать в достаточном количестве все необходимые питательные вещества (источники энергии, углерода, азота), соли и ростовые факторы;
- иметь оптимальное значение рН для роста данного вида бактерий;
- иметь достаточную влажность (при их усыхании повышается концентрация питательных веществ, особенно солей, тормозящих рост бактерий).
Среды для определения культуральных свойств бактерий должны быть по возможности прозрачными, стерильными, не содержать посторонней микрофлоры. По своему назначению их подразделяют на следующие основные категории.
Универсальные — среды, на которых хорошо растут многие виды патогенных и непатогенных бактерий. К ним относятся: мясо-пептонный бульон (МПБ = мясная вода + 1% пептона + 0,5% NaCl), мясо-пептонный агар (МПА = МПБ + 2-3% агара).
Дифференциально-диагностические - позволяющие отличать одни виды бактерий от других по их ферментативной активности или культуральным проявлениям (среды Эндо, Плоскирева, Гисса).
Дифференциально-селективные - сочетающие в себе свойства дифференциальных и селективных сред. Используются для ускорения обнаружения и идентификации бактерий.
Специальные - специально приготовленные для получения тех бактерий, которые растут очень плохо или не растут на универсальных средах (кровяной агар, среда Левенштейна - Иенсена).
Синтетические - строго определѐнного химического состава.
Полусинтетические - синтетические, к которым добавляют продукт природного происхождения (сыворотку, кровь).
Способы культивирования микроорганизмов
Стационарный способ. При культивировании этим способом питательные среды сохраняются постоянными, никаких манипуляций с ними не производят. Преобладают анаэробные энергетические процессы. Выход биомассы незначителен. Для получения большего выхода биомассы или биологически активных соединений разработаны новые методы.
Глубинный способ с аэрацией. Глубинное культивирование проводят в реакторах - в герметичных котлах с жидкой питательной средой, оборудованных автоматическими приспособлениями для контроля рН, О2, температуры, поступления стерильного воздуха и т.д.. В аэробных условиях достигается максимальное использование энергии и максимальный выход биомассы. Выход биомассы E.coli при культивировании в стационарных условиях через 18 - 20 ч - 1 млрд, а при глубинном способе через 12 - 14 ч - 50 - 60 млрд.
Проточный способ культивирования позволяет клеткам длительное время находиться в определенной фазе роста (экспоненциальной) при постоянной концентрации питательных веществ и в одних и тех же условиях, обеспечивающих непрерывный рост культуры. Метод основан на том, что в культивируемую суспензию непрерывно добавляют свежую питательную среду и одновременно удаляют соответствующее количество бактерий.
Различают два типа аппаратов: хемостаты и турбидостаты. Хемостат - аппарат, в который постоянно добавляется свежая питательная среда. В турбидостате поддерживается постоянная плотность (мутность) бактериальной популяции.
В зависимости от способа культивирования различают периодические (стационарные и при глубинном культивировании) и непрерывные (при проточном) культуры бактерий. При определенных условиях получают синхронные культуры, то есть культуры, в которых все клетки одновременно (синхронно) делятся.
КОЛИЧЕСТВЕННЫЕ ХАРАКТЕРИСТИКИ РОСТА
Для количественной характеристики ростовых процессов в микробной популяции пользуются двумя показателями: абсолютной (валовой) скоростью и относительной (удельной) скоростью роста. Среднюю валовую скорость роста (νср) за отрезок времени (t1 – t0) можно определить по абсолютному приросту биомассы по формуле:
νср = (mt-m0) / (t1-t0)
где m0 – величина биомассы в начале исследуемого отрезка времени; mt – величина биомассы в конце исследуемого отрезка времени.
Под удельной скоростью роста понимают часовой прирост, пересчитанный на единицу растущей массы:
µ = d(lnm) / dt
Скорость размножения бактерий (число удвоений за единицу времени) описывают уравнением:
ν = n / (t1-t0)
где n – число поколений.
Продолжительность жизни одного поколения (время генерации) в среднем составляет:
g = (t1-t0) / µ = 1 / ν
В результате логарифмирования приведенных формул и их сопоставления установлена связь удельной скорости роста с продолжительностью времени генерации и скоростью размножения клеток:
g = 0,693 / µ; ν = 1,44µ; µ = 0,693 / g
То есть между временем генерации и удельной скоростью роста существует обратно пропорциональная зависимость. Скорость роста не является величиной неизменной.
СТАДИИ РОСТА ПЕРИОДИЧЕСКОЙ КУЛЬТУРЫ БАКТЕРИЙ
В развитии микробной популяции различают следующие последовательные стадии (рис. 11): лаг-фаза; фаза положительного ускорения; фаза логарифмического роста; фаза отрицательного ускорения; стационарная фаза; фаза ускоренной гибели; фаза логарифмической гибели и фаза уменьшения скорости отмирания. Они отражают сложные процессы адаптации бактерий, привнесенных из одной среды обитания в другую, как правило, оптимальную для их размножения.
Рис. 11. Последовательные стадии роста периодической культуры бактерий
I – лаг-фаза; II – фаза положительного ускорения; III – фаза логарифмического роста; IV – фаза отрицательного ускорения; V – стационарная фаза; VI – фаза ускоренной гибели; VII – фаза логарифмической гибели; VIII – фаза уменьшения скорости гибели. На оси ординат показаны скорость размножения бактерий в условных единицах (слева) и величина популяции бактерий, выраженная логарифмом от числа живых клеток на 1 мл среды.
Природа лаг-фазы во многом связана с тем, что в этот период происходит активный синтез всех компонентов белоксинтезирующей системы и прежде всего такого количества рибосом, которое позволило бы обеспечить максимальную активность всех биосинтетических процессов.
Лаг-фаза (от англ. lag - запаздывание) - период между посевом бактерий и началом размножения. Продолжительность лаг-фазы в среднем 4 - 5 ч. Бактерии при этом увеличиваются в размерах и готовятся к делению нарастает количество нуклеиновых кислот, белка и других компонентов.
Последующие стадии развития периодических культур отражают высокую скорость размножения бактерий.
Фаза логарифмического (экспоненциального) роста является периодом интенсивного деления бактерий. Продолжительность ее около 5 - 6 ч. При оптимальных условиях роста бактерии могут делиться каждые 20 - 40 мин. Во время этой фазы бактерии наиболее ранимы, что объясняется высокой чувствительностью компонентов метаболизма интенсивно растущей клетки к ингибиторам синтеза белка, нуклеиновых кислот и др.
Затем, в силу постепенного истощения источника энергии и других жизненно важных метаболитов, скорость размножения бактерий уменьшается, наступает фаза стационарного роста, при которой количество жизнеспособных клеток остается без изменений, составляя максимальный уровень (М-концентрация). Ее продолжительность выражается в часах и колеблется в зависимости от вида бактерий, их особенностей и культивирования. В стационарной фазе наступает период некоторого равновесия - количество вновь образующихся клеток становится сопоставимым с числом погибающих клеток.
Вслед за этим наступает стадия, характеризующаяся постепенным уменьшением количества жизнеспособных бактерий. Это является следствием ряда причин: истощения источников энергии и других жизненно важных метаболитов, невозможности эффективно регулировать рН среды и др., накопления продуктов метаболизма, тормозящих рост, и, возможно, каких-то других факторов.
Завершает процесс роста бактерий фаза отмирания, характеризующаяся отмиранием бактерий в условиях истощения источников питательной среды и накопления в ней продуктов метаболизма бактерий. Продолжительность ее колеблется от 10 ч до нескольких недель.
Очевидно, что популяция бактерий - это тоже саморегулирующаяся система, сильно зависимая от среды, истощение которой оказывает на нее отрицательное действие. Жизнеспособные клетки, перенесенные из такой среды в новую питательную среду, вновь повторяют полностью весь цикл развития популяции. Интенсивность роста и размножения бактерий зависит от многих факторов, в том числе от оптимального состава питательной среды, окислительно-восстановительного потенциала, рН, температуры и др. В промышленных условиях при получении биомассы микроорганизмов с целью приготовления антибиотиков, вакцин, диагностических препаратов, эубиотиков культивирование бактерий и грибов осуществляют в ферментерах при строгом соблюдении оптимальных параметров для роста и размножения культур.
НЕКОТОРЫЕ КУЛЬТУРАЛЬНЫЕ СВОЙСТВА БАКТЕРИЙ
При росте на жидкой питательной среде бактерии чаще всего вызывают ее равномерное помутнение (диффузный рост), иногда выпадение осадка (придонный рост) крошковатого (стрептококки), хлопьевидного (стрептобациллы), при этом бульон остается прозрачным. Некоторые бактерии образуют пленку на поверхности жидкой среды (поверхностный рост): сухую чешуйчато-бородавчатую (туберкулезная палочка), тонкую нежную (холерный вибрион), рыхлую с отходящими вниз отростками «сталактитами» (возбудитель чумы).
Еще более разнообразен рост на плотных питательных средах. Размер, форма, консистенция, прозрачность, цвет и другие особенности колоний на плотной питательной среде учитываются при идентификации бактерий, а также отборе колоний для получения чистых культур. Колонии бывают очень мелкими (0,1 - 0,5 мм), мелкими (0,5 - 3,0 мм), средними (3 - 5 мм) и крупными - более 5 мм в диаметре. Они могут быть круглыми (дисковидными), плоскими, иметь форму, напоминающую львиную гриву (голову медузы), ризоидными и т.п.; края колонии могут быть гладкими, зазубренными, фестончатыми, изрезанными. Поверхность колонии бывает гладкая или шероховатая, влажная или сухая, ровная или складчатая, плоская или выпуклая, а ее консистенция - плотная, рыхлая, слизистая. Колонии могут быть прозрачными, полупрозрачными, непрозрачными и различаться по другим признакам, например, у некоторых бактерий центр темный, а периферическая зона полупрозрачная.
Культуры некоторых видов бактерий обладают характерным запахом, который связан с разложением органических веществ, сопровождающимся образованием скатола, индола, сероводорода, меркаптана, масляной кислоты, аммиака и др. Продукты жизнедеятельности некоторых бактерий обладают приятным ароматом, который связан с образованием различных эфиров: уксусноэтилового, уксусноамилового или диацетила. В природе существуют фосфоресцирующие бактерии, культуры которых светятся в темноте зеленовато-голубоватым или желтоватым светом. Они встречаются, главным образом, в морской и речной воде. Фосфоресценция (люминесценция) продолжается иногда несколько часов и даже суток. Она представляет собой особую форму освобождения энергии возбужденных электронов. Такие бактерии нередко обнаруживаются на мясе, чешуе рыб и других объектах. К светящимся (фотобактериям) относятся аэробные бактерии (вибрионы, палочки, кокки).
Многим видам микроорганизмов присуща способность образовывать пигменты. Цианобактерии, некоторые виды архей, а также серные и пурпурные бактерии имеют пигменты типа хлорофилла или бактериородопсина, с помощью которых они улавливают энергию солнца. Различные виды других бактерий образуют пигменты желтого, оранжевого, красного, синего или черного цвета. Окраска может быть связана как с пигментацией самих клеток, так и с выделением окрашенных веществ в питательную среду. Интенсивность образования пигментов зависит от состава питательной среды и условий культивирования микроорганизмов. Если пигмент не растворим в воде, но растворим в органических растворителях, окрашивается только культуральный налет. Так, колонии «чудесной палочки» Serratia marcescens имеют кроваво-красный пигмент, растворимый в спирте. Пигменты, растворимые в воде, диффундируют в питательную среду и окрашивают ее, например, синегнойная палочка (Pseudomonas aeruginosa) окрашивает среду в сине-зеленый цвет. И наконец, существуют пигменты, не растворимые ни в воде, ни в органических соединениях. Наиболее распространены среди микроорганизмов такие пигменты, как каротины, ксантофиллы и меланины. Меланины являются нерастворимыми пигментами черного, коричневого или красного цвета, синтезирующимися из фенольных соединений.
Химическая природа пигментов разнообразна: каротиноиды относятся к ненасыщенным углеводородам, антоцианы и меланины - к ароматическим соединениям и т.п. Биологическая роль этих пигментов заключается, во-первых, в том, что они защищают бактерии от губительного действия солнечных лучей, поэтому в воздухе так много пигментных бактерий; во-вторых, пигменты участвуют в обмене веществ этих бактерий. Меланины наряду с каталазой, супероксиддисмутазой и пероксидазами защищают микроорганизмы от воздействия токсичных перекисных радикалов кислорода. Многие пигменты обладают антимикробным, антибиотикоподобным действием.
§ 3.5. Размножение вирусов и методы их культивирования
ВЗАИМОДЕЙСТВИЕ ВИРУСА С КЛЕТКОЙ
Известны три типа взаимодействия вируса с клеткой:
- продуктивный тип, завершающийся образованием вирусного потомства;
- абортивный тип, не завершающийся образованием новых вирусных частиц, поскольку инфекционный процесс прерывается на одном из этапов;
- интегративный тип, или вирогения, характеризующийся встраиванием вирусной ДНК в хромосому клетки-хозяина.
Продуктивный тип взаимодействия (репродукция вирусов). Репродукция вирусов (от англ. reproduce - воспроизводить) осуществляется в несколько стадий, последовательно сменяющих друг друга:
- адсорбция вируса на клетке;
- проникновение вируса в клетку;
- «раздевание» вируса;
- биосинтез вирусных компонентов в клетке;
- формирование вирусов;
- выход вирусов из клетки.
Адсорбция. Взаимодействие вируса с клеткой начинается с процесса адсорбции, то есть прикрепления вирусов к поверхности клетки. Это высокоспецифический процесс. Вирус адсорбируется на определенных участках клеточной мембраны - так называемых рецепторах. Клеточные рецепторы могут иметь разную химическую природу, представляя собой белки, углеводные компоненты белков и липидов, липиды. Количество специфических рецепторов на поверхности одной клетки колеблется от 104 до 105. Следовательно, на клетке могут адсорбироваться десятки и даже сотни вирусных частиц. Поверхностные структуры вируса, «узнающие» специфические клеточные рецепторы и взаимодействующие с ними, называются прикрепительными белками. Обычно эту функцию выполняет один из поверхностных белков капсида или суперкапсида. Соответствие (комплементарность) клеточных рецепторов вирусным прикрепительным белкам имеет значение для возникновения инфекционного процесса в клетке. Способность вирусов избирательно поражать определенные клетки органов и тканей организма называют тропизмом вирусов (от греч. tropos - направление).
Проникновение вируса в клетку. Существует два способа проникновения вирусов животных в клетку: виропексис и слияние вирусной оболочки с клеточной мембраной. При виропексисе после адсорбции вирусов происходят инвагинация (впячивание) участка клеточной мембраны и образование внутриклеточной вакуоли, которая содержит вирусную частицу. Вакуоль с вирусом может транспортироваться в любом направлении в разные участки цитоплазмы или ядро клетки. Процесс слияния осуществляется одним из поверхностных вирусных белков капсидной или суперкапсидной оболочки. По-видимому, оба механизма проникновения вируса в клетку не исключают, а дополняют друг друга.
«Раздевание» вируса. Процесс «раздевания» заключается в удалении защитных вирусных оболочек и освобождении внутреннего компонента вируса, способного вызвать инфекционный процесс. «Раздевание» вирусов происходит постепенно, в несколько этапов, в определенных участках цитоплазмы или ядра клетки, для чего клетка использует набор специальных ферментов. В случае проникновения вируса путем слияния вирусной оболочки с клеточной мембраной процесс проникновения вируса в клетку сочетается с первым этапом его «раздевания». Конечными продуктами «раздевания» являются нуклеокапсид или нуклеиновая кислота вируса.
Биосинтез компонентов вируса в клетке. Проникшая в клетку вирусная нуклеиновая кислота несет генетическую информацию, которая успешно конкурирует с генетической информацией клетки. Она дезорганизует работу клеточных систем, подавляет собственный метаболизм клетки и заставляет ее синтезировать новые вирусные белки и нуклеиновые кислоты, идущие на построение вирусного потомства.
Реализация генетической информации вируса осуществляется в соответствии с хорошо известными из биологии процессами транскрипции (от лат. transcriptio - переписывание, то есть синтез информационных РНК- иРНК, комплементарных матричным ДНК или РНК), трансляции (от лат. translatio - передача, то есть синтез белков на рибосомах клетки с участием иРНК) и репликации (от лат. replicatio - повторение, то есть синтез молекул нуклеиновой кислоты, гомологичных геному). Поскольку генетический аппарат вирусов достаточно разнообразен, то передача наследственной информации в отношении синтеза иРНК различна. Основные схемы реализации вирусной генетической информации могут быть представлены следующим образом:
- для ДНК-содержащих вирусов: ДНК вируса → иРНК → белок вируса;
- для РНК-содержащих минус-нитевых вирусов: РНК вируса → иРНК -белок вируса;
- для РНК-содержащих плюс-нитевых вирусов: РНК вируса → белок вируса;
- для РНК-содержащих ретровирусов: РНК вируса - комплементарная ДНК → иРНК → белок вируса.
Для синтеза иРНК одни вирусы используют клеточные ферменты, другие - собственный набор ферментов (полимераз). Вирусная нуклеиновая кислота кодирует синтез двух классов белков: неструктурных белков-ферментов, которые обслуживают процесс репродукции вирусов на разных его этапах, и структурных белков, которые войдут в состав вирусных частиц потомства. Синтез компонентов вируса (белков и нуклеиновых кислот) разобщен во времени и пространстве, то есть протекает в разных структурах ядра и цитоплазмы клетки. Вот почему этот уникальный способ размножения вирусов называется дисъюнктивным (от лат. disjunctus - разобщенный).
Формирование (сборка) вирусов. Синтезированные вирусные нуклеиновые кислоты и белки обладают способностью специфически «узнавать» друг друга и при достаточной их концентрации самопроизвольно соединяются в результате гидрофобных, солевых и водородных связей. Существуют следующие общие принципы сборки вирусов, имеющих разную структуру:
- формирование вирусов является многоступенчатым процессом с образованием промежуточных форм;
- сборка просто устроенных вирусов заключается во взаимодействии молекул вирусных нуклеиновых кислот с капсидными белками и образовании нуклеокапсидов (например, вирусы полиомиелита). У сложно устроенных вирусов сначала формируются нуклеокапсиды, с которыми взаимодействуют белки суперкапсидных оболочек (например, вирусы гриппа);
- формирование вирусов происходит не во внутриклеточной жидкости, а на ядерных или цитоплазматических мембранах клетки;
- сложно организованные вирусы в процессе формирования включают в свой состав компоненты клетки-хозяина (липиды, углеводы).
Выход вирусов из клетки. Различают два основных типа выхода вирусного потомства из клетки. Первый тип - взрывной - характеризуется одновременным выходом большого количества вирусов. При этом клетка быстро погибает. Такой способ выхода характерен для вирусов, не имеющих суперкапсидной оболочки. Второй тип - почкование. Он присущ вирусам, имеющим суперкапсидную оболочку. На заключительном этапе сборки нуклеокапсиды сложно устроенных вирусов фиксируются на клеточной плазматической мембране, модифицированной вирусными белками, и постепенно выпячивают ее. В результате выпячивания образуется «почка», содержащая нуклеокапсид. Затем «почка» отделяется от клетки. Таким образом, внешняя оболочка этих вирусов формируется в процессе их выхода из клетки. При таком механизме клетка может продолжительное время продуцировать вирус, сохраняя в той или иной мере свои основные функции.
Время, необходимое для осуществления полного цикла репродукции вирусов, варьирует от 5 - 6 ч (вирусы гриппа, натуральной оспы и др.) до нескольких суток (вирусы кори, аденовирусы и др.). Образовавшиеся вирусы способны инициировать новые клетки и проходить в них указанный выше цикл репродукции.
Интегративный тип взаимодействия (вирогения). Характеризуется встраиванием (интеграцией) нуклеиновой кислоты вируса в хромосому клетки. При этом вирусный геном реплицируется и функционирует как составная часть клеточного генома. Интеграция вирусного генетического материала с ДНК клетки характерна для определенных групп вирусов: бактериофагов, опухолеродных (онкогенных) вирусов, некоторых инфекционных вирусов (вирус гепатита В, аденовирус, ВИЧ). Для интеграции с хромосомой клетки необходима кольцевая форма двунитчатой вирусной ДНК. У ДНК-содержащих вирусов (вирус гепатита В) их ДНК обладает свойством встраиваться в геном клетки при участии ряда ферментов. У некоторых РНК-содержащих вирусов (ВИЧ, онкогенные вирусы) процесс интеграции более сложный и является обязательным в цикле их репродукции. У этих вирусов сначала на матрице РНК с помощью вирусспецифического фермента обратной транскриптазы (ревертазы) синтезируется ДНК-копия, которая затем встраивается в ДНК клетки. ДНК вируса, находящаяся в составе хромосомы клетки, называется ДНК-провирусом. При делении клетки, сохраняющей свои нормальные функции, ДНК-провирус переходит в геном дочерних клеток, то есть состояние вирогении наследуется. ДНК-провирус несет дополнительную генетическую информацию, в результате чего клетки приобретают ряд новых свойств. Так, интеграция может явиться причиной возникновения ряда аутоиммунных и хронических заболеваний, разнообразных опухолей. Под воздействием ряда физических и химических факторов ДНК-провирус может исключаться из клеточной хромосомы и переходить в автономное состояние, что ведет к репродукции вируса.
КУЛЬТИВИРОВАНИЕ И ИНДИКАЦИЯ ВИРУСОВ
Культивирование вирусов человека и животных проводят с целью лабораторной диагностики вирусных инфекций, для изучения вопросов патогенеза и иммунитета, получения диагностических и вакцинных препаратов, применяют в научно-исследовательской работе. Поскольку вирусы являются абсолютными паразитами, их культивируют или на уровне организма, или на уровне живых клеток, выращиваемых вне организма в искусственных условиях. В качестве биологических моделей для культивирования используют лабораторных животных, развивающиеся куриные эмбрионы и культуры клеток.
Лабораторные животные (белые мыши, хлопковые крысы, кролики, хомяки, обезьяны и др.) в начальный период развития вирусологии были единственной экспериментальной биологической моделью, которую использовали для размножения и изучения свойств вирусов. На основании развития типичных признаков заболевания и патоморфологических изменений органов животных можно судить о репродукции вирусов, то есть проводить индикацию вирусов. В настоящее время применение этой модели для диагностики ограничено из-за невосприимчивости животных ко многим вирусам человека.
Куриные эмбрионы предложены в качестве экспериментальной модели для культивирования вирусов в середине 30-х гг. прошлого века Ф. Бернетом. К достоинствам модели относятся возможность накопления вирусов в больших количествах, стерильность объекта, отсутствие скрытых вирусных инфекций, простота техники работы. Для культивирования вирусов исследуемый материал вводят в различные полости и ткани куриного зародыша.
Индикацию вирусов осуществляют по характеру специфических поражений оболочек и тела эмбриона, а также феномену гемагглютинации - склеиванию эритроцитов. Явление гемагглютинации впервые было обнаружено в 1941 г. при культивировании в куриных эмбрионах вирусов гриппа. Позднее было установлено, что гемагглютинирующими свойствами обладают многие вирусы. На основе этого феномена была разработана техника реакции гемагглютинации (РГА) вне организма (in vitro), которая широко применяется для лабораторной диагностики вирусных инфекций. Куриные эмбрионы не являются универсальной биологической моделью для вирусов. Почти неограниченные возможности появились у вирусологов после открытия метода выращивания культур клеток.
Метод культур клеток - выращивание различных клеток и тканей вне организма на искусственных питательных средах - разработан в 1950-х гг. Дж. Эндерсом с сотрудниками. Подавляющее большинство вирусов способно размножаться на культурах клеток. Для приготовления таких культур используют самые разнообразные ткани человека, животных и птиц. Большое распространение получили культуры клеток из эмбриональных и опухолевых (злокачественно перерожденных) тканей, обладающих по сравнению с нормальной тканью взрослого организма более активной способностью к росту и размножению. В зависимости от техники приготовления и культивирования различают три типа культур клеток и тканей: однослойные культуры клеток; культуры суспензированных клеток; органные культуры.
Наибольшее практическое применение получили однослойные культуры, растущие на поверхности стекла лабораторной посуды в виде монослоя клеток. Однослойные культуры клеток в зависимости от числа жизнеспособных генераций, в свою очередь, подразделяются на первичные, или первично-трипсинизированные (способны размножаться однократно), перевиваемые, или стабильные (способны перевиваться в лабораторных условиях в течение неопределенно длительного срока), и полуперевиваемые (способны размножаться в течение 40-50 пассажей). Культуры суспензированных клеток растут и размножаются во взвешенном состоянии при постоянном интенсивном перемешивании среды. Они могут быть использованы для накопления большого количества вирусов. Некоторые вирусы лучше размножаются в органных культурах, которые представляют собой кусочки органов животного и человека, выращиваемых вне организма и сохраняющих свойственную данному органу структуру. В зависимости от свойств вируса подбирают наиболее чувствительную к данному вирусу культуру клеток, на которой возможна его репродукция.
О размножении вирусов в культуре клеток свидетельствуют следующие признаки:
- цитопатический эффект;
- образование в клетках включений;
- образование бляшек;
- феномен гемадсорбции;
- «цветная» реакция.
Цитопатический эффект (ЦПЭ или ЦПД) - видимые под микроскопом морфологические изменения клеток вплоть до их гибели, возникающие в результате повреждающего действия вирусов. Характер ЦПЭ, вызванного разными вирусами, неодинаков. Включения представляют собой скопления вирусных белков или клеточного материала, которые можно обнаружить в ядре или цитоплазме клеток при специальных методах окраски. Бляшки, или «негативные колонии» вирусов, - участки разрушенных вирусами клеток; их можно обнаружить при культивировании вирусов на однослойных клеточных культурах, покрытых тонким слоем агара. Бляшки, образуемые разными вирусами, отличаются по величине, форме, времени появления, поэтому реакцию бляшкообразования используют для дифференциации вирусов. Феномен гемадсорбции - способность клеточных культур, зараженных вирусом, адсорбировать на своей поверхности эритроциты. Механизмы реакций гемадсорбции и гемагглютинации сходны. Многие вирусы обладают гемадсорбирующими свойствами. «Цветная» реакция основана на разнице в цвете индикатора питательной среды, используемой для культур клеток. При росте клеток, не пораженных вирусом, накапливаются продукты метаболизма, что приводит к изменению цвета индикатора питательной среды. При репродукции вирусов в культуре нарушается нормальный метаболизм клеток и среда сохраняет первоначальный цвет.
БАКТЕРИОФАГИ
Бактериофаги (от «бактерия» и греч. phagos - пожиратель) - вирусы бактерий, обладающие способностью специфически проникать в бактериальные клетки, репродуцироваться в них и вызывать их растворение (лизис).
История открытия бактериофагов связана с именем канадского исследователя Ф. д'Эрелля (1917 г.), который обнаружил эффект лизиса бактерий, выделенных из испражнений больного дизентерией. Такие явления наблюдали и другие микробиологи (Н.Ф. Гамалея, 1898 г.; Ф. Туорт, 1915 г.), но лишь Ф. д'Эрелль, предположив, что имеет дело с вирусом, выделил этот «литический фактор» с помощью бактериальных фильтров и назвал его бактериофагом. В дальнейшем выяснилось, что бактериофаги широко распространены в природе. Их обнаружили в воде, почве, пищевых продуктах, различных выделениях организмов людей и животных, то есть там, где встречаются бактерии. В настоящее время эти вирусы выявлены у большинства бактерий как болезнетворных, так и неболезнетворных, а также ряда других микроорганизмов (например, грибов). Поэтому в широком смысле слова их стали называть просто фагами. Фаги различаются по форме, структурной организации, типу нуклеиновой кислоты и характеру взаимодействия с микробной клеткой.
Морфология. Большинство фагов под электронным микроскопом имеют форму головастика или сперматозоида, некоторые – кубическую и нитевидную формы. Размеры фагов колеблются от 20 до 800 нм у нитевидных фагов. Наиболее полно изучены крупные бактериофаги, имеющие форму сперматозоида. Они состоят из вытянутой икосаэдрической головки размером 65-100 нм и хвостового отростка длиной более 100 нм. Внутри хвостового отростка имеется полый цилиндрический стержень, сообщающийся отверстием с головкой, снаружи – чехол, способный к сокращению наподобие мышцы. Хвостовой отросток заканчивается шестиугольной базальной пластинкой с короткими шипами, от которых отходят нитевидные структуры – фибриллы (рис.12). Существуют также фаги, имеющие длинный отросток, чехол которого не способен сокращаться, фаги с короткими отростками, аналогами отростков, без отростка.

Рис. 12. Структура частицы Т-чѐтного фага: 1 - головка; 2 - отросток; 3 - воротничок; 4 - стержень диаметром 8 нм; 5 - чехол; б - фибриллы отростка; 7 - базальная пластинка с шестью шипами
Химический состав. Фаги состоят из двух основных химических компонентов - нуклеиновой кислоты (ДНК или РНК) и белка. У фагов, имеющих форму сперматозоида, двунитчатая ДНК плотно упакована в виде спирали внутри головки. Белки входят в состав оболочки (капсида), окружающей нуклеиновую кислоту, и во все структурные элементы хвостового отростка. Структурные белки фага различаются по составу полипептидов и представлены в виде множества идентичных субъединиц, уложенных по спиральному или кубическому типу симметрии. Кроме структурных белков, у некоторых фагов обнаружены внутренние (геномные) белки, связанные с нуклеиновой кислотой, и белки-ферменты (лизоцим, АТФ-аза), участвующие во взаимодействии фага с клеткой.
Резистентность. Фаги более устойчивы к действию химических и физических факторов, чем бактерии. Ряд дезинфицирующих веществ (фенол, этиловый спирт, эфир и хлороформ) не оказывают существенного влияния на фаги. Высокочувствительны фаги к формалину и кислотам. Инактивация большинства фагов наступает при температуре 65 - 70 °С. Длительное время они сохраняются при высушивании в запаянных ампулах, замораживании при температуре -185 °С в глицерине.
Взаимодействие фага с бактериальной клеткой. По механизму взаимодействия различают вирулентные и умеренные фаги. Вирулентные фаги, проникнув в бактериальную клетку, автономно репродуцируются в ней и вызывают лизис бактерий. Процесс взаимодействия вирулентного фага с бактерией протекает в виде нескольких стадий и похож на процесс взаимодействия вирусов человека и животных с клеткой хозяина. Однако у фагов, имеющих хвостовой отросток с сокращающимся чехлом, он имеет особенности. Эти фаги адсорбируются на поверхности бактериальной клетки с помощью фибрилл хвостового отростка. В результате активации фагового фермента АТФазы происходит сокращение чехла хвостового отростка и внедрение стержня в клетку. В процессе «прокалывания» клеточной стенки бактерии принимает участие фермент лизоцим, находящийся на конце хвостового отростка. Вслед за этим ДНК фага, содержащаяся в головке, проходит через полость хвостового стержня и активно впрыскивается в цитоплазму клетки. Остальные структурные элементы фага (капсид и отросток) остаются вне клетки (рис. 13).
После биосинтеза фаговых компонентов и их самосборки в бактериальной клетке накапливается до 200 новых фаговых частиц. Под действием фагового лизоцима и внутриклеточного осмотического давления происходит разрушение клеточной стенки, выход фагового потомства в окружающую среду и лизис бактерии. Один литический цикл (от момента адсорбции фагов до их выхода из клетки) продолжается 30-40 мин. Процесс бактериофагии проходит несколько циклов, пока не будут лизированы все чувствительные к данному фагу бактерии.
Рис. 13. Цикл литического развития фага
Взаимодействие фагов с бактериальной клеткой характеризуется определенной степенью специфичности. По специфичности действия различают поливалентные фаги, способные взаимодействовать с родственными видами бактерий, моновалентные фаги, взаимодействующие с бактериями определенного вида, и типовые фаги, взаимодействующие с отдельными вариантами (типами) данного вида бактерий.
Умеренные фаги лизируют не все клетки в популяции, с частью из них они вступают в симбиоз, в результате чего ДНК фага встраивается в хромосому бактерии. В таком случае геномом фага называют профаг. Профаг, ставший частью хромосомы клетки, при ее размножении реплицируется синхронно с геномом бактерии, не вызывая ее лизиса, и передается по наследству от клетки к клетке неограниченному числу потомков. Биологическое явление симбиоза микробной клетки с умеренным фагом (профагом) называется лизогенией, а культура бактерий, содержащая профаг, получила название лизогенной. Это название (от греч. lysis - разложение, genea - происхождение) отражает способность профага самопроизвольно или под действием ряда физических и химических факторов исключаться из хромосомы клетки и переходить в цитоплазму, то есть вести себя как вирулентный фаг, лизирующий бактерии.
Лизогенные культуры по своим основным свойствам не отличаются от исходных, но они невосприимчивы к повторному заражению гомологичным или близкородственным фагом и, кроме того, приобретают дополнительные свойства, которые находятся под контролем генов профага. Изменение свойств микроорганизмов под влиянием профага получило название фаговой конверсии. Последняя имеет место у многих видов микроорганизмов и касается различных их свойств: культуральных, биохимических, токсигенных, антигенных, чувствительности к антибиотикам и др. Кроме того, переходя из интегрированного состояния в вирулентную форму, умеренный фаг может захватить часть хромосомы клетки и при лизисе последней переносит эту часть хромосомы в другую клетку. Если микробная клетка станет лизогенной, она приобретет новые свойства. Таким образом, умеренные фаги являются мощным фактором изменчивости микроорганизмов.
Умеренные фаги могут нанести вред микробиологическому производству. Так, если микроорганизмы, используемые в качестве продуцентов вакцин, антибиотиков, продуктов питания и других биологических веществ, оказываются лизогенными, существует опасность перехода умеренного фага в вирулентную форму, что неминуемо приведет к лизису производственного штамма.
Практическое использование фагов. Применение фагов основано на их строгой специфичности действия. Фаги используют в диагностике инфекционных заболеваний:
- с помощью известных (диагностических) фагов проводят идентификацию выделенных культур микроорганизмов. Вследствие высокой специфичности фагов можно определить вид возбудителя или варианты (типы) внутри вида. Фаготипирование имеет большое эпидемиологическое значение, так как позволяет установить источник и пути распространения инфекции;
- с помощью тест-культуры можно определить неизвестный фаг в исследуемом материале, что указывает на присутствие в нем соответствующих возбудителей.
Фаги применяют для лечения и профилактики инфекционных болезней. Производят брюшнотифозный, дизентерийный, синегнойный, стафилококковый фаги и комбинированные препараты. Способы введения в организм: местно, энтерально или парентерально.
Умеренные фаги используют в генетической инженерии и биотехнологии в качестве векторов для получения рекомбинантных ДНК.
§ 3.6. Регуляторные системы прокариот (механизмы саморегуляции)
Для осуществления реакций окисления в окружающей среде должны быть акцепторы водорода (электронов): для аэробов это О2, а для анаэробов или могут быть органические вещества или органические субпродукты расщепления углеводов, или неорганические соединения (NO3-, SO42- и т.п.). Благодаря обмену источников углерода бактерии синтезируют промежуточные продукты, необходимые для образования основных биополимеров. Окисление источников энергии приводит к накоплению АТФ, что позволяет бактериям обеспечивать себя энергией, необходимой для биосинтеза субъединиц биополимеров и их активации. Активированные субъединицы полимеризуются и образуют макромолекулы, которые саморегулируются, формируя субклеточные и клеточные структуры. В результате биомасса клетки удваивается за определенный срок (клеточный цикл), и она размножается путем бинарного деления.
В одно и то же время в бактериальной клетке совершается огромное количество биохимических процессов, завершающихся в конечном счете увеличением биомассы. Это предполагает наличие у нее совершенных механизмов саморегуляции, чутко реагирующих на все изменения условий ее жизни. В настоящее время эти механизмы разделяют на две основные группы: а) группа неспецифических механизмов регуляции роста и размножения; б) группа специфических механизмов саморегуляции.
К неспецифическим механизмам относится совокупность действий различных физико-химических факторов, регулирующих общую скорость всех основных процессов жизнедеятельности. К ним относятся: температура, рН, rH2, концентрация ионов, степень обеспечения среды кислородом, давление и др. Неспецифический характер этой формы регуляции заключается в том, что она влияет, прежде всего, на общую кинетику биосинтетических процессов. Регулируя оптимальное соотношение всех указанных факторов, можно получить максимальную скорость размножения бактерий и максимальный выход биомассы в соответствующих производствах.
Действие физико-химических факторов опосредуется через специфические механизмы саморегуляции клетки. Она носит многоступенчатый характер и отличается выраженной универсальностью, вытекающей из того, что специфическая саморегуляция связана с ферментами, катализирующими биохимические реакции, а все ферменты имеют одинаковую химическую природу. Взаимодействие на уровне фермент - субстрат является важнейшим пусковым моментом всей клеточной системы саморегуляции. Именно на этом уровне происходит интеграция неспецифических и специфических механизмов саморегуляции клетки.
Специфичность взаимодействия фермента с субстратом детерминирована генетически - она обусловлена последовательностью расположения аминокислот в белковой молекуле и определяемыми ею вторичной, третичной и четвертичной структурами молекулы фермента. В связи с этим никаких дополнительных механизмов регуляции на уровне фермент - субстрат не требуется. Синтезированный фермент готов в любой момент, если не изменена его аллостерическая структура, вступить в реакцию с соответствующим
Как известно, скорость ферментативной реакции можно также выразить уравнением
V=К+2[E0][S] / Km+[S],
где К+2 - константа субстрата;
E0 - начальная концентрация фермента;
Km - константа Михаэлиса;
S - концентрация субстрата.
При увеличении концентрации S, когда S>Km, скорость ферментативной реакции ν будет стремиться к некоторой постоянной величине νмакс - максимальной скорости реакции:
ν = K+2[E0] = νмакс
То есть при малых величинах концентрации субстрата скорость реакции будет находиться в линейной зависимости от S, а при очень высокой концентрации субстрата скорость реакции ν будет стремиться к максимальной νмакс и мало зависеть от дальнейшего увеличения концентрации S. В свою очередь, при условии, когда S > Е0, скорость реакции будет пропорциональна концентрации фермента.
Колебание температурного режима оказывает на ферментативные реакции влияние таким же образом, как и на другие химические реакции. Отношение констант реакций К при более высокой Т2 и более низкой T1 температурах называется температурным коэффициентом:
Q= К2 / К1.
Значение его обычно дается для интервала в 10 °С (Q10). Величину Q10 легко вычислить для любого температурного интервала ∆T по формуле
Q10=K2 .10 / K1 ∆T
Скорость ферментативных реакций зависит также от концентрации водородных ионов. Величина оптимальной рН варьирует в зависимости от типа и свойств ферментов. Даже изоферменты, имеющие одинаковую специфичность к субстрату, могут различаться по оптимуму рН.
Существует специфический механизм саморегуляции скоростей отдельных биохимических реакций, вытекающий из аллостерической природы белков-ферментов: конечный продукт реакции (в случае накопления его некоторого избытка), взаимодействуя с молекулой фермента, так изменяет ее конформацию, что она временно утрачивает свою активность. Этот принцип саморегуляции, получивший название регуляции по типу отрицательной обратной связи, или торможения конечным продуктом, носит универсальный характер. С его помощью создаются идеальные условия для саморегуляции, так как он не требует никакой дополнительной затраты энергии и вещества. Запуск реакций, ведущих к превращению субстрата, осуществляется самим субстратом, а их остановка - конечным продуктом. Как только содержание конечного продукта достигает определенного уровня, дальнейший синтез его прекращается. Конечный продукт выступает в роли регулятора собственного синтеза.
Помимо этого уровня саморегуляции, определяющего кинетику единичных ферментативных реакций, общую скорость и координацию большинства биохимических процессов, существует высшая форма клеточной саморегуляции, осуществляемая на генетическом уровне. В соответствии с химическими сигналами, поступающими как из внешней среды, так и эндогенным путем, клетка автоматически запускает (индуцирует) или подавляет (репрессирует) синтез соответствующих ферментов. Эффекты индукции и репрессии противоположны по своим проявлениям, они представляют собой две стороны одного и того же процесса, а именно регуляции образования ферментов. Благодаря механизмам индукции и репрессии, реализуемым с помощью соответствующих генов (регуляторов, операторов, промоторов, аттенуаторов т.п.) и белков (репрессоров, активаторов, апорепрессоров и т.п.), клетка в соответствии с химическими сигналами осуществляет автоматический контроль биосинтеза необходимых ей в данное время ферментов.
Одним из проявлений регуляции синтеза ферментов на уровне генома служит постоянная или временная катаболитная репрессия. Суть ее в том, что некоторые источники углерода, принимающие участие в энергетическом обмене, например глюкоза, способны подавлять биосинтез определенных ферментов.
У бактерий обнаружены различные системы, способные воспринимать из внешней среды физические и химические сигналы. У многих патогенных бактерий (E.coli, Y.pestis, Y.pseudotuberculosis) обнаружены термоиндуцибельные системы, контролирующие синтез факторов патогенности. Например, у E.coli при температуре 18-20 °С практически не происходит синтез факторов адгезии (пилей). Повышение температуры до 37 °С индуцирует их образование. Такой же температурозависимый контроль синтеза факторов патогенности обнаружен у возбудителей чумы, дизентерии (шигеллы) и других заболеваний. Целесообразность этих систем очевидна: факторы патогенности необходимы для обеспечения их существования в организме животных или человека, то есть при 37°С.
Другим примером того, как бактерии реагируют на физические сиг- налы, является феномен «теплового шока», описанный в 1952 г. Ф. Ритос- сой. Он заключается в том, что нагревание среды до 42 °С активирует работу ряда генов, вследствие чего в 5 - 20 раз увеличивается синтез почти 20 белков, играющих ключевую роль в жизни клеток. Главную роль в системе теплового шока играет ген (позитивный регулятор) htpR (heat temperature protein regulator), картированный на 76-й минуте хромосомной карты E. coli.
Обнаружена система и «холодового шока»: снижение температуры роста с 37 до 10 °С у E.coli вызывает увеличение в 3 - 300 раз синтеза 13 белков, изменяющих ход ее биосинтетических процессов в новых условиях роста. Обе эти системы связаны друг с другом и с другими системами, в том числе с системой, регулирующей клеточное деление.
Восприятие химических сигналов бактериями осуществляется с помощью так называемых сенсорно-регуляторных систем. Сенсорно-регуляторная система состоит из белка-рецептора (сенсора), который располагается почти, но не всегда на мембране, и белка-регулятора, локализованного в цитоплазме. Примером такой системы является система осмотической регуляции у E.coli: ее сенсором является белок EnvZ, а регулятором - белок OmpR (система EnvZ / OmpR). Белок EnvZ получает информацию из периплазмы, в которой располагается его N-концевой домен. С-концевой домен располагается в цитоплазме и в присутствии АТФ С-домен фосфорилируется, а затем передает фосфорную группу белку-регулятору OmpR. Этот белок контролирует работу двух генов - ompC и ompF, кодирующих синтез белков-поринов наружной мембраны.
При большом количестве взаимодействующих систем для их согласованности, то есть для саморегуляции жизненных процессов клетки, решающее значение имеет соблюдение трех основных условий: во-первых, регулирования количественного и качественного состава самих ферментов в строгом соответствии с сигналами, поступающими из окружающей среды; во-вторых, приспособляемости, то есть корреляции между степенью физиологической активности клетки и условиями среды, которая возникает как неизбежное следствие установления взаимосвязи между динамическими системами клетки; в-третьих, внешних условий - наличия необходимых субстратов, температуры, рН и др., которые индуцируют одни системы и лимитируют активность других систем.
Целесообразность поведения живой системы складывается из совокупности согласованно протекающих в ней саморегулируемых и взаимосвязанных реакций, то есть она обусловлена самой организацией живой системы.
Конечным результатом регуляции протекающих в клетке биосинтетических и катаболитических процессов является воспроизведение потомства, а показателем сбалансированности функционирующих систем служит скорость роста бактерий.
Глава 4. ГЕНЕТИКА МИКРООРГАНИЗМОВ
§ 4.1. Особенности строения генетического аппарата прокариот.
Генетическая система бактерий имеет как минимум четыре особенности, присущие только этим организмам.
- Хромосомы бактерий (и соответственно плазмид) располагаются свободно в цитоплазме, не отграничены от нее никакими мембранами, но связаны с определенными рецепторами на цитоплазматической мембране. Поскольку длина хромосомы во много раз превышает длину бактериальной клетки (длина бактерий в среднем 1,5 - 3,0 мкм, а длина хромосом около 1 мм (у E.coli)), хромосома особым компактным образом в ней упакована. Хромосомная ДНК находится в суперспирализованной форме и свернута в виде петель, число которых составляет 12 - 80 на хромосому. Петли в центре нуклеоида объединяются за счет связывания ДНК с сердцевинной структурой, представленной молекулами РНК (4,5S РНК). Такая упаковка обеспечивает постоянную транскрипцию отдельных оперонов хромосомы и не препятствует ее репликации.
- Бактерии являются гаплоидными организмами, то есть имеют один набор генов, содержание ДНК у них непостоянно. Но оно может при благоприятных условиях достигать значений, эквивалентных по массе 2, 4, 6 и даже 8 хромосомам. У всех прочих живых существ содержание ДНК постоянное, и оно удваивается (кроме вирусов и плазмид) перед делением.
- У бактерий в естественных условиях передача генетической ин формации происходит не только по вертикали, то есть от родительской клетки дочерним, но и по горизонтали с помощью различных механизмов: конъюгации, трансдукции, трансформации.
- У бактерий очень часто помимо хромосомного генома имеется дополнительный плазмидный геном, наделяющий их важными биологическими свойствами, нередко специфическим иммунитетом к различным антибиотикам и другим химиопрепаратам.
Эубактерии - прокариоты, то есть не имеют ни оформленного ядра, ни хромосом, аналогичных таковым эукариотных клеток, поэтому в 40-х гг. XX в. микробиологи считали, что бактерии в генетическом отношении представляют собой неупорядоченную форму жизни. Впервые М. Бейеринк описал у прокариот стабильные, легко распознаваемые и наследуемые изменения, предположил, что бактерии и высшие организмы подчиняются общим генетическим законам. У прокариот весь генетический материал, необходимый для жизнедеятельности, представлен ДНК и локализован в одной хромосоме, то есть бактериальная клетка гаплоидна (рис. 14). В определенных условиях в клетках бактерий может содержаться несколько копий хромосомы.
Рис. 14. На тонком срезе (справа) показан бактериальный нуклеоид в виде компактной массы в центре клетки
Полуконсервативный механизм репликации ДНК (рис. 15), в результате которого из одной родительской двухцепочной молекулы образуются две дочерние молекулы, содержащие по одной родительской и одной вновь синтезированной комплементарной полинуклеотидной цепи, наилучшим образом обеспечивает идентичность исходной и синтезированных молекул и, следовательно, сохранность видоспецифической наследственной информации в ряду поколений клеток и организмов. Частота ошибок, возникающих в процессе репликации, порядка 10-7.
Реализация наследственной информации в процессе жизненного цикла (онтогенеза) организма - двухступенчатый процесс. Сначала с определенных участков ДНК информация переписывается (транскрибируется) в виде комплементарных нуклеотидных последовательностей молекул иРНК, которая перемещается в цитоплазму, связывается с рибосомами, и в рибосоме с иРНК осуществляется перевод (трансляция) генетической информации в определенную последовательность аминокислотных остатков молекулы белка. Процесс транскрипции находится в клетке под строгим контролем, поэтому имеет место как неодинаковое транскрибирование во времени разных участков ДНК (генов), так и неодинаковая скорость, с которой гены могут транскрибироваться. В результате количество молекул иРНК в клетке, комплементарных разным генам, сильно различается. Хотя в целом механизмы синтеза ДНК и РНК сходны, процесс транскрипции не обладает той степенью точности, которая характерна для репликации ДНК. Однако поскольку иРНК не способна к самовоспроизведению, возникающие при ее синтезе ошибки в последующих клеточных генерациях не воспроизводятся и, следовательно, не могут наследоваться.
Рис. 15. Полуконсервативный, дисперсивный и консервативный (конец-в-конец) способы распределения двух родительских цепей ДНК
Несмотря на то, что механизм трансляции отличается высокой точностью, вероятность ошибки в целом выше, чем в случае синтеза молекул нуклеиновых кислот и РНК. Наиболее уязвимый этап - «узнавание» с помощью фермента аминокислоты соответствующей молекулой тРНК. Частота возникновения ошибок на этом этапе около 10-4 , что и определяет, возможно, уровень точности процесса синтеза белка в целом. Однако, как и в случае синтеза РНК, белки в процессе трансляции, приводящие к синтезу измененной молекулы белка, не воспроизводятся, если они не закодированы исходно в генетическом материале. Только изменения, происходящие в молекулах ДНК, могут сохраняться в ряду поколений, поскольку они воспроизводятся в процессе репликации.
У многих бактерий обнаружены нехромосомные генетические элементы: плазмиды, умеренные фаги, мигрирующие элементы транспозоны и IS-элементы (от англ. insertion sequences - вставные последовательности). Таким образом, у прокариот большой объем генетической информации оказывается рассредоточенным в нехромосомных элементах. Это заставляет по-новому подходить к вопросу об организации генетической информации в мире прокариот.
Особенность генетической информации, содержащейся в нехромосомных элементах, - ее необязательность для жизнедеятельности бактерий, то есть в ее отсутствии бактериальная клетка жизнеспособна, но, как видно из дальнейшего материала, важная роль нехромосомных генетических элементов заключается в том, что они расширяют возможности существования бактериального вида, обеспечивают обмен генетическим материалом на большие расстояния по горизонтали и играют определенную роль в эволюции прокариот.
§ 4.2. Особенности репликации ДНК эубактерий
У бактерий различают три типа репликации ДНК: вегетативную, конъюгативную и репаративную.
Вегетативная репликация хромосомной и плазмидной ДНК обусловливает передачу генетической информации по вертикали, то есть по наследству от родительской клетки дочерним. Она контролируется соответственно хромосомными и плазмидными генами.
Конъюгативная репликация осуществляется при конъюгативном способе обмена генетическим материалом и контролируется только плазмидными генами. При ней происходит достройка нити ДНК, комплементарной нити, передаваемой от донора реципиенту.
Репаративная репликация является механизмом, посредством которого происходит устранение из ДНК структурных повреждений, или заключительный этап генетической рекомбинации. Эти процессы контролируются хромосомными и плазмидными генами.
Вегетативная репликация. Репликация хромосомной ДНК осуществляется от начальной точки ori (от англ. origin - начало), носит полуконсервативный характер (см. рис. 15), идет одновременно в двух направлениях и заканчивается в точке terminus. Хромосома бактериальной клетки связана в области ori с цитоплазматической мембраной. Репликация ДНК катализируется ДНК-полимеразами.
Сначала происходит раскручивание (деспирализация) двойной цепи ДНК, в результате чего образуется репликативная вилка (разветвленные цепи) (рис. 16). Одна из цепей, достраиваясь, связывает нуклеотиды от 5' - к 3'-концу, другая - достраивается посегментно.

Рис. 16. Репликативная вилка
Поскольку цепи ДНК антипараллельны (если одна нить начинается с 5'-конца, другая - с 3'-конца), а ДНК-полимераза III осуществляет синтез ДНК только в направлении 5'>3', репликация происходит своеобразно (рис. 17): на одной из расплетенных нитей - «прямой», «лидерной» или ведущей - она идет непрерывно, а на другой - «отстающей» - ДНК-полимераза III должна возвращаться, чтобы наращивать нить тоже в направлении 5'>3' прерывисто, через образование сегментов Оказаки, у бактерий длиной около 1000 нуклеотидов (у эукариот - около 200 - 300 нуклеотидов).
Синтез каждого сегмента Оказаки происходит последовательно через следующие стадии:
- Раскручивание нитей ДНК.
- Расплетение (разделение нитей).
- Стабилизация однонитевых участков.
- Формирование праймосомы (праймосома - мультиферментный комплекс, в который входят фермент ДНК-праймаза и ряд других белков).
- Синтез затравочной РНК с участием ДНК-праймазы (от англ. prime - подготавливать). Затравочная РНК необходима для синтеза каждого сегмента Оказаки потому, что сама ДНК-полимераза не способна инициировать синтез ДНК, для этого ей нужна специальная затравка, роль которой и выполняют короткие, длиной не более 10 нуклеотидов, фрагменты РНК, комплементарные ДНК-матрице.
- Синтез сегмента Оказаки.
- Вырезание затравочной РНК и замещение ее дезоксирибонуклеотидами, комплементарными основаниям ДНК-матрицы.
- Сшивание сегмента Оказаки с предсуществующей нитью ДНК с помощью лигазы.
- Суперспирализация новых синтезированных участков нитей ДНК. Ревизия ДНК-полимеразой нового синтезированного фрагмента ДНК: нет ли ошибочного включения нуклеотидов.
Рис. 17. Синтез фрагментов Оказаки. Ведущая цепь синтезируется непрерывной, в то время как отстающая цепь синтезируется в виде фрагментов Оказаки
Если получилась ошибка, происходит вырезание ошибочно включенного нуклеотида с частью этой нити и застройка образовавшейся бреши правильными нуклеотидами. При благоприятных для роста бактерий условиях, когда еще не закончился один цикл репликации, могут возникать вторичные и третичные репликативные вилки, благодаря чему в клетке и происходит увеличение массы ДНК и числа копий хромосом. В осуществлении процессов репликации ДНК участвует целый комплекс ферментов, образующих единую структуру - реплисому. Генетический контроль репликации ДНК осуществляется большим количеством генов (у Е.соИ их не менее 25), локализованных в самой ДНК; это процесс саморегулируемый.
§ 4.3. Формы обмена генетическим материалом у бактерий.
Помимо основного механизма передачи генов - по наследству (по вертикали), у бактерий существуют следующие формы обмена генетическим материалом по горизонтали, то есть между отдельными особями в популяции клеток: трансформация, трансфекция., трансдукция, конъюгация.
Трансформация - перенос генетического материала, заключающийся в том, что бактерия-реципиент захватывает (поглощает) из внешней среды фрагменты чужеродной ДНК. Трансформация может быть спонтанной или индуцированной. Индуцированная (искусственно получаемая) трансформация происходит при добавлении к культуре бактерий очищенной ДНК, полученной из культур тех бактерий, генетические признаки которых стремятся передать исследуемой культуре. Спонтанная трансформация происходит в естественных условиях и проявляется в возникновении рекомбинантов при смешивании генетически различающихся клеток. Она протекает за счет ДНК, попадающей в окружающую среду вследствие лизиса клеток или в результате ее активного выделения жизнеспособными клетками-донорами.
В процессе трансформации происходят значительные изменения поверхностных слоев клетки, которые способствуют поглощению ДНК. Аутолитические ферменты клетки растворяют клеточную стенку в тех участках, где происходит ее синтез. При этом мезосомы через образовавшиеся отверстия соприкасаются с внешней средой, адсорбируют и втягивают внутрь клетки трансформирующую ДНК, где она и вступает в рекомбинацию с ДНК реципиента. В результате этого образуется мерозигота. Клетка делится, и ее потомки наследуют признаки, полученные от донора и реципиента. Однако в других случаях поглощенные фрагменты ДНК разрушаются нуклеазами клетки-реципиента и трансформации не происходит.
Эффективность индуцируемой трансформации во многом зависит от физиологического состояния клеток-реципиентов, а также от размеров трансформирующей ДНК: высокомолекулярная ДНК поглощается труднее, чем менее крупные ее фрагменты. Способность к трансформации обнаружена у ряда родов бактерий, но, по-видимому, роль ее в обмене генетическим материалом среди бактерий в естественных условиях менее существенна, чем роль других механизмов, потому что у многих бактерий имеются особые системы рестрикции и модификации. Эти системы модифицируют свою ДНК (чаще всего путем ее метилирования) и разрушают чужеродную ДНК, если она подобным образом не модифицирована. Эффективность метода генетической трансформации во много раз повышается в том случае, если смесь ДНК и трансформируемых клеток с помощью специального прибора подвергнуть обработке электрическим импульсом. Метод электротрансформации является универсальным, он применим к любым видам бактерий. С помощью этого метода осуществлена трансформация более 100 видов бактерий.
Трансфекция - вариант трансформации бактериальных клеток, лишѐнных клеточной стенки, осуществляемый вирусной (фаговой) нуклеиновой кислотой. С помощью трансфекции удается вызвать у таких бактерий вирусную инфекцию. Трансфекцию можно осуществить и с другими (не бактериальными) клетками, если ввести в них чужеродную ДНК, способную рекомбинировать с ДНК этих клеток или способную воспроизводить вирионы, или самостоятельно реплицироваться.
Трансдукция - перенос генетического материала от клетки-донора к клетке-реципиенту с помощью бактериофагов. Различают трансдукцию неспецифическую и специфическую. Неспецифическая трансдукция - случайный перенос фрагментов ДНК от одной бактериальной клетки к другой. Специфическая трансдукция осуществляется только умеренными фагами, обладающими способностью включаться в строго определенные участки хромосомы бактериальной клетки и трансдуцировать определенные гены.
Конъюгация. Под конъюгацией понимают процесс обмена генетическим материалом (хромосомным и плазмидным), осуществляемый при непосредственном контакте клеток донора и реципиента. Этот процесс контролируется только конъюгативными плазмидами. Аппаратом переноса являются специальные донорные ворсинки (фимбрии, пили), с помощью которых устанавливается контакт между конъюгирующими клетками. Число донорных пилей у клетки невелико и, очевидно, соответствует числу копий конъюгативной плазмиды в клетке. Донорные ворсинки обнаруживают с помощью донорспецифических фагов, которые, адсорбируясь на них, проникают в клетку и вызывают ее лизис. Для каждой группы коньюгативных плазмид существуют свои донорспецифические фаги.
Ворсинки выполняют следующие функции:
- с их помощью устанавливается контакт между донорной и реципиентной клетками;
- они облегчают перенос нити ДНК (она, вероятно, протаскивается через ворсинку);
- стягивают спаривающиеся клетки, что повышает эффективность конъюгации.
Процесс конъюгации протекает через следующие стадии: установление контакта между донором и реципиентом, протаскивание нити ДНК от донора к реципиенту, достройка перенесенной нити ДНК комплементарной ей нитью в реципиентной клетке и рекомбинация между переданной хромосомой (ее фрагментами) и хромосомой клетки-реципиента, размножение мерозиготы и образование клеток, несущих признаки донора и реципиента.
Сущность поверхностного исключения заключается в том, что у бактерии синтезируются белки наружной мембраны, препятствующие (исключающие возможность) проникновению в клетку, несущую плазмиду, другой, но близкородственной ей плазмиды или подавляющие конъюгативную репликацию ее ДНК. Конъюгативная репликация переносимой нити хромосомной или плазмидной ДНК осуществляется также под контролем плазмидных генов. Классическим примером конъюгативной плазмиды является половой фактор, или F-плазмида (F - от англ. fertility - плодовитость). Главная функция этой плазмиды - контроль конъюгации у бактерий кишечной группы. Эта плазмида может находиться как в автономном состоянии, так и интегрироваться в хромосому клетки. Находясь в автономном состоянии, она контролирует только собственный перенос, при котором клетка, лишенная F-плазмиды, превращается в Р+-клетку (клетку, содержащую F-плазмиду). F-плазмида может интегрироваться в определенные участки бактериальной хромосомы, в этом случае она станет контролировать конъюгативный перенос хромосомы клетки. При этом одна из нитей ДНК хромосомы в месте интеграции F-плазмиды разрезается, и ее 5'-конец через донорный мостик начинает протягиваться в клетку-реципиент. Репликация ДНК в этом случае протекает по принципу «крутящегося» кольца. Таким образом, конъюгация начинается с установления контакта между донором и реципиентом с помощью донорной ворсинки. Последняя смыкается с рецептором клеточной мембраны клетки-реципиента. Нередко такой контакт устанавливается не только между двумя клетками, а между многими клетками, образуя агрегаты спаривания. Поскольку донорный мостик является непрочным, процесс конъюгации может в любой момент прерваться. Поэтому при конъюгации может переноситься или часть хромосомы, или, реже, полная хромосома.
§ 4.4. Роль генетической информации в регуляции и контроле метаболизма прокариот.
Цель вегетативной репликации - обеспечить передачу по наследству всех генов. Она происходит последовательно от начала до конца хромосомы, в то время как выражение генетической информации, то есть работа генов, подчиняется другой цели, а именно осуществлению за короткий срок жизненного цикла клетки. Поскольку он включает в себя множество биохимических реакций, сопряженных между собой, это предполагает хорошо согласованную во времени работу генов. Такая их согласованность возможна лишь при определенном жестком и четком управлении ими. Это управление осуществляется основной структурно-функциональной единицей хромосомы - опероном.
Гены, участвующие в реализации генетической информации, разделяют на структурные, или кодирующие (несущие генетическую информацию), и регуляторные (осуществляющие управление репликацией того или иного участка ДНК).
Оперон - это группа структурных генов-цистронов, физически сцепленных друг с другом и с геном-оператором, который управляет их выражением. В состав оперона, как правило, входят структурные цистроны, определяющие синтез ферментов, которые участвуют в цикле связанных между собой биохимических реакций.
Ген-оператор управляет одновременно всей группой структурных генов, которые образуют оперон, иначе говоря, оперон функционирует как самостоятельная единица. В свою очередь, оперон или их группа находится под управлением одного гена-регулятора. Так возникает более сложная структурно-функциональная единица - регулон.
Регулон представляет систему, состоящую из гена-регулятора и одного или нескольких оперонов, находящихся под контролем одного гена-регулятора.
Важным структурным элементом оперона является промотор - область, с которой взаимодействует РНК-полимераза.
В составе оперонов могут быть и другие регуляторные элементы: энхансеры, аттенуаторы, терминаторы и т. п.
Энхансер — генетический элемент, усиливающий транскрипцию оперона (от англ. enhance - усиливать).
Аттенуатор - генетический элемент, ослабляющий работу оперона (от англ. attenuate - разрежать, разбавлять). Аттенуатор - последовательность нуклеотидов, расположенная между промоторным операторным участком оперона и его первым структурным опероном; она кодирует лидерную РНК, ее длина около 150 пар нуклеотидов.
Терминатор (от англ. terminate - заканчивать) - особый участок в структуре аттенуатора (лидерной последовательности), от которого зависит образование участка мРНК, блокирующего синтез лидерной РНК перед началом первого структурного гена соответствующего оперона.
Модель лактозного оперона служит классическим примером организации и работы оперона. Лактоза - дисахарид, она состоит из галактозы и глюкозы, соединенных β-галактозидной связью. Поэтому фермент, разрушающий эти связи, получил название β-галактозидазы.
Лактозный оперон (рис. 18) содержит гены, которые контролируют синтез ферментов, участвующих в превращении лактозы: β-галактозидазу, галактозидпермеазу и тиогалактозидтрансацетилазу. Ген-оператор управляет одновременно выражением всей группы этих генов. В его составе содержится промотор, с которым взаимодействует РНК-полимераза.

Рис. 18. Структура лактозного оперона и элементы его регуляции: I - ген-регулятор; P - промотор; O - оператор; гены, контролирующие синтез: Z - β-галактозидазы; Y - галактозидпермеазы; A - тиогалактозид-трансацетилазы
Работа оперона находится под негативным контролем гена-регулятора, который следит за синтезом белка-репрессора (рис. 19). Белок-репрессор имеет два активных участка: с одним из них взаимодействует индуктор (лактоза), а с помощью другого он прикрепляется к оператору. В отсутствие лактозы белок-репрессор связывается с оператором и блокирует выражение этого оперона. Когда в среде появляется лактоза, она связывается со вторым активным участком репрессора, это приводит к изменению его конформации по типу аллостерического эффекта, и он становится неактивным, репрессия оперона снимается, происходит синтез ферментов.
Негативный контроль работы лактозного оперона хорошо объясняет сущность феномена индукции: нет индуктора - оперон молчит, его работа заблокирована; появился индуктор - оперон разблокирован и активно работает.

Рис. 19. Индукция фермента. Индукция (или репрессия) работы лактозного оперона
Катаболитная репрессия - это форма позитивного контроля транскрипцией, так как регулирующий белок усиливает транскрипцию оперона. Этот процесс был обнаружен в E.coli и упоминался первоначально как эффект глюкозы, потому что глюкоза подавляла синтез некоторых индуцибeльных ферментов, даже при том, что индуктор присутствовал в окружающей среде. Открытие было сделано в процессе изучения регуляции lac-оперона у E.coli. Так как глюкоза разлагается конститутивными ферментами, а лактоза - первоначально индуцибeльными, что случилось, если бы бактерия была выращена в условиях ограниченных количеств глюкозы и лактозы? График роста бактерий в этих условиях будет представлен двухфазной кривой роста, которая покажет две различные стадии активного роста (рис. 20).
В течение первой стадии экспоненциального роста бактерии используют глюкозу как источник энергии, пока вся глюкоза не израсходуется. Затем после второй лаг-фазы лактоза используется в течение второй фазы экспоненциального роста. В течение периода использования глюкозы лактоза не потребляется, потому что клетки неспособны транспортировать и расщеплять дисахарид (лактозу). Глюкоза всегда усваивается первой в предпочтении любому другому сахару. Только после того, как глюкоза полностью израсходуется, будет использоваться лактоза. Лактозный оперон будет подавляться даже в тех случаях, когда лактоза (индуктор) присутствует в питательной среде. Экологическое объяснение этого процесса состоит в том, что глюкоза - более экономичный источник энергии, чем лактоза, так как ее использование требует меньше ферментов, чем утилизация лактозы.

Рис. 20. Двухфазный рост. Кривая роста E.coli в условиях лимитирующих концентраций в смеси глюкозы и лактозы
Вторичная лаг-фаза в течение двухфазного роста представляет время, требуемое для полной индукции lac-оперона и синтеза ферментов, необходимых для использования лактозы (галактозидпермеазы и β-галактозидазы). Только тогда бактериальный рост происходит за счет лактозы.
Глюкоза, как известно, подавляет большое количество индуцибeльных ферментов в клетках бактерий многих видов. Она также подавляет образование индуцибeльных оперонов, запрещая синтез циклического АМФ (цАМФ), нуклеотида, который требуется для инициирования транскрипции большого количества индуцибeльных систем фермента, включая lac-оперон. Роль цАМФ сложна. Он обязан активизировать аллостерический белок, названный САР (катаболитный белок-активатор), который связывается с промотором САР и способствует прикреплению РНК-полимеразы (РНКп) к промотору для инициации транскрипции. Таким образом, для инициации транскрипции гена lac-оперона необходима лактоза, чтобы инактивировать lac-ген-репрессор, а также цАМФ, чтобы связаться с САР, который соединяется с ДНК для облегчения транскрипции.
Эффект глюкозы выполняет полезную функцию у бактерий, необходимую для того, чтобы клетки использовали наиболее доступный источник энергии. Для многих бактерий глюкоза - самый обычный и хорошо утилизируемый субстрат для роста. То есть она косвенно запрещает синтез ферментов, для того чтобы усваивались более бедные источники энергии. В присутствии глюкозы деятельность аденилатциклазы (AЦ) блокирована. AЦ обязана синтезировать цАМФ из ATФ. Поэтому, если концентрация цАМФ низкая, САР неактивен и транскрипция не происходит. В отсутствии глюкозы (концентрация цАМФ высокая) САР активизируется цАМФ, и транскрипция происходит (в присутствии лактозы). Многие положительно управляемые промоторы, типа lac-промотора, не полностью функционируют в присутствии одной РНКп и требуют активации САРом, который кодируется отдельным регулирующим геном и присутствует в конститутивных уровнях. САР активен только в присутствии цАМФ. Прикрепление цАМФ к САРу вызывает конформационное изменение в белке, что позволяет ему связаться с промотором рядом с РНКп связывающим сайтом. САР может очевидно взаимодействовать с РНКп и тем самым усиливать транскрипцию оперона примерно в 50 раз. Позитивная регуляция работы lac-оперона представлена на рис. 21.
В основе другого феномена - феномена репрессии - лежит тот же принцип регуляции. Однако в репрессируемой системе ген-регулятор контролирует синтез апорепрессора, то есть неактивного репрессора, который также имеет два активных центра: один - для взаимодействия с метаболитом (корепрессором), а другой - для специфического связывания с геном-оператором. Апорепрессор становится активным и подавляет работу оперона лишь после взаимодействия с соответствующим корепрессором (метаболитом).
Типичным примером репрессируемой системы является система синтеза ферментов пути образования триптофана у E.coli (рис. 22).
В отсутствии триптофана апорепрессор неактивен и не блокирует работу триптофанов ого оперона.
Рис. 21. Катаболитная репрессия - позитивная регуляция lac-оперона. Действие -усиление транскрипции. Белок САР активизируется цАМФ для связывания с lac-опероном и облегчает прикрепление РНКп к промотору для транскрипции генов, кодирующих ферменты утилизации лактозы

Рис. 22. Генетическая организация оперона триптофана и элементы его регуляции
При избыточном содержании триптофана в среде, в которой размножается E.coli, он, выполняя роль корепрессора, связывается с апорепрессором и вызывает его аллостерическое превращение в активный репрессор.
Последний связывается с геном-оператором, что и приводит к прекращению дальнейшей транскрипции структурных цистронов этого оперона и подавлению синтеза ферментов.
Особенностью триптофанового оперона является наличие в нем между промоторно-операторным участком и его первым структурным цистроном особой последовательности приблизительно из 150 пар нуклеотидов, получившей название лидерной последовательности, или аттенуатора. Роль аттенуатора состоит в регуляции активности РНК-полимеразы и заключается в том, что даже при незначительном избытке триптофана в клетке транскрипция оперона большинством молекул РНК-полимераз преждевременно обрывается в области аттенуатора. По мере же снижения концентрации триптофана все больше и больше молекул РНК-полимераз «проскакивают» этот участок и становятся способными транскрибировать весь оперон. Наоборот, при большом избытке триптофана его молекулы переводят апорепрессор в корепрессор и транскрипция оперона подавляется (рис. 23).

Рис. 23. Репрессия работы оперона триптофана. В отсутствии триптофана неактивный репрессор не может связаться с опероном, чтобы блокировать транскрипцию. Клетки должны синтезировать аминокислоту
Помимо негативных, существуют и позитивные механизмы контроля выражения генетической информации. Они были обнаружены при изучении арабинозного оперона у E.coli. Система позитивного контроля является необходимым атрибутом координированного управления различными оперонами. Таким образом, благодаря сочетанию механизмов индукции и репрессии, негативного и позитивного контроля выражения генетической информации обеспечивается определенная координация между различными функциональными группами оперонов.
§ 4.5. Механизмы изменчивости бактерий. Роль внехромосомных факторов наследственности и транспонируемых элементов.
Первое, что поразило исследователей, когда они поближе познакомились с миром прокариот, - огромное разнообразие присущих им признаков. В процессе экспериментальной работы с прокариотами исследователи часто наблюдали, что популяция одного вида при культивировании в течение длительного времени или в разных условиях подвержена изменениям. Накопилось огромное количество результатов, иллюстрирующих эти изменения, однако механизмы, лежащие в основе наблюдаемых явлений, были непонятны. Успехи, достигнутые за последние десятилетия XX в. в области изучения строения и функционирования генетического аппарата прокариот, позволили разобраться в этом вопросе. Прежде чем переходить к дальнейшему изложению материала, целесообразно ввести некоторые понятия.
Генотипом, или геномом, называют совокупность всех генов, присущих данному организму, то есть его генетическую конституцию.
Под фенотипом понимают совокупность признаков, присущих данному организму. Оказалось, что все наблюдаемые изменения можно разделить на два типа. К первому относят те из них, которые, как правило, проявляются у подавляющего большинства особей в популяции при изменении внешних условий и наблюдаются до тех пор, пока действует фактор, вызвавший эти изменения. Такой тип изменчивости получил название ненаследственного, или модификационного, а само явление названо модификацией. Ко второму типу относятся изменения признаков, которые первоначально возникают как редкие события в популяции особей (с частотой 1 на 104 - 1011 клеток). Если измененные особи имеют некоторое преимущество перед неизмененными, выражающееся в повышенной скорости роста или жизнеспособности, они постепенно накапливаются в популяции и вытесняют исходные особи. Изучение особенностей второго типа изменений привело к заключению, что последние возникают случайно. И наконец, эти изменения постоянны, то есть передаются из поколения в поколение при размножении организма. Такой тип изменчивости был назван наследственным.
МОДИФИКАЦИЯ
Это изменение, происходящее на уровне фенотипа и не затрагивающее клеточный генотип. Все признаки клетки определяются ее генотипом, но в определенных условиях она пользуется не всей заложенной в ней генетической информацией, количество которой гораздо больше, чем необходимо клетке для существования в конкретных условиях. Реакция клетки на изменение внешних условий приводит к проявлению каких-то новых признаков, свойств, которые не обнаруживались в исходной культуре. Однако информация, необходимая для проявления этих признаков, обязательно содержится в клеточном геноме. Модификация есть результат пластичности клеточного метаболизма, приводящего к фенотипическому проявлению «молчащих» генов в конкретных условиях. Таким образом, модификационные изменения имеют место в рамках неизменного клеточного генотипа.
Существует несколько типов модификационных изменений. Наиболее известны адаптивные модификации, то есть ненаследственные изменения, полезные для организма и способствующие его выживанию в изменившихся условиях. Причины адаптивных модификаций кроются в механизмах регуляции действия генов. Адаптивной модификацией является адаптация клеток Е.соli к лактозе как к новому субстрату. У ряда бактерий обнаружена универсальная адаптивная реакция в ответ на различные стрессовые воздействия (высокие и низкие температуры, резкий сдвиг рН и др.), проявляющаяся в интенсивном синтезе небольшой группы сходных белков. Такие белки получили название белков теплового шока, а само явление - синдром теплового шока. Еще не ясны те регуляторные механизмы, которые запускаются в клетке при воздействиях, вызывающих синдром теплового шока, но очевидно, что это универсальный механизм неспецифических адаптивных модификаций. Не все модификации обязательно адаптивны.
Таким образом, модификационная изменчивость не затрагивает генетической конституции организма, то есть не является наследственной. В то же время она вносит определенный вклад в процесс эволюции. Адаптивные модификации расширяют возможности организма к выживанию и размножению в более широком диапазоне условий внешней среды. Возникающие в этих условиях наследственные изменения подхватываются естественным отбором и таким путем происходит более активное освоение новых экологических ниш и достигается более эффективная приспособляемость к ним.
Наследственные изменения
Можно подразделить на изменения, возникающие в результате мутаций и рекомбинаций генетического материала.
МУТАЦИИ
Скачкообразные изменения в генетическом материале клетки, приводящие к появлению новых признаков, получили название мутаций. Они возникают в популяции особей всегда, часто без видимых воздействий на популяцию. Такие мутации, причины возникновения которых нам неизвестны, называются спонтанными. Повышать частоту мутаций по сравнению с фоном, то есть индуцировать их, могут физические, химические и биологические факторы, действующие на генетический материал клетки. Физические факторы - это прежде всего коротковолновое излучение (ультрафиолетовые и рентгеновские лучи). Получение индуцированных мутаций (мутантов) - один из основных способов изучения генетики микроорганизмов.
К химическим мутагенам относят аналоги оснований, акридины, алкилирующие и дезаминирующие агенты. Биологические факторы - это, в первую очередь мигрирующие элементы (транспозоны и IS-элементы).
Мутации, независимо от того, имеют ли они спонтанное происхождение или индуцированы каким-либо мутагеном, по характеру перестроек, происшедших в ДНК, можно разделить на мутации, состоящие в изменении одного нуклеотидного остатка молекулы ДНК, так называемые точковые мутации, и мутации, при которых наблюдается изменение участка молекулы ДНК размером больше одного нуклеотида.
Точковые мутации, в свою очередь, могут быть разделены на несколько классов в зависимости от того, какие конкретно химические перестройки происходят в молекуле ДНК в рамках одного нуклеотидного остатка: замена, вставка или выпадение. К мутациям, затрагивающим сегмент бактериальной хромосомы, ведут выпадение нескольких оснований или даже генов, перемещение их в пределах одной хромосомы, умножение или удвоение части хромосомы. Частым типом структурных повреждений ДНК, вызываемых УФ-излучением, является образование пиримидиновых димеров в результате ковалентного связывания соседних пиримидиновых оснований. Реже УФ вызывает разрыв водородных связей, образование межцепочечных поперечных сшивок и поперечных сшивок между ДНК и белком. Ионизирующие излучения всех видов вызывают, главным образом, одноцепочечные разрывы в ДНК; разрывов, поражающих обе цепи, обычно на порядок меньше. Различные химические мутагены индуцируют образование внутрицепочечных и межцепочечных поперечных сшивок и одноцепочечные разрывы ДНК.
В процессе эволюции прокариоты выработали способы защиты генетического материала от повреждающего воздействия облучения и различных химических факторов. В клетках прокариот обнаружены эффективные системы репарации мутационных повреждений. Наиболее изученными механизмами восстановления повреждений ДНК являются фотореактивация, вырезание повреждений и пострепликационное, или рекомбинационное, восстановление. Фотореактивация - наиболее простой механизм, устраняющий лишь индуцированные УФ-излучением повреждения ДНК, сопровождающиеся образованием пиримидиновых димеров. Особенность фотореактивации состоит в том, что ее действие распространяется только на одну цепь ДНК и не зависит от того, является ли молекула ДНК одно- или двухцепочечной. Осуществляется фотореактивация светозависимым фотореактивирующим ферментом, обеспечивающим специфическое расщепление пиримидиновых димеров. Вырезание повреждений - основной темновой механизм восстановления различных одноцепочечных повреждений ДНК, в том числе и пиримидиновых димеров. Особенность этого механиз- ма репарации заключается в том, что восстановление одноцепочечных повреждений происходит только тогда, когда не повреждена комплементарная цепь молекулы ДНК. В процессе темновой репарации происходит вырезание в одной из цепей молекулы ДНК коротких сегментов (длиной около 30 нуклеотидов).
Механизмы, обеспечивающие восстановление повреждений в обеих цепях молекулы ДНК, зависят от характера повреждений. Принципиальная схема пострепликационного восстановления заключается в следующем: ДНК-полимераза, катализирующая репликацию ДНК, «встретив» на своем пути повреждение, «перескакивает» через него, и процесс репликации продолжается. Образуются две дочерние молекулы, одна из которых содержит в одной цепи первичное повреждение, в другой - брешь, возникшую при репликации и располагающуюся напротив повреждения. Заделывание бреши происходит путем генетического обмена между идентичными цепями сестринских двухцепочечных молекул. В результате каждая из них имеет теперь по одной неповрежденной цепи, которая может служить матрицей в процессе репарации повреждений.
Фенотипическое проявление мутаций. Поскольку мутация - это стабильное изменение наследственного материала клетки, она реализуется по тем же каналам, что и любая другая генетическая информация. На этом пути судьба мутаций различна. Некоторые из них не влияют на признаки организма, оставаясь «молчащими». Такие мутации могут не проявляться в процессе трансляции, то есть не приводить к изменению аминокислотной последовательности синтезируемого белка. В другом случае изменение может происходить вдали от активного центра фермента и потому не сказываться на его функции. Если же мутация приводит к изменению в активном центре или резко влияет на его структуру, это сразу отражается на функциях фермента. Диапазон изменения функциональной активности фермента в этом случае велик: от незначительного понижения активности до полной ее потери. В последнем случае это часто приводит к гибели организма.
Для проявления мутации необходимо, чтобы прошѐл, по крайней мере, один цикл репликации ДНК, в которой исходно имело место изменение нуклеотидной последовательности. Только если это исходное изменение закрепится после репликации в дочерней молекуле ДНК, оно становится стабильным, а отсюда и наследственным.
Так, если мутация привела к нарушению способности синтезировать какой-либо витамин, например тиамин, то в течение нескольких генераций потребность в тиамине у мутантных клеток не обнаруживается. В этот период мутантные клетки используют тиамин, содержащийся в исходной немутантной клетке. Когда же запасы витамина иссякнут, мутанты смогут размножаться только при добавлении экзогенного тиамина.
На проявление мутантных признаков влияет также количество копий хромосомы, содержащихся в клетке. Все прокариоты гаплоидны, имеют набор генов, локализованных в одной хромосоме. В определенных условиях в клетке можно обнаружить несколько копий одной хромосомы. Если в такой клетке произошла мутация, приведшая к нарушению синтеза определенного метаболита, то она сразу (после одного цикла репликации - транскрипции - трансляции) не проявится, поскольку синтез необходимого клетке метаболита будет осуществляться в результате функционирования неповрежденных генов, содержащихся в остальных хромосомных копиях. Для фенотипического выражения мутантного гена необходимо, чтобы он содержался в клетке в «чистом» виде, то есть клетка имела одну копию хромосомы с мутантным геном, или чтобы все копии хромосомы в клетке имели одинаковый генотип. Это происходит через несколько клеточных делений.
РЕКОМБИНАЦИЯ ГЕНЕТИЧЕСКОГО МАТЕРИАЛА
Ко второму типу наследственной изменчивости относятся изменения, возникающие у прокариот в результате рекомбинации генетического материала, при которой происходит частичное объединение геномов двух клеток. Известны три основных способа, приводящих к рекомбинации генетического материала прокариот: конъюгация, трансформация и трансдукция, различающихся механизмами передачи хромосомной ДНК.
Одним из путей переноса генетического материала у прокариот являются плазмиды определенного типа, обладающие генами, обеспечивающими эту возможность. Такие плазмиды помимо переноса собственного генетического материала могут обеспечивать перенос хромосомных генов, плазмид, не обладающих способностью к самостоятельному переносу, а также осуществлять передачу транспозонов из плазмиды в хромосому или другую плазмиду.
Все известные способы передачи генетической информации с помощью плазмид создают огромные возможности для интенсивных генетических обменов между клетками различных бактерий.
Плазмидам и другим нехромосомным генетическим элементам принадлежит основная роль в передаче генетической информации «по горизонтали». Можно предположить, что в природе любая генетическая информация может быть перенесена в любую клетку прокариот, если не прямо, то через посредников. Подтверждением этого могут служить данные по введению с помощью сконструированной плазмиды в бактериальную клетку эукариотной ДНК и ее репродукции там.
Поскольку ДНК плазмид и бактериальных клеток не имеют одинаковых нуклеотидных последовательностей, то есть не являются гомологичными, рекомбинация между ними происходит не по механизму обмена, а по механизму встраивания (рис. 24).
Рекомбинации такого типа происходят также с участием транспозонов и IS-элементов при их перемещении (транспозиции) в пределах хромосомы. Встраивание плазмид и мигрирующих элементов помимо того, что приводит к введению в хромосому дополнительного генетического материала, может вызывать перестройку бактериального генома: нарушать целостность генов или регуляцию их функционирования, то есть вызывать мутации.
Рис. 24. Плазмиды. Встраивание нуклеотидных последовательностей в плазмидную ДНК
Большая роль в изменчивости бактерий и других организмов принадлежит так называемым транспонируемым или мигрирующим генетическим элементам, то есть генетическим структурам, способным в интактной форме перемещаться внутри данного генома или переходить от одного генома к другому, например от плазмидного генома к бактериальному, и наоборот. Они представлены IS-элементами, транспозонами и эписомами. Это линейные молекулы двухнитевой ДНК, размеры которых колеблются от 200 до 6000 пар нуклеотидов. Отличительная особенность мигрирующих элементов - их неспособность к автономной репликации. Мигрирующие элементы могут встраиваться в разные участки бактериальной хромосомы или плазмиды; их репликация осуществляется под контролем тех же механизмов, что и у соответствующей хромосомы или плазмиды. Частота переносов (транспозиции) мигрирующих элементов колеблется от 10-4 до 10-7.
IS-элементы, или вставочные последовательности (от англ. insertion sequence), имеют обычно размеры, не превышающие 2 тысяч пар оснований, или 2 кб (килобаза - тысяча пар оснований). IS-элементы несут только один ген - кодирующий белок транспозазу, с помощью которой IS-элементы встраиваются в различные участки хромосомы. Они содержат информацию, необходимую только для их переноса внутри клетки, никаких выявляемых признаков в них не закодировано. Их обозначают цифрами: IS1, IS2, IS3 и т. д.
Транспозоны (Тn) представляют собой более крупные сегменты ДНК, фланкированные инвертированными IS-элементами. Транспозоны также способны встраиваться в различные участки хромосомы или переходить от одного генома к другому, то есть ведут себя, как IS-элементы, но, помимо генов, обеспечивающих их транспозиции, содержат и другие гены, например гены лекарственной устойчивости. Очень часто они включены в состав R-плазмид. Известны транспозоны, содержащие гены устойчивости к антибиотикам, ионам тяжелых металлов и другим ингибиторам. Для переноса мигрирующих элементов между клетками нужен переносчик, которым могут быть определенные плазмиды или фаги. Встраивание мигрирующих элементов в бактериальную хромосому оказывает мутагенное действие, так как при этом происходит включение фрагмента ДНК, приводящее к изменению порядка расположения нуклеотидов в триплете и, как следствие этого, нарушению процесса транскрипции. Транспозоны, как и IS-элементы, обозначают порядковым номером: Tnl, Тn2, Тn3 и т. д.
К эписомам относятся еще более крупные и сложные саморегулирующиеся системы, содержащие IS-элементы и транспозоны и способные реплицироваться в любом из двух своих альтернативных состояний - автономном или интегрированном - в хромосому клетки-хозяина.
К эписомам относят различные умеренные лизогенные фаги, они отличаются от всех других транспонируемых элементов наличием собственной белковой оболочки и более сложным циклом репродукции.
Собственно эписомы - это вирусы, обладающие, подобно другим транспонируемым элементам, способностью в интактной форме переходить из одного генома в другой.
Таким образом, природа использовала все возможности, вытекающие из особенностей структуры ДНК, для эволюции живой материи: мутации генов, их дупликации, генетические рекомбинации и мобильность некоторых генетических элементов.
ХРОМОСОМНАЯ КАРТА БАКТЕРИЙ
Гены в хромосоме располагаются линейно, поэтому можно изучать их последовательность и составлять хромосомную (генетическую) карту. Такую карту у E.coli получают, изучая время переноса соответствующих генов при конъюгации, прерывая ее через разные промежутки времени. Конъюгационный мостик, образующийся между донором и реципиентом очень непрочен, он легко разрывается при встряхивании, поэтому процесс конъюгации можно прервать в любое время. В связи с этим мерой расстояния между генами служит разница во времени их передачи от донора реципиенту. Время переноса всей хромосомы занимает около 10 мин. Поэтому локализацию генов на хромосоме определяют в минутах их переноса (от 0 до 100 мин). За начало отсчета (0 мин) условно принято положение гена thr (треониновый оперон).
Определение локализации генов на хромосоме называется их картированием, а расположение генов на кольцевой молекуле хромосомы - хромосомной картой, масштаб которой выражается в минутах.
При постоянной скорости передачи ДНК при конъюгации следует, что 1 мин хромосомной карты соответствует в среднем участку ДНК, состоящему из 40 тысяч пар нуклеотидов, или приблизительно из 40 генов. К 1961 г. у E.coli было картировано 60 генов, к 1972 г. - 460 генов, а к 1983 г. было картировано уже более 1000 генов.
Поэтому кольцевидная генетическая карта кишечной палочки приобрела более сложную форму: к основной окружности пришлось добавлять дополнительные, чтобы на них нанести уточненную локализацию тех генов, которые переносятся в течение одной и той же минуты.
Помимо конъюгации, для составления хромосомной карты бактерий использованы методы трансформации и трансдукции. Можно ожидать, что в ближайшие годы составление хромосомной карты кишечной палочки будет завершено. Это позволит создать генетическую энциклопедию бактерии, то есть связать все ее жизненные процессы с конкретными генами. Так как различные приемы обмена наследственным материалом и методы генной инженерии уже освоены, с их помощью можно будет осуществлять любые генетические манипуляции с бактериальной клеткой, разумеется, только в интересах человека, а не ему во вред.
МЕТОДЫ ИЗУЧЕНИЯ ОРГАНИЗАЦИИ ГЕНОМОВ
В настоящее время изучение геномов не ограничивается только картированием генов, стало возможным изучать последовательность расположения нуклеотидов в составе любого гена. Решающим шагом на пути к решению этой проблемы явилось применение особых ферментов рестрикционных эндонуклеаз и разработка метода клонирования генов.
Рестрикционные эндонуклеазы (рестриктазы) - ферменты, расщепляющие ДНК в специфических участках нуклеотидных последовательностей, которые они распознают. Эти ферменты обнаружены у многих бактерий. Они определяют и разрушают чужеродные молекулы ДНК, попадающие в клетку, в том числе при инфицировании их фагами или при трансформации. Таких ферментов обнаружено более 100, и каждый из них распознает в ДНК специфическую последовательность из 4 - 6 нуклеотидов. Каждая рестриктаза способна разрезать двойную спираль ДНК любой длины. При этом образуется серия фрагментов, называемых рестрикционными фрагментами. Сравнение размеров этих фрагментов, полученных при обработке бактериальных или плазмидных геномов (а также ДНК хромосом эукариот), позволяет создавать рестрикционные карты, в которых отмечается локализация каждого разреза участка относительно соседних участков других таких разрезов (рестрикций).
Существенно, что многие рестриктазы вносят разрывы в обе цепи ДНК со смещением на несколько нуклеотидов. Вследствие этого на конце нити одного фрагмента образуется участок, нуклеотидные последовательности которого оказываются комплементарными нуклеотидным последовательностям другой нити с другого конца фрагмента. Такие концевые последовательности, комплементарные друг другу, получили название липких концов. С их помощью образовавшиеся рестрикционные фрагменты будут вновь образовывать кольца в результате спаривания липких концов. Способность рестрикционных нуклеаз разрезать ДНК с образованием липких концов широко используется в технологии создания рекомбинантных ДНК, так как при помощи таких концов можно соединить два любых фрагмента ДНК, если они получены с помощью одной и той же рестриктазы и, следовательно, имеют комплементарные липкие концы. После замыкания последних путем образования комплементарных пар оснований образовавшееся кольцо из фрагментов разных ДНК можно сшить ковалентными фосфодиэфирными связями между противоположными концами каждой нити ДНК с помощью ДНК-лигазы. В этом заключается суть технологии получения рекомбинантных молекул ДНК.
Ранее всего был изучен геном бактериального вируса ФХ174. Его ДНК состоит из 5400 нуклеотидов и содержит 9 генов. Вирус ФХ174 можно увидеть только с помощью электронного микроскопа, а запись его генетической информации, содержащейся в 9 генах, в виде линейной последовательности через буквы (А, Т, Г, Ц) занимает целую страницу текста. Запись в таком же виде информации, имеющейся в хромосоме животной клетки, составит книгу объемом более 500000 страниц!
Изучение генома человека началось в 80-х гг. XX в. В последующем была создана Международная организация по изучению генома человека - HUGO (от англ. Human Genome Organization - организация генома челове- ка). Изучением генома человека занимаются ученые США, Японии, ряда стран Европы, России и др.
Основная задача - определить последовательное расположение всех нуклеотидов (а их 3,5 • 109 пар) во всех 23 парах хромосом человека. Предстоит выяснить молекулярные основы наследственных болезней и определить пути их лечения - рано или поздно генотерапия станет вполне реальной. Уже сейчас осуществляется ДНК-диагностика более 100 наследственных болезней. После открытия структуры ДНК, гена и расшифровки гене- тического кода осуществление программы «Геном человека» будет означать самую фундаментальную революцию в биологии и медицине.
§ 4.6. Плазмиды.
Особенности организации плазмид. Плазмиды обнаружены у многих бактерий, принадлежащих к разным таксономическим группам. Для них характерно стабильное существование в нехромосомном состоянии. Количество плазмидной ДНК в клетке составляет обычно не более нескольких процентов от клеточного генома, а число плазмид колеблется от 1 до 38. Плазмиды - это линейные или кольцевые ковалентно замкнутые молекулы ДНК, содержащие от 1500 до 90000 пар нуклеотидов. Большинство плазмид состоит из трех групп генов: участка ДНК, ответственного за автономную репликацию плазмиды в клетке; системы генов, обеспечивающих возможность переноса плазмид из одной клетки в другую; генов, определяющих свойства, полезные для клетки-хозяина. Отличительная особенность плазмид - способность к автономной репликации. Обычно о присутствии плазмид в бактериальной клетке судят по проявлению определенных признаков, к которым относятся устойчивость к отдельным лекарственным препаратам, способность к переносу генов при конъюгации, синтез веществ антибиотической природы, способность использовать некоторые сахара или обеспечивать деградацию ряда веществ.
Впервые обнаруженные у E.coli генетические элементы, которые передавались у нее по наследству во внехромосомном состоянии, получили название просто генетических факторов. Раньше всего были обнаружены Со l-фактор (фактор, контролирующий у E.coli синтез бактерицидных белков, А. Грациа, 1925 г.) и F-фактор (фактор, контролирующий примитивный половой процесс у бактерий - конъюгацию, У. Хэйс, 1953 г.). Интерес к этим факторам сильно возрос после того, как в 1963 г. японский ученый Т. Ватанабе сообщил, что передача множественной лекарственной устойчивости у дизентерийных бактерий происходит также при участии независимых от хромосомы генетических элементов, названных R-факторами (от англ. resistance - устойчивость). В 1976 г. всем подобного рода генетическим элементам было дано название плазмид и следующее определение:
«Плазмида (внехромосомный генетический элемент) представляет собой репликон, который стабильно наследуется во внехромосомном состоянии». Однако это определение оставляет открытыми вопросы о том, являются ли плазмиды организмами или нет, и о месте плазмид в живой природе.
Поскольку плазмиды имеют собственные гены, которые наделяют их специфическими наследственными признаками и способностью к размножению, они должны быть, несомненно, отнесены к живым организмам. Плазмиды обладают большим сходством с вирусами, поэтому их следует объединить с ними в одно царство в качестве самостоятельного класса. С вирусами их объединяют следующие общие фундаментальные признаки: 1) подобно вирусам, плазмиды не имеют собственной белоксинтезирующей системы; 2) как и у вирусов, у них нет собственной системы мобилизации энергии; 3) плазмиды, как и вирусы, не способны к росту и бинарному делению, они размножаются путем воспроизведения себя из собственного генома (путем саморепликации его); 4) плазмиды, подобно вирусам, являются абсолютными внутриклеточными паразитами.
Вместе с тем плазмиды существенным образом отличаются от вирусов, и поэтому они должны рассматриваться как самостоятельная, обособленная от вирусов группа организмов. Главные отличия их от вирусов следующие:
- Геном плазмид представлен только двунитевой ДНК, у вирусов же имеется более 10 вариантов РНК- и ДНК-геномов. Правда, у некоторых грамположительных бактерий плазмиды существуют не только в виде двунитевых молекул ДНК, но и в виде однонитевых. Однако каждая из них соответствует одной из двух нитей плазмидной ДНК (на долю таких одно нитевых молекул приходится не более 1/3 общего количества копий плаз миды), и в результате репликации, происходящей по типу «крутящегося кольца», однонитевая молекула превращается в двунитевую молекулу плазмидной ДНК.
- Плазмиды в отличие от вирусов и других микроорганизмов вообще не имеют никакой оболочки. Они представляют собой «голые» геномы. Это их главная биологическая особенность.
- В связи с отсутствием белковой оболочки размножение плазмид происходит только путем саморепликации их ДНК и не требует синтеза структурных белков и процессов самосборки.
- Средой обитания вирусов являются клетки бактерий, растений и животных. Средой обитания плазмид - только бактерии.
- В отличие от вирусов плазмиды обладают системами генов, которые наделяют их способностью к самопереносу или к мобилизации на перенос от клетки к клетке.
- Плазмиды и вирусы отличаются друг от друга и по тем последствиям, к которым приводит инфицирование ими клеток. Заражение вирусами в большинстве случаев приводит к подавлению функционирования клеточного генома. Вирулентный вирус размножается в клетке и вызывает ее гибель или нарушает нормальное функционирование (при персистировании). Только умеренные фаги при лизогенизации бактерий наделяют их дополнительными свойствами.
В отличие от вирусов плазмиды, проникая в бактериальную клетку, не размножаются в ней бесконтрольно и не подавляют функции бактериальной хромосомы, а сосуществуют с ней и сами контролируют образование числа возможных своих копий на хромосому клетки. Плазмиды не только не вызывают гибели клеток, которые являются для них естественной средой обитания, а, наоборот, очень часто наделяют их важными дополнительными (селективными) свойствами. Это основное принципиально важное биологическое различие между плазмидами и вирусами. У вирусов клетка ценой собственной жизни способствует размножению вирусов. Плазмиды, наоборот, своим присутствием обеспечивают размножение бактерий в неблагоприятных для них условиях (например, в присутствии химиопрепаратов) и, спасая от гибели бактерии, обеспечивают собственное существование. По уровню молекулярно-генетической организации плазмиды занимают еще более низкое, по сравнению с вирусами, место в иерархии живой материи. Исходя из вышеизложенного, можно заключить, что плазмиды - наипростейшие организмы, лишенные оболочки, собственных систем синтеза белка и мобилизации энергии и представляющие собой особый класс абсолютных внутриклеточных паразитов, наделяющих своих бактерий-хозяев полезными для них свойствами.
В соответствии с теми свойствами, которыми плазмиды наделяют своих носителей, их подразделяют на различные категории (табл. 8). У бактерий очень часто обнаруживают криптические плазмиды, то есть плазмиды, функции которых еще не установлены. Поэтому классификация их, несомненно, будет уточняться. Уже сейчас известны плазмиды, контролирующие различные факторы патогенности бактерий (факторы адгезии, инвазии и т. п.).
Существуют два основных способа определения плазмид у бактерий: 1) биологический - по тем дополнительным признакам, которыми они наделяют своего хозяина; 2) биофизический - по выявлению плазмидных ДНК.
Для изучения биологии плазмид и их молекулярно-генетической организации широко используют различные генетические методы, методы клонирования, выделения чистых плазмидных ДНК, определения их молекулярных масс, составление рестриктограмм путем разрезания различными эндонуклеазами и определения размеров получаемых фрагментов, а также секвенирования. Сами по себе плазмиды, благодаря их относительно малым размерам и способности к саморепликации, очень часто используются в качестве векторов для клонирования самых различных генов и их последующего изучения.
Таблица 8 Классификация плазмид по свойствам, которыми они наделяют своих носителей.
|
Категория
|
Свойства
|
|
F-плазмиды
|
Донорные функции
|
|
R-плазмиды
|
Устойчивость к лекарственным препаратам
|
|
Col-плазмиды
|
Синтез колицинов
|
|
Ent-плазмиды
|
Синтез энтеротоксинов
|
|
Hly-плазмиды
|
Синтез гемолизинов
|
|
Биодеградативные плазмиды
|
Разрушение различных органических и неорганических соединений, в том числе содержащих тяжелые металлы
|
|
Криптические плазмиды
|
Функции неизвестны
|
Большинство плазмид представляют собой кольцевидные суперспирализованные молекулы двунитевой ДНК, размеры которых варьируют от 1500 до 400000 пар нуклеотидов. Кроме того, в ДНК плазмид могут быть гены, которые наделяют клетку-хозяина многими другими свойствами. Очень часто эти гены интегрируются в плазмидную ДНК в виде транспозонов, поэтому молекулярно-генетическая организация плазмид, особенно высокомолекулярных, очень сложна. Для плазмид как живых существ характерны следующие свойства, частью присущие только им и контролируемые их специфическими генами:
- Саморегулируемая репликация. Эта функция свойственна всем живым организмам. В составе плазмидных ДНК имеются фиксированная точка ori (point or origin, точка начала репликации) и соответствующие гены, контролирующие репликацию. Репликация мелких плазмид требует, очевидно, дополнительного участия генов клетки-хозяина.
- Явление поверхностного исключения. Этот механизм не позволяет проникнуть в клетку, уже содержащую плазмиду, другой родственной ей плазмиде. Поверхностное исключение обеспечивается синтезом под контролем генов плазмиды особых белков наружной мембраны, которые препятствуют установлению контакта этой клетки с клеткой, несущей такую же плазмиду, или подавляют конъюгативный метаболизм ДНК этой плазмиды.
- Явление несовместимости. Суть его заключается в том, что две близкородственные плазмиды не могут стабильно сосуществовать в одной клетке, одна из них подвергается элиминации (удалению).
- Контроль числа копий плазмиды на хромосому клетки. Различают малокопийные (1 - 4 копии) и многокопийные плазмиды (12 - 38 копий, например у плазмиды R6K). Наличие собственных генов репликации позволяет плазмиде осуществлять последнюю независимо от каких-либо со бытий хромосомной репликации или клеточного цикла клетки-хозяина.
- Контроль стабильного сохранения плазмид в клетке-хозяине (контроль стабильного поддержания).
- Контроль равномерного распределения дочерних плазмид в дочерние бактериальные клетки.
- Способность к самопереносу (у конъюгативных плазмид).
- Способность к мобилизации на перенос (у неконъюгативных плазмид).
- Способность наделять клетку-хозяина дополнительными важными для него биологическими свойствами, способствующими выживанию бактерий, а следовательно, и плазмид в природе.
Жизненный цикл плазмид складывается из двух главных процессов: вегетативной (или конъюгативной) репликации и равномерного распределения между дочерними клетками. Оба эти процесса относительно независимы друг от друга и контролируются специфическими системами плазмид. Однако вегетативная репликация плазмид и распределение их между дочерними клетками скоординированы с клеточным делением так, что дочерняя клетка стабильно получает необходимое число копий данной плазмиды.
Распространение плазмид. Плазмиды распространяются среди бактерий двумя способами: путем передачи от родительской клетки дочерним клеткам в процессе клеточного деления, то есть по вертикали, и путем переноса между клетками в популяции бактерий независимо от клеточного деления, то есть по горизонтали. Существует несколько генетических механизмов переноса плазмид между бактериальными клетками: а) путем трансформации; б) с помощью трансдуцирующих фагов; в) путем мобилизации на перенос с помощью конъюгативных плазмид; г) с помощью самопереноса, осуществляемого tra-опероном.
В зависимости от наличия или отсутствия этого оперона плазмиды делятся на конъюгативные и неконъюгативные. Основную роль в широком распространении плазмид играет механизм конъюгационной передачи.
Медицинское и общебиологическое значение плазмид. Значение плазмид для медицины состоит в том, что они контролируют синтез различных факторов патогенности у многих видов бактерий, в том числе у возбудителей чумы, сибирской язвы, иерсиниозов, дизентерии, эшерихиозов и др. Не вызывает сомнения, что возникновение диареегенных кишечных палочек (энтеротоксигенных, энтеропатогенных, энтероинвазивных и др.) является следствием приобретения ими плазмид, которые наделяют их факторами адгезии, инвазии и способностью синтезировать термолабильные и термостабильные энтеротоксины. Наличие в природе таких плазмид (особенно с широким кругом хозяев) может стать реальной причиной образования новых вариантов патогенных бактерий.
Не менее важную роль играют R-плазмиды, которые придают бактериям устойчивость к лекарственным веществам.
Общебиологическое значение плазмид заключается в том, что они выполняют, по крайней мере, три важнейшие функции для бактерий, обеспечивая одновременно существование как бактерий, так и собственное. Во-первых, они контролируют у бактерий обмен генетическим материалом. Во-вторых, контролируя синтез факторов патогенности, они обусловливают благоприятные возможности для размножения патогенных бактерий в естественных для них условиях (в организме животного или человека), а следовательно, для сохранения этих видов в природе. В-третьих, плазмиды являются уникальным биологическим средством самозащиты бактерий, так как они обеспечивают их приобретенным и наследуемым специфическим иммунитетом против различных химических (лекарственных и иных) веществ и других агентов.
Таким образом, представляя собой особую группу наиболее просто организованных живых существ, плазмиды сохраняются в природе благодаря взаимовыгодным отношениям, сложившимся между ними и бактериями. Бактерии для них - естественная среда обитания, а они для бактерий - дополнительные свободно циркулирующие между ними геномы с наборами таких генов, которые благоприятствуют сохранению бактерий в природе.
Глава 5
СИСТЕМАТИКА МИКРООРГАНИЗМОВ И ХАРАКТЕРИСТИКИ ОСНОВНЫХ ГРУПП ПРОКАРИОТ
§ 5.1. Основные термины, принятые в микробиологии для обозначения таксономических структур и сообществ микроорганизмов.
Систематика (таксономия) - наука о многообразии и взаимосвязях между организмами. Одна из задач систематики - распределение (классификация) множества организмов по группам (таксонам).
Таксон — группа организмов, объединенная по определенным однородным свойствам в рамках той или иной таксономической категории. Раздел систематики, изучающий принципы классификации, называется таксономией (от греч. taxis - расположение, порядок).
Специальный раздел таксономии - номенклатура - разрабатывает правила присвоения наименований описанным объектам. В систематике бактерий для наименования объекта используют биноминальную номенклатуру К. Линнея, согласно которой биологическому виду присваивают название, состоящее из двух слов: первое определяет принадлежность организма к определенному роду, второе - виду. Названия бактериям присваивают в соответствии с правилами Международного кодекса номенклатуры (зоологической, ботанической, номенклатуры бактерий, вирусов).
Самой крупной таксономической категорией является царство, более мелкими - подцарство, отдел, класс, порядок, семейство, род, вид, подвид и др.
Одной из основных таксономических категорий является вид (species). Вид - это совокупность популяций особей, способных к скрещиванию с образованием плодовитого потомства, обладающих рядом морфологических, биохимических, физиологических признаков, населяющих определенный ареал, обособленных от других видов нескрещиваемостью в природных условиях.
Однако у прокариот размножение половым путем отсутствует, поэтому данный признак для определения видовой принадлежности к ним неприменим. Отнесение прокариотных организмов к одному или разным видам осуществляется в большой степени эмпирическим путем на основе анализа многих признаков, при этом генетическая информация, содержащаяся в нехромосомных генетических элементах, для определения видовой принадлежности не используется.
Поэтому вид микроорганизмов - это совокупность особей, объединенных по сходству морфофизиологических свойств, но отличающихся от других представителей рода.
Виды объединяют в таксоны более высокого ранга - роды, роды - в семейства, далее следуют порядки, классы, отделы, царства. Для высших таксономических категорий пока нет удовлетворительного определения.
Совокупность однородных организмов, выделенных на питательной среде, характеризующаяся сходными морфологическими, тинкториальными, культуральными, биохимическими и антигенными свойствами, называется чистой культурой.
В микробиологии употребляются такие термины, как «штамм» и «клон». Штамм - более узкое понятие, чем вид или подвид. Чистая культура микроорганизмов, выделенных из определенного источника и отличающихся от других представителей вида, называется штаммом. Различия между штаммами не выходят за пределы вида. Клон — еще более узкое понятие, это совокупность потомков, выращенных из единственной микробной клетки.
Для обозначения некоторых совокупностей микроорганизмов, отличающихся по тем или иным свойствам, употребляется суффикс var (разновидность) или type (тип). Поэтому микроорганизмы в зависимости от характера различий обозначают как морфовар или морфотип (отличие по морфологии), резистовар или резистотип (отличие по устойчивости к антибиотикам), серовар или серотип (отличие по антигенам), фаговар или фаготип (отличие по чувствительности к бактериофагам), биовар или биотип (отличие по биологическим свойствам) и т.д.
Например, название сенной палочки пишется как Bacillus subtilis. Первое слово - название рода, которое начинается с прописной буквы, второе слово обозначает вид и пишется со строчной буквы. При повторном написании вида родовое название сокращается до начальной буквы, например B. subtilis.
§ 5.2. Проблемы систематики микроорганизмов.
Первым исследователем, предложившим объединить все обнаруженные почти за два столетия микроорганизмы в одно царство, был Э. Геккель (1866 г.). Он поместил все одноклеточные (микроскопические) организмы в новое царство Protista отдельно от растений (Plantae) и животных (Ani- malia), которые являются многоклеточными (макроскопическими) организмами. Появление электронного микроскопа в 1950-х гг. выявило две группы фундаментально отличающихся клеток среди этого царства: одни клетки содержали окруженное мембраной ядро, а другие не имели этой внутриклеточной структуры. Последние были временно перемещены в четвертое царство Monera (или Moneres), впоследствии названное Procaryotae. Protista оставалось как царство одноклеточных эукариотических микроорганизмов. В 1967 г. было выделено пятое царство - Грибы (Fungi) как отдельное царство многоклеточных эукариотических микроорганизмов.
В XX в. проблемы в систематике микроорганизмов, а бактерий особенно, стали возрастать в связи со стремительно увеличивавшимся объемом знаний об этих организмах.
В 1980-х гг. был проведен филогенетический анализ всех форм клеточной жизни, основанный на сравнительном секвенировании РНК малой субъединицы рибосомы, которая содержится во всех организмах. На этот раз было показано, что существует две группы прокариот, которые не связаны друг с другом так же, как эукариоты и все прокариоты. Таким образом, были определены три клеточные формы жизни: эукариоты, бактерии и археи.
Кроме фундаментальных различий между археями и бактериями, основанных на несходствах в нуклеотидной последовательности 16S-рибосомной РНК, есть много биохимических и фенотипических различий между двумя группами прокариот (см. табл. 1).
Возможно, что успех эукариотических клеток в эволюции основан на слиянии двух форм прокариотических клеток, одни из которых стали цитоплазматическими органеллами (митохондрии и хлоропласты).
Важным шагом в развитии систематики прокариот явилось использование признаков, дающих информацию о химическом строении клетки: состав оснований ДНК, ДНК-ДНК- и ДНК-РНК-гомологии, аминокислотная последовательность белков, строение рибосом, компонентов клеточной стенки и т.д.
§ 5.3. Современная классификация и номенклатура микроорганизмов.
Существуют 2 типа систематики биологических объектов: филогенетическая, или естественная, в основе которой лежит установление родственных (генетических, эволюционных) связей между организмами, и практическая, или искусственная, цель которой - выявление степени сходства между организмами для быстрой их идентификации и установления принадлежности к определенным таксонам. Если существующая систематика высших организмов отражает в определенной мере эволюционные связи между ними, то есть признаки, используемые для выявления степени сходства, отражает и степень родства между этими организмами, то попытка создания на этой же основе систематики прокариот не была успешной.
Сегодня задача быстрой идентификации прокариотных организмов наиболее полно решается с помощью издания «Определитель бактерий», периодически выпускаемого Обществом американских бактериологов с привлечением крупных специалистов в области изучения тех или иных групп бактерий. Первое издание определителя было выпущено в 1923 г. группой американских бактериологов под руководством Д. X. Берги (1860 - 1937 гг.); девятое издание в 4 томах вышло в 1984 - 1989 гг.
В девятом издании «Определителя бактерий» Берги все обнаруженные организмы, отнесенные в царство Рrоcаrуоtaе, разделены на 33 группы. Признаки, по которым осуществляется разделение на группы, как правило, относятся к категории легко определяемых и вынесены в названия групп, например: грамотрицательные аэробные палочки и кокки (группа 4), анаэробные грамотрицательные кокки (группа 8), грамположительные палочки и кокки, образующие эндоспоры (группа 13), скользящие бактерии, образующие плодовые тела (группа 24). Основная идея классификации по Берги - легкость идентификации бактерий.
Для осуществления этого используют совокупность признаков:
- Морфологические признаки - величина, форма, характер взаимо расположения .
- Тинкториальные свойства - способность окрашиваться различны ми красителями. Особенно важным признаком является отношение к окраске по Граму, которое зависит от структуры и химического состава клеточной стенки бактерий. По этому признаку все бактерии делятся на грамположительные и грамотрицательные. Морфологические свойства и отношение к окраске по Граму определяют принадлежность к крупным таксонам - роду, семейству и т.д.
- Культуральные свойства - особенности роста на жидких и плотных питательных средах.
- Подвижность бактерий. Различают подвижные (ползающие или скользящие, плавающие) и неподвижные бактерии.
- Спорообразование - форма и характер расположения споры в клетке.
- Физиологические свойства - способы углеродного (аутотрофы, гетеротрофы), азотного (аминоавтотрофы, аминогетеротрофы) питания; тип дыхания: аэробы, факультативные анаэробы, строгие анаэробы, микроаэрофилы.
- Биохимические свойства - способность ферментировать различные углеводы, протеолитическая активность, образование индола, сероводорода, наличие уреазы и других ферментов и т.д.
- Чувствительность к специфическим бактериофагам.
- Антигенные свойства. Они зависят от химического состава клеточной стенки и жгутиков бактерий.
- Химический состав клеточных стенок (содержание и состав основных сахаров и аминокислот).
- Липидный и жирнокислотный состав. Изучение состава жирных кислот проводят с помощью газовой хроматографии, которая обладает высокой разделительной способностью и чувствительностью.
- Белковые спектры. С помощью методов фракционирования (двумерный электрофорез в полиакриламидном геле) разделяют сложные смеси рибосомных, мембранных или внутриклеточных белков и получают электрофореграммы, или белковые спектры, соответствующей фракции данного вида бактерий.
- Нуклеотидный состав и последовательность нуклеотидов в моле куле ДНК; наличие и характер минорных оснований в ДНК; нуклеотидный состав рибосомальной РНК; последовательность аминокислот в ферментных белках с аналогичными функциями.
Для классификации бактерий все более широко используют методы геносистематики (изучение нуклеотидного состава ДНК и наиболее важных характеристик генома: величины, молекулярной массы, объема и других параметров).
Для девятого издания «Определителя бактерий» Берги характерен отказ от построения классической иерархической системы классификации. Она заменена списком упомянутых выше групп и сохранилась только фрагментами. Ценность определителя состоит в том, что он представляет собой наиболее полную сводку известных бактериальных форм и самое современное пособие для идентификации бактерий.
В этом же руководстве предложена схема деления царства Рrоcarуotae на высшие таксоны (отделы, классы). В основу деления на отделы положено строение клеточной стенки. Название и краткая характеристика отделов и классов представлены в табл. 9.
Таблица 9. Основные характеристики высших таксонов царства Proсaryotae
|
Отдел
|
Краткая характеристика
|
|
Отдел I
Gracilicиtes*
|
Включает организмы с разной морфологией, имеющие грамотрицательную клеточную стенку. Размножаются в основном бинарным делением, в некоторых группах - почкованием, в одной - множественным делением. Спор не образуют. Многие подвижны с помощью жгутиков или скольжения. Аэробные, анаэробные или факультативно анаэробные формы. Отдел подразделяется на 3 класса, объединяющие нефотосинтезирующие (Scotobacteria) и фотосинтезирующие (Anoxyphotobacteria, Oxyphotobacteria) организмы
|
|
Отдел II
Firmicиtes
|
Входят организмы с грамположительной клеточной стенкой. Размножаются в основном бинарным делением. У некоторых образуются эндоспоры. У других - споры на гифах или в спорангиях. Перемещаются с помощью жгутиков. Большинство неподвижны. В состав отдела входят аэробные, анаэробные, факультативно анаэробные формы. В зависимости от морфологии предложено деление на 2 класса: Firmibacteria (кокки, палочки, неветвящиеся нити) и Тhallobacteria (ветвящиеся формы)
|
|
Отдел III
Tenericиtes
|
Относятся прокариоты, у которых отсутствует клеточная стенка и не синтезируются предшественники пептидогликана. Клетки окружены ЦПМ, чрезвычайно плеоморфны. Размножение бинарным делением, почкованием, фрагментацией. Окрашивание по Граму отрицательное. Характерно образование мелких, врастающих в агар колоний. Могут быть сапрофитами, паразитами или патогенами. Представлены одним
классом - Mollicutes
|
|
Отдел IV.
Mendosicиtes
|
Объединены прокариоты, по имеющимся данным претендующие на более раннее происхождение, чем формы, включенные в I и II отделы. Клетки разной формы: кокки, палочки, нити. Многие плеоморфны. Большинство имеют клеточную стенку, но она не содержит типичного пептидогликана. Клеточная стенка может быть построена только из белковых макромолекул или гетерополисахаридов. Окрашивaниe по Граму отрицательное или положительное. Большинство - строгие анаэробы. Многие имеют жгутики. Характеризуются экологическим и метаболическим разнообразием, способностью жить в экстремальных условиях. Объединены в класс Archaeobacteria
|
* Термины образованы от следующих латинских слов: cutes - кожа; gracilis тонкий; firmus - крепкий, прочный; tener - мягкий, нежный; mendosus - ошибочный.
Представленная в «Определителе бактерий» Берги система классификации является строго идентификационной и не решает задачи выявления эволюционных связей между прокариотами. В то же время конечной целью является построение такой системы, в основе которой лежали бы родственные связи между прокариотными организмами.
Первая попытка в этом направлении принадлежит С. Орла-Йенсену, предложившему филогенетическую систему бактерий, основанную на физиологических признаках. Важный шаг на пути создания естественной систематики прокариот связан с успехами молекулярной биологии. В 60-х гг. XX в. было установлено, что все свойства организма определяются уникальными химическими молекулами - ДНК, поэтому бактерии могут быть классифицированы путем сравнения их геномов. По такому признаку, как генетический материал, оказалось возможным на основании выявления степени сходства делать вывод о степени родства между организмами.
Первоначально для таксономических целей сравнивали молярное содержание суммы гуанина и цитозина (ГЦ) в процентах от общего количества оснований ДНК у разных объектов.
Этот показатель у прокариот колеблется от 25 до 75 %. Однако ГЦ-показатель дает возможность только для грубого сравнения геномов. Если организмы имеют одинаковый нуклеотидный состав ДНК, возможно и сходство и различие между ними, поскольку генетическое кодирование основано не только на определенном содержании оснований в единице кодирования (триплете), но и на их взаимном расположении. Колебания нуклеотидного состава ДНК у эукариотных микроорганизмов (мол. %): грибы - 26 - 70, водоросли - 37 - 68, простейшие - 22 - 68; у высших растений и животных - 35 - 45. Колебания в составе оснований ДНК вирусов приблизительно такие же, как у прокариот. Более тонкий метод оценки генетического сходства организмов - сравнение нуклеотидных последовательностей ДНК из разных источников методом ДНК-ДНК-гибридизации. В целом значение данных о строении ДНК для систематики прокариот огромно, так как позволяет перейти от установления степени сходства к выводам о степени родства между организмами.
Помимо анализа молекул ДНК, для установления степени родства между прокариотными организмами разработаны методические подходы, позволяющие сравнивать продукты отдельных генов, выполняющие в клетке одинаковые функции. Это могут быть белки (ферредоксины, цитохромы и др.) или рРНК. С использованием последних в качестве филогенетических маркеров связано крупное открытие, позволяющее по-новому взглянуть на систему живого мира.
Выбор рРНК для решения проблем эволюционной систематики прокариот оказался удачным по ряду причин: эти молекулы обнаружены у всех клеточных форм жизни, что указывает на их древнейшее происхождение; их функции всегда одинаковы; первичная структура в целом характеризуется высокой консервативностью. Особенностью рРНК является ее нахождение вне сферы действия отбора, поэтому данные молекулы эволюционируют в результате спонтанных мутаций, происходящих с постоянной скоростью, и накопление таких мутаций зависит только от времени. Таким образом, мерой эволюционного расстояния между организмами служит количество нуклеотидных замен в молекулах сравниваемых рРНК.
Известно, что в рибосомах прокариот и эукариот присутствуют 3 типа рРНК, различающихся молекулярной массой и коэффициентом седиментации. Информационная емкость крупных молекул больше, но их труднее анализировать. Поэтому наиболее удобным оказался анализ молекул рРНК средней величины: 16S (у прокариот) и 18S (у эукариот), состоящих из 1600 и 2500 нуклеотидов. К настоящему времени последовательности 16S и 18S рРНК изучены более чем у 400 организмов, принадлежащих к разным царствам живой природы. На основании полученных данных рассчитаны коэффициенты сходства сравниваемых организмов, что привело к неожиданным результатам: выявлены не две группы организмов, различающихся прокариотным и эукариотным типами клеточной организации, а три:
- Одну образуют все эукариоты: высшие растения, животные, дрожжи, водоросли и т.п. В эту группу не вошли органеллы эукариот (митохондрии, хлоропласты). Таким образом, первая группа представлена ядерно-цитоплазматическим компонентом эукариотных клеток.
- Ко второй группе, получившей название бактерий, относится подавляющее большинство прокариот. Сюда же попали на основании степе ни гомологии 16S рРНК митохондрии и хлоропласты эукариотных клеток.
- Наконец, в третью группу вошли некоторые малоизученные прокариоты, обитающие в экстремальных условиях: метанобразующие бактерии, экстремальные галофилы и термоацидофилы. Эта группа организмов получила название архебактерий.
Общая характеристика архей. Хотя клетки архей структурно относятся к прокариотному типу, они построены из макромолекул (липидов, полисахаридов, белков), многие из которых являются уникальными и не синтезируются ни эукариотами, ни бактериями. Археи осуществляют ряд биохимических процессов, не свойственных остальным живым организмам. На основании этого был сделан вывод, что археи, по-видимому, представляют собой одну из самых древних групп живых существ.
Среди архей выделяют:
- Метаногены - анаэробы (восстанавливают СО2 до метана по реакции СО2 + 4Н2 = СН4 + 2Н2О + 31,3 ккал/моль, водород потребляют из атмосферы).
- Экстремальные галофилы - аэробы, способные расти в насыщенном растворе NaCl (от 12 - 15 до 32 %). Обладают системой фотосинтеза, отличной от системы фотосинтезирующих бактерий, так как у них нет хлорофилла, но есть бактериородопсин.
- Термоацидофилы - характеризуются высокими оптимальными температурами (от +75 до +90 °С) и низким значением рН (от 5 - 6 до 1 - 2) для своего роста. Экстремальные условия существования архей указывают на то, что их предки возникли тогда, когда физические условия существенно отличались от современных. Патогенных видов среди них не обнаружено. Открытие в мире прокариот группы архей поставило заново вопрос о путях клеточной эволюции с момента возникновения некоей гипотетической первичной клетки.
Традиционная общая схема клеточной эволюции основывается на следующих предположениях: из популяции первичных клеток в результате целого ряда событий, приведших к повышению уровня клеточной организации, под давлением естественного отбора возникла популяция предковых прокариотных клеток, из которых в конечном итоге произошли разные группы прокариот. Маловероятно, чтобы предковые прокариотные клетки все были «на одно лицо». Единственная их общая черта - прокариотная организация (см. табл. 1). Эукариотная клетка возникла в результате эндосимбиоза, в котором ядерно-цитоплазматическим компонентом, то есть клеткой-хозяином, и эндосимбионтами, превратившимися впоследствии в митохондрии и хлоропласты, были существенно различающиеся между собой прокариотные клетки. Следствием такого взгляда на общий ход эволюции явилось признание двух основных надцарств живых организмов - Рrоcаrуоtае и Еucаrуоtае.
§ 5.4. Основные принципы классификации вирусов и характеристика некоторых представителей царства Vira.
В вирусологии используют следующие таксономические категории: семейство (название оканчивается на viridae), подсемейство (название оканчивается на virinae), род (название оканчивается на virus).
Однако названия родов и особенно подсемейств сформулированы не для всех вирусов. Вид вируса биноминального названия, как у бактерий, не получил. В основу классификации вирусов положены следующие критерии (табл. 10):
- тип нуклеиновой кислоты (ДНК или РНК), ее структура, количество нитей (одна или две), особенности воспроизводства вирусного генома;
- размер и морфология вирионов, количество капсомеров и тип симметрии;
- наличие суперкапсида;
- чувствительность к эфиру и дезоксихолату;
- место размножения в клетке;
- антигенные свойства и пр.
Вирусы поражают позвоночных и беспозвоночных животных, а также растения и бактерии.
Являясь основными возбудителями инфекционных заболеваний человека, вирусы также участвуют в процессах канцерогенеза, могут передаваться различными путями, в том числе через плаценту (вирус краснухи, цитомегаловирус и др.), поражая плод человека. Они могут приводить к постинфекционным осложнениям - развитию миокардитов, панкреатитов, иммунодефицитов и др.
Таблица 10 Классификация и некоторые свойства основных вирусов
|
Семейство вирусов
|
Наличие супер- капсида
|
Размер вириона
|
Типовые представители
|
|
ДНК-содержащие вирусы
|
|||
|
Аденовирусы
|
-
|
70 - 90
|
Аденовирусы человека
|
|
Гепаднавирусы
|
+
|
45 - 50
|
Вирус гепатита В
|
|
Герпесвирусы
|
+
|
200
|
Вирусы герпеса, цитомегалии и др.
|
|
Паповавирусы
|
-
|
45 - 55
|
Вирусы папилломы, полиомы
|
|
Парвовирусы
|
-
|
18 - 26
|
Аденоассоциированный вирус
|
|
Поксвирусы
|
+
|
130-240
|
Вирус осповакцины, натуральной оспы
|
|
РНК-содержащие вирусы
|
|||
|
Аренавирусы
|
+
|
50- 300
|
Вирусы Ласса, Мачупо
|
|
Буньянвирусы
|
+
|
90- 100
|
Вирусы лихорадки с почечным синдромом
|
|
Калицивирусы
|
-
|
20 - 30
|
Калицивирусы человека
|
|
Коронавирусы
|
+
|
80- 130
|
Коронавирусы человека
|
|
Ортомиксовирусы
|
+
|
80- 120
|
Вирусы гриппа
|
|
Парамиксовирусы
|
+
|
150-300
|
Вирусы кори, паротита, парагриппа, респираторно-синцитиальный вирус
|
|
Пикорнавирусы
|
-
|
20 - 30
|
Вирусы полиомиелита, ящура, гепатита А
|
|
Рабдовирусы
|
+
|
70- 175
|
Вирус бешенства
|
|
Реовирусы
|
-
|
60 - 80
|
Реовирусы, ротавирусы
|
|
Ретровирусы
|
+
|
80- 100
|
Вирусы лейкоза человека, иммунодефицита человека
|
|
Тогавирусы
|
+
|
30 - 90
|
Вирусы Синдбис, лошадиных энцефалитов
|
|
Флавивирусы
|
+
|
30 - 90
|
Вирус клещевого и японского энцефалитов, желтой лихорадки, краснухи
|
Глава 6 МИКРОФЛОРА БИОСФЕРЫ
§ 6.1. Почвенная биота.
ПОЧВА - СРЕДА ЖИЗНИ
Почва - это самый верхний рыхлый слой земной коры, покрытый растительностью и обладающий плодородием.
Образование почвы - сложный длительный исторический процесс. Почва образовалась в результате изменения материнских горных пород под воздействием физических и биологических факторов. Она содержит как минеральные, так и органические вещества. В результате физических и химических процессов выветривания твердых пород образуются осколки камней различной величины; далее минеральные остатки могут разрыхляться водой, льдом, ветром и участвовать в формировании почвы.
В почвообразовании участвуют три группы организмов: зеленые растения, микроорганизмы и животные, образующие на суше сложные биоценозы. При совместном воздействии организмов в процессе их жизнедеятельности осуществляются важнейшие звенья почвообразования: синтез и разрушение органического вещества, избирательная концентрация биологически важных элементов, разрушение и новообразование минералов, миграция и аккумуляция веществ и другие явления, составляющие сущность почвообразовательного процесса и определяющие формирование главного свойства почвы - плодородия. Вместе с тем функции каждой из этих групп как почвообразователей различны.
Почва обладает некоторыми свойствами, которых лишены воздушная и водная среды. Частицы почвы образуют «мелкоячеистый фильтр», который весьма эффективно задерживает твердые взвеси из вод, просачивающихся в почву. В то же время поры почвы служат копилкой питательных веществ. Всю систему «цементируют» частицы глины и гумуса, которые адсорбируют целый ряд веществ. Таким образом, почвы в течение ряда лет могут удерживать вредные вещества, не давая последним возможности перейти в грунтовые воды. По исчерпании адсорбционной емкости наступает проскок - внешне неожиданное загрязнение грунтовых вод, даже без поступления вредных веществ. Следует отметить, что почвы обладают значительной способностью к регенерации. Многие обитатели почвы служат источником ферментов, в присутствии которых вредные вещества расщепляются быстрее, чем в воде или на воздухе.
Микрофлора почвы характеризуется большим разнообразием микроорганизмов, которые принимают участие в процессах почвообразования и самоочищения почвы, кругооборота в природе азота, углерода и других элементов.
В почве развиваются бактерии, грибы, водоросли и простейшие, входящие в состав лесных и травянистых биоценозов. Общее количество микроорганизмов в почве исчисляется миллионами и миллиардами в 1 г. Их количество минимально в почвах северных широт (подзолистые) и максимально в черноземах и сероземах, формирующихся под травянистой растительностью. На поверхности почвы микроорганизмов достаточно мало, так как на них губительно действуют ультрафиолетовые лучи, высушивание и т.д. Наибольшее количество микроорганизмов содержится в верхних горизонтах почвы, внутрь от поверхности оно уменьшается, и примерно на глубине 3 - 4 м они практически отсутствуют. Характерна неравномерность распределения микроорганизмов в массе почвы: максимальное количество их сосредоточено около живых корешков и на поверхности мертвых растительных остатков. Эта пленка, обогащенная микроорганизмами, называется ризосферой. Большинство микроорганизмов почвы способны развиваться при нейтральном рН, высокой относительной влажности, значениях температуры 25-45 оС.
Общая масса микроорганизмов в почве невелика и составляет, по данным Н.А. Красильникова, 7 - 10 т на 1 га, что при среднем содержании воды около 70 - 80 % составит не более 2 т сухого вещества. Численность микроорганизмов чрезвычайно изменчива в течение одного года вследствие многократно повторяющихся генераций.
Основными функциями микроорганизмов как почвообразователей являются разложение растительных остатков и почвенного гумуса до простых солей, используемых растениями, участие в образовании гумусовых веществ, в разрушении и новообразовании почвенных минералов. Важное значение имеет также способность некоторых групп микроорганизмов к фиксации атмосферного азота.
Эти процессы осуществляются при участии ферментов, часть которых выделяется во внешнюю, по отношению к клетке микроорганизма, среду, часть ферментов работают внутри живой клетки, осуществляя разнообразные реакции синтеза микробной плазмы. Основными группами ферментов являются гидролазы, катализирующие реакции гидролитического расщепления белков, углеводов, липидов, смол, лигнина, дубильных веществ до относительно простых органических соединений, и оксидоредуктазы, катализирующие процессы окисления и восстановления органических соединений до простых минеральных солей.
ГРИБЫ
Грибы составляют царство Mycota, в которое входят эукариотические организмы относительно простой организации - от одноклеточных до нитчатых, мицелиальных, размножающихся спорами. Разрастаясь на поверхности или в глубине субстрата, грибы соприкасаются c ним клеточной оболочкой, через которую они выделяют во внешнюю среду ферменты и поглощают питательные вещества абсорбтивным путем. Такой тип взаимодействия с субстратом определяет положение грибов как редуцентов органических веществ в экосистемах. Почвенные грибы представляют самую крупную экологическую группу, участвующую в минерализации органических остатков растений и животных и в образовании почвенного гумуса.
Признаки грибов, придающие им черты сходства с растениями, следующие: полярность клетки; неограниченный верхушечный рост; наличие ригидной клеточной стенки, вакуолей, поперечных перегородок; способность к синтезу витаминов.
Общие с животными признаки грибов: отсутствие хлорофилла, гетеротрофный тип питания; наличие в клеточной стенке хитина, а не целлюлозы; образование мочевины в процессе азотного обмена; синтез запасных углеводов в форме гликогена; формирование лизосом в цитоплазме; сходная первичная структура дыхательных ферментов - цитохромов и транспортных РНК. Однако у них имеются свойства, характерные только для царства Mycota, а именно: мицелиальная структура вегетативного тела; сложные ядерные циклы и плеоформизм; многоядерность и гетерокариоз (разнокачественность ядер в одной клетке); дикариоз (длительное существование в одной клетке двух ядер, одновременно делящихся и имитирующих диплоидное ядро).
В наземных биогеоценозах основная масса грибов сосредоточена в почве, где их мицелий достигает общей длины 700 - 1000 м в 1 г почвы.
Среди почвенных грибов выделяют пять экологических групп на основании, главным образом, их взаимоотношений с высшими растениями:
- паразиты, находящиеся в почве большей частью в виде спор или покоящихся форм;
- факультативные паразиты подземных и наземных частей растений;
- сапрофиты;
- микоризообразователи;
- хищные грибы.
Выделяют также большую группу грибов-симбионтов, сожительствующих с водорослями и цианобактериями в составе лишайников.
Среди грибов-сапрофитов наиболее распространены плесневые из родов Aspergillus, Penicillium, Trichoderma, Rhizopus. В аэробных условиях они синтезируют и выделяют во внешнюю среду разнообразные гидролитические ферменты, расщепляющие за сутки клетчатку, лигнин, жиры, белки и другие органические соединения. Грибы разлагают в 2 - 7 раз больше органического вещества, чем потребляют. Они участвуют также в минерализации гумуса почвы.
ВОДОРОСЛИ
Почвенными водорослями называют экологическую группировку тех видов водорослей, жизнь которых постоянно связана с почвой. Это простые одноклеточные организмы, нити или колонии. Среди них различают наземные формы, которые при благоприятных условиях разрастаются на поверхности почвы в виде корочек или пленок; водно-наземные, живущие в водной среде постоянно влажных почв; собственно почвенные, обитающие в толще почвенного слоя.
Почвенные водоросли распространены повсеместно, главным образом в поверхностных слоях почвы, где условия для них наиболее благоприятны. Влага - один из самых важных экологических факторов, определяющих распространение водорослей. Однако численность и биомасса их в одной и той же почве будет зависеть не только от влажности, но и от солевого режима и условий освещения. Количество клеток в 1 г почвы составляет от 5 тыс. до 1,5 млн, достигая максимальных значений в почвах, не занятых сплошным покровом высших растений, например в корковом солончаке. Биомасса их в слое 0 - 10 см достигает иногда сотен килограммов на 1 га.
Функции водорослей в почвах определяются, прежде всего, их принадлежностью к фотоавтотрофной группе организмов - первичным продуцентам органического вещества. Продуктивность водорослей в наземных биогеоценозах несравнимо меньшая, чем продуктивность высших растений, однако их биомасса изменчива, она быстро накапливается при благоприятных условиях и легко минерализуется, а также служит пищей для беспозвоночных животных.
Потребность водорослей в питательных веществах различна. На свету водоросли благодаря наличию хлорофилла используют углерод (СО2). Источником азота для них служат минеральные формы этого элемента. Нитраты они усваивают легче других соединений. Водоросли, живущие в темноте, нуждаются в источниках органического углерода и используют его из растительных остатков или из продуктов обмена веществ бактерий. В этих условиях лучший источник азота для них - аммонийный азот. Для водорослей благоприятно высокое содержание органических веществ, поэтому они в больших количествах встречаются в окультуренных и садовых почвах.
В болотных почвах и на рисовых полях водоросли улучшают аэрацию, усваивая растворенный CO2 и выделяя в воду кислород.
Также водоросли активно участвуют в процессах выветривания пород и в первичном процессе почвообразования.
Почвенные водоросли могут быть биоиндикаторами протекающих в почве процессов, газового и солевого режимов, загрязненности почв продуктами промышленной деятельности человека.
ПРОСТЕЙШИЕ
Protozoa — микроскопические одноклеточные животные. Размеры их 5 - 20 мкм, клетки могут быть шаровидной, овальной, сплюснутой или разветвленной формы. Они обычно подвижны и пластичны, то есть легко изменяют форму.
Простейшие обнаружены во всех почвах независимо от типа и географического местонахождения. Однако их число в почве зависит от ее типа, содержания в ней органического вещества, влажности, сезона года, растительности и других факторов, колеблется в значительных пределах и может достигать нескольких миллионов в 1 г абсолютно сухой почвы. В засушливые периоды, а также зимой количество их в почве резко уменьшается, при этом они переходят в инертное состояние, в форму цист.
Биомасса в благоприятных условиях достигает 30-40 г/м2.
У простейших складываются сложные отношения с другими почвенными микроорганизмами. Они поедают бактерии, клетки дрожжей и водорослей, проявляя при этом избирательность в выборе пищи. Есть среди простейших и сапрофаги. Некоторые питаются осмотрофно. Основная их роль в почве - участие в разложении органического вещества и поедание клеток микроорганизмов. Так, почвенные амебы, кроме других бактерий, активно поглощают клетки азотобактера. Уничтожая часть клеток, простейшие поддерживают численность азотобактера на определенном уровне; кроме того, биологически активные вещества простейших положительно влияют на фиксацию азота атмосферы почвенными микроорганизмами.
Некоторые исследователи считают, что простейшие, истребляя почвенные бактерии, оказывают вредное влияние на плодородие почвы, другие отмечают, что интенсивность микробиологических процессов в почве в присутствии Protozoa не только не ослабляется, но даже повышается. Возможно, что простейшие, поедая старые бактериальные клетки, облегчают размножение оставшихся и приводят к появлению значительного числа более молодых и биохимически активных особей.
В почве обитают представители трех классов простейших: жгутиконосцы (Flagellata), саркодовые (Sarcodina) и инфузории (Ciliata).
Жгутиконосцы - это простейшие, имеющие один или несколько жгутиков. Это самые мелкие формы среди почвенных простейших. Некоторые имеют размеры, сопоставимые с бактериями, - 2 - 4 мкм. Среди жгутиконосцев есть виды, содержащие в клетках пигменты, в том числе хлорофилл, и способные к фотосинтезу. Это растительные жгутиконосцы, или фитомастигины. Они занимают промежуточное положение между растениями и животными. Типичный представитель - Euglena viridis (эвглена зеленая).
В почвах встречаются также зеленые Chlamydomonas, бурые Cryptomonas, желтоватые Ochromonas. Некоторые зеленые жгутиконосцы способны менять тип питания, теряя в темноте хлорофилл и переходя на осмотрофный обмен, это так называемые организмы со смешанным типом питания - миксотрофы.
Саркодовые включают голые и раковинные амебы. Характерная их черта - непостоянная форма тела. Они не имеют жесткой пелликулы и образуют псевдоподии, в которые «переливается» плазма.
Раковинные амебы преимущественно сапрофаги. Часть их тела заключена в панцирь, или раковину. Через отверстие псевдоподии вытягиваются наружу, а раковина играет защитную роль. Раковинные корненожки (тестациды) - характерные члены биоценоза сфагновых торфяников, а также кислых почв хвойных лесов. Тестациды развиваются в слое подстилки. Так как раковинки амеб долго сохраняются в почве, то их используют как один из показателей почвенной биодиагностики.
Инфузории - одна из наиболее многочисленных и прогрессирующих групп простейших. В основном это обитатели водоемов, и в почве их значительно меньше, чем других простейших. Клетки их более крупные, имеют многочисленные реснички, сгруппированные в продольные, косые или спиральные ряды.
БАКТЕРИИ
Прокариоты - микроорганизмы с примитивной организацией ядерных структур. Они делятся на четыре группы по признаку строения наружных покровов клетки: грациликуты, фирмикуты, молликуты и мендозикуты; первые три объединяются как эубактерии, четвертая составляет особый таксон - архебактерии (см. табл. 9).
Грациликуты - наиболее обширная и разнообразная по числу видов и физиологическим функциям группа прокариот, объединяющая фототрофные и хемотрофные бактерии.
Фототрофные грациликуты (Photobacteria) делятся на группы Oxyphotobacteria (с кислородным фотосинтезом) и Anoxyphotobacteria (с бескислородным фотосинтезом). К первой группе принадлежат цианобактерии, которые способны к азотфиксации, ко второй - пурпурные и зеленые бактерии.
Хемотрофные грациликуты имеют в почве многочисленных представителей, которые населяют, главным образом, те микрозоны, где имеется легкодоступное органическое вещество, так как большинство из них не способны к гидролизу полимеров.
Псевдомонады - мелкие одиночные подвижные бактерии, не образующие спор. Они, как правило, аэробы. Некоторые способны к денитрификации.
Азотобактерии (Azotobacter) - довольно крупные подвижные палочки с перитрихиальным типом расположения жгутиков. Свободноживущие аэробные азотфиксаторы A. chroococcum — типичные обитатели нейтральных и щелочных почв. Способны образовывать цисты, которые устойчивы к высушиванию, но не к нагреванию. В кислых почвах распространены Вeijerinckia. Это очень слизистые бактерии, в стадии развития которых нет цист.
Клубеньковые бактерии (Rhizobium) - подвижные палочки, не образующие спор. Они живут в свободном состоянии в почве, но способны внедряться через корневые волоски в корни бобовых растений и, размножаясь в клетках растения-хозяина, превращаться в неподвижные искривленные палочки - бактероиды. На этой стадии они фиксируют азот. Под влиянием этих бактерии ткань корня разрастается и образует клубеньки.
Энтеробактерии — многочисленная группа палочковидных бактерий. Типичным представителем является Proteus vulgaris - обитатель почвы, но наиболее обильно развивается в навозе и в хорошо унавоженных почвах. Активный возбудитель гнилостного процесса, при котором происходит распад белков животного происхождения. Он способен также гидролизовать мочевину.
Миксобактерии и цитофаги - слизеобразующие скользящие бактерии. У них сложный цикл развития с образованием плодовых тел. Их вегетативные клетки - тонкие палочки, способные передвигаться по твердому субстрату, образуя плотные слизистые тяжи. При агрегации из клеток и слизи формируются плодовые тела разной формы и цвета. Клетки в созревших плодовых телах превращаются в миксоспоры, которые способны на свежем субстрате прорастать в новые вегетативные палочки. Помимо почвы, миксобактерии растут на навозе травоядных животных, на коре деревьев. Они важные агенты разложения целлюлозы (Polyangium).
Спириллы имеют форму изогнутых или спиральных клеток. Они имеют один или пучок жгутиков на полюсах и очень подвижны. Среди них есть патогенные виды, сапрофиты, живущие в местах скопления остатков животного и растительного происхождения, и автотрофы, окисляющие молекулярный водород. На корнях некоторых трав обитают спириллы с высокой азотфиксирующей активностью (Azospirillium).
К олиготрофным почвенным бактериям относят и Seliberia stellata. Ее клетки имеют форму крупных (до 10-15 мкм) скрученных палочек. Размножение происходит путем отделения перетяжкой мелкой дочерней клетки со жгутиками. При росте на средах с гуматами железа происходит отложение гидрата окиси железа, поэтому их относят к железобактериям.
К грамположительным бактериям относят все прокариоты с эндогенными спорами и актиномицеты. Характерные признаки - это наличие ригидной клеточной стенки грамположительного типа и движение (если оно есть) за счет перитрихиально расположенных жгутиков.
Спорообразующие бактерии - почти все хемогетеротрофы, использующие органические субстраты в процессах аэробного или анаэробного дыхания либо брожения. Общий признак - способность образовывать эндоспоры, которые обладают устойчивостью к нагреванию, токсическим веществам, ультрафиолетовому свету и ионизирующей радиации.
Бациллы - аэробные свободноживущие или патогенные бактерии палочковидной формы. В почве они участвуют во многих процессах, связанных с разложением разных органических субстратов, составляя группу гидролитиков. Вызывают аммонификацию белков (B.subtilis, B.mycoides), мочевины (B.pasteurii), мочевой кислоты (B.fastidiosus), разложение фосфорорганических соединений (B.megaterium).
Спорообразующие анаэробы в почвах представлены родами Clostridium, Desulfotomaculum, Anaerobaсter. Это довольно крупные палочки (от 3 до 30 мкм). Их споры устойчивы к нагреванию и кислороду. Среди них можно выделить несколько групп по физиологическим функциям:
- сахаролитические, сбраживающие простые углеводы, крахмал, пек тин, целлюлозу;
- клостридии, разлагающие в анаэробных условиях белки и вызывающие гниение;
- пуринолитические, сбраживающие азотсодержащие гетероциклические соединения - пурины и пиримидины;
- сульфатредуцирующие, окисляющие органические кислоты или водород с использованием сульфатов в качестве акцептора водорода.
Коринеподобные бактерии - грамположительные прокариоты, характеризующиеся плеоморфным ростом с циклом «кокк - палочка - кокк». К ним относится род Arthrobacter. Артробактерии - типичные обитатели почвенной среды. Это гетеротрофы, участвующие в процессах минерализации органических веществ в аэробных условиях. Их пропорция возрастает в почвах, бедных свежими органическими остатками, и в экстремальных условиях. Они составляют основную массу микробного населения почв тундры, высокогорных районов и пустынь.
Актиномицеты - это бактерии разной степени морфологической дифференциации, но сходные между собой по биохимическим показателям: высокому относительному содержанию ГЦ-пар в ДНК, составу 16S-рибосомальных РНК. Актиномицеты, иногда называемые лучистыми грибами (Actinomycetes), используют в качестве источника углерода разнообразные органические соединения. Они могут разлагать клетчатку, лигнин, перегнойные вещества почвы. Участвуют в образовании гумуса. Актиномицеты лучше развиваются в почвах с нейтральной или слабощелочной реакцией, богатых органическим веществом и хорошо обрабатываемых.
Микоплазмы - класс Mollicutes. Они не имеют ригидной клеточной стенки, так как не способны к синтезу предшественников пептидогликана - мурамовой и диаминопимелиновой кислот, и в связи с этим обладают высокой степенью плеоморфизма. Пограничный слой клеток представляет собой мембрану, в состав которой входят стеарины. Большинство микоплазм эти стеарины не синтезируют и нуждаются в их поступлении из внешней среды - от других живых клеток, с которыми они находятся в контакте. Их можно считать самыми мелкими из всех известных организмов, имеющих клеточную структуру. Они распространены на растениях и животных, в сточных и чистых водах, в почве. Микоплазма Metallogenium symbioticum, распространенная в почве, участвует в окислении марганца и железа.
Археи составляют отдел Mendosicutes. К ним принадлежат:
- метаногенные - это бактерии, участвующие в процессе анаэробного разложения органического субстрата, конечным продуктом которого является метан;
- сероокисляющие - аэробные архебактерии, которые участвуют в окислении соединений серы и закисного железа в термоацидофильных условиях. Они представлены одним родом Sulfolobus;
- серовосстанавливающие - анаэробные архебактерии, восстанавливающие элементарную серу до H2S. Это экстремальные термофилы с оптимумом от 85 до 105 °С (Thermoproteus, Thermococcus,Thermodiscus);
- галобактерии - участвуют в циклах углерода и азота в условиях сильного засоления. Они аэробы или факультативные анаэробы (Haloarcula, Halobaсterium).
§ 6.2. Функциональная структура сапрофитной группировки почвенных микроорганизмов.
Микробная система почв включает различные функциональные группы (рис. 25). Взаимосвязь между ними осуществляется на основе последовательного потребления ресурсов питания и биохимических механизмов регуляции процессов разложения органических веществ. Все бактерии и грибы - осмотрофные организмы и не способны потреблять нерастворимые полимерные соединения типа крахмала, клетчатки или лигнина до тех пор, пока они не будут разложены до соответствующих растворимых мономеров. Процесс гидролиза полимеров осуществляют микроорганизмы, составляющие группу гидролитиков, которые выделяют в среду внеклеточные гидролитические ферменты. К гидролитикам относят грибы и многие грамположительные бактерии, включая актиномицеты.
Время активного роста гидролитиков в почве обычно непродолжительно, так как накопление мономеров тормозит их рост по типу катаболитной репрессии. Вспышка роста гидролитиков сменяется переходом к покою, что обеспечивается их способностью образовывать споры. Выделенные в среду ферменты могут продолжать участвовать в процессах гидролиза полимеров.
Таким образом, скорость превращения веществ в почве определяется концентрацией ферментов - гидролаз, продуцируемых микроорганизмами группы гидролитиков.
Рис. 25. Схема функционирования гетеротрофной части микробной системы почв [12]
Накопление мономерных соединений типа простых углеводов и аминокислот приводит к активному росту микроорганизмов копиотрофов, которые не образуют гидролаз, но с большой скоростью потребляют растворимые соединения при их высокой концентрации в среде. В эту группу входят «сахаролитические» грибы, дрожжи и многие грамотрицательные бактерии. По мере снижения концентрации мономеров рост копиотрофов замедляется и на смену им приходят микроорганизмы олиготрофы. Они имеют систему транспорта мономерных соединений в клетку в условиях низкой концентрации их в среде. Олиготрофная группа микроорганизмов представлена в почвах в основном неспорообразующими грамотрицательными бактериями, часто необычной морфологии: многие из них имеют различные придатки, образуют выросты, простеки. В отличие от гидролитиков и копиотрофов они длительно активны в почве и составляют группу основных утилизаторов органических веществ на конечных стадиях их превращения.
Таким образом, микробная система почвы, обеспечивающая минерализацию органических веществ, может быть представлена в виде триады, составленной последовательно функционирующими группами гидролитиков, копиотрофов и олиготрофов. Регуляция активности каждой из этих групп основана на изменении концентрации мономерных субстратов (принцип катаболитной репрессии, субстратного ингибирования) и обеспечивается благодаря механизмам обратной связи.
§ 6.3. Анализ физиологических групп бактерий.
Анализ физиологических групп дает возможность составить представление о соотношении микроорганизмов, осуществляющих различные физиологические процессы, и до некоторой степени судить о господствующих направлениях в этих процессах.
В каждую физиологическую группу обычно входят совершенно разные в систематическом отношении микроорганизмы, но они объединяются общностью осуществляемых ими превращений.
Наиболее показательным для оценки почвенного плодородия считают групповой состав микроорганизмов, связанных с циклом превращения азота, а также целлюлозоразлагающих микроорганизмов. Устанавливаются определенные закономерности в распределении разных групп микроорганизмов в почвах разных типов. Например, в бедных питательными веществами кислых подзолистых почвах обычно слабо выражены или совсем отсутствуют нитрификаторы и азотобактер. Наличие большого количества микроорганизмов, участвующих в процессах азотфиксации, нитрификации, разрушении целлюлозы, говорит о плодородии почв. Следует отметить, что большое количество денитрификаторов не может рассматриваться как отрицательное явление. Денитрификация осуществляется ими только в определенных условиях (отсутствие кислорода воздуха и наличие большого количества окисленных форм азота). В других условиях они могут оказывать благоприятное действие на развитие растений, так как образуют полезные физиологически активные вещества.
Изучение интенсивности разложения целлюлозы дает возможность судить о скорости распада растительных остатков, в состав которых всегда входит значительное количество клетчатки, а также до некоторой степени об обеспеченности почвы азотом, так как интенсивное протекание этого процесса невозможно без достаточного количества связанных форм азота.
В зависимости от типа питания бактерии делятся на гетеротрофные и автотрофные.
Гетеротрофные бактерии осуществляют один из главнейших для каждой почвы процессов - разложение органических остатков до простых минеральных соединений, которое происходит в зависимости от характера воздушного режима в аэробных или анаэробных условиях. Аэробные бактерии осуществляют окисление белков, жиров, углеводов и других сложных органических соединений, являющихся компонентами мертвых растительных и микробных остатков, до аммиака, воды и углекислого газа. Среди аэробных гетеротрофных бактерий в почве широко распространены как спорообразующие (Bac. mycoides, Bac. subtilis и др.), так и не образующие спор (Pseudomonas fluorescens, Pseudomonas pyacyanea и др.).
Анаэробные бактерии вызывают процессы гниения компонентов растительных и микробных клеток также до простых, но недоокисленных органических, а затем минеральных соединений. Для создания благоприятных условий питания зеленых растений существенным является процесс аммонификации - разложения белковых соединений до аммиака:
белок → аминокислоты → NH3 + органические безазотистые соединения.
Аммонификация осуществляется как аэробными, так и анаэробными гетеротрофами. Различают окислительную, гидролитическую, восстановительную аммонификации, в результате которых в почве наряду с аммиаком образуются различные органические кислоты и спирты. Анаэробные гетеротрофные бактерии вызывают различные типы брожений углеводов, а также процессы денитрификации и десульфофикации.
Наиболее широко в почвах распространено масляно-кислое брожение различных углеводов (клетчатки, гемицеллюлоз, пектиновых веществ), при котором происходит расщепление углеводов на масляную кислоту, углекислоту и водород по суммарному уравнению:
С6Н12О6 → СН3СН2СН2СООН + 2СО2 + Н2 + 193 кДж
Этот процесс осуществляют различные виды Clostridium. Пектиновые вещества сбраживает Clostridium pektinovorum. Главным представителем анаэробных целлюлозоразлагающих бактерий является Clostridium omelianski. При высоких температурах разложение клетчатки вызывают специальные термофильные бактерии Clostridium thermocellum.
Денитрификация - восстановление нитратов до молекулярного азота, осуществляется группой факультативных анаэробных гетеротрофов, использующих для питания углеводы (глюкозу):
5C6Н12О6 + 24KNO3 → 24KHCO3 + 6CO2 + 12N2 + 18H2O + 1722 кДж.
Основными денитрификаторами в почве являются Pseudomonas fluorescens, Paracoccus denitrificans и др. Этот процесс приводит к значительным потерям азота в почвах с плохой аэрацией.
Десульфофикация, возбудителем которой являются анаэробные бактерии родов Desulfovibrio и Desulfotomaculum, приводит к восстановлению сульфатов до сероводорода, ядовитого для растений: поставщиком водорода служат углеводы, органические кислоты, метан, причем во всех случаях процесс восстановления проходит через следующие промежуточные этапы:
Н2SO4 → H2SO3 → H2SO2 → H2SO → H2S.
Автотрофные бактерии осуществляют в почве процесс окисления недоокисленных минеральных соединений, образующихся в тезультате деятельности гетеротрофов. Основными типами процессов являются нитрификация, сульфофикация, окисление закисного железа и водорода.
Нитрификация. Образующийся в процессе аммонификации аммиак подвергается в почве дальнейшему окислению и переходит сначала в азотистую, а затем в азотную кислоту. Окисление аммиачных солей до нитратов называется нитрификацией.
Процесс нитрификации осуществляется в две фазы:
1. Аммиак окисляется до азотистой кислоты:
2NH3 + 3O2 → 2HNO2 + 2H2O +273 кДж.
В окислении аммиака до азотистой кислоты принимают участие бактерии рода Nitrosomonas и других родов.
2. Азотистая кислота окисляется до азотной:
2HNO2 + O2 → 2HNO3 + 70 кДж.
Окисляют азотистую кислоту до азотной бактерии родов Nitrobacter, Nitrospira, Nitrococcus.
Нитрифицирующие бактерии - аэробы и требуют для развития постоянного притока кислорода. Они более активны в почвах, хорошо аэрируемых, близких к нейтральным, содержащих большое количество органических соединений. Поэтому нитрификация протекает интенсивно в дерново-подзолистых почвах, достаточно унавоженных и хорошо обрабатываемых, а также в черноземных и каштановых почвах, имеющих благоприятный водный режим.
В процессе нитрификации образующаяся азотная кислота, соединяясь с основаниями, находящимися в почве, дает нитраты, которые используются растениями в качестве азотной пищи. При активной нитрификации в почве может накопиться в течение года до 300 кг нитратов на 1 га.
Нитраты почвы хорошо потребляются растениями, но будучи легкорастворимыми в воде, могут легко вымываться в более глубокие слои почвы или за ее пределы.
Сульфофикация - это окисление сероводорода, элементарной серы и тиосоединений до серной кислоты. Она осуществляется серобактериями родов Beggiatoa, Thiothrix, Thioploga и тионовыми бактериями рода Thiobacillus. Химическая сущность сульфофикации может быть выражена уравнениями
2H2S + O2 → 2H2O + 2S + 168 кДж,
2S + 3O2 + 2H2O → 2H2SO4 + 484 кДж.
Выделяющаяся энергия используется серобактериями для усвоения углерода из CO2 и синтеза органических веществ.
Серобактерии широко распространены в почве, водоемах и имеют большое практическое значение. Серная кислота, получающаяся в результате деятельности серобактерий, соединяясь с находящимися в почве основаниями, образует сульфаты, которые потребляются зелеными растениями.
Окисление железа. Превращение солей закисного железа в окисные происходит при участии железобактерий, широко распространенных в водоемах и заболоченных почвах. Реакция окисления протекает по уравнению
4FeCO3 + 6H2O +O2 → 4Fe(OH)3 + 4CO2 + 160 кДж.
Выделяющаяся энергия используется железобактериями для ассимиляции углерода из CO2 и синтеза органических веществ. Среди этих бактерий более широко представлены нитевидные формы (Gallionella, Leptothrix).
Азотфиксация. Почвенные бактерии, способные фиксировать азот атмосферы, делятся на 2 группы:
- свободноживущие в почве аэробные и анаэробные бактерии;
- клубеньковые бактерии, живущие в симбиозе с растениями.
Важнейшим аэробным почвенным организмом, ассимилирующим азот атмосферы, является Azotobacter. К аэробным азотфиксаторам относятся также другие представители семейства Azotobacteriacea, бактерии родов Klebsiella, Erwinia, Pseudomonas. К анаэробным бактериям, которые могут фиксировать атмосферный азот, относятся Clostridium pasteurianum и другие представители рода Clostridium.
Клубеньковые бактерии Rhizobium были впервые обнаружены в клубеньках на корнях бобовых растений М.С. Ворониным (1860 г.). Эти бактерии проникают в корни бобовых растений и образуют на них вздутия (клубеньки). Они получают сахар от бобовых растений, а его снабжают фиксированным азотом атмосферы.
§ 6.4. Основные принципы индикации и диагностики почв.
В основе принципа биологической диагностики почв лежит представление о том, что почва как среда обитания составляет единую систему с населяющими ее популяциями разных организмов. В зависимости от сочетания природных факторов, определяющих почвообразовательный процесс, разные почвы различаются по составу своей биоты, направленности биохимических превращений и содержанию тех химических компонентов, которые являются продуктами этих превращений или их агентами.
Биологическая диагностика почв - это определение фактического и прогнозируемого состояния почвы по ее биологическим свойствам. C одной стороны, оно заключается в биоиндикации (биотестировании) свойственных почве признаков и тенденций в конкретном месте в конкретное время, то есть в распознавании современного состояния почвы по ее биологическим свойствам; с другой стороны, в прогнозировании динамично развивающихся в ней процессов и тенденций с определением как долевого, так и суммарного эффектов воздействия на почву факторов естественного и антропогенного происхождения.
Биоиндикация (биотестирование) - более узкое понятие, чем биодиагностика, понятие, предполагающее разовое, точечное измерение (оценку) состояния среды с применением того или иного показателя.
Мониторинг почв, то есть наблюдение за состоянием почв во времени, разделяют на диагностическую и прогностическую составляющие. Мониторинг применяется при интегральной оценке состояния почв, экологическом нормировании, уточнении классификации почв, экологической экспертизе и ОВОС, экологическом контроле.
Диагностический мониторинг отвечает за опознание почв по состоянию их биоты в естественных природных условиях и характеризует их фактическое состояние в настоящий момент времени.
Прогностический мониторинг дает представление о перспективе развития намечающихся в почве процессов и выполняется преимущественно в рамках планируемого эксперимента.
Для целей биологической диагностики и мониторинга состояния почв и почвенных процессов возможно применение комплекса биологических показателей, основанных на исследовании почвенной микрофауны (почвенных простейших), альгофлоры, определении биохимической активности почв.
§ 6.5. Биоиндикация и диагностика почв.
Ботанические методы фитоиндикации и диагностики почв наиболее хорошо разработаны. Они входят в особый раздел геоботаники - индикационную геоботанику, сформировавшуюся в 30-х гг. прошлого столетия.
При составлении описания почв используют, как правило, и характеристику растительности. Поэтому к настоящему времени накопился уже большой материал по взаимосвязи почв и растений.
Методы фитоиндикации применяют при бонитировке почв, почвенных свойств и процессов. Например, путем анализа состава и структуры растительных сообществ, распространения растений-индикаторов или определения индикаторных признаков у отдельных видов растений можно установить: тип почвы, степень ее гидроморфизма, развитие процессов заболачивания, соленакопления и т. д. Среди растений обнаружены индикаторы на механический и химический состав почв, степень обогащенности питательными элементами, на кислотность или щелочность, глубину протаивания мерзлотных почв или уровень грунтовых вод.
Почвенно-зоологические исследования диагностического профиля стали развиваться позже ботанических. Только в 1950-х гг. почвенная зоология оформилась как самостоятельная область науки. Накопленный к тому времени фактический материал по распространению в почвах беспозвоночных, их фаунистическому составу и адаптационным характеристикам позволил сформулировать основные принципы зоологического метода диагностики почв. Теоретической предпосылкой применения почвенно-зоологического метода для целей диагностики почв является представление об «экологическом стандарте» вида (М.С. Гиляров), о потребностях каждого вида в определенном комплексе условий среды.
Виды с широкой экологической амплитудой (эврибионты) мало пригодны для индикационных целей, тогда как экологически узковалентные виды (стенобионты) служат хорошими индикаторами определенных условий среды и свойств субстрата. Это положение представляет собой общий теоретический принцип в биологической диагностике. Однако использование одного вида для индикации дает мало уверенности в правильности выводов. Лучшее условие - исследование всего комплекса организмов, из которых одни могут быть индикаторами на влажность, другие - на температуру, третьи - на химический или механический состав. Чем больше общих видов почвенных животных встречается на сравниваемых участках, тем с большей долей вероятности можно судить о сходстве их режимов, а следовательно, и о близости исследуемых почвенных разностей, о единстве почвообразовательного процесса.
Не все группы почвенных животных равнозначны с точки зрения их диагностической ценности. Менее других полезны микроскопические формы - простейшие и микроартроподы (клещи, ногохвостки). Их представители отличаются космополитизмом в силу того, что почва для них не выступает как единая среда обитания, а живут они в системе пор, капилляров, полостей, которые можно найти в любой почве. Среди простейших до последнего времени только раковинные амебы были использованы в качестве показателей почвенных условий, особенно в некоторых гидроморфных почвах. Их легче, чем других простейших, определять по строению их раковинок, которые, кроме того, хорошо сохраняются в почве. Наибольшая численность тестацид обнаруживается в кислых лесных почвах под хвойными лесами (десятки тысяч в 1 г при биомассе около 10 кг/га) и наименьшая - в солонцах.
Из микроартропод наиболее хорошо изучены индикаторные свойства у панцирных клещей. Все зональные типы почв России четко различаются по численности, биомассе, продуктивности, характеру вертикального распределения, спектрам жизненных форм и по фаунистическому составу населения орибатид. Наибольшей величины их численность достигает в почвах таежной зоны, а наибольшей продуктивности - в почвах влажных субтропиков. Большинство представителей почвенных микроартропод характеризуются высокой степенью космополитизма. Состав их комплексов зависит не только от почвенных условий, но и от характера и флористического состава растительности. Поэтому перспективно использование комплексов микроартропод не столько для диагностики почв, сколько для индикации повреждающих воздействий на почву.
Особенно ценны и удобны для индикационных работ в почвоведении комплексы крупных беспозвоночных (дождевые черви, многоножки, личинки насекомых), которые в меньшей степени космополиты, чем простейшие и микроартроподы. Ареалы видов крупных беспозвоночных более надежно изучены и характеризуются определенным комплексом почвенно-климатических условий. Есть много примеров индикаторного значения почвенных беспозвоночных. Так, стафилиниды рода В1еdius и чернотелки рода Ве1ориs показательны для солончаково-солонцового комплекса почв, многоножки-кивсяки, некоторые мокрицы и легочные моллюски служат индикаторами на содержание в почве извести. Это организмы-калькофилы. Вид дождевых червей Осtо1аsium 1асtеиm и некоторые виды проволочников также являются показателями высокого содержания кальция в грунтовых водах. Для целей установления типа почвы и направления почвообразовательного процесса используется не только принцип сравнительного изучения комплекса почвенных животных, но и такие показатели, как профильное распределение беспозвоночных по отдельным горизонтам, их участие в переработке опада. Например, в формировании бурых лесных почв большую роль играют диплоподы, мокрицы, моллюски, энхитреиды, сосредоточенные в лесной подстилке и перерабатывающие опад in situ.
В серых лесных почвах значительное влияние на формирование профиля оказывают крупные сапрофаги - дождевые черви, связанные с минеральными слоями почвы, куда они вовлекают растительные остатки. Соотношение подстилочных и собственно почвенных крупных форм сапрофагов может помочь в некоторых случаях решению вопроса о направленности почвообразовательного процесса.
Почвенно-альгологическая индикация. Основой для развития почвенно-альгологических работ идикационно-диагностического профиля служит положение о том, что зональности почв и растительности соответствует и зональность водорослевых группировок. Она проявляется в общем видовом составе и комплексе доминантных видов водорослей, в наличии специфических видов, в характере распространения по почвенному профилю, в преобладании определенных жизненных форм.
Подзолообразовательному процессу соответствует сравнительно простая группировка водорослей с преобладанием одноклеточных зеленых и желто-зеленых, устойчивых к низкому значению рН. Для дернового процесса характерно большое разнообразие видов с равным преобладанием сине-зеленых и зеленых и значительной долей желто-зеленых и диатомовых водорослей. Болотный процесс характеризуется исключительным раз- нообразием видов с резким доминированием зеленых и наличием гидрофильных видов. При степном процессе в группировке водорослей преобладают сине-зеленые и одноклеточные зеленые - убиквисты, при солонцовом получают значительное развитие диатомовые, при осолодении на первое место выходят зеленые и желто-зеленые, включая специфические виды. Пустынный процесс приводит к сокращению численности и разнообразия желто-зеленых и диатомовых и резкому доминированию нитчатых сине-зеленых водорослей. Биологическое освоение безжизненных грунтов и первичное почвообразование связаны с развитием мелких одноклеточных зеленых, сине-зеленых или желто-зеленых водорослей-убиквистов.
Микробиологическая диагностика и биологическая активность почв. Микробиологическая и биохимическая характеристики почв - наиболее сложные разделы почвенной биодиагностики.
Микроорганизмы - очень чуткие индикаторы, резко реагирующие на различные изменения в среде. Отсюда необычайная динамичность микробиологических показателей. Уже в первых работах диагностического направления в почвенной микробиологии, организованных С.П. Костычевым в 1920-х гг., была поставлена задача исследования биодинамики почв, то есть учета показателей не только в пространстве, но и во времени.
Другая трудность - пестрота значений численности микроорганизмов в связи с их неравномерностью распределения в почвенной толще и даже в почвенном слое одного генетического горизонта. Из этого следует необходимость не только многократных анализов, но и многочисленности обрабатываемых образцов почв.
Третья сложность заключается в слабой разработанности микробной систематики и идентификации видов, без чего экологические исследования много теряют.
Биологическую активность почв определяют, используя самые различные микробиологические (прямой микробиологический подсчет микроорганизмов разных групп: бактерий, актиномицетов, грибов, и определение количества микроорганизмов на разных питательных средах), биохимические (определение ферментативной активности почв, АТФ, ДНК), физиологические (физиологический метод определения биомассы микроорганизмов, определение дыхания почв) и химические (определение содержания нитратов, аммиака) методы.
Методы четко делят на две группы:
- методы определения действительной, актуальной природной биологической активности почв (полевые методы определения дыхания, азотфиксации, денитрификации, некоторые изотопные методы);
- методы определения потенциальной биологической активности почв, то есть той активности, которая обнаруживается в лаборатории при оптимальных условиях для протекания данного процесса (определение ферментативной активности почв, лабораторные методы определения нитрификации, азотфиксации, денитрификации, дыхания).
Ко второй группе методов относятся и определение численности микроорганизмов прямыми методами или посевом, определение ДНК, мурамовой кислоты, хлорофилла, физиологический метод определения микробной биомассы, так как они позволяют определить только потенциальные возможности микроорганизмов в почве, но не дают представления об активной части микроорганизмов в определенный момент времени.
§ 6.6. Методы исследования биологической активности почв.
Прямыми методами можно учесть количество почвенных беспозвоночных, простейших и водорослей. Зная численность клеток в единице объема или массы почвы, их размер и удельную массу, можно получить расчетную биомассу разных групп организмов в почве. Так называемые «прямые» методы учета бактерий, актиномицетов и грибов предполагают отделение их клеток или мицелия от почвы в результате суспендирования в воде с последующим перенесением их на стекла или фильтры, окраску и подсчет под микроскопом отдельных клеток или длины обрывков мицелия. Разработаны также методы прямого счета бактерий в счетных капиллярах и под электронным микроскопом.
Хорошо известно, что численность живых организмов в почве постоянно меняется. Однако в каждой почве имеется определенный естественный уровень, который можно принять за пул, то есть тот запас почвенных микроорганизмов, который не обеспечен энергетическим веществом для непрерывного размножения, но находится в состоянии поддержания. Его величина не зависит от сезона, а определяется особенностями самой почвы и факторами среды, которые влияют на почвенные свойства.
В качестве характеристики интенсивности продукционного процесса почвенных микроорганизмов определяют суммарное количество синтезированной биомассы за тот или иной срок. Биомасса грибов в почвенной толще превышает бактериальную во всех типах зональных почв, но особенно заметно преобладание грибной биомассы в лесных почвах (табл. 11). Обратная картина резко выраженного преобладания бактерий над грибами наблюдается в зоне непосредственного влияния корневой системы растений - в ризосфере и ризоплане, где много экскретируемых корнями низкомолекулярных органических веществ. Бактерии оккупируют эту зону более активно, в то время как грибы получают явное преимущество в гетерогенной мозаичной почвенной среде за счет более быстрого линейного роста гиф, на один-два порядка превышающего скорость роста бактерий.
Для определения размеров и продуктивности микробной биомассы используют не только прямые подсчеты числа клеток, но и косвенные методы - биохимические и физиологические. Например, биомассу водорослей предложено определять по количеству хлорофилла, бактерий - по специфической для прокариот мурамовой кислоте, грибов - по хитину, который входит в состав их клеточных стенок. Микробную активность в почве определяют также по уровню АТФ, полифосфатов, содержанию ДНК и РНК, аминокислот.
Наиболее общими являются методы, позволяющие оценить суммарные биологические процессы по исходным или конечным продуктам. Таковыми служат, например, методы определения дыхания почвы по поглощению О2 или выделению СО2; метод учета активности азотфиксации по восстановлению ацетилена; использование микрокалориметрических измерений для установления уровня термогенеза; аппликационные методы с применением специальных материалов (целлюлозы, хроматографической бумаги, целлофана) для оценки скорости и степени их разложения и накопления продуктов метаболизма, например аминокислот.
Таблица 11 Соотношение грибной и бактериальной биомассы в почвах (по Мирчинк, Паникову, 1985 г.)
|
Почвы
|
Грибная биомасса
|
Биомасса
бактерий (Б), г/м
|
Г:Б
|
|
|
Общая (Г), г/м2
|
Биомасса
спор, %
|
|||
|
Тундровая:
|
|
|
|
|
|
Глеевая перегнойная
|
98,1
|
17,3
|
7,5-41,8
|
2 - 12
|
|
Дерново-подзолистая
|
377,2
|
33,3
|
37,3
|
10
|
|
Чернозем:
|
|
|
|
|
|
Мощный типичный
|
157,7
|
77,9
|
94,0
|
1,6
|
|
Краснозем типичный
|
111,0
|
85,0
|
18,5
|
6
|
|
Песчано-пустынная
|
24,6
|
—
|
5,0
|
5
|
Особую группу составляют методы определения активности отдельных ферментов в почвах, характеризующие потенциальную биологическую активность почв. При этом устанавливают не количественное содержание ферментов в почве, а их потенциальную активность. Выделение фермента из почвы - процесс трудоемкий. Из 25 кг почвы был получен, например, всего 1 г уреазы. Часто выделение приводит к инактивации фермента. Ферменты, выделенные клетками, хотя и являются белковыми молекулами, в почве сохраняются длительное время благодаря протекторному действию адсорбции или связи с другими веществами или элементами, что повышает их стойкость к микробному разрушению. Проблему составляет разделение внеклеточных и внутриклеточных ферментов. Нагревание почвы до 100 °С в течение 3 ч позволяет разделять эти группы ферментов.
В мире живого обнаруживают сейчас до 1000 ферментов. В почве есть, конечно, все ферменты, но только для немногих разработаны в настоящее время методы их количественного определения. Наиболее хорошо изучены методы определения гидролаз (например, инвертазы, фосфатазы (кислой и щелочной), протеазов, уреазы, амилазов) и оксидоредуктаз (например, дегидрогеназы, полифенолоксидазы, каталазы).
При характеристике типов почв по их ферментативной активности предлагается ввести показатель не на 1 г почвы, а на столбик почвы с площадью поверхности 1 см2 с учетом активности по всем генетическим горизонтам.
§ 6.7. Биологическая индикация загрязнений почвенной среды и самоочищение почв.
Показатели, характеризующие состояние почвенной биоты и биологическую активность почв, можно использовать для контроля за теми изменениями в почвах, которые возникают при включении в них разного рода посторонних веществ, чаще всего антропогенного происхождения. Различают следующие типы и характер загрязнения почв:
- химическое загрязнение пестицидами, тяжелыми металлами, радионуклидами, нефтяными углеводородами, минеральными удобрениями;
- биологическое загрязнение объектами микробиологического производства белка и белково-витаминных концентратов (БВК), энтомопатогенными бактериями, которые используются для борьбы с вредителями леса.
Общепризнанная система биоиндикации загрязнений почв отсутствует, хотя известно, что микроорганизмы чутко реагируют на изменения почвенных условий или на присутствие в ней загрязняющих веществ. В связи с этим, исходя из положения об иерархическом строении биологических систем, предложен новый подход к биоиндикации почвы, при котором биоиндикационные показатели отражают влияние загрязнителей на различных уровнях: доклеточном, клеточном, популяционном и ценотическом [14].
На доклеточном уровне организации биологической системы почвы чувствительными к изменению факторов внешней среды являются ферменты. Из большого разнообразия ферментов, выявленных в почве, для биоиндикации использовали аскорбатоксидазную активность. Этот фермент относится к группе оксидоредуктаз, которые связаны с транспортом электронов, участвующих в «дыхании» почвы. Внесенные в почву ионы меди и ртути угнетали активность аскорбатоксидазы на 33 - 52 % в течение всего периода наблюдений. Внесение в почву ионов кадмия понижало аскорбатоксидазную активность только в первые трое суток инкубации.
Различия в ферментативной активности почвы можно использовать в качестве одного из биодиагностических показателей на загрязнение тяжелыми металлами. Роль ферментов в почве, а также методы определения их активности (каталазы, инвертазы) рассматриваются в работе Ю.Г. Гельцера [4].
Почва представляет собой систему связанных ферментов. Ферментативные реакции осуществляются не только в ненарушенных клетках. Значительное количество ферментов выделяется в окружающую среду - почву. При этом часть их закрепляется на почвенных частицах (иммобилизуется), часть остается в незакрепленном состоянии, часть разрушается. Вся масса ферментного фонда находится в связи с гумусовыми веществами и минеральными коллоидами почвы, то есть в иммобилизованном состоянии. Иммобилизованные в почве ферменты обладают необычной для живых клеток устойчивостью. Каталитическая активность ферментов сохраняется при нагревании почвы до 100 оC в течение трех часов. Благодаря высокой устойчивости иммобилизованных ферментов, велика их роль в экстремальных условиях, когда жизнедеятельность микроорганизмов подавлена (повышенная влажность, воздействие антибиотических препаратов, пестицидов, тяжелых металлов).
Ферменты накапливаются в почве в результате жизнедеятельности почвенных организмов, мезофауны и корневой системы растений, участвуют в биохимических процессах, обеспечивают разрушение первичного органического вещества и синтез вторичного, обогащают почву биогенными элементами и гумусом, обеспечивают важнейшую биогеоценотическую функцию почвы - трансформацию веществ и энергии, уже находящихся в ней или поступающих, формируют почвенное плодородие.
Активность ферментов во многом зависит от свойств среды, например, концентрации водородных ионов, температуры, концентрации субстрата. Ферментативная активность является одним из диагностических критериев самоочищения почвы, так как, с одной стороны, она легко определяется в лабораторных условиях с низкой погрешностью, а с другой - очень чутко реагирует на изменение внешних условий. Ее используют при оценке плодородия, окультуренности, эффективности агроприемов, загрязненности. Наиболее часто о биологической активности почвы судят по ферментам, характеризующим процессы материально-энергетического обмена в почве.
На следующем, клеточном уровне организации биологической системы почвы исследуют влияние токсикантов на микробную клетку, определяют степень мутагенного воздействия на нее загрязненных почв. Наиболее распространенными тест-культурами являются E.coli (штаммы WP2 (B), WP67, CM871), а также дрожжи Saccharomyces cerevisiae (штамм р.2089, 1732288, Т.7).
В иерархической системе биоиндикации почв важным этапом являются исследования на популяционном уровне. Влияние тяжелых металлов на популяционном уровне изучали на примере культур стрептомицетов. Наблюдения за этими микроорганизмами, выделенными из почв, загрязненных тяжелыми металлами, позволили выявить нейтральную, положительную и отрицательную их реакции на загрязнения. Первая и вторая характеризовались хорошим ростом стрептомицетов, сохранением всех культуральных признаков. Отрицательная реакция популяций стрептомицетов на присутствие тяжелых металлов проявлялась в ухудшении или полном отсутствии их роста. Бактериостатическое воздействие тяжелых металлов вызывало уменьшение количества колоний, их измельчение, частичную или полную утрату культурами воздушного мицелия, обесцвечивание оставшегося воздушного мицелия, утрату пигмента у пигментообразующих культур. Были выделены культуры стрептомицетов, чувствительных к тяжелым металлам, которые могут служить индикаторами загрязнения почв этими металлами: Streptomyces griseoalbus, S. viridogenes и S. filamentosus.
Следующий иерархический уровень биологической системы почвы - ценотический. На этом уровне изучается изменение структурных и функциональных характеристик микробных сообществ почв, загрязненных, например, тяжелыми металлами. В качестве показателей структуры микробного ценоза определяли численность микроорганизмов разных экологотрофических и систематических групп. В работе [1] было показано, что реакция разных трофических блоков микробного ценоза на загрязнения тяжелыми металлами однотипна. В первые трое суток после попадания металлов в почву наблюдался больший или меньший угнетающий эффект, а в последующие сроки численность микроорганизмов восстанавливалась. Основываясь на однотипных реакциях различных трофических групп микроорганизмов, использовали для их объединения формулу расчета интегрального коэффициента сохранности системы, предложенную А.М. Степановым (1991 г.) для характеристики растительных обществ. Интегральный коэффициент сохранности микробной системы (Sm) рассчитывали следующим образом:
Sm = (1/n Σ xij / yiv) ⋅100 %,
где n – число показателей; xij – значение i-го показателя в опыте; yiv – значение i-го показателя на контроле.
Этот коэффициент отражает меру изменения численных значений структуры микробного ценоза в загрязненной почве по сравнению с незагрязненной. Значения Sm < 100 % указывают на угнетение микробного ценоза, Sm > 100 % - на его стимуляцию.
Химическое загрязнение почв. При оценке токсического воздействия тяжелых металлов или других веществ на ценотическом уровне необходимо оценить не только структурные, но и функциональные характеристики микробных ценозов. Наиболее обобщенной характеристикой функционирования микробного ценоза является интенсивность выделения CO2. Другой, более специализированной функцией микробного ценоза является активность азотфиксации. Иерархическая система биоиндикации почв может быть использована при определении степени токсического эффекта загрязнителей, в мониторинговых исследованиях, а также при разработке мероприятий по оздоровлению загрязненных почв.
Из анализа литературы по биоиндикации почв можно сделать вывод, что большинство исследований проводится на ценотическом уровне, то есть рассматривается преобразование почвообитающих микроорганизмов и отдельных биохимических показателей в условиях воздействия на почвенный покров набора антропогенных факторов. Уровень структурных изменений сообщества почвенных водорослей, обитающих на территории г. Москвы, зависит от характера урбанофитоценоза. В почвах городских дворов и загрязненных участков вокруг промышленных предприятий наблюдается низкое видовое разнообразие, спад активности зеленых водорослей, практическое отсутствие желто-зеленых и доминирование сине-зеленых (цианобактерий) форм почвенных водорослей. Загрязнение почв в экстремальных зонах, расположенных в непосредственной близости от предприятий цветной металлургии, действует необратимо по своей губительности на почвенные инфузории. В то же время отдельные группы раковинных амеб и почвенных водорослей - одни из немногих, которые склонны к выживанию в экстремальных условиях и вносят свою лепту в рекультивацию загрязненных земель.
Наиболее чувствительные критерии для индикации загрязнения дерново-подзолистых почв свинцом: активность дегидрогеназы, азотфиксации, выделение CO2, уреазы, денитрификация, а также численность свободноживущих азотфиксирующих и олиготрофных бактерий.
Практически для всех групп бактерий отмечена тенденция снижения их численности в загрязненных свинцом почвах, однако коринеформные, грамотрицательные, целлюлозолитические бактерии и псевдомонады, а также актиномицеты и грибы обнаруживали существенно меньшую чувствительность к загрязнению почвы свинцом. Численность спорообразующих бактерий не менялась при контаминации почвы свинцом. Имеются данные о высокой чувствительности олигонитрофильных микроорганизмов к загрязнению свинцом дерново-подзолистых почв, чернозема выщелоченного Западной Сибири. Под действием тяжелых металлов происходит снижение биологической активности почвы. При этом изменяется общая численность микроорганизмов, сужается их видовой состав, разнообразие, изменяется структура микробиоценозов, падает интенсивность основных микробиологических процессов и активность почвенных ферментов. Результаты загрязнения почв тяжелыми металлами не всегда однозначны. В ряде случаев отмечалось увеличение численности микроорганизмов и ферментативной активности.
Пестициды оказывают разное воздействие на почвенную биоту и биохимическую активность почв. Особую опасность представляют стойкие и кумулятивные пестициды, персистентность которых достигает нескольких лет. Поступающие в почву пестициды адсорбируются глинистыми минералами, вступают в химические реакции, разлагаются или трансформируются микроорганизмами. Известно четыре пути превращения пестицидов:
- энзиматическое воздействие, которое ведет к полной потере токсических свойств препаратом и его инактивации;
- трансформация в токсические вещества - активация;
- трансформация в другие вещества с иным спектром ингибирующего действия;
- трансформация с образованием соединения-стимулятора.
В природной среде, в почве, существенную роль в разложении пестицидов микроорганизмами играют такие явления, как кометаболизм и синтрофия. В первом случае скорость минерализации пестицида, относящегося к группе так называемых «устойчивых», повышается при наличии в среде дополнительного соокисляемого субстрата, а во втором случае на пестицид действует смешанная популяция микроорганизмов, и его разложение протекает более активно, чем в условиях чистых культур. Имеются попытки интенсифицировать процесс деградации, например хлорароматических кислот, внесением в почву соответствующих косубстратов - специфических индукторов для повышения активности почвенной микробиоты.
Один из путей изучения поведения пестицидов в почве - внесение его меченого препарата и определение выделяющегося СО2. В случае быстрой деградации пестицида почвенными микроорганизмами его рекомендуют к применению. Другой путь - оценка действия пестицида на почвенную биоту и биохимическую активность почв разными методами. Много фактов свидетельствует о том, что производственные дозы применяемых гербицидов не подавляют заметно развития почвенной биоты при редких обработках или однократном внесении. Дело в том, что расчетные дозы препаратов не соответствуют тем концентрациям, которые создаются в отдельных локусах почвы.
В почве всегда имеются участки, где концентрация гербицида может быть в 5 - 10 раз выше расчетной, а в других местах - очень низкой, вплоть до полного отсутствия. Биота иногда не только не повреждается, но даже стимулируется за счет поступления в почву органических остатков в результате массовой гибели сорняков после применения гербицида. Однако многократное применение, приводящее к накоплению препарата, или использование очень высоких доз может вызвать избирательное угнетение части биоты или отдельных биохимических процессов. Особенно резко проявляется действие фунгицидов, которые применяют против фитопатогенных грибов. Они подавляют также сапротрофные почвенные миксомицеты и другие микроорганизмы, вызывая эффект частичной стерилизации почвы.
Гербициды триазинового ряда вызывают последействие в отношении таких ферментов, как инвертаза и уреаза (их активность увеличивается), протеаза (слабо подавляется) и фосфатаза (активность увеличивается или подавляется в зависимости от почвы). При многолетнем применении хлорорганических пестицидов происходит подавление активности фосфатазы на 30 - 60 %. Ингибиторами нитрификации являются галогированные фенолы, нитрофенолы, хлориды, хлораты и особенно 2-хлор-6 (три- хлористил)-пиридин. Подавление этими препаратами нитрификации на 70 % и более происходит за счет ингибирования цитохромной системы микроорганизмов.
Наиболее сильным ингибирующим действием на нитрификацию в почве отличается прометрин. Его применяют для подавления процессов превращения азота и снижения его потерь. Все подвергнутые специальному изучению пестициды обнаружили мутагенную активность - способность изменять наследственность. В результате возникают устойчивые формы, что вызывает необходимость увеличения доз или расширения спектра применяемых ядохимикатов. Это приводит к многочисленным отрицательным последствиям в окружающей среде.
Радиоактивные элементы, например 90Sr, попадают в почву с осадками, образуемыми в результате ядерных испытаний или с отходами атомных электростанций и предприятий по производству ядерного горючего и ядерного оружия. В местах естественных понижений 90Sr может накапливаться в почве в результате поверхностного стока. Он поступает в растение и далее передается по пищевым цепям. Почвенные микроорганизмы способны аккумулировать радиоактивные элементы, что можно определить методами радиоавтографии. На этом принципе основана разработка методов использования микробных популяций для выявления геохимических провинций с высоким содержанием указанных элементов в почвах.
Загрязнение почв нефтью и продуктами ее переработки приводит к заметному сдвигу в составе биоты. Почва обогащается микроорганизмами, способными разлагать углеводороды. Также было выявлено, что нефть стимулирует рост некоторых почвенных грибов, например представителей родов Рaecilomyces, Fusarium; некоторые виды Scolecobasidium обнаружены только в почве, насыщенной нефтепродуктами. Возможно использование этих видов в качестве индикаторов на загрязнение почв нефтью.
Скорость самоочищения почв от нефти имеет отличия в разных природных зонах. В тех случаях, когда точно известно время загрязнения, состав и количество попавшей в почву нефти, можно сопоставить результаты очищения почв через определенные промежутки времени. На юге нашей страны, в условиях недостаточного увлажнения, в серо-коричневых солонцеватых почвах содержание нефти за первые 12 мес. снизилось на 65 %. При этом полностью минерализовалась лишь 1/3 часть, а около 40 % превратилось в различные другие органические продукты. В подзолистых и дерново-подзолистых почвах северных районов, в условиях переувлажнения уменьшение содержания нефти происходило более активно. При этом часть нефти перераспределилась внутри почвы за счет циркуляции влаги. В этом случае опасности загрязнения подвергаются грунтовые воды. Через некоторое время после загрязнения в почве возрастает численность и активность многих групп микроорганизмов, и в первую очередь, нефтеокисляющих. Зная естественные механизмы и скорость самоочищения почв, можно разрабатывать методы очистки почв от загрязнения нефтью и нефтепродуктами.
Биологическое загрязнение почв. Биологическое загрязнение почв чужеродными микроорганизмами происходит в результате попадания в почву бытовых и сельскохозяйственных отходов и отбросов, а также за счет аэрозолей микробиологических производств. С бытовыми отбросами в почву могут попадать потенциально опасные микроорганизмы - патогенные и токсикогенные, способные вызывать кишечные инфекции и пищевые отравления у человека, эпидемические заболевания у животных, токсикозы растений.
В санитарно-эпидемиологических почвенных исследованиях определяют содержание в почвах бактерий группы кишечной палочки (E.coli) и патогенных клостридий и бацилл: возбудителей столбняка (Сl. tetani), сибирской язвы (Вас. апthrаcis), газовой гангрены (Сl. реrfringens) и др. Бактериальные энтомопатогенные препараты (энтомобактерин, дендробациллин, боверин, мускардин) содержат споры бацилл (Вас. Сеrеиs, Вас. thuringiensis), которые в течение многих лет сохраняются и размножаются в почве. При применении этих препаратов методами аэрораспыления происходит массовое обсеменение растительности и почвы спорами этих бактерий, что может привести к нарушению природного равновесия в микробных сообществах.
Почва способна к самоочищению от несвойственных ей микроорганизмов. Механизмы, лежащие в основе самоочищения почв, пока остаются непознанными. Они могут быть разной природы. В первую очередь это связано с отсутствием в почвенной среде условий, необходимых для развития попадающих извне микроорганизмов, а также неблагоприятного действия физических и химических факторов (кислотности, низких значений температур, высушивания, солнечной радиации и т. д.).
Другой механизм элиминации микроорганизмов - взаимодействие с членами почвенной биоты: выедание, лизис и др. В некоторых случаях при загрязнении небольших территорий рекомендуется применять для очистки почв химические дезинфектанты (формалин, окись этилена, тиазол и др.) или специфические препараты пестицидов. Нарушение экологической среды под влиянием разного рода токсикантов - одна из важнейших проблем современности, поэтому разработка принципов и методов ранней диагно- стики повреждения почвенной биоты под воздействием пестицидов, тяжелых металлов, нефти и отходов ее переработки, минеральных удобрений в высоких дозах и других загрязнителей представляет собой одну из самых насущных задач биологии почв.
Изучение реакции на различные антропогенные воздействия активно функционирующих в почве микробных сообществ позволило сформулировать положение о том, что независимо от природы загрязняющего агента изменения микробиоты почвы в ответ на возрастающие антропогенные нагрузки выражаются в последовательной смене четырех адаптивных зон. Под адаптивной зоной понимается интервал концентраций изучаемого агента, определяющих совокупность изменений активно функционирующего в почве микробного сообщества. Эти изменения обеспечивают при- способление сообщества к данным условиям. Каждая из выделенных зон соответствует определенному уровню антропогенной нагрузки.
Первая адаптивная зона, характеризующая низкий уровень нагрузки, - зона гомеостаза микробной системы почвы. На примере действия кадмия показано, что от 0 до 7 мг кадмия на один килограмм дерново-подзолистой почвы изменяется только общая биомасса активно функционирующего сообщества микроорганизмов. Вторая адаптивная зона, которая характеризует средний уровень нагрузки, - зона стресса микробной системы почвы. В этой зоне происходит перераспределение степени доминирования членов микробного сообщества при внесении минеральных удобрений, некоторых гербицидов и отдельных тяжелых металлов. Наблюдается преимущественное развитие токсинообразующих микроорганизмов (грибы рода Penicillium).
Третья адаптивная зона микробной системы почвы - зона резистентности. Она характеризует высокий уровень нагрузки и проявляется при высоких дозах всех изученных загрязнителей независимо от их природы. На примере действия нефти эта зона обнаружена в интервале концентраций вещества от 10 до 100 л/м2 почвы. Видовое разнообразие резко сокращается, а преимущественное развитие получают устойчивые к данному фактору популяции микроорганизмов. Дальнейшее увеличение нагрузки приводит к полному элиминированию роста и развития микроорганизмов в почве. Это свидетельствует о переходе в следующую, четвертую зону - зону репрессии микробной системы почвы, которая характеризует очень высокий уровень антропогенной нагрузки.
Адаптационные свойства микробной системы почвы могут быть в общем виде охарактеризованы четырьмя типами изменений в сообществе активно функционирующих в почве микроорганизмов. Последовательность этих изменений в градиенте антропогенной нагрузки выглядит следующим образом: сохранение стабильности состава сообщества (зона гомеостаза), перераспределение доминантных популяций (зона стресса), преимущественное развитие устойчивых популяций (зона резистентности), полное подавление роста и развития микроорганизмов в почве (зона репрессии). Для биоиндикации различных уровней загрязнения почвы при антропогенных воздействиях предлагается следующее.
Низкий уровень загрязнения следует устанавливать по превышению фоновых концентраций поллютантов с помощью химических методов анализа. Для индикации среднего уровня загрязнения в наибольшей степени подходят микробиологические показатели. В этом интервале загрязнения происходит перераспределение доминирования среди активно функционирующих в почве микроорганизмов. В качестве дополнительных индикаторных признаков среднего уровня загрязнения можно использовать снижение вариабельности показателей биохимических процессов в почве, сокращение видового богатства и разнообразия комплекса почвенных микроорганизмов, а также увеличение в нем доли токсинообразующих форм микроорганизмов. Для индикации высокого уровня загрязнения почв экзогенными химическими веществами подходят многие микробиологические показатели, например широкое распространение в микробном сообществе почвы высокоустойчивых форм микроорганизмов. Однако более целесообразно для этого использовать другие тесты. Поскольку почвы при данном уровне загрязнения будут обладать общей высокой токсичностью, более удобно, наглядно и просто определять наличие этого уровня с использованием реакции высших организмов.
Устойчивость почвенной системы по отношению к загрязняющим агентам оценивается по величине зоны гомеостаза, которая для разных почв может варьировать в больших пределах. Таким образом, если за норму принять равновесное состояние биоты (в зоне гомеостаза), то степень повреждения оценивается по появлению изменений в сообществе на уровне последующих зон. Одна и та же доза загрязнителя может вызвать разной степени повреждения, поэтому при нормировании следует учитывать, что единого значения ПДК (предельно допустимой концентрации) для различных почв быть не может. При разработке системы мониторинга состояния почвенного покрова в связи с антропогенными нагрузками используются все показатели, характеризующие биологическую активность почв.
§ 6.8. Микрофлора воды
Вода, как и почва, является естественной средой обитания для многих видов микроорганизмов всех царств жизни. Разнообразные микроорганизмы обитают как в воде открытых водоемов, так и в грунтовых водах: палочки, кокки, вибрионы, спириллы, спирохеты, различные фотосинтези- руюшие бактерии, грибы, простейшие, вирусы и плазмиды. Многие виды галофильных бактерий обитают в морских водах. Численность микроорганизмов в воде определяется главным образом содержанием в ней органических веществ, которые под влиянием микроорганизмов подвергаются совершенно таким же превращениям, как и в почве. В 1 мл воды количество микробов может превышать несколько миллионов.
Грунтовые подземные воды чище, так как, просачиваясь через почву, вода подвергается своеобразной фильтрации, в результате которой большинство микробов задерживается в фильтрующем слое. Численность микроорганизмов в воде открытых водоемов подвержена колебаниям и зависит от климатических условий, времени года, а главным образом от степени загрязнения рек, озер и морей сточными и канализационными водами и отходами промышленных, агропромышленных и других предприятий. В реки, озера, моря из прибрежных городов и других населенных пунктов выбрасывается такое количество сточных вод, несущих мириады микробов и содержащих огромное количество органических веществ, что вода не успевает самоочищаться. В результате возникла и сохраняется серьезная глобальная экологическая проблема.
По степени микробного загрязнения различают три категории воды (или зоны водоема):
- Полисапробная зона - наиболее сильно загрязненная вода, бедная кислородом, богатая органическими веществами. В 1 мл воды численность микроорганизмов достигает 1 млн и более, преобладают E.coli и анаэроб ные бактерии, вызывающие процессы гниения и брожения.
- Мезосапробная зона - вода, загрязненная умеренно, в ней активно происходит минерализация органических веществ с интенсивными процессами окисления и нитрификации. Содержание микроорганизмов в 1 мл воды - сотни тысяч бактерий, количество E.coli значительно меньше.
- Олигосапробная зона - зона чистой воды, количество микроорганизмов в 1 мл воды - десятки или сотни, не более; E.coli отсутствует или встречается в количестве нескольких клеток на 1 л воды.
Питьевая вода считается хорошей, если общее количество бактерий в 1 мл - не более 100; сомнительной - 100 - 150; загрязненной - 500 и более.
Количество микроорганизмов в придонном слое ила озер и рек варьирует в пределах от 100 до 400 млн на 1 г.
Вода играет исключительно важную роль в эпидемиологии многих инфекционных заболеваний, особенно кишечных (брюшного тифа, дизентерии, сальмонеллезов, холеры, вирусных гепатитов, полиомиелита и т. п.), возбудители которых выделяются вместе с испражнениями больных и носителей и вместе со сточными водами поступают в воду открытых водоемов, а оттуда нередко и в питьевую воду. Хотя патогенные бактерии слабо приспособлены к существованию в воде, где на них оказывает неблагоприятное действие солнечный свет и различные другие факторы, включая конкурентную водную микрофлору, многие из них могут достаточно длительное время сохраняться в воде. Более того, в летнее время при наличии в воде органических веществ, щелочной рН и благоприятной температуры некоторые из них, в том числе холерный вибрион, могут даже размножаться. Заразиться можно и через лед, в котором патогенные бактерии могут сохраняться в течение нескольких недель и даже месяцев.
Загрязненная вода - главный источник заражения холерой, дизентерией, брюшным тифом и другими кишечными инфекциями, а также лептоспирозом и нередко туляремией.
Микробиологические методы исследования воды сводятся к определению общего количества микроорганизмов в 1 мл воды и выявлению тех или иных видов патогенных бактерий (особенно холерного вибриона). Кроме того, поскольку прямое выделение патогенных бактерий из воды требует специальных исследований, существуют косвенные методы, позволяющие дать количественную оценку степени фекального загрязнения воды.
§ 6.9. Микрофлора воздуха.
Воздух как среда обитания для микроорганизмов менее благоприятен, чем почва и вода, так как в нем не содержится или содержится очень мало питательных веществ, необходимых для размножения микроорганизмов. Кроме того, на них сильнее действуют такие неблагоприятные факторы, как высушивание и ультрафиолетовые лучи солнечного света. Тем не менее, попадая в воздух, многие микроорганизмы могут сохраняться в нем более или менее длительное время. Воздух особенно загрязнен вблизи земной поверхности, а по мере подъема вверх он становится все более чистым. На степень загрязнения воздуха микробами влияют и климато-географические условия. Больше всего микробов в атмосфере содержится летом, меньше всего - зимой. Главным источником загрязнения воздуха является почва, в меньшей степени - вода.
В воздухе в естественных условиях обнаруживаются сотни видов сапрофитных микроорганизмов, представленных кокками (в том числе сарцинами), споровыми бактериями и грибами, отличающимися большой устойчивостью к высушиванию и другим неблагоприятным условиям внешней среды, например действию солнечных лучей. Нужно различать воздух открытых пространств (он относительно чище, так как сказывается действие солнечных лучей, высушивания и других факторов) и воздух закрытых помещений. В последних факторы самоочищения действуют слабее, по-этому и загрязненность может быть значительно больше. В воздухе закрытых помещений, особенно если они плохо проветриваются, накапливается микрофлора, выделяемая через дыхательные пути человека.
Патогенные микроорганизмы попадают в воздух из мокроты и слюны при кашле, разговоре и чихании. Даже здоровый человек при каждом акте чихания выделяет в воздух 10000 - 20000 микробных тел, а больной - иногда во много раз больше.
Заслуга выяснения механизма передачи возбудителей заболеваний через воздух принадлежит П.Н. Лащенкову. Он одним из первых установил, что при чихании, кашле и разговоре в воздух выбрасывается множество капелек жидкости, внутри которых содержатся микроорганизмы. Особенно важно, что эти мельчайшие капельки могут часами удерживаться в воздухе во взвешенном состоянии, то есть образуют стойкие аэрозоли. В этих капельках за счет влаги микроорганизмы выживают дольше. Таким воздушно-капельным способом происходит заражение многими острыми респираторными заболеваниями, в том числе гриппом и корью, а также коклюшем, дифтерией, легочной чумой и т. д. Этот путь распространения возбудителей - одна из основных причин развития не только эпидемий, но и крупных пандемий гриппа, а в прошлом и легочной чумы.
Помимо капельного способа, распространение патогенных микробов через воздух может осуществляться «пылевым» путем. Находящиеся в выделениях больных (мокроте, слизи и т. п.) микроорганизмы окружены белковым субстратом, поэтому они более устойчивы к высыханию и другим факторам. Когда такие капли высыхают, они превращаются в своеобразную бактериальную пыль (внутри белкового субстрата сохраняются и выживают многие патогенные бактерии). Частички бактериальной пыли имеют обычно диаметр от 1 до 100 мкм. У частиц диаметром более 100 мкм сила тяжести превышает сопротивление воздуха, и они быстро оседают. Скорость переноса бактериальной пыли зависит от интенсивности сил воздушных перемещений. Пылевой путь играет особенно важную роль в эпидемиологии туберкулеза, дифтерии, туляремии и других заболеваний.
Количество микробов в воздухе варьирует в больших диапазонах - от нескольких бактерий до десятков тысяч их в 1 м3. В 1 г пыли может содержаться до 1 млн бактерий. Большое значение имеет чистота воздуха в операционных, реанимационных и перевязочных отделениях хирургических госпиталей. Общее количество микробов в операционной до операции не должно превышать 500 в 1 м3 , а после операции - 1000 в 1 м3 .
Для исследования микрофлоры воздуха используют различные методы: седиментацию (метод Коха), фильтрационный (воздух продувают через воду) и методы, основанные на принципе ударного действия воздушной струи с использованием специальных приборов. Последние методы наиболее надежны, так как позволяют точно определить количественное загрязнение воздуха микроорганизмами и изучить их видовой состав.
В настоящее время в биотехнологической промышленности широко используются различные микробы-продуценты, в том числе генетически модифицированные их формы. Поскольку эта технология связана с неизбежными периодическими выпусками (интродукциями) в открытую систему (воздух, вода, почва) генетически измененных форм микроорганизмов, возникает важный вопрос об их дальнейшей судьбе и о возможном влиянии на биосферу и человечество. Несомненно, этот вопрос как часть общего вопроса охраны окружающей среды должен решаться в глобальном плане.
Дополнительный материал:








