ООО "ПРОПИОНИКС"
| пн-пт с 09:00 до 18:00 | |
Пробиотики как средства биоконтроля
Пробиотики как потенциальные альтернативные агенты биоконтроля в сельском хозяйстве и пищевой промышленности: Обзор

Патогенные микроорганизмы представляют собой потенциальную угрозу для сельского хозяйства и пищевой промышленности. Загрязнение пищевых продуктов патогенными микроорганизмами может произойти на любом этапе производственной цепочки. В качестве стратегий борьбы с микроорганизмами обычно используются традиционные методы, такие как антибиотики, дезинфицирующие средства и физические методы. Из-за недостатков этих методов, таких как возникновение резистентности, низкая эффективность, высокая стоимость и пагубное воздействие на продукты питания, здоровье и окружающую среду, во многих странах были приняты законы и правила, ограничивающие их использование. Чтобы преодолеть эти проблемы, необходимо срочно найти экологически чистый и экономически эффективный альтернативный подход. Пробиотики - это живые микроорганизмы, которые при потреблении в достаточном количестве приносят пользу здоровью хозяина, обеспечивая защиту от патогенов и питательные вещества. С точки зрения пищевой микробиологии, использование пробиотиков в животном мире приводит к уменьшению количества зоонозных патогенов в желудочно-кишечном тракте (ЖКТ) животных, что предотвращает передачу этих патогенов через пищу. Поэтому пробиотики были предложены в качестве альтернативного антимикробного средства для защиты от патогенных микроорганизмов в целях улучшения здравоохранения и безопасности пищевых продуктов. В данном обзоре мы обсуждаем пробиотики, критерии их отбора, механизмы действия и перспективы их использования в качестве альтернативных агентов биоконтроля, уделяя особое внимание сельскому хозяйству (животноводству и аквакультуре), а также пищевой промышленности.
Введение
Пробиотик - это слово латинского и греческого происхождения, означающее "для жизни", которое впервые было использовано Коллатом (1953). Лилли и Стиллвелл (1965) первыми предложили дефиницию пробиотиков как веществ, выделяемых одним микроорганизмом, которые стимулируют рост другого. В 2002 году совместная комиссия FAO/WHO определила пробиотики как живые микроорганизмы, которые при приеме в достаточном количестве приносят пользу здоровью хозяина (FAO/WHO, 2002). Большинство пробиотиков - это бактерии, среди которых наиболее распространены молочнокислые бактерии (МКБ), но некоторые плесени и дрожжи также могут быть использованы в качестве пробиотиков (Oyetayo & Oyetayo, 2005). В качестве пробиотиков обычно используются бактерии родов Lactobacillus, Bifidobacterium, Lactococcus, Carnobacterium, Enterococcus, Streptococcus, Pediococcus, Propionibacterium, Leuconostoc и Bacillus, дрожжи Saccharomyces и плесени Aspergillus (Amara & Shibl, 2015). Хороший кандидат на пробиотик должен соответствовать следующим критериям: это должен быть организм, способный оказывать благотворное воздействие на хозяев, увеличивать устойчивость к болезням; он должен быть непатогенным и нетоксичным; он должен быть способен выживать и метаболизироваться в кишечной среде, сопротивляясь низкому pH желудка, органическим кислотам, желчной кислоте и ферментам, присутствующим в кишечнике; и он должен быть стабильным при хранении и в полевых условиях (Fuller, 1989).
Пробиотики называют полезными организмами, поскольку они способны оказывать такие полезные эффекты, как изменение баланса микрофлоры кишечника, подавление роста патогенных бактерий, синтез и повышение биодоступности питательных веществ, содействие хорошему пищеварению, снижение эффекта аллергенов, повышение иммунной функции, снижение уровня холестерина, стимулирование иммунной системы, облегчение непереносимости лактозы и повышение устойчивости к инфекциям. Новые данные подтверждают роль пробиотиков в профилактике и лечении других заболеваний, включая урогенитальные инфекции, муковисцидоз, различные виды рака, кариес, заболевания пародонта и неприятный запах изо рта (Kaur, Amrita, Kaur, & Nagpal, 2015).
Безопасность и качество продуктов питания, получаемых от животных, аквакультуры и растений, имеют жизненно важное значение для потребителей, пищевой промышленности и экономического положения страны-производителя. Распространенные патогены пищевого происхождения, такие как Salmonella spp., Listeria monocytogenes, Escherichia coli и Campylobacter jejuni, могут загрязнять продукты питания, вызывая заболевания пищевого происхождения, и поэтому считаются всемирной проблемой здравоохранения (Mor-Mur & Yuste, 2010). Кроме того, микроорганизмы могут образовывать биопленки на различных поверхностях, контактирующих с продуктами питания в пищевой промышленности, включая металл, пластик, стекло, дерево и частицы почвы, что повышает риск загрязнения продуктов питания (Gandhi & Chikindas, 2007).
У сельскохозяйственных животных стрессы окружающей среды, такие как диета, методы содержания и т. д., могут нарушать микробный режим кишечника, создавая факторы риска заражения патогенами. Зоонозные бактерии могут вызывать смертность, и заболеваемость животных, что приводит к огромным экономическим потерям в секторах животноводства и птицеводства. Хорошо известно, что такие патогены, как Campylobacter spp. и виды Salmonella. могут передаваться по пищевой цепи и стать источником заболеваний человека. Во всем мире микроорганизмы Salmonella и Campylobacter являются двумя наиболее значимыми патогенами среди ведущих организмов, вызывающих болезни пищевого происхождения (Scallan et al., 2011).
С глобальной точки зрения потребительский спрос на рыбу и другие продукты питания из водного мира растет; поэтому сектор аквакультуры в последнее время вырос, чтобы удовлетворить потребительский спрос. Виды Aeromonas, Alcaligenes, Alteromonas, Carnobacterium, Flavobacterium, Micrococcus, Moraxella, Photobacterium, Pseudomonas и Vibrio являются доминирующими микробами, обнаруженными в микробиоте морских видов (Askarian, Zhou, Olsen, Sperstad, & Ringø, 2012; Dhanasiri et al., 2011), тогда как у пресноводных видов отмечены виды Acinetobacter, Aeromonas, Flavobacterium, Lactococcus, Pseudomonas, представители семейства Enterobacteriaceae, Bacteroides, Clostridium и Fusobacterium (Wu et al., 2012). Заражение этими патогенами может вызвать серьезные вспышки заболеваний в секторе аквакультуры.
В условиях неблагоприятного воздействия патогенных и порчующих микроорганизмов в пищевой и сельскохозяйственной промышленности ведется поиск новых альтернативных методов без побочных эффектов. Использование пробиотиков в качестве средств биоконтроля можно считать подходящей альтернативой в этих секторах. В настоящее время используется несколько традиционных противомикробных подходов с целью борьбы с патогенными микроорганизмами для здоровья и безопасности пищевых продуктов. Однако из-за ограниченной эффективности, а также негативного воздействия некоторых из этих методов на здоровье, продукты питания и окружающую среду, срочно необходимы более эффективные и подходящие методы борьбы с патогенными микроорганизмами.
В данном обзоре рассматриваются последние достижения в области подходов к снижению или подавлению распространенности и колонизации различных типов патогенных микроорганизмов в пищевых продуктах и на контактирующих с ними поверхностях, в сельскохозяйственном секторе, а также с акцентом на скрининг пробиотиков.
Механизмы действия пробиотиков

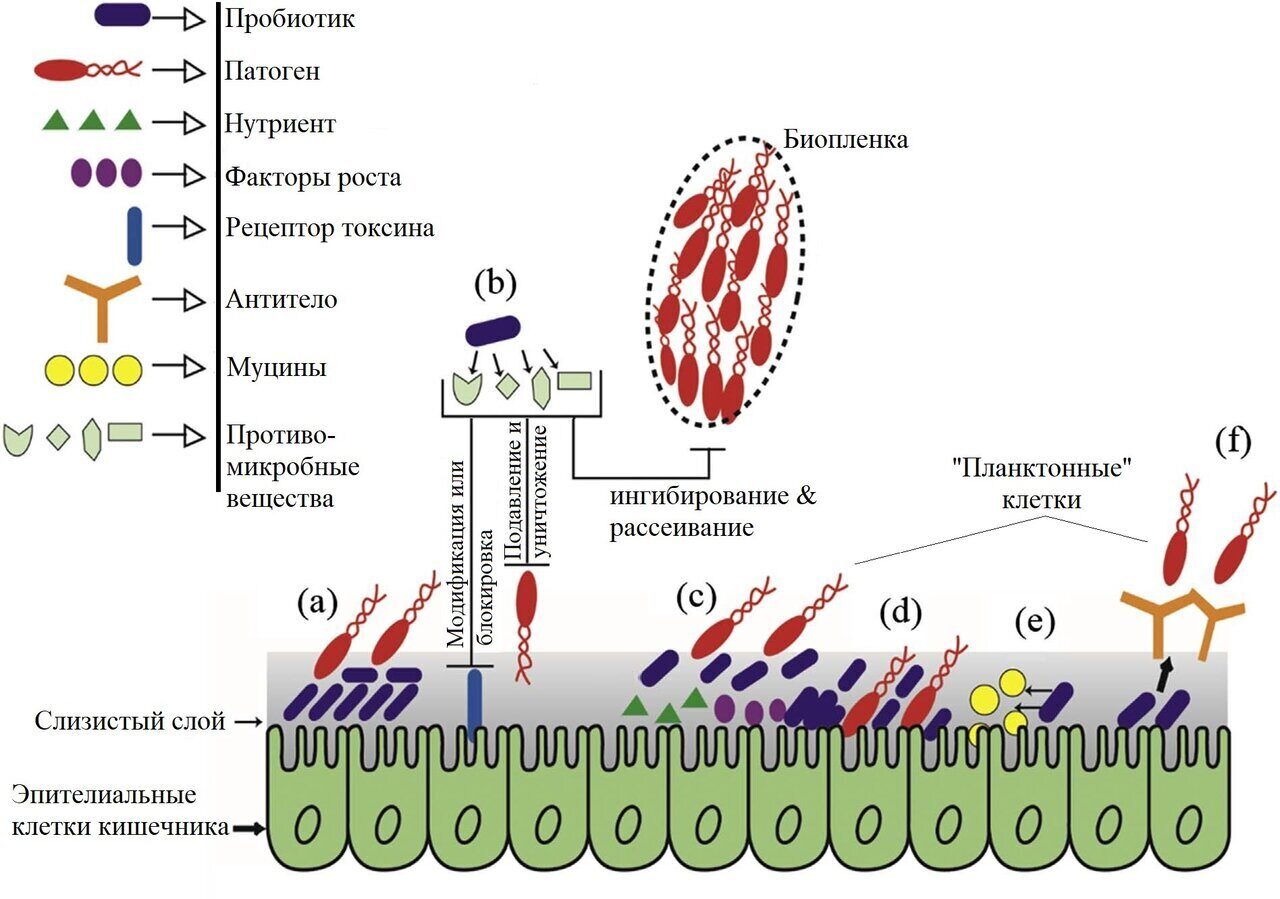
Существует множество механизмов, с помощью которых пробиотики могут предотвращать инфекции, включая повышение питательной ценности пищи, укрепление здоровья кишечника и предоставление полезных свойств, таких как выработка антимикробных веществ, ингибирование эпителиальной и мукозальной адгезии патогенов, конкуренция за ограниченное количество питательных веществ, ингибирование эпителиальной инвазии патогенов, модуляция иммунной системы и регулирование состава и активности кишечной микробиоты (Wan, Chen, Shah, & El-Nezami, 2016). Механизм действия каждого пробиотика зависит от штамма, что делает крайне важным выбор и научное сравнение отдельных пробиотиков по их назначению. Однако в основе механизмов лежит либо производство многих видов молекул, либо прямой контакт клеток с клетками (Jonkers, 2016).
Механизмы бактериального антагонизма или антимикробной активности пробиотиков играют важную роль в установлении равновесия между конкурирующими полезными и потенциально патогенными микроорганизмами (Balcazar, de Blas, Ruiz-Zarzuela, Vendrell, & Muzquiz, 2004). Пробиотические микроорганизмы используют этот механизм, выделяя различные антимикробные вещества, включая органические кислоты, перекись водорода, бактериоцины и биосурфактанты, которые могут подавлять рост патогенных бактерий; при этом бактериоцины обладают более сильной антимикробной активностью против патогенов в кислых условиях (Kanmani et al., 2013). Например, пробиотическая бактерия Lactobacillus reuteri выделяет антимикробное вещество реутерин, обладающее широким спектром активности против различных патогенов, включая бактерии, грибы, простейшие и вирусы (Spinler et al., 2008). Высвобождая антимикробные соединения, пробиотики могут подавлять рост патогенов пищевого происхождения, а также уменьшать образование биопленок патогенами и защищать от инфекции. В целом, пробиотические молочнокислые бактерии выделяют органические кислоты (в основном молочную и уксусную), которые снижают pH кишечника, уменьшают риск колонизации патогенами, создают более подходящие условия для резидентной микробиоты и формируют кислую среду, подавляющую патогены (Servin, 2004).
Пробиотики также могут использовать ферментативные механизмы, выделяя ферменты, способные гидролизовать бактериальные токсины, модифицировать рецепторы токсинов и ингибировать опосредованное токсинами заболевание (Alvarez-Olmos & Oberhelman, 2001). Например, Альварес-Олмос и Оберхельман (2001) продемонстрировали, что секреция полиаминовых ферментов позволяет Saccharomyces boulardii разрушать рецепторы токсина Clostridium difficile в подвздошной кишке кролика и блокировать секрецию токсина, вызванную холерой, в тощей кишке крысы.
Пробиотические штаммы также могут проявлять метаболические механизмы, в рамках которых они создают благоприятную анаэробную экосистему в кишечнике для резидентной микробиоты путем детоксикации ингибирующих молекул и кислородсодержащих соединений, таких как амины или нитраты. Эта метаболическая активность и способность выживать в кишечнике в основном зависят от используемых пробиотических штаммов (Chaucheyras-Durand, Walker, & Bach, 2008). Пробиотические штаммы также могут выделять экзополисахариды, которые препятствуют образованию биопленок патогенных микроорганизмов (Kim, Oh, & Kim, 2009).
Рис. 1. Механизмы действия пробиотиков. а) Конкурентное исключение патогенных микроорганизмов. b) Производство противомикробных веществ. c) Конкуренция за питательные вещества и факторы роста. d) Увеличение адгезии к слизистой оболочке кишечника. e) Усиление барьерной функции эпителия. f) Повышенная секреция Ig A (иммунная стимуляция).
Некоторые пробиотики могут также применять механизмы предотвращения колонизации, при которых они конкурентно ингибируют адгезию патогенных микроорганизмов к поверхности клеток хозяина (La Ragione, Narbad, Gasson, & Woodward, 2004). Для этого механизма важны определенные белки, присутствующие на поверхности пробиотических агентов, например, белки S-слоя (поверхностного слоя) на поверхности Lactobacillus helveticus и Lactobacillus crispatus, которые могут препятствовать адгезии Escherichia coli O157:H7 к клеткам HeLa, HEp-2 и T84 (Johnson-Henry, Hagen, Gordonpour, Tompkins, & Sherman, 2007). На рис. 1 показаны механизмы действия пробиотиков.
Роль пробиотиков как агентов биоконтроля пищевых продуктов и поверхностей, контактирующих с пищевыми продуктами
Овощи и свежие фрукты

Употребление овощей и свежих фруктов полезно для здоровья, поскольку они содержат питательные вещества, которые являются жизненно важными в рационе человека; есть доказательства того, что они приносят огромную пользу после употребления. Потребление свежих фруктов и овощей растет, но эти продукты могут быть загрязнены или заражены патогенными микроорганизмами, такими как Salmonella spp., Listeria monocytogenes и другими видами. Продукты, содержащие такие патогены, могут вызывать вспышки заболеваний, передающихся с пищей, среди населения (Alegre, Abadias, Anguera, Oliveira, & Vinas, 2010; CDC, 2007). Schuenzel и Harrison (2002) утверждают, что применение культур с ингибирующими свойствами может увеличить срок хранения овощей и повысить безопасность этих продуктов. В другом исследовании, проведенном Rydlo, Miltz и Mor (2006), молочнокислые бактерии могут защищать пищевые продукты от порчи и патогенных бактерий во время хранения, используя несколько механизмов, включая производство антимикробных веществ и конкуренцию за питательные элементы с патогенами. Был проанализирован возможный защитный эффект от Salmonella spp. и Listeria monocytogenes на свежесрезанных яблоках с помощью пробиотика Lactobacillus rhamnosus GG (Alegre, Vinas, Usall, Anguera, & Abadias, 2011). Эти авторы сообщили, что добавление штамма Lactobacillus rhamnosus GG к долькам яблок в концентрации 106 КОЕ/г привело к снижению роста Listeria monocytogenes на 1 логарифмическую единицу без какого-либо ухудшения качества в течение 14-дневного периода хранения как при 5, так и при 10°C, в то время как популяция Salmonella не уменьшалась под воздействием этого пробиотического штамма в тех же условиях на яблочных дольках.
Ферментированные продукты

Сыр - один из самых популярных кисломолочных продуктов питания, который употребляют многие люди по всему миру. Сыр может быть важным источником для выделения пробиотических кандидатов. Caggia, De Angelis, Pitino, Pino и Randazzo (2015) продемонстрировали, что пробиотические штаммы Lactobacillus rhamnosus FS10 и Lactobacillus paracasei PM8, выделенные из сыра, проявили in vitro антимикробную активность против Listeria monocytogenes, Escherichia coli, Enterococcus faecalis и Staphylococcus aureus, являющихся патогенами пищевого происхождения. Авторы предполагают, что эти потенциальные пробиотические штаммы могут быть использованы в функциональных продуктах питания для обеспечения пищевой безопасности. Более того, пробиотический штамм Enterococcus durans LAB18s, выделенный из сыра "Минас Фрескаль" (Minas Frescal), продемонстрировал широкий ингибирующий спектр против различных патогенных микроорганизмов in vitro, а именно Listeria monocytogenes, Escherichia coli, Bacillus cereus, Staphylococcus aureus, Salmonella enterica subsp. enterica serovar Typhimurium, Salmonella enterica subsp. enterica serovar Enteritidis, Pseudomonas aeruginosa (выделенная из пищи), Aeromonas hydrophila и Corynebacterium fimi (Pieniz, Andreazza, Anghinoni, Camargo, & Brandelli, 2014). Благодаря своей сильной антилистериозной активности Enterococcus faecium AQ71 (выделенный из азербайджанского сыра "Мотал") может быть использован в качестве "консервирующей культуры" в пищевой промышленности (Ahmadova et al., 2013). El-Kholy, El-Shinawy, Meshrefl и Korany (2014) заметили, что во время производства и хранения сыра "Домиати" (Domiati) пробиотики Lactobacillus acidophilus La-5 и Bifidobacterium longum ATCC15707 могли подавлять рост Escherichia coli O157:H7 и Staphylococcus aureus. Авторы показали, что L. acidophilus La-5 эффективно снижал количество E. coli O157:H7 и S. aureus на 1,88 и 3 log-цикла соответственно, а B. longum ATCC15707 снижал количество S. aureus и E. coli O157:H7 на 1,7 и 0,88 log-цикла соответственно, постепенно в течение 14 дней хранения, по сравнению с контрольным сыром.
В ряде исследований было доказано, что некоторые традиционные ферментированные продукты содержат пробиотики, которые могут подавлять патогенные микроорганизмы. Например, пробиотик Lactobacillus plantarum DGK-17, выделенный из кимчи, традиционного ферментированного корейского овощного продукта, показал антимикробную активность in vitro (тест диффузии на агаре) против нескольких патогенных микроорганизмов пищевого происхождения и целевых патогенов, таких как Pseudomonas aeruginosa, Klebsiella pneumoniae, Escherichia coli, Salmonella enterica subsp. enterica serovar Typhimurium, Bacillus subtilis, Bacillus cereus, Listeria monocytogenes и Staphylococcus aureus (Khan & Kang, 2016). Кроме того, Mpofu et al. (2016) продемонстрировали, что «мутандабота» («Mutandabota»), молочный продукт, потребляемый в южных районах Африки, при ферментации с пробиотиком Lactobacillus rhamnosus yoba проявлял антимикробную активность против 5 важных пищевых патогенов: Listeria monocytogenes, Escherichia coli O157:H7, Salmonella spp., Campylobacter jejuni и Bacillus cereus, и может считаться более безопасным, чем традиционная мутандабота.
Rubio et al. (2013) продемонстрировали, что два пробиотических штамма, Lactobacillus plantarum 299V и Lactobacillus rhamnosus GG, могут ингибировать рост Enterobacteriaceae в течение всего процесса ферментации мяса при применении в двух дозах (105 и 107 КОЕ/г). Пробиотический штамм Lactobacillus casei LOCK 0900 в концентрации 9 log КОЕ/г снижал популяции Escherichia coli, Staphylococcus aureus и Enterobacteriaceae в сыровяленых колбасах как после ферментации, так и в течение 6 месяцев хранения storage (Trząskowska, Kołożyn-Krajewska, Wójciak, & Dolatowski, 2014). Erkkilä et al. (2000) пришли к выводу, что пробиотические агенты Lactobacillus rhamnosus GG, L. rhamnosus LC-705, L. rhamnosus E-97800 и коммерческий Pediococcus pentosaceus ингибируют рост патогенной энтерогеморрагической Escherichia coli O157:H7 в сырой колбасе; количество популяций E. coli O157:H7 снизилось примерно с 5 до примерно 2 log КОЕ/г, и была получена высококачественная сухая колбаса.
Мясные продукты

Мясо и мясопродукты являются хорошей средой для роста микроорганизмов (Galvez, Abriouel, Benomar, & Lucas, 2010); поэтому многие штаммы пробиотиков используются в качестве заквасочных (стартерных) культур при переработке мяса. Многочисленные исследования показали, что пробиотические штаммы могут подавлять пищевые патогены, содержащиеся в мясных продуктах. Например, штаммы Lactobacillus reuteri PL542, L. reuteri PL519 и Lactobacillus fermentum ингибировали патоген пищевого происхождения Listeria monocytogenes (in vitro). Эти штаммы рассматривались в качестве подходящих потенциальных пробиотиков в мясных заквасках для производства иберийских колбас сухого брожения (Ruiz-Moyano et al., 2009). Более того, Muthukumarasamy and Holley (2007) сообщили, что пробиотический штамм Lactobacillus reuteri ATCC 55730 увеличивает инактивацию Escherichia coli O157:H7 в процессе производства колбас. При температуре охлаждения (5°C) некоторые пробиотические молочнокислые бактерии могут конкурентно подавлять рост патогенов Listeria monocytogenes в готовых к употреблению мясных продуктах, не вызывая изменений на ощупь (Amezquita & Brashears, 2002). В 2009 году два штамма, Lactobacillus fermentum ACA-DC179 и Enterococcus faecium PCD71, были успешно применены к сырому куриному мясу и эффективно снизили рост патогенов пищевого происхождения Salmonella enterica subsp. enterica serovar Enteritidis и Listeria monocytogenes (Maragkoudakis et al., 2009). Эти авторы также подтвердили, что применение этих штаммов не оказало неблагоприятного воздействия на сырое куриное мясо. Кроме того, Castellano, Gonzalez, Carduza, and Vignolo (2010) продемонстрировали, что инокуляция Lactobacillus curvatus CRL705 на поверхность упакованной в вакуум сырой говядины, которая затем хранилась в течение 60 дней, контролировала чрезмерный рост существующих в природе бактерий Listeria spp. и Brochothrix thermosphacta, приводящих к порче, не вызывая химических, портящих или сенсорных эффектов качества мяса. Более того, Lactobacillus sakei CECT 4808 значительно снижал количество микроорганизмов, вызывающих порчу, таких как Enterobacteriaceae, Pseudomonas spp. и Brochothrix thermosphacta, во время хранения нарезанной говядины в вакуумной упаковке в течение 28 дней без какого-либо негативного влияния на качество мяса (Katikou, Ambrosiadis, Georgantelis, Koidis, & Georgakis, 2005).
Предприятия пищевой промышленности

Пробиотические микроорганизмы могут уменьшать образование биопленок на различных предприятиях пищевой промышленности и на поверхностях. Zhao et al. (2013) продемонстрировали, что два пробиотических штамма молочнокислых бактерий, Enterococcus durans штамм 152 и Lactococcus lactis subsp. lactis штамм C-1-92 потенциально могут уменьшить образование биопленок Listeria monocytogenes в напольных стоках на заводе по переработке готовых к употреблению продуктов из птицы. Образующие биопленку Lactobacillus spp. могут ингибировать образование биопленок Listeria monocytogenes на абиотических поверхностях мясоперерабатывающего предприятия (Ibarreche, Castellano & Vignolo, 2014). Более того, Woo and Ahn (2013) показали, что пробиотические штаммы Lactobacillus (L. acidophilus KACC 12419, L. paracasei KACC 12427, L. casei KACC 12413 и L. rhamnosus KACC 11953) могут эффективно снижать образование биопленок, вызываемых пищевыми патогенами Salmonella enterica subsp. enterica serovar Typhimurium и Listeria monocytogenes посредством механизмов конкуренции, исключения и вытеснения. Исследования показали, что высушенный распылением неочищенный ферментат бактериоцина (CBF) из клеток Lactococcus Lactis UQ2 или Lactococcus Lactis UQ2 уменьшает или контролирует образование биопленок Listeria monocytogenes на поверхностях из нержавеющей стали, которые широко используются для оборудования на предприятиях пищевой промышленности (García-Almendárez, Cann, Martin, Guerrero-Legarreta, & Regalado, 2008). Эти исследователи продемонстрировали, что более 5 логарифмических циклов планктонных и сидячих клеток L. monocytogenes на фритюрницах из нержавеющей стали могут быть уменьшены с помощью L. Lactis UQ2. (прим. ред.: планктонные клетки - («свободно текущие бактерии в суспензии»; сидячие клетки - биопленка или «структурированное сообщество клеток (бактерий), заключенных в самопроизведенную полимерную матрицу и прикрепленных к инертной или живой среде). Результаты другого исследования показали, что штамм Lactobacillus sakei 1 и содержащийся в нем бактериоцин могут уменьшать или контролировать образование биопленки Listeria monocytogenes на поверхностях из нержавеющей стали (Winkelströter, Gomes, Thomaz, Souza & De Martinis, 2011). Guerrieri et al. (2009) оценили анти-листерическую активность против биопленок, разработанных в мелкомасштабной модели, путем сравнения продуцентов бактериоцинов (Lactobacillus plantarum 35d и Enterococcus casseliflavus IM 416K1) с двумя непродуцентами бактериоцина (L. plantarum 396/1 и E. faecalis JH2–2). Авторы заметили, что кандидаты, продуцирующие бактериоцин, демонстрировали высокий уровень микробного ингибирования на абиотических поверхностях, и это ингибирование было штаммоспецифичным. Кроме того, пробиотические биопленки могут использоваться в качестве альтернативного способа снижения образования патогенных биопленок в пищевой промышленности (Gomez, Ramiro, Quecan и de Melo Franco, 2016). Эти авторы обнаружили, что пробиотические штаммы МКБ из пищевых продуктов, использованных в исследовании, способны контролировать образование биопленок пищевых патогенов Salmonella enterica subsp. enterica серовар Typhimurium, Escherichia coli O157:H7 и Listeria monocytogenes, не создавая при этом никакого риска для потребителей. Пробиотический агент Lactobacillus acidophilus A4 продуцирует антимикробное экзополисахаридное соединение (r-EPS), которое может уменьшать образование биопленок энтерогеморрагической Escherichia coli O157:H7 на 96-луночных микропланшетах (87%) и на поверхностях полистирола и поливинилхлорида (94%) (Kim et al., 2009).
Безопасность пищевых продуктов очень важна для потребителей. С точки зрения безопасности пищевых продуктов многие исследователи пришли к выводу, что различные штаммы пробиотиков могут уменьшать или подавлять рост патогенов пищевого происхождения в продуктах питания и на поверхностях, контактирующих с пищевыми продуктами, в пищевой промышленности.
Роль пробиотиков в животноводстве и птицеводстве как агентов биоконтроля

Многие развивающиеся страны используют различные виды домашнего скота в качестве основного источника дохода и продовольствия. Зоонозные патогены, связанные с животными, могут передаваться людям, вызывая серьезный риск для здоровья населения, а также экономические потери в этих отраслях. Европейское управление по безопасности пищевых продуктов (EFSA, 2004) заявило, что загрязнение пищевых продуктов и пищевые отравления человека можно наиболее эффективно снизить путем снижения количества патогенов в организме живых животных. Наиболее важной целью использования пробиотиков для кормления животных является поддержание и улучшение роста и продуктивности животных, а также предотвращение и контроль кишечных патогенов. Здоровая микробная экология в желудочно-внутриклеточном тракте (ЖКТ) связана с улучшением показателей жизнедеятельности животных (роста и продуктивности) (Hung et al., 2012). Пробиотики могут изменять и поддерживать здоровую микробную экологию ЖКТ у животных, что может увеличить популяцию полезных микробов, которые предотвращают колонизацию вредных кишечных патогенов в ЖКТ путем выработки антимикробных соединений (Mountzouris, Balaskas, Xanthakos, Tzivinikou, & Fegeros, 2009; Shim et al., 2012). Таким образом, пробиотики могут быть эффективной альтернативой кормовым добавкам с антибиотиками для контроля кишечной патогенной нагрузки у животных за счет уменьшения колонизации кишечника и распространения распространенных зоонозных и других кишечных патогенов.
Домашняя птица

Домашняя птица и продукты из нее являются жизненно важным источником инфекции для человека (EFSA, 2015). Домашняя птица является важным резервуаром Campylobacter spp., как сообщается во многих исследованиях (Guard-Nicodème et al., 2015). Кампилобактериоз - широко распространенное зоонозное заболевание в ЕС, связанное с животными, разводимыми для получения продуктов питания (EFSA, 2015). В пределах рода Campylobacter виды C. jejuni, C. lari, C. coli и C. upsaliensis могут вызывать заболевания человека, хотя C. jejuni является одной из наиболее известных бактерий, вызывающих болезни пищевого происхождения у сельскохозяйственных животных (Hugas, Tsigarida, Robinson, & Calistri, 2009).
Таблица 1. Влияние пробиотиков на патогенные микроорганизмы кур.
|
Пробиотик
|
Целевой патоген
|
Тест
|
Эффект
|
Ref.
|
|
Lactobacillus salivarius SMXD51, Lb. salivarius MMS122, Lb. salivarius MMS151
|
Campylobacter jejuni
|
Диффузия в чашках с агаром (in vitro)
|
Появление зоны ингибирования
|
(Messaoudi et al., 2011)
|
|
Lactobacillus spp. P93
|
Campylobacter jejuni
|
Совместное культивирование и диффузия в чашках с агаром
|
Ингибирование роста патогена (снижение на 4-6 log)* и появление зоны ингибирования (in vitro)
|
(Chaveerach, Lipman, & Van Knapen, 2004)
|
|
Lactobacillus fermentum ATCC 14931, Lb. johnsonii BFE663, Lb. paracasei IMT22353,
|
Campylobacter jejuni
|
Диффузия в чашках с агаром (in vitro)
|
Появление зоны ингибирования
|
(Bratz, Gölz, Janczyk,
Nöckler, & Alter, 2015)
|
|
Lactobacillus gasseri SBT2055
|
Campylobacter jejuni
|
in vivo
|
Ингибирование роста патогена на 1-2 log
|
(Nishiyama et al., 2014)
|
|
Bacillus spp., Lb. salivarius subsp. salivarius, Lb. salivarius subsp. salicinius,
|
Campylobacter jejuni
|
in vivo
|
Ингибирование роста патогена на 1–3 log
|
(Arsi, Donoghue, Woo-Ming, Blore, & Donoghue, 2015 b.)
|
|
Bacillus spp.
|
Campylobacter jejuni
|
in vivo
|
Ингибирование роста патогена на 1–3 log
|
(Arsi, Donoghue, Woo-Ming, Blore, & Donoghue, 2015a)
|
|
Lb. paracasei J.R + Lb. rhamnosus 15b + Lb. lactis Y+Lb. lactis FOa
|
Campylobacter jejuni
|
in vivo
|
Ингибирование роста патогена на 5 log
|
(Cean et al., 2015)
|
|
Смесь из трех Bacillus subtilis spp.
|
Campylobacter jejuni
|
in vivo
|
Ингибирование роста патогена на 1–4 log
|
(Aguiar et al., 2013)
|
|
Bacillus cereus var. toyoi
|
Salmonella enterica subsp. enterica serovar Enteritidis
|
in vivo
|
Снижение колонизации Salmonella Enteritidis
|
(Vila et al., 2009)
|
|
Bacillus subtilis B2A
|
Salmonella population
|
in vivo
|
Снижение количества сальмонеллы
|
(Park & Kim, 2014)
|
|
Bacillus subtilis
|
Salmonella gallinarum
|
in vivo
|
Снижение количества возбудителей Salmonella gallinarum.
|
(Upadhaya et al., 2016)
|
|
Enterococcus faecium
|
E. coli K88
|
in vivo
|
Снижение E. coli
|
(Cao et al., 2013)
|
|
Lactobacillus johnsonii F19185
|
Clostridium perfringens
|
in vivo
|
Снижение колонизации C. perfringens
|
(La Ragione et al., 2004)
|
|
Lactobacillus johnsonii F19185
|
E. coli O78:K80
|
in vivo
|
Снижение колонизации E. coli
|
(La Ragione et al., 2004)
|
*Log reduction (лог-редукция или лог-снижение) — это математический термин, который используется для обозначения относительного числа живых микробов, удалённых с поверхности в результате дезинфекции или очистки. Например, «5-log reduction» означает снижение количества микроорганизмов в 100 000 раз.
В исследованиях in vitro оценивалась потенциальная антимикробная активность штаммов пробиотиков против патогенов Campylobacter, и на основании результатов этих тестов выделенные потенциальные штаммы пробиотиков были применены на птицефабриках. Было идентифицировано несколько потенциальных пробиотиков против кампилобактерий (таблица 1). Например, было показано, что Pediococcus parvulus и Lactobacillus salivarius потенциально ингибируют C. jejuni с помощью теста диффузии на агаре (Menconi et al., 2014). Методы совместного культивирования также применялись в качестве тестов in vitro. Robyn, Rasschaert, Messens, Pasmans и Heyndrickx (2012) показали, что совместное культивирование с Enterococcus faecalis MB 5259 снижало рост Campylobacter jejuni на 0,5–1 log.
В нескольких более ранних исследованиях сообщалось об эффективной роли пробиотиков в предотвращении или уменьшении выделения Campylobacter jejuni в исследованиях in vivo. Santini et al. (2010) сообщили, что пробиотический штамм Bifidobacterium longum PCB 133 успешно снизил количество C. jejuni в кале птицы по сравнению с необработанной группой при скармливании его 20-дневным цыплятам-бройлерам. Недавно Nishiyama et al. (2014) продемонстрировали способность Lactobacillus gasseri SBT2055 препятствовать адгезии и проникновению C. jejuni in vitro и нагрузке C. jejuni на цыплят in vivo. В другом исследовании Neal-McKinney et al. (2012) продемонстрировали, что добавление в корм пробиотического штамма Lactobacillus crispatus JCM5810 привело к значительному снижению количества C. jejuni у цыплят-бройлеров.
Комбинации пробиотиков также можно использовать для уменьшения выделения C. jejuni у цыплят-бройлеров. Willis и Reid (2008) показали, что пробиотики Lactobacillus acidophilus, Lactobacillus casei, Bifidobacterium thermophilum и Enterococcus faecium, используемые в качестве пищевой добавки к корму, могут значительно ингибировать рост C. jejuni у цыплят-бройлеров в дозе 108 КОЕ/г. В 2015 году Cean et al. (2015) заметили, что комбинация штаммов Lactobacillus, L. paracasei J.R., L. rhamnosus 15b, L. lactis Y и L. lactis FOa, выделенных от человека, может значительно ингибировать инвазию C. jejuni в клетки кишечника цыплят in vitro и может эффективно снизить присутствие этого патогена в кишечнике кур in vivo. Эти авторы сообщили, что 42 дня лечения этой комбинацией пробиотиков значительно снизили (на 0,5–5 log единиц) нагрузку C. jejuni из кишечной слизи.
Сальмонелла (Salmonella) — еще один род важных организмов, обнаруженных у кур. Эти организмы способны заражать кур, увеличивая риск для здоровья птицы и потребителей (Humphrey, 2006). Наряду с видами Campylobacter и Salmonella, некоторые другие патогенные бактерии, такие как Clostridium perfringens и патогенная E. coli, представляют повышенный риск для домашней птицы (Humphrey, O'Brien & Madsen, 2007).
Несколько экспериментальных результатов указывают на то, что применение пробиотических культур может эффективно контролировать и уменьшать колонизацию патогенов у домашней птицы (таблица 1). Например, введение цыплятам 108 КОЕ Lactobacillus salivarius 3d уменьшило колонизацию слепой кишки Salmonella enterica subsp. enterica serovar enteritidis и Clostridium perfringens в течение не менее 14 дней (Kizerwetter-Świda & Binek, 2009). В исследовании, проведенном Higgins et al. (2008), патогенный вызов Salmonella enterica subsp. enterica serovar Enteritidis был эффективно снижен у неонатальных цыплят-бройлеров путем применения пробиотических культур на основе Lactobacillus. Применение пробиотика Bacillus subtilis B2A в виде диетической добавки снижало популяцию Salmonella spp. в кишечнике бройлеров (Park & Kim, 2014). Пробиотический штамм Bacillus subtilis эффективно снижал количество патогенов Salmonella gallinarum в желудочно-кишечном тракте цыплят-бройлеров породы Hy-Line (Upadhaya, Hossiendoust, & Kim, 2016). При добавлении в корм цыплят-бройлеров пробиотического штамма Enterococcus faecium в концентрации 1×109 КОЕ/кг наблюдалось значительное снижение количества Escherichia coli K88 (Cao et al., 2013).
Снижение или контроль количества патогенных микроорганизмов в инфицированной переработанной птице и живой птице позволит успешно снизить риск для потребителей. Применение пробиотиков в качестве агента биоконтроля для снижения количества патогенных микроорганизмов в домашней птице является подходящим альтернативным методом.
Таблица 2. Пробиотики, используемые у разных животных против патогенов.
|
Животные
|
Потенциальный пробиотик
|
Целевой патоген
|
Наблюдаемый эффект
|
Ref.
|
|
Свинья
|
Enterococcus faecium
|
Clostridium perfringens
|
Ингибирующий эффект против Clostridium perfringens
|
(Hanczakowska et al., 2016)
|
|
Enterococcus faecium NCIMB 11181
|
Escherichia coli
|
Снижение количества кишечной палочки в фекалиях
|
(Pajarillo et al., 2015)
|
|
|
Lactobacillus fermentum I5007
|
Clostridium spp. & Escherichia spp.
|
Снижение уровня Clostridium spp. и Escherichia spp.
|
(Liu et al., 2014)
|
|
|
Enterococcus faecium
|
Escherichia coli
|
Снижение количества кишечных палочек
|
(Pollmann, Nordhoff, Pospischil, Tedin, & Wieler, 2005)
|
|
|
Коза
|
Lactobacillus plantarum PCA 236
|
Clostridium spp.
|
Снижение количества Clostridium spp.
|
(Maragkoudakis et al., 2010)
|
|
Lactobacillus alimentarius DDL 48 + Lactobacillus reuteri DDL 19 + Bifidobacterium bifidum DDBA +Enterococcus faecium DDE 39
|
Shigella & Salmonella
|
Снижение на 1,21 log и 1,09 log соответственно
|
(Apas et al., 2010)
|
|
|
Крупный рогатый скот
|
Propionibacterium freudenreichii
+ Lactobacillus acidophilus NP51
|
E. coli O157:H7
|
Снижение уровня фекального выделения E. coli O157:H7
|
(Wisener et al., 2015)
|
|
Lactobacillus acidophilus strain NP51
|
E. coli O157:H7
|
Снижение числа случаев выделения E. coli O157:H7 в фекалиях
|
(Tabe et al., 2008)
|
|
|
Propionibacterium freudenreichii
+ Lactobacillus acidophilus NP51
|
E. coli O157:H7
|
Уменьшение количества фекальных выделений E. coli O157:H7
|
(Sargeant et al., 2007)
|

У свиней применение пробиотиков связано с борьбой и уменьшением патологических состояний, возникающих из-за дисбаланса пищеварения. Добавление пробиотических культур с целью эффективного контроля и снижения колонизации патогенов в организме свиней было проведено в нескольких исследованиях (Таблица 2). Guerra, Bernardez, Mendez, Cachaldora и Castro (2007) отметили, что четыре потенциальных пробиотических штамма, Pediococcus acidilactici NRRL B-5627, Lactobacillus casei subsp. casei CECT 4043, Lactococcus lactis subsp. lactis CECT 539 и Enterococcus faecium CECT 410, снизили количество жизнеспособных колиформных бактерий у поросят-отъемышей. Недавно Pajarillo et al. (2015) обнаружили значительное снижение количества фекальных патогенных микроорганизмов Escherichia coli у поросят-отъемышей по сравнению с контрольной группой при кормлении пробиотическим штаммом Enterococcus faecium NCIMB 11181.
По данным Hanczakowska, Świątkiewicz, Natonek-Wiśniewska и Okoń (2016), корм с добавлением Enterococcus faecium показал ингибирующий эффект против Clostridium perfringens у поросят. В соответствии с этим, Szabo et al. (2009) обнаружили, что добавка Enterococcus faecium может улучшить инфекционное состояние сальмонелл путем увеличения выделения Salmonella enterica subsp. enterica serovar Typhimurium у поросят-отъемышей. В экспериментах, проведенных Liu et al. (2014), сообщалось, что штамм Lactobacillus fermentum I5007 снижал популяцию Clostridium spp. и энтеропатогенных Escherichia spp. у новорожденных поросят после перорального введения в дозе 6×109 КОЕ/мл ежедневно.
Крупный рогатый скот

Несколько полевых испытаний показали, что добавление пробиотиков может эффективно контролировать и снижать нагрузку патогенов в кишечнике крупного рогатого скота (таблица 2). Двухлетнее полевое исследование, проведенное Peterson et al. (2007) обнаружили, что ежедневное применение кормовой добавки Lactobacillus acidophilus штамма NP51 мясному скоту привело к значительному снижению на 35% выделения Escherichia coli O157:H7 с фекалиями. В другом исследовании сообщалось, что выделение E. coli O157:H7 с фекалиями у крупного рогатого скота было эффективно снижено (32%) после добавления в корм штамма Lactobacillus acidophilus NP51 (NPC 747) (Tabe et al., 2008). Это согласуется с результатами Sargeant, Amezcua, Rajic и Waddell (2007), которые обнаружили, что пробиотическая комбинация Propionibacterium freudenreichii и Lactobacillus acidophilus NP51 (NPC 747) эффективна у крупного рогатого скота для снижения выделения E. coli О157:H7 с фекалиями. Недавно Wisener, Sargeant, O'Connor, Faires и Glass-Kaastra (2015) также подтвердили, что комбинация Propionibacterium freudenreichii и Lactobacillus acidophilus NP51 (NPC 747) эффективно снижает выделение с фекалиями E. coli O157:H7 у крупного рогатого скота. Эти авторы также предположили, что дозировка 109 КОЕ/животное/день была более эффективной, чем более низкие дозы.
Козы

Несколько полевых испытаний показали, что добавление пробиотиков может эффективно контролировать и снижать патогенную нагрузку в кишечнике коз (таблица 2). Пероральное введение козам смешанной пробиотической добавки, содержащей штаммы Lactobacillus alimentarius DDL 48, Lactobacillus reuteri DDL 19, Bifidobacterium bifidum DDBA и Enterococcus faecium DDE 39, снижало уровни энтеробактерий Shigella и Salmonella в фекалиях на 1,21 log и 1,09 log соответственно в течение периода исследования (Apas, Dupraz, Ross, Gonzalez, & Arena, 2010). Применение пробиотической кормовой добавки Lactobacillus plantarum PCA 236 для коз снижало количество Clostridium spp. в фекалиях (Maragkoudakis et al., 2010). Значительное снижение количества кишечной палочки в фекалиях наблюдалось у коз после добавления в корм Saccharomyces cerevisiae (Stella et al., 2007). Результаты этих исследований показывают, что пробиотики обладают потенциальной антимикробной активностью в отношении основных патогенов, таких как Campylobacter spp., Salmonella spp., Escherichia coli и других возбудителей пищевых заболеваний, тем самым контролируя колонизацию этих патогенов в организме животных.
Подводя краткий итог, можно сказать, что в результате применения пробиотиков улучшаются темпы роста животных и птиц, в т.ч. качество мяса, молока, яиц, а также продуктивность.
Роль пробиотиков в аквакультуре в качестве агентов биоконтроля
 |
 |
Аквакультура является жизненно важным источником дохода во многих странах, и в последние 30 лет эта отрасль переживает бурный рост во всем мире. Использование антибиотиков для борьбы с инфекционными заболеваниями в аквакультуре может негативно сказаться на состоянии окружающей среды и здоровье населения. По этой причине пробиотические методы широко применяются для борьбы с болезнями во многих развивающихся странах, поскольку они более экологичны (Sorroza et al., 2012). Исходя из результатов тестов in vitro, мы можем рассмотреть, можно ли анализировать эти пробиотические штаммы-кандидаты in vivo.
Большинство пробиотиков, используемых в аквакультуре в качестве агентов биоконтроля, относятся к видам МКБ (Lactobacillus и Carnobacterium) и Bacillus, хотя другие распространенные пробиотики, используемые в аквакультуре, включают виды Aeromonas, Enterobacter, Pseudomonas, Shewanella, Lactococcus, Leuconostoc, Vibrio, Enterococcus и Saccharomyces, указанные в таблице 3.
Таблица 3. Пробиотики, используемые в аквакультуре против патогенов.
|
Потенциальный пробиотик
|
Виды рыб
|
Воздействие на виды рыб
|
Ref.
|
|
Enterococcus faecium SF68 и Bacillus toyoi
|
Речной угорь
(Anguilla Anguilla)
|
Защита от эдвардсиеллеза путем уменьшения количества Edwardsiella tarda
|
(Chang & Liu, 2002).
|
|
Aeromonas sobria GC2
|
Радужная форель (Oncorhynchus mykiss)
|
Борьба с лактококкозом (вызываемым Lactococcus garvieae) и стрептококкозом (вызываемым Streptococcus iniae)
|
(Brunt & Austin, 2005)
|
|
Lactococcus lactis ssp. lactis CLFP 100, Leuconostoc mesenteroides CLFP 196 и Lactobacillus sakei CLFP 202
|
Радужная форель (Oncorhynchus mykiss)
|
Защита от фурункулеза, заболевания, вызываемого возбудителем Aeromonas salmonicida ssp. salmonicida.
|
(Balcazar et al., 2007)
|
|
Vibrio alginolyticus UTM 102, Phaeobacter gallaeciensis SLV03, Pseudomonas aestumarina SLV22
|
Белоногая креветка (Litopenaeus vannamei)
|
Защита от Vibrio parahaemolyticus
|
(Balcazar, Rojas-Luna, & Cunningham, 2007)
|
|
Streptococcus phocae PI8o
|
Тигровая креветка (Penaeus monodon)
|
Ингибирующая активность против заражения Vibrio harveyi
|
(Swain, Singh, & Arul, 2009)
|
|
Lactobacillus rhamnosus GG
|
Радужная форель (Oncorhynchus mykiss)
|
Защита кишечника от поражения аэромонадами (Aeromonas)
|
(Ngamkala, Futami, Endo, Maita, & Katagiri, 2010)
|
|
Aeromonas sobria GC2,
и Bacillus subtilis JB-1
|
Радужная форель (Oncorhynchus mykiss)
|
Защита от заражения Yersinia ruckeri
|
(Abbass, Sharifuzzaman, & Austin, 2010)
|
|
Bacillus pumilus SE5, Bacillus clausii DE5
|
Оранжево-пятнистый групер (Epinephelus coioides)
|
Снижение уровня вибрионов
|
(Sun, Yang, Ma, & Lin, 2010)
|
|
Pseudomonas sp. MSB1
|
Радужная форель (Oncorhynchus mykiss)
|
Ингибирование роста Flavobacterium psychrophilum in vitro
|
(Strom-Bestor & Wiklund, 2011)
|
|
Pseudomonas sp. M174
|
Радужная форель (Oncorhynchus mykiss)
|
Ингибирование роста рыбного патогена Flavobacterium psychrophilum
|
(Korkea-aho, Heikkinen, Thompson, von
Wright, & Austin, 2011)
|
|
Pseudomonas aeruginosa VSG-2
|
Рохита (Labeo rohita)
|
Защита от инфекции Aeromonas hydrophila
|
(Giri, Sen, & Sukumaran, 2012)
|
|
Brevibacillus brevis
|
Сибас или обыкновенный лаврак (Dicentrarchus labrax)
|
Защита от вибриоза за счет снижения уровня возбудителя Vibrio
|
(Mahdhi, Kamoun, Messina,
Santulli, & Bakhrouf, 2012)
|
|
Bacillus sp. C5I18
|
Нильская тиляпия (Oreochromis niloticus)
|
Ингибирование роста видов Aeromonas и Pseudomonas в кишечнике рыбы
|
(Del'Duca, Cesar, Diniz, & Abreu, 2013)
|
Большинство пробиотиков, предлагаемых в качестве агентов биоконтроля против патогенов в секторе аквакультуры, принадлежат к роду Lactobacillus. Так Lactobacillus acidophilus полезен как пробиотик против некоторых распространенных патогенных бактерий (Staphylococcus xylosus, Aeromonas hydrophila gr.2 и Streptococcus agalactiae) у африканского клариевого сома Clarias gariepinus. (Al-Dohail, Hashim, & Aliyu-Paiko, 2011). По данным Pirarat, Kobayashi, Katagiri, Maita и Endo (2006), применение пробиотических пищевых добавок Lactobacillus rhamnosus в отношении тиляпии (Oreochromis niloticus) показало защитное действие против экспериментальной инфекции Edwardsiella tarda. Кроме того, Giri, Sukumaran, and Oviya (2013) обнаружили, что диетическая добавка пробиотического штамма Lactobacillus plantarum VSG3 в количестве 108 КОЕ/г была очень эффективна для рыб рохито (Labeo rohita) в борьбе с заболеванием, вызываемым Aeromonas hydrophila.
Виды Bacillus являются грамположительными бактериями, и большинство видов не оказывают вредного воздействия на человека и животных. Наиболее часто исследуемые виды — Bacillus subtilis, B. cereus, B. coagulans, B. clausii и B. licheniformis — использовались в качестве пробиотиков, а Bacillus spp. сохраняют некоторые преимущества перед Lactobacillus spp. (Cutting, 2011). Пробиотики Bacillus spp. также используются в секторе аквакультуры в качестве агентов биоконтроля. Das, Nakhro, Chowdhury и Kamilya (2013) сообщили, что потенциальный пробиотический штамм Bacillus amyloliquefaciens FPTB16 проявил антагонистическую активность против рыбных патогенных бактерий, включая Aeromonas hydrophila, Vibrio harveyi, Vibrio parahaemolyticus и Edwardsiella tarda, что было определено методом диффузионного анализа в агаровой чашке (тест in vitro), а также обеспечил устойчивость южноазиатского карпа Catla catla к болезни, вызываемой Edwardsiella tarda, при диетической дозе 109 КОЕ/г. В другом исследовании бактерия Bacillus amyloliquefaciens G1 также продемонстрировала антагонистическую активность против инфекций Aeromonas hydrophila у угря (важного тепловодного вида) как in vitro, так и in vivo (Cao, He, Wei, Diong, & Lu, 2011). Кроме того, две пробиотические бактерии (Lactobacillus acidophilus и Bacillus subtilis) были исследованы на предмет их защитного действия in vitro против инфекционного вызова у разводимой нильской тиляпии (Oreochromis niloticus) (Aly, Ahmed, Ghareeb, & Mohamed, 2008). Эти авторы продемонстрировали, что рост Aeromonas hydrophila подавлялся как Bacillus subtilis, так и Lactobacillus acidophilus, а рост Pseudomonas fluorescens подавлялся B. subtilis, в то время как L. acidophilus подавлял рост Streptococcus iniae. Доза Bacillus subtilis AB1 в 107 клеток/г корма была эффективна при выращивании радужной форели (Oncorhynchus mykiss, Walbaum) для борьбы с возбудителем рыбной инфекции Aeromonas spp. (Newaj-Fyzul et al., 2007).
Пробиотик Enterococcus faecium MC13, выделенный из рыбы (Mugil cephalus), продемонстрировал потенциальный эффект против инфекционного возбудителя Aeromonas hydrophila у карпа (Cyprinus carpio) (Gopalakannan & Arul, 2011). В экспериментах выживаемость 75 и 77,8% наблюдалась у рыб, получавших пробиотики, через 30 и 60 дней после заражения Aeromonas hydrophila. В другом исследовании Swain et al. (2009) продемонстрировали, что кормление креветок (Penaeus monodon) Enterococcus faecium MC13 позволяет постличинкам бороться с вибриозом, эффективно ингибируя патогены Vibrio harveyi и V. parahaemolyticus.
Sorroza et al. (2012) продемонстрировали, что пробиотический штамм Vagococcus fluvialis обеспечивает эффективную защиту от инфекции Vibrio anguillarum 975-1 у европейского морского окуня (Dicentrarchus labrax) после экспериментального воздействия in vivo. Кроме того, защитное действие Alteromonas macleodii 0444, Neptunomonas sp. 0536, Phaeobacter gallaeciensis и Pseudoalteromonas sp. D41 были оценены на предмет патогенного воздействия на три вида личинок моллюсков: плоскую устрицу (Ostrea edulis), тихоокеанскую устрицу (Crassostrea gigas) и морской гребешок (Pecten maximus) (Kesarcodi-Watson, Miner, Nicolas, & Robert, 2012).
Оптимальная концентрация пробиотика, то есть доза, обеспечивающая эффективную защиту от патогенов при одновременном увеличении роста хозяина, является ограничивающим фактором (Minelli & Benini, 2008). Различные исследования по применению пробиотиков in vitro и in vivo в аквакультуре привели к выводу, что различные концентрации пробиотиков могут быть оптимальными в зависимости от иммунного ответа рыб. Доза 106–10 КОЕ/г корма обычно используется в качестве эффективной дозы пробиотика в аквакультуре (Наяк, 2010). Например, Brunt, Newaj-Fyzul и Austin (2007) продемонстрировали, что использование пробиотиков вида Bacillus в количестве 2×108 клеток было эффективным и привело к самому минимальному проценту смертности за счет снижения количества патогенов во время экспериментального заражения радужной форели. В нескольких исследованиях был сделан вывод, что активность in vitro таких пробиотиков, как Bacillus subtilis, Pdp11, 51M6, Lactobacillus delbrueckii subsp. lactis, и активность in vivo таких пробиотиков, как МКБ и Bacillus subtilis, зависят от способа дозирования (Salinas et al., 2006).
Другими важными факторами являются продолжительность кормления пробиотиками и способ их приема. В аквакультуре были зарегистрированы периоды кормления пробиотиками от 1 до 10 недель, что обусловлено положительными эффектами, такими как улучшение иммунной активности и защита от болезней. Как и доза пробиотика, период кормления пробиотиками зависит от параметров хозяина и иммунитета (Nayak, 2010). Применение пробиотиков Shewanella putrefaciens и Shewanella baltica путем скармливания в течение 60 дней значительно снизило численность Photobacterium damselae subsp. piscicida у рыб Solea senegalensis (Díaz-Rosales et al., 2009). Многие исследователи продемонстрировали, что пробиотики в аквакультуре можно вводить суспензионным, кормовым и ванным методами, однако наилучшим методом представляется использование кормовых добавок (Nayak, 2010). В 2006 году Таока и др. (Taoka et al., 2006) зарегистрировали повышение защиты и иммунитета в аквакультуре после перорального применения пробиотиков по сравнению с методом водных добавок.
Действительно, эти выводы указывают на то, что различные типы пробиотических штаммов следует рассматривать в качестве агентов биоконтроля для широкого использования в аквакультуре для подавления роста патогенных организмов.
Перспективы будущих исследований
Разработка пробиотиков в качестве биоконтрольных агентов в настоящее время является важной областью исследований. Поэтому признание потребителей (безопасность, эффективность, сенсорная привлекательность, бренд, маркетинг и др.) является основным вопросом для успеха и будущей жизнеспособности пробиотиков как биоконтрольных агентов в пищевой и сельскохозяйственной промышленности. Для того чтобы добиться признания со стороны потребителей, ученые должны убедить их в этом, предоставив правдивую, правильную и четкую информацию о любых заявлениях, касающихся здоровья. Что касается потребительского признания, будущие исследования должны быть сосредоточены на безопасности и эффективности пробиотиков, регулировании правильного использования пробиотиков и снижении рисков, связанных с пробиотиками, которые в основном и ценятся потребителями. В будущем необходимо также сосредоточиться на соответствующих исследованиях, касающихся разработки инновационных подходов по введению пробиотических штаммов в продукты питания и животных, улучшающих жизнеспособность и функциональность пробиотических штаммов. Кроме того, для лучшего понимания молекулярных механизмов, расшифровки уникальных генов пробиотиков и их нового применения необходимы исследования на молекулярном уровне. Более того, необходимы дальнейшие исследования пробиотиков в экспериментах in vivo для оценки взаимодействия между кишечной микрофлорой и пробиотическими штаммами. Учитывая пробелы в существующих знаниях, следует призывать ученых сосредоточиться на исследованиях пробиотиков с применением самых передовых достижений в области микробиологии, биотехнологии и в др. смежных науках.
Выводы
Патогенные микроорганизмы и сопутствующие им заболевания представляют собой серьезную проблему для сельского хозяйства (животноводства и аквакультуры) и пищевой промышленности в плане безопасности продуктов питания. Разработка потенциальных стратегий борьбы с микробными патогенами без каких-либо негативных последствий является сложной задачей. Многочисленные подходы уже разработаны, но их пагубное воздействие вызывает серьезную озабоченность. Наконец, в качестве альтернативного и экологически безопасного подхода пробиотики демонстрируют большие перспективы и представляются хорошим средством для борьбы с микробными патогенами во многих областях. В данном обзоре освещаются исследования, посвященные их активности и возможному механизму действия против патогенов пищевого происхождения. В данном обзоре в качестве кандидатов на пробиотики наиболее часто используются микроорганизмы родов Lactobacillus, Bacillus, Enterococcus, Lactococcus, которые проявляют потенциальную антимикробную активность in vitro и in vivo. Многие пробиотические штаммы используются в течение многих лет, не вызывая никаких отрицательных эффектов, однако при выборе пробиотика следует учитывать, что некоторые из этих родов, такие как Enterococcus и Bacillus, содержат виды с доказанным патогенным действием. В заключение следует отметить, что исследования показали, что, используя свои потенциальные антимикробные функции, пробиотики могут стать новым подходом к контролю или снижению количества патогенов, передающихся через пищевые продукты, и, таким образом, повысить безопасность продуктов питания на уровне потребителя.
Дополнительная информация:
- Пробиотики в системах животноводства
- Микробные препараты прямого скармливания
- Пробиотики в птицеводстве. Пропионибактерии
- Пропионовокислые бактерии и рубцовое пищеварение
- Пропионибактерии в качестве пробиотиков для свиней
Литература
- Abbass, A., Sharifuzzaman, S. M., & Austin, B. (2010). Cellular components of probiotics control Yersinia ruckeri infection in rainbow trout, Oncorhynchus mykiss (Walbaum). Journal of Fish Diseases, 33, 31–37.
- Aguiar, V. F., Donoghue, A. M., Arsi, K., Reyes-Herrera, I., Metcalf, J. H., de los Santos, F. S., ... Donoghueet, D. J. (2013). Targeting motility properties of bacteria in the development of probiotic cultures against Campylobacter jejuni in broiler chickens. Foodborne Pathogens and Disease, 10, 435–441.
- Ahmadova, A., Todorov, S. D., Choiset, Y., Rabesona, H., Zadi, T. M., Kuliyev, A., ... Haertle, T. (2013). Evaluation of antimicrobial activity, probiotic properties, and safety of wild strain Enterococcus faecium AQ71 isolated from Azerbaijani motal cheese. Food Control, 30, 631–641.
- Al-Dohail, M. A., Hashim, R., & Aliyu-Paiko, M. (2011). Evaluating the use of Lactobacillus acidophilus as a biocontrol agent against common pathogenic bacteria and the effects on the haematology parameters and histopathology in African catfish Clarias gariepinus juveniles. Aquaculture Research, 42, 196–209.
- Alegre, I., Abadias, M., Anguera, M., Oliveira, M., & Vinas, I. (2010). Factors affecting growth of foodborne pathogens on minimally processed apples. Food Microbiology, 27, 70–76.
- Alegre, I., Vinas, I., Usall, J., Anguera, M., & Abadias, M. (2011). Microbiological and physicochemical quality of fresh-cut apple enriched with the probiotic strain Lactobacillus rhamnosus GG. Food Microbiology, 28, 59–66.
- Alvarez-Olmos, M. I., & Oberhelman, R. A. (2001). Probiotic agents and infectious dis- eases: A modern perspective on a traditional therapy. Clinical Infectious Diseases, 32, 1567–1576.
- Aly, S. M., Ahmed, Y. A. G., Ghareeb, A. A. A., & Mohamed, M. F. (2008). Studies on Bacillus subtilis, and Lactobacillus acidophilus, as potential probiotics, on the immune response and resistance of Tilapia nilotica (Oreochromis niloticus) to challenge infections. Fish and Shellfish Immunology, 25, 128–136.
- Amara, A. A., & Shibl, A. (2015). Role of probiotics in health improvement, infection control and disease treatment and management. Saudi Pharmaceutical Journal, 23, 107–114.
- Amezquita, A., & Brashears, M. M. (2002). Competitive inhibition of Listeria mono- cytogenes in ready-to-eat meat products by lactic acid bacteria. Journal of Food Protection, 316–325.
- Apas, A. L., Dupraz, J., Ross, R., Gonzalez, S. N., & Arena, M. E. (2010). Probiotic administration effect on fecal mutagenicity and microflora in the goat's gut. Journal of Bioscience and Bioengineering, 110, 537–540.
- Arsi, K., Donoghue, A. M., Woo-Ming, A., Blore, P. J., & Donoghue, D. J. (2015a). Intracloacal inoculation, an effective screening method for determining the efficacy of probiotic bacterial isolates against Campylobacter colonization in broiler chickens. Journal of Food Protection, 78, 209–213.
- Arsi, K., Donoghue, A. M., Woo-Ming, A., Blore, P. J., & Donoghue, D. J. (2015b). The efficacy of selected probiotic and prebiotic combinations in reducing Campylobacter colonization in broiler chickens. Journal of Applied Poultry Research, 24, 327–334.
- Askarian, F., Zhou, Z., Olsen, R. E., Sperstad, S., & Ringø, E. (2012). Culturable autochthonous gut bacteria in Atlantic salmon (Salmo salar L.) fed diets with or without chitin. Characterization by 16S rRNA gene sequencing, ability to produce enzymes and in vitro growth inhibition of four fish pathogens. Aquaculture, 326–329, 1–8.
- Balcazar, J. L., de Blas, I., Ruiz-Zarzuela, I., Vendrell, D., & Muzquiz, J. L. (2004). Probiotics: A tool for the future of fish and shellfish health management. Journal of Aquaculture in the Tropics, 19, 239–242.
- Balcazar, J. L., Rojas-Luna, T., & Cunningham, D. P. (2007). Effect of the addition of four potential probiotic strains on the survival of pacific white shrimp (Litopenaeus vannamei) following immersion challenge with Vibrio parahaemolyticus. Journal of Invertebrate Pathology, 96, 147–150.
- Balcazar, J. L., de Blas, I., Ruiz-Zarzuela, I., Vendrell, D., Girones, O., & Muzquiz, J. L. (2007). Enhancement of the immune response and protection induced by probiotic lactic acid bacteria against furunculosis in rainbow trout (Oncorhynchus mykiss). FEMS Immunology & Medical Microbiology, 51, 185–193.
- Bratz, K., Gölz, G., Janczyk, P., Nöckler, K., & Alter, T. (2015). Analysis of in vitro and in vivo effects of probiotics against Campylobacter spp. Berliner und Münchener Tierärztliche Wochenschrif, 128, 155–162.
- Brunt, J., & Austin, B. (2005). Use of a probiotic to control lactococcosis and strepto- coccosis in rainbow trout, Oncorhynchus mykiss (Walbaum). Journal of Fish Diseases, 28, 693–701.
- Brunt, J., Newaj-Fyzul, A., & Austin, B. (2007). The development of probiotics for the control of multiple bacteria diseases of rainbow trout, Oncorhynchus mykiss (Walbaum). Journal of Fish Diseases, 30, 573–579.
- Caggia, C., De Angelis, M., Pitino, I., Pino, A., & Randazzo, C. L. (2015). Probiotic features of Lactobacillus strains isolated from ragusano and pecorino siciliano cheeses. Food Microbiology, 50, 109–117.
- Cao, G. T., Zeng, X. F., Chen, A. G., Zhou, L., Zhang, L., Xiao, Y. P., & Yang, C. M. (2013). Effects of a probiotic, Enterococcus faecium, on growth performance, intestinal mor- phology, immune response, and cecal microflora in broiler chickens challenged with Escherichia coli K88. Poultry Science, 92, 2949–2955.
- Cao, H., He, S., Wei, R., Diong, M., & Lu, L. (2011). Bacillus amyloliquefaciens G1: A potential antagonistic bacterium against eel-pathogenic Aeromonas hydrophila. Evidence-based Complementary and Alternative Medicine, 2011, 7.
- Carpentier, B., & Cerf, O. (2011). Review - persistence of Listeria monocytogenes in food industry equipment and premises. International Journal of Food Microbiology, 145, 1–8.
- Castellano, P., Gonzalez, C., Carduza, F., & Vignolo, G. (2010). Protective action of Lactobacillus curvatus CRL705 on vacuum-packaged raw beef. Effect on sensory and structural characteristics. Meat Science, 85, 394–401.
- CDC (Centers for Disease Control and Prevention) (2007). Outbreak Surveillance Data.
- Cean, A., Stef, L., Simiz, E., Julean, C., Dumitrescu, G., Vasile, A., ... Corcionivoschi, N. (2015). Effect of human isolated probiotic bacteria on preventing Campylobacter je- juni colonization of poultry. Foodborne Pathogens and Disease, 12, 122–130.
- Chang, C. I., & Liu, W. Y. (2002). An evaluation of two probiotic bacterial strains, Enterococcus faecium SF68 and Bacillus toyoi, for reducing edwardsiellosis in cultured European eel, Anguilla anguilla L. Journal of Fish Diseases, 25, 311–315.
- Chaucheyras-Durand, F., Walker, N. D., & Bach, A. (2008). Effects of active dry yeasts on the rumen microbial ecosystem: Past, present and future. Animal Feed Science and Technology, 145, 5–26.
- Chaveerach, P., Lipman, L. J., & Van Knapen, F. (2004). Antagonistic activities of several bacteria on in vitro growth of 10 strains of Campylobacter jejuni/coli. International Journal of Food Microbiology, 90, 43–50.
- Cutting, S. M. (2011). Bacillus probiotics. Food Microbiology, 28, 214–220.
- Das, A., Nakhro, K., Chowdhury, S., & Kamilya, D. (2013). Effects of potential probiotic Bacillus amyloliquefaciens FPTB16 on systemic and cutaneous mucosal immune responses and disease resistance of catla (Catla catla). Fish & Shellfish Immunology, 35, 1547–1553.
- Del'Duca, A., Cesar, D. E., Diniz, C. G., & Abreu, P. C. (2013). Evaluation of the presence and efficiency of potential probiotic bacteria in the gut of tilapia (Oreochromis niloticus) using the fluorescent in situ hybridization technique. Aquaculture, 388–391, 115–121.
- Dhanasiri, A. K. S., Brunvold, L., Brinchmann, M. F., Korsnes, K., Bergh, Ø., & Kiron, V. (2011). Changes in the intestinal microbiota of wild Atlantic cod Gadus morhua L. upon captive rearing. Microbial Ecology, 61, 20–30.
- Díaz-Rosales, P., Arijo, S., Chabrillón, M., Alarcón, F. J., Tapia-Paniagua, S. T., Martínez- Manzanares, E., ... Morinigo, M. A. (2009). Effects of two closely related probiotics on respiratory burst activity of Senegalese sole (Solea senegalensis, Kaup) phagocytes, and protection against Photobacterium damselae subsp. Piscicida. Aquaculture, 293, 16–21.
- EFSA (2015). EU summary report on trends and sources of zoonoses, zoonotic agents and food-borne out breaks in 2013. EFSA Journal, 13, 3991.
- EFSA (European Food Safety Authority) (2004). Opinion of the scientific panel on biological hazards on a request from the commission related to the use of vaccines for the control of Salmonella in poultry. EFSA Journal, 114, 1–74.
- El-Kholy, A. M., El-Shinawy, S. H., Meshrefl, A. M. S., & Korany, A. M. (2014). Microbiological quality of domiati cheese and the influence of probiotics on the be- havior of Staphylococcus aureus and Escherichia coli O157:H7 in domiati cheese. Journal of Food Safety, 34, 396–406.
- Erkkilä, S., Venäläinen, M., Hielm, S., Petäjä, E., Puolanne, E., & Mattila-Sandholm, T. (2000). Survival of Escherichia coli O157:H7 in dry sausage fermented by probiotic lactic acid bacteria. Journal of the Science of Food Agriculture, 80, 2101–2104.
- FAO/WHO (Food and Agriculture Organization of the United Nations, World Health Organization) (2002). Probiotics in food. Health and nutritional properties and guidelines for evaluation. Food and agriculture organization of the United Nations and World Health Organization, Rome. FAO food and nutrition paper no. 85.
- Fuller, R. (1989). Probiotics in man and animals. Journal of Applied Bacteriology, 66, 365–378.
- Galvez, A., Abriouel, H., Benomar, N., & Lucas, R. (2010). Microbial antagonists to foodborne pathogens and biocontrol. Current Opinion in Biotechnology, 21, 142–148.
- Gandhi, M., & Chikindas, M. L. (2007). Listeria: A foodborne pathogen that knows how to survive. International Journal of Food Microbiology, 113, 1–15.
- García-Almendárez, B. E., Cann, I. K. O., Martin, S. E., Guerrero-Legarreta, I., & Regalado, C. (2008). Effect of Lactococcus lactis UQ2 and its bacteriocin on Listeria monocytogenes biofilms. Food Control, 19, 670–680.
- Giri, S. S., Sen, S. S., & Sukumaran, V. (2012). Effects of dietary supplementation of potential probiotic Pseudomonas aeruginosa VSG-2 on the innate immunity and disease resistance of tropical freshwater fish, Labeo rohita. Fish & Shellfish Immunology, 32, 1135–1140.
- Giri, S. S., Sukumaran, V., & Oviya, M. (2013). Potential probiotic Lactobacillus plantarum VSG3 improves the growth, immunity, and disease resistance of tropical freshwater fish, Labeo rohita. Fish & Shellfish Immunology, 34, 660–666.
- Gomez, N. C., Ramiro, J. M. P., Quecan, B. X. V., & de Melo Franco, B. D. G. (2016). Use of potential probiotic lactic acid bacteria (LAB) biofilms for the control of Listeria monocytogenes, Salmonella typhimurium, and Escherichia coli O157:H7 biofilms formation. Frontiers in Microbiology, 7, 863.
- Gopalakannan, A., & Arul, V. (2011). Inhibitory activity of probiotic Enterococcus faecium MC13 against Aeromonas hydrophila confers protection against hemorrhagic septicemia in common carp Cyprinus carpio. Aquaculture International, 19, 973–985.
- Guerra, N. P., Bernardez, P. F., Mendez, J., Cachaldora, P., & Castro, L. P. (2007). Production of four potentially probiotic lactic acid bacteria and their evaluation as feed additives for weaned piglets. Animal Feed Science and Technology, 134, 89–107.
- Guerrieri, E., de Niederhausern, S., Messi, P., Sabia, C., Iseppi, R., Anacarso, I., & Bondi, M. (2009). Use of lactic acid bacteria (LAB) biofilms for the control of Listeria monocytogenes in a small-scale model. Food Control, 20, 861–865.
- Guyard-Nicodème, M., Rivoal, K., Houard, E., Rose, V., Quesne, S., Mourand, G., ... Chemaly, M. (2015). Prevalence and characterization of Campylobacter jejuni from chicken meat sold in French retail outlets. International Journal of Food Microbiology, 203, 8–14.
- Hanczakowska, E., Świątkiewicz, M., Natonek-Wiśniewska, M., & Okoń, K. (2016). Medium chain fatty acids (MCFA) and/or probiotic Enterococcus faecium as a feed supplement for piglets. Livestock Science, 192, 1–7.
- Higgins, S. E., Higgins, J. P., Wolfenden, A. D., Henderson, S. N., Torres-Rodriguez, A., Tellez, G., & Hargis, B. (2008). Evaluation of a Lactobacillus-based probiotic culture for the reduction of Salmonella Enteritidis in neonatal broiler chicks. Poultry Science, 87, 27–31.
- Hugas, M., Tsigarida, E., Robinson, T., & Calistri, P. (2009). The EFSA scientific panel on biological hazards first mandate: May 2003–May 2006. Insight into foodborne zoo- noses. Trends in Food Science & Technology, 20, 188–193.
- Humphrey, T. (2006). Are happy chickens safer chickens? Poultry welfare and disease susceptibility. British Poultry Science, 47, 379–391.
- Humphrey, T., O'Brien, S., & Madsen, M. (2007). Campylobacters as zoonotic pathogens: A food production perspective. International Journal of Food Microbiology, 117, 237–257.
- Hung, A. T., Lin, S. Y., Yang, T. Y., Chou, C. K., Liu, H. C., Lu, J. J., ... Lien, T. F. (2012). Effects of Bacillus coagulans ATCC 7050 on growth performance, intestinal morphology, and microflora composition in broiler chickens. Animal Production Science, 52, 874–879.
- Ibarreche, P. M., Castellano, P., & Vignolo, G. (2014). Evaluation of anti-Listeria meat borne Lactobacillus for biofilm formation on selected abiotic surfaces. Meat Science, 96, 295–303.
- Johnson-Henry, K. C., Hagen, K. E., Gordonpour, M., Tompkins, T. A., & Sherman, P. M. (2007). Surface-layer protein extracts from Lactobacillus helveticus inhibit enterohaemorrhagic Escherichia coli O157:H7 adhesion to epithelial cells. Cellular Microbiology, 9, 356–367.
- Jonkers, D. M. A. E. (2016). Microbial perturbations and modulation in conditions associated with malnutrition and malabsorption. Best Practice & Research Clinical Gastroenterology, 30, 161–172.
- Kanmani, P., Kumar, S. R., Yuvaraj, N., Paari, A. K., Pattukumar, V., & Arul, V. (2013). Probiotics and its functionally valuable products—A review. Critical Reviews in Food Science and Nutrition, 53, 641–658.
- Katikou, P., Ambrosiadis, I., Georgantelis, D., Koidis, P., & Georgakis, S. A. (2005). Effect of Lactobacillus-protective cultures with bacteriocin-like inhibitory substances-pro- ducing ability on microbiological, chemical, and sensory changes during storage of refrigerated vacuum-packaged sliced beef. Journal of Applied Microbiology, 99, 1303–1313.
- Kaur, S., Amrita, Kaur, P., & Nagpal, R. (2015). In vitro biosurfactant production and biofilm inhibition by lactic acid bacteria isolated from fermented food. International Journal of Probiotics & Prebiotics, 10, 17–22.
- Kesarcodi-Watson, A., Miner, P., Nicolas, J. L., & Robert, R. (2012). Protective effect of four potential probiotics against pathogen-challenge of the larvae of three bivalves: Pacific oyster (Crassostrea gigas), flat oyster (Ostrea edulis) and scallop (Pecten maximus). Aquaculture, 344–349, 29–34.
- Khan, I., & Kang, S. C. (2016). Probiotic potential of nutritionally improved Lactobacillus plantarum DGK-17 isolated from Kimchi - a traditional Korean fermented food. Food Control, 60, 88–94.
- Kim, Y., Oh, S., & Kim, S. H. (2009). Released exopolysaccharide (r-EPS) produced from probiotic bacteria reduce biofilm formation of enterohemorrhagic Escherichia coli O157:H7. Biochemical and Biophysical Research Communications, 379, 324–329.
- Kizerwetter-Świda, M., & Binek, M. (2009). Protective effect of potentially probiotic Lactobacillus strain on infection with pathogenic bacteria in chickens. Polish Journal of Veterinary Sciences, 12, 15–20.
- Kollath, W. (1953). Nutrition and the tooth system; general review with special reference to vitamins. Deutsche zahnarztliche Zeitschrift, 8, 7–16.
- Korkea-aho, T. L., Heikkinen, J., Thompson, K. D., von Wright, A., & Austin, B. (2011). Pseudomonas sp. M174 inhibits the fish pathogen Flavobacterium psychrophilum. Journal of Applied Microbiology, 111, 266–277.
- La Ragione, R. M., Narbad, A., Gasson, M. J., & Woodward, M. J. (2004). In vivo char- acterization of Lactobacillus johnsonii FI9785 for use as a defined competitive exclusion agent against bacterial pathogens in poultry. Letters in Applied Microbiology, 38, 197–205.
- Lilly, D. M., & Stillwell, R. H. (1965). Probiotic: Growth–promoting factors produced by microorganism. Science, 147, 747–748.
- Liu, H., Zhang, J., Zhang, S., Yang, F., Thacker, P. A., Zhang, G., ... Ma, X. (2014). Oral administration of Lactobacillus fermentum I5007 favors intestinal development and alters the intestinal microbiota in formula-fed piglets. Journal of Agricultural and Food Chemistry, 62, 860–866.
- Mahdhi, A., Kamoun, F., Messina, C., Santulli, A., & Bakhrouf, A. (2012). Probiotic properties of Brevibacillus brevis and its influence on sea bass (Dicentrarchus labrax) larval rearing. African Journal of Microbiology Research, 6, 6487–6495.
- Maragkoudakis, P. A., Mountzouris, K. C., Psyrras, D., Cremonese, S., Fischer, J., Cantor,
- M. D., & Tsakalidou, E. (2009). Functional properties of novel protective lactic acid bacteria and application in raw chicken meat against Listeria monocytogenes and Salmonella enteritidis. International Journal of Food Microbiology, 130, 219–226.
- Maragkoudakis, P. A., Mountzouris, K. C., Rosu, C., Zoumpopoulou, G., Papadimitriou, K., Dalaka, E., ... Tsakalidou, E. (2010). Feed supplementation of Lactobacillus plantarum PCA 236 modulates gut microbiota and milk fatty acid composition in dairy goats - a preliminary study. International Journal of Food Microbiology, 141, 109–116.
- Menconi, A., Kallapura, G., Latorre, J. D., Morgan, M. J., Pumford, N. R., Hargis, B. M., & Tellez, G. (2014). Identification and characterization of lactic acid bacteria in a commercial probiotic culture. Bioscience of Microbiota, Food, and Health, 33, 25–30.
- Messaoudi, S., Kergourlay, G., Rossero, A., Ferchichi, M., Prévost, H., Drider, D., ... Dousset, X. (2011). Identification of lactobacilli residing in chicken ceca with antagonism against Campylobacter. International Microbiology, 14, 103–110.
- Minelli, E. B., & Benini, A. (2008). Relationship between number of bacteria and their probiotic effects. Microbial Ecology in Health and Disease, 20, 180–183.
- Mor-Mur, M., & Yuste, J. (2010). Emerging bacterial pathogens in meat and poultry: An overview. Food and Bioprocess Technology, 3, 24.
- Mountzouris, K. C., Balaskas, C., Xanthakos, I., Tzivinikou, A., & Fegeros, K. (2009). Effects of a multi-species probiotic on biomarkers of competitive exclusion efficacy in broilers challenged with Salmonella enteritidis. British Poultry Science, 50, 467–478.
- Mpofu, A., Linnemann, A. R., Nout, M. J. R., Zwietering, M. H., Smid, E. J., & den Besten, H. M. W. (2016). Inactivation of bacterial pathogens in yoba mutandabota, a dairy product fermented with the probiotic Lactobacillus rhamnosus yoba. International Journal of Food Microbiology, 217, 42–48.
- Muthukumarasamy, P., & Holley, R. A. (2007). Survival of Escherichia coli O157:H7 in dry fermented sausages containing micro-encapsulated probiotic lactic acid bacteria. Food Microbiology, 24, 82–88.
- Nayak, S. K. (2010). Probiotics and immunity: A fish perspective. Fish & Shellfish Immunology, 29, 2–14.
- Neal-McKinney, J. M., Lu, X., Duong, T., Larson, C. L., Call, D. R., & Shah, D. H. (2012). Production of organic acids by probiotic lactobacilli can be used to reduce pathogen load in poultry. PloS One, 7, e43928.
- Newaj-Fyzul, A., Adesiyun, A. A., Mutani, A., Ramsubhag, A., Brunt, J., & Austin, B. (2007). Bacillus subtilis AB1 controls Aeromonas infection in rainbow trout (Oncorhynchus mykiss, Walbaum). Journal of Applied Microbiology, 103, 1699–1706.
- Ngamkala, S., Futami, K., Endo, M., Maita, M., & Katagiri, T. (2010). Immunological effects of glucan and Lactobacillus rhamnosus GG, a probiotic bacterium, on Nile tilapia Oreochromis niloticus intestine with oral Aeromonas challenges. Fisheries Science, 76, 833–840.
- Nishiyama, K., Seto, Y., Yoshioka, K., Kakuda, T., Takai, S., Yamamoto, Y., & Mukai, T. (2014). Lactobacillus gasseri SBT2055 reduces infection by and colonization of Campylobacter jejuni. PloS One, 9, e108827.
- Oyetayo, V. O., & Oyetayo, F. L. (2005). Potential of probiotics as biotherapeutic agents targeting the innate immune system. African Journal of Biotechnology, 4, 123–127.
- Pajarillo, E. A. B., Chae, J. P., Balolong, M. P., Kim, H. B., Park, C. S., & Kang, D. K. (2015). Effects of probiotic Enterococcus faecium NCIMB 11181 administration on swine fecal microbiota diversity and composition using barcoded pyrosequencing. Animal Feed Science and Technology, 201, 80–88.
- Park, J. H., & Kim, I. H. (2014). Supplemental effect of probiotic Bacillus subtilis B2A on productivity, organ weight, intestinal Salmonella microflora, and breast meat quality of growing broiler chicks. Poultry Science, 93, 2054–2059.
- Peterson, R. E., Klopfenstein, T. J., Erickson, G. E., Folmer, J., Hinkley, S., Moxley, R. A., & Smith, D. R. (2007). Effect of Lactobacillus acidophilus strain NP51 on Escherichia coli O157:H7 fecal shedding and finishing performance in beef feedlot cattle. Journal of Food Protection, 70, 287–291.
- Pieniz, S., Andreazza, R., Anghinoni, T., Camargo, F., & Brandelli, A. (2014). Probiotic potential, antimicrobial and antioxidant activities of Enterococcus durans strain LAB18s. Food Control, 37, 251–256.
- Pirarat, N., Kobayashi, T., Katagiri, T., Maita, M., & Endo, M. (2006). Protective effects and mechanisms of a probiotic bacterium Lactobacillus rhamnosus against experimental Edwardsiella tarda infection in tilapia (Oreochromis niloticus). Veterinary Immunology and Immunopathology, 113, 339–347.
- Pollmann, M., Nordhoff, M., Pospischil, A., Tedin, K., & Wieler, L. H. (2005). Effects of a probiotic strain of Enterococcus faecium on the rate of natural chlamydia infection in swine. Infection and Immunity, 73, 4346–4353.
- Robyn, J., Rasschaert, G., Messens, W., Pasmans, F., & Heyndrickx, M. (2012). Screening for lactic acid bacteria capable of inhibiting Campylobacter jejuni in in vitro simulations of the broiler chicken caecal environment. Beneficial Microbes, 3, 299–308.
- Rubio, R., Aymerich, T., Bover-Cid, S., Guàrdia, M. D., Arnau, J., & Garriga, M. (2013). Probiotic strains Lactobacillus plantarum 299V and Lactobacillus rhamnosus GG as starter cultures for fermented sausages. LWT-Food Science and Technology, 54, 51–56.
- Ruiz-Moyano, S., Martin, A., Benito, M. J., Casquete, R., Serradilla, M. J., & de Guia Cordoba, M. (2009). Safety and functional aspects of pre-selected lactobacilli for probiotic use in Iberian dry-fermented sausages. Meat Science, 83, 460–467.
- Rydlo, T., Miltz, J., & Mor, A. (2006). Eukaryotic antimicrobial peptides: Promises and premises in food safety. Journal of Food Science, 71, 125–135.
- Salinas, I., Diaz-Rosales, P., Cuesta, A., Meseguer, J., Chabrillon, M., Morinigo, M. A., & Esteban, M.Á. (2006). Effect of heat-inactivated fish and non-fish derived probiotics on the innate immune parameters of ateleost fish (Sparus aurata L.). Veterinary Immunology and Immunopathology, 111, 279–286.
- Santini, C., Baffoni, L., Gaggìa, F., Granata, M., Gasbarri, R., Di Gioia, D., & Biavati, B. (2010). Characterization of probiotic strains: An application as feed additives in poultry against Campylobacter jejuni. International Journal of Food Microbiology, 14, 98–108.
- Sargeant, J. M., Amezcua, M. R., Rajic, A., & Waddell, L. (2007). Pre-harvest interventions to reduce the shedding of E. coli O157 in the faeces of weaned domestic ruminants: A systematic review. Zoonoses and Public Health, 54, 260–277.
- Scallan, E., Hoekstra, R. M., Angulo, F. J., Tauxe, R. V., Widdowson, M. A., Roy, S. L., ... Griffin, P. M. (2011). Foodborne illness acquired in the United States—Major pathogens. Emerging Infectious Diseases, 17, 7–15.
- Schuenzel, K. M., & Harrison, M. A. (2002). Microbial antagonists of foodborne pathogens on fresh, minimally processed vegetables. Journal of Food Protection, 65, 1909–1915.
- Servin, A. L. (2004). Antagonistic activities of lactobacilli and bifidobacteria against microbial pathogens. FEMS Microbiology Reviews, 28, 405–440.
- Shim, Y., Ingale, S., Kim, J., Kim, K., Seo, D., Lee, S., ... Kwon, I. (2012). A multi-microbe probiotic formulation processed at low and high drying temperatures: Effects on growth performance, nutrient retention and caecal microbiology of broilers. British Poultry Science, 53, 482–490.
- Sorroza, L., Padilla, D., Acosta, F., Román, L., Grasso, V., Vega, J., & Real, F. (2012). Characterization of the probiotic strain Vagococcus fluvialis in the protection of European sea bass (Dicentrarchus labrax) against vibriosis by Vibrio anguillarum. Veterinary Microbiology, 155, 369–373.
- Spinler, J. K., Taweechotipatr, M., Rognerud, C. L., Ou, C. N., Tumwasorn, S., & Versalovic, J. (2008). Human-derived probiotic Lactobacillus reuteri demonstrate antimicrobial activities targeting diverse enteric bacterial pathogens. Anaerobe, 14, 166–171.
- Stella, A. V., Paratte, R., Valnegri, L., Cigalino, G., Soncini, G., Chevaux, E., ... Savoini, G. (2007). Effect of administration of live Saccharomyces cerevisiae on milk production, milk composition, blood metabolites, and fecal flora in early lactating dairy goats. Small Ruminant Research, 67, 7–13.
- Strom-Bestor, M., & Wiklund, T. (2011). Inhibitory activity of Pseudomonas sp. on Flavobacterium psychrophilum, in vitro. Journal of Fish Diseases, 34, 255–264.
- Sun, Y. Z., Yang, H. L., Ma, R. L., & Lin, W. Y. (2010). Probiotic applications of two dominant gut Bacillus strains with antagonistic activity improved the growth performance and immune responses of grouper Epinephelus coioides. Fish & Shellfish Immunology, 29, 803–809.
- Swain, S. M., Singh, C., & Arul, V. (2009). Inhibitory activity of probiotics Streptococcus phocae PI8o and Enterococcus faecium MC13 against vibriosis in shrimp Penaeus monodon. World Journal of Microbiology and Biotechnology, 25, 697–703.
- Szabo, I., Wieler, L. H., Tedin, K., Scharek-Tedin, L., Taras, D., Hensel, A., ... Nöckler, K. (2009). Influence of a probiotic strain of Enterococcus faecium on Salmonella enterica serovar Typhimurium DT104 infection in a porcine animal infection model. Applied and Environmental Microbiology, 75, 2621–2628.
- Tabe, E. S., Oloya, J., Doetkott, D. K., Bauer, M. L., Gibbs, P. S., & Khaitsa, M. L. (2008). Comparative effect of direct-fed microbials on fecal shedding of Escherichia coli O157:H7 and Salmonella in naturally infected feedlot cattle. Journal of Food Protection, 71, 539–544.
- Taoka, Y., Maeda, H., Jo, J. Y., Kim, S. M., Park, S., Yoshikawa, T., & Sakata, T. (2006). Use of live and dead probiotic cells in tilapia Oreochromis niloticus. Fisheries Science, 72, 755–766.
- Trząskowska, M., Kołożyn-Krajewska, D., Wójciak, K., & Dolatowski, Z. (2014). Microbiological quality of raw-fermented sausages with Lactobacillus casei LOCK 0900 probiotic strain. Food Control, 35, 84–91.
- Upadhaya, S. D., Hossiendoust, A., & Kim, I. H. (2016). Probiotics in Salmonella-challenged Hy-Line brown layers. Poultry Science, 95, 1894–1897.
- Vila, B., Fontgibell, A., Badiola, I., Esteve-Garcia, E., Jiménez, G., Castillo, M., & Brufau, J. (2009). Reduction of Salmonella enterica var. Enteritidis colonization and invasion by Bacillus cereus var. toyoi inclusion in poultry feeds. Poultry Science, 88, 975–979.
- Wan, L. Y. M., Chen, Z. J., Shah, N. P., & El-Nezami, H. (2016). Modulation of intestinal epithelial defense responses by probiotic bacteria. Critical Reviews in Food Science and Nutrition, 56, 2628–2641.
- Willis, W. L., & Reid, L. (2008). Investigating the effects of dietary probiotic feeding regimens on broiler chicken production and Campylobacter jejuni presence. Poultry Science, 87, 606–611.
- Winkelströter, L. K., Gomes, B. C., Thomaz, M. R. S., Souza, V. M., & De Martinis, E. C. P. (2011). Lactobacillus sakei 1 and its bacteriocin influence adhesion of Listeria monocytogenes on stainless steel surface. Food Control, 22, 1404–1407.
- Wisener, L. V., Sargeant, J. M., O'Connor, A. M., Faires, M. C., & Glass-Kaastra, S. K. (2015). The use of direct-fed microbials to reduce shedding of Escherichia coli O157 in beef cattle: A systematic review and meta-analysis. Zoonoses and Public Health, 62, 75–89.
- Woo, J., & Ahn, J. (2013). Probiotic-mediated competition, exclusion, and displacement in biofilm formation by food-borne pathogens. Letters in Applied Microbiology, 4, 307–313.
- Wu, S., Wang, G., Angert, E. R., Wang, W., Li, W., & Zou, H. (2012). Composition, diversity, and origin of the bacterial community in grass carp intestine. PloS One, 7, e30440.
- Zhao, T., Podtburg, T. C., Zhao, P., Chen, D., Baker, D. A., & Cords, B. (2013). Reduction by competitive bacteria of Listeria monocytogenes in biofilms and Listeria in floor drains in a ready-to-eat poultry processing plant. Journal of Food Protection, 74, 601–607.