ООО "ПРОПИОНИКС"
| пн-пт с 09:00 до 18:00 | |
Propionibacterium и рубцовое пищеварение
МОЛОЧНЫЕ ПРОПИОНИБАКТЕРИИ И РУБЦОВОЕ ПИЩЕВАРЕНИЕ
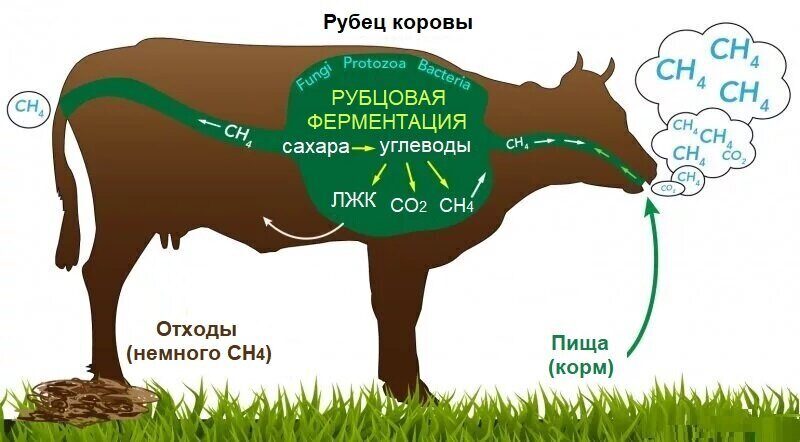
Пропионовокислые бактерии усиливают деградацию корма в рубце и снижают выработку метана in vitro
Введение
Микробиом рубца, который ферментирует корм и тем самым обеспечивает конечные продукты ферментации, которые могут быть использованы животным-хозяином, имеет решающее значение для пищеварения жвачных животных. Соответственно, меры, направленные на улучшение использования кормов и продуктивности животных путем скармливания жвачным животным живых микробов, имеют давнюю традицию (Nocek & Kautz, 2006; McAllister et al., 2011). Основная цель — снизить образование кишечного метана во время рубцовой ферментации. Производство метана представляет собой потерю энергии для жвачных животных, составляющую от 3 до 10% от общего потребления энергии (Niu et al., 2018). Более того, метан является важным парниковым газом, и около 17% всего антропогенного метана, выбрасываемого в атмосферу, приходится на домашних жвачных животных (Knapp et al. 2014). Метан вырабатывается метаногенами из CO2 и водорода, образующихся в ходе микробной ферментации корма в летучие жирные кислоты (ЛЖК) (Boadi et al., 2004). Ацетат, пропионат и бутират являются основными ЛЖК, которые поступают в кровоток и служат источником энергии и субстратом для анаболических функций у жвачных животных. Путь пропионатной ферментации отличается от путей, ведущих к ацетату и бутирату, тем, что не выделяет водород (Boadi et al., 2004). Таким образом, была установлена положительная корреляция между выработкой кишечного метана и соотношением ацетата и пропионата в рубце (Russell, 1998). Следовательно, стимулирование пропионатной ферментации у жвачных животных может снизить выбросы метана. Более того, в отличие от ацетата и бутирата, пропионат является глюконеогенным ЛЖК и, таким образом, может увеличивать поступление энергии в молочную железу (Yost & Young, 1977; Zárate, 2012). Пропионат — конечный продукт ферментации различных видов бактерий, в том числе организмов семейства Propionibacteriaceae. Сообщалось, что при скармливании молочным коровам штаммы пропионово-кислых бактерий (PAB) оказывают положительное влияние на продуктивность, включая повышение уровня пропионата в рубце и улучшение надоев молока (Stein et al., 2006; Adams et al. 2008; de Ondarza & Seymour, 2008; Weiss et al., 2008). Vyas et al. (2014) и Jeyanathan et al. (2019) изучали влияние Propionibacterium на производство метана у жвачных животных. Было установлено, что ни один из протестированных штаммов не влияет на общее производство метана. Однако Vyas et al. (2014) отметили, что потребление корма было выше у мясных телок, которых кормили Propionibacterium, а соотношение между произведенным метаном и потребленным кормом было ниже на 8-13 %. Другие штаммы PAB были изучены в экспериментах in vitro на рубцовой жидкости канадского мясного скота (Alazzeh et al., 2013). Эта работа показала, что три штамма PAB могут снизить образование метана in vitro на 7-15 %, при этом уменьшается доля ацетата, и/или увеличивается доля пропионата, или не изменяется доля этих ЛЖК.
В этой работе, используя рубцовую жидкость норвежских красных молочных коров (порода Norwegian Red), мы изучили большое количество изолятов PAB на предмет их способности влиять на выработку метана и ЛЖК, а также на деградацию корма в рубце in vitro.
Материалы и методы
Бактериальные штаммы и условия роста
Для поиска штаммов, способных благоприятно изменить метаболизм рубца, мы первоначально проанализировали 149 штаммов PAB на предмет их влияния на производство метана и газа in vitro (данные не показаны). Большинство штаммов из первоначального отбора не оказывали никакого влияния на производство метана. Тридцать один из 149 штаммов PAB, отобранных для настоящего исследования (28 штаммов рода Propionibacterium, 2 штамма Tessaracoccus и 1 штамм Luteococcus, табл. 2 и 3), показали ингибирующее действие на выработку метана. Мы провели дополнительные эксперименты in vitro с 9 перспективными штаммами из 31, в которых деградация корма измерялась как разница в весе до и после инкубации в рубцовой жидкости. Штаммы PAB, использованные в данном исследовании, были выделены из сырого молока Norwegian Red. Было показано, что эти штаммы производят пропионовую кислоту из молочной кислоты в анаэробных условиях (Holo et al., 2002). Штаммы выращивали анаэробно при 37 °C в 10 мл стеклянных пробирках с винтовой крышкой, заполненных лактатным натриевым бульоном (SLB), содержащим 10 % триптона, 10 % дрожжевого экстракта, 1,2 % лактата натрия и 0,25 г K2HPO4 на литр (Malik et al., 1968). Культуры, используемые в экспериментах in vitro, инокулировали 100 мкл экспоненциально растущих клеток и инкубировали в течение двух дней перед использованием в экспериментах. Количество жизнеспособных PAB определяли после анаэробной инкубации при 37 °C на твердом SLB, содержащем 1,5% агара. Для определения жизнеспособного PAB в образцах, полученных в экспериментах in vitro, агаровые чашки были дополнены метронидазолом (4 мкг/мл) (Jan et al., 2002).
Корм и рубцовая жидкость
В качестве субстрата для инкубации in vitro использовали кормовую смесь, состав которой был сопоставим с составом корма для норвежских красных молочных коров в пик лактации (табл. 1). Сухое вещество корма (DM), использованное в экспериментах in vitro, содержало 60% травяного силоса и 40% концентрата, измельченного для прохождения через сита диаметром 4 мм и 1 мм соответственно. Концентрат DM содержал 40% ячменя, 40% пшеницы и 20% соевого шрота.
Таблица 1. Ингредиенты и химический состав субстрата (% сухого вещества, СВ), использованного в экспериментах in vitro с 1 по 6.
|
Элемент
|
% СВ
|
|
Ингредиенты
|
|
|
Травяной силос
|
60
|
|
Ячмень
|
16
|
|
Пшеница
|
16
|
|
Соевый шрот
|
8
|
|
Химический состав
|
|
|
Сырой протеин
|
16.5
|
|
Кислотно-детергентное волокно
|
27.1
|
|
Нейтрально-детергентное волокно
|
43.4
|
|
Неволокнистые углеводы
|
33.8
|
Рубцовую жидкость получали от двух нелактирующих коров норвежской красной породы, которым вводили постоянную руминальную канюлю. Коровы содержались в метаболическом отделении, разрешенном Норвежским управлением по исследованию животных, и получали стандартный рацион, состоящий из травы и концентратов, который соответствовал требованиям содержания. Смесь концентратов содержала около 180 г сырого протеина (CP)/кг СВ и 120 г нейтрально-детергентной клетчатки (NDF)/кг СВ. Рационы сена и концентратов выдавались равными порциями в 06.30 и 14.30 ч. Пробы рубцовой жидкости у двух коров были взяты через фистулы через два часа после утреннего кормления, профильтрованы через два слоя марли, смешаны в соотношении 1:1, промыты углекислым газом и затем, в течение 30 минут, смешаны с двумя частями буфера, приготовленного по Menke et al. (1979). Эту свежеприготовленную буферную жидкость рубца использовали для экспериментов in vitro.
Эксперименты in vitro и отбор проб
Во время первоначального скрининга и в последующих 1-м и 2-м экспериментах 10 мл забуференной рубцовой жидкости (Menke et al., 1979) смешивали со 100 мкл культуры PAB (от 2 × 108 до 4 × 108 КОЕ, в целом) и 50 мг корма во флаконах с сывороткой емкостью 25 мл под струей CO2. Флаконы закрывали резиновыми пробками для сыворотки и алюминиевыми обжимными крышками и инкубировали в течение 24 часов при 39°С. В контрольные образцы добавляли по 100 мкл стерильной SLB вместо культуры PAB. Эксперименты 3, 4, 5 и 6 проводились, как описано выше, за исключением того, что инкубации проводились в закупоренных флаконах с сывороткой емкостью 125 мл с использованием 450 мкл культуры PAB (или 450 мкл SLB), 45 мл забуференной рубцовой жидкости и 500 мг корма. Во время скрининга и в экспериментах с 3 по 6 все обработки и контроль проводились в трех повторностях. В экспериментах 1 и 2 обработки проводили в трех повторностях, а контрольные образцы воспроизводились 9 раз.
Давление во флаконах измеряли через 24 ч инкубации с помощью цифрового манометра DPG-200 (Dwyer Instruments, Inc., Michigan City, IN). Пробы газа отбирали из головного пространства флаконов с помощью газонепроницаемого шприца и измеряли концентрацию метана на газовом хроматографе (модель 7890A, Agilent, Санта-Клара, Калифорния, США) с 20-метровой колонкой Poraplot Q (0,53 мм) при 38°C с обратной продувкой и He в качестве газа-носителя. Производство метана (VCH4, мл) рассчитывалось как:
VCH4 = ppmCH4 × VHS × 10−6 × ΔP
где VHS — объем свободного пространства флакона (мл), а ΔP — давление во флаконе относительно стандартного давления (атм).
Жидкие пробы для анализа концентрации ЛЖК хранили при –20°С. Для определения разложения корма у 9 штаммов в экспериментах 3, 4, 5 и 6 содержимое промытых бутылей центрифугировали при 7000×g в течение 10 мин в 50 мл предварительно взвешенных полипропиленовых центрифужных пробирках. Супернатанты отбрасывали, осадки дважды промывали дистиллированной водой, сушили в печи при 65°C в течение 7 дней и взвешивали. Количество переваренного сухого вещества корма рассчитывали как разницу в весе гранул из проб, взятых в начале и в конце инкубации.
Химический анализ
Содержание CP, кислотно-детергентной клетчатки (ADF), NDF и неволокнистых углеводов (NFC) в сухом комбикорме определялось лабораторией Dairy One Forage Laboratory (Итака, Нью-Йорк) с использованием спектроскопии отражения в ближнем инфракрасном диапазоне (таблица 1).
Концентрацию метана в пробах газа определяли с помощью пламенно-ионизационного детектора, откалиброванного по сертифицированным стандартам 2, 100 и 10 000 ppmv (Yara, Норвегия).
Для анализа ЛЖК жидкие образцы размораживали и аликвоты по 5 мл смешивали с 0,3 мл 50%-ной H2SO4 и 15 г сульфата натрия и экстрагировали 25 мл диэтилового эфира. Образцы из эфирной фазы анализировали на ЛЖК методом газовой хроматографии с использованием автоматической системы Perkin Elmer GC, оснащенной пламенно-ионизационным детектором и стеклянной колонкой Supelco 2 м, 0,635 см OD и 2 мм ID, заполненной GP 10% SP 1000/1% H3PO4 на хромосорбенте WAW 100/120 (Kraggerud et al., 2014). Температура впрыска составляла 210°C, а газом-носителем был азот со скоростью 40 мл/мин. Была применена следующая температурная программа: 120°C в течение 1 минуты, а затем от 15°C/мин до 190°C в течение 5 минут.
Статистический анализ
Результаты были проанализированы с помощью одностороннего дисперсионного анализа (ANOVA), где штамм был постоянным фактором, а флакон - случайным. Затем апостериорный тест Фишера на наименьшую значимую разницу (LSD) был проведен с использованием 95% доверительного интервала (версия 19 Minitab от Minitab Inc., Пенсильвания, США).
Результаты и обсуждение
Влияние на выработку летучих жирных кислот и метана
Контрольные образцы в опытах 1 и 2 давали 48 мл и 51 мл метана на г сухого сырья соответственно (табл. 2 и 3). Большинство протестированных штаммов PAB не вызывали существенных изменений в продукции метана, которая колебалась от 42 до 54 мл/г сухого вещества корма. Однако инкубация с P. jensenii LMGT2826 и P. thoeni LMGT2827 или T159 привела к снижению (P<0,048) продукции метана на 18%, 8% и 20% соответственно по сравнению с контрольными образцами. В предыдущих отчетах эффекты Propionibacterium были обнаружены в экспериментах на молочном скоте, в частности с использованием штамма Propionibacterium acidipropionici P169, который может повысить эффективность производства молока (de Ondarza & Seymour, 2008; Weiss et al., 2008). но другие протестированные штаммы не показали такого эффекта (Seo et al., 2010). Используя рубцовую жидкость крупного рогатого скота, было показано, что несколько штаммов PAB могут снижать выработку метана в рубце in vitro (Alazzeh et al, 2013), но этот эффект не наблюдался у штамма P169 (Alazzeh et al., 2014). Этот вывод противоречит выводам Stein et al. (2006); они обнаружили, что штамм P169 вызывает более высокие уровни пропионата в рубце in vivo.
Таблица 2. Влияние штаммов пропионовокислых бактерий Propionibacterium (P.) и Tessaracoccus (T.) (все из семейства Propionibacteriaceae – ред.) на продукцию метана и летучих жирных кислот в эксперименте 1.
|
Добавленная бактерия
|
Штамм
|
Сумма ЛЖКa, мМ
|
Ацетат, мМ/ 100 мМ всего ЛЖК
|
Пропионат, мМ/100 мМ всего ЛЖК
|
Бутират, мМ/ 100 мМ всего ЛЖК
|
Ацетат: пропионат
|
Метан,
мл/г СВ
|
|
P. sp.
|
LMGT2789
|
77.0
|
68.9
|
16.8
|
14.2
|
4.09
|
48.1
|
|
P. acidipropionicii
|
LMGT2831
|
75.4
|
68.6
|
17.2
|
14.2
|
4.00
|
49.7
|
|
P. freudenreichii
|
LMGT2832
|
76.1
|
67.9
|
18.0*
|
14.1
|
3.78*
|
43.9
|
|
P. freudenreichii
|
LMGT2833
|
77.1
|
68.7
|
17.1
|
14.2
|
4.02
|
47.1
|
|
P. freudenreichii
|
LMGT2842
|
72.4
|
67.6*
|
17.6
|
14.7
|
3.84
|
55.0
|
|
P. jensenii
|
LMGT2864
|
71.7
|
67.6*
|
17.3
|
15.1*
|
3.90
|
47.3
|
|
P. sp.
|
T1
|
76.2
|
68.6
|
17.1
|
14.3
|
4.01
|
47.5
|
|
P. sp.
|
T25
|
78.7
|
69.3
|
17.1
|
13.7
|
4.06
|
49.0
|
|
P. freudenreichii
|
T28
|
80.4*
|
69.6
|
16.9
|
13.5
|
4.12
|
50.1
|
|
P. freudenreichii
|
T30
|
73.0
|
67.9
|
16.8
|
15.3*
|
4.05
|
47.1
|
|
P. freudenreichii
|
T62
|
79.6*
|
69.1
|
16.9
|
14.0
|
4.08
|
47.8
|
|
P. sp.
|
T88
|
81.2*
|
69.8*
|
17.0
|
13.2*
|
4.11
|
52.1
|
|
T. bendingoniensis
|
T93
|
71.9
|
67.5*
|
17.6
|
14.9
|
3.83
|
48.4
|
|
T. bendingoniensis
|
T104
|
77.2
|
69.3
|
17.0
|
13.7
|
4.09
|
48.6
|
|
P. freudenreichii
|
T114
|
82.0*
|
69.4
|
17.1
|
13.5
|
4.06
|
53.7
|
|
P. acidipropionicii
|
T122
|
77.2
|
69.2
|
17.3
|
13.5
|
4.00
|
45.2
|
|
None
|
Контроль
|
74.1
|
68.7
|
17.1
|
14.2
|
4.01
|
47.9
|
|
|
SEM
|
2.01
|
0.36
|
0.24
|
0.35
|
0.06
|
0.68
|
Общие концентрации ЛЖК (сумма концентраций ацетата, пропионата и бутирата) в контроле при 74 мМ были очень похожи в экспериментах 1 и 2 (таблицы 2 и 3). Ни один из штаммов PAB не вызывал значительного снижения общего производства ЛЖК, но семь штаммов имели стимулирующий эффект (P ≤ 0,046). Относительно контроля штамм Т159 показал наиболее сильную стимуляцию продукции ЛЖК, увеличив уровень на 21% (Р = 0,001), при этом доля пропионата была выше на 6%, но без изменения ацетата. Присутствие четырех (Т28, Т62, Т114 или Т24) из семи стимулирующих штаммов не меняло пропорции ацетата, пропионата и бутирата. При добавлении штамма Т83 доля ацетата немного увеличивалась по сравнению с контролем (P < 0,001), что приводило к более высокому соотношению ацетата к пропионату (P = 0,011). Штамм Т88 был протестирован в обоих экспериментах, и он увеличил (P ≤ 0,024) продукцию ЛЖК примерно на 10% и долю ацетата на 2% в эксперименте 1 (Таблица 2), но не сделал этого в эксперименте 2 (Таблица 3), относительно контроля. Большинство из 31 штамма не влияли на содержание бутирата; только Т88, Т83 и Т159 приводили к небольшому снижению доли бутирата по сравнению с контролем (P ≤ 0,038).
Таблица 3. Влияние штаммов пропионовокислых бактерий Propionibacterium (P.) и Luteococcus (L.) на производство метана и летучих жирных кислот в эксперименте 2.
|
Добавленная
бактерия
|
Штамм
|
Сумма ЛЖКa, мМ
|
Ацетат, мМ/ 100 мМ всего ЛЖК
|
Пропионат, мМ/100 мМ всего ЛЖК
|
Бутират, мМ/ 100 мМ всего ЛЖК
|
Ацетат: пропионат
|
Метан,
мл/г СВ
|
|
P. jensenii
|
LMGT2816
|
79.4
|
72.8
|
15.9
|
11.3*
|
4.57
|
46.6
|
|
P. jensenii
|
LMGT2822
|
73.6
|
72.5
|
16.0
|
11.5
|
4.52
|
44.6
|
|
P. jensenii
|
LMGT2823
|
73.4
|
71.8
|
16.2
|
12.1
|
4.44
|
46.8
|
|
P. jensenii
|
LMGT2824
|
73.8
|
71.6
|
16.2
|
12.2
|
4.41
|
49.7
|
|
P. jensenii
|
LMGT2825
|
71.3
|
71.2
|
16.4
|
12.4
|
4.35
|
47.9
|
|
P. jensenii
|
LMGT2826
|
75.5
|
72.4
|
16.3
|
11.4*
|
4.45
|
41.7*
|
|
P. thoenii
|
LMGT2827
|
74.1
|
71.5
|
16.2
|
12.2
|
4.41
|
47.0*
|
|
P. freudenreichii
|
LMGT2841
|
75.0
|
72.2
|
16.1
|
11.7
|
4.49
|
47.3
|
|
P. sp.
|
T22
|
71.4
|
71.1
|
16.4*
|
12.4
|
4.33*
|
47.4
|
|
P. sp.
|
T24
|
85.6*
|
71.9
|
16.1
|
12.0
|
4.51
|
43.3
|
|
P. freudenreichii
|
T27
|
73.1
|
72.2
|
16.0
|
11.9
|
4.52
|
45.3
|
|
P. freudenreichii
|
T31
|
81.4
|
72.9
|
15.9
|
11.2*
|
4.57
|
44.5
|
|
P. propinicus
|
T83
|
85.9*
|
74.1*
|
15.2
|
10.7*
|
4.88*
|
43.9
|
|
P. sp.
|
T88
|
80.3
|
72.4
|
15.8
|
11.8
|
4.58
|
41.7
|
|
L. japonicus
|
T145
|
75.8
|
72.4
|
15.9
|
11.7
|
4.54
|
47.8
|
|
P. thoenii
|
T159
|
89.6*
|
72.5
|
16.7*
|
10.8*
|
4.34
|
40.7*
|
|
None
|
Контроль
|
74.0
|
72.0
|
15.8
|
12.2
|
4.57
|
51.0
|
|
|
SEM
|
2.53
|
0.37
|
0.22
|
0.25
|
0.08
|
0.42
|
В то время как доминирующей ЛЖК в рубце является ацетат, конечными продуктами метаболизма PAB, которые растут на сахарах или лактате, являются пропионат и ацетат в соотношении 2:1 или выше. Предыдущие исследования показали, что штаммы PAB могут повышать уровни пропионата в рубце (в процентах от общего количества ЛЖК) и снижать уровни ацетата in vivo (Stein et al., 2006; Raeth-Knight et al., 2007; Weiss et al., 2008). ) и in vitro (Akay & Dado, 2001; Alazzeh et al., 2013), что позволяет предположить, что PAB может вносить значительный вклад в ферментацию рубца. Luo et al. (2017) показали, что PAB может расщеплять лактат в рубцовой жидкости in vitro. В экспериментах 1 и 2 мольные отношения ацетата к пропионату в контроле составляли 4,0 и 4,6 соответственно. Несколько пониженное чем в контроле соотношение ацетата к пропионату (P ≤ 0,048) наблюдалось при использовании штаммов P. freudenreichii LMGT2832 и P. sp. Т22.
Включение метронидазола в чашки с SLB-агаром (Jan et al., 2002) позволило нам изучить судьбу PAB после 24 ч инкубации. При отсутствии PAB в образце мы обнаружили на этой среде жизнеспособное количество 1 × 106 КОЕ на мл в очищенной рубцовой жидкости, и это количество увеличилось примерно в два раза за 24 ч в контрольных пробирках без PAB (данные не показаны). Ни один из штаммов PAB, добавленных во флаконы, не показал роста во флаконах во время инкубации, и их количество жизнеспособных особей снизилось от 17% (штамм LMGT2826) до 95% (штамм LMGT2827) (результаты не показаны). Хотя мы наблюдали уменьшение количества клеток PAB во время инкубации, мы не можем исключить первоначальный рост PAB, за которым последовала фаза гибели в течение 24 ч инкубации. Однако PAB растут медленно; используя опубликованные данные о максимальной специфической продукции пропионата и скорости роста (Lee et al., 1974), мы рассчитали, что средняя скорость синтеза пропионата в наших экспериментах будет ниже, чем наблюдаемая стимуляция, по сравнению с контролем.
Таким образом, большая часть пропионата в наших экспериментах должна была быть произведена другими организмами в образцах рубца. По этой же причине кажется маловероятным, что увеличение количества пропионата, наблюдаемое при скармливании P169, продуцируется самим штаммом P169, так как восстановление для этого штамма составляло 106 КОЕ на мл или ниже (Peng et al., 2011). Однако Luo et al. (2017) показали, что пропионат может образовываться под действием PAB с высокой скоростью, и мы не можем исключить, что P169 мог производить пропионат быстрее in vivo, чем in vitro, в результате стимуляции естественных микробных обитателей рубца.
Результаты, полученные нами при использовании рубцовой жидкости молочного скота норвежской породы, несколько отличаются от данных, представленных в предыдущих отчетах, в отношении соотношения ЛЖК в рубце. Два штамма привели к увеличению доли ацетата, но не к сопутствующему увеличению выхода метана. Три других штамма, протестированных в настоящем исследовании, вызвали увеличение доли пропионата, но не изменили долю ацетата и выход метана, за исключением P. thoenii T159, который привел к 20-процентному снижению выхода метана. Это свидетельствует о том, что штаммы PAB in vitro способны частично перенаправлять поток углерода. Более того, штаммы PAB LMGT2826, LMGT2827 и T159 даже смогли перенаправить его в сторону от метаногенеза.
Данные показывают, что, хотя ферментация пропионата стимулируется, ацетогенез, возможно, гомоацетогенез (Joblin, 1999), по-видимому, в некоторых случаях стимулируется еще больше. Продукция метана в наших экспериментах составляла от 40,7 до 55,0 мл/г СВ, что немного выше, чем сообщалось для канадского крупного рогатого скота (Alazzeh et al., 2013; Alazzeh et al., 2014). В нашем исследовании продукция метана соответствовала примерно 0,1 ммоль С в метане на флакон. Максимум оно снижалось по сравнению с контролем на 0,02 ммоль С (штамм Т159), тогда как наблюдаемое увеличение продукции ЛЖК у этого штамма соответствовало 0,35 ммоль С. Таким образом, наши результаты нельзя объяснить просто перенаправлением потока углерода от метаногенеза к производству ЛЖК. Скорее, данные указывают на повышенную деградацию и ферментацию корма по путям, которые производят в основном ацетат и, в меньшей степени, пропионат. Они также указывают на то, что штаммы PAB могут стимулировать метаболизм других микробов в рубце.
Было показано, что PAB влияют на рост широкого спектра микробов, включая бактерии, дрожжи и плесени. Большинство исследований было посвящено избирательному ингибированию роста микробов (Holo et al., 2002; Lind et al., 2007; Schwenninger et al., 2008; Faye et al., 2011), однако известны и свойства PAB стимулировать рост (Kaneko, 1999; Jan et al, 2002; Warminska- Radyko et al., 2002); 1,4-дигидрокси-2-нафтойная кислота, секретируемая PAB, может стимулировать рост бифидобактерий и различных других анаэробов (Kaneko, 1999; Fenn et al., 2017). В соответствии с этим сообщалось, что P. acidipropionicii P169 может стимулировать деградацию корма в рубце (Sanchez et al., 2014).
Деградация корма
В контроле деградация, то есть количество переваренного субстрата через 24 ч, составляла от 57 до 63 % (табл. 4). Деградация СВ сильно варьировала при добавлении штаммов PAB, за исключением штаммов LMGT2825 и LMGT2841. При добавлении этих двух штаммов мы не наблюдали стимуляции деградации. Каждый из остальных штаммов увеличивал деградацию корма (P < 0,05), по крайней мере, в одном из четырех экспериментов. В эксперименте 5 несколько штаммов увеличили деградацию примерно до 72 %.
Таблица 4. Влияние штаммов пропионовокислых бактерий Propionibacterium (P.) и Tessaracoccus (T.) на деградацию субстрата в экспериментах (Exp.) 3-6.
|
Добавленная бактерия
|
Штамм
|
Деградация субстрата (% сухого вещества)
|
||||
|
Exp. 3
|
Exp. 4
|
Exp. 5
|
Exp. 6
|
Average
|
||
|
P. jensenii
|
LMGT2816
|
60.9
|
59.2
|
64.4
|
71.3*
|
63.9
|
|
P. jensenii
|
LMGT2824
|
54.6*
|
60.2
|
57.0
|
69.7*
|
60.4
|
|
P. jensenii
|
LMGT2825
|
59.6
|
59.6
|
60.5
|
57.8
|
59.4
|
|
P. freudenreichii
|
LMGT2841
|
59.0
|
60.6
|
63.5
|
60.5
|
60.9
|
|
P. sp.
|
T24
|
58.5
|
60.5
|
72.3*
|
60.4
|
63.0
|
|
P. freudenreichii
|
T31
|
58.9
|
59.5
|
72.4*
|
62.6
|
63.3
|
|
P. sp.
|
T88
|
61.3
|
58.6
|
71.3*
|
63.2
|
63.6
|
|
T. bendingoniensis
|
T93
|
61.1
|
59.2
|
69.2*
|
64.7
|
63.5
|
|
P. thoenii
|
T159
|
57.2
|
63.3*
|
71.7*
|
67.5
|
64.9*
|
|
None
|
Контроль
|
56.5
|
59.4
|
61.0
|
63.2
|
60.0
|
|
|
SEM
|
0.55
|
0.32
|
1.11
|
0.82
|
1.97
|
Наиболее сильную общую стимуляцию (P < 0.008) показал штамм T159: среднее увеличение деградации корма составило 8% по сравнению с контролем. Штаммы LMGT2816, T88 и T93 показали ту же тенденцию (P ≤ 0.057), со средним увеличением деградации на 6 %. Благотворное влияние PAB на деградацию корма в рубце изучено недостаточно. PAB может стимулировать рост и активность микроорганизмов в рубце за счет факторов роста, например, 1,4-дигидрокси-2-нафтойной кислоты (Kaneko, 1999; Fenn et al., 2017).
Вариабельность распада корма в разных опытах была выше при инкубации с PAB, чем в контроле, от отсутствия эффекта до увеличения на 12%. Это может быть следствием ежедневных различий в микробиоме рубца или в состоянии используемых культур PAB.
Мы обнаружили, что PAB может усиливать деградацию корма. Возможно, это общее свойство PAB, но штамм T159 показал наиболее устойчивые результаты. Интересно, что этот же штамм показал самые сильные эффекты в тесте in vitro с рубцовой жидкостью канадского мясного скота (Alazzeh et al. 2013). В этих экспериментах, при использовании разных кормов, влияние на выход метана было меньше, хотя пропионат стимулировался за счет ацетата. Примечательно, что штамм T159 повлиял на метаболизм микробиоты рубца, которая, вероятно, была совершенно разной в наших и Alazzeh et al. (2013) исследованиях, о чем свидетельствуют различия в соотношении ацетата и пропионата в рубце. Такие различия и разные корма, использованные в этих исследованиях, возможно, способствовали получению несколько разных результатов.
Используя рацион, типичный для молочных коров, мы показали, что P. thoenii T159 может стимулировать деградацию корма и одновременно подавлять образование метана. Эти два положительных свойства добавляют штамм T159 в список перспективных микроорганизмов прямого кормления для более эффективного использования корма жвачными животными, но это должно быть оценено в естественных условиях.
Источник: Jikun Chen, et al. Propionic acid bacteria enhance ruminal feed degradation and reduce methane production in vitro / Acta agriculturae Scandinavica, Section A—Animal science2020, Vol. 69, No. 3, 169–175
КОРМОВАЯ ДОБАВКА НА ОСНОВЕ ПРОПИОНИБАКТЕРИЙ ДЛЯ КОРРЕКЦИИ РУБЦОВОГО ПИЩЕВАРЕНИЯ
Примечание редактора: Речь пойдет об использовании пропионовокислых бактерий в кормопроизводстве. Тема использования пропионовокислых бактерий в животноводстве начала равиваться еще во времена СССР. На основе клеток пропионовокислых бактерий (ПКБ), выделенных из рубца коровы, в конце 80-х был разработан препарат "Пропиовит", который обеспечивал животных витамином В12, повышал привесы, сопротивляемость болезням, что в итоге сокращало их гибель в 2 раза. Как тогда показала практика, в результате использования "Пропиовита" могла быть получена прибыль в 19 руб. на 1 руб. затрат. В данной статье речь пойдет о белорусском препарате, основой которого являются лиофильно высушенные клетки специально подобранных культур Propionibacterium freudenreichii, которые, как известно, являются природными компонентами рубцового содержимого у жвачных животных, утилизируют молочную кислоту, при этом продуцируют пропионовую и уксусную кислоты, что позволяет оптимизировать рН содержимого рубца и снизить риск развития ацидоза, а также повысить переваримость сырой клетчатки, увеличить суточную продуктивность животных...
Ацидоз рубца – широко распространённое заболевание у жвачных животных, которое характеризуется усиленной продукцией в рубце молочной кислоты и смещением кислотно- щелочного равновесия в организме животного.
В последние годы доказано, что ацидоз рубца носит главным образом алиментарный характер [1]. На начальных этапах заболевания ацидоз проявляется в маловыраженной субклинической форме, однако при рН 5,5 включается каскадное развитие патологий [2-4].
Популяция микроорганизмов в рубце является экосистемой со сложными трофическими связями и функционирует по принципу саморегуляции. Отклонение от оптимальных условий изменяет активность и состав микробоценоза, что приводит к нарушению пищеварения и отрицательно отражается на здоровье и продуктивности животных. Установлено, что снижение рН рубцовой среды до 5,2-5,6 (при физиологической норме рН 6,5-7,5), приводит к прекращению роста целлюлолитических микроорганизмов и снижению переваримости клетчатки. При этом наблюдается активный рост бактерий, продуцирующих молочную кислоту. Более того, в рубце в условиях избытка легкометаболизируемых сахаров и при наличии тех или иных ограничивающих рост микроорганизмов факторов, происходит образование резервных продуктов метаболизма, многие из которых, например, липополисахариды, являются токсичными для организма-хозяина и вызывают заболевания животных (ламинит копыт, хромоту). Дополнительным фактором, отрицательно влияющим на организм животного, является снижение продукции биотина и других витаминов микрофлорой рубца [4-5]. Особое значение имеет увеличение содержания в рубце жвачных медленно метаболизируемого организмом D-изомера молочной кислоты, даже относительно небольшая концентрация которого может привести к значительному снижению рН. В оптимальных условиях существует баланс между выработкой молочной кислоты в рубце, ее поступлением с кормом (из силоса), использованием бактериями рубца и ее выходом из рубца. В рубце обнаружено несколько групп бактерий (Megasphaera elsdenii, Selenomonas ruminantum, Propionibacterium freudenreichii), которые ферментируют молочную кислоту, тем самым эффективно повышая рН содержимого рубца. Однако бактерии, усваивающие молочную кислоту, растут в несколько раз медленнее микроорганизмов, которые метаболизируют крахмал [2]. Вследствие этого дисбаланса микробиоценоза в рубце наблюдается нарушение метаболических процессов, что приводит к размножению патогенных микроорганизмов и риску внутреннего отравления.
С целью коррекции рубцового пищеварения и предотвращения ацидозов использовали пропионовокислые бактерии (ПКБ) – Propionibacterium freudenreichii subsp. shermanii R 15 и полученный в результате адаптивной селекции к повышенной кислотности штамм Pr. freudenreichii subsp. shermanii AR 16 [6].
При культивировании в условиях с пониженной кислотностью в питательной среде с исходным рН 5,5 накопление биомассы полученного штамма Pr. freudenreichii АR 16 в 1,3 раза больше, тируемая кислотность – на 15% выше, чем у исходного штамма Pr. freudenreichii R 15 (рисунок).
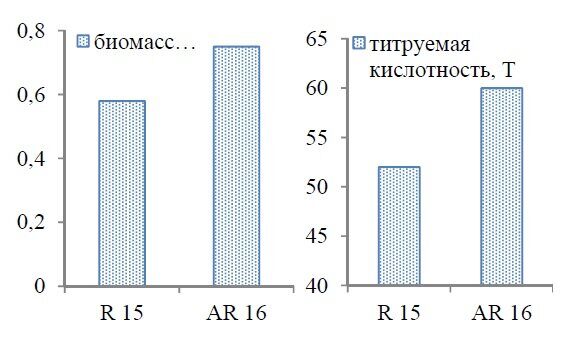
Рисунок – Биомасса и титруемая кислотность Pr. freudenreichii R 15 и Pr. freudenreichii АR 16 к 42 ч роста на среде с глюкозой и молочной кислотой (1:1) в качестве источников углеродного питания, рН 5,5
Исследование культур показало, что Pr. freudenreichii АR 16 отличается более высоким уровнем жизнеспособности клеток при выращивании на среде с молочной кислотой – 2*108 КОЕ/мл, тогда как у Pr. freudenreichii R 15 в этих условиях показатель КОЕ/мл составил 1*105 (таблица 1).
Таблица 1. – Жизнеспособность Pr. freudenreichii R 15 и Pr. freudenreichii АR 16 на различных питательных средах
|
Источник углеродного
питания в среде
|
Штамм
|
Количество жизнеспособных клеток
в 1 мл среды
|
|
Глюкоза, рН 7,2
|
AR 16
|
1.0*109
|
|
R 15
|
2,1*109
|
|
|
Глюкоза+ молочная кислота, рН 5,5
|
AR 16
|
2*108
|
|
R 15
|
1*105
|
Из культуральной жидкости, содержащей клетки двух штаммов пропионовокислых бактерий с показателем КОЕ/мл 2,0х109 получена кормовая добавка (Румибакт) с содержанием жизнеспособных лиофилизированных ПКБ в 1 г 1,2х1012 КОЕ.
С целью испытания эффективности добавку вводили в состав комбикорма в условиях молочно-товарного комплекса «Дубовка» СПК им. Денщикова Гродненского района. При проведении опытов на поголовье высокопродуктивных коров использовался метод групп-аналогов. Проведено исследование влияния кормовой добавки на показатели молочной продуктивности и качественные показатели молока коров.
Установлено, что у коров (по 100 голов в группах), которым в состав комбикорма вводили Румибакт, валовый надой молока натуральной жирности был выше на 2,35% по сравнению с контролем, при этом жирность молока на 0,21 п.п. выше. Надой молока базисной жирности оказался в опытной группе больше на 74,7 кг или 8,2% (таблица 2).
Таблица 2. – Показатели молочной продуктивности коров.
|
Показатели
|
контроль
|
опыт
|
|
Валовый надой молока за опытный период, кг
|
891
|
912
|
|
Среднесуточный надой коров в среднем за опыт, кг
|
29,7±0,90
|
30,4±0,73
|
|
Процент к контролю
|
100
|
102,35
|
|
Жирность молока коров в среднем за опыт, %
|
3,70±0,03
|
3,91±0,04
|
|
Среднесуточный надой в пересчете на базисную жирность, кг
|
30,5±1,10
|
33,0±0,87
|
|
Получено молока за опыт в пересчете на базисную жирность, кг
|
915,8
|
990,5
|
Результаты исследования биохимических показателей молока свидетельствуют, что использование в составе комбикорма для дойных коров кормовой добавки на основе ПКБ способствует повышению уровня жира в молоке на 0,29 п.п, белка – на 0,11 п.п. по сравнению с молоком контрольной группы (таблица 3).
Таблица 3. – Биохимические показатели молока и его качество
|
Показатели
|
Группы
|
± к кон-
тролю
п.п.
|
|||
|
контрольная
|
опытная
|
||||
|
1**
|
2***
|
1
|
2
|
||
|
Жир, %
|
3,62±0,26
|
3,78±0,31
|
3,75±0,19
|
4,07±0,39
|
+0,29
|
|
СОМО, %
|
8,57±0,31
|
8,71±0,20
|
8,54±0,29
|
8,89±0,26
|
+0,18
|
|
Белок, %
|
3,09±0,16
|
3,14±0,25
|
3,09±0,11
|
3,25±0,26
|
+0,11
|
|
Лактоза, %
|
4,70 ± 0,07
|
4,76 ± 0,04
|
4,65 ± 0,04
|
4,83 ± 0,10
|
+0,07
|
|
Вода, %
|
0
|
0
|
0
|
0
|
-
|
|
Минеральные вещества, %
|
0,68±0,07
|
0,69±0,09
|
0,68±0,188
|
0,70±0,119
|
+0,01
|
|
Кетоны, мг%*
|
~100
|
~110
|
~90
|
-
|
-
|
|
Мочевина, мг%*
|
~28-30
|
~25-30
|
~25-30
|
~20-25
|
-
|
|
Точка замерзания, ºС
|
- 0,54
|
- 0,54
|
- 0,54
|
- 0,56
|
-
|
|
Соматические клетки, тыс. КОЕ/см3
|
142,0±2,26
|
140,0±3,57
|
148,0±2,98
|
136±3,12
|
-4,0
|
|
КМАФАнМ, тыс. КОЕ/см3
|
131
|
123
|
129
|
110
|
-13,0
|
|
Плотность, * А
|
27,4±1,53
|
27,8±1,46
|
27,5±1,77
|
28,8±1,22
|
+1,0
|
Проведена органолептическая оценка образцов молока от коров контрольной и опытной групп по 5-ти бальной шкале. Результаты экспертной оценки показали, что все пробы молока характеризуются отличным вкусом и запахом и с учетом физико-химических и микробиологических показателей молоко может быть отнесено к сорту «Экстра» по СТБ 1598-2006* (* госстандарт республики Беларусь "молоко коровье сырое" ТУ - ред.).
Таким образом, результаты проведенных исследований показали, что скармливание комбикорма с добавкой Румибакт на основе ПКБ высокопродуктивным дойным коровам способствует увеличению среднесуточного надоя молока натуральной жирности на 2,35% по сравнению с контролем при одновременном повышении жирности молока на 0,21 п.п., что свидетельствует об эффективности кормовой добавки Румибакт. Годовой экономический эффект от использования добавки в расчете на 1000 голов коров может составить 48,42 тысячи рублей* (*речь идет о респулике Беларусь → на февраль 2024 г. указанная сумма эквивалентна 1 370 000 руб. в России - ред.).
Источник: Кормовая добавка на основе пропионовокислых бактерий для коррекции рубцового пищеварения / Н.А. Головнева, Н.Е. Рябая, А.Н. Морозова, А.А. Самарцев, А.Н. Михалюк // Биотехнология: достижения и перспективы развития: материалы V Междунар. науч.-практ. конф., (г. Пинск, 25-26 нояб. 2021 г.). Пинск: ПолесГУ, 2021. С. 65-67.
Доп. информация к основному разделу: Пробитики в животноводстве (+ доп.)
- Пробиотики как средства биоконтроля (якорь)
- Пробиотики в системах животноводства (якорь)
- Пропионибактерии в силосовании кормов
Прим. ред: Для КРС разработано много пробиотиков, однако в последнее время для защиты от таких патогенов, как Salmonella и Clostridium perfringens, все чаще стали добавлять в состав DFM пропионовокислые бактерии. Вот примеры из зарубежной литературы:
- Новый микроб при прямом скармливании для мясного скотоводства оказывает поддерживающее действие против Clostridium perfringens In Vitro и In Vivo (ссылка)
- Снижение содержания патогенов в фекалиях и лимфатических узлах, собранных у мясного скота, которого кормили Lactobacillus salivaris (L28), Lactobacillus acidophilus (NP51) и Propionibacterium freudenreichii (NP28), коммерчески доступными микроорганизмами прямого скармливания (ссылка)
- Эффективность ежедневного скармливания двух пробиотических продуктов для снижения неблагоприятных последствий для здоровья и продуктивности телят, вызванных Clostridium perfringens (ссылка)
- Эффективность кормовых добавок на основе Lactobacillus animals и Propionibacterium freudenreichii в снижении воздействия сальмонеллы на здоровье и продуктивность телят, выращиваемых в промышленных условиях (ссылка)
- Adams, M. C., Luo, J., Rayward, D., King, S., Gibson, R. & Moghaddam, G. H. (2008). Selection of a novel direct-fed microbial to enhance weight gain in intensively reared calves. Animal Feed Science and Technology 145, 41–52.
- Akay, V. & Dado, R. G. (2001). Effects of Propionibacterium strain P5 on in vitro volatile fatty acids production and digestibility of fiber and starch. Turkish Journal of Veterinary and Animal Sciences 25, 635–642.
- Alazzeh, A. Y., Smith, A. H., Beauchemin, K. A., Meale, S. J. & McAllister, T. A. (2014). Supplementing Propionibacterium acidipropionici P169 does not affect methane production or volatile fatty acid profiles of different diets in in vitro rumen cultures from heifers. Acta Agriculturae Scandinavica A ̶Animal Science 64, 170–177.
- Alazzeh, A. Y., Sultana, H., Beauchemin, K. A., Wang, Y., Holo, H., Harstad, O. M. & McAllister, T. A. (2013). Using strains of Propionibacteria to mitigate methane emissions in vitro. Acta Agriculturae Scandinavica A ̶Animal Science 62, 263–272.
- Boadi, D., Benchaar, C., Chiquette, J. & Massé, D. (2004). Mitigation strategies to reduce enteric methane emissions from dairy cows: Update review. Canadian Journal of Animal Science 84, 319–335.
- De Ondarza, M. B. & Seymour, W. M. (2008). Case Study: Effect of Propionibacteria supplementation on yield of milk and milk components of dairy cows. The Professional Animal Scientist 24, 254–259.
- Faye, T., Holo, H., Langsrud, T., Nes, I. F. & Brede, D. A. (2011). The unconventional antimicrobial peptides of the classical propionibacteria. Applied Microbiology Biotechnology 89, 549–554.
- Fenn, K., Strandwitz, P., Stewart, E. J., Dimise, E., Rubin, S., Gurubacharya, S., Clardy, J. & Lewis, K. (2017). Quinones are growth factors for the human gut microbiota. Microbiome 5, 161. DOI 10.1186/s40168-017-0380-5
- Holo, H., Faye, T., Brede, D. A., Nilsen, T., Ødegård, I., Langsrud, T., Brendehaug, J. & Nes, I. F. (2002). Bacteriocins of propionic acid bacteria. Lait 82, 59–68.
- Jan, G., Leverrier, P., Proudy, I. & Roland, N. (2002). Survival and beneficial effects of propionibacteria in the human gut: In vivo and in vitro investigations. Lait 82, 131–144.
- Jeyanathan, J., Martin, C., Eugène, M., Ferlay, A., Popova, M. & Morgavi, D. P. (2019). Bacterial direct-fed microbials fail to reduce methane emissions in primiparous lactating dairy cows. Journal of Animal Science and Biotechnology 10, 41. DOI 10.1186/s40104-019-0342-9
- Joblin, K. N. (1999). Ruminal acetogens and their potential to lower ruminant methane emissions. Australian Journal of Agricultural Research 50, 1307–1314.
- Kaneko, T. (1999). A novel bifidogenic growth stimulator pro- duced by Propionibacterium freudenreichii. Bioscience and Microflora 18, 73–80.
- Knapp, J. R., Laur, G. L., Vadas, P. A., Weiss, W. P. & Tricarico, J. M. (2014). Invited review: Enteric methane in dairy cattle production: Quantifying the opportunities and impact of reducing emissions. Journal of Dairy Science 97, 3231–3261.
- Kraggerud, H., Næs, T. & Abrahamsen, R. K. (2014). Prediction of sensory quality of cheese during ripening from chemical and spectroscopy measurements. International Dairy Journal 34, 6–18.
- Lee, I. H., Fredrickson, A. G. & Tsuchiya, H. M. (1974). Diauxic growth of Propionibacterium shermanii. Applied Microbiology 28, 831–835.
- Lind, H., Sjögren, J., Gohil, S., Kenne, L., Schnürer, J. & Broberg, A. (2007). Antifungal compounds from cultures of dairy propioni- bacteria type strains. FEMS Microbiology Letters 271, 310–315. Luo, J., Ranadheera, C. S., King, S., Evans, C. & Baines, S. (2017). In vitro investigation of the effect of dairy propionibacteria on rumen pH, lactic acid and volatile fatty acids. Journal of Integrative Agriculture 16, 1566–1575.
- Malik, A. C., Reinbold, G. W. & Vedamuthu, E. R. (1968). An evalu- ation of the taxonomy of Propionibacterium. Canadian Journal of Microbiology 14, 1185–1191.
- McAllister, T. A., Beauchemin, K. A., Alazzeh, A. Y., Baah, J., Teather, R. M. & Stanford, K. (2011). Review: The use of direct fed micro- bials to mitigate pathogens and enhance production in cattle. Canadian Journal of Animal Science 91, 193–211.
- Menke, K., Raab, L., Salewski, A., Steingass, H., Fritz, D. & Schneider, W. (1979). The estimation of the digestibility and metabolizable energy content of ruminant feeding stuffs from the gas production when they are incubated with rumen liquor in vitro. The Journal of Agricultural Science 93, 217–222.
- Niu, M., Kebreab, E., Hristov, A. N., Oh, J., Arndt, C., Bannink, A., Bayat, A. R., Brito, A. F., Boland, T., Casper, D., Crompton, L. A., Dijkstra, J., Eugene, M. A., Garnsworthy, P. C., Haque, M. N., Hellwing, A. L. F., Huhtanen, P., Kreuzer, M., Kuhla, B., Lund, P., Madsen, J., Martin, C., McClelland, S. C., McGee, M., Moate, P. J., Muetzel, S., Munoz, C., O’Kiely, P., Peiren, N., Reynolds, C. K., Schwarm, A., Shingfield, K. J., Storlien, T. M., Weisbjerg, M. R., Yanez-Ruiz, D. R. & Yu, Z. (2018). Prediction of enteric methane production, yield and intensity in dairy cattle using an intercontinental database. Global Change Biology 24, 3368–3389.
- Nocek, J. E. & Kautz, W. P. (2006). Direct-fed microbial supplementation on ruminal digestion, health, and performance of pre- and postpartum dairy cattle. Journal of Dairy Science 89, 260–266.
- Peng, M., Smith, A. H. & Rehberger, T. G. (2011). Quantification of Propionibacterium acidipropionici P169 bacteria in environmental samples by use of strain-specific primers derived by suppressive subtractive hybridization. Application Environment Microbiology 77, 3898–3902.
- Raeth-Knight, M., Linn, J. & Jung, H. (2007). Effect of direct-fed microbials on performance, diet digestibility, and rumen characteristics of Holstein dairy cows. Journal of Dairy Science 90, 1802–1809.
- Russell, J. B. (1998). The importance of pH in the regulation of ruminal acetate to propionate ratio and methane production in vitro. Journal of Dairy Science 81, 3222–3230.
- Sanchez, P., Tracey, L., Browne-Silva, J. & Lodge-Ivey, S. (2014). Propionibacterium acidipropionici P169 and glucogenic precursors improve rumen fermentation of low-quality forage in beef cattle. Journal of Animal Science 92, 1738–1746.
- Schwenninger, S. M., Lacroix, C., Truttmann, S., Jans, C., Spörndli, C., Bigler, L. & Meile, L. (2008). Characterization of low-molecular-weight anti-yeast metabolites produced by a food-protective lactobacillus-propionibacterium coculture. Journal of Food Protection 71, 2481–2487.
- Seo, J. K., Kim, S.-W., Kim, M. H., Upadhaya, S. D., Kam, D. K. & Ha, J. K. (2010). Direct-fed microbials for ruminant animals. Asian-Australasian Journal of Animal Sciences 23, 1657– 1667.
- Stein, D. R., Allen, D. T., Perry, E. B., Bruner, J. C., Gates, K. W., Rehberger, T. G., Mertz, K., Jones, D. & Spicer, L. J. (2006). Effects of feeding propionibacteria to dairy cows on milk yield, milk components, and reproduction. Journal of Dairy Science 89, 111–125.
- Vyas, D., McGeough, E. J., McGinn, S. M., McAllister, T. A. & Beauchemin, K. A. (2014). Effect of Propionibacterium spp. on ruminal fermentation, nutrient digestibility, and methane emissions in beef heifers fed a high-forage diet. Journal of Animal Science 92, 2192–2201.
- Warminska-Radyko, I., Laniewska-Moroz, L. & Babuchowski, A. (2002). Possibilities for stimulation of Bifidobacterium growth by Propionibacteria. Lait 82, 113–121.
- Weiss, W. P., Wyatt, D. J. & McKelvey, T. R. (2008). Effect of feeding Propionibacteria on milk production by early lactation dairy cows. Journal of Dairy Science 91, 646–652.
- Yost, W. M. & Young, J. W. (1977). Gluconeogenesis in ruminants: Propionic acid production from a high-rain diet fed to cattle. Journal of Nutrition 107, 2036–2043.
- Zárate, G. (2012). Dairy Propionibacteria: Less conventional probiotics to improve the human and animal health. In E. C. Rigobelo (ed.) Probiotic in Animals (Rijeka, Croatia: In Tech), pp. 153–202.
- Харитонов, Е.Л. Физиология и биохимия питания молочного скота / Е.Л. Харитонов. – Боровск : Оптима пресс, 2011. – 372 с.
- Direct-fed Microbials for Ruminant Animals /Ja Kyeom Seo [et al.] // Asian-Aust. J. Anim. Sci. – 2010. – Vol. 23, № 12. – Р.1657-1667.
- Архипов, А.В. Углеводы кормов: функции, достоинства, проблемы / А.В. Архипов // Ветеринария, зоотехния и биотехнология. – 2014. – № 9. – С. 46-63.
- Калюжный, И.И. Ацидоз рубца: автореф. дис. … докт. вет. наук: 16.00.01/ И.И. Калюжный. – Воронеж, 1996. ˗ 21 с.
- Малков, М.А. Методические рекомендации по управлению физиологическим состоянием КРС в различных жизненных периодах / М.А. Малков [и др.] – СПб, 2016. – 23 с.
- Головнева, Н.А. Особенности культивирования пропионовокислых бактерий – компонентов биопрепаратов / Н.А. Головнева [и др.] // Микробные биотехнологии: фундаментальные и прикладные аспекты: сб. науч. тр. / редкол: Э.И. Коломиец [и др.]. – Минск, 2018. – Т. 10. – С.32-44.

