ООО "ПРОПИОНИКС"
| пн-пт с 09:00 до 18:00 | |
Исследование роли молочных пропионибактерий P. freudenreichii в профилактике колоректального рака
« НазадИсследование роли молочных (классических) пропионовокислых бактерий в профилактике колоректального рака

Исследование потенциальной роли Propionibacterium freudenreichii в профилактике колоректального рака и его влияния на разнообразие кишечной микробиоты у крыс
Резюме
На колоректальный рак (CRC) приходится 10% всех диагнозов рака и смертей, связанных с раком, во всем мире. За последние два десятилетия несколько исследований продемонстрировали клинические преимущества пробиотических добавок, а некоторые исследования показали, что определенные пробиотики могут модулировать иммунитет и усиливать разнообразие кишечной микробиоты. Цель этого исследования - оценить влияние пробиотика Propionibacterium freudenreichii (PF) на CRC, индуцированный азоксиметаном (AOM), и исследовать его влияние на разнообразие кишечной микробиоты у крыс, а также оценить антипролиферативную активность PF в клетках CRC HCT116. (прим. ред.: Азоксиметан (АОМ) — это канцерогенное и нейротоксичное химическое соединение, используемое в биологических исследованиях. Это оксид азометана, который особенно эффективен для индукции рака толстой кишки).
Эксперимент был проведен с использованием четырех групп крыс Спрег-Доули (SD): 1) нормальный контроль, 2) группа AOM, 3) группа PF (1 × 109 КОЕ/мл) и 4) стандартный лекарственный контроль (группа 5-FU → 5-фторурацил, 35 мг/кг). Окрашивание тканей толстой кишки метиленовым синим показало, что введение PF значительно уменьшало образование очагов аберрантных крипт толстой кишки (ACF) по сравнению с контрольной AOM-группой. Кроме того, обработанные крысы имели более низкие уровни малонового диальдегида (MDA) в гомогенатах ткани толстой кишки, что указывает на то, что перекисное окисление липидов подавлялось добавкой PF. Кроме того, анализ гена 16S рРНК показал, что лечение пробиотиками увеличивало разнообразие кишечной микробиоты у крыс. Исследование In vitro показало, что жизнеспособность клеток HCT116 подавлялась пробиотическим бесклеточным супернатантом со значением IC50 13,3±0,133. В заключение, эти результаты показывают, что потребление PF в качестве пробиотических добавок модулирует микробиоту кишечника, ингибирует канцерогенные эффекты AOM и показывает антипролиферативную активность в отношении клеток CRC. Необходимы дальнейшие исследования для выяснения роли PF в иммунном ответе во время развития и роста CRC.
1. Введение
Колоректальный рак (CRC) является третьим по распространенности типом рака и второй по значимости причиной смертности от рака во всем мире. Ожидается, что к 2035 году будет диагностировано еще 2,5 миллиона случаев CRC. Заболеваемость CRC и смертность от него выше в развитых странах; однако в настоящее время наметилась новая тенденция роста заболеваемости CRC в развивающихся странах и странах с низким уровнем дохода [1]. Различные причины CRC были исследованы с использованием данных различных когортных исследований, и результаты аналогичны результатам исследований на животных. Коллективный вывод заключается в том, что генетические факторы риска и образ жизни, которые могут привести к избыточному весу и диабету, способствуют более высокой частоте CRC [2]. Чрезмерное курение и употребление алкоголя, чрезмерное потребление красного мяса и полуфабрикатов, дисбактериоз и пожилой возраст (>50 лет) являются поддающимися модификации факторами риска развития CRC. Однако наблюдается тревожный рост случаев постановки диагноза CRC у молодых людей (20-50 лет) из-за случаев наследования раковых мутаций, плохой дифференцировки клеток и первоначального расположения опухоли на левой стороне толстой кишки. Другие факторы риска, такие как генетика, не могут быть изменены [3].
За последние два десятилетия увеличилось количество исследований, подтверждающих клиническую пользу употребления пробиотиков, и было продемонстрировано, что пробиотики повышают иммунитет и укрепляют защитную линию кишечника [4]. В настоящее время пробиотики рекламируются как возможный метод профилактики рака. Несколько РКИ-исследований показали, что пациенты с CRC, которые постоянно употребляли кисломолочные продукты (содержащие пробиотики), такие как йогурт, кефир, сыр и пробиотические БАД, показали лучший результат [5,6,7,8]. Поскольку изучается влияние пробиотиков на CRC, бифидобактерии и лактобациллы были наиболее распространенными пробиотиками, использовавшимися в этих исследованиях.
Propionibacterium freudenreichii - грамположительная палочка с нейтральным рН, неподвижная и не образующая спор. Это классическая молочная пропионибактерия, которая отличается от условно-патогенного микроорганизма Propionibacterium acnes, который относится к кожным пропионибактериям. Недавняя таксономия, основанная на геноме, привела к реклассификации классических пропионибактерий, таких как Acidipropionibacterium, Propionibacterium freudenreichii и Pseudopropionibacterium, в отдельную таксономическую категорию. Напротив, кожные бактерии были реклассифицированы в род Cutibacterium. Это различие основано на полном секвенировании генома этих бактерий [9]. Молочные (классические) пропионибактерии способны ферментировать различные углеводы, спирт, субстраты и органические кислоты, что позволяет им адаптироваться к различным условиям окружающей среды [9,10].
 Propionibacterium freudenreichii - это пробиотическая бактерия, которая широко используется при производстве швейцарского сыра. Её способность выживать в суровых условиях производства сыра и противостоять стрессу пищеварения имеет важное значение для терапевтического воздействия на кишечник [11]. Вид P. freudenreichii был тщательно изучен и, как было установлено, соответствует критериям пробиотика, включая адгезию к клеткам-хозяевам, устойчивость к стрессорам желудочно-кишечного тракта, противоопухолевый потенциал, антипатогенное действие и иммуномодулирующие способности [12,13]. Пробиотические свойства P. freudenreichii объясняются множеством биологически активных метаболитов и короткоцепочечных жирных кислот (SCFAs), таких как пропионат и ацетат, которые обеспечивают энергией клетки толстой кишки, стимулируют рост нормальных клеток толстой кишки и ограничивают рост клеток рака толстой кишки [14]. Вид P. freudenreichii считается “общепризнанным безопасным” (GRAS), его безопасность для потребления человеком была оценена исследованиями, при этом о побочных эффектах не сообщалось [15,16]. Кроме того, P. freudenreichii обладает внутренней устойчивостью к нескольким антибиотикам, включая аминогликозиды, хинолоны первого и второго поколения, оксациллин, метронидазол, канамицин и левофлоксацин. Эта устойчивость не кодируется бактериальными плазмидами, и не было зарегистрировано никакой передаваемой устойчивости к антибиотикам [17,18].
Propionibacterium freudenreichii - это пробиотическая бактерия, которая широко используется при производстве швейцарского сыра. Её способность выживать в суровых условиях производства сыра и противостоять стрессу пищеварения имеет важное значение для терапевтического воздействия на кишечник [11]. Вид P. freudenreichii был тщательно изучен и, как было установлено, соответствует критериям пробиотика, включая адгезию к клеткам-хозяевам, устойчивость к стрессорам желудочно-кишечного тракта, противоопухолевый потенциал, антипатогенное действие и иммуномодулирующие способности [12,13]. Пробиотические свойства P. freudenreichii объясняются множеством биологически активных метаболитов и короткоцепочечных жирных кислот (SCFAs), таких как пропионат и ацетат, которые обеспечивают энергией клетки толстой кишки, стимулируют рост нормальных клеток толстой кишки и ограничивают рост клеток рака толстой кишки [14]. Вид P. freudenreichii считается “общепризнанным безопасным” (GRAS), его безопасность для потребления человеком была оценена исследованиями, при этом о побочных эффектах не сообщалось [15,16]. Кроме того, P. freudenreichii обладает внутренней устойчивостью к нескольким антибиотикам, включая аминогликозиды, хинолоны первого и второго поколения, оксациллин, метронидазол, канамицин и левофлоксацин. Эта устойчивость не кодируется бактериальными плазмидами, и не было зарегистрировано никакой передаваемой устойчивости к антибиотикам [17,18].
В нескольких исследованиях [19,20,21] изучались противораковые свойства P. freudenreichii. Например, Ян и др. обнаружено, что Propionibacterium ингибирует раковые клетки, такие как Caco2, HeLa и HT29, предположительно, благодаря своим метаболитам, таким как SCFAs [19]. Другое исследование показало, что вид P. freudenreichii ускорял ингибирование раковых клеток путем апоптоза в толстой кишке крысы после генотоксического воздействия, что также было приписано микробным метаболитам [22].
Предыдущие исследования показали, что определенная микробиота кишечника, включающая Fusobacterium nucleatum, Streptococcus gallolyticus и Bacteroides fragilis, играет значительную роль в канцерогенезе CRC, создавая физические и биологические условия, которые могут увеличить вероятность предраковых поражений толстой кишки [23]. Дисбактериоз кишечной микробиоты вносит свой вклад в патогенез CRC, и исследования показали специфическую взаимосвязь между развитием CRC и составом кишечных бактерий. Колонизируя ткани хозяина и предотвращая колонизацию вредных бактерий, пробиотики могут помочь восстановить микробный баланс кишечника и бороться с дисбактериозом [24]. Это подтверждает идею о том, что манипулирование кишечной микробиотой может быть потенциальной стратегией профилактики CRC.
В этой работе мы исследовали антипролиферативное действие метаболитов P. freudenreichii на раковые клетки (клеточные линии HCT116 CRC) и профилактическое действие живых клеток P. freudenreichii, потребляемых крысами Sprague-Dawley (SD), у которых были индуцированы опухолевые поражения при введении азоксиметана (АОМ).
2. Результаты
2.1. Бесклеточный супернатант P. freudenreichii ингибирует пролиферацию клеток CRC
Результаты анализа MTT показали, что бесклеточный супернатант P. freudenreichii снижал жизнеспособность клеток HCT116 по мере увеличения дозы PF. С другой стороны, 5-FU оказывал сильнейший ингибирующий эффект против пролиферации клеток колоректального рака HCT116 по сравнению с P. freudenreichii (рисунок 1). IC50 5-FU против клеток HCT116 через 72 ч лечения составила 0,84 ± 0,02 мкг/мл, в то время как IC50 P. freudenreichii составляла 13,3 ± 0,133% в тот же момент времени.
Рисунок 1. Жизнеспособность раковых клеток HCT116, обработанных бесклеточным супернатантом P. freudenreichii (PF) и 5-фторурацилом (5-FU) в течение 72 ч. Данные выражены как среднее значение ± SEM трех повторов.
2.2. P. freudenreichii уменьшает окислительный стресс
Концентрация малонового диальдегида (MDA) в образцах толстой кишки крыс группы, индуцированной AOM, заметно увеличилась до 5,7 ± 1,9 мкмоль/мг белка по сравнению с группой нормального контроля (NC), что указывает на окислительный стресс. С другой стороны, пробиотические добавки P. freudenreichii снижали окислительный стресс до 2,34 ± 0,87 мкмоль / мг белка у обработанных крыс. Уровни MDA также были снижены у крыс, получавших 5-FU (рисунок 2).
Рисунок 2. Уровни окислительного стресса у обработанных (леченных) и необработанных (нелеченных) животных. Данные были выражены в виде среднего значения ± SEM. (AOM): азоксиметан, (PF): P. freudenreichii, (5-FU): 5-фторурацил и (NC): нормальный контроль.
2.3. Влияние P. freudenreichii на образование ACF
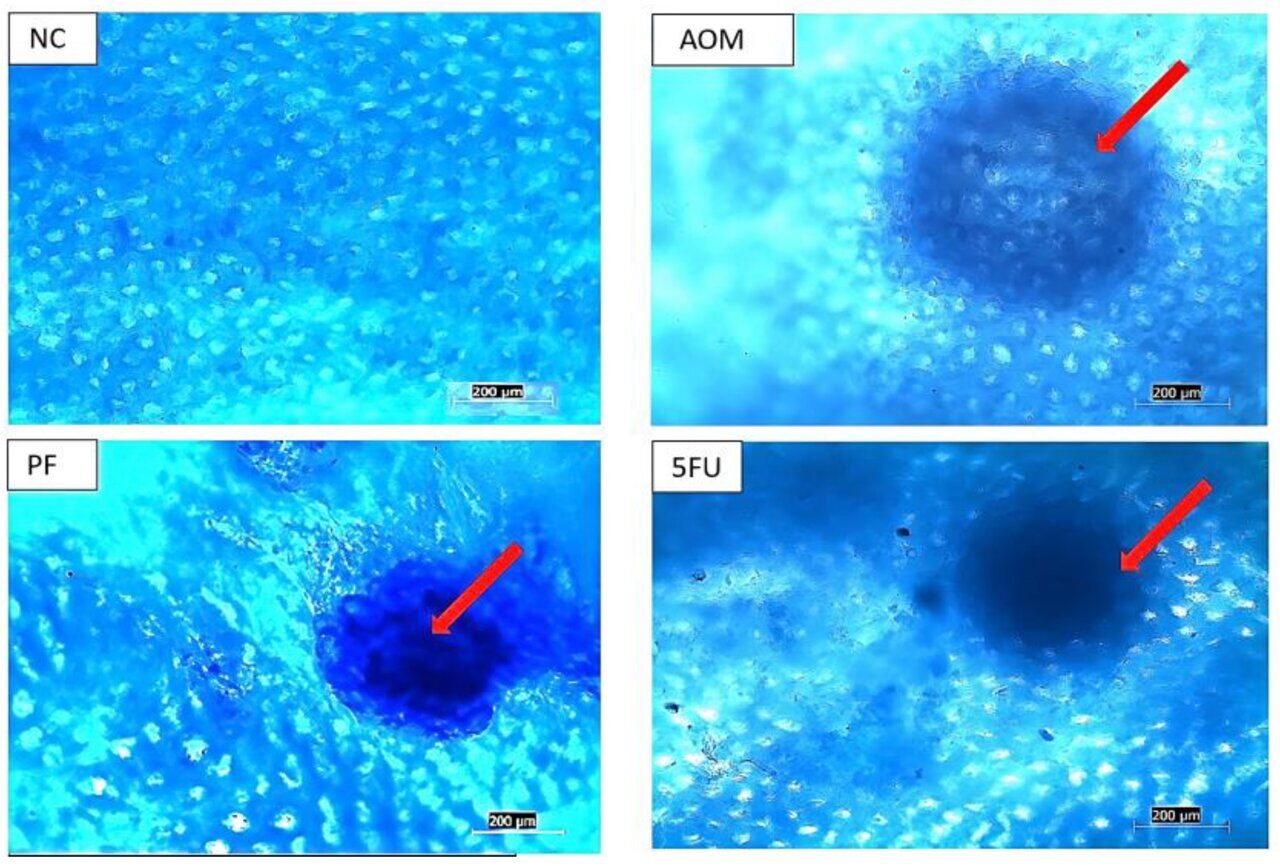
Аномальные очаги аберрантных крипт (ACF) чаще обнаруживались в дистальном отделе толстой кишки, чем в проксимальном отделе толстой кишки. Общее количество крипт определяли путем подсчета ACF в образцах толстой кишки с помощью микроскопа. У крыс, получивших AOM, развились узнаваемые поражения, известные как очаги аберрантных крипт (ACF) в толстой кишке, что видно при окрашивании метиленовым синим (рисунок 3). В толстой кишке нормальной контрольной группы аномальных крипт не наблюдалось. По сравнению с контрольной группой AOM, крысы, которых кормили пробиотиками, имели более низкие показатели ACF и их множественность. У крыс, получавших пробиотики P. freudenreichii, было значительно меньше ACF (p < 0,05) по сравнению с группой AOM. Доля ингибирования ACF в группе P. freudenreichii (PF) составила 56,0% по сравнению с 67,6% у крыс, получавших обычный препарат 5-FU. У крыс, получавших пробиотики P. freudenreichii, общее количество ACF было значительно снижено на 14,9 ± 2,73 (p < 0,001) по сравнению с контрольной группой AOM (33,9 ± 3,18) (таблица 1).
Рисунок 3. Очаги абберантных крипт (ACF) в толстой кишке обработанных и контрольных крыс. (NC): нормальный контроль, (AOM): азоксиметан, (PF): P. freudenreichii и (5-FU): 5-фторурацил (шкала = 200 мкм).Красные стрелки указывают на аномальные крипты (поражения ACF).
Таблица 1. Количество очагов аберрантных крипт (ACF) подсчитывается в группе лечения и контрольной группе.
|
Группы
|
1 крипта
|
2 крипты
|
3 крипты
|
4 крипты
|
5 крипт
и более
|
Общее
кол-во ACF
|
% ингиби-рования
|
|
Норм. контроль
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
|
Группа АОМ
|
9.8 ± 1.28
|
4.5 ± 0.77
|
8.0 ± 1.30
|
4.4 ± 0.40
|
7.2 ± 0.37
|
33.9 ± 3.18
|
0
|
|
P. freudenreichii
|
5.2 ± 1.46
|
2.66 ± 0.68
|
2.25 ± 0.42
|
2.0 ± 0.31
|
2.8 ± 0.58
|
14.9 ±
2.73 ***
|
56.0 ***
|
|
Группа 5-FU
|
2.75 ± 0.75
|
2.25 ± 0.75
|
1.75 ± 1.18
|
2.0 ± 0.40
|
2.25 ± 0.85
|
11.0 ±
1.10 ***
|
67.6 ***
|
Значения были выражены в виде среднего ± SEM, значение с *** p < 0,001 указывает на значимость по сравнению с группой азоксиметана (AOM).
2.4. Гистологические результаты
В контрольной AOM-группе в тканях толстой кишки были обнаружены диспластические и гиперпластические крипты. Эти ACF имели более крупную и длинную слизистую выстилку, явную коррозию клеток, большее воспаление, скученность ядра, потерю полярности и потерю бокаловидных клеток. Присутствие ACF распространяло слизистые железы в тканях толстой кишки крыс, индуцированных AOM, о чем свидетельствовали удлиненные стратифицированные ядра, архитектурная атипия, частые митозы и деградация муцина, атипичные эпителиальные клетки и крипты большего размера, чем обычно, по сравнению с нормальными крысами. Эти аномалии в некоторой степени уменьшились в группах, получавших лечение, по сравнению с группой АОМ (рис. 4).
Рисунок 4. Гистологический анализ толстой кишки леченных и нелеченных крыс. (NC): нормальный контроль, (PF): P. freudenreichii, (AOM): азоксиметан, и (5-FU): 5-фторурацил, (масштабная линейка = 50 мкм). Коричневые стрелки указывают на увеличенные крипты, а красные стрелки показывают инфильтрацию воспалительных клеток.
2.5. Влияние P. freudenreichii на разнообразие микробиоты кишечника
Firmicutes, Bacteroidota, Actinobacteriota, Proteobacteria, Verrucomicrobiota и Patescibacteria были наиболее многочисленными типами в каждой группе на уровне типа, как показало секвенирование 16S рРНК. В целом, во всех группах преобладали типы Firmicutes, Actinobacteriota, Proteobacteria и Bacteroidetes (Рисунок 5).
Рисунок 5. График разнообразия микробиоты кишечника на уровне типов. (NC): нормальная контрольная группа, (PF): группа P. freudenreichii, (AOM): контрольная группа азоксиметана, и (5-FU): контрольная группа 5-фторурацила.
На уровне родов наиболее разнообразная микробиота кишечника была обнаружена в группе нормального контроля, за которой следовала группа, леченная P. freudenreichii, в то время как группа, леченная 5-FU, и группа, индуцированная AOM, были менее разнообразными группами (Рисунок 6). Относительная численность идентифицированных таксонов была визуализирована с помощью тепловой карты (Рисунок 7). Анализ альфа-разнообразия проводился с использованием индекса Шеннона для измерения разнообразия внутри образцов. Более низкий индекс Шеннона указывал на более высокое альфа-разнообразие, в то время как более высокие значения указывали на меньшее разнообразие (Рисунок 8a). Анализ бета-разнообразия проводился с использованием неметрического многомерного шкалирования (NMDS) для сравнения сходства между группами. Рисунок 8b,c показывает, что разнообразие группы P. freudenreichii отличается от разнообразия других групп. Микробиота контрольных образцов была менее разнообразной, чем микробиота других групп.
Рисунок 6. График разнообразия микробиоты кишечника на уровне рода. (NC): нормальная контрольная группа, (PF): группа P. freudenreichii, (AOM): контрольная группа азоксиметана, и (5FU): контрольная группа 5-фторурацила.
Рисунок 7. Анализ тепловой карты микробного состава на уровне рода. (NC): нормальная контрольная группа, (PF): группа P. freudenreichii, (AOM): контрольная группа азоксиметана, и (5-FU): контрольная группа 5-фторурацила.
Рисунок 8. (a) Анализ альфа-разнообразия с использованием индекса Шеннона, представленного в виде последовательностей на образец. Ось x показывает количество чтений на образец, а ось y - индекс Шеннона. Каждая кривая представляет отдельный образец и показана другим цветом. (b,c): анализ бета-разнообразия, визуализированный с помощью неметрического многомерного графика рассеяния (NMDS), (NC): нормальная контрольная группа, (PF): группа P. freudenreichii, (AOM): контрольная группа азоксиметана, и (5-FU): контрольная группа 5-фторурацила.
3. Обсуждение
Колоректальный рак является одной из основных причин смерти во всем мире, и считается, что он возникает в результате трансформации нормальных эпителиальных клеток толстой кишки в аденоматозные полипы, которые затем превращаются в инвазивную злокачественную опухоль. Хотя генетика (наследственность) является основным фактором риска CRC, факторы окружающей среды, такие как диета и образ жизни, были связаны с увеличением заболеваемости CRC в эпидемиологических исследованиях [25,26].
Propionibacterium freudenreichii является пробиотикопотенциальной бактерией, которая имеет коммерческую ценность. Она считается безопасной и способна выдерживать пищеварительный стресс, возникающий при пероральном приеме, что делает ее очень интересным пробиотическим микроорганизмом [10]. Благодаря образованию SCFAs, таких как пропионат и ацетат, эта бактерия может защищать от CRC путем запуска апоптоза [11,27].
Митохондриальная функция клеток представлена превращением тетразолиевой соли МТТ в кристаллы формазана, которые могут быть солюбилизированы для гомогенного анализа метана. Уменьшение популяции клеток представляет собой подавление клеточного роста в делящихся клетках. В нашем исследовании цитотоксичность Propionibacterium freudenreichii против клеток рака толстой кишки оценивалась с использованием клеточной линии рака толстой кишки HCT116, и наши результаты показали, что бесклеточный супернатант P. freudenreichii подавляет пролиферацию клеток рака толстой кишки HCT116. Этот противораковый эффект может быть обусловлен выделением в супернатант метаболитов SCFA, таких как пропионовая кислота. По сравнению со стандартным контролем (5-FU), ингибирующая активность 5FU против клеток CRC была значительно сильнее, чем P. freudenreichii (рис. 1).
В одном из исследований было установлено, что P. freudenreichii инициирует апоптоз клеток рака желудка человека HGT-1 путем воздействия на митохондрии клеток колоректального рака через метаболит пропионат [28]. Кроме того, несколько исследований показали, что P. freudenreichii оказывает ингибирующее действие на различные клеточные линии карциномы толстой кишки, включая клетки HT29, HeLa и CaCo-2 [19,29]. Примечательно, что P. freudenreichii не проявляет цитотоксичности и не подавляет пролиферацию нормальных клеток толстой кишки, таких как эпителиальные клетки кишечника человека (HIEC) [29]. Более того, некоторые исследования показали, что P. freudenreichii может оказывать защитное действие на кишечный эпителий, способствуя дифференцировке клеток и предотвращая воспаление, что может быть полезно для поддержания здоровья кишечника. Более того, P. freudenreichii может уменьшать воспаление в клетках HIEC, что подчеркивает его потенциал в качестве функционального продукта питания для борьбы с воспалением кишечника [30].
Очаги аберрантных крипт (ACF) обычно считаются ранними индикаторами новообразований толстой кишки человека. В экспериментах на животных ACF индуцировали у крыс канцерогенным веществом AOM [31,32]. В целом, CRC развивается и распространяется по стадиям, каждая из которых характеризуется нерегулируемой и быстрой клеточной пролиферацией, а также ингибированием апоптоза [33]. Крысиная модель отражает и выражает большинство основных молекулярных, морфологических и клинических характеристик, связанных с CRC у людей, таких как образование ACF, которые считаются предшественниками злокачественных опухолей [34].
В данном исследовании было установлено, что P. freudenreichii подавляет образование ACF и снижает частоту пренеопластических поражений и мультикриптов в толстой кишке крыс, что сопоставимо с результатами других опубликованных исследований, в которых пробиотики подавляли химически индуцированные ACF у крыс SD [19,37,38]. Общее количество ACF у крыс, получавших 1 × 109 КОЕ/мл P. freudenreichii, было значительно ниже, с большей долей ингибирования по сравнению с группой АОМ; также у крыс, получавших 5FU, было значительно меньше ACF, чем в контрольной группе АОМ, от единичных до множественных крипт, как видно из таблицы 1 и рисунка 3. После окрашивания метиленовым синим в группах AOM, PF и 5FU были видны заметные ACF (Рисунок 4).
Наличие атипичных эпителиальных клеток, скученность и удлинение ядер, а также архитектурная атипия в ACF доказывали, что это были диспластические аберрантные крипты, которые являются предшественниками CRC. Также наблюдались гиперпластические аберрантные крипты, которые представляют собой первый этап формирования ACF до развития легкой или тяжелой дисплазии (Рисунок 5).
AOM метаболизируется цитохромом P450 в токсичный метаболит (метилазоксиметанол), который вызывает окислительный стресс, мутации ДНК и неопластические поражения. Окислительный стресс в клетках толстой кишки опосредован истощением глутатиона, что снижает общую антиоксидантную способность. Высокая скорость перекисного окисления липидов, на которую указывает повышенный уровень MDA у крыс, индуцированных АОМ, была снижена у крыс, получавших пробиотики, поскольку добавка пробиотиков снижала уровень реактивных форм кислорода. У крыс, индуцированных АОМ, не получавших лечения, антиоксидантные ферменты были истощены и не могли ослабить действие свободных радикалов. В группе АОМ наблюдался более высокий уровень перекисного окисления липидов, что является признаком острого повреждения клеток толстой кишки (Рисунок 2). Предыдущие исследования влияния пробиотиков на перекисное окисление липидов показали, что пробиотики снижают уровень MDA, что согласуется с результатами данного исследования [37,38]. Результаты нашего исследования показали, что лечение P. freudenreichii смягчало окислительный стресс, вызванный токсичными метаболитами АОМ.
Противораковые эффекты P. freudenreichii все еще изучаются, и точные механизмы не до конца понятны. Однако было предложено несколько потенциальных механизмов, включая детоксикацию канцерогенов, производство антиоксидантных соединений, таких как экзополисахариды, индукцию апоптоза в раковых клетках, ингибирование роста и миграции опухолевых клеток, модуляцию иммунной системы, увеличение разнообразия и богатства микробиоты кишечника, предотвращение роста и распространения вредных бактерий, а также производство SCFAs, таких как пропионат и бутират, которые могут оказывать противораковое действие (прим. ред.: исследования показали, что бактерии P. freudenreichii вызывают в т.ч. повышение бутирата, в среднем на 15%). Было показано, что бутират уменьшает воспаление в кишечнике и потенциально предотвращает развитие рака [19,28,29].
Применение пробиотиков является одной из стратегий, влияющих на микробное разнообразие кишечника. Микробиота кишечника изучается как потенциальный новый подход к профилактике или лечению колоректального рака. Употребление определенных пробиотиков помогает поддерживать баланс кишечных микроорганизмов, заселяя толстую кишку человека и препятствуя заселению ее не полезными бактериями [39].
В данном исследовании инокуляция крыс, индуцированных АОМ, бактерией P. freudenreichii привела к обогащению Lactobacillus и Bifidobacterium, все из которых являются полезными микроорганизмами, помогающими поддерживать здоровый баланс микрофлоры кишечника. Несмотря на отсутствие существенной разницы в родовом разнообразии между группами, группа P. freudenreichii имела более разнообразный микробиом, чем группа АОМ, что говорит о том, что АОМ подавляет диверсификацию микробиома кишечника и приводит к снижению популяции полезных микроорганизмов у крыс (Рисунок 6 и Рисунок 7). Результаты данного исследования согласуются с результатами других исследований, в которых оценивалось влияние потребления пробиотиков на микробное разнообразие кишечника [40,41,42]. Поэтому регулярное употребление швейцарского сыра и пробиотических составов будет полезным, особенно для людей с повышенным риском полипов толстой кишки или страдающих CRC.
Важно отметить, что для полного понимания воздействия P. freudenreichii на различные типы клеток и определения оптимальных штаммов и дозировок для потенциального терапевтического применения необходимы дополнительные исследования. Ограничения данного исследования включают отсутствие анализа экспрессии генов маркеров CRC и ограниченный молекулярный анализ сигнальных путей. Для полного выяснения профилактической роли этого полезного микроорганизма необходимы дальнейшие исследования для изучения молекулярных механизмов действия P. freudenreichii и влияния его метаболитов на экспрессию генов-маркеров рака.
4. Материалы и методы
4.1. Условия выращивания и бактериальные штаммы
Propionibacterium freudenreichii (DSM 2027) был получен из Немецкой коллекции микроорганизмов и клеточных культур GmbH, Институт Лейбница DSMZ, Германия. Бактерии были высушены замораживанием (лиофильной сушкой) и упакованы в двойной стеклянный флакон. Для оживления сублимированных клеток бактерий их выращивали при 37 °C в течение 3 дней в анаэробной камере с использованием анаэробных газовых пакетов (Thermo Fisher Scientific, Waltham, MA, USA) с использованием бульона усиленной клостридиальной среды (RCM) (CM0149 Oxoid, Basingstoke, UK) и триптическо-соевого агара (TSA), обогащенного кровью овцы (Oxoid, Basingstoke, UK). P. freudenreichii дважды промывали PBS и центрифугировали при 5000×g. После этого бактерии суспендировали в концентрации 1 × 109 КОЕ в PBS для создания живого бактериального инокулята. Бесклеточный супернатант готовили путем фильтрации бульона с бактериальной культурой через мембрану из полиэфирсульфона (PES) размером 0,22 мкм и хранили в одноразовых аликвотах при температуре -20 °C до тех пор, пока не понадобится.
4.2. Культура клеточной линии CRC и МТТ-анализ
Клетки колоректального рака HCT116 были приобретены у ATCC, США. Клетки HCT-116 культивировали в среде DMEM (модифицированная среда Eagle от Dulbecco) при 37 °C с 5% CO2 во влажном сушильном шкафу. Перед пересевом в среду добавляли антибиотики и 10% эмбриональную бычью сыворотку (FBS).
Антипролиферативное действие бесклеточного супернатанта P. freudenreichii против клеток HCT116 проверяли с помощью анализа жизнеспособности клеток МТТ. Клетки высевали на ночь по 5000 клеток на лунку, после чего их подвергали воздействию супернатанта пробиотика в серийных концентрациях (50%, 25%, 12,5%, 6,25% и 3,13%). Затем в качестве стандартного химиотерапевтического препарата использовали 5-фторурацил, приготовленный в различных концентрациях (50, 25, 12,5, 6,25, 3,13, 1,56 и 0,78 мкг/мл), а в качестве отрицательного контроля использовали клетки, обработанные носителем (фосфатно-буферным физраствором). Затем лунки инкубировали при 5% CO2 и 37 °C в течение 72 ч. После этого во все лунки добавили 10 мкл реагента МТТ и повторно инкубировали еще 4 ч. Клетки лизировали с помощью 100 мкл DMSO для выделения кристаллов формазана и измеряли поглощение при 570 нм [43]. Эксперимент проводился в трех повторах.
4.3. Эксперимент in vivo
Данный эксперимент проводился в соответствии с институциональными этическими принципами, и исследование было одобрено Институциональным комитетом по уходу и использованию животных с идентификатором IACUC: 2020-221205/PHARM/R/MAM (2019367). Двадцать самцов крыс SD (9-10 недель) содержались в клетках IVC (3 и 2 крысы на клетку) в стандартных условиях при температуре 22 °C, влажности 75% и цикле свет/темнота 12 часов. Крыс кормили стандартными крысиными гранулами ad libitum. Крысы были разделены на четыре группы, в каждой из которых было по пять крыс, включая контрольную группу. Группе 1 давали фосфатно-буферный физраствор, что является нормальным контролем. Крысам в группах 2-4 подкожно вводили азоксиметан (Sigma-Aldrich, Сент-Луис, МО, США) в дозе 7 мг/кг массы тела один раз в неделю в течение трех недель, чтобы вызвать образование очагов аберрантных крипт, и лечили P. freudenreichii (1 × 109 КОЕ/мл) и 5-фторурацилом (35 мг/кг) в течение пяти недель, как описано в (Таблица 2) [44].
Таблица 2. Группировка подопытных животных.
|
Группы
|
Обработка (лечение, вмешательство)
|
|
Группа 1
Нормальный контроль (NC)
|
Пероральный прием фосфатно-буферного солевого раствора (носитель) 5 дней в неделю в течение 5 недель
|
|
Группа 2
AOM-индуцированный контроль
|
7 мг/кг азоксиметана (АОМ), (в/в) один раз в неделю в течение 3 недель + фосфатно-буферный физраствор (пероральный прием, 5 дней/неделю), начиная за неделю до введения АОМ и продолжая еще 5 недель
|
|
Группа 3
P. freudenreichii (PF) |
7 мг/кг AOM (в/в) один раз в неделю в течение 3 недель + 1 × 109 КОЕ/мл P. freudenreichii (пероральный гаваж, 5 дней/неделю), начиная за неделю до введения AOM и продолжая еще 5 недель
|
|
Группа 4
5-Флуороурацил (5-FU) |
7 мг/кг AOM (в/в) один раз в неделю в течение 3 недель + 5-фторурацил (35 мг/кг, IP, 3 раза в неделю) в течение 5 недель
|
4.4. Исследование очагов аберрантных крипты (ACF)
После пяти недель лечения крыс умерщвляли под наркозом и у всех животных забирали толстую кишку. Фиксированные ткани толстой кишки окрашивали 0,5%-ным раствором метиленового синего в течение 5 мин и проводили макроскопическое исследование толстой кишки по методу Берда [45]. Аберрантные очаги крипт были исследованы и подсчитаны в соответствии с протоколом, описанным McGinley et al. [46]. Вкратце, сумму ACF во всей толстой кишке (от дистального до проксимального конца) подсчитывали в нескольких полях (сегменты длиной 2 см) для каждого образца, и данные представлены в среднем по 5 крысам на группу. ACF отличались от нормальных крипт их большим размером, наличием перикриптальной зоны и увеличенным расстоянием от базальной до пластинчатой поверхности клеток. Количество и кратность ACF на каждом сегменте толстой кишки исследовали под световым микроскопом.
4.5. Гистологическое исследование толстой кишки
Собранные ткани толстой кишки у всех животных фиксировали в забуференном формалине (10%), гистологически обрабатывали и заливали в парафин. Для окрашивания срезов толстой кишки использовали эозин и гематоксилин. Под световым микроскопом каждый ACF, обнаруженный в толстой кишке обработанных групп, был исследован на предмет его характеристик и сравнен с нормальным необработанным контролем [47].
4.6. Выделение ДНК
Для изучения влияния пробиотиков на разнообразие микробиоты кишечника крыс общую микробную ДНК выделяли из фекалий с помощью набора DNA Stool QIAamp (Qiagen, Хильден, Германия), процедуры проводили в соответствии с инструкциями производителя [48]. Качество ДНК контролировали с помощью 1% агарозного геля и NanoDrop, затем концентрацию корректировали до 1 мкг/мл с помощью воды, не содержащей нуклеазу [49].
Чтобы охарактеризовать кишечную микробиоту обработанных и необработанных крыс, было проведено секвенирование 16 S рРНК для образцов кала, полученных от крыс. Прямой праймер 515F (5'-GTGCCAGCMGCCGCGGTAA-3') и обратный праймер 806 R (5'-GGACTACHVGGGTWTCTAAT-3') были использованы в качестве матрицы для амплификации отдельной области V4 бактериальной 16s рРНК. Всего было приготовлено 20 мкл смеси, содержащей 5 × FastPfu Buffer (4 мкл), 5 мкМ каждого праймера (0,8 мкл), 2,5 мМ dNTPs (2 мкл), FastPfu полимеразу (0,4 мкл) и 10 нг шаблонной ДНК. Протокол ПЦР амплификации начинался с начальной денатурации в течение 2 мин при 95 °C, затем следовала денатурация в течение 30 с при 95 °C (каждый цикл в течение 25 циклов), отжиг в течение 30 с при 55 °C, стадия удлинения в течение 30 с при 72 °C и стадия окончательного удлинения, которая проводилась при 72 °C в течение 5 мин. С помощью программного пакета QIIME2 (версия 1.9.1; http://qiime.org/scripts/assigntaxonomy.html, доступ получен 19 июня 2021 года) необработанные чтения секвенирования гена 16S рРНК FASTQ были демультиплексированы и отфильтрованы по качеству на основе перекрывающихся связей; парные чтения были объединены в одно чтение. Фильтрация проводилась по следующим критериям: 300-пунктовые считывания усекались на любом участке со средним баллом качества 20 в скользящем окне 50 п.н., а считывания короче 50 п.н. отбрасывались. Точное совпадение кода, несоответствие двух нуклеотидов в сопоставлении праймеров и считывания с неоднозначными символами были удалены, и только последовательности, которые перекрывались более чем на 10 п.н., были собраны на основе их перекрывающихся последовательностей. Считывания были сгруппированы с использованием базы данных функциональных генов (FGR; Версия 7.3; http://fungene.cme.msu.edu/, дата обращения 19 июня 2021 г.) и база данных GreenGenes (версия 13.5; http://greengenes.secondgenome.com /, дата обращения 19 июня 2021 года). Чтения, которые не удалось организовать, были исключены. Объединенные данные были использованы для кластеризации оперативных таксономических единиц (OTU), таксономической классификации и оценки разнообразия сообществ с использованием UPARSE (версия 7.1; http://drive5.com/uparse/, доступ получен 19 июня 2021 г.), и химерные последовательности были идентифицированы и удалены с помощью UCHIME. Сообщество микроорганизмов использовалось для сравнения сходства или несходства различных групп и корреляции между развитием микроорганизмов и факторами окружающей среды, а также для филогенетического анализа и анализа разнообразия альфа- и бета-анализа [50].
4.8. Измерение перекисного окисления липидов и окислительного стресса
После сбора органов образцы толстой кишки промывали холодным PBS. Гомогенаты толстой кишки (10% w/v) гомогенизировали в холодном PBS (pH 7,4) с помощью гомогенизатора со льдом. Образцы гомогената центрифугировали при 4500 об/мин в течение 15 мин при 4 °C в охлажденной центрифуге, затем удаляли остатки клеток. После этого измеряли содержание белка, а супернатанты использовали для оценки уровня перекисного окисления липидов с помощью набора для определения малондиальдегида (Cayman Chemical, MI, USA). Вкратце, к образцам/стандартам добавляли раствор SDS. Затем к смеси добавляли 4 мл цветного реагента и как следует перемешивали. На 1 ч пробирки со стандартным раствором и образцами погружали в кипящую воду. Чтобы подавить реакции, все пробирки инкубировали на ледяной бане в течение 10 минут. После этого все образцы центрифугировали при 1600×g в течение 10 мин при 4°C. В 96-луночный планшет загружали дубликаты образцов или стандартов и измеряли оптическую плотность с помощью планшет-ридера при 532 нм.
4.9. Статистический анализ
Статистический пакет для социальных наук версии 27.0 для Windows использовался для проведения статистического анализа. Однофакторный дисперсионный анализ (ANOVA) с последующим апостериорным тестом множественных сравнений Тьюки использовался для определения статистической значимости результатов. Для параметров in vitro данные были выражены как среднее значение ± стандартная ошибка среднего (SEM) для трех биологических повторов, тогда как для эксперимента in vivo данные были представлены как среднее значение ± SEM для пяти крыс. Результаты считались статистически значимыми при p-значении менее 0,05.
5. Выводы
Данное исследование открывает новые возможности для расширения использования P. freudenreichii. FDA считает его безвредным бактериальным пробиотиком и в настоящее время использует в качестве одного из штаммов в некоторых пробиотических добавках. Он используется при производстве сыра, а также может применяться при производстве других молочных продуктов, таких как молоко и йогурт. Наше исследование подчеркивает потенциальное профилактическое действие P. freudenreichii против колоректального рака, что может стимулировать дальнейшее изучение его биоактивных метаболитов с помощью метаболомики для понимания молекулярных механизмов, лежащих в основе его действия. Кроме того, необходимо провести дополнительные клинические испытания с использованием P. freudenreichii для подтверждения его полезных свойств и оценки клинической эффективности у пациентов с колоректальным раком.
Источник:
- Ifeoma Julieth Dikeocha, et. al.
- Investigation into the Potential Role of Propionibacterium freudenreichii in Prevention of Colorectal Cancer and Its Effects on the Diversity of Gut Microbiota in Rats
- Int. J. Mol. Sci. 2023, 24(9), 8080
См. дополнительно:
К разделу: Роль микробиома в развитии и терапии рака
Литература
- Ferlay, J.; Colombet, M.; Soerjomataram, I.; Parkin, D.M.; Piñeros, M.; Znaor, A.; Bray, F. Cancer statistics for the year 2020: An overview. Int. J. Cancer 2021, 149, 778–789. [Google Scholar] [CrossRef] [PubMed]
- Gandomani, H.S.; Aghajani, M.; Mohammadian-Hafshejani, A.; Tarazoj, A.A.; Pouyesh, V.; Salehiniya, H. Colorectal cancer in the world: Incidence, mortality and risk factors. Biomed. Res. Ther. 2017, 4, 1656–1675. [Google Scholar] [CrossRef]
- Patel, S.G.; Ahnen, D.J. Colorectal cancer in the young. Curr. Gastroenterol. Rep. 2018, 20, 12. [Google Scholar] [CrossRef] [PubMed]
- Hill, C.; Guarner, F.; Reid, G.; Gibson, G.R.; Merenstein, D.J.; Pot, B.; Morelli, L.; Canani, R.B.; Flint, H.J.; Salminen, S.; et al. The international scientific association for probiotics and prebiotics consensus statement on the scope and appropriate use of the term probiotic. Nat. Rev. Gastroenterol. Hepatol. 2014, 11, 506–514. [Google Scholar] [CrossRef]
- Zaharuddin, L.; Mokhtar, N.M.; Nawawi, K.N.M.; Ali, R.A.R. A randomized double-blind placebo-controlled trial of probiotics in post-surgical colorectal cancer. BMC Gastroenterol. 2019, 19, 131. [Google Scholar] [CrossRef]
- Kakaei, F.; Shahrasbi, M.; Kermani, T.A.; Taheri, S.; Tarvirdizade, K. Assessment of probiotic effects on colorectal surgery complications: A double blinded, randomized clinical trial. Biomed. Res. Ther. 2019, 6, 3067–3072. [Google Scholar] [CrossRef]
- Franko, J.; Raman, S.; Krishnan, N.; Frankova, D.; Tee, M.C.; Brahmbhatt, R.; Goldman, C.D.; Weigel, R.J. Randomized trial of perioperative probiotics among patients undergoing major abdominal operation. J. Am. Coll. Surg. 2019, 229, 533. [Google Scholar] [CrossRef]
- Dikeocha, I.J.; Al-Kabsi, A.M.; Eid, E.E.M.; Hussin, S.; Alshawsh, M.A. Probiotics supplementation in patients with colorectal cancer: A systematic review of randomized controlled trials. Nutr. Rev. 2021, 80, 22–49. [Google Scholar] [CrossRef]
- Scholz, C.F.; Kilian, M. The natural history of cutaneous propionibacteria, and reclassification of selected species within the genus propionibacterium to the proposed novel genera acidipropionibacterium gen. Nov., cutibacterium gen. Nov. And pseudopropionibacterium gen. Nov. Int. J. Syst. Evol. Microbiol. 2016, 66, 4422–4432. [Google Scholar] [CrossRef]
- De Rezende Rodovalho, V.; Rodrigues, D.L.N.; Jan, G.; Le Loir, Y.; Azevedo, V.A.D.C.; Guédon, E. Propionibacterium freudenreichii: General characteristics and probiotic traits. In Prebiotics Probiotics-Food Health; IntechOpen: London, UK, 2021. [Google Scholar]
- Thierry, A.; Deutsch, S.-M.; Falentin, H.; Dalmasso, M.; Cousin, F.; Jan, G. New insights into physiology and metabolism of propionibacterium freudenreichii. Int. J. Food Microbiol. 2011, 149, 19–27. [Google Scholar] [CrossRef]
- De Melo Pereira, G.V.; de Oliveira Coelho, B.; Magalhães Júnior, A.I.; Thomaz-Soccol, V.; Soccol, C.R. Thomaz-Soccol and C. R. Soccol. How to select a probiotic? A review and update of methods and criteria. Biotechnol. Adv. 2018, 36, 2060–2076. [Google Scholar] [CrossRef] [PubMed]
- Rabah, H.; Carmo, F.L.R.D.; Jan, G. Dairy propionibacteria: Versatile probiotics. Microorganisms 2017, 5, 24. [Google Scholar] [CrossRef] [PubMed]
- Lan, A.; Bruneau, A.; Philippe, C.; Rochet, V.; Rouault, A.; Hervé, C.; Roland, N.; Rabot, S.; Jan, G. Survival and metabolic activity of selected strains of propionibacterium freudenreichii in the gastrointestinal tract of human microbiota-associated rats. Br. J. Nutr. 2007, 97, 714–724. [Google Scholar] [CrossRef]
- Uchida, M.; Tsuboi, H.; Arita, M.T.; Nemoto, A.; Seki, K.; Tsunoo, H.; Martyres, S.; Roberts, A. Safety of high doses of propionibacterium freudenreichii et-3 culture in healthy adult subjects. Regul. Toxicol. Pharmacol. 2011, 60, 262–267. [Google Scholar] [CrossRef] [PubMed]
- Jan, G.; Leverrier, P.; Proudy, I.; Roland, N. Survival and beneficial effects of propionibacteria in the human gut: In vivo and in vitro investigations. Le Lait 2002, 82, 131–144. [Google Scholar] [CrossRef]
- Meile, L.; Le Blay, G.; Thierry, A. Safety assessment of dairy microorganisms: Propionibacterium and bifidobacterium. Int. J. Food Microbiol. 2008, 126, 316–320. [Google Scholar] [CrossRef]
- Ammor, M.S.; Flórez, A.B.; Mayo, B. Antibiotic resistance in non-enterococcal lactic acid bacteria and bifidobacteria. Food Microbiol. 2007, 24, 559–570. [Google Scholar] [CrossRef]
- Jan, G.; Belzacq, A.S.; Haouzi, D.; Rouault, A.; Metivier, D.; Kroemer, G.; Brenner, C. Propionibacteria induce apoptosis of colorectal carcinoma cells via short-chain fatty acids acting on mitochondria. Cell Death Differ. 2002, 9, 179–188. [Google Scholar] [CrossRef]
- Cousin, F.; Foligne, B.; Deutsch, S.-M.; Massart, S.; Parayre-Breton, S.; Le Loir, Y.; Boudry, G.; Jan, G. Assessment of the probiotic potential of a dairy product fermented by propionibacterium freudenreichii in piglets. J. Agric. Food Chem. 2012, 60, 7917–7927. [Google Scholar] [CrossRef]
- Lan, A.; Lagadic-Gossmann, D.; Lemaire, C.; Brenner, C.; Jan, G. Acidic extracellular ph shifts colorectal cancer cell death from apoptosis to necrosis upon exposure to propionate and acetate, major end-products of the human probiotic propionibacteria. Apoptosis 2007, 12, 573–591. [Google Scholar] [CrossRef]
- Lan, A.; Bruneau, A.; Bensaada, M.; Philippe, C.; Bellaud, P.; Rabot, S.; Jan, G. Increased induction of apoptosis by propionibacterium freudenreichii tl133 in colonic mucosal crypts of human microbiota-associated rats treated with 1, 2-dimethylhydrazine. Br. J. Nutr. 2008, 100, 1251–1259. [Google Scholar] [CrossRef]
- He, M.; Shi, B. Gut microbiota as a potential target of metabolic syndrome: The role of probiotics and prebiotics. Cell Biosci. 2017, 7, 54. [Google Scholar] [CrossRef]
- Sobhani, I.; Tap, J.; Roudot-Thoraval, F.; Roperch, J.P.; Letulle, S.; Langella, P.; Corthier, G.; Van Nhieu, J.T.; Furet, J.P. Microbial dysbiosis in colorectal cancer (crc) patients. PLoS ONE 2011, 6, e16393. [Google Scholar] [CrossRef]
- Villalobos, C.; Hernández-Morales, M.; Gutiérrez, L.G.; Núñez, L.J.C.C. Trpc1 and orai1 channels in colon cancer. Cell Calcium 2019, 81, 59–66. [Google Scholar] [CrossRef] [PubMed]
- Eslami, M.; Yousefi, B.; Kokhaei, P.; Hemati, M.; Nejad, Z.R.; Arabkari, V.; Namdar, A. Importance of probiotics in the prevention and treatment of colorectal cancer. J. Cell. Physiol. 2019, 234, 17127–17143. [Google Scholar] [CrossRef]
- Ambalam, P.; Raman, M.; Purama, R.K.; Doble, M. Probiotics, prebiotics and colorectal cancer prevention. Best Pract. Res. Clin. Gastroenterol. 2016, 30, 119–131. [Google Scholar] [CrossRef] [PubMed]
- Cousin, F.J.; Jouan-Lanhouet, S.; Dimanche-Boitrel, M.-T.; Corcos, L.; Jan, G. Milk fermented by propionibacterium freudenreichii induces apoptosis of hgt-1 human gastric cancer cells. PLoS ONE 2012, 7, e31892. [Google Scholar] [CrossRef]
- Cousin, F.J.; Jouan-Lanhouet, S.; Théret, N.; Brenner, C.; Jouan, E.; Le Moigne-Muller, G.; Dimanche-Boitrel, M.-T.; Jan, G. The probiotic propionibacterium freudenreichii as a new adjuvant for trail-based therapy in colorectal cancer. Oncotarget 2016, 7, 7161. [Google Scholar] [CrossRef] [PubMed]
- Illikoud, N.; Carmo, F.L.R.D.; Daniel, N.; Jan, G.; Gagnaire, V. Development of innovative fermented products by exploiting the diversity of immunomodulatory properties and fermentative activity of lactic and propionic acid bacteria. Food Res. Int. 2023, 166, 112557. [Google Scholar] [CrossRef]
- Saki, E.; Yazan, L.S.; Ali, R.M.; Ahmad, Z. Chemopreventive effects of germinated rough rice crude extract in inhibiting azoxymethane-induced aberrant crypt foci formation in sprague-dawley rats. BioMed Res. Int. 2017, 2017, 9517287. [Google Scholar] [CrossRef]
- Clapper, M.L.; Chang, W.-C.L.; Cooper, H.S. Dysplastic aberrant crypt foci: Biomarkers of early colorectal neoplasia and response to preventive intervention. Cancer Prev. Res. 2020, 13, 229–240. [Google Scholar] [CrossRef]
- Mehta, A.; Patel, B.M. Therapeutic opportunities in colon cancer: Focus on phosphodiesterase inhibitors. Life Sci. 2019, 230, 150–161. [Google Scholar] [CrossRef]
- Sahebi, Z.; Emtyazjoo, M.; Mostafavi, P.G.; Bonakdar, S. Promising chemoprevention of colonic aberrant crypt foci by portunus segnis muscle and shell extracts in azoxymethane-induced colorectal cancer in rats. Anti-Cancer Agents Med. Chem. (Former. Curr. Med. Chem.-Anti-Cancer Agents) 2020, 20, 2041–2052. [Google Scholar] [CrossRef] [PubMed]
- Bird, R.P.; Good, C.K. The significance of aberrant crypt foci in understanding the pathogenesis of colon cancer. Toxicol. Lett. 2000, 112, 395–402. [Google Scholar] [CrossRef] [PubMed]
- Ribeiro, C.C.D.; Silva, R.M.; Campanholo, V.M.D.L.P.; Ribeiro, D.A.; Paiotti, A.P.R.; Forones, N.M. Effects of grape juice in superoxide dismutase and catalase in colorectal cancer carcinogenesis induced by azoxymethane. Cancer Prev. Res. 2018, 19, 2839. [Google Scholar]
- Ogbuagu, N.E.; Aluwong, T.; Ayo, J.O.; Sumanu, V.O. Effect of fisetin and probiotic supplementation on erythrocyte osmotic fragility, malondialdehyde concentration and superoxide dismutase activity in broiler chickens exposed to heat stress. J. Vet. Med. Sci. 2018, 80, 1895–1900. [Google Scholar] [CrossRef] [PubMed]
- Heshmati, J.; Farsi, F.; Shokri, F.; Rezaeinejad, M.; Almasi-Hashiani, A.; Vesali, S.; Sepidarkish, M. A systematic review and meta-analysis of the probiotics and synbiotics effects on oxidative stress. J. Funct. Foods 2018, 46, 66–84. [Google Scholar] [CrossRef]
- Fong, W.; Li, Q.; Yu, J. Gut microbiota modulation: A novel strategy for prevention and treatment of colorectal cancer. Oncogene 2020, 39, 4925–4943. [Google Scholar] [CrossRef]
- Håkansson, Å.; Bränning, C.; Molin, G.; Adawi, D.; Hagslätt, M.-L.; Jeppsson, B.; Nyman, M.; Ahrne, S.J.P.O. Blueberry husks and probiotics attenuate colorectal inflammation and oncogenesis, and liver injuries in rats exposed to cycling dss-treatment. PLoS ONE 2012, 7, e33510. [Google Scholar] [CrossRef]
- Li, J.; Sung, C.Y.J.; Lee, N.; Ni, Y.; Pihlajamäki, J.; Panagiotou, G.; El-Nezami, H. Probiotics modulated gut microbiota suppresses hepatocellular carcinoma growth in mice. Proc. Natl. Acad. Sci. 2016, 113, E1306–E1315. [Google Scholar] [CrossRef]
- Purama, R.K.; Raman, M.; Ambalam, P.; Pithva, S.; Kothari, C.; Doble, M. Prebiotics and probiotics in altering microbiota: Implications in colorectal cancer. In Immunity and Inflammation in Health and Disease; Elsevier: Amsterdam, The Netherlands, 2018; pp. 403–413. [Google Scholar]
- Dallal, M.M.S.; Mojarrad, M.; Baghbani, F.; Raoofian, R.; Mardaneh, J.; Salehipour, Z. Effects of probiotic lactobacillus acidophilus and lactobacillus casei on colorectal tumor cells activity (caco-2). Arch. Iran. Med. 2015, 18. [Google Scholar]
- Almagrami, A.A.; Alshawsh, M.A.; Saif-Ali, R.; Shwter, A.; Salem, S.D.; Abdulla, M.A. Evaluation of chemopreventive effects of acanthus ilicifolius against azoxymethane-induced aberrant crypt foci in the rat colon. PLoS ONE 2014, 9, e96004. [Google Scholar] [CrossRef] [PubMed]
- Bird, R.P. Role of aberrant crypt foci in understanding the pathogenesis of colon cancer. Cancer Lett. 1995, 93, 55–71. [Google Scholar] [CrossRef] [PubMed]
- McGinley, J.N.; Thompson, M.D.; Thompson, H.J. A method for serial tissue processing and parallel analysis of aberrant crypt morphology, mucin depletion, and beta-catenin staining in an experimental model of colon carcinogenesis. Biol. Proced. Online 2010, 12, 9032. [Google Scholar] [CrossRef]
- Jacouton, E.; Chain, F.; Sokol, H.; Langella, P.; Bermúdez-Humarán, L.G. Probiotic strain lactobacillus casei bl23 prevents colitis-associated colorectal cancer. Front. Immunol. 2017, 8, 1553. [Google Scholar] [CrossRef] [PubMed]
- Chen, P.; Yang, S.; Hu, C.; Zhao, Z.; Liu, J.; Cheng, Y.; Wang, S.; Chen, Q.; Yu, P.; Zhang, X.; et al. Sargassum fusiforme polysaccharide rejuvenat es the small intestine in mice through altering its physiol ogy and gut microbiota composition. Curr. Mol. Med. 2017, 17, 350–358. [Google Scholar] [CrossRef] [PubMed]
- Kuugbee, E.D.; Shang, X.; Gamallat, Y.; Bamba, D.; Awadasseid, A.; Suliman, M.A.; Zang, S.; Ma, Y.; Chiwala, G.; Xin, Y.; et al. Structural change in microbiota by a probiotic cocktail enhances the gut barrier and reduces cancer via tlr2 signaling in a rat model of colon cancer. Dig. Dis. Sci. 2016, 61, 2908–2920. [Google Scholar] [CrossRef]
- Dikeocha, I.J.; Al-Kabsi, A.M.; Chiu, H.T.; Alshawsh, M.A. Faecalibacterium prausnitzii ameliorates colorectal tumorigenesis and suppresses proliferation of HCT116 colorectal cancer cells. Biomedicines 2022, 10, 1128. [Google Scholar] [CrossRef]
Комментарии
Комментариев пока нет