ООО "ПРОПИОНИКС"
| пн-пт с 09:00 до 18:00 | |
Иммобилизация пробиотических микроорганизмов
Иммобилизация клеток пробиотических микроорганизмов

Технологии иммобилизации в производстве пробиотических продуктов питания

СОДЕРЖАНИЕ:
- 1. Введение
- Таблица 1. Наиболее распространенные микроорганизмы, изученные на предмет пробиотических свойств.
- Таблица 2. Наиболее важные полезные эффекты некоторых пробиотиков
- 2. Критерии культуры, используемой в качестве пробиотика
- Таблица 3. Критерии, используемые для определения пробиотического микроорганизма.
- 2.1. Критерии безопасности.
- 2.2. Функциональные Критерии.
- 2.3. Технологические критерии.
- 3. Технологии иммобилизации и инкапсуляции
- 3.1. Методы иммобилизации и инкапсуляции.
- Рисунок 1. Основные методы иммобилизации клеток [26].
- Таблица 4: Необходимые условия для поддержки иммобилизации и преимущества иммобилизации клеток.
- 3.2. Преимущества иммобилизации клеток.
- 4. Применение технологии иммобилизации в производстве пробиотических продуктов питания
- Таблица 5. характерные примеры применения иммобилизации пробиотических клеток в производстве пищевых продуктов.
- 4.1. Микрокапсулирование на биополимерах.
- 4.1.1. Альгинаты.
- Рисунок 2. Стадии экструзионных и эмульсионных процессов и химическая структура альгинатных остатков, а также принципиальная схема микроорганизмов и гидрогелей.
- 4.1.2. Молочные и сывороточные белковые гели.
- 4.2. Натуральные опоры.
- 5. Выводы и перспективы на будущее
- Доп. информация и литература
Были предложены и испытаны различные методы поддержки и иммобилизации / инкапсуляции для применения в производстве функциональных пищевых продуктов. В настоящем обзоре обсуждается использование пробиотических микроорганизмов для производства новых пищевых продуктов, а также анализируются преимущества и критерии использования пробиотических культур. Описываются способы иммобилизации / инкапсуляции в пищевой промышленности, направленные на продление жизнеспособности клеток, а также дается оценка их потенциального будущего воздействия.
1. Введение
Пробиотики быстро завоевали интерес в области самопомощи и комплементарной медицины под общим термином «функциональные продукты питания». Современные потребители все больше интересуются своим личным здоровьем, особенно продуктами питания, которые способны предотвращать и/или лечить болезни. Микробы использовались в течение многих лет в пищевой и алкогольной ферментации, но только недавно подверглись научной проверке, чтобы изучить их возможную пользу для здоровья.
Слово «пробиотик» происходит от греческих слов «про» и «биотик», что означает «для жизни». Понятие «пробиотики» появилось очень давно. Нобелевский лауреат Илья Мечников был первым микробиологом в начале XX века, который предположил, что долговечность болгарских крестьян может быть связана с их большим потреблением кислого молока, содержащего Lactobacillus bulgaricus. Наиболее часто используемое определение для пробиотиков исходит от Фуллера (Fuller) в 1989 году, определяющего, что «пробиотики - это живые микробные пищевые добавки, которые благотворно влияют на животное-хозяина, улучшая его микробный баланс кишечника» [1]. Салминен (Salminen) [2] изменил термин на «пробиотики - препараты микробных клеток или компоненты микробных клеток, которые оказывают благотворное влияние на здоровье и благополучие хозяина». Согласно этому определению, пробиотики не обязательно должны быть жизнеспособными, так как было доказано, что даже нежизнеспособные формы оказывают воздействие на здоровье [3]. Сегодня термин «пробиотик» относится к «живым микроорганизмам, которые при введении в адекватных количествах оказывают благотворное физиологическое воздействие на хозяина», согласно данным Продовольственной и сельскохозяйственной организации (Food and Agriculture Organization) и Всемирной Организации Здравоохранения [4].
Различные микроорганизмы были изучены на предмет потенциального пробиотического эффекта. Большинство штаммов микроорганизмов с пробиотической активностью относятся в первую очередь к родам лактобацилл (Lactobacillus) и бифидобактерий (Bifidobacterium). Однако потенциальные пробиотические роли других микробов также находятся в стадии изучения. В таблице 1 представлены наиболее распространенные микроорганизмы, исследованные на пробиотические свойства.
|
Таблица 1. Наиболее распространенные микроорганизмы, изученные на предмет пробиотических свойств.
|
|
|
Lactobacilli
|
Bifidobacteria
|
|
L. acidophilus
|
B. bifidum
|
|
L. casei
|
B. breve
|
|
L. rhamnosus
|
B. infantis
|
|
L. reuteri
|
B. longum
|
|
L. plantarum
|
B. lactis
|
|
L. fermentum
|
B. thermophilum
|
|
L. johnsonii
|
B. adolescents
|
|
L. helveticus
|
B. animalis
|
|
L. farciminis
|
Другие бактерии
|
|
L. curvatus
|
Enterococcus faecium
|
|
L. brevis
|
Escherichia coli Nissle 1917
|
|
L. gasseri
|
Lactococcus lactis
|
|
L. salivarius
|
Propionibacterium freudenreichii
|
|
L. cellobiosus
|
Bacillus clausii
|
|
|
Bacillus oligonitrophilis
|
|
Дрожжи
|
|
|
Saccharomyces boulardii
|
|
|
Saccharomyces cerevisiae
|
|
Иммобилизация / инкапсуляция пробиотиков - это захватывающая область пищевой технологии, которая быстро возникла и развивалась в последнее десятилетие. Наиболее эффективным применением технологии иммобилизации пробиотиков является контролируемая и непрерывная доставка клеток в кишечник. Потенциальное преимущество этой терапевтической стратегии заключается в поддержании большей жизнеспособности клеток, несмотря на кислотность желудка. В своем жизнеспособном состоянии пробиотики оказывают благотворное воздействие на здоровье хозяина.
Существует все больше научных доказательств в поддержку концепции, что поддержание здоровой кишечной микробиоты может обеспечить защиту от желудочно-кишечных расстройств, таких как желудочно-кишечные инфекции и воспалительные заболевания кишечника [5-7]. Использование пробиотических бактериальных культур может стимулировать рост предпочтительных микроорганизмов, вытеснять потенциально вредные бактерии и усиливать естественные защитные механизмы организма [7]. Благотворное влияние потребления пробиотиков также включает в себя повышение биодоступности питательных веществ, уменьшение симптомов непереносимости лактозы, уменьшение появления аллергических симптомов у восприимчивых людей и снижение риска развития некоторых видов рака [5-7]. В таблице 2 обобщены наиболее важные полезные эффекты пробиотиков на человека. Однако механизмы, посредством которых пробиотики оказывают свое действие, в значительной степени неизвестны и могут включать модификацию рН кишечника, антагонизм патогенов через продукцию антимикробных и антибактериальных соединений, конкуренцию за рецепторные участки патогена и за доступные питательные вещества и факторы роста, стимуляцию иммуномодулирующих клеток и продукцию лактазы [8].
Общая цель настоящего обзора – анализ и оценка данных по технологии иммобилизации пробиотических микроорганизмов для применения в производстве пищевых продуктов.
|
Таблица 2. Наиболее важные полезные эффекты некоторых пробиотиков
|
|||||
|
Благоприятное воздействие
|
Пробиотический микроорганизм
|
Тип испытания
|
Результат
|
Ref |
|
|
Метаболизм
|
Переваривание лактозы; Метаболизм липидов; Оксалатный обмен
|
Lactobacillus casei Shirota
Lactobacillus plantarum,
Lactobacillus curvatus
Lactobacillus casei
|
Целевая группа пациентов, нарушение пищеварения лактозы;
Рандомизированная целевая группа пациентов;
И пациенты с камнеобразованием.
|
Lactobacillus casei Shirota, по-видимому, улучшает симптомы у пациентов с непереносимостью лактозы. Lactobacillus plantarum и Lactobacillus curvatus снижают уровень холестерина в плазме и печени. Обработанные Lactobacillus casei снижают эффект при экскреции оксалатов с мочой.
|
46
47
48
|
|
Хронические кишечные воспалит. и функц. нарушения
|
ВЗК:
Болезнь Крона;
Язвенный колит;
Синдром раздраженного кишечника (СРК)
|
Saccharomyces boulardii Комбинированные лактобациллы и энтерококки
Lactobacillus plantarum
|
Пилотное исследование;
Рандомизированное двойное слепое, плацебо-контролируемое;
И параллельное исследование.
|
Saccharomyces boulardii контролировал воспаление и способствовал восстановлению эпителия. Эффективное лечение путем опосредования иммунологического ответа Lactobacillus plantarum обеспечило эффективное облегчение симптомов
|
49
50
51
|
|
Аллерг. заболевания
|
Экзема; Атопический дерматит;
Аллергический ринит;
Астма
|
Lactobacillus rhamnosus Lactobacillus plantarum Lactobacillus salivarius Lactobacillus gasseri
|
Рандомизированный, двойной слепой, плацебо-контролируемый;
Рандомизированный, двойной слепой, плацебо-контролируемый;
Рандомизированный, двойной слепой контроль;
Рандомизированный, плацебо-контролируемый.
|
Lactobacillus rhamnosus показал защитный эффект против экземы;
Lactobacillus plantarum был полезен при лечении детского атоп. дерматита;
Lactobacillus salivarius уменьшает симптомы и употребление наркотиков у детей;
Lactobacillus gasseri имел клинические преимущества при лечении астмы.
|
52
53
54
55
|
|
Снижение факторов риска заражения
|
Инфекционная диарея; Некротический энтероколит (младенцы);
Helicobacter pylori
|
Lactobacillus acidophilus, Lactobacillus rhamnosus, Bifidobacterium bifidum и Bifidobacterium longum;
Lactobacillus acidophilus, Bifidobacterium infantis, Lactobacillus acidophilus, Lactobacillus rhamnosus, Lactobacillus bulgaricus, Lactobacillus casei;
Streptococcus thermophilus и Bifidobacterium infantis,
Bifidobacterium breve.
|
Рандомизированный, одиночный слепой; Рандомизированный, плацебо-контролируемый; Рандомизированный, двойной слепой, плацебо-контролируемый
|
Синбиотическая смесь показала снижение продолжительности диареи.
Защитный эффект при клиническом NEC.
Положительное влияние на эрадикацию инфекции H. pylori.
|
56
57
58
|
|
Инфекции дыхательных путей
|
Инфекции уха, носа и горла
|
Lactobacillus rhamnosus GG
|
Рандомизированный, двойной слепой и плацебо-контролируемый
|
Lactobacillus rhamnosus GG снижает риск раннего острого отита, применение антибиотиков и риск повторных респираторных инфекций в течение первого года жизни.
|
59
|
|
Злока-чественность
|
Рак шейки матки
|
Bifidobacterium adolescentis
|
Проспективное контролируемое пилотное исследование
|
Пробиотические исследования способствовали клиренсу цитологических нарушений, связанных с HPV
|
32
|
2. Критерии культуры, используемой в качестве пробиотика.
В процессе отбора пробиотических микроорганизмов необходимо учитывать несколько аспектов, включая безопасность, функциональные и технологические характеристики. Многие микроорганизмы могут рассматриваться как потенциальные пробиотики, но лишь немногие способны удовлетворять необходимым критериям.
Аспекты безопасности включают в себя такие характеристики, как происхождение (здоровый желудочно-кишечный тракт человека), непатогенность, расстройства пищеварения и характеристики устойчивости к неантибиотику.
Функциональные аспекты включают жизнеспособность и персистенцию в желудочно-кишечном тракте (ЖКТ), выживаемость при пищеварительных стрессах [9], иммуномодуляцию, антагонистические и антимутагенные свойства [10, 11].
Тщательный скрининг пробиотических штаммов на предмет их технологической пригодности также может позволить отобрать штаммы с наилучшими производственными и технологическими характеристиками пищевых продуктов. Более того, они не должны производить посторонних запахов [12].
Обзор наиболее значимых критериев для определения пробиотического микроорганизма представлен в таблице 3.
|
Таблица 3. Критерии, используемые для определения пробиотического микроорганизма.
|
|
|
Критерии безопасности
|
|
|
Функциональные критерии
|
|
|
Технологические критерии
|
|
2.1. Критерии безопасности.
По мнению Управления по контролю за продуктами и лекарствами США, важно, чтобы пробиотики считались «общепризнанными безопасными» (GRAS) организмами для использования человеком [13]. Конгруэнтные аспекты безопасности включают главным образом происхождение штаммов человека, чтобы исключить отрицательные характеристики, такие как вредные эффекты, патогенность, расстройства пищеварения и устойчивость к антибиотикам. В частности:
(1) настоятельно рекомендуется, чтобы штаммы, используемые для продуктов, предназначенных для людей, были человеческого происхождения. Кроме того, ожидается, что пробиотический штамм будет функционировать лучше в аналогичной среде, из которой он был первоначально изолирован (например, желудочно-кишечный тракт человека). Как правило, пробиотики должны быть выделены из желудочно-кишечного тракта здорового человека. Также считается, что критерии безопасности зависят от нашего опыта в ферментации пищевых продуктов;
(2) не должно быть никакой связи с болезнью. Большинство кишечных микроорганизмов не считаются патогенными для здоровых людей, но некоторые кишечные бактерии являются потенциально патогенными. На их рост и метаболизм влияет нормальная иммунная система пищеварительного тракта. Патогенные микробы могут потенциально вызывать инфекцию даже у здорового хозяина;
(3) метаболическая активность в пищевой матрице и в кишечнике после потребления является важным критерием безопасности. Например, несмотря на то, что толерантность к солям желчи является существенным критерием отбора потенциальных пробиотических штаммов, активность гидролазы микробных солей желчных кислот считается потенциально вредной для человека-хозяина, и, таким образом, еще не совсем ясно, является ли это на самом деле желательным признаком в пробиотической бактерии [14];
(4) выбранные штаммы не должны нести трансмиссивные (переносимые) гены устойчивости к антибиотикам.
2.2. Функциональные Критерии.
Для выбора пробиотического штамма необходимо учитывать несколько критериев функциональности. Функциональные критерии пробиотиков должны быть установлены на основе как in vitro, так и in vivo анализов, и результаты должны быть также отражены в контролируемых исследованиях на людях. Чтобы обеспечить пользу для здоровья, пробиотики должны быть способны выживать в кислых условиях верхних отделов желудочно-кишечного тракта и размножаться в кишечнике, что не всегда выполняется. Исследования кормления крыс линии Wistar ферментированным молоком, содержащим свободный или иммобилизованный L. casei ATCC 393, показали, что уровень пробиотического штамма в фекалиях и в тканях кишечника резко снижался и не обнаруживался через 48 ч после прекращения введения [15, 16]. По-видимому, ежедневное потребление пробиотических продуктов является необходимым условием для поддержания клеточного уровня в эффективной концентрации, что может быть ценным в пищевой промышленности. Таким образом, продолжающееся существование пробиотического штамма в желудочно-кишечном тракте человека считается важной особенностью.
Выживаемость различных пробиотических штаммов в разных частях желудочно-кишечного тракта может сильно различаться. Некоторые штаммы быстро гибнут в желудке, в то время как другие способны в большом количестве проходить через всю кишку [17]. Бифидобактерии значительно различаются по выживаемости в желудочных соках [18–20] и желчных солях [21, 22], а также по их способности прилипать к эпителиальным клеткам [23, 24]. Кроме того, поскольку жизнеспособные и биологически активные микроорганизмы обычно требуются на целевом участке в организме хозяина, важно, чтобы пробиотики были способны противостоять естественным барьерам хозяина против поглощенных бактерий. Несколько исследований показали, что многим штаммам Bifidobacterium sp. присуще отсутствие способности выживать в суровых условиях кислотности и концентрации желчи, обычно встречающихся в желудочно-кишечном тракте человека [19, 25].
Снижение уровня жизнеспособных клеток не всегда может представлять собой серьезную проблему, так как большое количество исследований сообщают, что нежизнеспособные пробиотики могут также оказывать благотворное влияние на здоровье человека или даже быть более эффективными, чем живые клетки [27, 28]. Например, лиофилизированная термически убитая Лактобацилла (Lactobacillus acidophilus) оказалась более эффективной, чем живые лактобациллы, в лечении хронической диареи [29]. Аналогично, в случае толерантности к лактозе субъектами с дефицитом лактазы жизнеспособные и нежизнеспособные культивируемые молочные продукты демонстрируют сходные эффекты [27]. Аналогично, при лечении острого гастроэнтерита некоторые пробиотики продемонстрировали клиническую эффективность в сокращении продолжительности диареи как в жизнеспособных, так и нежизнеспособных формах [27].
С другой стороны, поддержание жизнеспособности клеток является необходимым условием для профилактики и/или лечения многих заболеваний; то есть для восстановления и поддержания нормальной мочеполовой флоры у женщин требовалась суточная доза не менее 108 клеток [30]; в качестве потенциального подхода к лечению атопической экземы и аллергии на коровье молоко предлагалось добавление в детские смеси жизнеспособных, но не инактивированных теплом LGG [31]; для лечения кандидоза требовались Saccharomyces boulardii в жизнеспособной форме, в отличие от молочнокислых бактерий, показавших эффективность как в жизнеспособной, так и в нежизнеспособной формах [27]; стимуляция иммунной системы человека пероральным введением ферментированного молока или пробиотических культур наблюдалась только у жизнеспособных бактерий [27], эффекты в фекальных бактериальных ферментативных активностях наблюдались после потребления только жизнеспособных бактерий [27] и т.д. Следовательно, связь уровней жизнеспособных клеток с клиническим исходом все еще сомнительна и, по-видимому, зависит от видов микробов и расстройства. Будущая работа должна быть сосредоточена на контролируемых слепых исследованиях для дальнейшего уточнения вопросов, касающихся жизнеспособности пробиотиков во время производства продукта и в организме хозяина, а также для установления необходимой дозы для каждого случая.
Следует также оценить пользу для здоровья потенциальных пробиотических штаммов. Потенциальные преимущества могут варьироваться от поддержания нормальной кишечной флоры [15] до противоопухолевых эффектов [32]. Однако положительная активность может быть специфичной для штамма и может зависеть от пищевой матрицы. Таким образом, необходимы долгосрочные клинические исследования, в которых используются как животные модели, так и люди, чтобы получить полностью доказанные эффекты для здоровья, особенно для здоровых групп населения.
2.3. Технологические критерии.
Несмотря на то, что пробиотический штамм удовлетворяет необходимым критериям безопасности и функциональности, его отбор должен также соответствовать технологическим критериям, поскольку аспекты, связанные с производством и переработкой пробиотических продуктов питания, также очень важны.
Жизнеспособность бактерий часто снижается в процессе производства, распределения и хранения пищевых продуктов. «Нежизнеспособные» культивированные продукты обычно имеют более длительный срок годности и более легкое хранение, что способствует внедрению технологии промышленным сектором, но было заявлено, что только пробиотические продукты с жизнеспособными микроорганизмами оказывают благотворное воздействие на здоровье.
Поскольку настоятельно рекомендуется, чтобы пробиотические продукты содержали достаточное количество живых бактерий (не менее 106-107 КОЕ/г) [33], пищевая промышленность приняла рекомендуемый уровень 106 КОЕ/г пробиотических клеток на момент потребления. Таким образом, ежедневное потребление не менее 108-109 жизнеспособных клеток, которое может быть достигнуто при ежедневном потреблении не менее 100 г пробиотической пищи, было предложено в качестве минимального потребления для обеспечения пробиотического эффекта. Помимо высокой выживаемости, пробиотические культуры также не должны оказывать вредного влияния на сенсорные характеристики, например, обеспечивать неприятный вкус или текстуру.
Многие исследования показали большие колебания и плохую жизнеспособность пробиотических бактерий и особенно бифидобактерий в пищевых продуктах, таких как йогуртовые препараты [34, 35]. Утверждается, что несколько факторов влияют на жизнеспособность культур Bifidobacterium в кисломолочных продуктах, включая кислотность [36], pH [37], концентрацию молочной и уксусной кислот [38], перекись водорода [39] и содержание растворенного кислорода [40]. Чувствительность бифидобактерий к низким значениям рН и перекиси водорода в сочетании с низкой жизнеспособностью в молочных продуктах при хранении при температуре охлаждения остается проблемой в большинстве ферментированных продуктов [19, 39, 41]. Следовательно, промышленный спрос на технологии, обеспечивающие стабильность бифидобактерий в пищевых продуктах, по-прежнему высок, поскольку высокая выживаемость клеток важна как с экономической точки зрения (при высокой стабильности необходимо добавлять меньше клеток в продукт), так и с точки зрения последствий для здоровья, а также вопросов деловой этики (промышленность не должна вводить потребителя в заблуждение, упоминая только наличие пробиотиков без уточнения количества живых бактерий во время потребления). Бифидобактерии также очень чувствительны к параметрам окружающей среды и требуют дорогих сред для размножения и добавления факторов, способствующих росту, из-за их строгих требований к росту [42]. Они в основном продаются через ферментированные молочные продукты, которые хорошо подходят для укрепления здоровья пробиотиками по нескольким причинам. Во-первых, кисломолочные продукты и, в частности, молочные продукты уже имеют положительный имидж для здоровья, и потребители знакомы с тем фактом, что эти продукты содержат живые микроорганизмы [43]. Во-вторых, изображение йогурто-подобных продуктов в качестве здоровой пищи облегчает рекомендацию ежедневного потребления бифидобактерий. Кроме того, бифидобактерии не оказывают отрицательного влияния на вкус или аромат молочных продуктов и не усиливают подкисление в течение срока годности продукта [44]. Наконец, бифидобактерии защищены молочными белками во время пищеварения, что позволяет лучше доставлять их хозяину [45].
Как и для всех кисломолочных продуктов, содержащих живые бактерии, продукты, содержащие бифидобактерии, должны охлаждаться во время хранения, что необходимо как для обеспечения высокой выживаемости, так и для обеспечения стабильности продукта [34].
3. Технологии иммобилизации и инкапсуляции
Термины «иммобилизация» и «инкапсуляция» используются взаимозаменяемо. Иммобилизация относится к захвату материала внутри или по всей матрице, в то время как инкапсуляция - это процесс формирования непрерывного покрытия вокруг внутренней матрицы, которая полностью содержится в стенке капсулы в качестве ядра инкапсулированного материала. В обоих случаях должна быть разрешена двунаправленная диффузия молекул, таких как приток кислорода, питательных веществ и факторов роста, необходимых для клеточного метаболизма и внешней диффузии отходов.
3.1. Методы иммобилизации и инкапсуляции.
Методы иммобилизации часто имитируют природу, так как естественно многие микроорганизмы обладают способностью прилипать и выживать на различных видах поверхностей, и таким образом клетки могут расти в пределах естественных структур.

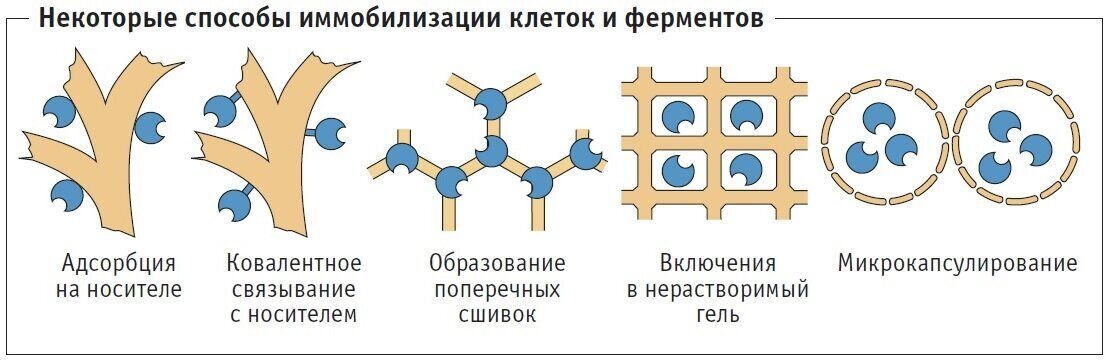
Рисунок 1. Основные методы иммобилизации клеток [26].
Методы иммобилизации можно разделить на следующие четыре основные категории в зависимости от используемого физического механизма (Рис. 1) [26]:
(1) захват внутри пористой матрицы вследствие проникновения клеток до тех пор, пока их подвижность не будет затруднена присутствием других клеток или образованием пористого материала in situ в культуре клеток;
(2) прикрепление или адсорбция на поверхности твердого носителя путем физической адсорбции под действием электростатических сил или путем ковалентного связывания между клеточной мембраной и носителем;
(3) самоагрегация флокуляцией (естественной) или искусственно вызванная сшивающими агентами;
(4) механическое сдерживание за барьером, который может быть либо микропористой мембраной, либо микрокапсулой.
Однако не все носители пригодны для производства продуктов питания. Материал, используемый в качестве носителя, должен (a) обладать химической, физической и биологической стабильностью в процессе обработки и в условиях реакции, (b) обладать достаточной механической прочностью, особенно для его использования в реакторах и промышленности, (c) быть нетоксичным как для иммобилизованной клетки, так и для продукта, и (d) обладать высокой нагрузочной способностью. Другие критерии, такие как физические характеристики (пористость, набухание, сжатие и среднее поведение частиц), а также возможность микробного роста, биоразлагаемости и растворимости, зависят от конкретного применения и должны также приниматься во внимание. В таблице 4 приведены основные предпосылки, касающиеся опор (поддержки) для иммобилизации клеток.
|
Таблица 4: Необходимые условия для поддержки иммобилизации и преимущества иммобилизации клеток. |
|
|
Необходимые условия для поддержки иммобилизации |
Преимущества иммобилизации клеток |
|
(1) адекватно большая поверхность иммобилизационной опоры (поддержки); (2) Простота в обращении и регенерации иммобилизационной опоры (поддержки); (3) Наличие иммобилизационной поддержки; (4) экономическая эффективность процесса поддержки и иммобилизации; (5) принятие потребителями иммобилизационной опоры и предотвращение негативного воздействия на конечный пищевой продукт (например, образования неприятных запахов); (6) сохранение жизнеспособности иммобилизованных клеток; (7) предотвращение негативного влияния иммобилизации клеток на биологическую и метаболическую активность иммобилизованных клеток; (8) пищевая чистота иммобилизационной опоры. |
(1) Длительная активность и стабильность иммобилизованных клеток, поскольку опора иммобилизации может выступать в качестве защитного агента от физико-химических изменений (рН, температура, соли желчных кислот и т. Д.) (2) Более высокая плотность клеток, которая приводит к повышению продуктивности и увеличению поглощения и выхода субстрата. (3) Повышенная устойчивость к высокой концентрации субстрата и ингибированию конечного продукта (4) Снижение риска микробного загрязнения из-за высокой плотности клеток и повышенной активности брожения (5) Способность к низкотемпературной ферментации и / или созреванию для определенных пищевых продуктов (6) Сокращение времени ферментации и созревания при определенных обстоятельствах. |
3.2. Преимущества иммобилизации клеток.
Недавние примеры исследований и применения иммобилизации клеток выявили ряд преимуществ, которые обобщены в таблице 4. Вкратце, иммобилизация клеток обеспечивает защиту клеточного агента от физико-химических изменений, таких как pН, температура, соли желчи [15, 73-76], более высокие плотности клеток и клеточные нагрузки [77], более высокая производительность и эффективность [61], улучшенная утилизация субстрата [61], снижение риска микробного загрязнения [61], а также более быстрые темпы ферментации и созревания, то есть при ферментации пробиотического ферментированного молока и мяса [61, 78].
4. Применение технологии иммобилизации в производстве пробиотических продуктов питания
Продукты, используемые для распространения пробиотиков, обычно являются ферментированными продуктами, даже если пробиотики могут также присутствовать в детских смесях, фруктовых напитках, сывороточных напитках и сладком молоке. Кисломолочные продукты и сыр являются наиболее распространенными продуктами, содержащими пробиотики [33], в то время как йогурты [79], мороженое [80] и ферментированные соевые продукты [81] также хорошо известны на рынке [82]. В ферментированных молочных продуктах чаще всего в качестве пробиотиков используются лактобациллы, такие как Lactobacillus acidophilus и бифидобактерии, часто называемые «бифидус» [83]. Хотя штаммы бифидобактерий и лактобактерий в настоящее время являются наиболее широко используемыми пробиотиками для потребления человеком, другие микроорганизмы, включая Enterococcus, Streptococcus и Propionibacterium, а также некоторые дрожжи, также могут способствовать здоровью кишечника человека [84].
В Европе применение пробиотиков ограничено кисломолочными продуктами. Однако в Соединенных Штатах пробиотики чаще всего встречаются в секторе пищевых добавок и в йогуртах, в то время как в Японии и Корее использование пробиотиков также широко распространено в пищевых продуктах, которые, как утверждается, способствуют процессу пищеварения. С другой стороны, исследования в настоящее время также ориентированы на немолочные продукты, такие как ферментированное мясо и хлебобулочные изделия.
Среди многочисленных опор для иммобилизации только несколько считаются пригодными для производства продуктов питания. Например, неорганические материалы обычно исключаются, потому что они характеризуются как непригодные для питания человека или животных. Вместо этого предпочтительными являются биополимеры и натуральные чистые пищевые носители. Также очень интересно использовать материалы с неперевариваемыми углеводами и исследовать их применение в производстве пробиотических пищевых продуктов.
В таблице 5 представлены примеры применения пробиотической иммобилизации клеток в производстве продуктов питания.
|
Таблица 5. характерные примеры применения иммобилизации пробиотических клеток в производстве пищевых продуктов.
|
|||
|
Поддержка иммобилизации / инкапсуляции
|
Пробиотические микроорганизмы
|
Пробиотический пищевой продукт
|
Ref.
|
|
Альгинатная инкапсуляция
|
Bifidobacterium bifidum, Bifidobacterium infantis
|
Майонез
|
60
|
|
Кусочки яблока, кусочки айвы
|
Lactobacillus casei ATCC 393
|
Ферментированное молоко
|
61
|
|
Яблоко, кусочки груши
|
Lactobacillus casei ATCC 393
|
Сыр
|
62
|
|
Шарики альгината покрытые хитозаном
|
Lactobacillus casei 01, Lactobacillus acidophilus 547
|
Йогурт
|
63
|
|
Растительные волокна
|
Lactobacillus rhamnosus E800, E522 Lactobacillus acidophilus DD910
|
Яблочный сок, хлопья для завтрака с шоколадной глазурью
|
64
|
|
Инкапсулированный альгинатом крахмал, индукцированный кальцием
|
Bifidobacterium lactis DD920
|
Йогурт
|
65
|
|
Микрокапсулирование в альгинате
|
Lactobacillus reuteri
|
Колбасы
|
66
|
|
Сывороточный белок
|
Lactobacillus rhamnosus R011
|
Печенье, замороженный клюквенный сок и овощной сок
|
67
|
|
Кальций альгинат
|
Lactobacillus acidophilus BCRC 10695
|
Томатный сок
|
68
|
|
Кожура дуриана, мангустина и джекфрута
|
Lactobacillus acidophilus FTDC 1331, 2631, 2333, и 1733 и Lactobacillus bulgaricus FTDC 0411
|
Соевое молоко
|
69
|
|
Кальций альгинат
|
Lactobacillus acidophilus ATCC 4356
|
Йогурт
|
[70]
|
|
Альгинат натрия
|
Lactobacillus casei NCDC 298
|
Синбиотический молочный шоколад
|
[71]
|
|
Фрукты, кусочки овса
|
Lactobacillus casei ATCC 393, Lactobacillus delbrueckii ssp. bulgaricus
|
Йогурт
|
[72]
|
|
Зерна пшеницы
|
Lactobacillus casei ATCC 393
|
Ферментированная колбаса
|
[неопуб. результ.]
|
4.1. Микрокапсулирование на биополимерах.
Микроинкапсуляция описана как технология, которая может обеспечить защиту чувствительных культур от высокого уровня кислорода [85], производства и хранения [86], замораживания [87] и во время транзита через желудочно-кишечный тракт человека [88].
4.1.1. Альгинаты.
Альгинаты представляют собой природные линейные сополимеры 1,4-связанных остатков β-D-маннуроновой кислоты (М) и α-L-гулуроновой кислоты (G). Водные растворы полисахаридов образуют гидрогели в присутствии ионов Ca2+, что приводит к физически сшитым полимерам с механическими свойствами, зависящими от альгинатного состава, поскольку в альгинатных полимерах отсутствует регулярный повтор (цепи могут быть описаны как изменяющаяся последовательность областей блоков M, G или MG) [89].
Микросферы альгината кальция могут быть получены как методом экструзии, так и эмульсией [77, 90–93].
Экструзия является старейшим и наиболее распространенным подходом для изготовления капсул с гидроколлоидами, и его можно достичь, просто опуская водный раствор пробиотиков в гелеобразующую ванну. Размер и форма шариков обычно колеблются в пределах 2–5 мм и зависят от диаметра иглы и расстояния свободного падения [90]. Он обладает небольшим диапазоном размеров (меньше, чем эмульсия), но не дает частиц размером менее 300 мкм [92]. Экструзия более популярна, чем эмульсионная технология, благодаря своей простоте, удобству в обращении, низкой стоимости, по крайней мере в небольших масштабах, и щадящим условиям рецептуры, которые обеспечивают поддержание высокой жизнеспособности клеток (80-95%) [90]. Применение технологии струйной резки позволяет сегодня производить микрошарики в больших масштабах [94].
В эмульсионном методе к большому объему масла добавляют небольшой объем суспензии клеточного полимера, и смесь гомогенизируют с образованием эмульсии вода-в-масле. Очень часто рН снижается добавлением маслорастворимой кислоты, например уксусной, что позволяет инициировать гелеобразование с Ca2+. Размер шариков зависит от скорости перемешивания и типа используемого эмульгатора. Таким образом, он позволяет получать целевые микрокапсулы с размером [65], который может варьироваться от 25 мкм до 2 мм [90]. Полученные капсулы имеют малый диаметр, но главным недостатком этого способа является то, что он обеспечивает большой диапазон размеров и форм частиц. Из-за потребности в растительном масле эксплуатационные расходы могут быть выше, чем при экструзионной технологии [90]. Эмульсионный метод является относительно новым для пищевой промышленности и легко масштабируется для крупномасштабного производства и приводит к высокой выживаемости клеток (80-95%) [90, 95]
На рис. 2 представлены этапы процессов экструзии и эмульсии и химическая структура остатков альгината, а также схематическая диаграмма микроорганизмов и гидрогелей.
Рисунок 2. Стадии экструзионных и эмульсионных процессов и химическая структура альгинатных остатков, а также принципиальная схема микроорганизмов и гидрогелей.
Важной проблемой для пробиотической инкапсуляции является уменьшение размера частиц, поскольку это может отрицательно повлиять на текстурные и сенсорные свойства продукта. Например, потребители обнаружили зернистую текстуру в йогуртах, содержащих инкапсулированные бифидобактерии (размер частиц около 22-50 мкм) [96]. С другой стороны, уже есть коммерческие продукты (йогурт и хлопья для завтрака), в которых частицы, содержащие пробиотики, четко видны в продуктах и даже рекламируются на этикетке. С частицами геля клетки обычно не высвобождаются в пищевые продукты при добавлении; исследования in vitro и ex vivo показали что бусы сохраняли свою целостность в условиях имитации желудка, но впоследствии высвобождали свой груз в желудочно-кишечный тракт [91].
Другая проблема, на которую следует обратить внимание, заключается в том, что присутствие остаточного масла на поверхности капсулы, полученного эмульгированием, оказывает вредное воздействие на текстуру и органолептические свойства продукта. Кроме того, введение капсул в диетические продукты затруднено, а остаточное масло, поверхностно-активное вещество или эмульгатор могут быть токсичными для пробиотических клеток.
Выживание микрокапсулированных пробиотиков, Lactobacillus acidophilus 547, Bifidobacterium bifidum ATCC 1994 и Lactobacillus casei 01, в перемешанном йогурте ультра-высокотемпературной обработки (UHT) и обычно обработанном молоке во время хранения при низкой температуре было исследовано Krasaekoopt et al. [63]. Было зафиксировано более высокое выживание инкапсулированных пробиотических бактерий в альгинатных гранулах, покрытых хитозаном, по сравнению со свободными клетками приблизительно на 1 log-цикл. Количество пробиотических бактерий оставалось выше рекомендуемого терапевтического минимума (107 КОЕ/г) в течение всего периода хранения (4 недели), за исключением B. bifidum, уровни которого снизились ниже 106 КОЕ/г (снижение жизнеспособности на 37,6–47,5% количество клеток). Использование UHT или обычного обработанного молока не влияло на выживаемость клеток. Поскольку бифидобактерии строго анаэробны, выживаемость этого организма может быть улучшена путем увеличения исходного числа клеток перед капсулированием и путем добавления поглотителя кислорода, такого как гидрохлорид L-цистеина, во время микроинкапсулирования [63].
Микрокапсулирование также, по-видимому, создает аноксические области внутри микрокапсул, поэтому снижает кислород, что предотвращает потерю жизнеспособности чувствительных к кислороду пробиотических штаммов, а также защищает клетки от кислотных условий в йогурте [97, 98]. Кислородная толерантность бифидобактерий в гелевых шариках также была подтверждена [99]. Однако эффективность микрокапсулирования при защите пробиотиков зависит от чувствительности штамма к кислороду и уровня растворенного кислорода в пищевом продукте.
Кальций-альгинатный захват Lactobacillus acidophilus был также предложен для получения пробиотического ферментированного томатного сока [68]. Иммобилизованные клетки переносили неблагоприятные эффекты томатного сока, и, таким образом, жизнеспособное количество иммобилизованных клеток поддерживалось на уровне ≥7 log КОЕ/г после 10 недель хранения в холодильнике при 4°C, в отличие от 4 log КОЕ/г свободных клеток.
Сходным образом, благодаря введению в йогурт выживаемость вызванных кальцием альгинатно-крахмальных инкапсулированных L. acidophilus и B. lactis была значительно улучшена благодаря защите клеток [65]. О такой же тенденции сообщалось и при хранении лиофилизированного йогурта при температуре окружающей среды, содержащего альгинатно-микрокапсулированную смешанную пробиотическую культуру [100], а также альгинатно-микроинкапсулированную L. reuteri, полученную с использованием технологии экструзии или эмульсии, включенную в сухие колбасные изделия [66], и кальциево-альгинатные капсулированные В. Bifidum и B. infantis, введенные в майонез [60].
Симбиотический кондитерский продукт был предварительно приготовлен путем включения свободной или инкапсулированной Lactobacillus casei NCDC 298 в альгинат натрия в молочном шоколаде вместе с инулином [71]. Хотя инкапсуляция клеток приводила к значительному увеличению выживаемости клеток при низком рН, высокой концентрации желчных солей и при термической обработке [101], жизнеспособность как свободных, так и инкапсулированных L. casei NCDC 298 оставалась неизменной при хранении молочного шоколада в охлажденных условиях до 60 суток и была выше рекомендованного Международной молочной Федерацией уровня (107 КОЕ/г) в конце срока годности продукта [71]. Скармливание симбиотического шоколада увеличивало фекальные лактобациллы и снижало фекальные колиформы и активность -глюкуронидазы у мышей, что указывает на то, что такой шоколад может представлять собой отличную пищу для доставки пробиотических лактобацилл [71].
Напротив, инкапсуляция Lactobacillus acidophilus ATCC 4356 на альгинатах кальция не оказывала влияния на выживаемость клеток по сравнению со свободными клетками при холодильном хранении йогуртов в течение 4 недель [70]. Однако значительно большая выживаемость инкапсулированных по сравнению со свободными пробиотическими бактериями наблюдалась в исследованиях in vitro с использованием искусственных систем желудочного пищеварения человека [70].
В другом исследовании сообщалось, что микрокапсулирование в альгинатах приводит к повышению устойчивости L. casei к термической обработке при температуре 55-65 °С [101]. Полученные данные позволяют предположить, что микрокапсулированные пробиотические клетки могут быть использованы в мясопереработке, где требуется умеренная термическая обработка.
4.1.2. Молочные и сывороточные белковые гели.
Инкапсуляция пробиотиков в белковые гелевые частицы может обеспечить защиту во время пищевой обработки и хранения. Микрокапсулы белка, содержащие инкапсулированные бактерии, могут быть получены путем эмульсионной и распылительной сушки или экструзии и сублимационной сушки, и они могут быть включены в различные продукты, такие как йогурт, сыр и печенье, для придания пробиотических свойств [67, 102-105]. Иммобилизация пробиотических культур в микрокапсулах на основе сывороточного белка может увеличить выживаемость клеток в экстремальных условиях, что делает этот подход потенциально полезным для доставки жизнеспособных бактерий в желудочно-кишечный тракт человека через кисломолочные ферментированные продукты. Однако при инкапсуляции чувствительных микроорганизмов распылительной сушкой следует учитывать технологические свойства штаммов, в частности термостойкость.
Lactobacillus paracasei ssp. paracasei F19 и Bifidobacterium lactis Bb12 инкапсулировали в молочные белковые матрицы с помощью ферментативного индуцированного желирования с сычужным ферментом [74] и в микрокапсулы казеина пищевого качества на основе катализируемого трансглутаминазой желирования суспензий казеина [75]. Были получены нерастворимые в воде сферические капсулы с объемным средним диаметром 68±5 мм и 165±23 мм соответственно. Анализ числа живых клеток после инкубации свободных и инкапсулированных пробиотиков при низких значениях рН и в моделированном желудочном соке без пепсина при рН 2,5 и рН 3,6 (37°С, 90 мин) показал защитный эффект, обусловленный микрокапсуляцией при всех испытанных условиях. Оба исследования показали, что микрокапсулирование пробиотических клеток может быть подходящей альтернативой современным доступным технологиям и может защитить пробиотические клетки от повреждения из-за уровней рН, аналогичных тем, что находятся в желудке человека.
Эффективность изолята сывороточного белка в качестве матрицы инкапсуляции для поддержания жизнеспособности Lactobacillus rhamnosus GG была оценена ранее [106]. Атомно-силовая микроскопия показала, что экструзия микрошариков при рН 4,6 стимулирует сильные когезивные взаимодействия внутри белковых пробиотических амальгам. Микроскопическое окрашивание живых / мертвых клеток визуализировало однородное распределение живых пробиотиков по матрицам микрошариков. После 3 ч инкубации в желудке in vitro (рН 1,8; 37°С) микрошарики, нагруженные 1010 КОЕ, продемонстрировали кислотную стабильность и пептическую устойчивость, характеристики, необходимые для оптимального пробиотического убежища. Однако энзим-активированные кишечные условия катализировали синергическую реакцию, включающую быструю дезинтеграцию матрикса и контролируемое высвобождение пробиотика. В целом, исследование привело к разработке и проектированию белкового инкапсулирующего полимера на основе конгруэнтных матричных взаимодействий для усиления пробиотической защиты в сложных ситуациях для их адресной доставки к местам адсорбции в кишечнике.
Соответственно, клеточная иммобилизация одного и того же штамма (Lactobacillus rhamnosus GG) в нативных, денатурированных и гидролизованных изолятах сывороточного белка была исследована Doherty et al. [76]. Гидролизованные или денатурированные изоляты сывороточного белка были наиболее подходящими матрицами для иммобилизации клеток, в то время как нативный белок обеспечивал самую слабую защиту от термического и кислотного стресса. Пространственное распределение пробиотических клеток в иммобилизованных препаратах оценивали методом атомно-силовой и конфокальной сканирующей лазерной микроскопии, а микроскопический анализ денатурированных препаратов выявил оазис иммобилизованных клеток, отделенных по фазе от окружающей белковой матрицы.
Прямое диспергирование свежих клеток в термообработанной белковой суспензии с последующей распылительной сушкой также было предложено в качестве альтернативного и менее разрушительного метода микрокапсулирования, при этом выживаемость после распылительной сушки составила 26% для B. breve и 1,4% для более чувствительной к нагреванию. B. longum [102]. Хотя жизнеспособность бактерий после сушки распылением оставалась низкой, количество жизнеспособных клеток B. breve, захваченных в микрокапсулы из сывороточного белка, было значительно выше, чем у свободных клеток после 28 дней в йогурте, хранящемся при 4 °C (+2,6 log циклов) и после последовательного воздействия смоделированного желудочного и кишечного соков (+2,7 log циклов). В отличие от этого, у B. longum не наблюдалось защитного эффекта инкапсуляции.
Аналогичным образом, Ainsley Reid et al. исследовали влияние микропрепарата геля изолята сывороточного белка на жизнеспособность Lactobacillus rhamnosus R011 во время производства и хранения печенья, замороженного клюквенного сока и овощного сока. [67]. Гранулы были получены путем экструзии денатурированного раствора бактерий, концентрированного изолятом сывороточного белка (объемное соотношение 70:30), в растворе CaCl2. После замачивания в течение 30 мин при 4°С в стерильном защитном растворе на основе молока, состоящем из 20% (w/w) сухого обезжиренного молока, 5% (w/w) сахарозы, 1% (w/w) бакто-казитона и добавленной 0,35% (w/v) аскорбиновой кислоты, их подвергали сублимационной сушке и растирали до получения мелкодисперсного порошка [67]. Жизнеспособность микроэнтропийных клеток сравнивали со свободными клетками, сублимированными в защитном растворе на основе молока и в денатурированном растворе на основе сывороточного белка, обогащенном лактозой и сахарозой. При производстве печенья и его хранении в течение 2 недель при температуре 23°С минимальное снижение количества клеток (от 1,3×107 до <103 КОЕ/г) наблюдалось в клетках, микроинтрапированных в частицы геля изолята сывороточного белка. Однако свободные клетки, полученные в матрице на основе молока, сохраняют наибольшую жизнеспособность при хранении овощного сока, а также при замораживании и хранении клюквенного сока. Наибольшее снижение количества жизнеспособных микроорганизмов в процессе нагревания печенья, а также при хранении овощного сока, замораживании и хранении клюквенного сока было зафиксировано в свободной культуре, приготовленной в растворе на основе изолята сывороточного белка. Хотя раствор на основе изолята сывороточного белка не был эффективным в поддержании высокой жизнеспособности свободных клеток, был сделан вывод о том, что процесс микропрепарата может помочь в защите лиофилизированных клеток от последующих кислотных и щелочных условий pH и во время нагревания и замораживания продукты питания.
4.2. Натуральные опоры.
Плоды содержат неперевариваемые углеводы, которые являются основой для иммобилизации клеток. Кусочки яблока и айвы оказались подходящими носителями для иммобилизации клеток Lactobacillus casei [61]. Иммобилизованные биокатализаторы использовали в производстве кисломолочной и пробиотической добавки ферментированного молока, в то время как иммобилизованные бактериальные клетки были способны к реактивации после хранения в течение 129 дней при 4°C. В ферментированном молоке на протяжении всего периода хранения преобладал фруктовый, характерный аромат. Иммобилизованный клетки L. casei на кусочках фруктов также успешно используются в производстве пробиотических сыров [62].
Кусочки фруктов и овса также были недавно предложены в качестве средств доставки L. casei ATCC 393. Иммобилизованные клетки использовались для производства пробиотического йогурта, и за выживанием клеток следили во время хранения в холодильнике. Микробиологический и штамм-специфический мультиплексный ПЦР-анализ показал, что как свободный, так и иммобилизованный L. casei ATCC 393 были обнаружены на необходимых уровнях для обеспечения пробиотического эффекта (не менее 6 log КОЕ/г) в течение более длительных периодов, чем требуется молочной промышленностью (≥30 дней) при хранении при 4°С [72].
Были предприняты попытки объединить полезные эффекты пробиотиков с фруктами и овощами, применяя процесс вакуумной пропитки. Было показано, что возможно введение микробных клеток в структурный матрикс свежей яблочной ткани с помощью пропиточной жидкости, инокулированной S. cerevisiae и L. casei spp. rhamnosus. Для разработки сухофруктовых продуктов с пробиотическим эффектом был предложен процесс, сочетающий процесс вакуумной пропитки с воздушной сушкой [107]. Вакуумные и / или атмосферные методы пропитки рассматриваются как возможные технологии для эксплуатации тканей фруктов и овощей. Функциональные ингредиенты могут быть успешно включены в ткани растительного происхождения, обеспечивая, таким образом, новые функциональные категории продуктов и новые коммерческие возможности.
Целью методов консервирования пищевых продуктов, представляющих интерес в рамках программы ”Иберо-Америка" (CYTED Program), проводившейся с 1999 по 2004 год, был анализ возможности атмосферной и/или вакуумной пропитки с целью включения физиологически активных соединений в растительные ткани без разрушения исходной пищевой матрицы. Вышеуказанные исследования внесли значительный вклад в разработку функциональных фруктовых и овощных матриц, обогащенных пробиотиками [108].
Злаки, которые также содержат неперевариваемые углеводы, могут применяться в качестве опор для иммобилизации клеток. В последние годы для повышения жизнеспособности пробиотических штаммов в функциональных пищевых продуктах было протестировано несколько методов инкапсуляции с использованием зерновых фракций [109, 110]. Многочисленные полезные эффекты злаков могут быть использованы по-разному, что приводит к разработке новых продуктов питания. Зерновые культуры могут быть использованы в качестве ферментируемых субстратов для роста пробиотических микроорганизмов, но они также содержат потенциальные пребиотические соединения, функциональные свойства которых должны быть изучены. Кроме того, предполагается, что зерновые компоненты, такие как крахмал, обладают способностью доставлять иммобилизованные пробиотические микроорганизмы в кишечник человека при использовании в качестве иммобилизационных опор [111, 112]
Исходя из вышеизложенного, перспективными носителями Lactobacillus rhamnosus при сублимационной сушке и хранении в яблочном соке и хлопьях с шоколадной глазурью считались пшеничный декстрин, полидекстроза, яблочная клетчатка и инулин [64].
Недавно была проведена оценка производства пробиотических сухих ферментированных колбас, содержащих иммобилизованные Lactobacillus casei ATCC 393 на пшенице (неопубликованные результаты). Уровни пробиотического штамма оставались выше 6 log КОЕ / г в процессе созревания, но, что более важно, после тепловой обработки при 70–72 °C в течение 8–10 минут в отличие от свободных клеток, подтверждая защитную роль иммобилизации клеток.
Наконец, недавно были предприняты усилия по иммобилизации пробиотического штамма на сельскохозяйственных отходах. Кожура дуриана, мангостина и джекфрута использовалась в качестве подложки для иммобилизации штаммов L. acidophilus и L. bulgaricus, а иммобилизованные пробиотики показали повышенный рост, большее снижение стахиозы, сахарозы и глюкозы, более высокую продукцию молочной и уксусной кислот и более низкий pH в соевом молоке по сравнению со свободными клетками [69]. Аналогично, L. casei иммобилизировали на пивных дробинах (отработанном пивоварном зерне), а иммобилизованный биокатализатор использовали в хлебопечении [113]. Однако продукты не характеризовались как пробиотики, так как клетки L. casei не выживали в процессе выпечки.
5. Выводы и перспективы на будущее
Несмотря на изобилие пробиотических препаратов и поддержку иммобилизации, предложенную рядом исследователей, технология иммобилизованных клеток еще не получила широкого распространения в промышленном секторе, главным образом из-за проблем безопасности, связанных с агентами иммобилизации, подтверждением стабильности и функциональности биоактивных культур и отсутствием процессов, которые можно легко масштабировать. Текущие исследования направлены на решение вышеуказанных проблем, поскольку иммобилизация является успешным способом защиты и повышения жизнеспособности клеток. Оценка промышленной осуществимости технологии иммобилизации является обязательной для обеспечения экономически эффективных, крупномасштабных количеств пробиотических продуктов для конкретного клинического и / или коммерческого использования.
Решающими факторами для внедрения на промышленном уровне являются материалы-носители, технология иммобилизации и конструкция биореактора. Хотя исследования иммобилизованных клеток ведутся уже несколько лет, многие трудности, связанные с их применением в промышленных масштабах, все еще существуют. Два наиболее важных недостатка, о которых следует всегда помнить, - это сложность производственного процесса и ограниченность затрат. В настоящее время основными задачами успешного применения иммобилизованных клеточных технологий в промышленной пробиотической пищевой промышленности являются повышение жизнеспособности клеток, улучшение клинического результата по сравнению со свободными клетками и улучшение органолептических показателей. На самом деле инженерные проблемы, связанные с выбором носителя и конструкции реактора, осложняются безопасностью иммобилизирующих агентов и воздействием иммобилизации на сенсорные свойства конечных продуктов. Будущие исследования должны быть направлены на преодоление разрыва между условиями на уровне исследований и требованиями к крупномасштабным приложениям, совершенствование существующих технологий производства и выбор новых условий обработки и новых материалов-носителей. Кроме того, будущие исследования должны быть ориентированы на методы консервации и хранения, которые могут быть легко приняты на промышленном уровне.
Для успешной иммобилизации и культивирования пробиотических клеток иммобилизационный материал должен способствовать жизнеспособности и функционированию клеток (биосовместимости) в определенных пищевых системах. Следовательно, иммобилизационные носители пищевой чистоты, такие как натуральные носители, считаются выгодными для производства пищевых продуктов. Системы микрокапсул или шариков с использованием различных биополимеров очень легко приготовить в лабораторных условиях. Однако масштабирование процесса очень сложно, а затраты на его обработку очень высоки. Кроме того, механическая нестабильность является важным недостатком гелей. Часто замечали, что структура геля разрушается из-за роста клеток и интенсивного производства углекислого газа.
В ближайшем будущем ожидается, что ключевым фактором будут множественные доставки, и таким образом будет расширена новая область комплексных питательных матриц. Например, коэнкапсуляция пробиотических культур с определенными пищевыми ингредиентами может быть полезной, так как в то же время она позволяет вводить биологически активные соединения, в то время как положительный эффект пробиотиков может быть усилен при правильном подборе веществ. Таким образом, коиммобилизация пробиотических микроорганизмов с пребиотиками, антиоксидантами, пептидами или иммуностимулирующими соединениями становится особенно привлекательной в будущих перспективах.
В настоящее время изучается ряд эффективных материалов и связанных с ними механизмов контролируемого высвобождения. Ожидается, что в ближайшее время будут разработаны новые инновационные способы введения и доставки пробиотиков. Тем не менее, все еще требуются дополнительные исследования для выбора иммобилизационных опор, которые могут вызвать успешную адгезию к конкретным клеткам кишечника, таким образом достигая целевой доставки пробиотических бактерий к различным участкам внутри желудочно-кишечного тракта. Для подтверждения эффективности микро - или нанокапсуляции в транспортировке пробиотических бактерий и их контролируемого высвобождения в системе ЖКТ следует проводить больше исследований in vivo с участием людей. По-прежнему требуются дополнительные доказательства, основанные на клинических данных о безопасности иммобилизационных опор и о влиянии иммобилизации на эффективность пробиотиков по сравнению со свободными клетками.
Кроме того, в нормативах по новым продуктам должна быть указана маркировка, включая штамм и количество жизнеспособных клеток в конце срока годности пробиотических продуктов. Такие директивы считаются важнейшими для развития промышленного и коммерческого сознания, а также для защиты прав потребителей.
Наконец, разработка новых функциональных продуктов питания является серьезной проблемой для удовлетворения ожиданий потребителей в отношении здоровых и полезных продуктов питания. Отрасли промышленности должны преодолеть возможные трудности и найти пути использования преимуществ, предлагаемых технологией иммобилизованных клеток, с адекватными затратами. Очевидно, что рынок пробиотиков имеет большое будущее, поскольку преимущества, обеспечиваемые потреблением пробиотиков, теперь хорошо документированы, и, следовательно, потребительские потребности, как ожидается, возрастут.
- Создание иммобилизованной формы сухого синбиотика
- Гранатовый сок как субстрат для доставки пробиотиков
- Биореакторы с иммобилизованными ферментами и клетками
Литература:
- R. Fuller, “Probiotics in man and animals,” Journal of Applied Bacteriology, vol. 66, no. 5, pp. 365–378, 1989.View at: Google Scholar
- S. Salminen, A. von Wright, L. Morelli et al., “Demonstration of safety of probiotics: a review,” International Journal of Food Microbiology, vol. 44, no. 1-2, pp. 93–106, 1998.View at: Publisher Site | Google Scholar
- S. Salminen, A. Ouwehand, Y. Benno, and Y. K. Lee, “Probiotics: how should they be defined?” Trends in Food Science & Technology, vol. 10, no. 3, pp. 107–110, 1999.View at: Publisher Site | Google Scholar
- FAO/WHO Working Group on Drafting Guidelines for the Evaluation of Probiotics in Food, “Guidelines for the evaluation of probiotics in food: report of a Joint FAO/WHO Working Group on Drafting Guidelines for the Evaluation of Probiotics in Food,” London, Ontario, Canada April and May 2002.View at: Google Scholar
- H. Haenel and J. Bendig, “Intestinal flora in health and disease,” Progress in food & Nutrition Science, vol. 1, no. 1, pp. 21–64, 1975.View at: Google Scholar
- T. Mitsuoka, “Recent trends in research on intestinal flora,” Bifidobacteria Microflora, vol. 1, pp. 3–24, 1982.View at: Google Scholar
- S. Salminen, A. C. Ouwehand, and E. Isolauri, “Clinical applications of probiotic bacteria,” International Dairy Journal, vol. 8, no. 5-6, pp. 563–572, 1998.View at: Publisher Site | Google Scholar
- L. Kopp-Hoolihan, “Prophylactic and therapeutic uses of probiotics: a review,” Journal of the American Dietetic Association, vol. 101, no. 2, pp. 229–241, 2001.View at: Google Scholar
- M. Alander, R. Satokari, R. Korpela et al., “Persistence of colonization of human colonic mucosa by a probiotic strain, Lactobacillus rhamnosus GG, after oral consumption,” Applied and Environmental Microbiology, vol. 65, no. 1, pp. 351–354, 1999.View at: Google Scholar
- T. Mattila-Sandholm, J. Mättö, and M. Saarela, “Lactic acid bacteria with health claims—interactions and interference with gastrointestinal flora,” International Dairy Journal, vol. 9, no. 1, pp. 25–35, 1999.View at: Publisher Site | Google Scholar
- M. Saarela, G. Mogensen, R. Fondén, J. Mättö, and T. Mattila-Sandholm, “Probiotic bacteria: safety, functional and technological properties,” Journal of Biotechnology, vol. 84, no. 3, pp. 197–215, 2000.View at: Publisher Site | Google Scholar
- U. Svensson, “Industrial perspectives,” in Probiotics: A Critical Review, G. W. Tannock, Ed., pp. 57–64, Horizon Scientific Press, Wymondham, UK, 1999.View at: Google Scholar
- J. E. Teitelbaum and W. A. Walker, “Nutritional impact of pre- and probiotics as protective gastrointestinal organisms,” Annual Review of Nutrition, vol. 22, pp. 107–138, 2002.View at: Publisher Site | Google Scholar
- Begley, C. Hill, and C. G. M. Gahan, “Bile salt hydrolase activity in probiotics,” Applied and Environmental Microbiology, vol. 72, no. 3, pp. 1729–1738, 2006.View at: Publisher Site | Google Scholar
- M. Sidira, A. Galanis, P. Ypsilantis et al., “Effect of probiotic-fermented milk administration on gastrointestinal survival of Lactobacillus casei ATCC 393 and modulation of intestinal microbial flora,” Journal of Molecular Microbiology and Biotechnology, vol. 19, no. 4, pp. 224–230, 2011.View at: Publisher Site | Google Scholar
- G. Saxami, P. Ypsilantis, M. Sidira, C. Simopoulos, Y. Kourkoutas, and A. Galanis, “Distinct adhesion of probiotic strain Lactobacillus casei ATCC 393 to rat intestinal mucosa,” Anaerobe, vol. 18, no. 4, pp. 417–420, 2012.View at: Publisher Site | Google Scholar
- Marteau, P. Pochart, Y. Bouhnik, and J. C. Rambaud, “The fate and effects of transiting, nonpathogenic microorganisms in the human intestine,” World Review of Nutrition and Dietetics, vol. 74, pp. 1–21, 1993.View at: Google Scholar
- P. A. Clark, L. N. Cotton, and J. H. Martin, “Selection of bifidobacteria for use as dietary adjuncts in cultured dairy foods: II. Tolerance to simulated pH of human stomach,” Cultured Dairy Products Journal, vol. 28, pp. 11–14, 1993.View at: Google Scholar
- W. E. B. Lankaputhra and N. P. Shah, “Survival of Lactobacillus acidophilus and Bifidobacterium spp. in the presence of acid and bile salts,” Cultured Dairy Products Journal, vol. 30, pp. 2–7, 1995.View at: Google Scholar
- W. P. Charteris, P. M. Kelly, L. Morelli, and J. K. Collins, “Development and application of an in vitro methodology to determine the transit tolerance of potentially probiotic Lactobacillus and Bifidobacterium species in the upper human gastrointestinal tract,” Journal of Applied Microbiology, vol. 84, no. 5, pp. 759–768, 1998.View at: Google Scholar
- P. A. Clark and J. H. Martin, “Selection of bifidobacteria for use as dietary adjuncts in cultured dairy foods: III. Tolerance to simulated bile concentrations of human intestines,” Cultured Dairy Products Journal, vol. 29, pp. 18–21, 1994.View at: Google Scholar
- J. P. Grill, C. Manginot-Durr, F. Schneider, and J. Ballongue, “Bifidobacteria and probiotic effects: action of Bifidobacterium species on conjugated bile salts,” Current Microbiology, vol. 31, no. 1, pp. 23–27, 1995.View at: Publisher Site | Google Scholar
- C. Ouwehand, E. Isolauri, P. V. Kirjavainen, and S. J. Salminen, “Adhesion of four Bifidobacterium strains to human intestinal mucus from subjects in different age groups,” FEMS Microbiology Letters, vol. 172, no. 1, pp. 61–64, 1999.View at: Publisher Site | Google Scholar
- H. Kim, M. S. Park, and G. E. Ji, “Characterization of adhesion of bifidobacterium sp. BGN4 to human enterocyte-like caco-2 cells,” Journal of Microbiology and Biotechnology, vol. 13, no. 2, pp. 276–281, 2003.View at: Google Scholar
- N. Berrada, J. F. Lemeland, G. Laroche, P. Thouvenot, and M. Piaia, “Bifidobacterium from fermented milks: survival during gastric transit,” Journal of dairy science, vol. 74, no. 2, pp. 409–413, 1991.View at: Google Scholar
- V. A. Nedović, B. Obradović, I. Leskošek-Čukalović, and G. Vunjak-Novaković, “Immobilized yeast bioreactor systems for brewing-recent achievements,” in Focus on Biotechnology, P. Thonart and M. Hofman, Eds., vol. 4 of Engineering and Manufacturingfor Biotechnology, pp. 277–292, Kluwer Academic, Dodrecht, The Netherlands, 2001.View at: Google Scholar
- C. Ouwehand and S. J. Salminen, “The health effects of cultured milk products with viable and non-viable bacteria,” International Dairy Journal, vol. 8, no. 9, pp. 749–758, 1998.View at: Publisher Site | Google Scholar
- S. Lahtinen, “Probiotic viability-does it matter?” Microbial Ecology in Health & Disease, vol. 23, pp. 10–14, 2012.View at: Google Scholar
- S.-D. Xiao, D. Z. Zhang, H. Lu et al., “Multicenter, randomized, controlled trial of heat-killed Lactobacillus acidophilus LB in patients with chronic diarrhea,” Advances in Therapy, vol. 20, no. 5, pp. 253–260, 2003.View at: Google Scholar
- G. Reid, D. Beuerman, C. Heinemann, and A. W. Bruce, “Probiotic Lactobacillus dose required to restore and maintain a normal vaginal flora,” FEMS Immunology and Medical Microbiology, vol. 32, no. 1, pp. 37–41, 2001.View at: Publisher Site | Google Scholar
- P. V. Kirjavainen, S. J. Salminen, and E. Isolauri, “Probiotic bacteria in the management of atopic disease: underscoring the importance of viability,” Journal of Pediatric Gastroenterology and Nutrition, vol. 36, no. 2, pp. 223–227, 2003.View at: Publisher Site | Google Scholar
- V. Verhoeven, N. Renard, A. Makar et al., “Probiotics enhance the clearance of human papillomavirus-related cervical lesions: a prospective controlled pilot study,” European Journal of Cancer Prevention, vol. 22, no. 1, pp. 46–51, 2013.View at: Google Scholar
- T. D. Boylston, C. G. Vinderola, H. B. Ghoddusi, and J. A. Reinheimer, “Incorporation of bifidobacteria into cheeses: challenges and rewards,” International Dairy Journal, vol. 14, no. 5, pp. 375–387, 2004.View at: Publisher Site | Google Scholar
- N. P. Shah, W. E. V. Lankaputhra, M. L. Britz, and W. S. A. Kyle, “Survival of Lactobacillus acidophilus and Bifidobacterium bifidum in commercial yoghurt during refrigerated storage,” International Dairy Journal, vol. 5, no. 5, pp. 515–521, 1995.View at: Google Scholar
- U. Schillinger, “Isolation and identification of lactobacilli from novel-type probiotic and mild yoghurts and their stability during refrigerated storage,” International Journal of Food Microbiology, vol. 47, no. 1-2, pp. 79–87, 1999.View at: Publisher Site | Google Scholar
- F. A. M. Klaver, F. Kingma, and A. H. Weerkamp, “Growth and survival of bifidobacteria in milk,” Netherlands Milk and Dairy Journal, vol. 47, no. 3-4, pp. 151–164, 1993.View at: Google Scholar
- H. Martin and K. M. Chou, “Selection of Bifidobacterium ssp for use as dietary adjuncts in cultured dairy foods I. Tolerance to pH of yoghurt,” Cultured Dairy Products Journal, vol. 27, pp. 21–26, 1992.View at: Google Scholar
- Samona and R. K. Robinson, “Effect of yoghurt cultures on the survival of bifidobacteria in fermented milks,” Journal of the Society of Dairy Technology, vol. 47, pp. 58–60, 1994.View at: Publisher Site | Google Scholar
- W. E. V. Lankaputhra, N. P. Shah, and M. L. Britz, “Survival of bifidobacteria during refrigerated storage in the presence of acid and hydrogen peroxide,” Milchwissenschaft, vol. 51, no. 2, pp. 65–70, 1996.View at: Google Scholar
- R. I. Dave and N. P. Shah, “Viability of yoghurt and probiotic bacteria in yoghurts made from commerical starter cultures,” International Dairy Journal, vol. 7, no. 1, pp. 31–41, 1997.View at: Publisher Site | Google Scholar
- M. Medina and R. Jordano, “Survival of constitutive microflora in commercially fermented milk containing bifidobacteria during refrigerated storage,” Journal of Food Protection, vol. 56, pp. 731–733, 1994.View at: Google Scholar
- S. A. Ibrahim and A. Bezkorovainy, “Growth-promoting factors for Bifidobacterium longum,” Journal of Food Science, vol. 59, no. 1, pp. 189–191, 1994.View at: Google Scholar
- J. Heller, “Probiotic bacteria in fermented foods: product characteristics and starter organisms,” The American Journal of Clinical Nutrition, vol. 73, no. 2, pp. 374S–379S, 2001.View at: Google Scholar
- Samona, R. K. Robinson, and S. Marakis, “Acid production by bifidobacteria and yoghurt bacteria during fermentation and storage of milk,” Food Microbiology, vol. 13, no. 4, pp. 275–280, 1996.View at: Publisher Site | Google Scholar
- Lönnerdal, “Nutritional and physiological significance of human milkproteins,” The American Journal of Clinical Nutrition, vol. 77, pp. 1537S–1543S, 2003.View at: Google Scholar
- C. Almeida, S. L. S. Lorena, C. R. Pavan, H. M. I. Akasaka, and M. A. Mesquita, “Beneficial effects of long-term consumption of a probiotic combination of Lactobacillus casei Shirota and Bifidobacterium breve Yakult may persist after suspension of therapy in lactose-intolerant patients,” Nutrition in Clinical Practice, vol. 27, no. 2, pp. 247–251, 2012.View at: Publisher Site | Google Scholar
- S. R. Yoo, Y. J. Kim, D. Y. Park et al., “Probiotics L. plantarum and L. curvatus in combination alter hepatic lipid metabolism and suppress diet-inducedobesity,” Obesity, 2013.View at: Publisher Site | Google Scholar
- R. R. N. Ferraz, N. C. Marques, L. Froeder et al., “Effects of Lactobacillus caseiand Bifidobacterium breve on urinary oxalate excretion in nephrolithiasis patients,” Urological Research, vol. 37, no. 2, pp. 95–100, 2009.View at: Publisher Site | Google Scholar
- S. Thomas, D. Metzke, J. Schmitz, Y. Dörffel, and D. C. Baumgart, “Anti-inflammatory effects of Saccharomyces boulardii mediated by myeloid dendritic cells from patients with Crohn's disease and ulcerative colitis,” The American Journal of Physiology, vol. 301, no. 6, pp. G1083–G1092, 2011.View at: Publisher Site | Google Scholar
- H. M. Zhao, X. Y. Huang, Z. Q. Zuo et al., “Probiotics increase T regulatory cells and reduce severity of experimental colitis in mice,” World Journal of Gastroenterology, vol. 19, no. 5, pp. 742–749, 2013.View at: Publisher Site | Google Scholar
- P. Ducrotté, P. Sawant, and V. Jayanthi, “Clinical trial: Lactobacillus plantarum299v (DSM, 9843) improves symptoms of irritable bowel syndrome,” World Journal of Gastroenterology, vol. 18, no. 30, pp. 4012–4018, 2012.View at: Publisher Site | Google Scholar
- K. Wickens, P. Black, T. V. Stanley et al., “A protective effect of Lactobacillus rhamnosus HN001 against eczema in the first 2 years of life persists to age 4years,” Clinical and Experimental Allergy, vol. 42, no. 7, pp. 1071–1079, 2012.View at: Publisher Site | Google Scholar
- Y. Han, B. Kim, J. Ban et al., “A randomized trial of Lactobacillus plantarumCJLP133 for the treatment of atopic dermatitis,” Pediatric Allergy and Immunology, vol. 23, no. 7, pp. 667–673, 2012.View at: Publisher Site | Google Scholar
- T. Y. Lin, C. J. Chen, L. K. Chen, S. H. Wen, and R. H. Jan, “Effect of probiotics on allergic rhinitis in df, dp or dust-sensitive children: a randomized double blind controlled trial,” Indian Pediatrics, vol. 50, no. 2, pp. 209–213, 2013.View at: Publisher Site | Google Scholar
- Y.-S. Chen, Y.-L. Lin, R.-L. Jan, H.-H. Chen, and J.-Y. Wang, “Randomized placebo-controlled trial of lactobacillus on asthmatic children with allergic rhinitis,” Pediatric Pulmonology, vol. 45, no. 11, pp. 1111–1120, 2010.View at: Publisher Site | Google Scholar
- E. C. Dinleyici, N. Dalgic, S. Guven et al., “The effect of a multispecies synbiotic mixture on the duration of diarrhea and length of hospital stay in children with acute diarrhea in Turkey: single blinded randomized study,” European Journal of Pediatrics, vol. 172, no. 4, pp. 459–464, 2013.View at: Google Scholar
- K. Ganguli, D. Meng, S. Rautava, L. Lu, W. A. Walker, and N. Nanthakumar, “Probiotics prevent necrotizing enterocolitis by modulating enterocyte genes that regulate innate immune-mediated inflammation,” The American Journal of Physiology, vol. 304, no. 2, pp. G132–G141, 2013.View at: Publisher Site | Google Scholar
- K. Ahmad, F. Fatemeh, N. Mehri, and S. Maryam, “Probiotics for the treatment of pediatric helicobacter pylori infection: a randomized double blind clinical trial,” Iranian Journal of Pediatrics, vol. 23, no. 1, pp. 79–84, 2013.View at: Google Scholar
- S. Rautava, S. Salminen, and E. Isolauri, “Specific probiotics in reducing the risk of acute infections in infancy: a randomised, double-blind, placebo-controlled study,” British Journal of Nutrition, vol. 101, no. 11, pp. 1722–1726, 2009.View at: Publisher Site | Google Scholar
- H. Khalil and E. H. Mansour, “Alginate encapsulated bifidobacteria survival in mayonnaise,” Journal of Food Science, vol. 63, no. 4, pp. 702–705, 1998.View at: Google Scholar
- Y. Kourkoutas, V. Xolias, M. Kallis, E. Bezirtzoglou, and M. Kanellaki, “Lactobacillus casei cell immobilization on fruit pieces for probiotic additive, fermented milk and lactic acid production,” Process Biochemistry, vol. 40, no. 1, pp. 411–416, 2005.View at: Publisher Site | Google Scholar
- Y. Kourkoutas, L. Bosnea, S. Taboukos, C. Baras, D. Lambrou, and M. Kanellaki, “Probiotic cheese production using Lactobacillus casei cells immobilized on fruit pieces,” Journal of Dairy Science, vol. 89, no. 5, pp. 1439–1451, 2006.View at: Google Scholar
- W. Krasaekoopt, B. Bhandari, and H. C. Deeth, “Survival of probiotics encapsulated in chitosan-coated alginate beads in yoghurt from UHT and conventionally treated milk during storage,” Food Science and Technology, vol. 39, no. 2, pp. 177–183, 2006.View at: Publisher Site | Google Scholar
- Saarela, I. Virkajärvi, L. Nohynek, A. Vaari, and J. Mättö, “Fibres as carriers for Lactobacillus rhamnosus during freeze-drying and storage in apple juice and chocolate-coated breakfast cereals,” International Journal of Food Microbiology, vol. 112, no. 2, pp. 171–178, 2006.View at: Publisher Site | Google Scholar
- K. Kailasapathy, “Survival of free and encapsulated probiotic bacteria and their effect on the sensory properties of yoghurt,” Food Science and Technology, vol. 39, no. 10, pp. 1221–1227, 2006.View at: Publisher Site | Google Scholar
- P. Muthukumarasamy and R. A. Holley, “Microbiological and sensory quality of dry fermented sausages containing alginate-microencapsulated Lactobacillus reuteri,” International Journal of Food Microbiology, vol. 111, no. 2, pp. 164–169, 2006.View at: Publisher Site | Google Scholar
- Ainsley Reid, C. P. Champagne, N. Gardner, P. Fustier, and J. C. Vuillemard, “Survival in food systems of Lactobacillus rhamnosus R011 microentrapped in whey protein gel particles,” Journal of Food Science, vol. 72, no. 1, pp. M031–M037, 2007.View at: Publisher Site | Google Scholar
- V. A.-E. King, H.-Y. Huang, and J.-H. Tsen, “Fermentation of tomato juice by cell immobilized Lactobacillus acidophilus,” Mid-Taiwan Journal of Medicine, vol. 12, no. 1, pp. 1–7, 2007.View at: Google Scholar
- S.-S. Teh, A. Rosma, W.-N. Wan-Abdullah, and L. Min-Tze, “Evaluation of agrowastes as immobilizers for probiotics in soy milk,” Journal of Agricultural and Food Chemistry, vol. 57, no. 21, pp. 10187–10198, 2009.View at: Publisher Site | Google Scholar
- F. Ortakci and S. Sert, “Stability of free and encapsulated Lactobacillus acidophilus ATCC, 4356 in yogurt and in an artificial human gastric digestion system,” Journal of Dairy Science, vol. 95, no. 12, pp. 6918–6925, 2012.View at: Publisher Site | Google Scholar
- S. Mandal, S. Hati, A. K. Puniya, R. Singh, and K. Singh, “Development of symbiotic milk chocolate using encapsulated Lactobacillus casei NCDC 298,” Journal of Food Processing and Preservation, 2012.View at: Publisher Site | Google Scholar
- Sidira, G. Saxami, D. Dimitrellou, V. Santarmaki, A. Galanis, and Y. Kourkoutas, “Monitoring survival of Lactobacillus casei ATCC 393 in probiotic yogurts using an efficient molecular tool,” Journal of Dairy Science, vol. 96, pp. 3369–3377, 2013.View at: Publisher Site | Google Scholar
- L. Saucier and C. Champagne, “Immobilised-cell technology and meat processing,” in Applications of Cell Immobilisation Biotechnology, V. Nedovic and R. Willaert, Eds., pp. 337–353, 2005.View at: Google Scholar
- T. Heidebach, P. Först, and U. Kulozik, “Microencapsulation of probiotic cells by means of rennet-gelation of milk proteins,” Food Hydrocolloids, vol. 23, no. 7, pp. 1670–1677, 2009.View at: Publisher Site | Google Scholar
- T. Heidebach, P. Först, and U. Kulozik, “Transglutaminase-induced caseinate gelation for the microencapsulation of probiotic cells,” International Dairy Journal, vol. 19, no. 2, pp. 77–84, 2009.View at: Publisher Site | Google Scholar
- S. B. Doherty, V. L. Gee, R. P. Ross, C. Stanton, G. F. Fitzgerald, and A. Brodkorb, “Efficacy of whey protein gel networks as potential viability-enhancing scaffolds for cell immobilization of Lactobacillus rhamnosus GG,” Journal of Microbiological Methods, vol. 80, no. 3, pp. 231–241, 2010.View at: Google Scholar
- V. Nedovic, A. Kalusevic, V. Manojlovic, S. Levic, and B. Bugarski, “An overview of encapsulation technologies for food applications,” in Procedia Food Science, pp. 1806–1815, 2011.View at: Google Scholar
- C. Champagne, B. Lee, and L. Saucier, “Immobilization of cells and enzymes for fermented dairy or meat products,” in Encapsulation Technologies for Active Food Ingredients and Food Processing, N. J. Zuidam and V. A. Nedovic, Eds., pp. 345–365, 2010.View at: Google Scholar
- S. E. Gilliland, S. S. Reilly, G. B. Kim, and H. S. Kim, “Viability during storage of selected probiotic lactobacilli and bifidobacteria in a yogurt-like product,” Journal of Food Science, vol. 67, no. 8, pp. 3091–3095, 2002.View at: Google Scholar
- G. Godward and K. Kailasapathy, “Viability and survival of free, encapsulated and co-encapsulated probiotic bacteria in ice cream,” Milchwissenschaft, vol. 58, no. 3-4, pp. 161–164, 2003.View at: Google Scholar
- Y.-C. Wang, R.-C. Yu, and C.-C. Chou, “Growth and survival of bifidobacteria and lactic acid bacteria during the fermentation and storage of cultured soymilk drinks,” Food Microbiology, vol. 19, no. 5, pp. 501–508, 2002.View at: Publisher Site | Google Scholar
- C. Stanton, G. Gardiner, H. Meehan et al., “Market potential for probiotics,” The American Journal of Clinical Nutrition, vol. 73, no. 2, pp. 476S–483S, 2001.View at: Google Scholar
- C. Daly and R. Davis, “The biotechnology of lactic acid bacteria with emphasis on applications in food safety and human health,” Agricultural and Food Science, vol. 7, no. 2, pp. 219–250, 1998.View at: Google Scholar
- C. Ouwehand, B. Bianchi Salvadori, R. Fondén, G. Mogensen, S. Salminen, and R. Sellars, “Health effects of probiotics and culture-containing dairy products in humans,” Bulletin International Dairy Federation, vol. 380, pp. 4–19, 2003.View at: Google Scholar
- H. Sunohara, T. Ohno, N. Shibata, and K. Seki, “Process for producing capsule and capsule obtained thereby,” US Patent, vol. 5, pp. 478–570, 1995.View at: Google Scholar
- K. Adhikari, A. Mustapha, I. U. Grün, and L. Fernando, “Viability of microencapsulated bifidobacteria in set yogurt during refrigerated storage,” Journal of Dairy Science, vol. 83, no. 9, pp. 1946–1951, 2000.View at: Google Scholar
- P. Shah and R. R. Ravula, “Microencapsulation of probiotic bacteria and their survival in frozen fermented dairy desserts,” Australian Journal of Dairy Technology, vol. 55, no. 3, pp. 139–144, 2000.View at: Google Scholar
- W. Sun and M. W. Griffiths, “Survival of bifidobacteria in yogurt and simulated gastric juice following immobilization in gellan-xanthan beads,” International Journal of Food Microbiology, vol. 61, no. 1, pp. 17–25, 2000.View at: Publisher Site | Google Scholar
- M. L. Moya, M. Morley, O. Khanna, E. C. Opara, and E. M. Brey, “Stability of alginate microbead properties in vitro,” Journal of Materials Science, vol. 23, no. 4, pp. 903–912, 2012.View at: Publisher Site | Google Scholar
- W. Krasaekoopt, B. Bhandari, and H. Deeth, “Evaluation of encapsulation techniques of probiotics for yoghurt,” International Dairy Journal, vol. 13, no. 1, pp. 3–13, 2003.View at: Publisher Site | Google Scholar
- C. P. Champagne and P. Fustier, “Microencapsulation for the improved delivery of bioactive compounds into foods,” Current Opinion in Biotechnology, vol. 18, no. 2, pp. 184–190, 2007.View at: Publisher Site | Google Scholar
- J. Burgain, C. Gaiani, M. Linder, and J. Scher, “Encapsulation of probiotic living cells: from laboratory scale to industrial applications,” Journal of Food Engineering, vol. 104, no. 4, pp. 467–483, 2011.View at: Publisher Site | Google Scholar
- V. Manolović, V. Nedovic, K. Kailasapathy, and J. N. Juidam, “Encapsulation of probiotics for use in food products,” in Encapsulation Technologies for Active Food Ingredients and Food Processing, J. N. Juidam and V. Nedovic, Eds., pp. 269–302, Springer, 2010.View at: Google Scholar
- U. Prüsse, L. Bilancetti, M. Bučko et al., “Comparison of different technologies for alginate beads production,” Chemical Papers, vol. 62, no. 4, pp. 364–374, 2008.View at: Publisher Site | Google Scholar
- M. J. Chen and K. N. Chen, “Applications of probiotic encapsulation in dairy products,” in Encapsulation and Controlled Release Technologies in Food Systems, J. M. Lakkis, Ed., pp. 83–107, John Wiley & Sons, New York, NY, USA, 2007.View at: Google Scholar
- K. Adhikari, A. Mustapha, and I. U. Grün, “Survival and metabolic activity of microencapsulated Bifidobacterium in stirred yogurt,” Journal of Food Science, vol. 68, no. 1, pp. 275–280, 2003.View at: Google Scholar
- Talwalkar and K. Kailasapathy, “Effect of microencapsulation on oxygen toxicrty in probiotic bacteria,” Australian Journal of Dairy Technology, vol. 58, no. 1, pp. 36–39, 2003.View at: Google Scholar
- Talwalkar and K. Kailasapathy, “A review of oxygen toxicity in probiotic yoghurts: influence on the survival of probiotic bacteria and protective techniques,” Comprehensive Reviews in Food Science and Food Safety, vol. 3, pp. 117–124, 2004.View at: Google Scholar
- L. D. McMaster, S. A. Kokott, S. J. Reid, and V. R. Abratt, “Use of traditional African fermented beverages as delivery vehicles for Bifidobacterium lactis DSM 10140,” International Journal of Food Microbiology, vol. 102, no. 2, pp. 231–237, 2005.View at: Publisher Site | Google Scholar
- Capela, T. K. C. Hay, and N. P. Shah, “Effect of cryoprotectants, prebiotics and microencapsulation on survival of probiotic organisms in yoghurt and freeze-dried yoghurt,” Food Research International, vol. 39, no. 2, pp. 203–211, 2006.View at: Publisher Site | Google Scholar
- S. Mandal, A. K. Puniya, and K. Singh, “Effect of alginate concentrations on survival of microencapsulated Lactobacillus casei NCDC-298,” International Dairy Journal, vol. 16, no. 10, pp. 1190–1195, 2006.View at: Publisher Site | Google Scholar
- Picot and C. Lacroix, “Encapsulation of bifidobacteria in whey protein-based microcapsules and survival in simulated gastrointestinal conditions and in yoghurt,” International Dairy Journal, vol. 14, no. 6, pp. 505–515, 2004.View at: Publisher Site | Google Scholar
- Ainsley Reid, J. C. Vuillemard, M. Britten, Y. Arcand, E. Farnworth, and C. P. Champagne, “Microentrapment of probiotic bacteria in a Ca2+-induced whey protein gel and effects on their viability in a dynamic gastro-intestinal model,” Journal of Microencapsulation, vol. 22, no. 6, pp. 603–619, 2005.View at: Publisher Site | Google Scholar
- K. Anal and H. Singh, “Recent advances in microencapsulation of probiotics for industrial applications and targeted delivery,” Trends in Food Science & Technology, vol. 18, no. 5, pp. 240–251, 2007.View at: Publisher Site | Google Scholar
- Y. D. Livney, “Milk proteins as vehicles for bioactives,” Current Opinion in Colloid and Interface Science, vol. 15, no. 1-2, pp. 73–83, 2010.View at: Publisher Site | Google Scholar
- S. B. Doherty, V. L. Gee, R. P. Ross, C. Stanton, G. F. Fitzgerald, and A. Brodkorb, “Development and characterisation of whey protein micro-beads as potential matrices for probiotic protection,” Food Hydrocolloids, vol. 25, no. 6, pp. 1604–1617, 2011.View at: Publisher Site | Google Scholar
- N. Betoret, L. Puente, M. J. Díaz et al., “Development of probiotic-enriched dried fruits by vacuum impregnation,” Journal of Food Engineering, vol. 56, no. 2-3, pp. 273–277, 2003.View at: Publisher Site | Google Scholar
- S. M. Alzamora, D. Salvatori, M. S. Tapia, A. López-Malo, J. Welti-Chanes, and P. Fito, “Novel functional foods from vegetable matrices impregnated with biologically active compounds,” Journal of Food Engineering, vol. 67, no. 1-2, pp. 205–214, 2005.View at: Publisher Site | Google Scholar
- T. Mattila-Sandholm, P. Myllärinen, R. Crittenden, G. Mogensen, R. Fondén, and M. Saarela, “Technological challenges for future probiotic foods,” International Dairy Journal, vol. 12, no. 2-3, pp. 173–182, 2002.View at: Publisher Site | Google Scholar
- L. A. Bosnea, Y. Kourkoutas, N. Albantaki, C. Tzia, A. A. Koutinas, and M. Kanellaki, “Functionality of freeze-dried L. casei cells immobilized on wheat grains,” Food Science and Technology, vol. 42, no. 10, pp. 1696–1702, 2009.View at: Publisher Site | Google Scholar
- D. Charalampopoulos, S. S. Pandiella, and C. Webb, “Growth studies of potentially probiotic lactic acid bacteria in cereal-based substrates,” Journal of Applied Microbiology, vol. 92, no. 5, pp. 851–859, 2002.View at: Publisher Site | Google Scholar
- D. Charalampopoulos, S. S. Pandiella, and C. Webb, “Evaluation of the effect of malt, wheat and barley extracts on the viability of potentially probiotic lactic acid bacteria under acidic conditions,” International Journal of Food Microbiology, vol. 82, no. 2, pp. 133–141, 2003.View at: Publisher Site | Google Scholar
- S. Plessas, M. Trantallidi, A. Bekatorou, M. Kanellaki, P. Nigam, and A. A. Koutinas, “Immobilization of kefir and Lactobacillus casei on brewery spent grains for use in sourdough wheat bread making,” Food Chemistry, vol. 105, no. 1, pp. 187–194, 2007.View at: Publisher Site | Google Scholar